细胞毒性t细胞示踪系统以及动物模型的构建方法及应用
技术领域
1.本发明属于基因工程技术领域,具体涉及一种细胞毒性t细胞示踪系统和动物模型的构建方法及其在t细胞功能及药物药理、药效研发中的应用。
背景技术:
2.细胞毒性t细胞(cytotoxic t cell, tc或ctl),又称为杀手t细胞(killer t cell)或cd8
t细胞,属于t细胞的一种,可以杀死癌细胞、病毒感染的细胞,以及其他原因受损的细胞,其在器官移植的免疫排斥中也发挥作用,该类细胞的特点是细胞表面表达cd8蛋白,因此也被称为cd8
t细胞。cd8
t细胞表达的cd8分子通过识别细胞表面的mhc
‑
i分子递呈的短肽抗原,来区分正常细胞和应杀伤的异常细胞。细胞毒性t细胞作为杀伤细胞,在cd8
t细胞免疫应答中起重要作用,其杀伤活性具有直接性、连续性和特异性的特点,在抗肿瘤、抗病毒等免疫过程中发挥重要作用。
3.在抗肿瘤免疫过程中,细胞毒性t细胞被视为抗肿瘤免疫的主要驱动因素。cd8
肿瘤浸润性淋巴细胞(til)通过识别肿瘤抗原和直接杀死转化细胞来介导抗肿瘤反应。肿瘤微环境中的效应性cd8
t细胞可生成il
‑
2、il
‑
12和ifnγ,提高cd8
t细胞的细胞毒能力,靶向肿瘤细胞杀伤。目前肿瘤免疫治疗中最为成功的免疫检查点抑制剂分子的抗肿瘤作用,都与提高cd8
t细胞活性相关,如:最早获批上市针对ctla4靶点的伊匹木单抗(yervoy)的抗肿瘤作用,是通过增强t细胞的活化、增殖,同时抑制treg细胞介导的免疫抑制环境,提高cd8
t细胞活性增强对肿瘤的杀伤作用。另外,肿瘤微环境中的细胞毒性cd8
t细胞水平高低与病人对免疫检查点抑制剂的响应情况和预后改善密切相关,cd8
t细胞含量的高低已经成为免疫治疗药物用药伴随诊断的标记物之一。因此,对肿瘤发生、发展过程以及药物治疗过程中cd8
t细胞的动态变化,对于理解cd8
t细胞的功能和药物作用机制研究具有重要意义。但目前对cd8
t细胞含量的检测,主要还是基于抗体反应,如通过免疫组化方法、流式细胞分选方法等,无法直接在活体动物水平对cd8
t细胞的分布和动态变化进行实时跟踪。
4.当前的动物活体成像技术是指应用影像学方法,对活体状态下的生物过程进行组织、细胞和分子水平的定性和定量研究的技术。其中的生物发光成像 (bioluminescence imaging,bli)基于酶(荧光素酶)催化底物(荧光素)的氧化反应所产生的光的检测来反映标记的目的分子或者细胞的表达,常用的荧光素酶和底物为萤火虫荧光素酶(firefly luciferase,fluc)和天然底物d
‑
荧光素(luciferin)。2018年日本的atsushi miyawaki实验室报道了一个通过定向进化获得的荧光素酶生物发光成像系统(akabli):akaluciferase(荧光素酶)和akalumine(底物),该系统体内荧光亮度约为传统的fluc和luciferin系统的100
‑
1000倍,具有更好的组织穿透性和灵敏度。
5.综上所述,细胞毒性t细胞在抗肿瘤、抗病毒等t细胞免疫应答过程中发挥重要作用,当前的方法和手段无法在活体状态下,对其在体内的动态变化进行跟踪,限制了对细胞毒性t细胞体内功能和相关药物作用机制的研究。如能通过活体成像系统对细胞毒性t细胞
示踪,则有可能解决上述问题。
6.本发明研发及申请过程中,发明人对已有相关动物模型及示踪方法进行了比对,本发明在方法和应用方便较已有专利具有明显的优越性,具体描述如下:1)徐州医科大学申请的cn111500628a描述了一种cd8定点基因敲入2a
‑
creert2
‑
wpre
‑
pa小鼠模型,该模型利用cd8内源基因启动子驱动creert2的表达,creert2是一个cre重组酶本身不具有示踪性,需要和其他报告基因小鼠交配后在给予小鼠他莫昔芬药物后才可能实现对细胞的示踪性,而且因为细胞毒性t细胞在体内处于不断的分化、更新替代过程中,如要通过cd8
‑ꢀ
2a
‑
creert2
‑
wpre
‑
pa小鼠和其他报告基因小鼠交配后给予小鼠他莫昔芬药物实现对细胞毒性t细胞的示踪,需要不间断给予他莫昔芬药物,而本发明的cd8a
‑
akaluci小鼠既不需要和其他报告基因小鼠交配,也不需要给予药物刺激,就可以实时对细胞毒性t细胞进行示踪;2)华东师范大学申请的cn110747227a描述了一种蓝光照射pa
‑
cre转基因小鼠,同上类似,cre重组酶本身不具有示踪性,该专利中申请人通过给药小鼠报告病毒的方式,对示踪性进行了验证,相较于本技术,其示踪一方面需要通过蓝光照射激活,一方面细胞毒性t细胞处于动态变化中,长期示踪需要不间断进行蓝光激活,更重要的是aav病毒本身在体内能否感染细胞毒性t细胞、感染效率等未知,具有很大的不确定;3)sloan kettering inst cancer申请的wo2004033640a2描述了利用特异性启动子驱动luciferase表达制备转基因小鼠进行体内示踪的方法,本技术相较于该申请具有明显的优势,本技术采用定点敲入的方式制备,akaluciferase的表达完全受cd8a内源启动子的驱动具有更好的准确性,同时避免了常规转基因方式需要对多个founder鼠进行筛选建系的弊端;4)institute for medical research申请的wo2020017948a1方法描述了一种利用病人鼻咽癌组织进行细胞建系,通过慢病毒感染,使肿瘤细胞表达gfp和luciferase进行示踪和药物筛选的方法,该方法仅能对肿瘤细胞进行示踪,无法对肿瘤接种宿主自身的细胞如免疫细胞进行示踪,和本发明是截然不同的示踪方向。综上比对的各种方法,虽然可用于体内示踪,但和本发明功能及示踪对象完全不同,无法用于对细胞毒性t细胞的示踪。
技术实现要素:
7.本发明的目的在于提供一种构建细胞毒性t细胞的小鼠模型的构建方法及其在体内抗肿瘤研究和药物研发中的应用。本发明所采用的构建载体及方法相较于已有模型具有明显的优越性;在具体实施中,本发明构建的动物模型,成功对正常生理状态下、肿瘤生长状态下,体内细胞毒性t细胞的动态变化进行了示踪,对抗肿瘤药物的作用机制进行了分析,这是已有模型无法实现的。
8.本发明涉及一种t细胞示踪系统,包括同源重组载体、cas9mrna、grna、模式生物目的细胞,所述同源重组载体包括重组左臂、核糖体接入位点、第一报告基因、自剪切多肽、第二报告基因、重组右臂。并可以进一步在重组左臂和核糖体接入位点之间添加蛋白标签,所述蛋白标签可以为v5 tag,也可以为myc、his、gst、ha、flag、mbp、avi tag、sumo tag等,其目的在于增加一个可识别表达小鼠cd8分子细胞的标记物,通过识别v5 tag的抗体,可以将示踪后的动物器官进行摘除并进行免疫学检测,如流式细胞术检测、elisa检测、免疫组化、免疫荧光、免疫共沉淀等,用于对标记细胞进行定性和定量检测,评估示踪效果等。所述第一报告基因可以为荧光素酶luciferase,所述第二报告基因可以为绿色荧光蛋白egfp,所
述自剪切多肽可以为2a,包括但不限于p2a、t2a、f2a中的一种;对于报告基因,在实际运用中,可采用其他报告基因,只要能够实现发光检测位置功能即可,并不局限于具体实施使用的基因。上述元件片段,通过基因工程方法获得,包括但不限于pcr扩增、基因合成等,共同导入基因工程载体中获得同源重组载体。基因工程表达载体包括但不限于质粒表达载体、慢病毒载体、逆转录病毒载体、腺病毒载体、腺相关病毒载体、猿猴病毒载体、痘苗病毒载体、仙台病毒载体、eb病毒载体、或单纯疱疹病毒载体。
9.进一步的,本发明还涉及一种动物模型构建方法,在插入位点附近设计并合成识别靶位点的grna,将前述同源重组载体、cas9 mrna和前述的grna混合,导入动物模型的细胞,从而通过grna的引导,将前述同源重组载体插入动物模型的cd8a基因终止密码子的c端。导入的方式包括显微注射、共转染等,动物模型包括但不限于小鼠、大鼠、兔、猪等哺乳类动物,优选小鼠;所述细胞为具有能发育成完整生物体的全能性体细胞,优选受精卵。
10.本发明进一步提供了前述的同源重组载体以及动物模型在细胞示踪中的用途。所述细胞为细胞毒性t细胞。具体方法为:给予动物模型发光底物,在活体成像系统下,检测生物发光的状态,采集影像学进行分析。
11.本发明进一步提供了一种t细胞示踪方法,采用前述同源重组载体,导入动物模型中,检测生物发光。进一步的,利用t细胞示踪方法,可用于药物机理研究、药物效果研究、ctl细胞分布研究等。
12.本发明的有益效果本发明利用cd8分子是细胞毒性t细胞的标记分子这一特性,通过将高灵敏度的akaluciferase荧光素酶和绿色荧光蛋白定点插入到cd8分子基因表达框,构建cd8a
‑
v5
‑
ires
‑
akaluc
‑
egfp(简称:cd8a
‑
akaluci)基因修饰小鼠模型,该模型可以实现小鼠内源cd8基因驱动akaluciferase(akaluc)荧光素酶和绿色荧光蛋白表达;在活体成像系统下,可通过给予小鼠底物akalumine,检测生物发光,实现对cd8分子表达,即细胞毒性t细胞的示踪。利用该模型,发明人对正常生理状态下和肿瘤接种状态下,细胞毒性t细胞在体内的组织分布进行了研究;并且通过给予荷瘤小鼠免疫检查点抗体药物,对药物的作用机制进行了验证,说明该模型可以应用于对细胞毒性t细胞的示踪和药物药效作用机制的分析。
附图说明
13.为了更清楚的说明本发明实施例或现有方法和实验中的技术方案,下面将对实施例中所需使用的附图做简单的介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
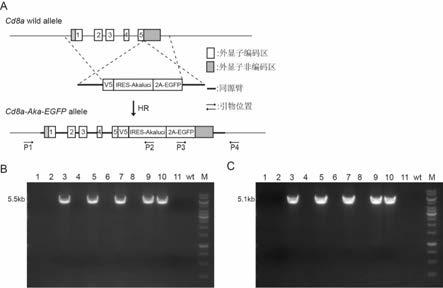
14.图1:小鼠cd8a基因结构和cd8a
‑
akaluci基因修饰后的cd8a基因结构。
15.图2:grna活性t7核酸内切酶i酶切检测电泳图,数字为对应的grna;con为对照;m为dna marker。
16.图3: cd8a
‑
akaluci小鼠构建策略示意图及鉴定结果,图3中的a图为cd8a
‑
akaluci小鼠构建策略示意图;p1,p2,p3,p4为重组pcr鉴定引物位置示意;图3中的b图为f0代小鼠左臂同源重组pcr鉴定电泳图;图3中的c图为f0代小鼠右臂同源重组pcr鉴定电泳图;数字为小鼠编号:wt为野生型对照;m为1kb dna marker。
17.图4:正常生理状态下,cd8a
‑
akaluci小鼠荧光及v5 tag表达检测,图4中的a图为小鼠整体荧光检测结果;图4中的b图为小鼠解剖组织荧光检测结果;图4中的c图为流式细胞术检测cd8a阳性细胞egfp荧光表达结果;图4中的d图为流式细胞术检测cd8a阳性细胞中v5 tag表达结果。
18.图5:不同类型肿瘤接种cd8a
‑
akaluci小鼠,细胞毒性t细胞在肿瘤中的浸润情况检测,图5中的a图为肿瘤接种不同时间点,活体成像检测akaluci表达情况,框内为肿瘤所在部位;图5中的b图为mc38和b16两种类型肿瘤细胞接种后的生长曲线;图5中的c图为mc38和b16两种类型肿瘤细胞接种后不同时间点肿瘤部位的荧光信号值。
19.图6:mc38肿瘤接种cd8a
‑
akaluci小鼠后,给予ctla4抗体治疗,不同时间点akaluci荧光检测结果,图6中的a图为给予ctla4抗体治疗和荧光检测时间点示意图;图6中的b图为对照组和给药组肿瘤生长曲线;图6中的c图为不同时间点荧光表达检测结果;图6中的d图为不同时间点对照组和给药组单位肿瘤体积荧光强度统计结果。
具体实施方式
20.实施例一cd8a
‑
akaluci小鼠模型构建为了避免破坏小鼠内源cd8a的表达,cd8a
‑
akaluci小鼠模型的构建设计策略为将v5 tag
‑
ires
‑
akaluciferase
‑
2a
‑
egfp插入到小鼠cd8a基因终止密码子前野生型cd8a基因结构和cd8a
‑
akaluci基因修饰后基因结构如图1所示。
21.1)grna靶位点筛选grna靶序列决定了其靶向特异性和诱导cas9切割目的基因的效率。cas9切割目的基因的效率越高,发生同源重组的效率就越高。因此,高效特异的靶序列选择和设计是成功构建cd8a
‑
akaluci小鼠模型的前提。
22.根据重组方案,在插入位点附近设计并合成识别靶位点1
‑
10(seq id no:1
‑
10)的grna(grna1
‑
grna10)。使用t7核酸内切酶 i检测试剂盒检测,从酶切后凝胶电泳结果可见不同的grna活性不同,检测结果参见图2所示。从中优先选择靶向位点6的grna6为后续小鼠受精卵注射实验的grna。
23.2)同源重组载体构建根据获得的grna位点及插入位点信息,构建同源重组载体,载体结构如策略图3所示,从左到右结构依次为:重组左臂、v5标签蛋白、核糖体接入位点(ires)、荧光素酶(akaluciferase)、自剪切多肽p2a、绿色荧光蛋白(egfp)和重组右臂,序列依次为seq id no:11
‑
17。重组左臂和重组右臂,通过以小鼠基因组为模板,pcr扩增获得,其余片段通过全基因合成获得。构建过程中,先通过pcr获得重组左臂、基因敲入片段(v5 tag
‑
ires
‑
akaluciferase
‑
2a
‑
egfp)和重组右臂,利用in
‑
fusion的方法将3个dna片段连入pbr322载体,获得最终的pbr322
‑
cd8a
‑
akaluci重组载体。载体经酶切及测序验证正确后,进行后续的小鼠制备。
24.3)cd8a
‑
akaluci基因敲入小鼠构建取c57bl/6小鼠的受精卵,按照《小鼠胚胎操作实验手册(第三版)》中的方法将pbr322
‑‑
cd8a
‑
akaluci重组载体、cas9 mrna和grna混合后,进行受精卵显微注射,注射后
的受精卵经培养箱短暂培养后,移植至受体母鼠的输卵管,获得基因修饰小鼠f0代小鼠。共出生11只f0代小鼠,f0代剪尾抽提基因组,分别针对同源重组左臂(引物p1和p2)和同源重组右臂(引物p3和p4)设计引物,对是否发生正确同源重组进行鉴定,引物位置示意如图3中的a图的p1
‑
p4所示。f0代小鼠左臂和右臂同源重组pcr鉴定的条件如下。
25.引物信息如下:引物名称序列信息(5
’→3’
)p1atgcctgcacccaagattcacc(seqidno:18)p2gggcgcaactgcaactccgataaa(seqidno:19)p3tcatgggccgacaagcagaagaacg(seqidno:20)p4actgggggcaagaaatggggaaca(seqidno:21)引物对p1/p2,p3/p4的pcr反应体系相同,具体如下:pcr反应组成体积 (
µ
l)ddh2o31pcr buffer102.5 mm dntp4引物1(20pmol/
µ
l)1引物2(20pmol/
µ
l)1dnapolymerase2genomic dna1总计50引物对p1/p2,p3/p4的pcr反应程序相同,具体如下:步骤温度(℃)时间备注1982 minꢀ29815 secꢀ36315 secꢀ4684min重复步骤2
‑
4共34个循环5685minꢀ61210minꢀf0代小鼠左臂和右臂同源重组pcr鉴定的电泳结果如图3中的b(左臂重组)和c(右臂重组)图所示。左臂发生正确重组的小鼠,引物对p1/p2可以扩增出5.5kb大小的pcr产物,阴性小鼠无pcr产物扩增出;右臂发生正确重组的小鼠引物对p3/p4可以扩增出5.1kb大小的pcr产物,阴性小鼠无pcr产物扩增出。pcr鉴定阳性小鼠的pcr产物送测序进一步确认是否正确。根据pcr和测序鉴定结果,f0代11只小鼠中3,5,7,9,10号小鼠为双臂同源重组阳性小鼠,阳性率为:45.5%,说明该方法为一种高效获得cd8a基因位点同源重组模型的制备方法。
26.阳性f0代小鼠成年后与野生型c57bl/6小鼠交配,获得f1代小鼠。f1代小鼠出生后,剪尾抽提基因组,采用和f0代小鼠重组鉴定相同的条件,分别针对同源重组左臂和右臂进行鉴定,验证f0代小鼠是否可以稳定遗传到f1代小鼠。对获得的阳性f1代小鼠进行后续的实验验证。
27.实施例二正常生理状态下细胞毒性t细胞小鼠体内位置示踪根据以前的研究报道,cd8
t细胞和其他类的t细胞一样起源于骨髓,在胸腺内成熟,成熟后在随着淋巴循环到达全身各处,相当一部分cd8储存于脾脏和淋巴结等免疫器官内。为了验证构建的cd8a
‑
akaluci小鼠是否能够反映正常状态下细胞毒性t细胞在小鼠体内的分布,发明人利用珀金埃尔默公司的ivis spectrum 设备对体内和离体组织的akaluciferase表达进行了检测,在测量前3分钟通过腹腔注射给予小鼠5 mm 底物 akalumine
‑
hcl底物,在发射光谱677nm 处测量,曝光时间为 30s,分别对不同体位的小鼠进行成像,检测结果如图4中的a图所示,小鼠胸腺、脾脏和腹腔(肠系膜淋巴结丰富的区域)有较强的荧光信号;为了进一步验证荧光表达的组织类型,将小鼠解剖后,取胸腺、脾脏和肠系膜淋巴结进行荧光表达的确认,结果如图4中的b图所示,胸腺、脾脏和肠系膜淋巴结均可以检测到较强的荧光信号,说明体内检测观察到的荧光信号确实源自这些组织。cd8a
‑
akaluci小鼠构建过程中,根据设计策略表达akaluciferase的同时,还表达egfp荧光蛋白,发明人通过流式细胞术对脾脏和淋巴结cd8
t细胞egfp荧光表达情况进行了检测。流式细胞术检测结果如图4中的c图所示,在淋巴结中,95%的cd8
t细胞可以检测到egfp荧光表达;在脾脏中,82%的cd8
t细胞可以检测到egfp荧光表达。这些结果表明,在正常生理状态下,akaluciferase荧光的表达与预期细胞毒性t细胞的所在位置一致,cd8a
‑
akaluci小鼠可以用于细胞毒性t细胞的示踪研究。根据cd8a
‑
akaluci小鼠构建策略,在cd8a分子的c端融合了一个v5 tag,阳性小鼠中表达的cd8a蛋白c端应同时融合有v5 tag,v5 tag的抗体作为检测cd8a表达的另外一个标记分子标记cd8a阳性细胞,通过流式细胞术,利用分别针对cd8a分子apc标记的抗体和针对v5 tag pe标记的抗体对外周血中cd8a阳性细胞进行了检测,检测结果(图4中的d图所示)显示,野生型小鼠中只能检测到针对cd8a分子的信号,cd8a
‑
akaluci小鼠既可以检测到针对cd8a分子的信号,也可以检测到针对v5 tag抗体的信号,说明v5 tag确实和cd8a分子融合表达,其可以作为检测cd8a阳性细胞的另外一个标记分子,用于后续的检测。
28.实施例三肿瘤生长过程中细胞毒性t细胞在肿瘤中的浸润情况示踪在肿瘤免疫治疗中,研究人员发现不同肿瘤组织中的浸润淋巴细胞(tils)数量有很大不同,肿瘤组织中有大量tils浸润的患者,往往对治疗反应敏感,生存时间长,伴有较好的预后;而肿瘤组织中没有tils的患者,对治疗反应差,存活期也很短,预后很差。研究者将有广泛tils浸润的肿瘤称为热性肿瘤(hot tumor),仅有少量甚至没有tils浸润的肿瘤称为冷性肿瘤(cold tumor)。小鼠结肠癌肿瘤细胞系mc38被认为是一种“hot tumor”,而小鼠黑色素瘤细胞系b16则被认为是一种“cold tumor”。为了验证cd8a
‑
akaluci小鼠是否能够用于示踪细胞毒性t细胞在不同肿瘤组织中的浸润情况,用于甄别肿瘤类型,发明人分别将mc38细胞系和b16细胞系接种于cd8a
‑
akaluci小鼠皮下,在不同时间点通过活体成像系统检测肿瘤组织的荧光信号,检测结果如图5中的a图所示。活体成像检测结果显示:b16细胞系形成的肿瘤,在肿瘤生长过程中,几乎检测不到明显的荧光信号,说明仅有少量甚至没有tils浸润,b16形成的肿瘤为冷性肿瘤;mc38细胞系形成的肿瘤,肿瘤生长过程中,荧光信号随着肿瘤体积的增大,信号逐渐增强,说明有大量的tils浸润,mc38细胞形成的肿瘤为热
性肿瘤。对活体成像信号进行定量分析结果(图5中的b图)与成像显示的结果相一致,b16细胞系形成肿瘤的信号值在肿瘤生长过程中几乎没有变化,mc38细胞系形成肿瘤的信号值随着肿瘤的生长,信号不断增强。
29.与该结果相对比的是,b16细胞形成的肿瘤具有更快的生长速度(图5中的c图)。如上结果显示,cd8a
‑
akaluci小鼠可用于对肿瘤生长过程中的细胞毒性t细胞对肿瘤浸润的示踪作用,通过荧光值可以反映肿瘤的免疫类型是热性肿瘤还是冷性肿瘤。
30.实施例四细胞毒性t细胞示踪在抗肿瘤药物作用机制研究中的应用肿瘤免疫治疗中,抗ctla4抗体是第一个获批上市的免疫检查点抑制剂分子,已有的研究机制表明:其可以活化淋巴组织t细胞,促进更多细胞毒性t细胞浸润到肿瘤组织中,对肿瘤进行杀伤作用。为了验证cd8a
‑
akaluci细胞毒性t细胞示踪小鼠是否可用于抗ctla4抗体的肿瘤治疗作用机制研究,发明人通过在cd8a
‑
akaluci小鼠上接种mc38肿瘤细胞,然后给予抗ctla4抗体治疗,对不同时间点细胞毒性t细胞的肿瘤浸润进行了研究。肿瘤接种、给药和进行活体成像检测的时间点如图6中的a图所示。每只cd8a
‑
akaluci小鼠皮下接种1x106的mc38肿瘤细胞,待肿瘤生长到约80
‑
120mm3时,随机分为两组(每组5只小鼠),一组给予生理盐水,一组给予抗ctla4抗体,分别在肿瘤接种后第6天,第12天和第15天分别给予生理盐水和抗体药物,在第7天,第13天和第16天进行活体成像检测。肿瘤生长曲线检测显示,给予抗ctla4抗体后,肿瘤接种第13天即显示出显著的mc38肿瘤生长抑制效果(图6中的b图)。对肿瘤接种不同时间点活体成像检测结果(图6中的c图)显示:相较于给生理盐水组,给抗ctla4抗体组小鼠肿瘤部位自接种肿瘤10天起即可见增强的荧光信号;通过将活体成像信号与肿瘤体积相比较,计算单位体积的荧光信号强度(图6中的d图),随着给药次数的增加和时间的延长,给药组小鼠单位体积肿瘤的信号强度不断增强,在实验终点(接种肿瘤16天)时,给药组荧光信号强度是生理盐水组的5.08倍,显示给予抗ctla4抗体显著增强了肿瘤内细胞毒性t细胞的浸润能力,更多的细胞毒性t细胞浸润到肿瘤内,发挥抗肿瘤作用,与研究报道的ctla4抑制剂作用机制相吻合。因此,cd8a
‑
akaluci细胞毒性t细胞示踪小鼠模型可用于抗肿瘤药物的药理、药效等肿瘤治疗作用机制研究。
31.综上所述,发明人提供了一种构建细胞毒性t细胞示踪小鼠模型的构建方法,利用筛选到的高活性grna靶位点,基于crispr/cas9系统介导的同源重组构建cd8a
‑
akaluci小鼠模型;发明人基于该模型,对细胞毒性t细胞在正常生理状态下体内的分布,细胞毒性t细胞对不同肿瘤的浸润情况以及抗ctla4抗体抗肿瘤的作用机制进行研究应用,提供了利用该模型进行t细胞功能及药物药理、药效研发中的应用场景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。