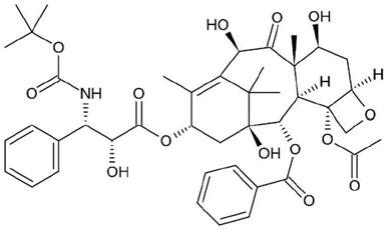
1.本发明涉及医疗器械领域,具体而言,本发明涉及一种雷帕霉素药物球囊的制备方法,本发明还涉及由此制得的雷帕霉素药物球囊。
背景技术:
2.冠状动脉粥样硬化性心脏病是危害人类身体健康的一大杀手。1977年,gruentzig进行了首例经皮冠状动脉成形术(ptca:percutaneous transluminal coronary angioplasty),开创了冠心病介入治疗的先河。因其创伤小,效果好,ptca技术迅速被推广。1986年,puol和sigmart首次将冠状动脉金属裸支架置入冠状动脉内,完成了冠状动脉支架置入术,其可显著减少ptca导致的急性冠状动脉夹层和闭塞,并可显著降低远期再狭窄率。2003年,药物洗脱支架(des:drug eluting stent)开始应用于临床,使血管的再狭窄率进一步降低。
3.药物涂层球囊(dcb:drug
‑
coated balloons)是近年来出现的一项用于治疗支架内再狭窄的新兴手段。与药物洗脱支架不同,药物球囊是将抗增殖药物涂于球囊表面,在药物球囊扩张时将抗增殖药物转移至靶病变血管壁上,以起到抗内皮细胞增殖的作用。药物球囊有以下优点:(1)无金属支架,保存了血管原有的解剖结构,还血管自身舒张与收缩的生理特性,避免了对血流模式的影响;(2)药物在特定区域均匀、高浓度、短时间分布,不会引起长期的炎症反应和全身不良反应;(3)抗血小板治疗的疗程缩短,降低了治疗成本并减少了出血并发症。因此药物球囊理论上具有良好的应用前景。
4.目前商品化的药物球囊sequent please是贝朗公司开发的、以紫杉醇为活性药物、以碘普罗胺为载体,制剂后喷涂到球囊表面制得。随后,invatec公司开发了以尿素为载体,以紫杉醇为活性药物的admiral xtreme药物球囊;lutonix公司开发了以聚山梨醇为载体、以紫杉醇为活性药物的lutonix035药物球囊;等等。目前几乎所有商品化的药物球囊均以紫杉醇为活性药物,不同的是载体技术。这是由于紫杉醇可有效抑制细胞快速增殖,还可抑制平滑肌细胞迁移和表型改变,抑制内膜增生性炎症反应。同时,紫杉醇亲脂性及吸附性均较高,在球囊释放时可迅速被内膜吸收,从而对细胞骨架结构产生不可逆转的影响。但是,紫杉醇的药物毒性正在引起越来越多的关注,特别是紫杉醇药物涂层球囊和支架在治疗股动脉疾病过程中可能会增加患者死亡风险的事实已被fda所提醒。
5.雷帕霉素是一种天然的大环内酯类药物,是有效的免疫抑制剂,可延长移植存活率,对组织移植、骨髓移植和胰岛细胞移植均有效。雷帕霉素与一种特殊的称为tor(雷帕霉素靶)的转导蛋白结合,作用在细胞有丝分裂g1期,并抑制它的活性,使细胞返回到静止期,从而抑制细胞生长。由于它独特的作用机制,雷帕霉素与其他免疫抑制剂相比毒性很低。此外,雷帕霉素可抑制动脉损伤和支架植入后炎症反应和平滑肌细胞的过度增生。因此,雷帕霉素已在药物洗脱支架中应用。
6.此外,药物球囊的药物利用率主要受四个方面的影响:(1)如何实现药物涂层与球囊表面之间的有效粘结,避免在球囊折叠过程中的药物损失;(2)如何避免血流对药物球囊
涂层的冲刷和溶解作用,避免在球囊递送至病灶部位过程中的药物损失;(3)在药物球囊扩张与血管壁短暂接触后,如何能够最大化地将药物转移至血管内皮细胞上;(4)如何保证转移到血管上的雷帕霉素转运体具备良好的药代动力学。
7.因此,有必要开发一种能够制备可有效递送雷帕霉素的药物球囊的方法。
技术实现要素:
8.本发明的目的在于提供一种雷帕霉素药物球囊的制备方法,其能够制备可有效递送雷帕霉素的药物球囊。
9.本发明的制备方法包括:
10.1)将雷帕霉素或其衍生物、聚对二氧环己酮
‑
聚乙二醇
‑
聚对二氧环己酮(ppdo
‑
peg
‑
ppdo)三嵌段共聚物、磷脂溶解于溶剂中,充分混匀配成雷帕霉素药物溶液;所述磷脂选自二油酰磷脂酰乙醇胺(dope)或二油酰磷脂酰胆碱(dopc)的至少一种;所述聚对二氧环己酮
‑
聚乙二醇
‑
聚对二氧环己酮(ppdo
‑
peg
‑
ppdo)三嵌段共聚物与磷脂的重量比为1.5~3.2:1;
11.2)将乳化剂、葡聚糖加入到去离子水中,搅拌使其溶解,制得乳化溶液;
12.3)在高速搅拌下,将雷帕霉素药物溶液逐滴加入到乳化溶液中,滴加完成后使用超声探头乳化仪乳化,制得载药胶束溶液;
13.4)将所得载药胶束溶液用高速离心机离心分离,用去离子水洗涤后冻干,制得载药胶束;
14.5)将所述载药胶束用有机溶剂分散,并加入壳聚糖,分散后制得喷涂溶液;
15.6)用去离子水冲洗裸球囊,干燥后进行表面等离子预处理;
16.7)使用超声喷涂工艺将喷涂溶液喷涂在裸球囊表面,直到球囊表面的载药量达到0.1~10μg/mm2;
17.8)烘干、折叠,即可得到雷帕霉素药物球囊。
18.在本发明的一个实施方案中,步骤1)中的聚对二氧环己酮
‑
聚乙二醇
‑
聚对二氧环己酮(ppdo
‑
peg
‑
ppdo)三嵌段共聚物的分子量为2000~8000g/mol,其中ppdo嵌段与peg嵌段的质量比为1~5:1。优选的,所述聚对二氧环己酮
‑
聚乙二醇
‑
聚对二氧环己酮(ppdo
‑
peg
‑
ppdo)三嵌段共聚物的分子量为2800~5000g/mol,其中ppdo嵌段与peg嵌段的质量比为2~3:1。
19.其中,所述聚对二氧环己酮
‑
聚乙二醇
‑
聚对二氧环己酮(ppdo
‑
peg
‑
ppdo)三嵌段共聚物的制备方法包括:
20.在惰性气体保护下将对二氧环己酮、聚乙二醇和催化剂置于反应装置中,升温至60~100℃,搅拌下保温进行聚合反应,纯化后制得聚对二氧环己酮
‑
聚乙二醇
‑
聚对二氧环己酮(ppdo
‑
peg
‑
ppdo)三嵌段共聚物。
21.优选的,对二氧环己酮与聚乙二醇的质量比为1~5:1,优选2~3:1。
22.优选的,所述催化剂选自辛酸亚锡、乳酸亚锡、丁基锡酸、氧化二丁基锡、钛酸四正丁酯中的至少一种。所述催化剂的用量为对二氧环己酮的0.01~1wt%,优选0.05~0.5wt%,更优选0.1~0.3wt%。
23.优选的,聚合反应的温度为70~80℃。聚合反应的温度过低的话,聚合反应难以进
行;而聚合反应的温度过高的话,聚合速率较快、程度较深,共聚物的分子量会变得过大。
24.优选的,所述纯化包括将聚合反应产物溶于二甲亚砜或n,n
‑
二甲基甲酰胺中,然后在搅拌下将所得溶液滴入水中,将析出的固体颗粒浸泡于丙酮或无水乙醇中,过滤并干燥得到纯化的聚对二氧环己酮
‑
聚乙二醇
‑
聚对二氧环己酮(ppdo
‑
peg
‑
ppdo)三嵌段共聚物。通过纯化,可以去除ppdo
‑
peg
‑
ppdo三嵌段共聚物中的杂质,大大提高其纯度。
25.优选的,步骤1)中所述聚对二氧环己酮
‑
聚乙二醇
‑
聚对二氧环己酮(ppdo
‑
peg
‑
ppdo)三嵌段共聚物与磷脂的重量比为1.8~2.6:1,更优选2.0~2.5:1。ppdo
‑
peg
‑
ppdo三嵌段共聚物与磷脂的比例可影响胶束的各项性质。
26.在本发明的一个实施方案中,步骤2)中乳化剂选自吐温系列与十二烷基硫酸钠、十二烷基磺酸钠或十二烷基苯磺酸钠组成的复合体系。优选的,吐温系列选自吐温20、吐温40、吐温60、吐温80、吐温85。优选的,吐温系列与十二烷基硫酸钠、十二烷基磺酸钠或十二烷基苯磺酸钠的质量比为1:2~6,优选1:3~4。
27.优选的,乳化剂的用量为聚对二氧环己酮
‑
聚乙二醇
‑
聚对二氧环己酮(ppdo
‑
peg
‑
ppdo)三嵌段共聚物与磷脂质量总和的6~14倍,优选8~12倍。
28.优选的,步骤2)中葡聚糖的用量为乳化剂质量的5~15%,优选7~12%。本发明中少量葡聚糖的加入有助于增加胶束的稳定性,从而延长雷帕霉素的作用时间。
29.在本发明的一个实施方案中,步骤3)中的高速搅拌是指搅拌的转速优选为6000~15000rpm,更优选8000~12000rpm。
30.优选的,所述载药胶束的粒径不大于350nm,优选不大于300nm。优选的,所述载药胶束的粒径不小于50nm,优选不小于100nm。所述粒径的载药胶束特别适合于雷帕霉素的转运。
31.优选的,所述载药胶束的载药量不小于5%,优选不小于10%,更优选不小于15%。优选的,所述载药胶束的载药量不大于50%,优选不大于40%,更优选不大于35%。
32.在本发明的一个实施方案中,步骤5)中有机溶剂选自酮类溶剂如丙酮,醇类溶剂如甲醇、乙醇,烷烃类溶剂如正己烷、正庚烷、环己烷中的至少一种。优选的,所述有机溶剂选自丙酮与甲醇或乙醇的组合,其中,丙酮与甲醇或乙醇的体积比为1~5:1,优选2~3:1。
33.优选的,步骤5)中壳聚糖的用量为载药胶束质量的4~16%,优选7~12%。壳聚糖起到辅助粘结的作用,其引入可增加胶束间、胶束与预处理球囊表面间、以及胶束与血管内皮细胞间的粘附力,避免涂层脱落,提高涂层的转移率。但是,大量使用壳聚糖并不会导致这一作用的进一步提升。
34.在本发明的一个实施方案中,步骤6)中等离子体预处理的条件包括使用体积比1:2~4的氮气和氧气的混合气体,等离子处理功率为50~150w,频率为30~80mhz,气压40~80pa。在药物球囊的表面上进行等离子处理可以增加球囊表面的粗糙度,增加涂层对于球囊的粘附强度,并且减少在将药物球囊输送至病变部分的过程中,血流对球囊表面药物涂层的冲刷,从而减小药物的损失。
35.在本发明的一个实施方案中,步骤7)中超声喷涂工艺的条件是设置超声功率为3~5w,微量注射泵流量为1.5~3ml/h,喷头移动速率4~6mm/s
36.优选,本发明所制得的药物球囊,表面的载药量为1~8μg/mm2,优选1.5~5μg/mm2,更优选3~4μg/mm2。
37.本发明的另一个目的在于提供一种由所述制备方法制得的雷帕霉素药物球囊。
38.本发明的另一个目的在于提供所述雷帕霉素药物球囊在经皮冠状动脉成形术(ptca)中的应用。
39.总之,本发明提供了一种雷帕霉素药物球囊的制备方法,其操作简单,能够容易地制备可有效递送雷帕霉素的药物球囊。所述药物球囊有效解决了雷帕霉素药物涂层在喷涂于药物球囊后容易脱落的问题,大幅提高了药物球囊扩张后雷帕霉素向血管内皮细胞的转移率,提高了初始的组织药物浓度。同时,转移到血管的雷帕霉素胶束粒子有着良好的药代动力学性质,在90天仍然可以在组织中检测到雷帕霉素的有效治疗浓度。本发明的雷帕霉素药物球囊构成材料安全无毒,雷帕霉素利用率高、作用时间长,因此特别适合在ptca中应用。
具体实施方式
40.以下将对发明的优选实例进行详细描述。所举实例是为了更好地对发明内容进行,并不是发明内容仅限于实例。根据发明内容对实施方案的非本质的改进和调整,仍属于发明范畴。
41.合成例1:
42.氩气保护下将20.4g的对二氧环己酮、6.8g的peg800和0.04g的辛酸亚锡催化剂置于反应装置中,升温至80℃,搅拌下保温反应48h;将反应产物按照1g产物配置0.1l溶剂的比例与适量的二甲亚砜混合,升温至120℃搅拌溶解;然后,将其在搅拌下滴入5倍体积的去离子水中,沉淀出固体颗料,再将所述固体颗料浸泡于丙酮中2h,过滤分离出固体颗粒,真空干燥后得到纯化的ppdo
‑
peg
‑
ppdo三嵌段共聚物25g。经分析,ppdo与peg嵌段的质量比大约为3:1;数均分子量约3150g/mol。
43.实施例1:
44.1)将75mg的雷帕霉素溶解于25ml的丙酮中,然后加入180mg合成例1合成的ppdo
‑
peg
‑
ppdo三嵌段共聚物、80mg的二油酰磷脂酰乙醇胺,搅拌使溶解,充分混匀配成雷帕霉素药物溶液;
45.2)将0.6g吐温80、1.8g十二烷基磺酸钠、0.2g的葡聚糖加入200ml去离子水中,搅拌使溶解,制得乳化溶液;
46.3)在2000rpm的转速下,将雷帕霉素药物溶液逐滴加入到乳化溶液中,滴液速度1ml/min,滴加完成后使用超声探头乳化仪乳化5分钟,制得载药胶束溶液;
47.4)将所制得的载药胶束溶液用高速离心机离心分离,用去离子水洗涤后冻干,制得载药胶束320mg;取少量胶束,测得载药量约为22%。分散于去离子水中,使用激光散射粒径测量仪(mastersizer 3000,马尔文帕纳科)进行粒度分析,测得平均粒径为247nm;
48.5)将所述载药胶束用体积比为丙酮:乙醇=3:1的溶剂30ml分散,然后在其中进一步加入载药胶束重量的10%的壳聚糖,充分分散后制得喷涂溶液;
49.6)将直径4mm、长40mm的尼龙裸球囊用去离子水冲洗,干燥后在万级洁净环境下,采用等离子机对该裸球囊进行表面等离子预处理,预处理气体为体积比1:2的氮气和氧气的混合气体,等离子处理功率为100w,频率为50mhz,处理时间30min,气压50pa;处理结束后固定于自动超声喷涂仪上;
50.7)设置超声功率为3.5w,微量注射泵流量为2ml/h,喷头移动速率5.4mm/s,将上述喷涂溶液采用超声喷涂工艺均匀地喷涂在裸球囊表面,共喷涂7次,直到球囊表面的载药量为3μg/mm2;
51.8)烘干、折叠,即可得到雷帕霉素药物球囊。
52.实施例2:
53.与实施例1相同,区别在于用等量的二油酰磷脂酰胆碱代替二油酰磷脂酰乙醇胺。其中,所获得的载药胶束的量为318mg,粒径为231nm。同样喷涂直到球囊表面的载药量为3μg/mm2。
54.实施例3:
55.与实施例1相同,区别在于步骤5)中壳聚糖的量为载药胶束重量的15%。同样喷涂直到球囊表面的载药量为3μg/mm2。
56.实施例4
57.与实施例1相同,区别在于步骤1)中丙酮替换为30ml的二氯甲烷。其中,所获得的载药胶束的量为326mg,粒径为264nm。同样喷涂直到球囊表面的载药量为3μg/mm2。
58.对比例1:
59.与实施例1相同,区别在于用260mg的合成例1合成的ppdo
‑
peg
‑
ppdo三嵌段共聚物,代替180mg合成例1合成的ppdo
‑
peg
‑
ppdo三嵌段共聚物、80mg的二油酰磷脂酰乙醇胺。其中,所获得的载药胶束的量为324mg,粒径为413nm。同样喷涂直到球囊表面的载药量为3μg/mm2。
60.对比例2:
61.与实施例1相同,区别在于步骤2)中不加葡聚糖。其中,所获得的载药胶束的量为304mg,粒径为308nm。同样喷涂直到球囊表面的载药量为3μg/mm2。
62.对比例3:
63.与实施例1相同,区别在于步骤5)中不加壳聚糖。其中,同样喷涂直到球囊表面的载药量为3μg/mm2。
64.性质测试:
65.试验1、球囊折叠的药物损失测试:
66.取未折叠的药物球囊,用甲醇完全溶解载药部分的涂层后,通过hplc测量雷帕霉素的含量,每种样品测试5个,取平均值记为初始载药量m0。然后,再取折叠的药物球囊,同样用溶剂完全溶解载药部分的涂层并通过hplc测量雷帕霉素的含量,每种样品测试5个,取平均值记为球囊载药量m1。按照以下公式计算折叠药物损失率:
67.折叠药物损失率=(m0
‑
m1)/m0
×
100%
68.其中,m0为初始载药量;m1为球囊载药量。
69.试验2、球囊输送损失测试:
70.将折叠的药物球囊插入体外模拟冲刷装置,不扩张,采用pbs模拟血液,流速为35ml/min,37℃,共冲刷时间3min。之后取出,用甲醇将药物涂层完全溶解后,通过hplc测量雷帕霉素的含量,每种样品测试5个,取平均值记为不扩张撤回球囊的载药量m2。按照以下公式计算递送药物损失率:
71.输送药物损失率=(m1
‑
m2)/m1
×
100%
72.其中,m1为球囊载药量(如试验1中所测得的);m2为不扩张撤回球囊的载药量。
73.试验3、模拟转移率测试:
74.取离体的猪动脉血管段,保持37℃恒温,取灭菌的裸球囊扩张血管1min,6atm,随后泄压取出裸球囊。将折叠的药物球囊置入扩张过的血管,6atm扩张1min,随后泄压取出药物球囊。用甲醇完全溶解涂层后,通过hplc测量雷帕霉素的含量,每种样品测试5个,取平均值记为模拟残余载药量m3。按照以下公式计算转移率:
75.模拟转移率=(m1
‑
m3)/m1
×
100%
76.其中,m1为球囊载药量(如试验1中所测得的);m3为模拟残余载药量。
77.以上结果记于表1中:
78.表1:
[0079][0080][0081]
从上述结果可以看出,根据本发明的方法制得的雷帕霉素药物球囊在折叠过程以及在球囊的输送过程中都只有很少的损失,并且在球囊扩张后能够将绝大部分的药物涂层转移至血管内皮细胞上。而对比例1的药物球囊由于不具有磷脂,其药物涂层在球囊上的粘结力以及向血管内皮细胞转移的能力均较差;对比例3的药物球囊由于缺少壳聚糖,同样存在在球囊上的粘结力不足的缺点。试验4、实际转移率和药代动力学评价:
[0082]
将20只家猪分为4组,每组各5只,每一组家猪施用同一种药物球囊。将折叠的药物球囊分别在同一只家猪的冠状动脉的左前降支(lad)、右冠状动脉(rca)和回旋支(cx)部分,6atm扩张1min,然后泄压并撤回球囊,用甲醇完全溶解涂层后,通过hplc测量雷帕霉素的含量,取每组的15个(3
×
5)药物球囊的残余载药量平均值记为测试样品的实际残余载药量m4。按照以下公式计算实际残余率,并结合试验3中的输送药物损失率考察实际转移率:
[0083]
实际残余率=m4/m1
×
100%
[0084]
其中,m1为球囊载药量(如试验1中所测得的);m4为实际残余载药量。
[0085]
而后,分别在10分钟、7天、28天、60天和90天将猪进行处死解剖,取出被扩张血管,
用甲醇提取组织中的药物,通过hplc来测定组织中的雷帕霉素浓度,取3个部位的组织中残留雷帕霉素的平均值作为其组织药物残留浓度。结果记于表2中:
[0086]
表2:
[0087][0088]
“‑”
表示未测到。
[0089]
从上述结果可以看出,根据本发明的方法制得的雷帕霉素药物球囊具有高的初始组织药物浓度以及长的药物作用时间,在90天后仍能具有有效的雷帕霉素浓度。对比例1的药物球囊由于转移率低,在涂层具有同等雷帕霉素浓度的情况下,初始组织药物浓度低,导致雷帕霉素作用时间不够长。对比例2的药物球囊在制备时没有引入葡聚糖,胶束的稳定性下降,导致雷帕霉素的作用时间也不够长。此外,从残余率上看,在家猪上的试验结果与通过模拟测试获得的结果相符,说明了模拟测试具有足够的准确性。
[0090]
最后说明的是,以上优选实施例仅用于说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。