用于治疗抑郁症和其它病症的组合物和方法
1.相关申请的交叉引用
2.本技术要求于2019年2月17日提交的第62/806,831号美国临时申请项下的权益,其内容通过整体引用,纳入本文。
发明领域
3.本发明提供了用于治疗抑郁症和其它精神障碍的组合物和方法。尤其是,本发明提供了缓释(sustained
‑
release)制剂或控释(controlled
‑
release)制剂,特别是延释(extended
‑
release)或缓慢释放(slow
‑
release)制剂,其包括至少一种单胺氧化酶抑制剂(maoi),至少一种maoi和至少一种去甲肾上腺素再摄取抑制剂(nri)的联合疗法,以及使用此类控释制剂和联合疗法的方法。
背景技术:
4.抑郁症是美国最常见的精神障碍之一。抑郁症的发病率呈上升趋势,全球范围内预计有3亿多人饱受抑郁症的困扰。然而,目前的抑郁症治疗方法会产生非期望的副作用,并且其并非对所有病例均有效。据估计,抗抑郁药物对~30%至45%的人并非完全有效。此类患者被归类为患有难治性抑郁症(trd)。据估计,70%的自杀者都属于该人群。此外,抑郁症患者往往面临更多的健康问题,以至于他们的预期寿命缩短了10年。每位trd患者的医疗保健费用大约为正常人费用的10倍,并且所消耗的美国经济总成本估计至少为300亿美元。
5.研究和临床实践已表明maoi在治疗重度抑郁症(mdd)方面非常有效,在很多情况下,当其它治疗方案失败时,maoi仍有一定的疗效(有关综述,参见bender和walker,2012;fiedorowicz和swartz,2004;和thase等人,1995)。它们经常被临床医生(schatzberg、alan f.和charles debattista。《临床精神药理学手册》(已编辑第八版)。华盛顿哥伦比亚特区:美国精神病学出版社,美国精神病学协会部门,2015年,第140页)和患者(https://socialphobiaworld.com/threads/nardil
‑
saved
‑
my
‑
life.53171/)称为“重度抑郁症患者的救星”。然而,它们很少且被勉强作为药物使用,主要是因为患者必须遵守严格的饮食限制以避免潜在的危险高血压危象。因此,患者必须避免食用已知含有过量酪胺(是一种随着发酵和老化,食物中含量会增加的天然存在的物质)的食物和饮料,包括奶酪、葡萄酒和啤酒(thase等人,1995)。总结如下,当未遵守饮食限制而摄入过量的酪胺时,可能会导致危险或危及生命的血压升高(glaxosmithkline,2008;gillman,2017)。
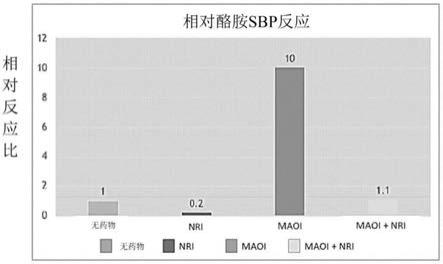
6.maoi阻断超过80%的单胺氧化酶,包括在神经末梢、gi道、肝脏和其它部位代谢生物胺的同种型mao
‑
a(mcdaniel,1986;finberg,2014;finberg和rabey,2016)。通常,mao
‑
a可代谢高达90%摄入的酪胺(finberg等人,2011),显著降低吸收后酪胺代谢的影响。在经典的不可逆maoi抑制mao
‑
a期间,在代谢过程中幸存的酪胺量会显著增加,并会导致与食用含酪胺食物相关的血压升高。已使用多种策略设计选择性阻断mao
‑
b或对mao
‑
a产生可逆抑制的maoi,但结果是此类药物治疗mdd的有效性较差(finberg,2014)。
7.因此,需要使用maoi制剂和组合治疗抑郁症和其它精神障碍的组合物和方法,其
未出现不安全的副作用,并且其即使对抑郁症的一线和/或二线护理标准的建议无响应的患者也具有治疗有效性。具有显著改善的安全性和副作用特征的“更安全的maoi”的新型制剂是在有效治疗重度抑郁症患者方面取得的重大进展。
技术实现要素:
8.根据本发明的目的,如本文所体现和广泛描述的,本发明一方面涉及一种药物组合物,包括maoi(例如,反苯环丙胺的控释剂型),或者nri(例如托莫西汀),及其制备和使用方法。
9.因此,本文公开了包括治疗有效量的反苯环丙胺(tcp)和药学上可接受的载体的药物组合物,其中所述药物组合物被配制成控释剂型,其在向患者给药后在约6
‑
16小时内释放tcp。
10.本文还公开了包括治疗有效量的苯乙肼和药学上可接受的载体的药物组合物,其中所述药物组合物被配制成控释剂型,其在向患者给药后约6
‑
16小时内释放苯乙肼。
11.本文还公开了包括maoi、nri和药学上可接受的载体的药物组合物,其中所述maoi和所述nri中的至少一种以治疗有效量存在,或其中所述maoi和所述nri一起以治疗有效量存在。
12.本文还公开了包括苯乙肼、托莫西汀和药学上可接受的载体的药物组合物,其中托莫西汀被配制成控释剂型,其中苯乙肼被配制成控释剂型,并且其中苯乙肼和托莫西汀在不同时间段内被释放,并且其中苯乙肼和托莫西汀中的至少一种以治疗有效量存在,或其中苯乙肼和托莫西汀一起以治疗有效量存在。
13.本文还公开了包括苯乙肼、地昔帕明和药学上可接受的载体的药物组合物,其中地昔帕明被配制成控释剂型,其中苯乙肼被配制成控释剂型,并且其中苯乙肼和地昔帕明在不同时间段内被释放,并且其中苯乙肼和地昔帕明中的至少一种以治疗有效量存在,或其中苯乙肼和地昔帕明一起以治疗有效量存在。
14.本文还公开了用于治疗受试者精神障碍的方法,所述方法包括向所述受试者给药有效量的公开的组合物。
15.本文还公开了用于治疗受试者精神障碍的方法,所述方法包括向所述受试者同时给药maoi和nri,其中所述maoi和所述nri中的至少一种以治疗有效量给药,或其中所述maoi和所述nri一起以治疗有效量给药,从而治疗所述精神障碍。
16.本文还公开了用于治疗受试者精神障碍的方法,所述方法包括向所述受试者同时给药maoi和nri,其中所述maoi和所述nri各自给药,使用在延释制剂时间段内,对食用富含酪胺的膳食的反应中,足以导致血压升高小于约20mm hg的nri剂量,以及其中所述maoi和所述nri中的至少一种以治疗有效量给药,或其中所述maoi和所述nri一起以治疗有效量给药,从而治疗所述精神障碍。
17.本文还公开了maoi组合物和利用其进行病症和疾病(包括例如抑郁症和其它精神和/或神经障碍)治疗的方法。本文所述的组合物和方法旨在克服mao抑制剂给药的限制,然而此类限制是否存在或仅是执业医师认为其存在。maoi是最早开发的抗抑郁药。虽然maoi可有效治疗抑郁症,但是其通常已被执业医师认为更安全且副作用更少的抗抑郁药所取代。本文所述的组合物和方法包括各种mao抑制剂的联合疗法和/或缓释制剂或控释制剂,
特别是延释制剂或缓慢释放制剂。这些联合疗法和控释制剂,包括延释制剂或缓慢释放制剂,旨在消除重大安全性问题并改善副作用特征,从而克服执业医师经常提到的放弃基于mao抑制剂的抑郁症和其它精神障碍疗法存在的问题。作为非限制性实例,用于本文所述的制剂、联合疗法和/或方法的合适maoi包括tcp、异卡波肼、苯乙肼、司来吉兰,及其任何组合。虽然本文所述的某些方面和实例使用tcp和/或苯乙肼,应当理解为,任何maoi可与本文所述的制剂、联合疗法和/或方法一起使用。
18.虽然本发明的各方面(仅出于方便)可按照具体法定类别(例如,系统法定类别)进行描述和要求保护,但本领域技术人员将理解本发明的每个方面均可按照任何法定类别进行描述和要求保护。除非另有明确说明,否则绝不能将本文中阐述的任何方法或方面解释为要求以特定顺序执行其步骤。因此,如果方法权利要求没有在权利要求或描述中具体说明步骤受到特定顺序的限制,则在任何方面均不得将其确定为断顺序。这适用于任何可能的非明确的解释基础,包括有关步骤安排或操作流程的逻辑问题,由语法组织或标点符号得出的简单含义,或说明书中描述的方面的数量或类型。
附图说明
19.附图并入本说明书,并构成本说明书的一部分,其示出几个方面,并与描述一起用于解释本发明的原理。
20.图1示出了描绘酪胺相对响应摘要的代表性图。“无药物”条件描绘了未用药患者对约1
‑
5g范围内静脉内(iv)酪胺剂量的正常响应。在该图中,相对响应比(y轴)由下式表示:
[0021][0022]
图2示出了描绘酪胺相对于nri去甲替林的血液浓度之间的关系的代表性图。如图2所示,酪胺耐受性随去甲替林的血液浓度增加而增加。0.2的相对响应值表示在存在nri的情况下一个人可食用5
×
酪胺量,并且仍会表现出与在不存在nri的情况下食用1
×
酪胺量的人相同的收缩压(sbp)升高现象。
[0023]
图3示出了在服用多种药物及随餐服用40mg酪胺时观察到的平均收缩压(sbp)升高相关的代表性数据。另见表1。
[0024]
图4示出了在服用苯乙肼联合或未联合nri及随餐服用40mg酪胺时观察到的平均sbp升高相关的代表性数据。另见表2。
[0025]
图5示出了在服用tcp联合或未联合nri及随餐服用40mg酪胺时观察到的平均sbp升高相关的代表性数据。另见表3。
[0026]
图6示出了sbp体位下降与tcp血浆浓度高度相关的代表性数据。另见表4。
[0027]
本发明的其它优点将在以下描述部分中阐述,并且部分从描述中是显而易见的,或者可通过本发明的实践得知。本发明的优点将通过所附权利要求中特别指出的元素和组合的方式来实现和获得。应当理解,前述一般描述和以下详细描述均仅是示例性和说明性的,而并非对所要求保护的本发明的限制。
具体实施方式
[0028]
本发明提供了maoi组合物和使用其治疗病症和疾病(包括抑郁症和其它精神障碍)的方法。本文所述的组合物和方法旨在克服治疗抑郁症和其它精神和/或神经障碍的治疗方案在使用mao抑制剂方面存在的实际或认知的局限性。本文所述的组合物和方法包括用于各种mao抑制剂的控释制剂,以及使用mao抑制剂和至少一种另外的药剂的联合疗法。在一些方面,控释制剂作为延释制剂或缓慢释放制剂使用。作为非限制性实例,用于本文所述的组合物和方法的合适maoi包括tcp、苯乙肼、司来吉兰、异卡波肼、吗氯贝胺,及其任何组合。虽然本文所述的某些方面和实例使用tcp,但应当理解,任何maoi均可与本文提供的制剂、联合疗法和/或方法一起使用。
[0029]
maoi是最早开发的抗抑郁药。mao抑制剂的有效性是公认的,例如,至少在tcp的情况下(tcp,在各种品牌和商品中应用,包括例如parnate),其目前仍被用作治疗难治性抑郁症(trd)病例(包括电休克疗法(ect)失败的病例)的最后手段。然而,maoi给药的诸多副作用、管理困难和患者依从性等历史问题,导致其几乎被新一代精神病学家和医生放弃了,他们已转向执业医师认为更安全且副作用更少的抗抑郁药。例如,由于担心maoi与某些含有酪胺(一种调节血压的氨基酸)的食物和饮料(例如陈年奶酪、泡菜、腌肉、生啤酒和发酵豆制品)的相互作用可能导致血压升高,一些执业医师已放弃开具基于maoi的处方。
[0030]
制药行业已经多次尝试基于以下三种策略之一通过构建新型maoi分子来减少基于maoi的抗抑郁药的副作用和繁琐的饮食限制:
[0031]
(1)使mao抑制具有选择性和可逆性,这是构建rima(mao a的可逆抑制剂)药物子类的策略,并且包括药物,例如,溴法罗明(也称为consonar)、卡罗沙酮(也称为surodil、timostenil)、依普贝胺(也称为befol)、美曲吲哚(也称为inkazan)、米那普林(也称为cantor)、吗氯贝胺(也称为aurorix、manerix)、吡吲哚(也称为pirazidol)和托洛沙酮(也称为humoryl)。事实证明,此类药物在上市后使用方面显著弱于原始maoi,并且此类药物的销量一直低迷。
[0032]
(2)青睐选择性抑制mao
‑
b而非抑制mao
‑
a的maoi。此类药物的实例包括司来吉兰和雷沙吉兰。司来吉兰在低剂量时可抑制mao
‑
b,利用透皮贴剂将药物直接递送进入血流,以避免消化系统中酪胺的相互作用。选择性mao
‑
b药物尚未证明具有抗抑郁作用,并且主要用于早期帕金森病治疗。然而,较高剂量有时可激活mao
‑
a抑制机制,并需要相同的经典maoi饮食限制。尽管如此,司来吉兰和雷沙吉兰已被证明是弱抗抑郁药,并且现在主要用于帕金森病的早期治疗。
[0033]
过去60年来,所有旨在“解决(fixing)”maoi的尝试(包括所有九种上市药物)大多以失败告终,因为它们修改了基本分子结构,并禁用了某些maoi特性。与先前的尝试相比,本文提供的组合物、联合疗法和方法使用新型方法,通过保持maoi分子完整性并提供一种或多种解决方案来抑制与原始(或经典)maoi相关的严重消极副作用。
[0034]
例如,强效精神药物tcp于1960年首次用于人,已证明对多种疾病和各种形式的抑郁症(包括非典型抑郁症、严重忧郁症和双相抑郁症)有效。尽管世界上各个权威机构发布的大多数治疗指南中仍然建议tcp用于三线或四线甚至五线治疗,但当代执业精神科医生很少使用它,目前使用量约占所有抗抑郁药处方的0.01%。(参见(例如)shulman,ki等人,《不可逆单胺氧化酶抑制剂的当前处方模式和安全性:一项基于人群的老年人队列研究》,
《临床精神病学杂志》2009.70(12):第1681页
‑
第1686页;o
‘
brien,v,《单胺氧化酶抑制剂:历史再思考》,《精神病学年报》,2011.41(3):第176页
‑
第183页)。
[0035]
tcp的这种低使用率部分归因于基于目前的剂量和制剂进行治疗的困难和缺点,通常在12小时内多次口服。例如,tcp可以丸剂形式给药,并且患者必须全天多次服用4
‑
6粒含10mg tcp的药丸。按照目前的剂量和制剂,如果服用tcp的患者摄入过量酪胺(其是一种生物胺,仅在通过老化或发酵制备的少数食物(例如,奶酪和酱油)中以显著浓度存在),tcp可造成血压急剧升高。(参见(例如)gillman,k.p.,《重新评估单胺氧化酶抑制剂的安全性:有关神话般酪胺的阐述》,《神经传递杂志》(维也纳),2017.124(7):第1707页
‑
第1717页)。
[0036]
如果采用目前的剂量和制剂,tcp还可在血药峰浓度时,通常在给药后约一小时,特别是在单次大剂量给药后,在一定比例的患者中引发短暂阵发性高血压。这种短暂阵发性高血压可引发一些症状,但尚未记录严重不良反应。(参见(例如)gillman,pk,《神经传递杂志》(维也纳),2018;lavin m.r.等人)。这些症状经常会阻止医生和患者继续tcp治疗。
[0037]
本文所述的制剂、组合物和/或方法旨在克服mao抑制剂给药的实际或认知限制。
[0038]
本文所述的控释制剂(包括延释制剂或缓慢释放制剂)和联合疗法克服了maoi治疗方案的已知缺点。这些控释制剂(包括延释制剂或缓慢释放制剂)和联合疗法可减少tcp的心血管副作用。这种严重且常见的副作用是体位性低血压,当患者从坐位站起来时收缩压下降,这会导致头晕、失去平衡和跌倒。这种副作用是十分严重的,并且在老年患者中特别常见。延释制剂将显著降低体位性低血压的程度。延释制剂减弱或消除的另一个副作用是给药后观察到的短暂阵发性高血压,这在高血压患者中比较常见。最后,当tcp单次给药的血浆峰浓度因tcp释放随时间扩散而显著降低时,与摄入酪胺相关的血压升高速度明显放缓。因此,除延释制剂标准给药便利性和依从性效果外,潜在的单次释放药物的心血管副作用得到了极大改善,从而扫清了临床医生和患者采用的障碍。
[0039]
在一些方面,本发明提出了包括至少一种maoi的控释制剂。在一些方面,控释制剂至少包括tcp。在一些方面,控释制剂是延释制剂或缓慢释放制剂。在一些方面,延释制剂或缓慢释放制剂至少包括tcp。tcp的半衰期极短,约1
‑
2小时。对于相同的剂量,本公开的控释制剂可降低tcp的峰浓度,但使其可用时间更长,并基本上或完全降低阵发性高血压和体位性低血压,以及在在给药后数小时内达到血药峰浓度。这些控释制剂(包括延释制剂或缓慢释放制剂)利用缓慢释放曲线降低峰浓度效应。这些控释制剂(包括延释制剂或缓慢释放制剂)可提高给药便利性、降低体位性低血压并降低药物峰浓度时可能出现的血压峰电位(spike)。
[0040]
与目前的mao抑制剂制剂相比,本文提供的控释制剂(包括延释制剂或缓慢释放制剂)有许多优点。例如,活性成分在治疗抑郁症和其它病症方面已被证明有效,包括用于治疗重度和/或难治性抑郁症亚型的独特有效的多巴胺效应。这些控释制剂(包括延释制剂或缓慢释放制剂)副作用更小,包括,作为非限制性实例,可降低高血压事件的风险、显著降低体位性低血压,并且在峰剂量时可使血压升高很少或未升高。
[0041]
在本文提供的控释制剂(包括延释制剂或缓慢释放制剂)中,maoi的释放速率,可通过向制剂中添加药学上可接受的辅料来调节或稳定。辅料可包括添加到生物可降解聚合物贮库中的任何有用成分,但其并非maoi、nri或生物可降解聚合物。药学上可接受的辅料可包括但不限于乳糖、葡萄糖、蔗糖、山梨糖醇、甘露糖醇、淀粉、阿拉伯树胶、磷酸钙、藻酸
盐、黄蓍胶、明胶、硅酸钙、微晶纤维素、peg、聚山梨醇酯20、聚山梨醇酯80、聚乙烯吡咯烷酮、纤维素、水、生理盐水、糖浆、甲基纤维素和羧甲基纤维素。用于从控释制剂(包括延释制剂或缓慢释放制剂)中调节maoi释放速率的辅料,还可包括但不限于成孔剂、ph调节剂、还原剂、抗氧化剂和自由基清除剂。
[0042]
控释制剂(包括延释制剂或缓慢释放制剂)的生产在本领域中是已知的。在一些方面,控释制剂包括生物相容性聚合物。在一些方面,控释制剂包括可生物降解的、生物相容的聚合物。在一些方面,延释制剂或缓慢释放制剂包括生物相容性聚合物。在一些方面,延释制剂或缓慢释放制剂包括可生物降解的、生物相容的聚合物。
[0043]
在一些方面,生物可降解聚合物包括但不限于天然或合成的生物相容性生物可降解材料或其组合。天然聚合物包括但不限于蛋白质,例如,白蛋白、胶原蛋白、明胶合成聚(氨基酸)和醇溶谷蛋白;糖胺聚糖,例如,透明质酸和肝素:多糖,例如,海藻酸盐、壳聚糖、淀粉和右旋糖酐;和其它天然存在的或化学改性的可生物降解聚合物。合成的生物相容性生物可降解材料包括但不限于由以下组成的组、聚(丙交酯
‑
共
‑
乙交酯)(plga)、聚乳酸(pla)、聚乙交酯(pg)、聚羟基丁酸、聚(三亚甲基碳酸酯)、聚己内酯(pcl)、聚戊内酯、聚(α
‑
羟基酸)、聚(内酯)、聚(氨基酸)、聚(酸酐)、聚缩酮聚(芳基化物)、聚(原酸酯)、聚(原碳酸酯)、聚(磷酸酯)、聚(酯
‑
共
‑
酰胺)、聚(丙交酯
‑
共
‑
氨基甲酸酯)、聚乙二醇(peg)、聚乙烯醇(pva)、pva
‑
g
‑
plga、pegt
‑
pbt共聚物(多活性)、聚氨酯、聚硫酯、甲基丙烯酸酯、聚(n
‑
异丙基丙烯酰胺)、peo
‑
ppo
‑
peo(普朗尼克,pluronics)、peo
‑
ppo
‑
paa共聚物、和plga
‑
peo
‑
plga共混物及其共聚物、多嵌段聚合物构型(例如,plga
‑
peg
‑
plga),及其任何组合。这些聚合物可用于制备本文公开的控释或缓释或延释或缓慢释放组合物。
[0044]
在一些方面,可利用聚(d,l
‑
乳酸
‑
共
‑
乙醇酸)(plga)制备制剂,其可从许多来源商采购获得。可生物降解的plga共聚物有广泛的分子量和乳酸与乙醇酸比。
[0045]
在一些方面,控释制剂(包括延释制剂或缓慢释放制剂)可包括合适的水性或非水性载体,其可包括但不限于水、生理盐水、药学上可接受的油、低熔点蜡、脂肪、脂质、脂质体,以及任何亲脂性、基本上不溶于水、并且可生物降解和/或可通过患者身体自然消除的其它药学上可接受的物质。包括植物(例如,蔬菜和种子)的油。实例包括由以下制成的油:玉米、芝麻、奶油卷(cannoli)、大豆、蓖麻、花生、橄榄、落花生(arachis)、玉蜀黍(maize)、扁桃仁、亚麻、红花、向日葵、油菜、椰子、棕榈、巴巴苏和棉籽油;蜡,例如,巴西棕榈蜡(carnoba wax)、蜂蜡和牛脂;如甘油三酯等脂肪,脂肪酸和酯等脂质,以及如红细胞影(red cell ghost)和磷脂层等脂质体。
[0046]
在一些方面,本发明提出了包括至少一种maoi和至少一种去甲肾上腺素再摄取抑制剂(nri)的联合疗法。nri药物已在治疗实践中广泛使用,尽管其尚未在临床上联用maoi给药用于减轻酪胺升压作用的目的。作为非限制性实例,合适的nri药物包括去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀和尼索西汀。
[0047]
这些联合疗法旨在缓解升压反应,其中患者在maoi给药后,或在摄入过量酪胺后血压暂时升高。摄入过量酪胺的升压反应机制要求酪胺进入突触前神经元,以从去甲肾上腺素突触小泡中释放去甲肾上腺素,从而促进升压反应。酪胺利用去甲肾上腺素转运体(net)实现这一点,这表示net阻断效果显著减弱,或甚至对过量酪胺的升压反应消失,从而可提高maoi的可接受性和安全性。这可通过maoi联用中剂量的具有适当效力和作用持续时
间(例如,半衰期)的nri来实现。例如,已表明在采用nri去甲替林时,酪胺升压作用大幅降低(参见(例如)freyschuss,u,sjoqvist,f,和tuck,d,《去甲替林或ect治疗前和期间对人体的酪胺升压作用:血浆水平与去甲替林作用的相关性》,《欧洲临床药理学杂志》1970.2(33):第72页
‑
第78页;chalon s.,granier l.,vandenhende f.,bieck r.,bymaster f.,joliat m.,hirth c.,potter w.,2003。《度洛西汀增加健康患者血清素和去甲肾上腺素的可用性:一项双盲对照研究》,《神经精神药理学》28,2003,第1685页
–
第1693页)。nri联用maoi降低酪胺的作用甚至更大(参见(例如)zimmer r.《酪胺增强与单胺氧化酶(mao)抑制的关系:吗氯贝胺与其它单胺氧化酶抑制剂的比较》,《斯堪的纳维亚精神病学报》,1990:增刊360:81
‑
83)。
[0048]
在maoi和nri联合用药的情况下,静脉内注射给定量的酪胺造成的平均血压升高与作为对酪胺的自然反应的一部分(没有任何药物)的情况大体上相同。简而言之,尽管酪胺分子的比例较高,nri降低了它的结合能力。因此,净结果是相对于maoi单用约9
×
酪胺升压减弱(参见(例如)pare,c.m.,kline,n.,hallstrom,c.,cooper,t.b.,1982。《阿米替林可阻止单胺氧化酶抑制剂的“奶酪”反应吗?》,《柳叶刀》2(8291),183
–
186)。这种酪胺相关反应总结如图1所示。
[0049]
本文提供的控释制剂(包括延释制剂或缓慢释放制剂)和/或联合疗法被配制为与预期给药途径相容。给药途径的实例包括肠胃外,例如静脉内、皮内、皮下、口服(例如吸入)、经皮(即局部)、经粘膜和直肠给药。在一些方面,控释制剂作为口服制剂。在一些方面,延释制剂或缓慢释放制剂作为口服制剂。在一些方面,联合疗法中的每个元素maoi和nri被配制用于口服给药。
[0050]
用于肠胃外、皮内或皮下应用的溶液或混悬剂可包括以下组分:无菌稀释剂,例如,注射用水、生理盐水溶液、不挥发油、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗菌剂,例如,苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,例如,抗坏血酸或亚硫酸氢钠;螯合剂,例如,乙二胺四乙酸(edta);缓冲剂,例如,乙酸盐、柠檬酸盐或磷酸盐,以及调节张力的试剂,例如,氯化钠或葡萄糖。ph可用酸或碱(例如,盐酸或氢氧化钠)调节。肠胃外制剂可封装在安瓿、一次性注射器或者玻璃或塑料制成的多剂量小瓶中。
[0051]
本发明还提出了将控释制剂(包括延释制剂或缓慢释放制剂)和/或联合疗法用于治疗各种病症、疾病和其它病痛的方法。在示例性方面,控释制剂包括延释制剂或缓慢释放制剂。
[0052]
虽然这些方面是参考抑郁症和其它精神障碍的治疗举例说明的,但不应推断本发明仅用于这些用途。相反,预期本发明可用于治疗其它精神障碍和/或病症,例如,焦虑症、adhd、双相抑郁症等。特定词语和参考文献的任何和所有使用仅是为了详细说明本发明的不同方面。
[0053]
作为非限制性实例,其它适应症包括在氧化应激的治疗、症状缓解、改善和/或延迟进展中的神经保护治疗方案(参见(例如)binda,c.等人,2011年,《神经保护药理治疗中单胺氧化酶抑制的希望与预示》,《药物化学的当前主题》11,第2788页
–
第2796页;finberg john p.m.,rabey jose m。《精神病学和神经病学中的mao
‑
a和mao
‑
b抑制剂》,《药理学前沿》第7卷,2016,第340
‑
355页);帕金森病(参见(例如)finberg等人,2016);和阿尔茨海默病(参见(例如)filippo caraci等人《单胺氧化酶抑制剂tcp及其酰胺衍生物对aβ(1
‑
42)诱
导毒性的神经保护作用》,《欧洲药理学杂志》第764卷,2015,第256页
‑
第263页)。
[0054]
本文提出的控释制剂(包括延释制剂或缓慢释放制剂)和/或联合疗法还可用于add/adhd的治疗、症状缓解、改善和/或延迟进展(参见finberg等人,2016)。本文提供的控释制剂(包括延释制剂或缓慢释放制剂)和/或联合疗法还可用于抑郁症相关的认知缺陷的治疗、症状缓解、改善和/或进展延迟。
[0055]
将本文提出的控释制剂(包括延释制剂或缓慢释放制剂)和/或联合疗法适用于患有或易患精神障碍或病症的患者。使用本领域已知的各种方法中的任一种(例如各种精神病学、临床和/或实验室检测方法中的任一种,例如,精神病学评价、体格检查和/或体液分析,以评价健康状况)识别患有或易患特定精神障碍或病症的患者。
[0056]
如果实现了各种实验室或临床结果中的任一项,则认为本文提出的控释制剂(包括延释制剂或缓慢释放制剂)给药和/或联合疗法是有效的。例如,如果与治疗相关的一种或多种严重副作用导致停用原本有效的治疗,或者与疾病相关的症状被缓解、减轻、抑制或未有进一步进展(即状态更差),则认为控释制剂(包括延释制剂或缓慢释放制剂)给药和/或联合疗法是有效的。如果疾病(例如关节炎或其它炎性疾病)进入缓解期或未有进一步进展(即状态更差),则认为控释制剂(包括延释制剂或缓慢释放制剂)给药和/或联合疗法是有效的。
[0057]
另外,本发明的任何和所有变更和进一步修改,如本领域普通技术人员所想到的,都在本发明范围内。
[0058]
通过参考以下本发明的以下详细描述和其中包括的实施例,可更容易理解本发明。
[0059]
在公开和描述本发明化合物、组合物、制品、系统、装置和/或方法之前,应理解为,除非另有说明,否则其不限于特定的合成方法,或具体试剂,除非另有说明,因此当然可能有所不同。还应理解,本文中采用的术语仅用于描述具体方面的目的,并不旨在进行限制。尽管在本发明的实践或检测中可使用与本文所述的方法和材料相似或等同的任何方法和材料,但此处所述为实例方法和材料。
[0060]
虽然本发明可仅出于方便目的按照具体法定类别(例如,系统法定类别)进行描述和要求保护,但本领域技术人员将理解本发明的每个方面均可根据任何法定类别进行描述和要求保护。除非另有明确说明,否则绝不旨在将本文中阐述的任何方法或方面解释为要求以特定顺序执行其步骤。因此,如果方法权利要求没有在权利要求或描述中具体说明步骤限于特定顺序,则在任何方面均无意推断出顺序。这适用于任何可能的非明确解释基础,包括有关步骤安排或操作流程的逻辑问题,由语法组织或标点符号得出的简单含义,或说明书中描述的数量或类型。
[0061]
在本技术中,引用了各种出版物。这些出版物的公开内容在此通过引用整体并入本技术中,以更全面地描述与其相关的领域的状况。公开的参考文献也通过参考文献以单独和具体的方式纳入本文,其中包含的材料在涉及参考文献的语句中进行讨论。本文中的任何内容均不得解释为承认本发明借助于先前的发明而早于此类出版物。此外,本文所示的公开日期可能与实际公开日期不同,这可能需要单独确认。
[0062]
a.定义
[0063]
除非另有说明,否则以下术语具有以下含义。
[0064]
如在说明书和所附权利要求中使用,除非上下文另有明确规定,否则单数形式(“a”、“an”和“the”)包括复数指示对象。例如,提及的“官能团”、“烷基”或“残基”包括两个或更多个此类官能团、烷基或残基等的混合物。
[0065]
范围在本文中可表示为从一个具体值(“约”)和/或至另一个具体值(“约”)。当表示这样的范围时,另一方面包括从一个具体值和/或至另一个具体值。类似地,当值表示为近似值时,通过使用先行词“约”,将理解为该具体值形成另一方面。并可进一步理解为,每个范围的端点相对于另一个端点是有意义的,并且不依赖于另一个端点。还应理解为,本文公开了多个值,并且除该值本身之外,每个值还在本文中公开为该具体值(“约”)。例如,如果公开值“10”,则还公开“约10”。还应理解为,还公开了两个具体单位之间的每个单位。例如,如果公开了10和15,则还公开了11、12、13和14。
[0066]
将说明书和最后的权利要求中对组合物中具体元素或组分的重量份的引用,表示为重量份的组合物或制品中该元素或组分与任何其它元素或组分之间的重量关系。因此,在含有2重量份的组分x和5重量份的组分y的化合物中,x和y以2:5的重量比存在,无论化合物中是否含有其它成分,均以该比例存在。
[0067]
除非另有特别说明,否则组分的重量百分比(wt.%)基于包括该组分的制剂或组合物的总重量。
[0068]
本文所用的术语“任选的”或“任选地”是指随后描述的事件或情况可能或不可能发生,并且该描述包括所述事件或情况发生的实例和不发生的实例。
[0069]
本文所用的术语“患者”是指被诊断患有可根据本文所述的发明进行治疗的疾病或病状的人。在一些方面,预期本文所述的制剂还可用于其它哺乳动物。术语“受试者”和“患者”在本文中可互换使用。
[0070]
术语“治疗(treatment和treating)”患者是指减轻、缓解、停止、阻断或预防患者的病症、疾病或其它病痛的症状。本文所用的术语“治疗(treatment和treating)”是指症状部分缓解以及完全缓解一段时间。一段时间可是数小时、数天、数个月或甚至数年。
[0071]
本文所用的术语“预防(prevent或preventing)”是指阻止、避免、消除、预先阻止、停止或阻碍某事的发生,特别是通过预先行动。应当理解,在本文中使用“减轻、抑制或预防”的情况下,除非另有特别说明,否则其它两个词也被明确公开。
[0072]
本文所用的术语“已诊断”是指已接受技术人员(例如医生)的体格检查,并且发现其患有可通过本文公开的化合物、组合物或方法诊断或治疗的病状。在公开方法的一些方面,受试者在给药之前已被诊断需要治疗病毒感染。本文所用的短语“已识别需要治疗病症”等是指基于需要治疗病症来选择受试者。一方面,可由与诊断者不同的人来进行识别。在一些方面,给药可由随后进行给药的人进行。
[0073]
本文所用的术语“给药(administering和administration)”是指向受试者提供药物制剂的任何方法。此类方法是本领域技术人员熟知的,并且包括但不限于口服给药、透皮给药、吸入给药、鼻给药、局部给药、阴道内给药、眼部给药、耳内给药、脑内给药、直肠给药和肠胃外给药,包括可注射的给药,例如,静脉内给药、动脉内给药、肌肉注射给药和皮下给药。给药可是连续的或间歇的。在各个方面,制剂可以治疗性给药;即,用于治疗现有的疾病或病状。在各个方面,制剂可预防性地给药;即,用于预防疾病或病状给药。
[0074]
本文所用的术语“接触”是指将公开的化合物与细胞、靶受体或其它生物实体以该
化合物可直接(即,通过与靶标本身相互作用)或间接(即,通过与靶标活性依赖的另一种分子、辅助因子、因子或蛋白质相互作用)影响靶标(例如受体、细胞等)活性的方式结合在一起。
[0075]
药物或药理活性剂的“有效”量或“治疗有效量”是指无毒但足以实现期望效果(例如治疗抑郁症)的药物或药剂的量。本领域普通技术人员可根据常规实验结果确定任何个体病例中的适当“有效”量。
[0076]
术语“药学上可接受的”描述了并非生物学上或其它方面非期望的材料,即未引起不可接受水平的非期望生物学效应或以有害方式相互作用。
[0077]
本文所用的术语“衍生物”是指具有衍生自母体化合物(例如,本文公开的化合物)的结构,并且其结构与本文公开的充分相似和基于该相似性的化合物,本领域技术人员预期其表现出与要求保护的化合物相同或相似的活性和效用,或者作为前体诱导与要求保护的化合物相同或相似的活性和效用。示例性衍生物包括母体化合物的盐、酯、酰胺、酯或酰胺的盐和n
‑
氧化物。
[0078]“生物相容的”材料是指对人体无毒的材料,其无致癌性,并应在身体组织中引起有限的炎症或无炎症。“可生物降解的”材料是指通过身体过程(例如酶促)降解成易于被身体处理或被身体组织吸收的产物的材料。生物降解产物还应与人体具有生物相容性。在一些方面,此类聚合物可用于制造,但不限于:微粒、微球体、基质、微粒基质、微球体基质、胶囊、水凝胶、棒、薄片、丸剂、脂质体、纤维、丸剂,或医生可给药至患者的其它合适的药物递送组合物。可生物降解的聚合物降解为无毒残留物,身体很容易清除或分解或缓慢溶解这些残留物,并将原型从体内清除。聚合物可离体固化,形成固体基质,其掺入药物以控释,例如缓慢释放或延释至期望区域。合适的生物可降解聚合物可包括但不限于天然或合成的生物相容性生物可降解材料。天然聚合物包括但不限于蛋白质,例如,白蛋白、胶原蛋白、明胶合成聚(氨基酸)和醇溶谷蛋白;糖胺聚糖,例如,透明质酸和肝素;多糖,例如,海藻酸盐、壳聚糖、淀粉和右旋糖酐;和其它天然存在的或化学改性的可生物降解聚合物。合成的生物相容性生物可降解材料包括但不限于由以下组成的组、聚(丙交酯
‑
共
‑
乙交酯)(plga)、聚乳酸(pla)、聚乙交酯(pg)、聚羟基丁酸、聚(三亚甲基碳酸酯)、聚己内酯(pcl)、聚戊内酯、聚(α
‑
羟基酸)、聚(内酯)、聚(氨基酸)、聚(酸酐)、聚缩酮聚(芳基化物)、聚(原酸酯)、聚氨酯、聚硫酯、聚(原碳酸酯)、聚(磷酸酯)、聚(酯
‑
共
‑
酰胺)、聚(丙交酯
‑
共
‑
氨基甲酸酯)、聚乙二醇(peg)、聚乙烯醇(pva)、pva
‑
g
‑
plga、pegt
‑
pbt共聚物(多活性)、甲基丙烯酸酯、聚(n
‑
异丙基丙烯酰胺)、peo
‑
ppo
‑
peo(普朗尼克)、peo
‑
ppo
‑
paa共聚物和plga
‑
peo
‑
plga共混物及其共聚物,以及其任何组合物。生物相容性生物可降解材料可包括生物相容性生物可降解材料的组合。例如,生物相容性生物可降解材料可是三嵌段或其它多嵌段结构,其中生物相容性生物可降解聚合物的组合连接在一起。例如,三嵌段可是plga
‑
peg
‑
plga。
[0079]
本文所用的短语“富含酪胺的膳食”是指根据fda(美国食品药品监督管理局,司来吉兰透皮医学审查(2019年9月29日访问:https://www.accessdata.fda.gov/drugsatfda_docs/nda/2006/021336s000_021708s000_medr_part1.pdf),2006年2月)定义的食物标准食用40mg或更少的酪胺。例如,在各个方面,maoi和nri各自给药,采用在制剂有效性时间段内食用富含酪胺的膳食(即,酪胺的量为40mg或更少)后足以导致血压升高小于约20mm hg的nri剂量。因此,maoi和nri各自给药,采用在有效血浆浓度时间段内食用约40mg或更少、
约35mg或更少、约30mg或更少、约25mg或更少、约20mg或更少、约15mg或更少、约10mg或更少、或约5mg或更少的酪胺后足以导致血压升高小于约20mm hg的nri剂量。
[0080]
本文所用的短语“控释制剂时间段”是指制剂中的活性剂在给药至受试者后以延迟但受控的方式释放的时间段。控释的目的是为了避免生物利用度的峰值和谷值,并延长制剂浓度在狭窄范围内波动的时间段。另一个关键目标是为了延长药物浓度保持在达到预期效果期望的最低目标浓度以上的时间段。该时间段在本文中将被称为“有效血浆浓度期”。例如,在各个方面,本文公开了包括nri托莫西汀(其在强代谢者中的消除半衰期为约5小时)的延释制剂,缓释制剂用于在24小时内维持约130ng/ml的最低托莫西汀血浆浓度,以充分减弱酪胺升压作用,而无论一天中何时摄入富含酪胺的膳食。该24小时“有效血浆浓度期”可通过约18小时的控释时间段来实现。类似地,如果采用的nri是地昔帕明,一种消除半衰期为12
‑
30小时的药物,则可实现24小时有效时间段,最小浓度为约30ng/ml,控释时间段为8至12小时。取决于制剂中采用的nri,nri可在约6
‑
20小时、约6
‑
8小时、约8
‑
12小时、约12
‑
14小时、约14
‑
16小时、约16
‑
18小时、约18
‑
20小时内释放。在各个进一步的方面,本文公开了包括maoi的缓释制剂,其中maoi在给药至受试者后在约6
‑
16小时的时间段(例如,延释制剂期)内释放。因此,在给药至受试者后maoi可在约6
‑
16小时、约6
‑
14小时、约6
‑
12小时、约6
‑
10小时、约6
‑
8小时、约8
‑
16小时、约10
‑
16小时、约12
‑
16小时、或约14
‑
16小时内释放。
[0081]
本文所用的术语“半衰期”是指血浆中药物的初始浓度降低50%的时间段。例如,在maoi中,tcp的半衰期为约2.5小时,苯乙肼的半衰期为约11.6小时,司来吉兰的半衰期为约10小时。在nri中,托莫西汀的半衰期在强代谢者中为约5小时,在慢代谢者中超过10小时,地昔帕明的半衰期平均为21小时,瑞波西汀的半衰期为13小时。
[0082]
本文所用的术语“有效血浆浓度时间段”是指活性剂以有效血浆浓度存在于血浆中的时间段。例如,40mg tcp剂量浓度之后的血浆浓度保持高于25ng/ml最低阈值持续9小时,而相同40mg剂量的10小时缓释制剂保持高于25ng/ml持续15小时。因此,缓释制剂使有效血浆时间延长了6小时。
[0083]
本文所用的术语“去甲肾上腺素(norepinephrine)”是与有时称为“降肾上腺素(noradrenaline)”的化合物相同的化合物。这些术语可互换使用,是指在外周和中枢神经系统中既是神经递质又是激素的化合物。在本技术的默认情况下,将使用术语去甲肾上腺素。
[0084]
本文所用的术语“去甲肾上腺素再摄取抑制剂”和“nri”是指通过阻断去甲肾上腺素转运体的作用来抑制神经递质去甲肾上腺素(即,降肾上腺素)和肾上腺素(epinephrine,即adrenaline)的药物。
[0085]
除非另有明确说明,否则绝不欲将本文中阐述的任何方法解释为要求其步骤以特定顺序进行。因此,如果方法权利要求实际上并未叙述其所遵循的顺序,或者在权利要求或描述中未另外具体说明这些步骤将被限制为特定顺序,则在任何方面均绝不欲推断顺序。这适用于任何可能的非明确的解释基础,包括有关步骤安排或操作流程的逻辑问题;由语法组织或标点符号得出的简单含义;或说明书中描述的方面的数量或类型。
[0086]
应当理解,本文公开的组合物具有某些功能。本文公开的是进行公开功能的某些结构要求,并且可理解,有多种结构可进行与公开的结构相关的相同功能,并且这些结构通常将实现相同的结果。
[0087]
引用的所有参考文献、专利、专利申请或其它文件均通过引用在此并入。
[0088]
b.控释制剂
[0089]
一方面,本文公开了包括控释制剂的组合物,该控释制剂包括tcp、其化学类似物、或其药学上可接受的盐,其中tcp在向患者给药后从控释制剂中释放超过约6小时,但小于约16小时。在一些方面,控释制剂进一步包括生物相容性聚合物。在一些方面,生物相容性聚合物是可生物降解的。在一些方面,生物相容性聚合物是天然生物相容性聚合物。在一些方面,生物相容性聚合物是合成的生物相容性聚合物。
[0090]
一方面,本文公开了包括控释制剂的组合物,该控释制剂包含苯乙肼、其化学类似物、或其药学上可接受的盐,其中苯乙肼在向患者给药后从控释制剂中释放超过约6小时,但小于约16小时。
[0091]
一方面,本文公开了包括至少一种maoi、其化学类似物、或其药学上可接受的盐的控释制剂,其中maoi在向患者给药后从控释制剂中释放超过约6小时,但小于约16小时。在一些方面,控释制剂是延释或缓慢释放的。在一些方面,maoi在向患者给药后从控释制剂中释放超过约6小时,但小于约16小时。在一些方面,maoi在向患者给药后从延释制剂或缓慢释放制剂中释放超过约6小时,但小于约14小时。
[0092]
一方面,本文公开了包括治疗有效量的tcp和药学上可接受的载体的药物组合物,其中药物组合物被配制成控释剂型,在向患者给药后约6
‑
16小时内从该控释剂型释放tcp。
[0093]
一方面,本文公开了包括治疗有效量的苯乙肼和药学上可接受的载体的药物组合物,其中药物组合物被配制成控释剂型,在向患者给药后约6
‑
16小时内从该控释剂型释放苯乙肼。
[0094]
因此,在一些方面,本文公开了控释、缓释、迟释或脉冲式释放(pulsatile
‑
release)组合物。参见(例如)《remington药物科学》(第18版;mack出版社,eaton,pa,1990)。在一些方面,控释制剂至少包括tcp和/或苯乙肼。在一些方面,控释制剂包括tcp和/或苯乙肼、其化学类似物、或其药学上可接受的盐,其中tcp和/或苯乙肼在向患者给药后从控释制剂中释放超过约6小时,但小于约16小时。在一些方面,tcp和/或苯乙肼在向患者给药后从控释制剂中释放超过约6小时,但小于约14小时。在一些方面,tcp以外消旋混合物存在于控释制剂中。在一些方面,tcp以单一异构体存在于控释制剂中。
[0095]
在一些方面,延释制剂或缓慢释放制剂至少包括tcp和/或苯乙肼。在一些方面,延释制剂或缓慢释放制剂包括tcp和/或苯乙肼、其化学类似物、或其药学上可接受的盐,其中tcp和/或苯乙肼在向患者给药后的延释制剂时间段内从延释制剂或缓慢释放制剂中释放。在一些方面,tcp以外消旋混合物存在于延释制剂或缓慢释放制剂中。在一些方面,tcp以单一异构体形式存在于延释制剂或缓慢释放制剂中。
[0096]
在一些方面,控释制剂进一步包括生物相容性聚合物。在一些方面,延释制剂或缓慢释放制剂进一步包括生物相容性聚合物。在一些方面,生物相容性聚合物是可生物降解的。在一些方面,生物相容性聚合物是天然生物相容性聚合物。在一些方面,生物相容性聚合物是合成的生物相容性聚合物。
[0097]
在一些方面,控释制剂或者延释制剂或缓慢释放制剂中的maoi包括以下范围内的负荷剂量:约10mg
‑
120mg之间,例如,约10mg
‑
100mg之间、约10mg
‑
80mg之间、约10mg
‑
60mg之间、约10mg
‑
40mg之间、约10mg
‑
20mg之间、约20mg
‑
120mg之间、约40mg
‑
120mg之间、约60mg
‑
120mg之间、约80mg
‑
120mg之间、或约100mg
‑
120mg之间。在一些方面,maoi包含在约40mg
‑
75mg范围内的负荷剂量。在一些方面,maoi在向患者给药后约16小时内从控释制剂或者延释制剂或缓慢释放制剂中基本释放或完全释放。
[0098]
在一些方面,控释制剂或者延释制剂或缓慢释放制剂中的tcp包括以下范围内的负荷剂量:约10mg
‑
60mg之间,例如,约10mg
‑
50mg之间、约10mg
‑
40mg之间、约10mg
‑
30mg之间、约10mg
‑
20mg之间、约20mg
‑
60mg之间、约20mg
‑
50mg之间、约20mg
‑
40mg之间、约20mg
‑
30mg之间、约30mg
‑
60mg之间、约30mg
‑
50mg之间、约30mg
‑
40mg之间、约40mg
‑
60mg之间、约40mg
‑
50mg之间、或约50mg
‑
60mg之间。在一些方面,tcp包括在约40mg
‑
60mg之间范围内的负荷剂量。在一些方面,tcp在向患者给药后约16小时内从控释制剂或者延释制剂或缓慢释放制剂中基本释放或完全释放。
[0099]
在一些方面,控释制剂或者延释制剂或缓慢释放制剂中的苯乙肼包括以下范围内的负荷剂量:约15mg
‑
120mg之间,例如,约15mg
‑
75mg之间、约15mg
‑
60mg之间、约15mg
‑
45mg之间、约15mg
‑
30mg之间、约15mg
‑
25mg之间、约25mg
‑
85mg之间、约35mg
‑
85mg之间、约45mg
‑
85mg之间、约55mg
‑
85mg之间、约65mg
‑
85mg之间、或约75mg
‑
85mg之间。在一些方面,苯乙肼包括约45mg
‑
75mg之间范围内的负荷剂量。在一些方面,苯乙肼在向患者给药后约16小时内从控释制剂或者延释制剂或缓慢释放制剂中基本释放或完全释放。
[0100]
在一些方面,组合物被配制成口服剂型。
[0101]
化合物药学上可接受的盐是常规的酸加成盐或碱加成盐,其保留了化合物的生物有效性和特性,并且由合适的无毒有机或无机酸或者有机或无机碱形成。示例性酸加成盐包括衍生自无机酸例如,盐酸、氢溴酸、氢碘酸、硫酸、氨基磺酸、磷酸和硝酸,以及衍生自有机酸例如,对甲苯磺酸、水杨酸、甲磺酸、草酸、琥珀酸、柠檬酸、苹果酸、乳酸、富马酸等。示例性碱加成盐包括衍生自氢氧化铵、钾、钠和季铵(例如,氢氧化四甲基铵)等。药物化合物经化学修饰成盐是获得化合物的改进的物理和化学稳定性、吸湿性、流动性和溶解性的已知技术。参见(例如)h.ansel等人《药物剂型和给药系统》(第6版,1995年),第196页和第1456页
‑
第1457页。
[0102]
在一些方面,为了延长本文所述化合物的作用,可能需要减慢化合物的吸收(例如,通过制备控释制剂)。例如,这可通过具有差水溶性的结晶或无定形材料的液体混悬剂来实现。化合物的吸收速率取决于其溶解速率,反过来,溶解速率又可能取决于晶体大小和结晶形式。可选地,化合物的延迟吸收可通过将化合物溶解或悬浮于油性溶媒中来实现。控释制剂还可通过在生物可降解聚合物例如,聚丙交酯
‑
聚乙交酯中形成化合物的微囊基质进行制备。根据化合物与聚合物的比例以及所用具体聚合物的性质,可控制化合物释放的速率。其它生物可降解聚合物的实例包括聚(原酸酯)和聚(酸酐)。可选地,控释制剂可通过将化合物包封在与身体组织相容的脂质体或微乳液中进行制备。
[0103]
在一些方面,本文公开的控释剂型是满足本文公开的溶出、释放、递送和/或药代动力学特性中的一种或多种制剂。例如,cmax(即,给药后血液或血浆中的药物峰浓度)可能受药物剂量(例如,较高剂量通常产生较高cmax值)、给药途径(例如,与口服给药相比,iv推注给药可能出现较高cmax值)和制剂类型(例如,与速释复方制剂相比,控释口服制剂给药后可能出现较低cmax)的影响。控释制剂通过使药物可用时间更长但浓度较低来降低给定每日剂量的cmax。其它药物特性,例如,溶解度、渗透性、吸收进入体内的方式、代谢和代谢
产物等,也可影响cmax,这表示虽然可基于上述因素进行预测,但是若没有有意义的人体实验,观察到的实际行为难以预测,而且可能是非预期的。在一些方面,本文公开的控释制剂对于40mg/d的tcp剂量,速释制剂的平均cmax为约230ng/ml。tcp的控释制剂在10小时内将降低cmax至约90ng/ml,降低超过60%。这种降低对体位性低血压有重要作用,这是导致许多患者停药的主要tcp副作用。如果采用速释制剂,体位收缩压的最高下降幅度为约25mm hg,而控释制剂将在峰值时下降至约10mm hg。最终结果是显著改善安全性和耐受性。
[0104]
在一些方面,本文公开的控释制剂根据常规程序被配制成适于向受试者口服给药的组合物。用于口服递送的组合物可以各种形式存在,包括但不限于片剂、锭剂、水或油混悬剂、颗粒剂、粉剂、乳剂、胶囊、糖浆或酏剂。组合物口服给药还可含有一种或多种甜味剂,例如,果糖、阿斯巴甜或糖精;调味剂,例如,薄荷、冬青油或樱桃;着色剂;和/或防腐剂,以提供药学上适口的制剂。此外,如果采用片剂或丸剂,可对组合物进行包衣以延迟其在胃肠道中的崩解和吸收,从而在延长的时间段内产生持续作用。渗透活性化合物周围的选择性渗透膜也适用于口服给药。在后一种形式中,来自胶囊周围环境的流体被驱动化合物吸收,驱动化合物膨胀以置换药剂或药剂制剂。如单硬脂酸甘油酯或硬脂酸甘油酯等延时材料也可能是有用的。口服组合物可包括标准辅料,例如,甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素和碳酸镁。在一些方面,辅料是药物级的。
[0105]
在一些方面,控释制剂可通过控释方式或通过本领域普通技术人员公知的递送装置给药。实例包括但不限于美国专利号3,845,770;3,916,899;3,536,809;3,598,123;4,008,719;5,674,533;5,059,595;5,591,767;5,120,548;5,073,543;5,639,476;5,354,556;和5,733,556。此类剂型可用于实现本文公开的组合物的控释或缓释,使用例如羟丙基甲基纤维素、其它聚合物基质、凝胶、渗透膜、渗透系统、多层包衣、微粒、脂质体、微球、或其组合,以提供不同比例的期望释放曲线。因此,在一些方面,本文公开了适用于口服给药的单一单位剂型,例如,但不限于适用于控释或缓释的片剂、胶囊、软胶囊和囊片。
[0106]
c.包括maoi和nri的药物组合物
[0107]
本发明还提供了包括至少一种maoi、其化学类似物、或其药学上可接受的盐以及至少一种nri的药物组合物,其中maoi和nri各自给药,采用在向患者给药组合物后足以抑制酪胺摄取的nri剂量给药。
[0108]
在一些方面,药物组合物包括tcp和至少一种nri,其中nri以在向患者给药组合物后足以抑制酪胺摄取的剂量存在于组合物中。在一些方面,tcp以外消旋混合物存在于组合物中。在一些方面,tcp以单一异构体存在于组合物中。
[0109]
在一些方面,药物组合物包括苯乙肼和至少一种nri,其中nri以在向患者给药组合物后足以抑制酪胺摄取的剂量存在于组合物中。
[0110]
因此,本文公开了包括maoi、nri和药学上可接受的载体的药物组合物,其中maoi和nri中的至少一种以治疗有效量存在,或其中maoi和nri一起以治疗有效量存在。
[0111]
还公开了包括tcp、托莫西汀和药学上可接受的载体的药物组合物,其中托莫西汀被配制成控释剂型,其中tcp被配制成控释剂型,并且其中tcp和托莫西汀在不同时间段内被释放,并且其中tcp和托莫西汀中的至少一种以治疗有效量存在,或其中tcp和托莫西汀一起以治疗有效量存在。
[0112]
还公开了包括苯乙肼、托莫西汀和药学上可接受的载体的药物组合物,其中托莫
西汀被配制成控释剂型,其中苯乙肼被配制成控释剂型,并且其中苯乙肼和托莫西汀在不同时间段内释放,并且其中苯乙肼和托莫西汀中的至少一种以治疗有效量存在,或其中苯乙肼和托莫西汀一起以治疗有效量存在。
[0113]
还公开了包括苯乙肼、地昔帕明和药学上可接受的载体的药物组合物,其中地昔帕明被配制成控释剂型,其中苯乙肼被配制成控释剂型,其中苯乙肼和地昔帕明在不同时间段内释放,并且其中苯乙肼和地昔帕明中的至少一种以治疗有效量存在,或其中苯乙肼和地昔帕明一起以治疗有效量存在。
[0114]
还公开了包括tcp和nri的药物组合物,其中nri以在向患者给药组合物后足以抑制酪胺摄取的剂量存在于组合物中。
[0115]
还公开了包括苯乙肼和nri的药物组合物,其中nri以在向患者给药组合物后足以抑制酪胺摄取的剂量存在于组合物中。
[0116]
在一些方面,nri选自由去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合组成的组。
[0117]
在一些方面,maoi包括以下负荷剂量:约20mg
‑
1000mg、约50mg
‑
1000mg、约100mg
‑
1000mg、约250mg
‑
1000mg、约500mg
‑
1000mg、约750mg
‑
1000mg、约20mg
‑
750mg、约20mg
‑
500mg、约20mg
‑
250mg、约20mg
‑
100mg、约20mg
‑
50mg、约30mg
‑
90mg、或约40mg
‑
60mg。本领域技术人员将理解,maoi的负荷剂量取决于所采用的maoi。例如,当maoi是tcp时,负荷剂量可为约10mg
‑
120mg。可选地,当maoi是苯乙肼时,负荷剂量可为约15mg
‑
120mg。
[0118]
在一些方面,tcp包括在以下范围内的负荷剂量:约10mg
‑
120mg之间,例如,约10mg
‑
100mg之间、约10mg
‑
80mg之间、约10mg
‑
60mg之间、约10mg
‑
40mg之间、约10mg
‑
20mg之间、约20mg
‑
120mg之间、约40mg
‑
120mg之间、约60mg
‑
120mg之间、约80mg
‑
120mg之间、或约100mg
‑
120mg之间。在一些方面,tcp包括在约40mg至60mg范围内的负荷剂量。
[0119]
在一些方面,苯乙肼包括以下范围内的负荷剂量:约15mg
‑
85mg之间,例如,约15mg
‑
75mg之间、约15mg
‑
65mg之间、约15mg
‑
55mg之间、约15mg
‑
45mg之间、约15mg
‑
35mg之间、约15mg
‑
25mg之间、约25mg
‑
85mg之间、约35mg
‑
85mg之间、约45mg
‑
85mg之间、约55mg
‑
85mg之间、约65mg
‑
85mg之间或约75mg
‑
85mg之间。在一些方面,苯乙肼包括约45mg
‑
75mg范围内的负荷剂量。
[0120]
在一些方面,药物组合物包括控释制剂,该控释制剂包括至少一种maoi、其化学类似物、或其药学上可接受的盐,其中maoi在向患者给药后的延释制剂时间段内从控释制剂中释放。在一些方面,控释制剂是延释制剂或缓慢释放制剂。
[0121]
在一些方面,控释制剂至少包括tcp。在一些方面,控释制剂包括tcp、其化学类似物、或其药学上可接受的盐,其中tcp在向患者给药后的延释制剂时间段内从控释制剂中释放。在一些方面,tcp以外消旋混合物存在于控释制剂中。在一些方面,tcp以单一异构体存在于控释制剂中。
[0122]
在一些方面,控释制剂至少包括苯乙肼。在一些方面,控释制剂包括苯乙肼、其化学类似物、或其药学上可接受的盐,其中苯乙肼在向患者给药后的延释制剂时间段内从控释制剂中释放。
[0123]
在一些方面,maoi以治疗有效量存在。在一些方面,nri以非治疗有效量存在。在一些方面,maoi和nri一起以治疗有效量存在。
[0124]
在一些方面,maoi被配制成控释剂型。在一些方面,控释剂型在向患者给药后的以下时间段内释放maoi:约4
‑
16小时、约6
‑
16小时、约8
‑
16小时、约10
‑
16小时、约12
‑
16小时、约14
‑
16小时、约4
‑
14小时、约4
‑
12小时、约4
‑
10小时、约4
‑
10小时、约4
‑
8小时、或约4
‑
6小时。在一些方面,在向患者给药后的以下时间段后基本上释放所有maoi:约8
‑
16小时、约10
‑
16小时、约12
‑
16小时、约14
‑
16小时、约8
‑
14小时、约8
‑
12小时、约8
‑
10小时、约10
‑
16小时、或约12
‑
16小时。
[0125]
在一些方面,maoi以约20mg
‑
1000mg、约50mg
‑
1000mg、约100mg
‑
1000mg、约250mg
‑
1000mg、约500mg
‑
1000mg、约750mg
‑
1000mg、约20mg
‑
750mg、约20mg
‑
500mg、约20mg
‑
250mg、约20mg
‑
100mg、约20mg
‑
50mg、约30mg
‑
90mg、or约40mg
‑
60mg的量存在于。本领域技术人员将理解,存在的maoi的量取决于所采用的maoi。例如,当maoi是tcp时,maoi可以约10mg
‑
120mg的量存在。可选地,当maoi是苯乙肼时,maoi可以约15mg
‑
120mg的量存在。
[0126]
在一些方面,maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,maoi是tcp。在一些方面,maoi是苯乙肼。
[0127]
在一些方面,maoi是雷沙吉兰,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是雷沙吉兰,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀及其任何组合。在一些方面,maoi是雷沙吉兰,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀及其任何组合。在一些方面,maoi是雷沙吉兰,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明及其任何组合。在一些方面,maoi是雷沙吉兰,并且nri选自去甲替林、地昔帕明、普罗替林及其任何组合。在一些方面,maoi是雷沙吉兰,并且nri选自去甲替林、地昔帕明及其任何组合。在一些方面,maoi是雷沙吉兰,并且nri选自地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是雷沙吉兰,并且nri选自普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是雷沙吉兰,并且nri选自洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是雷沙吉兰,并且nri选自瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是雷沙吉兰,并且nri选自托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是雷沙吉兰,并且nri是去甲替林。在一些方面,maoi是雷沙吉兰,并且nri是地昔帕明。在一些方面,maoi是雷沙吉兰,并且nri是普罗替林。在一些方面,maoi是雷沙吉兰,并且nri是洛非帕明。在一些方面,maoi是雷沙吉兰,并且nri是瑞波西汀。在一些方面,maoi是雷沙吉兰,并且nri是托莫西汀。在一些方面,maoi是雷沙吉兰,并且nri是尼索西汀。
[0128]
在一些方面,maoi是司来吉兰,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是司来吉兰,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀及其任何组合。在一些方面,maoi是司来吉兰,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀及其任何组合。在一些方面,maoi是司来吉兰,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明及其任何组合。在一些方面,maoi是司来吉兰,并且nri选自去甲替林、地昔帕明、普罗替林及其任何组合。在一些方面,maoi是司来吉兰,并且nri选自去甲替林、地昔帕明及其任何组合。在一些方面,maoi是司来吉兰,并且nri选自地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是司来吉兰,并且nri选自普罗
替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是司来吉兰,并且nri选自洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是司来吉兰,并且nri选自瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是司来吉兰,并且nri选自托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是司来吉兰,并且nri是去甲替林。在一些方面,maoi是司来吉兰,并且nri是地昔帕明。在一些方面,maoi是司来吉兰,而nri是普罗替林。在一些方面,maoi是司来吉兰并且nri是洛非帕明。在一些方面,maoi是司来吉兰,并且nri是瑞波西汀。在一些方面,maoi是司来吉兰,并且nri是托莫西汀。在一些方面,maoi是司来吉兰,并且nri是尼索西汀。
[0129]
在一些方面,maoi是异卡波肼,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是异卡波肼,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀及其任何组合。在一些方面,maoi是异卡波肼,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀及其任何组合。在一些方面,maoi是异卡波肼,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明及其任何组合。在一些方面,maoi是异卡波肼,并且nri选自去甲替林、地昔帕明、普罗替林及其任何组合。在一些方面,maoi是异卡波肼,并且nri选自去甲替林、地昔帕明及其任何组合。在一些方面,maoi是异卡波肼,并且nri选自地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是异卡波肼,并且nri选自普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是异卡波肼,并且nri选自洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是异卡波肼,并且nri选自瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是异卡波肼,并且nri选自托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是异卡波肼,并且nri是去甲替林。在一些方面,maoi是异卡波肼,并且nri是地昔帕明。在一些方面,maoi是异卡波肼,并且nri是普罗替林。在一些方面,maoi是异卡波肼,并且nri是洛非帕明。在一些方面,maoi是异卡波肼,并且nri是瑞波西汀。在一些方面,maoi是异卡波肼,并且nri是托莫西汀。在一些方面,maoi是异卡波肼,并且nri是尼索西汀。
[0130]
在一些方面,maoi是苯乙肼,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是苯乙肼,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀及其任何组合。在一些方面,maoi是苯乙肼,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀及其任何组合。在一些方面,maoi是苯乙肼,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明及其任何组合。在一些方面,maoi是苯乙肼,并且nri选自去甲替林、地昔帕明、普罗替林及其任何组合。在一些方面,maoi是苯乙肼,并且nri选自去甲替林、地昔帕明及其任何组合。在一些方面,maoi是苯乙肼,并且nri选自地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是苯乙肼,并且nri选自普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是苯乙肼,并且nri选自洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是苯乙肼,并且nri选自瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是苯乙肼,并且nri是托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是苯乙肼,并且nri是去甲替林。在一些方面,maoi是苯乙肼,并且nri是地昔帕明。在一些方面,maoi是苯乙肼,并且nri是普罗替
林。在一些方面,maoi是苯乙肼,并且nri是洛非帕明。在一些方面,maoi是苯乙肼,并且nri是瑞波西汀。在一些方面,maoi是苯乙肼,并且nri是托莫西汀。在一些方面,maoi是苯乙肼,并且nri是尼索西汀。
[0131]
在一些方面,maoi是tcp,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是tcp,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀及其任何组合。在一些方面,maoi是tcp,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀及其任何组合。在一些方面,maoi是tcp,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明及其任何组合。在一些方面,maoi是tcp,并且nri选自去甲替林、地昔帕明、普罗替林及其任何组合。在一些方面,maoi是tcp,并且nri选自去甲替林、地昔帕明及其任何组合。在一些方面,maoi是tcp,并且nri选自地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是tcp,并且nri选自普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是tcp,并且nri选自洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是tcp,并且nri选自瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是tcp,并且nri选自托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是tcp,并且nri是去甲替林。在一些方面,maoi是tcp,并且nri是地昔帕明。在一些方面,maoi是tcp,并且nri是普罗替林。在一些方面,maoi是tcp,并且nri是洛非帕明。在一些方面,maoi是tcp,并且nri是瑞波西汀。在一些方面,maoi是tcp,并且nri是托莫西汀。在一些方面,maoi是tcp,并且nri是尼索西汀。
[0132]
在一些方面,maoi是吗氯贝胺,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是吗氯贝胺,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀及其任何组合。在一些方面,maoi是吗氯贝胺,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀及其任何组合。在一些方面,maoi是吗氯贝胺,并且nri选自去甲替林、地昔帕明、普罗替林、洛非帕明及其任何组合。在一些方面,maoi是吗氯贝胺,并且nri选自去甲替林、地昔帕明、普罗替林及其任何组合。在一些方面,maoi是吗氯贝胺,并且nri选自去甲替林、地昔帕明及其任何组合。在一些方面,maoi是吗氯贝胺,并且nri选自地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是吗氯贝胺,并且nri选自普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是吗氯贝胺,并且nri选自洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是吗氯贝胺,并且nri选自瑞波西汀、托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是吗氯贝胺,并且nri是托莫西汀、尼索西汀及其任何组合。在一些方面,maoi是吗氯贝胺,并且nri是去甲替林。在一些方面,maoi是吗氯贝胺,并且nri是地昔帕明。在一些方面,maoi是吗氯贝胺,并且nri是普罗替林。在一些方面,maoi是吗氯贝胺,并且nri是洛非帕明。在一些方面,maoi是吗氯贝胺,并且nri是瑞波西汀。在一些方面,maoi是吗氯贝胺,并且nri是托莫西汀。在一些方面,maoi是吗氯贝胺,并且nri是尼索西汀。
[0133]
在一些方面,nri是去甲替林,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是去甲替林,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼及其任何组合。在一些方面,nri是去甲替林,并且maoi
选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼及其任何组合。在一些方面,nri是去甲替林,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰及其任何组合。在一些方面,nri是去甲替林,并且maoi选自吗氯贝胺、雷沙吉兰及其任何组合。在一些方面,nri是去甲替林,并且maoi选自雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是去甲替林,并且maoi选自司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是去甲替林,并且maoi选自异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是去甲替林,并且maoi选自苯乙肼、tcp及其任何组合。在一些方面,nri是去甲替林,并且maoi是雷沙吉兰。在一些方面,nri是去甲替林,并且maoi是司来吉兰。在一些方面,nri是去甲替林,并且maoi是异卡波肼。在一些方面,nri是去甲替林,并且maoi是苯乙肼。在一些方面,nri是去甲替林,并且maoi是tcp。在一些方面,nri是去甲替林,并且maoi是吗氯贝胺。
[0134]
在一些方面,nri是地昔帕明,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是地昔帕明,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼及其任何组合。在一些方面,nri是地昔帕明,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼及其任何组合。在一些方面,nri是地昔帕明,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰及其任何组合。在一些方面,nri是地昔帕明,并且maoi选自吗氯贝胺、雷沙吉兰及其任何组合。在一些方面,nri是地昔帕明,并且maoi选自雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是地昔帕明,并且maoi选自司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是地昔帕明,并且maoi选自异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是地昔帕明,并且maoi选自苯乙肼、tcp及其任何组合。在一些方面,nri是地昔帕明,并且maoi是雷沙吉兰。在一些方面,nri是地昔帕明,并且maoi是司来吉兰。在一些方面,nri是地昔帕明,并且maoi是异卡波肼。在一些方面,nri是地昔帕明,并且maoi是苯乙肼。在一些方面,nri是地昔帕明,并且maoi是tcp。在一些方面,nri是地昔帕明,并且maoi是吗氯贝胺。
[0135]
在一些方面,nri是普罗替林,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是普罗替林,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼及其任何组合。在一些方面,nri是普罗替林,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼及其任何组合。在一些方面,nri是普罗替林,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰及其任何组合。在一些方面,nri是普罗替林,并且maoi选自吗氯贝胺、雷沙吉兰及其任何组合。在一些方面,nri是普罗替林,并且maoi选自雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是普罗替林,并且maoi选自司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是普罗替林,并且maoi选自异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是普罗替林,并且maoi选自苯乙肼、tcp及其任何组合。在一些方面,nri是普罗替林,并且maoi是雷沙吉兰。在一些方面,nri是普罗替林,并且maoi是司来吉兰。在一些方面,nri是普罗替林,并且maoi是异卡波肼。在一些方面,nri是普罗替林,并且maoi是苯乙肼。在一些方面,nri是普罗替林,并且maoi是tcp。在一些方面,nri是普罗替林,并且maoi是吗氯贝胺。
[0136]
在一些方面,nri是洛非帕明,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是洛非帕明,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼及其任何组合。在一些方面,nri是洛非帕明,并且maoi
选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼及其任何组合。在一些方面,nri是洛非帕明,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰及其任何组合。在一些方面,nri是洛非帕明,并且maoi选自吗氯贝胺、雷沙吉兰及其任何组合。在一些方面,nri是洛非帕明,并且maoi选自雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是洛非帕明,并且maoi选自司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是洛非帕明,并且maoi选自异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是洛非帕明,并且maoi选自苯乙肼、tcp及其任何组合。在一些方面,nri是洛非帕明,并且maoi是雷沙吉兰。在一些方面,nri是洛非帕明,并且maoi是司来吉兰。在一些方面,nri是洛非帕明,并且maoi是异卡波肼。在一些方面,nri是洛非帕明,并且maoi是苯乙肼。在一些方面,nri是洛非帕明,并且maoi是tcp。在一些方面,nri是洛非帕明,并且maoi是吗氯贝胺。
[0137]
在一些方面,nri是瑞波西汀,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是瑞波西汀,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼及其任何组合。在一些方面,nri是瑞波西汀,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼及其任何组合。在一些方面,nri是瑞波西汀,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰及其任何组合。在一些方面,nri是瑞波西汀,并且maoi选自吗氯贝胺、雷沙吉兰及其任何组合。在一些方面,nri是瑞波西汀,并且maoi选自雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是瑞波西汀,并且maoi选自司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是瑞波西汀,并且maoi选自异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是瑞波西汀,并且maoi选自苯乙肼、tcp及其任何组合。在一些方面,nri是瑞波西汀,并且maoi是雷沙吉兰。在一些方面,nri是瑞波西汀,并且maoi是司来吉兰。在一些方面,nri是瑞波西汀,并且maoi是异卡波肼。在一些方面,nri是瑞波西汀,并且maoi是苯乙肼。在一些方面,nri是瑞波西汀,并且maoi是tcp。在一些方面,nri是瑞波西汀,并且maoi是吗氯贝胺。
[0138]
在一些方面,nri是托莫西汀,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是托莫西汀,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼及其任何组合。在一些方面,nri是托莫西汀,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼及其任何组合。在一些方面,nri是托莫西汀,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰及其任何组合。在一些方面,nri是托莫西汀,并且maoi选自吗氯贝胺、雷沙吉兰及其任何组合。在一些方面,nri是托莫西汀,并且maoi选自雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是托莫西汀,并且maoi选自司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是托莫西汀,并且maoi选自异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是托莫西汀,并且maoi选自苯乙肼、tcp及其任何组合。在一些方面,nri是托莫西汀,并且maoi是雷沙吉兰。在一些方面,nri是托莫西汀,并且maoi是司来吉兰。在一些方面,nri是托莫西汀,并且maoi是异卡波肼。在一些方面,nri是托莫西汀,并且maoi是苯乙肼。在一些方面,nri是托莫西汀,并且maoi是tcp。在一些方面,nri是托莫西汀,并且maoi是吗氯贝胺。
[0139]
在一些方面,nri是尼索西汀,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是尼索西汀,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼及其任何组合。在一些方面,nri是尼索西汀,并且maoi
选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼及其任何组合。在一些方面,nri是尼索西汀,并且maoi选自吗氯贝胺、雷沙吉兰、司来吉兰及其任何组合。在一些方面,nri是尼索西汀,并且maoi选自吗氯贝胺、雷沙吉兰及其任何组合。在一些方面,nri是尼索西汀并且maoi选自雷沙吉兰、司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是尼索西汀,并且maoi选自司来吉兰、异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是尼索西汀,并且maoi选自异卡波肼、苯乙肼、tcp及其任何组合。在一些方面,nri是尼索西汀,并且maoi选自苯乙肼、tcp及其任何组合。在一些方面,nri是尼索西汀,并且maoi是雷沙吉兰。在一些方面,nri是尼索西汀,并且maoi是司来吉兰。在一些方面,nri是尼索西汀,并且maoi是异卡波肼。在一些方面,nri是尼索西汀,并且maoi是苯乙肼。在一些方面,nri是尼索西汀,并且maoi是tcp。在一些方面,nri是尼索西汀,并且maoi是吗氯贝胺。
[0140]
在一些方面,nri被配制成控释剂型。在一些方面,该剂型被配制成给药后24小时其平均每日血浆浓度的至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、或至少90%。
[0141]
在一些方面,maoi被配制成控释剂型并且nri被配制成控释剂型,并且其中maoi和nri在不同时间段内被释放。
[0142]
在一些方面,nri选自地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀和尼索西汀,以及它的组合。在一些方面,nri是托莫西汀或地昔帕明。在一些方面,nri并非三环类抗抑郁药。在一些方面,nri并非阿米替林。
[0143]
在一些方面,该组合物不含三环类抗抑郁药。在一些方面,该组合物不含阿米替林。
[0144]
在一些方面,该组合物不含已知用于治疗低血压的药剂。已知治疗低血压的药剂的实例包括但不限于屈昔多巴、氟氢可的松和米多君。在一些方面,该组合物不含屈昔多巴。
[0145]
在一些方面,maoi是tcp并且nri是托莫西汀或地昔帕明。
[0146]
在一些方面,maoi是苯乙肼并且nri是托莫西汀或地昔帕明。
[0147]
在一些方面,控释制剂进一步包括生物相容性聚合物。在一些方面,延释制剂或缓慢释放制剂包括生物相容性聚合物。在一些方面,生物相容性聚合物是可生物降解的。在一些方面,生物相容性聚合物是天然生物相容性聚合物。在一些方面,生物相容性聚合物是合成的生物相容性聚合物。
[0148]
在一些方面,组合物、控释制剂和/或延释制剂或缓慢释放制剂中的maoi包括在以下范围内的负荷剂量:约10mg
‑
120mg之间,例如,约10mg
‑
100mg之间、约10mg
‑
80mg之间、约10mg
‑
60mg之间、约10mg
‑
40mg之间、约10mg
‑
20mg之间、约20mg
‑
120mg之间、约40mg
‑
120mg之间、约60mg
‑
120mg之间、约80mg
‑
120mg之间、或约100mg
‑
120mg之间。在一些方面,maoi包括在约40mg
‑
75mg范围内的负荷剂量。在一些方面,maoi在向患者给药后约16小时内从控释制剂或者延释制剂或缓慢释放制剂中基本释放或完全释放。
[0149]
在一些方面,组合物、控释制剂和/或延释制剂或缓慢释放制剂中的tcp包括在以下范围内的负荷剂量:约10mg
‑
60mg之间,例如,约10mg
‑
50mg之间、约10mg
‑
40mg之间、约10mg
‑
30mg之间、约10mg
‑
20mg之间、约20mg
‑
60mg之间、约20mg
‑
50mg之间、约20mg
‑
40mg之间、约20mg
‑
30mg之间、约30mg
‑
60mg之间、约30mg
‑
50mg之间、约30mg
‑
40mg之间、约40mg
‑
60mg之间、约40mg
‑
50mg之间、或约50mg
‑
60mg之间。在一些方面,tcp包括约40mg
‑
60mg范围内的负荷剂量。在一些方面,tcp在向患者给药后约16小时内从组合物、控释制剂和/或延释制剂或缓慢释放制剂中基本释放或完全释放。
[0150]
在一些方面,组合物、控释制剂和/或延释制剂或缓慢释放制剂中的苯乙肼包括在以下范围内的负荷剂量:约15mg
‑
85mg之间,例如,约15mg
‑
75mg之间、约15mg
‑
65mg之间、约15mg
‑
55mg之间、约15mg
‑
45mg之间、约15mg
‑
35mg之间、约15mg
‑
25mg之间、约25mg
‑
85mg之间、约35mg
‑
85mg之间、约45mg
‑
85mg之间、约55mg
‑
85mg之间、约65mg
‑
85mg之间、或约75mg
‑
85mg之间。在一些方面,苯乙肼包括约45mg
‑
75mg范围内的负荷剂量。在一些方面,苯乙肼在向患者给药后约16小时内从控释制剂或者延释制剂或缓慢释放制剂中基本释放或完全释放。
[0151]
在一些方面,药物包括maoi的控释制剂,其中maoi在向患者给药后的延释制剂时间段内从控释制剂中释放。在一些方面,maoi在向患者给药后约16小时内,从控释制剂中基本释放或完全释放。
[0152]
在一些方面,药物包括tcp的控释制剂,其中tcp在向患者给药后的延释制剂时间段内从控释制剂中释放。在一些方面,tcp在向患者给药后约16小时内,从控释制剂中基本释放或完全释放。
[0153]
在一些方面,药物包括苯乙肼的控释制剂,其中苯乙肼在向患者给药后的延释制剂时间段内从控释制剂中释放。在一些方面,苯乙肼在向患者给药后约16小时内,从控释制剂中基本释放或完全释放。
[0154]
在一些方面,药物包括maoi的延释制剂或缓慢释放制剂,其中maoi在向患者给药后的延释制剂时间段内从延释制剂或缓慢释放制剂中释放。在一些方面,maoi在向患者给药后约16小时内从延释制剂或缓慢释放制剂中基本释放或完全释放。
[0155]
在一些方面,药物包括tcp的延释制剂或缓慢释放制剂,其中tcp在向患者给药后的延释制剂时间段内从延释制剂或缓慢释放制剂中释放。在一些方面,tcp在向患者给药后约16小时内从延释制剂或缓慢释放制剂中基本释放或完全释放。
[0156]
在一些方面,药物包括苯乙肼的延释制剂或缓慢释放制剂,其中苯乙肼在向患者给药后的延释制剂时间段内从延释制剂或缓慢释放制剂中释放。在一些方面,苯乙肼在向患者给药后约16小时内从延释制剂或缓慢释放制剂中基本释放或完全释放。
[0157]
在一些方面,maoi在向患者给药后的以下时间段释放:约4
‑
16小时、约6
‑
16小时、约8
‑
16小时、约10
‑
16小时、约12
‑
16小时、约14
‑
16小时、约4
‑
14小时、约4
‑
12小时、约4
‑
10小时、约4
‑
10小时、约4
‑
8小时、或约4
‑
6小时。
[0158]
在一些方面,tcp在向患者给药后的以下时间段释放:约4
‑
16小时、约6
‑
16小时、约8
‑
16小时、约10
‑
16小时、约12
‑
16小时、约14
‑
16小时、约4
‑
14小时、约4
‑
12小时、约4
‑
10小时、约4
‑
10小时、约4
‑
8小时、或约4
‑
6小时。
[0159]
在一些方面,苯乙肼在向患者给药后的以下时间段释放:约4
‑
16小时、约6
‑
16小时、约8
‑
16小时、约10
‑
16小时、约12
‑
16小时、约14
‑
16小时、约4
‑
14小时、约4
‑
12小时、约4
‑
10小时、约4
‑
10小时、约4
‑
8小时、或约4
‑
6小时。
[0160]
在一些方面,基本上所有的maoi在向患者给药后的以下时间段后释放:约8
‑
16小时、约10
‑
16小时、约12
‑
16小时、约14
‑
16小时、约8
‑
14小时、约8
‑
12小时、约8
‑
10小时、约10
‑
16小时、或约12
‑
16小时。
[0161]
在一些方面,基本上所有的tcp在向患者给药后的以下时间段后释放:约8
‑
16小时、约10
‑
16小时、约12
‑
16小时、约14
‑
16小时、约8
‑
14小时、约8
‑
12小时、约8
‑
10小时、约10
‑
16小时、或约12
‑
16小时。
[0162]
在一些方面,基本上所有的苯乙肼在向患者给药后的以下时间段后释放:约8
‑
16小时、约10
‑
16小时、约12
‑
16小时、约14
‑
16小时、约8
‑
14小时、约8
‑
12小时、约8
‑
10小时、约10
‑
16小时、或约12
‑
16小时。
[0163]
在一些方面,该组合物被配制成口服剂型。
[0164]
药物组合物包括在药学上可接受的载体中的化合物。药学上可接受的载体是指无菌水溶液或非水溶液、分散液、混悬液或乳液,以及用于在使用前复溶为无菌可注射溶液或分散液的无菌粉末。合适的水性和非水性载体、稀释剂、溶剂或溶媒的实例包括水、乙醇、多元醇(例如,甘油、丙二醇、聚乙二醇等)、羧甲基纤维素及其合适的混合物、植物油(例如,橄榄油)和注射用有机酯例如,油酸乙酯。化合物可与药学上可接受的载体或稀释剂以及任何其它已知的佐剂和辅料一起按照常规技术(例如,remington:药学科学与实践,第19版,gennaro,编辑,mack出版社,easton,pa.,1995公开)进行配制。
[0165]
在各个方面,本文公开的药物组合物包括公开的化合物(包括其药学上可接受的盐)作为活性成分、药学上可接受的载体、和任选的其它治疗成分或佐剂。本组合物包括适合于口服、直肠、局部和肠胃外(包括皮下、肌内和静脉内)给药的组合物,尽管在任何给定情况下最合适的途径将取决于具体宿主,以及待给药活性成分条件的性质和严重程度。药物组合物可方便地以单位剂型方式提供并通过药学领域熟知的任何方法制备。
[0166]
适用于肠胃外给药的本发明药物组合物可制备为活性化合物在水中的溶液或混悬液。可包括合适的表面活性剂,例如羟丙基纤维素。还可在甘油、液体聚乙二醇及其在油中的混合物中制备分散体。此外,可包括防腐剂,以防止微生物的有害生长。
[0167]
适用于注射用途的本发明药物组合物包括无菌水溶液或分散体。此外,组合物可是用于即时制备这种无菌可注射溶液或分散体的无菌粉末形式。在所有情况下,最终的可注射形式应该是无菌的并且应该是有效的流体,以便于注射。药物组合物在生产和储存条件下应该是稳定的;因此,优选应保存以防止细菌和真菌等微生物的污染作用。载体可是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇)、植物油及其合适混合物的溶剂或分散介质。
[0168]
本发明的药物组合物可是适合局部采用的形式例如气雾剂、乳膏、软膏、洗剂、粉剂、漱口水(mouth washes)、漱口剂(gargle)等。此外,组合物可是适用于经皮装置的形式。这些制剂可利用本发明的化合物或其药学上可接受的盐通过常规加工方法制备。例如,乳膏或软膏通过将亲水性材料和水,以及约5wt%
‑
10wt%的化合物混合进行制备,以产生具有期望稠度的乳膏或软膏。
[0169]
本发明的药物组合物可是适合直肠给药的形式,其中载体是固体。优选混合物以形成单位剂量栓剂。合适的载体包括可可脂和本领域常用的其它材料。通过首先将组合物与软化或熔化的载体混合,然后在模具中冷却和成型,可方便地形成栓剂。
[0170]
在各个方面,本发明的药物组合物可包括药学上可接受的载体和本发明的化合物或其药学上可接受的盐。本发明的化合物或其药学上可接受的盐还可与一种或多种其它治
疗活性化合物组合包括在药物组合物中。
[0171]
采用的药物载体可是,例如,固体、液体或气体。固体载体的实例包括乳糖、白土(terra alba)、蔗糖、滑石、明胶、琼脂、果胶、阿拉伯胶、硬脂酸镁和硬脂酸。液体载体的实例是糖浆、花生油、橄榄油和水。气态载体的实例包括二氧化碳和氮气。
[0172]
要制备用于口服剂型的组合物,可采用任何方便获取的药物介质。例如,水、二醇、油、醇、调味剂、防腐剂、着色剂等可用于制备口服液体制剂,例如,混悬剂、酏剂和溶液;而载体例如,淀粉、糖、微晶纤维素、稀释剂、造粒剂、润滑剂、粘合剂、崩解剂等可用于制备口服固体制剂例如,粉剂、胶囊剂和片剂。由于其易于给药,片剂和胶囊是优选的口服剂量单位,借由采用固体药物载体。任选地,片剂可通过标准的水性或非水性技术进行包衣
[0173]
含有本发明组合物的片剂可通过压制或模压进行制备,任选地与一种或多种辅助成分或佐剂一起。压制片剂可通过在合适的机器中压制自由流动形式例如,粉末或颗粒的活性成分进行制备,任选地与粘合剂、润滑剂、惰性稀释剂、表面活性剂或分散剂混合。模压片可通过在合适的机器中模压粉末状化合物与惰性液体稀释剂润湿的混合物进行制备。
[0174]
除前述载体成分外,上述药物制剂可包括(如适用)一种或多种另外载体成分,例如,稀释剂、缓冲剂、调味剂、粘合剂、表面活性剂、增稠剂、润滑剂、防腐剂(包括抗氧化剂)等。此外,可包括其它佐剂,以使制剂与预期接受者的血液等渗。含有本发明化合物和/或其药学上可接受的盐的组合物还可以粉末或液体浓缩物的形式制备。
[0175]
d.治疗精神障碍的方法
[0176]
本发明还提出了通过给药包括至少一种maoi、其化学类似物、或其药学上可接受的盐的控释制剂来治疗患者的抑郁症的方法,其中maoi在向患者给药后从控释制剂中释放超过约6小时,但小于约16小时。在一些方面,maoi在向患者给药后从控释制剂释放超过约6小时,但小于约16小时。在一些方面,控释制剂是延释制剂或缓慢释放制剂。
[0177]
因此,一方面,本文公开了用于治疗受试者精神障碍精神障碍的方法,该方法包括向受试者给药有效量的公开的组合物。
[0178]
在一些方面,本文公开了用于治疗受试者精神障碍精神障碍的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括治疗有效量的tcp和药学上可接受的载体,其中药物组合物被配制成控释剂型,其在向患者给药后约6
‑
16小时内释放tcp。
[0179]
在一些方面,本文公开了治疗受试者精神障碍精神障碍的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括治疗有效量的苯乙肼和药学上可接受的载体,其中药物组合物被配制成控释剂型,其在向患者给药后约6
‑
16小时内释放苯乙肼。
[0180]
在一些方面,本文公开了用于治疗受试者精神障碍精神障碍的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括maoi、nri和药学上可接受的载体,其中maoi和nri中的至少一种以治疗有效量存在,或其中maoi和nri一起以治疗有效量存在。
[0181]
在一些方面,本文公开了治疗受试者精神障碍精神障碍的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括tcp、托莫西汀和药学上可接受的载体,其中托莫西汀被配制成控释剂型,其中tcp被配制成控释剂型,并且其中tcp和托莫西汀在不同时间段内被释放,并且其中tcp和托莫西汀中的至少一种以治疗有效量存在,或其中tcp和托莫西汀一起以治疗有效量存在。
[0182]
在一些方面,本文公开了用于治疗受试者精神障碍精神障碍的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括苯乙肼、托莫西汀和药学上可接受的载体,其中托莫西汀被配制成控释剂型,其中苯乙肼被配制成控释剂型,并且其中苯乙肼和托莫西汀在不同时间段内被释放,并且其中苯乙肼和托莫西汀中的至少一种以治疗有效量存在,或其中苯乙肼和托莫西汀一起以治疗有效量存在。
[0183]
在一些方面,本文公开了治疗受试者精神障碍精神障碍的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括苯乙肼、地昔帕明和药学上可接受的载体,其中地昔帕明被配制成控释剂型,其中苯乙肼被配制成控释剂型,并且其中苯乙肼和地昔帕明在不同时间段内被释放,并且其中苯乙肼和地昔帕明中的至少一种以治疗有效量存在,或其中苯乙肼和地昔帕明一起以治疗有效量存在。
[0184]
在一些方面,本文公开了用于治疗受试者精神障碍精神障碍的方法,该方法包括向受试者同时给药maoi和nri,其中maoi和nri中的至少一种以治疗有效量给药,或其中maoi和nri一起以治疗有效量给药,从而治疗精神障碍。
[0185]
在一些方面,本文公开了用于治疗受试者精神障碍精神障碍的方法,该方法包括向受试者同时给药maoi和nri,其中nri以在延释制剂时间段内对食用富含酪胺的膳食的反应中足以导致血压升高小于约20mm hg的量给药,并且其中maoi和nri中的至少一种以治疗有效量给药,或其中maoi和nri一起以治疗有效量给药,从而治疗精神障碍。
[0186]
在一些方面,maoi和nri同时给药。在一些方面,maoi和nri序贯给药。
[0187]
在一些方面,maoi和药剂同时给药。在一些方面,maoi和药剂序贯给药。
[0188]
在一些方面,maoi和nri以单一剂型给药。在一些方面,maoi和nri以单一口服剂型给药。
[0189]
在一些方面,maoi和药剂以单一剂型给药。在一些方面,maoi和药剂以单一口服剂型给药。
[0190]
在一些方面,该方法包括给药包括tcp、其化学类似物、或其药学上可接受的盐的控释制剂,其中tcp在向患者给药后的延释制剂时间段内从控释制剂中释放。在一些方面,tcp以外消旋混合物存在于控释制剂中。在一些方面,tcp以单一异构体存在于控释制剂中。在一些方面,控释制剂是延释制剂或缓慢释放制剂。
[0191]
在一些方面,该方法包括给药包括苯乙肼、其化学类似物、或其药学上可接受的盐的控释制剂,其中苯乙肼在向患者给药后的延释制剂时间段内从控释制剂中释放。在一些方面,控释制剂是延释制剂或缓慢释放制剂。
[0192]
在一些方面,精神障碍是抑郁症。在一些方面,抑郁症是难治性抑郁症(trd)。在一些方面,trd是电惊厥治疗抵抗的重度抑郁症(ect
‑
r mdd)。在一些方面,trd是双相抑郁症。
[0193]
在一些方面,maoi以治疗有效量存在。在一些方面,nri以非治疗有效量存在。在一些方面,maoi和nri一起以治疗有效量存在。
[0194]
在一些方面,maoi被配制成控释剂型。在一些方面,控释剂型在向患者给药后的以下时间段内释放maoi:约4
‑
16小时、约6
‑
16小时、约8
‑
16小时、约10
‑
16小时、约12
‑
16小时、约14
‑
16小时、约4
‑
14小时、约4
‑
12小时、约4
‑
10小时、约4
‑
10小时、约4
‑
8小时、或约4
‑
6小时。在一些方面,基本上所有的maoi在向患者给药后的以下时间段后释放:约8
‑
16小时、约10
‑
16小时、约12
‑
16小时、约14
‑
16小时、约8
‑
14小时、约8
‑
12小时、约8
‑
10小时、约10
‑
16小
时、或约12
‑
16小时。
[0195]
在一些方面,maoi以约20mg
‑
1000mg、约50mg
‑
1000mg、约100mg
‑
1000mg、约250mg
‑
1000mg、约500mg
‑
1000mg、约750mg
‑
1000mg、约20mg
‑
750mg、约20mg
‑
500mg、约20mg
‑
250mg、约20mg
‑
100mg、约20mg
‑
50mg、约30mg
‑
90mg、或约40mg
‑
60mg的量存在。本领域技术人员将理解,存在的maoi的量取决于采用的maoi。例如,当maoi是tcp时,maoi可以约10mg
‑
120mg的量存在。可选地,当maoi是苯乙肼时,maoi可以约15mg
‑
120mg的量存在。
[0196]
在一些方面,maoi选自吗氯贝胺、雷沙吉兰、司来吉兰、异卡波肼、苯乙肼和tcp。在一些方面,maoi是tcp。在一些方面,maoi是苯乙肼。
[0197]
在一些方面,nri被配制成控释剂型。在一些方面,剂型被配制成给药后24小时平均每日血浆浓度的至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、或至少90%。在一些方面,控释剂型在向患者给药后的以下时间段内释放nri:约14
‑
26小时、约14
‑
24小时、约14
‑
22小时、约14
‑
20小时、约14
‑
18小时、约14
‑
16小时、约16
‑
26小时、约16
‑
26小时、约18
‑
26小时、约18
‑
26小时、约20
‑
26小时、约22
‑
26小时、或约16
‑
24小时。在一些方面,基本上所有的nri在向患者给药后的以下时间段后释放:约16
‑
24小时、约18
‑
24小时、约20
‑
24小时、约22
‑
24小时、约16
‑
22小时、约16
‑
20小时、或约16
‑
18小时。
[0198]
在一些方面,maoi被配制成控释剂型,并且nri被配制成控释剂型,并且其中maoi和nri在不同时间段内被释放。
[0199]
在一些方面,maoi被配制成控释剂型,并且药剂被配制成控释剂型,并且其中maoi和药剂在不同时间段内被释放。因此,在一些方面,maoi在约6
‑
16小时内释放,并且nri在约16
‑
24小时内释放。
[0200]
在一些方面,nri选自地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀和尼索西汀及其组合。在一些方面,nri是托莫西汀或地昔帕明。在一些方面,nri并非三环类抗抑郁药。在一些方面,nri并非阿米替林。
[0201]
在一些方面,该组合物不含a1激动剂。a1激动剂的实例包括但不限于甲氧胺、米多君、间羟胺、去氧肾上腺素和阿米福林。
[0202]
在一些方面,该组合物不含三环类抗抑郁药。在一些方面,该组合物不含阿米替林。
[0203]
在一些方面,该组合物不含已知用于治疗低血压的药剂。已知治疗低血压的药剂的实例包括但不限于屈昔多巴、氟氢可的松和米多君。在一些方面,该组合物不含屈昔多巴。
[0204]
在一些方面,maoi是tcp,并且nri是托莫西汀。
[0205]
在一些方面,maoi是苯乙肼,并且nri是托莫西汀或地昔帕明。
[0206]
在一些方面,受试者是人。在一些方面,受试者既往服用过除tcp之外的抗抑郁药,或既往接受过电休克疗法(ect)或其组合。在一些方面,受试者在给药步骤之前已被诊断需要治疗精神障碍。在一些方面,该方法进一步包括识别需要治疗精神障碍的受试者的步骤。
[0207]
在一些方面,患者既往未接受过抑郁症治疗。在一些方面,患者既往未接受过精神障碍治疗。在一些方面,患者既往接受过抑郁症治疗。在一些方面,患者既往接受过精神障碍治疗。在一些方面,患者既往服用过除tcp之外的抗抑郁药、既往接受过电休克疗法(ect)
或其组合。
[0208]
在一些方面,控释制剂进一步包括生物相容性聚合物。在一些方面,延释制剂或缓慢释放制剂包括生物相容性聚合物。在一些方面,生物相容性聚合物是可生物降解的。在一些方面,生物相容性聚合物是天然生物相容性聚合物。在一些方面,生物相容性聚合物是合成的生物相容性聚合物。
[0209]
在一些方面,控释制剂中的maoi包括在以下范围内的负荷剂量:约10mg
‑
120mg之间,例如,约10mg
‑
100mg之间、约10mg
‑
80mg之间、约10mg
‑
60mg之间、约10mg
‑
40mg之间、约10mg
‑
20mg之间、约20mg
‑
120mg之间、约40mg
‑
120mg之间、约60mg
‑
120mg之间、约80mg
‑
120mg之间、或约100mg
‑
120mg之间。在一些方面,maoi包括在约40mg
‑
75mg范围内的负荷剂量。在一些方面,maoi在向患者给药后约16小时内,从控释制剂中基本释放或完全释放。
[0210]
在一些方面,控释制剂中的tcp包括在以下范围内的负荷剂量:约10mg
‑
60mg之间,例如,约10mg
‑
50mg之间、约10mg
‑
40mg之间、约10mg
‑
30mg之间、约10mg
‑
20mg之间、约20mg
‑
60mg之间、约20mg
‑
50mg之间、约20mg
‑
40mg之间、约20mg
‑
30mg之间、约30mg
‑
60mg之间、约30mg
‑
50mg之间、约30mg
‑
40mg之间、约40mg
‑
60mg之间、约40mg
‑
50mg之间、或约50mg
‑
60mg之间。在一些方面,tcp包括在约40mg
‑
60mg范围内的负荷剂量。在一些方面,tcp在向患者给药后约12小时内,从控释制剂中基本释放或完全释放。
[0211]
在一些方面,控释制剂中的苯乙肼包括在以下范围内的负荷剂量:约15mg
‑
85mg之间,例如,约15mg
‑
75mg之间、约15mg
‑
65mg之间、约15mg
‑
55mg之间、约15mg
‑
45mg之间、约15mg
‑
35mg之间、约15mg
‑
25mg之间、约25mg
‑
85mg之间、约35mg
‑
85mg之间、约45mg
‑
85mg之间、约55mg
‑
85mg之间、约65mg
‑
85mg之间、或约75mg
‑
85mg之间。在一些方面,苯乙肼包括在约45mg
‑
75mg范围内的负荷剂量。在一些方面,苯乙肼在向患者给药后约16小时内,从控释制剂中基本释放或完全释放。
[0212]
在一些方面,maoi在向患者给药后从控释制剂释放超过约6小时,但小于约16小时。在一些方面,maoi在向患者给药后从控释制剂释放超过约4小时,但小于约12小时。在一些方面,maoi在向患者给药后约16小时内,从控释制剂中基本释放或完全释放。
[0213]
在一些方面,tcp在向患者给药后从控释制剂释放超过约6小时,但小于约16小时。在一些方面,tcp在向患者给药后从控释制剂释放超过约4小时,但小于约12小时。在一些方面,tcp在向患者给药后约16小时内,从控释制剂中基本释放或完全释放。
[0214]
在一些方面,苯乙肼在向患者给药后从控释制剂中释放超过约6小时,但小于约16小时。在一些方面,苯乙肼在向患者给药后从控释制剂中释放超过约4小时,但小于约12小时。在一些方面,苯乙肼在向患者给药后约16小时内,从控释制剂中基本释放或完全释放。
[0215]
在一些方面,延释制剂或缓慢释放制剂中的maoi包括在以下范围内的负荷剂量:约10mg
‑
120mg之间,例如,约10mg
‑
100mg之间、约10mg
‑
80mg之间、约10mg
‑
60mg之间、约10mg
‑
40mg之间、约10mg
‑
20mg之间、约20mg
‑
120mg之间、约40mg
‑
120mg之间、约60mg
‑
120mg之间、约80mg
‑
120mg之间、或约100mg
‑
120mg之间。在一些方面,maoi包括约40mg
‑
75mg范围内的负荷剂量。在一些方面,maoi在向患者给药后约16小时内从延释制剂或缓慢释放制剂中基本释放或完全释放。
[0216]
在一些方面,延释制剂或缓慢释放制剂中的tcp包括在以下范围内的负荷剂量:约10mg
‑
60mg之间,例如,约10mg
‑
50mg之间、约10mg
‑
40mg之间、约10mg
‑
30mg之间、约10mg
‑
20mg之间、约20mg
‑
60mg之间、约20mg
‑
50mg之间、约20mg
‑
40mg之间、约20mg
‑
30mg之间、约30mg
‑
60mg之间、约30mg
‑
50mg之间、约30mg
‑
40mg之间、约40mg
‑
60mg之间、约40mg
‑
50mg之间、或约50mg
‑
60mg之间。在一些方面,tcp包括约40mg
‑‑
60mg范围内的负荷剂量。在一些方面,tcp在向患者给药后约12小时内从延释制剂或缓慢释放制剂中基本释放或完全释放。
[0217]
在一些方面,延释制剂或缓慢释放制剂中的苯乙肼包括在以下范围内的负荷剂量:约15mg
‑
85mg之间,例如,约15mg
‑
75mg之间、约15mg
‑
65mg之间、约15mg
‑
55mg之间、约15mg
‑
45mg之间、约15mg
‑
35mg之间、约15mg
‑
25mg之间、约25mg
‑
85mg之间、约35mg
‑
85mg之间、约45mg
‑
85mg之间、约55mg
‑
85mg之间、约65mg
‑
85mg之间、或约75mg
‑
85mg之间。在一些方面,苯乙肼包括约45mg
‑
75mg范围内的负荷剂量。在一些方面,苯乙肼在向患者给药后约16小时内从延释制剂或缓慢释放制剂中基本释放或完全释放。
[0218]
在一些方面,maoi在向患者给药后从延释制剂或缓慢释放制剂中释放超过约6小时,但小于约16小时。在一些方面,maoi在向患者给药后从延释制剂或缓慢释放制剂释放超过约4小时,但小于约12小时。在一些方面,maoi在向患者给药后约16小时内从延释制剂或缓慢释放制剂中基本释放或完全释放。
[0219]
在一些方面,tcp在向患者给药后从延释制剂或缓慢释放制剂释放超过约6小时,但小于约16小时。在一些方面,tcp在向患者给药后从延释制剂或缓慢释放制剂释放超过约4小时,但小于约12小时。在一些方面,tcp在向患者给药后约16小时内从延释制剂或缓慢释放制剂中基本释放或完全释放。
[0220]
在一些方面,苯乙肼在向患者给药后从延释制剂或缓慢释放制剂中释放超过约6小时,但小于约16小时。在一些方面,苯乙肼在向患者给药后从延释制剂或缓慢释放制剂中释放超过约4小时,但小于约12小时。在一些方面,苯乙肼在向患者给药后约16小时内从延释制剂或缓慢释放制剂中基本释放或完全释放。
[0221]
在一些方面,nri按照在延释制剂时间段内在食用富含酪胺的膳食(例如,约40mg的酪胺)后足以导致血压升高小于约20mm hg的量给药。实现该结果所需的nri浓度根据所选的maoi和nri而变化。例如,在一些方面,当与tcp联合用药时,实现该结果所需的nri(例如地昔帕明,75mg口服剂量)的量为约15ng/ml
‑
30ng/ml或约17ng/ml
‑
28ng/ml。在一些方面,实现该结果所需的nri(例如,托莫西汀,80mg口服剂量)的量为约120ng/ml
‑
170ng/ml或约132ng/ml
‑
201ng/ml。不希望受理论束缚,基于标准化nri剂量后的一次性血液检测,个体达到最小目标nri血浆浓度所需的nri剂量可通过如本文进一步描述的预测算法来确定。如果所需剂量低于与副作用耐受性相关的某些nri特定最大值,则根据开处方者设定的目标maoi剂量和以上确定的nri剂量确定定制处方剂量。
[0222]
为了治疗或控制病症,向有需要的受试者给药化合物和包括这些化合物的药物组合物。该术语不指示具体年龄或性别。因此,成人和新生儿受试者,以及胎儿,无论是男性还是女性,均将被涵盖在内。受试者优选人等哺乳动物。在给药化合物或组合物之前,可诊断受试者是否需要治疗精神障碍,例如,抑郁症。
[0223]
化合物或组合物可根据任何方法给药至受试者。此类方法是本领域技术人员熟知的,并且包括但不限于口服给药、透皮给药、吸入给药、鼻给药、局部给药、阴道内给药、眼部给药、耳内给药、脑内给药、直肠给药、舌下给药、含服给药和肠胃外给药,包括注射给药,例如,静脉内给药、动脉内给药、肌内给药和皮下给药。给药可是连续的或间歇的。制剂可以治
疗性给药;即,给药用于治疗现有疾病或病状。制剂还可预防性给药;即,给药用于预防感染或病状,例如,精神障碍。
[0224]
化合物的治疗有效量或剂量可在宽范围内变化。这种剂量根据每种具体情况下的个体需要进行调整,包括待给药的特定化合物、给药途径、待治疗的病状、以及待治疗的患者。通常,在对体重约70kg或更高的成年人口服或肠胃外给药的情况下,约10mg
‑
1000mg,优选约20mg
‑
800mg的每日剂量应该是合适的,尽管可能超出上限。每日剂量可单次给药或分开给药,或者对于肠胃外给药,进行连续输注。单次给药组合物可含有构成每日剂量的化合物或组合物的此类量或其近似量。在任何禁忌症的情况下,个体医生可调整剂量。剂量可变化,并且可每天一次或多次给药,持续一天或几天。
[0225]
e.治疗抑郁症的方法
[0226]
本发明还提出了通过给药包括至少一种maoi、其化学类似物、或其药学上可接受的盐,以及至少一种nri的控释制剂来治疗患者的抑郁症的方法,其中maoi和nri各自给药,采用在向患者给药maoi和nri后足以抑制酪胺摄取的nri剂量。在一些方面,控释制剂是延释制剂或缓慢释放制剂。
[0227]
因此,一方面,本文公开了治疗受试者的抑郁症的方法,该方法包括向受试者给药有效量的公开组合物。
[0228]
在一些方面,本文公开了用于治疗受试者的抑郁症的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括治疗有效量的tcp和药学上可接受的载体,其中该药物组合物被配制成控释剂型,其在向患者给药后约6
‑
16小时内释放tcp。
[0229]
在一些方面,本文公开了治疗受试者的抑郁症的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括治疗有效量的苯乙肼和药学上可接受的载体,其中该药物组合物被配制成控释剂型,其在向患者给药后约6
‑
16小时内释放苯乙肼。
[0230]
在一些方面,本文公开了用于治疗受试者的抑郁症的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括maoi、nri和药学上可接受的载体,其中maoi和nri中的至少一种以治疗有效量存在,或其中maoi和nri一起以治疗有效量存在。
[0231]
在一些方面,本文公开了用于治疗受试者的抑郁症的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括tcp、托莫西汀和药学上可接受的载体,其中托莫西汀被配制成控释剂型,其中tcp被配制成控释剂型,并且其中tcp和托莫西汀在不同时间段内释放,并且其中tcp和托莫西汀中的至少一种以治疗有效量存在,或其中tcp和托莫西汀一起以治疗有效量存在。
[0232]
在一些方面,本文公开了治疗受试者的抑郁症的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括苯乙肼、托莫西汀和药学上可接受的载体,其中托莫西汀被配制成控释剂型,其中苯乙肼被配制成控释剂型,并且其中苯乙肼和托莫西汀在不同时间段内被释放,并且其中苯乙肼和托莫西汀中的至少一种以治疗有效量存在,或其中苯乙肼和托莫西汀一起以治疗有效量存在。
[0233]
在一些方面,本文公开了治疗受试者的抑郁症的方法,该方法包括向受试者给药有效量的药物组合物,该药物组合物包括苯乙肼、地昔帕明和药学上可接受的载体,其中地昔帕明被配制成控释剂型,其中苯乙肼被配制成控释剂型,并且其中苯乙肼和地昔帕明在不同时间段内被释放,并且其中苯乙肼和地昔帕明中的至少一种以治疗有效量存在,或其
中苯乙肼和地昔帕明一起以治疗有效量存在。
[0234]
在一些方面,本文公开了用于治疗受试者的抑郁症的方法,该方法包括向受试者同时给药maoi和nri,其中maoi和nri中的至少一种以治疗有效量给药,或其中maoi和nri一起以治疗有效量给药,从而治疗精神障碍。
[0235]
在一些方面,本文公开了用于治疗受试者的抑郁症的方法,该方法包括向受试者同时给药maoi和nri,其中maoi和nri各自给药,使用在延释制剂时间段内对食用富含酪胺的膳食的反应中,足以导致血压升高小于约20mm hg的nri剂量,并且其中maoi和nri中的至少一种以治疗有效量给药,或其中maoi和nri一起以治疗有效量给药,从而治疗精神障碍。
[0236]
在一些方面,本文公开了用于治疗患者的抑郁症的方法,该方法包括给药包括tcp、其化学类似物、或其药学上可接受的盐的控释制剂,其中tcp在向患者给药后从控释制剂释放超过约6小时,但小于约16小时。
[0237]
在一些方面,本文公开了用于治疗患者的抑郁症的方法,该方法包括给药包括苯乙肼、其化学类似物、或其药学上可接受的盐的控释制剂,其中苯乙肼在向患者给药后从控释制剂中释放超过约6小时,但小于约16小时。
[0238]
在一些方面,本文公开了治疗患者的抑郁症的方法,该方法包括给药tcp和nri,其中tcp和nri各自给药,采用在向患者给药tcp和nri后足以抑制酪胺摄取的nri剂量。
[0239]
在一些方面,本文公开了治疗患者的抑郁症的方法,该方法包括给药苯乙肼和nri,其中苯乙肼和nri各自给药,采用向患者给药苯乙肼和nri后足以抑制酪胺摄取的nri剂量。
[0240]
在一些方面,maoi和nri同时给药。在一些方面,maoi和nri序贯给药。
[0241]
在一些方面,maoi和nri以单一剂型给药。在一些方面,maoi和nri以单一口服剂型给药。
[0242]
在一些方面,该方法包括给药tcp和至少一种nri,其中tcp和nri各自给药,采用在向患者给药tcp和nri后足以抑制酪胺摄取的nri剂量。在一些方面,tcp以外消旋混合物存在。在一些方面,tcp以单一异构体存在。
[0243]
在一些方面,该方法包括给药苯乙肼和至少一种nri,其中苯乙肼和nri各自给药,采用在向患者给药苯乙肼和nri后足以抑制酪胺摄取的nri剂量。
[0244]
在一些方面,患者先前未接受过抑郁症治疗。在一些方面,患者先前未接受过精神障碍治疗。在一些方面,患者先前接受过抑郁症治疗。在一些方面,患者先前接受过精神障碍治疗。在一些方面,患者先前服用过除tcp之外的抗抑郁药、先前接受过电休克疗法(ect)或其组合。
[0245]
在一些方面,maoi和nri联合疗法与抑郁症或其它精神障碍的任何建议的护理标准或其它治疗方案结合使用。在一些方面,maoi和nri联合疗法与抑郁症或其它精神障碍的任何建议的护理标准或其它治疗方案同时使用。在一些方面,maoi和nri联合疗法在抑郁症或其它精神障碍的任何建议的护理标准或其它治疗方案之后给药。在一些方面,maoi和nri联合疗法在抑郁症或其它精神障碍的任何建议的护理标准或其它治疗方案之前给药。
[0246]
在一些方面,maoi和nri以单一组合物给药。在一些方面,maoi和nri以单独的组合物给药。在一些方面,maoi和nri序贯给药。在一些方面,maoi和nri以交替方式给药。在一些方面,maoi和nri单次给药。在一些方面,maoi和nri多次给药。在一些方面,maoi和nri同时
给药。在一些方面,maoi和nri在治疗方案中的不同时间给药。
[0247]
在一些方面,maoi和nri各自被配制用于口服给药。在一些方面,maoi和nri被配制成用于口服给药的单一片剂。在一些方面,maoi和nri各自被配制成用于口服给药的单独片剂。在一些方面,maoi和nri各自被配制成用于口服给药的单独片剂,并且每种片剂在进行相同的包装后(例如,采用相同的泡罩包装)提供给患者。
[0248]
在一些方面,tcp和nri以单一组合物给药。在一些方面,tcp和nri以单独的组合物给药。在一些方面,tcp和nri序贯给药。在一些方面,tcp和nri以交替方式给药。在一些方面,tcp和nri单次给药。在一些方面,tcp和nri多次给药。在一些方面,tcp和nri同时给药。在一些方面,tcp和nri在治疗方案中的不同时间给药。
[0249]
在一些方面,tcp和nri各自被配制用于口服给药。在一些方面,tcp和nri被配制成用于口服给药的单一片剂。在一些方面,tcp和nri各自被配制成用于口服给药的单独片剂。在一些方面,tcp和nri各自被配制成用于口服给药的单独片剂,并且每种片剂在进行相同的包装后(例如,采用相同的泡罩包装)提供给患者。
[0250]
在一些方面,苯乙肼和nri以单一组合物给药。在一些方面,苯乙肼和nri以单独的组合物给药。在一些方面,苯乙肼和nri序贯给药。在一些方面,苯乙肼和nri以交替方式给药。在一些方面,苯乙肼和nri单次给药。在一些方面,苯乙肼和nri多次给药。在一些方面,苯乙肼和nri同时给药。在一些方面,苯乙肼和nri在治疗方案中的不同时间给药。
[0251]
在一些方面,苯乙肼和nri各自被配制用于口服给药。在一些方面,苯乙肼和nri被配制成用于口服给药的单一片剂。在一些方面,苯乙肼和nri各自被配制成用于口服给药的单独片剂。在一些方面,苯乙肼和nri各自被配制成用于口服给药的单独片剂,并且每种片剂在进行相同的包装后(例如,采用相同的泡罩包装)提供给患者。
[0252]
在一些方面,nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其任何组合。
[0253]
在一些方面,maoi包括在以下范围内的负荷剂量:约10mg
‑
120mg之间,例如,约10mg
‑
100mg之间、约10mg
‑
80mg之间、约10mg
‑
60mg之间、约10mg
‑
40mg之间、约10mg
‑
20mg之间、约20mg
‑
120mg之间、约40mg
‑
120mg之间、约60mg
‑
120mg之间、约80mg
‑
120mg之间、或约100mg
‑
120mg之间。在一些方面,maoi包括约40mg
‑
75mg范围内的负荷剂量。
[0254]
在一些方面,tcp包括在以下范围内的负荷剂量:约10mg
‑
120mg之间,例如,约10mg
‑
50mg之间、约10mg
‑
40mg之间、约10mg
‑
30mg之间、约10mg
‑
20mg之间、约20mg
‑
60mg之间、约20mg
‑
50mg之间、约20mg
‑
40mg之间、约20mg
‑
30mg之间、约30mg
‑
60mg之间、约30mg
‑
50mg之间、约30mg
‑
40mg之间、约40mg
‑
60mg之间、约40mg
‑
50mg之间、或约50mg
‑
60mg之间、或60
‑
80mg之间、或80
‑
100mg之间或100
‑
120mg之间。在一些方面,tcp包括约40mg
‑
60mg范围内的负荷剂量。
[0255]
在一些方面,苯乙肼包括在以下范围内的负荷剂量:约15mg
‑
120mg之间,例如,约15mg
‑
120mg之间、约15mg
‑
65mg之间、约15mg
‑
55mg之间、约15mg
‑
45mg之间、约15mg
‑
35mg之间、约15mg
‑
25mg之间、约25mg
‑
85mg之间、约35mg
‑
85mg之间、约45mg
‑
85mg之间、约55mg
‑
85mg之间、约65mg
‑
85mg之间、或约75mg
‑
85mg之间、或85
‑
100mg之间、或100mg
‑
120mg之间。在一些方面,苯乙肼包括在约45mg
‑
75mg范围内的负荷剂量。
[0256]
在一些方面,药物包括maoi的控释制剂,其中maoi在向患者给药后从控释制剂中
释放超过约6小时,但小于约16小时。在一些方面,maoi在向患者给药后约16小时内,从控释制剂中基本释放或完全释放。
[0257]
在一些方面,药物包括tcp的控释制剂,其中tcp在向患者给药后,从控释制剂中释放超过约6小时,但小于约16小时。在一些方面,tcp在向患者给药后约16小时内,从控释制剂中基本释放或完全释放。
[0258]
在一些方面,药物包括苯乙肼的控释制剂,其中苯乙肼在向患者给药后从控释制剂中释放超过约6小时,但小于约16小时。在一些方面,苯乙肼在向患者给药后约16小时内,从控释制剂中基本释放或完全释放。
[0259]
f.试剂盒
[0260]
一方面,本文公开了试剂盒,其包括公开的药物组合物,和以下项中的一种或多种:(a)至少一种与治疗精神障碍有关的药剂;(b)与治疗精神障碍有关的组合物的给药说明;(c)治疗精神障碍的说明。
[0261]
在一些方面,药剂选自情绪稳定剂和抗精神病药。
[0262]
在一些方面,药剂是情绪稳定剂。情绪稳定剂的实例包括但不限于锂、丙戊酸、双丙戊酸钠、卡马西平和拉莫三嗪。
[0263]
在一些方面,药剂是抗精神病药或第二代抗精神病药(sga)。抗精神病药的实例包括但不限于阿立哌唑、阿塞那平、卡利拉嗪、氯氮平、鲁拉西酮、奥氮平、喹硫平、利培酮和齐拉西酮。
[0264]
在一些方面,组合物和药剂是共同包装的。
[0265]
在一些方面,组合物和药剂序贯给药。在一些方面,组合物和药剂同时给药。
[0266]
在一些方面,精神障碍是抑郁症。
[0267]
在一些方面,该试剂盒进一步包括多个剂型,该多个剂型包括一个或多个剂量;其中每个剂量包括有效量的至少一种化合物和至少一种药剂。在另一方面,有效量是治疗有效量。在另一方面,有效量是预防有效量。
[0268]
在一些方面,每个剂量的至少一种化合物和至少一种药剂是共同配制的。在另一方面,每个剂量的至少一种化合物和至少一种药剂是共同包装的。
[0269]
在一些方面,每个剂量的至少一种化合物和至少一种药剂序贯给药。在另一方面,每个剂量的至少一种化合物和至少一种药剂同时给药。
[0270]
在一些方面,剂型被配制用于口服给药、吸入、局部给药和/或肠胃外给药。在另一方面,至少一种化合物的剂型被配制用于口服给药,并且至少一种药剂的剂型被配制用于肠胃外给药。在另一方面,至少一种化合物的剂型被配制用于肠胃外给药,并且至少一种药剂的剂型被配制用于口服给药。更进一步而言,至少一种化合物的剂型被配制用于局部给药,并且至少一种药剂的剂型被配制用于肠胃外给药。在另一方面,至少一种化合物的剂型被配制用于肠胃外给药,并且至少一种药剂的剂型被配制用于局部给药。在另一方面,至少一种化合物的剂型被配制用于口服给药,并且至少一种药剂的剂型被配制用于吸入。在更进一步的方面,至少一种化合物的剂型被配制用于吸入,并且至少一种药剂的剂型被配制用于口服给药。在另一方面,至少一种化合物的剂型被配制用于局部给药,并且至少一种药剂的剂型被配制用于吸入。在另一方面,至少一种化合物的剂型被配制用于吸入,并且至少一种药剂的剂型被配制用于局部给药。
[0271]
应当理解,本文公开的试剂盒可由公开的化合物、产品和药物组合物制备。还应理解,本文公开的试剂盒可与公开的使用方法结合使用。
[0272]
g.实施例
[0273]
本文公开了基于maoi的组合物,该组合物旨在更安全地治疗患有激发mdd综合征(例如,双相抑郁症和内源性单相抑郁症)的患者。不希望受理论束缚,本文详述的方法利用基于机制的策略来减少酪胺升压剂的影响。具体地,该方法通过maoi与nri联合用药,直接阻断酪胺在神经末梢的间接拟交感神经作用。
[0274]
酪胺通过去甲肾上腺素转运(net)受体摄取进入外周交感神经末梢,以产生心血管作用(finberg等人,2011),从而在突触前储存囊泡中释放的大量去甲肾上腺素,并通过血管收缩和心脏刺激升高血压。nri阻断net,从而显著降低酪胺对周围神经系统的作用(gillman,2011)。众所周知,nri可显著降低酪胺对血压的作用。例如,100mg剂量的地昔帕明可将受试者对tyr的敏感性平均降低5倍(即,增加tyr的剂量使收缩压增加30mm hg 5倍;chalon,等人,2003)。其它研究表明,nri瑞波西汀在tcp前给药时,可阻断标记的酪胺水平升高,这些标记的酪胺在大鼠心脏中蓄积(dostert,等人,1994)。针对接受阿米替林治疗的抑郁症患者的研究表明,酪胺敏感性降低与去甲替林(阿米替林的主要代谢物,可选择性地阻断net)的血浆浓度相关(ghose和coppen,1977)。pare等人,(1982)表明阿米替林给药逆转与tcp给药相关的对静脉内酪胺敏感性的增加。因此,有充分证据表明maoi与nri联合用药将减轻与maoi给药相关的“奶酪效应(cheese effect)”(gillman,2011)。
[0275]
本发明在以下实施例中进一步定义。应当理解,这些实施例虽然指出了本发明的优选方面,但仅作为说明给出。根据上述讨论和这些实施例,本领域技术人员可确定本发明的基本特征,并在不背离本发明的精神和范围的情况下,可对本发明进行各种更改和修改,以适应各种用途和条件。
[0276]
1.接受maoi和nri联合治疗的患者的酪胺升压反应评价
[0277]
本文提供的研究使用正常的志愿者受试者开展。在这些研究中,试验受试者被给予基于maoi的抗抑郁药,例如,tcp与nri联合用药,该nri选自去甲替林、地昔帕明、普罗替林、洛非帕明、瑞波西汀、托莫西汀、尼索西汀及其组合组成的组,以评价在nri条件下观察到的酪胺升压反应的精确衰减程度。
[0278]
一小组未患抑郁症或任何其它重大疾病的正常志愿者被口服给予小剂量酪胺,他们先前已给予治疗剂量的maoi和足够剂量的所选nri,并评估他们在这些条件下对酪胺的敏感性。这将可估计由于注射酪胺引起的血压升高量。重要的是,群体受试者的平均血压升高和最大血压升高均足够适中(例如,小于20mm hg),以在极少或没有酪胺饮食限制条件下安全地服用maoi组合。
[0279]
2.评价接受maoi控释制剂的患者的短暂阵发性高血压
[0280]
本文所述的研究针对正常的志愿者受试者开展。在这些研究中,试验受试者被给予控释制剂,其包括至少一种基于maoi的抗抑郁药,例如,苯乙肼(phz)或tcp,以评价maoi控释制剂给药后观察到的短暂阵发性高血压反应的精确衰减程度。
[0281]
3.maoi酪胺作用比较
[0282]
平均收缩压(sbp)随着随餐服用40mg酪胺而上升,如图3和下表1所示。
[0283]
表1.
[0284][0285]
4.nri
‑
phz联合用药
[0286]
如图5和下表2所示,向苯乙肼(phz)添加nri可显著降低随餐服用40mg酪胺的sbp升高幅度。fda先前已阐明40mg是富含酪胺的膳食的最大含量。
[0287]
表2.
[0288][0289]
5.nri
‑
tcp联合用药
[0290]
如图6和下表3所示,向tcp添加nri可显著降低随餐服用40mg酪胺的sbp升高幅度。fda先前已阐明40mg是富含酪胺的膳食的最大含量。
[0291]
表3.
[0292][0293]
6.反苯环丙胺体位性低血压
[0294]
如图4和下表4所示,sbp的体位下降与tcp血浆浓度高度相关。
[0295]
表4.
[0296][0297]
7.个性化nri剂量以实现足够酪胺升压缓解的算法
[0298]
不希望受理论束缚,个体患者可有与群体平均值非常不同的生物计量结局。例如,如果给定的药物剂量达到100ng/ml的平均浓度,对于一些个体,在相同剂量下有30%的该浓度并不罕见。类似地,如果sbp作为对酪胺的反应而增加的群体平均值为15mm hg,则个体之间的最大sbp可能升高为50mm hg或更多,这与群体平均值不同,可能导致临床危害。
[0299]
鉴于nri阻断酪胺用于升高sbp的途径,维持血压升高上限的关键是确保最低nri浓度。这种最低限度可能需要比标准剂量更高的剂量,以补偿较低个体nri血浆可用性。
[0300]
最小nri浓度可按如下方式计算:(1)计算a=导致至少99%net受体阻断的最小nri浓度。这可使用下式计算:阻断百分比=c/(c ki)=.99,其中c是最小nri浓度,ki是nri的net抑制常数。(2)对足够的个体群体(30
‑
100例受试者)进行酪胺激发的经验检测,并计算b作为最小nri浓度,其中sbp升高幅度低于目标sbp升高阈值,例如,20mm hg。(3)将最小nri浓度m设置为a或b中的较大者。
[0301]
个体化的nri剂量可按如下方式计算:(1)估计将平均nri稳态浓度与nri单次给药6小时后达到的浓度联系起来的模型。该模型提供函数形式f使得:预测稳态浓度=f(6小时单次给药浓度)。此类模型的实例由hrdina pd、bakish d、swenson s、lapierre yd提供。根据抑郁门诊患者的单次给药水平预测多塞平和丙米嗪的稳态血浆水平。《精神病学和神经科学杂志》,1991;16(1):25
–
29。这种模型的数据可从30
‑
100例受试者中根据经验收集,其中测量单次给药和稳态浓度。(2)对于给定的患者,测量给药后6小时nri的标准化剂量s达到的血浆浓度c6,并根据以上步骤(1)中建立的模型估计患者的预测稳态浓度ssc=f(c6)。(3)计算目标nri剂量td=s*m/ssc。如果td低于nri建议的最大值,则个性化剂量设置为td,四舍五入到最接近的可用剂量。如果td大于nri的最大允许剂量,则由于缺乏足够的酪胺缓解的确定性,患者被判定为不符合处方。
[0302]
8.通过与去甲肾上腺素再摄取抑制剂联合用药,以降低单胺氧化酶抑制剂对酪胺作用的增强作用
[0303]
对健康受试者进行了一项开放标签、随机、平行酪胺激发研究,以研究苯乙肼单独给药对血压和酪胺升压反应的影响,和潜在的三种去甲肾上腺素再摄取抑制剂(托莫西汀、地昔帕明和潜在的普罗替林)对苯乙肼给药期间酪胺升压作用的减轻作用,详细情况如下所述。
[0304]
a.研究设计
[0305]
在atx(bid,65mg/天)或dmi(bid,75mg/天)与phz(bid,60mg/天)联合用药,或prt(bid,15mg/天)与phz(bid,60mg/天)联合用药,以及phz单药治疗(bid,60mg/天)期间,tyr
序贯口服给药。对于phz单药治疗,1%牛奶给药的酪胺剂量为5mg、10mg和20mg,并进行安全性调节,以确保收缩压升高幅度不超过30mm hg。对于nri与phz联合用药,5mg、20mg和40mg的酪胺增量剂量与1%牛奶一起给药,并进行安全性调节以确保收缩压升高幅度不超过30mm hg。此外,对于每个nri方案,随标准膳食分开40mg酪胺剂量,对于接受phz单药的受试者,随标准膳食分开20mg酪胺剂量。
[0306]
该研究分两部分,旨在:(1)检查phz的固有特性,单药给药;(2)比较两种较短半衰期的nri(atx或dmi)对phz治疗期间酪胺反应的作用,如果合适,选择“更好”的nri进行验证性研究。将选择“更好的nri”应该在末次phz给药后24小时提供足够的酪胺升压缓解,并且在与phz联合用药时应该具有可接受的耐受性和副作用;(3)如果在末次联合phz给药后24小时,atx和dmi均未提供足够的酪胺升压缓解,则有可能检测更长半衰期nri、普罗替林与phz联合用药。
[0307]
第1部分入组30例健康受试者,其随机接受phz单药,或phz与dmi或atx联合用药,以10(phz单药):10(phz atx):10(phz dmi)的方式。第2部分入组高达30例受试者,以深入研究phz nri联合用药,第1部分选择nri(atx或dmi)或第2部分选择prt(一种更长半衰期nri)。
[0308]
研究的每个部分分为4个阶段:筛选和资格(阶段1/访视1);剂量推进(dose advancement)(阶段2/访视2);血压
‑
心率评估,酪胺检测(阶段3/访视3);和研究药物洗脱(阶段4/访视4,电话关闭)。
[0309]
b.研究受试者
[0310]
入选标准包括:健康的男性或女性受试者;18
‑
55岁,含;提供参与研究的书面知情同意书,了解程序和研究要求,同意遵守研究限制条件,并按计划返回研究访视;基于病史的一般健康检查,体格检查,并且筛选实验室评估中无不明原因的临床显著异常;bmi小于31kg/m2;乙型和丙型肝炎以及hiv感染的筛查试验呈阴性;机器读数和研究者读数心电图数据在正常限度内;在phz/tyr/nri给药之前,过去30天内无用药,但基于常用剂量对乙酰氨基酚、布洛芬、口服抗组胺药(不含减充血剂)除外。经申办方审查后,被认为不干扰研究干扰的草药和慢性病药物(例如,它汀类药物、抗分泌剂)可能被允许使用;愿意并能够在研究和随访期间远离受限的处方药/非处方药;愿意遵循phz包装说明书中规定的tyr饮食限制条件;愿意遵循maoi/nri、药物禁忌症条件,但与研究相关的除外;筛选时,静息/坐位收缩压不高于130mm hg并且舒张压不高于90mm hg;静息心率在65至85bpm之间;育龄女性正在使用以下可接受的避孕方法之一:在首次给药前至少3个月和整个研究期间使用非激素释放宫内节育器,或在首次给药前至少3个月和整个研究期间使用长效/可植入激素(例如,implanon)。
[0311]
排除标准包括:无法提供知情同意书;根据研究者的判断,研究不符合受试者的最佳获益;根据研究者的判断,受试者无法遵循研究程序;目前患有医学或精神病状,根据研究者的判断,这将使研究不安全,和/或混淆研究结果的解读。这些可能包括高血压;或接受治疗的高血压病史、慢性抑郁症(即在过去一年中未接受过抗抑郁药治疗)、目前患有严重心血管疾病(例如冠状动脉疾病、静脉血栓形成、血栓性静脉炎、血栓栓塞等)或有其病史、肺病史(例如哮喘、copd)需要使用β受体激动剂或吸入类固醇进行治疗、目前患有adhd、慢性病毒病(例如,hiv和丙型肝炎)病史,或研究者认为可能干扰研究评估的任何其它病状;
受试者目前正在接受或在过去6周内接受过任何抑郁症治疗—包括ssri或tca,其可提高中枢神经系统中的血清素水平;受试者目前正在接受任何其它抑郁症治疗—包括maoi和其它抗抑郁药;受试者目前正在接受抗高血压药、口服或吸入减充血剂、吸入或口服β激动剂治疗哮喘,噻吗洛尔滴眼液,口服避孕药,质子泵抑制剂和/或adhd治疗;在任何情况下,如果对任何药物有任何疑问,研究者将与申办方一起审查该药物;受试者正在利用圣约翰草(st.john
‘
s wort)、色氨酸或麻黄碱补充剂进行自我治疗。在研究过程中不允许使用任何形式的尼古丁(电子烟、吸烟、贴片等);受试者在过去2年内符合目前dsm
‑
v药物滥用障碍的诊断标准,包括大麻和cbd;过去3年内有任何自杀史;符合以下任一条件的女性受试者:在研究期间妊娠、哺乳、或计划妊娠或哺乳;对感冒药或其它药物有过敏或超敏病史;在前一个月或至少5个半衰期内使用任何研究药物进行治疗,以较长者为准;血液或尿液筛选评价中任何具有医学意义的异常,特别包括alt和/或ast>参考实验室正常上限的1.25倍;苯丙胺、苯二氮卓类、可卡因、阿片类药物、pcp、三环类抗抑郁药的尿液药物筛查呈阳性。大麻素筛查呈阳性的受试者将被询问最近的使用情况,并建议他们在研究期间为了自身安全切勿使用大麻素。受试者被警告可进行额外的尿检,如果结果仍呈阳性,受试者可能将停止研究;已知不能耐受phz(60mg/天或更高)、dmi(75mg/天)、prt、15mg/天或atx(65mg/天)。
[0312]
c.tyr反应性评估
[0313]
本研究旨在表征phz在整个给药间隔内单独给药时对酪胺反应的作用,并将与net抑制剂联合用药,以降低phz对酪胺升压的增强作用。作为背景,phz在多项研究中显示出抗抑郁活性(rabkin等人,1985;thase,等人,1995;birkenhager等人,2004)。phz的治疗剂量60mg可降低空腹酪胺剂量,从437mg降低至33mg,降低13倍,从而导致收缩压升高30mm hg,与其它maoi相比作用降低(bieck和antonin,1989)。不希望受理论束缚,预期在接受60mg/天phz治疗期间随餐给药fda定义的40mg剂量的酪胺将使sbp升高12mm hg,这是临床可接受的升高幅度。预期接受nri将减弱该作用,导致仅升高3mm hg。
[0314]
本研究中评估tyr反应性的方法是确定在预先指定的固定口服tyr剂量下收缩压(升压反应或pr)的升高幅度。预期nri将减弱酪胺升压作用的增强作用,将在phz与nri联合治疗期间检测5mg(pr5)、20(pr20)和40mg(pr40)的酪胺剂量。对于推进剂量,应确保由此引起的血压升高幅度不超过40mm hg。如果空腹条件下口服tyr的pr达到被认为是高血压紧急持续水平,或任何具有显著症状的水平,静脉注射酚妥拉明可用于快速逆转pr。本研究将确定随1%牛奶的6盎司口服酪胺胶囊(包括限制胃肠道刺激,若有)的受试者的pr,被认为相当于空腹剂量。
[0315]
在空腹条件下测定tyr pr是一项研究评估。当在进餐期间摄入tyr时,此类测量结果未直接用于评估与maoi对tyr pr的影响相关的“奶酪效应”(bieck等人,1988;gillman,2011)。因此,食物已被证明可降低酪胺的口服生物利用度(vandenberg等人,2003)。c
max
平均降低72%,auc
∞
平均降低53%。因此,向服用nri phz的受试者给药40mg的tyr剂量,或向服用phz单药受试者给药20mg的tyr剂量,在随餐服用时检测pr作用。fda在先前的产品审查中强调了maoi临床研究中测量血压随含有高达40mg酪胺的膳食(其的特点是富含酪胺最大含量的膳食)升高的重要性(us fda,2006)。如果pr20表明40mg剂量的餐中酪胺可能导致安全且适度的血压升高,则针对此类受试者进行该检测。
[0316]
对于空腹条件下对酪胺的反应的所有评估,在给予胺时监测观察到的每例受试者
对每剂酪胺的实际反应。根据对每个剂量的反应,调整空腹或随餐服用的后续剂量,以尽可能确保不超过30mm hg的反应达到有意义的程度。
[0317]
本研究的另外重点是进一步表征phz的内在药理学。这包括birkenharger,等(2004)在其对照研究中描述的不良反应,如上文所述,以及rabkin,等人(1985)总结的相对较大的临床群体事件。此外,几项研究描述了体位性低血压可能与仰卧血压降低有关,如采用与本研究中剂量相当剂量的情况下,向抑郁症患者给药phz所观察到的(kronig等人,1983,rabkin等人,1985,和georgotas等人,1987(ulrich等人,2017))。虽然有与剂量相关的趋势,但尚不清楚这些和其它不良反应是否与mao抑制或phz的其它作用有关(baker等人,1992)。
[0318]
d.安全性策略
[0319]
先验地,本研究旨在强化受试者的安全性、侧重于临床监测以及研究药物和酪胺的给药。此前基于人体和实验模型的研究表明,nri例如,地昔帕明(dmi)、托莫西汀(atx)和普罗替林(prt)可抑制间接作用于胺,如tyr的行为(chalon,2003;zerbe,1985;gillman,2011)。
[0320]
简而言之,目标是给药phz联合nri(托莫西汀、地昔帕明或潜在的普罗替林(prt)),然后进行精心设计的空腹(随6oz 1%牛奶给药)固定剂量酪胺激发,以测量联合用药的tyr升压作用。在phz/phz nri联合用药后2、3、4和6小时达到峰值时,在给药后约18、19和24小时,在谷值时,对tyr反应进行评估。
[0321]
文献表明,餐中摄入的酪胺剂量可造成30mm sbp的升高,比空腹口服剂量大2至4倍,后者导致收缩压升高30mm hg(gillman,2011)。因此,如果空腹口服pd30为33mg tyr,则餐中剂量可能为约100mg。在本研究中,作为安全预防措施,评估接受phz nri治疗的受试者对tyr的反应,空腹最多40mg,以确定与食物一起服用40mg剂量的tyr是否将使得sbp升高30mm hg多。作为保守的安全措施,如果受试者的空腹酪胺剂量导致作用过大,则随餐服用的剂量将向下调整。
[0322]
经验表明,可安全地单独口服和静脉注射tyr,或与nri或maoi或两者一起分级给药,其对收缩压的靶向作用为30mm hg(参见(例如)pare等人,1982;bieck和antonin,1988;1989;blier等人,2007)。在本研究中待评价的固定tyr剂量下,单独使用phz和nri时酪胺的sbp作用预期接近30mm hg或更低(参见(例如)bieck和antonin,1989;bieck等人,1988)。此外,给予受试者餐中剂量的tyr(目标为40mg用于评价具有phz联合nri,和20mg用于phz,单独给药)也适合收缩压的预期增加,不超过30
‑
40mm hg,基于先前空腹口服酪胺激发期间测量的特定受试者pr20值。
[0323]
dmi,待研究的一种nri,是一种三环类抗抑郁药(tca);第二种atx,并非三环类抗抑郁药。基于maoi(例如,phz)的选择性nri给药必须小心进行,并给出与这些药物一起采用的标记警告(pfizer,2009)。此类警告主要基于这些联合用药诱导血清素毒性的假定潜力。然而,本研究中采用的nri在去甲肾上腺素方面比血清素转运体更有效,尤其是与选择性血清素再摄取抑制剂(ssri),如氟西汀和帕罗西汀相比(pfizer,2009)。此外,有大量经验数据表明,选择性nri可与maoi安全联合给药,剂量明显高于本研究中提出的剂量(ulrich等人,2017;gillman,2006)。例如,本研究中用于地昔帕明的建议剂量为75mg/天,而用于抑郁症的地昔帕明治疗剂量范围为100mg
‑
300mg。与net相比,选择性nri对血清素转运体(sert)
的作用很小,并且已与maoi联合给药。相比之下,当与maoi联合给药时,通过选择性5
‑
羟色胺再摄取抑制剂(ssri)和tca抑制sert,已知具有明显的5
‑
羟色胺毒性风险(gillman,2006;2011)。为了进一步控制这些研究治疗方案的安全性,phz、atx和dmi的给药逐步推进至最终剂量,并且研究者指示对联合用药耐受性差的任何受试者停用。是否需要停止研究治疗是另一个关键的研究主题。
[0324]
普罗替林是可研究的潜在第三种nri,具体取决于地昔帕明和托莫西汀的结果。如地昔帕明,普罗替林是一种tca。普罗替林的特性与地昔帕明非常相似,但有两个关键例外:半衰期长(60
‑
90小时)和较低的剂量范围(方案剂量为15mg/天)。普罗替林的抗抑郁“治疗范围”为20
‑
40mg/d(teva,2014)。
[0325]
e.phz给药
[0326]
phz将以单独的片剂给药,每天两次,间隔~12小时,总共60mg/天,除非基于60mg/天的耐受性差,需要将phz滴定至45mg/天。如果不能耐受30mg/天的phz,则受试者将停药。
[0327]
表5.
[0328]
[0329][0330]
phz的剂量将提前(如耐受)升至计划的60mg剂量。给药将以3
‑
4天为间隔,允许在访视3之前采用phz最终剂量进行定义的治疗间隔。另见下表6。
[0331]
表6.
[0332]
[0333][0334]
phz剂量推进:达到最终剂量水平所需的多个步骤从访视2开始,如果不能耐受60mg/天,则根据需要逆向滴定一步至45mg/天。如果出现向下滴定情况,受试者可能需要3
‑
4天才能耐受45mg phz剂量,然后进行v3检查。
[0335]
由于体位性低血压,可能无法耐受一定剂量的phz;然而,这种作用可能是暂时的和/或无症状的。如果出现直立性低血压,受试者要小心缓慢地站起来,并向研究者报告任何导致跌倒的过度头晕。如果报告过度头晕或其它体位性低血压症状,则在cru评价受试者,并相应调整phz剂量推进。研究者将逐步减少phz剂量,直到直立性低血压现象基本消失,在这种情况下,受试者可重新采用下一个phz剂量。如果phz的剂量最终不能推进至60mg/天,则受试者停药。
[0336]
剂量推进调整可能导致访视3的延迟,以允许受试者在phz的最终剂量时稳定。
[0337]
针对所有治疗的研究逐渐减量期结束:从访视3结束时开始,根据上表3和表4逐步减少phz的剂量。对于发生与停药相关的不良事件的受试者,研究者可自行决定采用较慢的逐渐减量方案。
[0338]
f.atx、dmi或prt给药
[0339]
托莫西汀(atx)、地昔帕明(dmi)或普罗替林(prt)以单独的片剂给药,每天两次,与phz给药同时间隔约6小时。参见上表3和表4。
[0340]
atx队列目标:phz(每天两次)与atx(每天两次)联合用药。
[0341]
dmi队列目标:phz(每天两次)与dmi(每天两次)联合用药。
[0342]
prt队列目标(如果在第2部分中研究):phz(每天两次)与prt(每天两次)联合用药。
[0343]
nri剂量推进:根据上表3和4,nri的剂量推进(如耐受)至计划剂量。
[0344]
dmi推进:在访视2时开始时有多个剂量水平,如果不能耐受剂量,则根据需要进行一步反滴定。dmi的目标剂量是在am为50mg/天,在pm为25mg/天(50/25mg)。反滴定将导致am
和pm的剂量为25mg和25mg(25/25mg)。如果不能耐受dmi的25/25mg方案,则受试者停药。
[0345]
atx剂量推进:在访视2时开始时有多个剂量水平,如果不能耐受剂量,则根据需要进行一步反向滴定。atx的目标剂量是在am为40mg/天,在pm为25mg/天(40/25mg)。反滴定将导致在am为20mg和在pm为25mg的剂量(20/25mg)。如果不能耐受atx的20/25mg方案,则受试者停药。
[0346]
prt剂量推进:在访视2开始时有多个剂量水平,如果不能耐受剂量,则根据需要进行一步反向滴定。prt的目标剂量对于am为10mg/天,对于pm为5mg/天(10/5mg)。反滴定将导致am和pm下剂量为10mg和0mg(10/0mg)。如果不能耐受prt的10/0mg方案,则受试者停药。
[0347]
针对所有治疗的研究逐渐减量期结束:从访视3结束时开始,每种药物的剂量逐渐减量。有关atx、dmi或prt的逐渐减量计划,参见表3和表4。对于每种药物,研究者可自行决定为与停药相关的不良事件的受试者出具较慢的逐渐减量方案。
[0348]
g.酪胺给药
[0349]
酪胺以5、10和20mg胶囊形式提供,以达到高达40mg的剂量。如下表7a和表7b所示,在每次酪胺给药后(不依赖于是否存在升压反应),观察期为90分钟,假设sbp恢复至基线至少10分钟。
[0350]
空腹时给予,tyr应与6oz 1%牛奶(或等同物)一起服用。
[0351]
根据研究治疗方案,tyr随餐给药两个胶囊,在开始和进餐后5分钟给药。表7a和表7b中描述了餐中酪胺剂量的调整。
[0352]
对于phz,酪胺的剂量为5、10和20mg,空腹服用(与6oz 1%牛奶(或等同物)),和20mg分次随餐服用。
[0353]
对于phz nri,酪胺的剂量为5、20和40mg,空腹服用(与6oz 1%牛奶(或等同物)),和40mg分次随餐服用。
[0354]
根据第一次空腹酪胺检测期间对5、10和20mg酪胺的升压反应,每个剂量将依次检测,20mg是膳食检测的目标剂量。对于单独接受phz并获得高于或低于预期的反应的个体受试者,请注意以下事项:如果对5mg酪胺的升压反应低于5mm hg,则此剂量将不再使用。如果对5mg酪胺的升压反应≥20mm hg,则5mg将是随后空腹检测的剂量,并且将是随餐服用的单次剂量。如果对5mg酪胺的升压反应≥30mm hg,受试者将因“对最低剂量酪胺反应过度”而停止研究。如果对10mg的sbp升压反应>20mm hg且<30mm hg,则5mg将是后续空腹检测的剂量;10mg将是膳食检测的剂量。如果对10mg酪胺的升压反应≥30mm hg,则5mg将作为随后空腹检测和随餐服用的单次剂量。如果对20mg酪胺的升压反应<30mm hg,则20mg将为随后空腹和随餐服用的剂量。如果对20mg的sbp升压反应>30mm hg,10mg将是随后空腹检测的剂量;20mg将是膳食检测的剂量(因为对10mg的反应将低于20mm hg)。
[0355]
可选地,对于每例个体受试者,可按如下方式调整tyr剂量:如果对最低(和中间)空腹剂量的反应小于5mm hg,下次开始使用更高剂量。如果对特定空腹剂量的反应≥30mm hg,下次空腹给予下一个较低剂量,除非剂量为5mg,然后停止。如果对特定空腹剂量的反应≥30mm hg且<40mm hg,则使用该剂量进行餐中检测。如果对特定空腹剂量的反应≥40mm hg,则利用下一个较低的剂量进行餐中检测。
[0356]
根据第一次空腹酪胺检测期间对5、20和40mg酪胺的升压反应,将针对每个剂量依次进行检测,40mg是膳食检测的目标剂量。对于接受phz nri并获得高于或低于预期反应的
个体受试者,请注意以下事项:如果对5mg酪胺的升压反应低于5mm hg,则此剂量将不再使用。如果对5mg酪胺的升压反应≥20mm hg,则5mg将是随后空腹和餐中检测的剂量。如果对5mg酪胺的升压反应≥30mm hg,受试者将因“对最低剂量酪胺反应过度”而停止研究。如果对20mg的sbp升压反应>20mm hg,且≤30mm hg,则20mg将是随后空腹和餐中检测的剂量。如果对20mg的sbp升压反应>30mm hg且<40mm hg,10mg将是随后的空腹检测的剂量,20mg将是餐中检测的剂量。如果对20mg的sbp升压反应≥40mm hg,则5mg将是随后空腹和餐中检测的剂量。如果对40mg酪胺的sbp升压反应<40mm hg,该剂量将随后用于空腹和餐中检测。如果对40mg的sbp升压反应>40mm hg,则20mg将是随后空腹和餐中检测的剂量。
[0357]
表7a.
[0358]
[0359][0360]
如表7a所示,给药的时间间隔近似,“0”是第1天和第2天程序的开始时间(通常在每天0700至0800时之间)。为方便起见,显示了近似时钟时间。用于phz单药的酪胺剂量为5、10或20mg,用于phz nri的酪胺剂量为10、20或40mg。重要的是,在tyr检测期间确定(或估计)每个tyr剂量的收缩压峰值升高,特别是对于访视3的初始剂量序列。根据tyr给药顺序中对给定剂量的反应,如果对给定剂量的升压反应大于或小于预期,则可能调整给定系列剂量内待给药的下一剂tyr在随后的空腹剂量系列中给予的剂量和随餐给予的剂量。调整的触发点包括反应是否:小于5mm hg;大于或小于20mm hg;20至30mm hg之间;大于40mm hg。重点应主要放在对序列中2个较低剂量的反应上,以及对最高剂量的反应是否超过40mm hg。
[0361]
nri是dmi、atx或prt(稍后在审查第1部分结果后选择prt)。phz、nri和/或tyr的pk
采样将在每次酪胺空腹服用后约30和39分钟(
±
1分钟)采集。pk采样时记录的血压测量值将记录在数据库中。在第二次给药后~30和42分钟(
±
1分钟)采集phz、nri和/或tyr的pk采样,此时酪胺与膳食分开给药。pk采样时记录的血压测量值将记录在数据库中。plat采样表示通过采集样品来测量血小板mao活性。由研究中心根据以下程序或类似可接受的程序制备血小板膜。对于检测表中建议时间的5分钟内的抽血和给药,将不会产生方案偏离。
[0362]
表7b.
[0363]
[0364]
[0365]
[0366][0367]
如表7b所示,酪胺剂量为5、20和40mg,空腹(含6oz 1%牛奶,或等同物),40mg,随餐服用。
[0368]
苯乙肼 nri治疗
‑
访视3。根据第一次空腹酪胺检测期间对5、20和40mg酪胺的反应,对于个体受试者,请注意以下几点:(1)如果对5mg酪胺的升压反应>20mm hg,则5mg为后续空腹检测的剂量;(2)如果对5mg酪胺的升压反应为40mm hg或更高,则受试者停药;(3)如果对20mg的sbp升压反应>20mm hg,则20mg为后续空腹检测的剂量;(4)如果对20mg的sbp升压反应>40mm hg,则10mg为后续空腹检测的剂量;(5)如果对40mg酪胺的升压反应小于40mm hg,则该剂量将后续用于空腹检测;(6)如果对40mg的sbp升压反应大于40mm hg,则20mg用于后续空腹检测剂量;(7)如果根据对空腹tyr的升压反应确定后续的空腹tyr剂量为2或5mg,则受试者的餐中tyr剂量为20mg;(8)如果根据对空腹tyr的升压反应确定后续的空腹tyr剂量为10、20或40mg,则受试者的餐中tyr剂量为40mg;(9)对于检测表中建议时间的5分钟内的抽血和给药,将不会产生方案偏离。
[0369]
h.研究持续时间
[0370]
在每个研究部分,对于每例受试者,研究持续时间约为6个活跃研究周,包括4次计划访视,然后是2周的研究后观察,然后是最终关闭电话采访。
[0371]
i.与maoi治疗相关的受试者限制
[0372]
以下总结的饮食和药物限制基于phz的批准标签(pfizer,2009)。根据已发表的文献(综述,参见gillman,2006,2011)、与监测酪胺检测相关的研究程序,以及本研究中采用的特定伴随治疗的专属、密切监测的使用,可判断在本方案中受试者可安全地进行研究。停止规则的设计考虑到了这些限制。
[0373]
饮食限制。根据美国包装说明书(pfizer,2009),在受试者在研究期间服用phz的时间段内,以及之后约两周的时间里,受试者必须避免食用已被证明含有高tyr含量的食物,如下所示:肉和鱼(例如腌鲱鱼、肝脏、干香肠,包括热那亚意大利腊肠、硬意大利腊肠、意大利辣香肠和黎巴嫩博洛尼亚大红肠)、蔬菜(例如蚕豆荚或蚕豆荚、酸菜)、乳制品(例如奶酪(允许农家奶酪和奶油奶酪)、酸奶)、饮料(啤酒和葡萄酒、无酒精和低酒精啤酒以及葡萄酒产品)和混杂食品(例如酵母提取物,包括大量啤酒酵母、肉提取物、过量的巧克力和咖啡因)。此外,任何变质或冷藏、处理或储存不当的富含蛋白质的食物,例如,肉类、鱼类和乳
制品,包括可能因老化、腌制、发酵、吸烟或细菌污染而发生蛋白质变化以改善风味的食物,均应避免。
[0374]
药物限制。与phz同时使用限用药物可能会导致严重的、可能危及生命的相互作用(pfizer,2009)。受试者不应服用在研究筛选期间和研究期间以及受试者服用atx//dmi//prt phz末次剂量后的2周洗脱期期间排除的任何药物。此限制也适用于某些非处方药。为避免任何有害或危险的药物相互作用,未经研究者特别许可,受试者在服用atx//dmi phz期间,及其后两周内不应服用以下特定药物:抗抑郁药;拟交感神经药,包括含有苯丙胺的草药和制剂,以及相关化合物,例如,胍乙啶、甲基多巴、利血平、多巴胺、左旋多巴和色氨酸,以及非处方药,例如,含有血管收缩剂的感冒、花粉症或减肥制剂;哌替啶(meperidine,pethidine)和右美沙芬。
[0375]
j.访视研究
[0376]
访视1(第0天,约2小时)。受试者签署知情同意书并进行评价,以确定他们是否符合入选/排除标准。确实符合所有入选标准且不符合排除标准的人可入组。根据要求,一旦确认资格,就可在第1部分将受试者分配到第1部分中的atx或dmi和第2部分中的第1部分中的nri或prt,以允许顺利管理访视2
‑
4的方式。指示受试者在约7天内(即,在确定受试者符合所有入选标准且不符合排除标准之后)返回访视2。受试者自前半夜起空腹后,将在上午08:00至上午09:30之间报告访视2(以及所有后续访视)结果,但预期不干扰研究结果的慢性药物除外。
[0377]
访视2(距访视1约1
‑
7天;时长约6小时)。入组的受试者被分配到接受phz单药治疗(仅第1部分)、第1部分中phz联合dmi或atx,以及第1部分中phz最好联合nri,或第2部分中prt。治疗将按照访视2时的指示开始和进行。phz的初始剂量以临床研究单位(cru)进行给药,并监测受试者4小时(或更长时间)的耐受性。如上所述,指导受试者每次治疗的剂量推进。此外,还抽取plat样品用于mao活性。在提供小餐后给药计划剂量的研究药物(即,phz,单药(仅第1部分);phz联合dmi、atx或prt(第1部分和第2部分))(参见表3和4)。患有轻度、无症状的体位性低血压的受试者可继续进行研究。患有重度头晕或晕厥伴体位性低血压的受试者停止研究。
[0378]
在研究药物给药后4小时(或更长时间),根据受试者对剂量的耐受性,研究者可自行决定受试者出院。如果研究者确定需要对受试者进行额外观察,则受试者必须留在研究单位,直至研究者确定该受试者可出院返回进行下一次访视。如果需要,应规定让受试者过夜以进行观察,每2小时监测一次血压和心率,或更频繁地,如有必要,由研究者决定。
[0379]
如果受试者需要过夜观察,根据研究者的判断,他/她可能退出研究(并替换为替代者)。可选地,可在第二天给药第二剂,并且如先前继续对受试者进行观察。如果第二剂耐受性差,则受试者停止研究。
[0380]
访视3(距访视2间隔:phz单药、phz atx、phz dmi后约14天。为了达到prt的稳定状态,在该组中,访视3将在访视2后21天进行;约48小时)。为期两天的访视由以下研究治疗的给药方案和酪胺检测组成,如表7a和表7b所示。受试者将在访视3的前一天晚上开始进入cru并连续2天进行检测(第1天和第2天)。根据研究者,受试者将在访视3前的晚上向cru报告。根据需要,研究中心可向受试者提供“常规”晚餐和/或晚间小吃,并进行给药前评价,包括以下:使用经过校准的自动血压计进行简短的体格检查,包括血压和心率;审查研究药物
的每日剂量和自上次访视以来的既往合并用药;尿液药物筛查;生命体征—体温;记录自访视2以来的不良事件;审查在访视2时收集的安全性实验室检查;根据访视2时可接受的安全性实验室检查结果、研究治疗的依从性、研究治疗的耐受性、受试者继续研究的意愿等,确认是否适合继续研究;在访视3的前一天晚上采集cyp 2d6基因型的样品(入组的受试者)。
[0381]
访视3时的住院第1天和第2天检测。
[0382]
第1天:受试者自~00:00h开始空腹;在cru服用晨剂量;连续ecg用于tyr检测(例如,心律失常、缺血证据);phz、phz atx、dmi或prt、tyr的pk抽取;制备血小板膜用于mao活性;午餐和晚餐时开展餐中tyr检测。
[0383]
第2天:受试者自~00:00h开始空腹;跳过晨服研究药物,除atx应以15mg给药;空腹口服酪胺检测;连续ecg用于tyr检测(例如,心律失常、缺血证据);phz、phz atx、dmi或prt、tyr的pk抽取;制备血小板膜用于mao活性;午餐时开展餐中tyr检测;在bp恢复至基线后空腹口服酪胺检测时,给予pm剂量的phz、phz atx、dmi或prt;评估在访视3期间一直发生的不良事件;使用经过校准的自动血压监测设备进行血压测量。可通过血压监测器、ecg监测器或径向脉搏进行心率测量。在静立2分钟后(或如果受试者站立后出现症状)测量站立血压。
[0384]
监测血压和心率:(1)从phz、atx/dmi或prt给药前15分钟开始,每15分钟一次,直至服用一剂酪胺,或如果不服用酪胺,则在给药后4小时:坐位和站立测量;(2)服用每剂酪胺后每3分钟一次,持续90分钟:坐位测量;(3)在给予当天最后一剂酪胺后几分钟开始,每3小时一次,直至第2天的研究程序开始:仰卧或坐位测量。
[0385]
在第2天phz、phz nri的pm给药后1小时,确认血压/心率恢复至基线。此时,研究者可自行决定是否让受试者出院。如果研究者确定需要对受试者进行另外观察,则受试者必须留在研究单位,直至研究者确定该受试者可出院并接受下一次访视。
[0386]
访视4(与访视3的间隔:~14天,取决于剂量逐渐减量时间表;时长为约2小时)。确定研究药物已安全逐渐减量至停药。安排研究后的联系事宜。告知受试者他们预期在研究药物末次给药后2周内保持phz饮食限制和处方药限制。以14天后的电话关闭为准。加强对合并用药的限制,尤其是ssri和类似药物
[0387]
访视5(与访视4的间隔:约14天)。在电话谈话期间完成研究后的电话联系和安全确认。如果在随后的一个月中出现任何相关的副作用,告知受试者联系诊所。
[0388]
k.统计学分析
[0389]
phz以及atx
‑
phz或dmi
‑
phz或prt
‑
phz联合用药的总体耐受性通过以下方式测量:因不良事件停药;严重不良事件分析;atx、dmi或prt phz、phz单药期间和/或tyr检测期间的治疗中不良事件(teae)的发生率和性质;不良事件的严重程度和与研究药物的关系,和/或tyr与研究药物的关系;对于每种phz nri,不同剂量水平的ae比较;血压和心率对phz和phz nri的反应;tyr检测期间的血压和心率,包括需要用iv酚妥拉明治疗血压过度升高;tyr检测期间的ecg监测结果(若有);严重不良事件的发生率和性质;以及较基线心电图的变化。
[0390]
药效学结局指标。汇总phz随着时间的心血管作用,包括坐位血压和心率、站立血压和心率,以及从坐位到站立期间的血压和心率变化。
[0391]
在phz单药治疗和联合每种nri治疗期间,在空腹和进食条件下对固定剂量的酪胺
的反应随时间和每个剂量的酪胺在峰值时进行汇总。在访视3期间,相对于phz单药给药和联合每种nri,在“峰值”、给药后18小时和给药后24小时汇总收缩压、舒张压和心率对tyr的反应:
[0392]
用于分析的升压反应指标包括:prf(tyr剂量)=空腹升压反应;prim(tyr剂量)=膳食中升压反应;升压反应(pr)是在测量每个tyr血浆浓度时相对于tyr前基线的坐位收缩压的升高,如根据tyr剂量给药后每3分钟记录的血压测量值所确定。此外,自tyr剂量给药后每3分钟记录的血压测量值中记录的是“最大”pr(pr
max
),即每次tyr给药后观察到的最大坐位收缩压升高。
[0393]
峰值—对于距末次phz给药小于8小时给药的tyr剂量;固定酪胺剂量,空腹(nri/phz治疗期间为5、20、40mg;phz单药期间为5、10、20mg);具体地,prf5、prf20、prf40用于nri/phz;prf5、prf10、prf20用于phz,单药;nri/phz治疗期间40mg随餐服用;phz单药期间随餐服用20mg(膳食中prim40和prim20用于升压反应)。注:在指定prim剂量时,根据第6.3.2节,随餐服用的tyr的实际剂量可能因prf与tyr的剂量而异。
[0394]
给药后~18小时—固定tyr剂量,空腹(prf5、prf10或prf 40用于nri/phz治疗;prf5、prf10或prf20用于phz,单药)。
[0395]
谷值(即24小时)—随餐tyr(nri/phz治疗期间的prim40;phz单药期间的prim10)。
[0396]
对于每个升压反应指标,升压反应测量(prf或prim)按治疗(phz单药、phz atx、phz dmi或,如可用,phz prt)对总试验群体进行汇总,或对于nri浓度在接受该nri治疗的受试者中前70%的受试者,亚群按治疗类型进行汇总。例如,对于atx,找出atx浓度前70%的亚群,并计算汇总统计量例如,平均值和标准偏差。
[0397]
其它探索性分析。tyr反应与血小板mao抑制百分比的关系(对于每例受试者,访视3时的血小板mao活性除以访视2时的血小板mao活性
×
100)。每例受试者在访视3时的血小板mao抑制百分比与phz剂量(以mg/天和mg/kg/天计)的关系。
[0398]
对于每种nri,针对每种治疗(phz单药,phz nri)评估对酪胺(prf和prim)的升压反应低于安全性目标(即<20mm hg)的时间百分比,给药时间为末次phz给药后1
‑
8小时,以及18小时和24小时。这些评估的长期目标是确定是否对于每种nri/phz联合用药,以及剂量方案或最低浓度是否在给药后立即达到安全性目标反应。根据数据可变性和预测建模的把握度,探索和微调这些分析结果。
[0399]
l.酪胺激发
[0400]
检测前。在约~0830h,将导管插入合适的前臂静脉用于tyr激发检测期间的静脉通路。如果对tyr的过度升压反应导致需要静脉注射酚妥拉明治疗高血压急症,为了安全,维持静脉通路。每隔约1小时进行定期生理盐水冲洗,通路端口也将用于血液采样(例如,atx、dmi、prt、phz、tyr浓度)。校准的自动血压测量装置放置在对侧。然后受试者在略暗的房间里安静地休息至少30分钟,以实现血压平衡。tyr给药周期被确定为从口服一剂tyr开始至以3分钟为间隔进行3次血压测量的时间,期间血压应稳定且较基线sbp不超过5mm hg。
[0401]
酪胺给药步骤。对于接受nri(atx、dmi或prt)联合phz的受试者,tyr将以增量激发剂量(即剂量周期)方式使用5、20和40mg的剂量给药。对于接受phz单药的受试者,tyr剂量为5、10和20mg。初始tyr剂量为5.0mg或2mg,保守地偏低,预期在30分钟内显示效果(若有)。对tyr升压反应的评估并非“蓄积的”;在给予下一个剂量之前,允许对每个剂量的反应达到
“
cheese”reaction of monoamine
‑
oxidase inhibitors.lancet 1982,2(8291):183
‑
186.
[0429]
pare,cmb,al mousawi,m,sandler,m,glover,v.:attempts to attenuate the
ꢀ‘
cheese effect.
‘
combined drug therapy in depressive illness journal of affective disorders,1985,9:137
‑
141.
[0430]
teva,protriptyline package insert,us package insert.teva,2014:p.1
‑
4.
[0431]
thase,me,trivedi,mh,rush,aj,maois in the contemporary treatment of depression,neuropsychopharmacology,1995,12:185
‑
219.
[0432]
ulrich,s,ricken,r,adli,m,tranylcypromine in mind(part l):review of pharmacology,eur neuropsychopharmacology 2017 27:697
‑
713.
[0433]
us food and drug administration,selegine transdermal medical review(accessed 29
‑
sept
‑
2019:https://www.accessdata.fda.gov/drugsatfda_docs/nda/2006/021336s000_021708s000_medr_part1.pdf),february 2006.
[0434]
vandenberg,cm,blob,lf,kemper,em,azzaro,aj tyramine pharmacokinetics and reduced bioavailability with food,journal of clinical pharmacology,2003;43:604
‑
609.
[0435]
zerbe,rl,rowe,h,enas,gg,wong,d,farid,n,and lemberger,l,clinical pharmacology of tomoxetine,a potential antidepressant,j pharmacol exp therap.1985,232:139
‑
143.
[0436]
本领域的技术人员应该清楚理解,在不背离本发明的范围或精神的情况下,可对本发明进行各种修改和改进。通过考虑本文公开的本发明的说明书和实践,本发明的其它方面对于本领域技术人员是显而易见的。说明书和实施例仅被视为示例性的,本发明的真正范围和精神由以下权利要求书指出。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。