1.本发明涉及医药领域,特别是涉及一种阿米替林在制备改善内皮细胞功能的药物中的应用。
背景技术:
2.动脉粥样硬化(atherosclerosis,as)是导致心血管疾病(cardiovascular disease,cvd)的主要原因。as是一种动脉内膜的慢性炎症性疾病,其病理变化可分为脂纹形成、纤维斑块和粥样斑块三个阶段。在各个阶段,血液成分,血管壁组成细胞和细胞外基质相互作用,其中包括内皮功能不全、脂蛋白浸入和修饰、白细胞聚集、血管平滑肌细胞增生迁移、泡沫细胞形成和细胞外基质沉积等,引起动脉壁增厚变硬,管腔狭窄或者闭塞,导致动脉供血功能下降,促进了心血管疾病cvd的发生和发展。
3.as的发病机制十分复杂,至今尚未完全阐明,“内皮炎症反应学说”是目前最广泛认可的解释as机理的重要学说。该学说认为as是由血浆脂蛋白、血管内皮细胞及血液成分通过多种细胞因子相互作用,相互影响的慢性炎症反应。当不断受到缺血、缺氧、血流剪切力及自身代谢紊乱等因素刺激而受损时,内皮细胞(endothelial cells,ecs)为适应内外环境变化发生形态学和结构的改变,细胞间的连接发生断裂,导致局部血管内皮结构不完整,通透性增加,ecs分泌大量黏附分子如血管细胞黏附因子
‑
1(vascular cell adhesion molecule
‑
1,vcam
‑
1)、细胞间黏附分子
‑
1(intercellular cell adhesion molecule
‑
1,icam
‑
1)、促进单核细胞和炎症细胞在其表明黏附、聚集,在单核细胞趋化蛋白
‑
1(monocyte chemotactic protein 1,mcp
‑
1)的作用下迁移至ecs下,分化为巨噬细胞,巨噬细胞通过其表明的清道夫受体,大量摄取氧化低密度脂蛋白(oxidized low density lipoprotein,ox
‑
ldl),转化为泡沫细胞;摄取ox
‑
ldl后,巨噬细胞被刺激可表达多种炎性细胞因子增强炎症反应及氧化应激,通过mapk、nf
‑
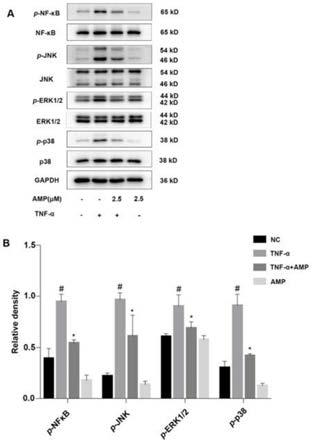
κb、pi3k
‑
akt等通路的变化,促进as斑块形成,加速as的发展。因此,减轻内皮细胞炎症和改善内皮功能紊乱可能成为预防和治疗as的有效方法,这对于降低心血管疾病风险及其重要。
4.盐酸阿米替林,英文名称为amitriptyline hydrochloride。化学式为c
20
h
23
n
·
hcl,是一种临床上常用的三环类抗抑郁药,具有抗炎、抗凋亡的作用。近年来有研究表明amp除了能抑制5
‑
羟色胺和去甲肾上腺素的再摄取外,还能聚集在溶酶体内干扰酸性鞘磷脂酶(acid sphingomyelinase,asmase)与细胞膜的结合,导致asmase脱落,进而抑制asmase的功能。asmase作为鞘磷脂类家族的重要成员,是细胞膜结构的重要组成部分,在细胞内能将鞘磷脂水解生成神经酰胺(ceramide)。ceramide作为鞘磷脂代谢的关键分子,在许多细胞活动,如炎症、生长、分化、衰老、凋亡等中起调控作用。近些年来,研究发现ceramide的聚集会引起活性氧(reactive oxygen species,ros)增多,抑制enos的激活,导致no释放量减少及活性下降,在一些小的冠状动脉,ceramide信号传导通过减少冠状动脉的no的生物利用度进而损害内皮依赖性舒张功能。因此抑制as进程中asmase的活性进而减少ceramide的释放以改善血管ecs功能,这可能为cvd的治疗提供一个新的靶点。
5.虽然现有研究已经报道了阿米替林在多种疾病中发挥保护作用,但至今还未报道过阿米替林能够减轻内皮细胞炎症或改善内皮功能及其作用机制。
技术实现要素:
6.本发明的目的是提供一种阿米替林在制备改善内皮细胞功能的药物中的应用,以解决上述现有技术存在的问题,发现了阿米替林的新的应用途径,同时也为内皮炎症提供了一种新的治疗药物。
7.为实现上述目的,本发明提供了如下方案:
8.本发明提供阿米替林在制备改善内皮细胞功能的药物中的应用。
9.优选的是,所述改善内皮细胞功能的药物包括如下任一项:
10.(1)促进内皮细胞中enos磷酸化和no释放的药物;
11.(2)抑制tnf
‑
α诱导的内皮细胞炎症反应的药物;
12.(3)抑制tnf
‑
α诱导的内皮细胞活性氧产生的药物;
13.(4)通过抑制mapk信号通路以及nf
‑
κb的活化,减轻内皮细胞炎症的药物。
14.本发明还提供阿米替林在制备抑制内皮细胞炎症药物中的应用,所述阿米替林通过抑制tnf
‑
α诱导的炎性相关分子的表达,以抑制单核细胞对内皮细胞的黏附作用,实现对内皮细胞的功能的改善。
15.优选的是,所述炎症相关分子包括icam
‑
1、vcam
‑
1、mcp
‑
1。
16.本发明还提供阿米替林在制备抑制tnf
‑
α诱导的内皮细胞损伤药物中的应用,所述阿米替林通过促进内皮细胞增殖、迁移和管腔形成,减轻内皮细胞损伤,改善内皮细胞功能。
17.本发明公开了以下技术效果:
18.阿米替林对tnf
‑
α诱导的人脐静脉内皮细胞损伤有明显的抑制作用,本发明首次公开指出阿米替林在血管内皮损伤和炎症反应的动脉粥样硬化等血管疾病发生的过程中,阿米替林能明显抑制mapk
‑
nf
‑
κb信号通路减轻tnf
‑
α诱导的人脐静脉内皮细胞炎症反应,如nf
‑
κb、icam
‑
1、vcam
‑
1以及mcp
‑
1等的蛋白表达,单核细胞的黏附数量;阿米替林能够减轻tnf
‑
α诱导的人脐静脉内皮细胞功能障碍,如促进内皮细胞增殖、迁移,恢复管腔形成能力等。本发明发现了阿米替林的新用途,并为内皮细胞炎症的治疗提供了新的药物,另外对于预防和治疗心血管疾病具有很好的应用前景。
附图说明
19.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
20.图1为阿米替林可促进内皮细胞的功能;a:western blotting检测amp(0
‑
5μm,24hours)对huvec中p
‑
enos蛋白表达水平的影响;b:amp(0
‑
5μm,24hours)对huvec中no释放量的影响;c:edu检测amp(2.5μm,24hours)对huvec增殖的影响,标尺:400μm;d:huvec增殖的统计结果;e:cck
‑
8检测amp(0
‑
5μm,24hours)对huvec细胞活力的影响;
*
p<0.05,
**
p<
0.01,
***
p<0.001vs.con,mean
±
sem,n=5;
21.图2为阿米替林可抑制tnf
‑
α诱导的内皮细胞黏附相关分子的表达和单核细胞的黏附;a:western blotting检测amp对tnf
‑
α诱导的huvec中vcam
‑
1,icam
‑
1和mcp
‑
1蛋白表达水平的影响;b
‑
c:elisa检测amp对tnf
‑
α诱导的huvec上清液中svcam
‑
1和sicam
‑
1释放量的影响;d:amp对tnf
‑
α诱导的单核细胞黏附的影响,标尺:400μm;
*
p<0.05,
**
p<0.01,
***
p<0.001vs.con,
#
p<0.05,
##
p<0.01,
###
p<0.001vs.tnf
‑
α,mean
±
sem,n=3;
22.图3为阿米替林可减轻tnf
‑
α诱导的内皮细胞功能障碍;a:transwell实验检测amp对tnf
‑
α诱导的huvec迁移的影响,标尺:4
×
200μm,10
×
200μm,20
×
100μm;b:huvec迁移到下室的细胞数;c:edu检测amp对tnf
‑
α诱导的huvec增殖的影响,标尺:400μm;d:edu阳性率;e:tube formation检测amp对tnf
‑
α诱导的huvec小管形成的影响,标尺:200μm;f:成管总长度的测量;*p<0.05,**p<0.01,***p<0.001vs.con,
#
p<0.05,
##
p<0.01,
###
p<0.001vs.tnf
‑
α,mean
±
sem,n=5;
23.图4为阿米替林可抑制tnf
‑
α诱导的内皮细胞活性氧的产生;a:二氢乙啶(dihydroethidium,dhe)检测amp对tnf
‑
α诱导的活性氧产生的荧光结果,标尺:400μm;b:活性氧荧光强度统计结果;
*
p<0.05,
**
p<0.01,
***
p<0.001vs.con,
#
p<0.05,
##
p<0.01,
###
p<0.001vs.tnf
‑
α,mean
±
sem,n=5;
24.图5为阿米替林可抑制tnf
‑
α诱导的asmase的活化和ceramide的释放;a:huvec上清液中ceramide的含量;b
‑
c:huvec上清液asmase的活性和ceramide的释放情况;*p<0.05,**p<0.01,***p<0.001,
##
p<0.01,
###
p<0.001;
25.图6为阿米替林可抑制tnf
‑
α诱导的内皮细胞mapk的活化;a:western blotting检测amp对tnf
‑
α诱导的p
‑
nf
‑
κb,p
‑
erk1/2,p
‑
p38和p
‑
jnk蛋白表达水平的影响;b:p
‑
nf
‑
κb,p
‑
erk1/2,p
‑
p38和p
‑
jnk蛋白表达量统计结果;
*
p<0.05,
**
p<0.01,
***
p<0.001vs.con,
#
p<0.05,
##
p<0.01,
###
p<0.001vs.tnf
‑
α,mean
±
sem;n=3。
具体实施方式
26.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
27.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
28.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
29.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实
施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
30.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
31.实施例1
32.1、实验材料
33.盐酸阿米替林购自美国sigma公司;人重组tnf
‑
α购自北京sino biological有限公司;ebm
‑
2培养基购自lonza公司,1640培养基购自美国gibco公司;edu试剂盒购自广州锐博公司;matrigel购自美国康宁公司;asmase抗体购自中国爱博泰克公司;icam
‑
1、vcam
‑
1、mcp
‑
1、mapk、p
‑
mapk、p
‑
nf
‑
κb等抗体购自美国cst公司;icam
‑
1和vcam
‑
1elisa试剂盒购自中国达科为公司。
34.2、实验细胞培养及模型建立
35.人脐静脉内皮细胞(human umbilical vein endothelial cell,huvec)从美国cell applications公司购买。
36.细胞培养于含有95%空气和5%co2的37℃无菌培养箱中。待细胞生长状态良好且密度生长至80%时,按照以下处理分为4组:
37.control组:对照组;
38.单独tnf
‑
α组:tnf
‑
α(20ng/ml);
39.tnf
‑
α amp组:tnf
‑
α(20ng/ml) amp(2.5μm);
40.amp组:amp(2.5μm)。
41.3、实验方法
42.(1)检测cck
‑
8细胞活力
43.按照实验设计分组将huvec接种在96孔板内(8
×
103cells/well),等待细胞状态稳定后进行后续实验;配制cck
‑
8反应液:根据需要按照ebm
‑
2(无血清):cck
‑
8溶液=10:1的比例充分混匀,全程避光;弃去96孔板内的旧培养基,用预热的pbs将细胞清洗一遍,每个待测样本孔加入110μl的cck
‑
8反应液,放入37℃,5%co2培养箱孵育3小时;用酶标仪在450nm波长处读取各孔内的od值;
44.(2)edu检测细胞增殖
45.1)edu标记:
①
配制edu a液培养基:用含血清的细胞培养基按照1000:1的比例稀释edu a液,edu a液终浓度为50μm;
②
将细胞用稀释好的edu a液(50μm)培养基在细胞培养箱中孵育4小时;
③
弃去旧培养基,每个实验孔用pbs清洗1次,5分钟;
46.2)细胞固定:
①
48孔板每孔加入4%多聚甲醛(100μl)在18
‑
25℃条件下孵育30分钟,弃去固定液;
②
每孔加入2mg/ml甘氨酸(100μl)以中和多余的醛基,摇床孵育5分钟后,吸弃孔内溶液,pbs清洗一次,5分钟;
③
弃pbs,分别加入0.5%tritonx
‑
100渗透剂(100μl)至每个实验孔,摇床在18
‑
25℃条件下孵育10分钟,pbs清洗一次,5分钟;
47.3)appllo染色:
①
根据需要配制1
×
apollo染色反应液;全程避光,每孔加入1
×
apollo染色反应液(100μl),脱水摇床在18
‑
25℃条件下孵育30分钟,吸弃染色反应液;
②
每孔加入0.5%tritonx
‑
100渗透剂(100μl),脱色摇床慢摇10分钟,重复2次,弃渗透剂;
③
每孔加入无水甲醇100μl以降低染色背景,静置5分钟;
④
pbs清洗一次,5分钟;
48.4)dna染色:
①
用ddh2o按照100:1的比例稀释试剂f,配制1
×
hoechest染色液,现
配现用,避光备用;
②
全程避光,每孔加入1
×
hoechest染色液(100μl),脱水摇床在18
‑
25℃条件下孵育30分钟,吸弃孔内液体;
③
pbs清洗一次,5分钟;
④
每孔加入pbs(200μl)保持样本湿润,荧光显微镜下观察拍照或避光4℃保存,3天内拍照。
49.(3)硝酸还原酶法检测一氧化氮含量
50.收集细胞上清按照试剂盒说明书操作测定一氧化氮水平,使用酶标仪在550nm波长处检测各样本od值。
51.(4)elisa法测定细胞上清中vcam
‑
1、icam
‑
1以及ceramide的含量
52.收集处理完的细胞上清,按照试剂盒说明书操作测定vcam
‑
1、icam
‑
1和ceramide的水平,使用酶标仪在450nm波长处检测各样本od值。
53.(5)单核细胞黏附实验
54.将huvec铺至12孔板,按照实验设计进行分组处理;吸取一定体积thp
‑
1细胞悬液,950rpm,离心3分钟;弃去上清,1ml ebm
‑
2培养基重悬,并进行细胞计数,计算所需thp
‑
1细胞数量,用ebm
‑
2培养基稀释细胞悬液至4
×
105cells/ml;避光,加入钙黄绿素到细胞悬液,终浓度为1μg/ml,轻轻混匀,室温孵育15分钟;从培养箱中拿出处理好的12孔板,弃去旧培养基,加入thp
‑
1细胞悬液,1ml/well,“8”字法摇匀,放入细胞培养箱孵育45分钟;弃去培养基,pbs洗去未黏附的单核细胞,重复3次;加入新鲜培养基,荧光显微镜下拍照,imagej软件进行数据分析。
55.(6)transwell检测细胞迁移
56.取p4处于对数生长期状态良好的huvec铺至6孔板,按照实验设计分组进行处理;细胞处理完毕后,消化、离心并收集细胞,无血清ebm
‑
2培养基重悬细胞,细胞计数,配制成浓度为4
×
104cells/ml的细胞悬液;将准备好的transwell小室(8μm)放入24孔板,取150μl细胞悬液加入上室,下室加入700μl含5%fbs的ebm
‑
2培养基;将装有transwell小室的24孔板放入细胞培养箱中孵育12
‑
16小时;从培养箱中拿出24孔板,小心弃去上、下室培养基,pbs清洗1遍,将小室置于4%多聚甲醛中固定30分钟;pbs清洗1遍,将小室置于结晶紫溶液染色45分钟,弃去小室中残余的结晶紫溶液,pbs清洗3次;用棉签小心将上室未迁移到下室的细胞擦去,晾干后置于倒置显微镜下拍照,保存数据。
57.(7)检测内皮细胞管腔形成能力
58.根据实验设计取p4处于对数生长期状态良好的huvec铺至6孔板,待细胞状态稳定后进行下一步处理;提前一天将96孔板,无菌枪头放入冰箱预冷,matrigel提前溶解;从冰箱取出预冷的96孔板以及无菌枪头,将准备好的matrigel加入96孔板,50μl/孔,全程冰上操作,37℃包被1小时;用胰酶分别消化每孔的细胞,离心后弃去上清,无血清ebm
‑
2培养基重悬细胞,细胞计数,配制成浓度为3
×
105cells/ml的细胞悬液;细胞悬液100μl/孔加入matrigel包被好的96孔板,将96孔板置于细胞培养箱37℃孵育6小时;倒置显微镜下拍照,imagej软件进行数据分析。
59.(8)细胞ros检测
60.将huvec铺至12孔板,按照实验设计进行分组处理;避光条件下将超氧化物阴离子荧光探针(dihydroethidium,dhe)溶于无血清ebm
‑
2培养基,终浓度为20μm;从培养箱中拿出处理好的12孔板,弃去旧培养基,pbs洗2遍,加入含dhe(20μm)的ebm
‑
2培养基,置于细胞培养箱孵育45分钟;将孔内旧培养基弃去,pbs洗2遍,加入新鲜培养基,荧光显微镜下拍照,
imagej软件进行数据分析。
61.(9)asmase活性测定
62.1)提前从冰箱取出asmase活性试剂盒,恢复至室温;
63.2)配制工作液:
①
abred指示剂:将abred指示剂(粉末)溶解在80μl dmso中,得到200
×
abred指示剂,分装后,避光储存于
‑
20℃冰箱,使用前平衡至室温;
②
鞘磷脂工作液:根据需要将鞘磷脂溶液与鞘磷脂酶反应液按照1:100的比例混合,现配现用;
③
enzyme mix:整瓶enzyme mix(粉末)中加入5ml检测缓冲液,充分混匀溶解,分装后置于
‑
20℃冰箱保存;
④
鞘磷脂酶反应液:根据需要将enzyme mix与abred指示剂按照200:1的比例混合,现配现用,避光保存;
64.3)从培养箱取出处理好的细胞,弃去旧培养基,用pbs洗涤一次,吸尽残余pbs;
65.4)6孔板中加入1
×
mammalian lysis buffer(300μl),在室温条件下(18
‑
25℃)孵育15分钟;收集细胞裂解液于1.5ml ep管中,1500rpm,离心5分钟,将上清液转移至新的ep管中,冰上操作;
66.5)取待测样本(50μl)加入到黑色96孔板中,加入检测缓冲液(50μl)到空白孔中;
67.6)每个待测样本中加入鞘磷脂(50μl)工作液,37℃孵育2小时;
68.7)取鞘磷脂酶反应液(50μl)加入到待测混合反应液中;
69.8)避光,在室温条件下(18
‑
25℃)孵育2小时,荧光酶标仪设置ex/em=540/590nm,读取吸光度。
70.(10)western blot法检测vcam
‑
1、icam
‑
1、mcp
‑
1、p
‑
enos、p
‑
jnk、p
‑
erk1/2、p
‑
p38、p
‑
nf
‑
κb的蛋白表达
71.内皮细胞药物处理后,加入细胞裂解液冰上裂解细胞,4℃,12000g离心15min,转移上清至新的ep管中,即为蛋白样品原液;使用bca试剂盒测定蛋白浓度;将5
×
loading buffer与蛋白样品按照1:4比例混合,100℃水浴10min;冰上冷却1min备用;用10%sds
‑
page凝胶电泳分离蛋白,然后进行转膜、封闭、孵育相关一抗过夜,次日,洗膜、二抗孵育后,将pvdf膜置于化学发光仪中进行图像采集,并使用imagej软件进行定量分析,以gapdh作为内参对照。
72.4、统计学分析
73.采用spss 21.0软件对数据进行统计学分析,每组实验都至少重复3次以上,所有数据均用均数
±
标准误表示。对于方差不齐的两组或两亚组间的差异显著性检验采用非参数检验中mann
‑
whitney u检验,对于方差不齐的多组或多个亚组间的差异显著性检验采用非参数检验中kruskal
‑
wallis h检验。对于方差齐的两组数据间比较采用独立样本t检验。p<0.05认为差异具有统计学意义。
74.5、结果分析
75.(1)阿米替林可促进脐静脉内皮细胞的功能
76.本发明提供的药物以不同浓度直接作用于huvec 24h,结果显示enos的磷酸化程度在阿米替林药物浓度0
‑
5μm范围内呈浓度依赖性增加(图1a),同时阿米替林促进了huvec上清液中no的释放(图1b),其中以浓度2.5μm效果最为明显。
77.为了进一步研究阿米替林对huvec功能的影响,我们检测了细胞的活力和增殖功能(图1d),结果显示,与对照组相比,阿米替林处理后,huvec的活性明显增强,edu阳性细胞
数明显增加(图1c),差异具有统计学意义(p<0.05),这些结果都说明了阿米替林促进了内皮细胞的功能。
78.(2)阿米替林可抑制tnf
‑
α诱导的内皮细胞黏附相关分子的表达和单核细胞的黏附
79.本发明提供的药物先作用于huvec 1h后再加入tnf
‑
α(20ng/ml)作用23h,如图2a所示,阿米替林单独处理,与对照组相比并没有什么差异;tnf
‑
α(20ng/ml)处理后,黏附分子vcam
‑
1、icam
‑
1以及mcp
‑
1的表达较对照组明显升高;预处理阿米替林明显抑制了这些分子的表达,elisa的结果与western blot一致(图2b,c)。
80.我们进一步研究了阿米替林在tnf
‑
α诱导的单核细胞黏附中的作用,结果显示,在tnf
‑
α处理24h后,与对照组相比,黏附在huvec上的thp
‑
1明显增多,而阿米替林的干预明显抑制了thp
‑
1的黏附;单独使用阿米替林处理huvec,与对照组相比无明显统计学差异(图2d);这些结果说明了阿米替林通过抑制内皮细胞黏附分子的表达,阻断炎症状态下单核细胞对内皮细胞的黏附作用。
81.(3)阿米替林可减轻tnf
‑
α诱导的内皮细胞功能障碍
82.内皮细胞功能在as的发生和发展中起着重要的作用。tanswell检测huvec的迁移能力,如图3a和b所示,与对照组相比,tnf
‑
α抑制了内皮细胞的迁移,而本发明提供的药物后,迁移至transwell小室下方的细胞数量明显增多;edu实验检测细胞增殖能力,如图3c和d所示,tnf
‑
α组的edu阳性率明显低于con组,细胞增殖能力下降,而添加了阿米替林后的edu阳性率高于tnf
‑
α组,说明了细胞增殖能力的恢复;如图3e和f,tube formation结果显示,经tnf
‑
α处理后,huvec的成管总长度下降,提前加入阿米替林后,成管总长度明显提高;上述结果提示阿米替林可减轻了tnf
‑
α诱导的内皮功能障碍。
83.(4)阿米替林可抑制tnf
‑
α诱导的内皮细胞活性氧的产生
84.氧化应激在内皮细胞活化和动脉粥样硬化发生、发展中起着重要作用。于是我们通过dhe检测内皮细胞中活性氧的产生。
85.如图4a和b所示,tnf
‑
α能促进huvec中活性氧的产生,相比tnf
‑
α组,使用本发明提供的药物阿米替林可下调了huvec中活性氧的产生,与con组相比,阿米替林单独处理对huvec中活性氧的产生影响不大,这些结果表明阿米替林能抑制tnf
‑
α诱导的huvec活性氧的产生。
86.(5)阿米替林可抑制tnf
‑
α诱导的asmase的活化和ceramide的释放
87.为了研究本发明提供的药物阿米替林对tnf
‑
α诱导的内皮细胞asmase的影响,我们检测了asmase的活性和下游产物ceramide在细胞上清中的含量。在tnf
‑
α(5
‑
30ng/ml)的作用下,与对照组相比,huvec上清液中ceramide的含量呈浓度依赖性增加(图5a),而且,阿米替林能以浓度依赖性的方式抑制asmase的活性和ceramide的释放(图5b,c),因此,阿米替林是有效的asmase的活性抑制剂。
88.(6)阿米替林对tnf
‑
α诱导的内皮细胞中mapk通路的活化的影响
89.tnf
‑
α能通过与tnfr结合激活mapk通路,我们探讨了本发明提供的药物阿米替林是否能通过抑制mapk信号转导通路减轻tnf
‑
α诱导的促炎效应。
90.如图6a和b,western blotting结果显示,tnf
‑
α能明显上调huvec中p
‑
nf
‑
κb、p
‑
jnk、p
‑
erk1/2和p
‑
p38的表达,当预处理阿米替林后,与tnf
‑
α组相比,p
‑
nf
‑
κb、p
‑
jnk、p
‑
erk和p
‑
p38的表达均降低,而单独使用阿米替林处理后,与con组相比,这些蛋白表达无显著变化。这些结果表明阿米替林可能通过抑制mapk通路发挥抗炎效应,进而改善内皮功能的作用。
91.通过以上实验结果证明阿米替林能够通过有效抑制mapk
‑
nf
‑
κb信号转导通路,减少炎症状态下内皮细胞分泌黏附分子以及活性氧的产生,抑制单核细胞对内皮细胞的黏附,减轻内皮细胞的进一步损伤和功能障碍。
92.内皮细胞作为血管的重要组成部分,具有抗栓、抗炎和产生血管活性物质调节血管张力的能力,在血管功能稳态中发挥着重要作用。慢性的血管内皮损伤会引起血管收缩和舒张功能失衡,活性氧产生增多,炎症因子和炎症介质的生成与分泌不仅会损伤内皮自身,导致no生物利用度不足,还会促进血管平滑肌细胞的增生与迁移,进一步引起血管病变,加速动脉粥样硬化的发展进程。本发明提供的药物在以上内皮细胞损伤实验中表现出很好的抑制内皮细胞炎症,保护内皮细胞功能的特性。因此,本发明提供的药物在预防由内皮细胞炎症以及内皮细胞功能障碍引起的心血管疾病有很好的应用前景,为心血管疾病的预防和治疗开辟新的医药途径。
93.以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。