蔗糖异构酶突变体、编码基因及其应用
(一)技术领域
1.本发明属于生物技术领域,具体涉及一种来源于erwiniasp.ejp617的蔗糖异构酶突变体及其编码基因、含有该突变体基因的重组载体以及蔗糖异构酶突变体生物催化蔗糖制备异麦芽酮糖中的应用。
(二)
背景技术:
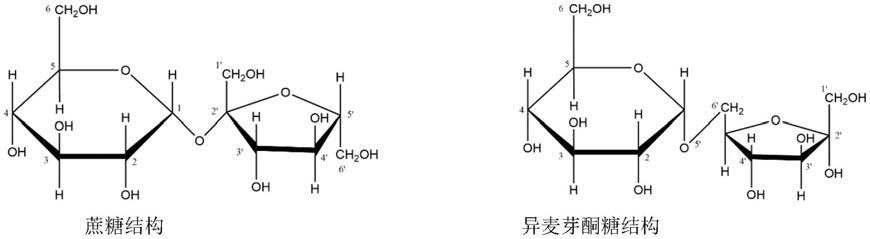
2.异麦芽酮糖(isomaltulose),也称帕拉金糖(palatinose),是一种还原性双糖,是蔗糖的同分异构体,由d
‑
葡萄糖和d
‑
果糖通过α
‑
1,6糖苷键连接构成,这与蔗糖中的α
‑
1,2糖苷键不同。1957年,由weidenhagen等人在甜菜制作中首先发现。异麦芽酮糖具有与蔗糖类似的甜味特性和口感,但其甜度低,仅为蔗糖的52%,与蔗糖相比,其突出的优点主要体现在:(1)低致龋齿特性;(2)对糖尿病患者和糖尿病前期患者有良好的治疗作用;(3)在人肠道中,选择性刺激双歧杆菌的生长;(4)极低的吸湿性,稳定性强,货架期也更长;(5)适用于中小学生和白领人等需要持续、长时间进行脑力工作的人群。作为一种有前途的功能性甜味剂,异麦芽酮糖已在日本、美国、西欧等国家得到广泛应用,应用范围包括硬糖、软糖、口香糖、巧克力、焙烤食品、水果罐头、果酱、运动饮料和牙膏等。另外,异麦芽酮糖也是异麦芽酮糖醇(isomalt)的原料。异麦芽酮糖醇是近年来国际上新兴的一种功能性糖醇,广泛应用于无糖食品、无糖保健品和无糖药品等产品的生产上。
3.异麦芽酮糖由蔗糖异构酶ec 5.4.99.22(sucrose isomerase),或叫异麦芽酮糖合成酶(isomaltulose syntheses),蔗糖葡萄糖基变位酶(sucrose glucosylmutase),α
‑
葡萄糖基转移酶(α
‑
glucosyltransferase),其能使蔗糖中连接葡萄糖和果糖的α
‑
1,2键发生重排反应,当其重排为α
‑
1,4键时,即生成海藻酮糖,重排为α
‑
1,6键则生成异麦芽酮糖。目前,用于异麦芽酮糖生产的蔗糖异构酶来源于各种微生物,如大黄欧文氏菌nx
‑
5、欧文氏菌属d12(erwinia sp.d12)、白沙雷氏菌atcc15928(serratia plymuthica atcc15928)、克雷伯氏菌属、嗜酸假单胞菌mx
‑
45(pseudomonas mesoacidophila mx
‑
45)和大黄欧文氏菌ncppb1578(e.rhapontici ncppb1578)的天然酶,以及来自大黄欧文氏菌dsm4484(genbank登录号aak28735.1)、大黄欧文氏菌nx
‑
5(adj56407.2)、肠杆菌属fmb
‑
1(enterobacter sp.fmb
‑
1)(acf42098.1)、嗜酸假单胞菌mx
‑
45(aco05018.1)、红色精朊杆菌cbs574.77(caf32985.1)、肺炎克雷伯菌nk33
‑
98
‑
8(klebsiella pneumonia nk33
‑
98
‑
8)(aam96902.1)、分散泛菌uq68j(pantoea dispersa aap57083.1)(aap57083.1)、普氏克雷伯菌uq14s(klebsiella planticola uq14s)(aap57085.1)和克雷伯氏菌属lx3(aak82938.1)的重组酶。虽然上述几种细菌产的蔗糖异构酶能够把蔗糖转变成异麦芽酮糖,但产量很不稳定,转化率也不高,为8%~85%。而且,除了主产物外,酶转化液中还存在部分海藻酮糖和少量的异麦芽糖、异松三糖、葡萄糖和果糖等副产物,产物特异性不高。为了提高蔗糖异构酶的酶活以提高异麦芽酮糖的产量,通过各种突变方法来产生异麦芽酮糖高产菌株也是目前研究的一大热点。如张洪达等以一株实验室筛选的克雷伯氏菌属lx3为出发菌株,利用常压室温等离子体注入技术对菌株进行诱变,并通过测定发酵液中蔗糖异
构酶活性、异麦芽酮糖含量以及检测菌体絮凝效果,获得一株异麦芽酮糖高产且黏度较低的菌株(lx3
‑
1),与野生菌株相比,突变株蔗糖异构酶酶活提高了20.42%(p<0.05),异麦芽酮糖产量提高了41.87%,且突变株经6次传代培养后,发酵液中蔗糖异构酶酶活和异麦芽酮糖产量仍稳定。liu等对来源于分散泛菌uq68j的蔗糖异构酶靠近底物结合位点的y296和q299进行了突变,实现了异麦芽酮糖产量的提升。
4.目前,国内外虽有不少关于蔗糖异构酶的研究,但大都还是停留在实验室水平,关于蔗糖异构酶工业化应用方面的研究,还需要进一步的深入。
(三)
技术实现要素:
5.本发明的目的是提供一种蔗糖异构酶突变体及其编码基因、含有该突变体基因的重组载体以及蔗糖异构酶突变体生物催化蔗糖制备异麦芽酮糖中的应用。
6.本发明采用的技术方案是:
7.一种蔗糖异构酶突变体,其氨基酸序列如seq id no:1所示。该蔗糖异构酶突变体为来源于erwiniasp.ejp617的第209位氨基酸由谷氨酰胺突变为丝氨酸、第456位精氨酸突变为组氨酸所得。本发明利用易错pcr技术对蔗糖异构酶进行定点突变进行分子改造,进一步提高了蔗糖异构酶的酶活和异麦芽酮糖的产率。
8.本发明还涉及编码所述的蔗糖异构酶突变体的基因。
9.具体的,所述编码基因核苷酸序列如seq idno.2所示。
10.本发明还涉及含有所述编码基因的重组载体。这些基因、表达盒、质粒、转化体可以通过本领域技术人员所熟知的基因工程构建方式获得。
11.本发明还涉及蔗糖异构酶突变体在生物催化蔗糖制备异麦芽酮糖中的应用。
12.当做为生物催化剂用于生产时,本发明的蔗糖异构酶突变体可以呈现酶的形式或者菌体的形式。所述酶的形式包括游离酶、固定化酶,包括纯化酶、粗酶、发酵液、载体固定的酶、细胞破碎物等:所述菌体的形式包括存活菌体细胞和死亡菌体细胞。
13.具体的,所述的应用为:以所述蔗糖异构酶突变体为催化剂,以蔗糖为底物,在ph6.0~7.0、28~32℃条件下反应3~12h,于反应液中获得所述异麦芽酮糖。
14.优选的,反应体系中蔗糖浓度为500~600g/l。
15.与现有技术相比,本发明的有益效果主要体现在:本发明构建了一个酶活和催化效率均得到了提高的蔗糖异构酶双重突变体q209s/r456h,在ph 6.0,40℃的水浴中,蔗糖异构酶突变体q209s/r456h的酶活达到684u/mg,催化效率是野生型蔗糖异构酶的16倍以上;酶动力学分析显示,q209s/r456h的k
m
值分别比天然酶下降了48.7%,k
cat
值是天然酶的8.3倍;催化效率k
cat
/k
m
是wt的16倍以上。催化蔗糖生产异麦芽酮糖时,突变体的异麦芽酮糖最大转化率比天然酶提高了19.3%。
(四)附图说明
16.图1:为利用高通量筛选方法得到好的突变点显色反应;
17.图2:为天然蔗糖异构酶及五种突变体纯酶sds
‑
page凝胶电泳;其中,m代表蛋白分子量标准,wt为野生型蔗糖异构酶,泳道1为突变体q209n;泳道2为突变体r456k;泳道3为突变体q209s,泳道4为突变体r456h,泳道5为突变体q209s
‑
r456h.
18.图3:ersiase_wt和ersiase_q209s
‑
r456h的最适温度和ph值。(a)ersiase_wt的最适温度,(b)ersiase_wt的最适ph,(c)ersiase_q209s
‑
r456h的最适温度,(d)ersiase_q209s
‑
r456h的最适ph。
19.图4:为野生型蔗糖异构酶及其突变体在40℃下制备异麦芽酮糖的转化率。
20.图5:含有ersiase基因重组质粒的重组大肠杆菌e.coli bl21(de3)/pet28b( )
‑
ersiase的构建。
(五)具体实施方式
21.下面结合具体实例对本发明做进一步详细地说明,但本发明并不限于以下实施例:
22.本发明中涉及到多种物质的添加量、含量及浓度,其中所述的百分含量,除特别说明外,皆指质量百分含量。
23.上游基因工程操作所用试剂:本发明实施例中使用的一步克隆试剂盒均购自vazyme,南京诺唯赞生物科技有限公司;质粒提取试剂盒dna回收纯化试剂盒购自axygen杭州有限公司;质粒等购自上海生工;dna marker、fast pfu dna聚合酶、低分子量标准蛋白、琼脂糖电泳试剂、引物合成与基因测序以及基因合成工作由杭州擎科梓熙生物技术有限公司完成。以上试剂使用方法参考商品说明书。蔗糖和异麦芽酮糖等常用试剂购自国药集团化学试剂有限公司。
[0024][0025]
实施例1:蔗糖异构酶基因在大肠杆菌e.coli bl21(de3)中的克隆和表达。
[0026]
构建表达载体:以下所述的蔗糖异构酶基因合成工作均由杭州擎科梓熙生物技术有限公司完成。将来源于欧文氏菌(erwiniasp.ejp617)的蔗糖异构酶基因(genbank:g37835)通过pcr无缝克隆到pet28b( )载体的nco i和xho i之间,获得带有蔗糖异构酶的表达载体pet28b( )
‑
si(图4)。pcr程序的操作如下:95℃预变性3分钟;95℃变性15s,53
‑
58℃退火15s,72℃延伸1.5分钟,共25个循环;然后以72℃延伸10分钟。
[0027]
感受态细胞的制备方法为:从
‑
80℃冰箱中获得甘油管保藏的e.coli bl21(de3)菌株,在无抗lb平板上划线,37℃培养10h,获取单菌落;挑取lb平板的单菌落,接种至含5ml的lb培养基的试管中,37℃、180rpm培养9h;从试管中取200μl菌液,接种到50ml的lb培养基中,37℃、180rpm培养od 600
至0.4
‑
0.6;将菌液在冰上预冷,取菌液至灭菌的离心管中,冰上放置10min,4℃、5000rpm离心10min;将上清液倒出,注意防止染菌,用预冷的0.1mol/l的cacl2水溶液重悬沉淀细胞,并在冰上放置30min;4℃、5000rpm离心10min,弃上清,用预冷的含15%甘油的0.1mol/l的cacl2水溶液重悬沉淀细胞,取100μl重悬细胞分装至灭菌的1.5ml离心管中,保藏于
‑
80℃冰箱,需要时取出。
[0028]
构建工程菌文库:将储藏于
‑
80℃的大肠杆菌bl21(de3)(invitrogen)感受态细胞在0℃冰浴10min,然后在超净台内分别加入5μl的带有蔗糖异构酶基因表达载体pet28b( )
‑
si,0℃冰浴30min,42℃水浴中热击90s,0℃冰浴4min,加入600μl的lb培养基,在37℃、200rpm摇床培养1h;涂布于含有50μg/ml卡那霉素抗性的lb平板,37℃下培养8
‑
12h,获得含有表达重组质粒的重组大肠杆菌e.coli bl21(de3)/pet28b( )
‑
si工程菌。
[0029]
实施例2:蔗糖异构酶重组菌的诱导表达及纯化
[0030]
含蔗糖异构酶的湿菌体:分别将实施例2获得的重组大肠杆菌e.coli bl21(de3)/pet28b( )
‑
si接种至含有50μg/ml卡那霉素抗性的lb液体培养基,37℃,200rpm下培养12h,再以1%(v/v)接种量接种至新鲜的含有50μg/ml卡那霉素抗性的lb液体培养基中,于37℃,150rpm下培养至菌体od
600
达0.6
‑
0.8,加入终浓度为0.1mm的iptg,25℃下诱导培养10h后,4℃、8000rpm离心20min,弃去上清液,收集沉淀,用ph 7.0、50mm tris hcl缓冲液洗涤两次,即获得含蔗糖异构酶的重组菌株e.coli bl21(de3)/pet28b( )
‑
si的湿菌体;将湿菌体加入ph 7.0、50mm tris hcl缓冲液中重悬,在冰水混合物上超声破碎20min,超声破碎条件:功率为400w,破碎1s,暂停5s,获得粗酶液。
[0031]
蔗糖异构酶的纯化:由于有6个组氨酸标签和蔗糖异构酶基因一起表达,所以可以通过此组氨酸标签表达的肽段和二价ni
2
的螯合作用,用ni亲和柱(40
×
12.6mm,bio
‑
rad,usa)进行亲和层析纯化蛋白。该纯化过程主要使用和进行纯化。具体操作如下:
①
用5倍柱体积的ni柱平衡缓冲液a(50mm nah2po4·
2h2o 300mm nacl 50mm咪唑)平衡ni柱,至基线稳定;
②
样品上样,流速1ml/min,上样量在25
‑
40mg/ml蛋白,使目标蛋白吸附于ni柱上;
③
用6倍柱体积的缓冲液a冲洗杂蛋白,流速1ml/min,至基线稳定;
④
用洗脱液b(50mm nah2po4·
2h2o 300mm nacl 500mm咪唑)洗脱,流速1ml/min,收集目的蛋白。将目的蛋白置于ph 7.5、20mm磷酸盐缓冲液中透析过夜,获得纯化酶,sds
‑
page电泳图如图2所示。
[0032]
实施例3:蔗糖异构酶基因文库的构建和筛选。
[0033]
(一)通过易错pcr引入有益突变
[0034]
用minibest质粒纯化试剂盒(takara,大连,中国)从e.coli bl21(de3)/pet28b( )
‑
si重组大肠杆菌中分离质粒dna。在含有60ng质粒(pet28b
‑
si)作为模板,60pmol每种诱变引物(e2
‑
f,e2
‑
r,表s1),0.4mm mncl2、2x的50μl反应混合物中进行dna片段的扩增taq pcr starmix和loding dye(takara,中国大连)。编码siase的基因的扩增过程为:94℃2min,然后依次进行30个循环,分别是94℃30s,60℃30s和72℃2分钟,最后在72℃下放置10分钟。该方案导致平均突变频率为每1000bp个碱基取代。使用quickcut dpn i在37℃下消化pcr产物3小时,以除去模板。然后,使用minibest dna片段纯化试剂盒(takara,大连,中国)纯化文库基因片段。然后将纯化的基因片段连接到nco i和xho i位点之间的pet28b中,以形成重组质粒pet28b
‑
si。然后将pet28b
‑
si转化到大肠杆菌中,并使所有转化的细胞生长过夜。筛选最佳变体并测序。
[0035]
易错pcr引物序列
[0036][0037]
(二)高通量筛选方法的建立以及详细步骤
[0038]
1、96深孔板培养制备种子液:往96深孔板中每个孔加入500μl含0.1%(v/v)100g/l kana的lb液体培养基,然后用无菌牙签挑取单菌落于对应孔中,并在每块96深孔板中选取剩下的4个孔,挑取加入wt单菌落,作为阳性对照。然后用盖子密封,于37℃,180rpm振荡培养5h。
[0039]
2、种子液转接及诱导:取上一步培养好的50μl转化子种子液于另一块96深孔板中,并加入900μl含0.1%(v/v)100g/l kan的lb液体培养基,然后用盖子密封,于37℃,180rpm振荡培养2h,然后每个孔加入50μl含0.8%(v/v)120g/l iptg和0.1%(v/v)100g/l kana的lb液体培养基,用盖子密封后于25℃,180rpm振荡培养10h以上。剩余的转化子种子液于4℃冰箱中保存备用。
[0040]
3、dns法酶活检测:取50μl诱导液于96孔板中,并加入50μl 50g/l蔗糖(用50mm柠檬酸
‑
磷酸氢二钠缓冲液(ph 6.0)配制),于40℃恒温反应15min。然后加入50μl dns试剂,于微波炉中中火加热25s左右显色,观察实验结果,用酶标仪检测显色液在540nm处的吸光度。
[0041]
4、高酶活突变体菌液保藏及序列测定:根据dns法测定结果,标记吸光度高于阳性对照且较高的样品,取其对应的种子液200μl于甘油管中,加入200μl 50%甘油并混匀,然后保存于
‑
20℃冰箱中。再取10μl种子液于10ml含0.1%(v/v)100g/l kan的lb液体培养基,于37℃,180rpm振荡培养7h以上,取200μl以上菌液送测,根据测序结果保留合适的突变体。
[0042]
(三)高效液相检测方法(hplc)进行复筛
[0043]
高效液相色谱法测定酶活力:将200μl粗酶液(100g/l湿菌体超声破碎后上清)加入到800μl含有蔗糖的50mm柠檬酸
‑
磷酸氢二钠缓冲液中(ph 6.0)(蔗糖终浓度为50g/l)。40℃反应30min后,沸水浴处理10min灭活。取离心后的上清液,用流动相稀释5倍,然后滤膜过滤,并用高效液相色谱仪测定稀释液中的异麦芽酮糖量。所用的液相色谱仪为waters2414;流动相为体积比4:1的乙腈和水混合液,流速为1.5ml/min;色谱柱为安捷伦zorbax糖分析专用色谱柱(规格4.6
×
250mm,载碳量3.5%,孔径70埃,粒径5μm,比表面积300m2/g,ph范围2.0~8.0);检测器为示差折光检测器;外部温度和柱温分别为35℃和30℃;进样量为10μl。高效液相色谱法标准曲线的标定:制备不同浓度(1mm、10mm、20mm、40mm、80mm和120mm)的蔗糖溶液和异麦芽酮糖溶液,分别用hplc法测定其峰面积,以蔗糖溶液(或异麦芽酮糖溶液)为横坐标、峰面积为纵坐标,绘制相关标准曲线。
[0044]
酶活力的定义:在ph 6.0和40℃条件下,1min内催化蔗糖异构化生成1μmol异麦芽酮糖所需的酶量,即为1个酶活力单位(u)。
[0045]
纯酶比活力计算公式如下:
[0046]
[0047]
在筛选了4500个突变体之后,获得了两个最优的突变体q209n,r456k,e.coli bl21(de3)/pet28b( )
‑
si
‑
q209n和e.coli bl21(de3)/pet28b( )
‑
si r456k酶活分别达到59u/mg,165u/mg,而野生型e.coli bl21(de3)/pet28b( )
‑
si酶活为39u/mg protein,突变体q209n和r456k比活性分别提高了1.5倍和4.2倍。
[0048]
实施例4:蔗糖异构酶定点饱和突变
[0049]
为了进一步筛选潜在活力提升菌株,先将实施例3中得到的蔗糖异构酶的q209和r456两个有益突变位点进行定点饱和突变,做进一步的筛选,pcr引物设计如表1所示,pcr体系(50μl)为:2*phanta max缓冲液25μl,dntps 1μl,突变上下引物各1μl,模板(出发菌株)1μl,pfu dna聚合酶0.5μl,补ddh2o至50μl。pcr条件为:95℃预变性3min:95℃变性15s,60℃退火15s,72℃延伸7min 20s,30个循环;72℃终延伸10min。pcr产物经过dna琼脂糖凝胶电泳验证,并通过dpni消化模板后,将pcr产物转化到大肠杆菌e.coli bl21(de3)感受态细胞中,转化后的产物涂布于含50μg/ml氨苄霉素抗性的lb平板上,37℃倒置培养过夜,对获得的突变体进行优势突变体的筛选,将获得优势菌株送杭州擎科生物技术有限公司进行测序确认,并保存。
[0050]
表1:蔗糖异构酶定点饱和突变引物设计
[0051][0052]
液相检测计算酶活方法同上实施例3。
[0053]
对蔗糖异构酶的q209和r456两个有益突变位点进行定点饱和突变之后,发现除了q209n和r456k作为有益突变点之外,突变体q209s和r456h酶活分别提高7.3倍和11.5倍,比突变体q209n和r456k提高的酶活幅度更大。然后,我们q209n和r456k突变体进行组合得到双重突变体e.coli bl21(de3)/pet28b( )
‑
si
‑
q209s/r456h,酶活达到最高为684u/mg,催化效率也达到最高为22.67s
‑1mm
‑1,是wt的16倍以上。
[0054]
表2:野生型和不同突变体蔗糖异构酶酶学表征
[0055][0056]
实施例5:利用重组大肠杆菌e.coli bl21(de3)/pet28b( )
‑
si
‑
q209s/r456h蔗糖
异构酶突变体催化底物蔗糖合成异麦芽酮糖。
[0057]
首先将原始菌体和突变体e.coli bl21(de3)/pet28b( )
‑
si
‑
q209s/r456h的温度和ph值进行优化。在不同的ph(从4.6到10.0)条件下进行反应以确定其最优ph值,不同ph条件下所用缓冲液分别为:100mm磷酸氢二钠缓冲液(ph 4.6
‑
7.5)、100mm tris
‑
hcl缓冲液(ph 7.5
‑
8.6)和100mm gly中
‑
naoh缓冲液(ph 8.6
–
10.0)。同时通过在不同温度(20
–
55℃)条件下测酶活性来研究ersiase的最适温度。
[0058]
结果表明,ersiase_wt和ersiase_q209s
‑
r456h的最适ph分别为6.5和6.0(图3b和3d)。如图3a和3c所示,纯化的ersiase_wt和ersiase_q209s
‑
r456h在40℃左右都具有最高的酶活性。
[0059]
最后在最适温度和ph反应条件下,利用全细胞进行催化反应。反应体系为600g/l蔗糖,重组大肠杆菌e.coli bl21(de3)/pet28b( )
‑
si
‑
q209s/r456h(高表达量)(0.1g/l干细胞)。反应条件:恒温水浴40℃,转速600rpm。在整个反应过程中,每隔30min间隔取样品(100μl),加入5μl 6m浓盐酸终止反应,然后处理样品,通过使用hplc测量蔗糖或者异麦芽酮糖浓度来确定转化率,反应进程曲线如图4所示。
[0060]
当底物蔗糖浓度为600g/l时,使用0.1g/l催化剂可在60min时转化率达到80.0%,最终3小时反应完,转化率达到93.6%。在相同的反应条件下,使用初始菌体(蔗糖异构酶wt),反应3小时完成后,转化率只能达到74.3%。相对于野生型蔗糖异构酶,e.coli bl21(de3)/pet28b( )
‑
si
‑
q209s/r456h蔗糖异构酶突变体在催化600g/l蔗糖底物时转化率提高了19.3%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。