1.本发明的方面大体上涉及筛查食管赘生物(neoplasm)或胃部赘生物的发病、发病倾向和/或进展的方法。更具体地,一些实施方式涉及通过对选定基因的组的甲基化模式或甲基化水平的变化进行筛查来筛查食管赘生物或胃部赘生物的发病、发病倾向和/或进展的方法。本文描述的实施方式可用于一系列应用,包括但不限于与食管赘生物或胃部赘生物(例如食管腺癌或胃部腺癌)的诊断和/或监测有关的应用。
背景技术:
2.胃肠癌是指胃肠道(gi道)和消化辅助器官(包括食管、胃、胆道系统、胰、小肠、大肠、直肠和肛门)的恶性病症。症状与受影响的器官有关,并可包括梗阻(导致吞咽或排便困难)、异常出血或其它相关问题。总的来说,相比身体的任何其它系统,gi道和消化辅助器官(胰、肝、胆囊)导致更多的癌症和更多的癌症死亡。
3.尽管gi道的器官分担共同的功能,即它们都以某种方式对消化过程有贡献,不过它们各自在其组织结构和功能方面都是完全不同且独特的器官。因此,不同胃肠癌症的比率、病因、病原学和预后存在显著差异,并且它们在病原学方面共享的共同点并不比它们与非胃肠癌症共享的多。
4.局限在构成gi道的一部分的器官壁内的浸润性癌症(例如tnm i期和ii期)通常可通过手术治愈。如果不治疗,它们扩散至区域淋巴结(例如tnm iii期),在这种情况下它们可通过手术和化学疗法的组合治愈。尽管化学疗法可以延长生存,转移到远端位点的癌症(例如tnm iv期)通常不可治愈,并且在极少数情况下,手术和化学疗法一起帮助患者治愈。
5.食管癌和胃癌都是常见的,并且通常呈现预后不良,主要是因为患者最常出现在显著的疾病进展发生之后,因此生存率不良。食管癌是世界第六常见的癌症,并且其发病率在增加,其中相对每名女性3至5名男性患病。食管的癌症通常发现得晚,因为通常没有早期症状。尽管如此,如果癌症被及时发现,患者可具有90%以上的五年生存率。然而,当食管癌通常被检测到时,它已经扩散到食管壁之外,并且生存率显著下降。在中国,晚期食管癌的总体五年生存率为约20%,在美国为约15%。胃癌是全球第四常见类型的癌症,并且是全球第二大癌症死亡原因。胃癌的最常见类型是腺癌。与食管癌一样,诊断通常很晚,虽然不一定是由于缺乏早期症状,而是因为许多症状也可能出现在其它疾病中,因此症状可能无法确定地诊断胃癌,直到疾病进展。
6.食管癌是从食管(喉和胃之间延伸的长肌肉管)出现的癌症。较晚期症状通常包括吞咽困难和体重减轻。其它症状可能包括吞咽时疼痛、声音嘶哑、锁骨周围淋巴结增大、干咳、以及可能咳血或吐血。该疾病的两个主要亚型是食管鳞状细胞癌(escc)(在发展中国家更常见)和食管腺癌(eac)(在发达国家更常见)。也出现了一些较不常见的类型。鳞状细胞癌起源于排列在食管的上皮细胞。腺癌倾向于起源于食管下三分之一处存在的腺细胞,通常是当鳞状细胞转化为腺细胞时(一种称为barrett食管的病症)。虽然这种转化的原因只是部分被了解,但胃食管反流病(gerd)或胆汁反流的长期侵蚀影响与这种类型的癌症强烈
相关。长期存在的gerd可引起响应于其鳞状内衬(lining)的侵蚀的食管下部细胞类型的变化。这种现象在女性中似乎比在男性中晚约20年出现,这可能是由于激素因素。
7.胃癌通常发生在胃的内衬。早期症状可包括消化不良、上腹痛、恶心和食欲不振。后来的体征和症状可包括体重减轻、皮肤和眼白变黄、呕吐、吞咽困难和便血等。这些都是可归因于多种原因的相当普遍的症状。
8.胃癌的特别常见的原因是细菌幽门螺杆菌(helicobacter pylori)感染,占高于60%的病例。约10%的病例发生在家族中,1%到3%之间的病例是由于从个人的父母遗传的遗传综合征(例如遗传性弥漫性胃癌)。胃癌倾向于在多年中分阶段发展。
9.食管癌的预后和治疗计划取决于做出诊断和建立临床分期的能力。经常进行钡餐研究。它为以后的内窥镜检查提供癌症嫌疑和肿瘤定位。然而,食管镜检查是做出诊断所必需的。它允许对barrett食管和肿瘤进行直接可视化和评价,并且可以用活检提供组织诊断。在这种情况下,可疑病变的单次活检为93%准确。通过增加多次活检(七次)和刷检(brushings),准确度可以提高至100%。根据美国癌症联合委员会制定的肿瘤
‑
结
‑
转移标准,超声探头结合常规内窥镜检查(内窥镜超声)可提供对疾病阶段的最准确的估计。超声通过以85%准确率评价五层食管壁,并以约80%准确率检测异常纵隔淋巴结转移来做到这一点。eus引导细针抽吸提高了这种准确性。
10.用于诊断和筛查胃癌的明确方法是重要的,因为它的表现经常模仿其它疾病过程,并且只有小的时间窗可能可治愈该疾病。每种不同的诊断方式都表现出优势和劣势。尽管有创且昂贵,但内窥镜检查是目前除开腹术之外获得确定的诊断的最具特异性和最敏感的方法,并且由于其活检能力已经取代了钡造影放射摄影术。它允许对病变直接可视化并有机会获得组织样品。对胃溃疡边缘和基部进行的带有7次活检的内窥镜检查对诊断所有阶段的胃癌具有98%的敏感性,相比于钡剂研究在早期胃癌中的敏感性仅14%。钡剂在皮革状胃(linitis plastica)(一种难以用内窥镜检查鉴别的弥漫型胃癌)的诊断中继续发挥重要作用。在处于出血风险中的区域进行刷拭活检。
11.由于人口统计学差异和疾病发病率的近期变化,对研究食管癌和胃癌二者的风险因素给予了很多重视。然而,尽管对这些疾病的了解有所增长,但低生存率仍然继续存在。食管癌和胃癌可能需要多年来发展,并且这些癌症的早期检测可以大大改善预后。然而,缺乏症状或相当非特异性的症状,加上主要仅存在侵入性和昂贵的诊断技术是可靠的,往往导致实际诊断发生在非常晚的阶段。甚至关于实施早期筛查方法的适度努力会引起癌症死亡下降。然而,简单、非侵入性且具有成本效益的筛查方法的缺乏使得无法实现这一点。大多数更敏感的测试都是颇具侵入性且昂贵的,因此患者的接受度低。因此,存在对开发更简单且信息量更大的诊断方案或诊断辅助的持续需求,使得能够将更具侵入性或昂贵的诊断方法用于有更大可能发展出癌(carcinoma)的人。简单且准确的筛查测试将使得能够建立更广泛适用的筛查系统。
12.在引出本发明的工作中,已确定bcat1和/或ikzf1基因的甲基化的变化指示食管赘生物和胃部赘生物(例如癌)的发展。更进一步,变得高甲基化的特定基因组dna胞嘧啶核苷酸的鉴别使得能够开发相当简单且特异性的扩增反应以在诊断的背景下常规使用。因此,可以基于对这两种差异甲基化基因中的一种或两种进行筛查来进行诊断。当考虑到以下时,这些数据是令人惊讶的:虽然已知bcat1和ikzf1在结直肠赘生物形成(neoplasia)中
高甲基化,但它们不是泛癌症标志物,并且已明确证实在表现出一些与食管组织和胃组织相同的组织学特征的赘生物性组织中保持不变。例如,胃组织、乳腺组织和前列腺组织各自本质上是腺性的。已证实这三种组织中每一种的腺细胞都引起腺癌,但乳腺腺癌和前列腺腺癌已反复被证明显示bcat1和ikzf1的甲基化没有变化。在食管组织和胃组织之间,这些器官完全不同,因此不会预期赘生物性标志物表达的任何相似性,并且完全是偶然的。它们的不同程度不仅体现在它们的组织学差异上,而且还进一步体现在功能差异上,例如如下事实:尽管幽门螺杆菌感染是gerd的常见病因和胃癌的风险因素,但它不是食管腺癌的风险因素,实际上似乎具有保护性作用。事实上,这种感染似乎与降低多达50%的食管腺癌风险有关。因此,本发明人已鉴别了有助于监测以食管和胃中赘生物形成为特征的病症和/或诊断赘生物形成的两种基因。
技术实现要素:
13.贯穿本技术文件和所附的权利要求,除非上下文另有要求,否则词语“包括/包含/含有(comprise)”和例如“包括/包含/含有(comprises)”和“包括/包含/含有(comprising)”的变体将被理解为暗示包括所陈述的整体或步骤、或者整体或步骤的组,但不排除任何其它整体或步骤、或者整体或步骤的组。
14.如本文所使用的术语“衍生自”应被用来指示特定的整体或整体的组源自指定的物种,但不一定直接从指定的来源获得。此外,除非上下文另有明确规定,否则如本文所使用的“一个/一种(a/an)”和“所述/该(the)”的单数形式包括复数所指对象。
15.除非另有定义,本文使用的所有技术术语和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。
16.本技术文件包含使用程序patentin version 3.5制作的核苷酸序列信息,在参考文献之后给出。每个核苷酸序列在序列表中通过数字指示符<210>后跟随序列标识符(例如<210>1、<210>2等)来标识。每个序列的长度、序列类型(dna等)和来源有机体分别由数字指示符字段<211>、<212>和<213>中提供的信息所指示。本技术文件中提及的核苷酸序列由指示符seq id no:后跟随序列标识符(例如seq id no:1、seq id no:2等)来标识。在申请文件中提到的序列标识符与序列表中数字指示符字段<400>中提供的信息相关,所述数字指示符字段<400>的后面是序列标识符(例如<400>1、<400>2等)。即,申请文件中详述的seq id no:1与序列表中指示为<400>1的序列相关。
17.本发明的一个方面涉及对个体中的食管赘生物或胃部赘生物的发病或发病倾向进行筛查或者对个体中的食管赘生物或胃部赘生物进行监测的方法,所述方法包括对来自所述个体的生物样品中选自以下的dna区域的甲基化状况进行评估:
18.(i)由如下hg19坐标所定义的区域,包含转录起始位点上游2kb:
19.(1)chr12:24962958..25102393,和/或
20.(2)chr7:5034437s...50472798;
21.或者
22.(ii)以下基因的基因区域,包括上游2kb:
23.(1)bcat1,和/或(2)ikzf1,
24.其中,相对于对照水平,组(i)和/或组(ii)的dna区域中的至少一个的甲基化水平
较高指示食管赘生物或胃部赘生物、或者食管赘生物性状态或胃部赘生物性状态的发病倾向。
25.在一个实施方式中,所述方法涉及对生物样品中的bcat1或ikzf1进行筛查。
26.在另一实施方式中,所述方法涉及对生物样品中的bcat1和ikzf1两者进行筛查。
27.在又一实施方式中,所述方法涉及筛查bcat1和ikzf1两者,但其中仅所述基因中的一种表现出较高水平的甲基化。
28.在进一步的实施方式中,所述方法涉及筛查bcat1和ikzf1两者,但其中所述基因中的两种均表现出较高水平的甲基化。
29.在又一实施方式中,所述对照水平是非赘生物性水平。
30.在又一实施方式中,所述对照水平是来自所述个体的先前筛查的生物样品的水平。
31.在又一实施方式中,所述赘生物是恶性的,例如癌。
32.在进一步的实施方式中,所述赘生物是非恶性的,例如腺瘤。
33.在又一进一步的实施方式中,所述赘生物是食管腺瘤或食管腺癌或者胃部腺瘤或胃部腺癌。
34.已确定表现出特定效用的亚区是:
35.(1)bcat1亚区:chr12:25101992
‑
25102093(seq id no:1或相应的负链)和chr12:25101909
‑
25101995(seq id no:2或相应的负链);以及
36.(2)ikzf1亚区:chr7:50343867
‑
50343961(seq id no:3或相应的负链)和chr7:50343804
‑
5033895(seq id no:4或相应的负链)。
37.不将本发明限制于任何一种理论或作用方式,对于每个基因标志物技术人员可以对一个或多个亚区进行筛查。
38.在一个实施方式中,所测试的甲基化标志物亚区为:
39.(1)由seq id no:1或seq id no:2或相应负链所定义的bcat1亚区;和
40.(2)由seq id no:3或seq id no:4或相应负链所定义的ikzf1亚区;
41.就本发明的方法包括分析ikzf1而言,可以评估以下一项或多项或者相对的dna链上n 1位处的相应胞嘧啶的甲基化:
[0042][0043]
在另一实施方式中,所述样品是手术切除、组织活检、唾液、尿液或血液样品(例如全血、血清、血浆、外泌体或血沉棕黄层)。
[0044]
更优选地,所述方法涉及对血浆衍生的无细胞dna(例如循环肿瘤dna)的甲基化进
行筛查。
[0045]
本发明的另一方面涉及对个体中的食管赘生物或胃部赘生物的发病或发病倾向进行筛查或者对个体中的食管赘生物或胃部赘生物进行监测的方法,所述方法包括对来自所述个体的生物样品中选自以下的dna区域的表达水平进行评估:
[0046]
(i)由如下hg19坐标所定义的区域,包括转录起始位点上游2kb:
[0047]
(1)chr12:24962958..25102393;和/或
[0048]
(2)chr7:50344378...50472798;
[0049]
或者
[0050]
(ii)以下基因的基因区域,包括上游2kb:
[0051]
(1)bcat1;和/或(2)ikzf1,
[0052]
其中,相对于对照水平,组(i)和/或组(ii)的dna区域中的至少一个的表达水平较低指示食管赘生物或胃部赘生物、或者赘生物性状态的发病倾向。
[0053]
本发明的相关方面提供了分子阵列,所述阵列包括以下的多项:
[0054]
(i)包含对应于上文所述的赘生物性标志物dna的任意两种或更多种的核苷酸序列或与其具有至少80%同一性的序列的核酸分子,或者所述核酸分子的功能衍生物、片段、变体或同源物;或者
[0055]
(ii)包含能够在中等严格性条件下与(i)的序列中的任意一种或多种杂交的核苷酸序列的核酸分子,或所述核酸分子的功能衍生物、片段、变体或同源物;或者
[0056]
(iii)包含能够在中等严格性条件下与(i)的序列中的任意两种或更多种杂交的核苷酸序列的核酸探针或寡核苷酸,或所述核酸分子的功能衍生物、片段、变体或同源物;或者
[0057]
(iv)能够与由(i)的核酸分子所编码的蛋白质中的任意两种或更多种结合的探针,或其衍生物、片段或同源物,
[0058]
其中,(i)
‑
(iii)的所述标志物基因或(iv)的蛋白质的表达水平指示衍生自食管或胃的细胞或细胞亚群的赘生物性状态。
[0059]
因此,本文提供的一些实施方式通过以下编号的替代方式进行描述:
[0060]
1.一种对个体中的食管赘生物或胃部赘生物的发病或发病倾向进行筛查或者对个体中的食管赘生物或胃部赘生物进行监测的方法,所述方法包括对来自所述个体的生物样品中选自以下的dna区域的甲基化状况进行评估:
[0061]
(i)由如下hg19坐标所定义的区域,包括转录起始位点上游2kb:
[0062]
(1)chr12:24962958..25102393;和/或
[0063]
(2)chr7:50344378...50472798;
[0064]
或者
[0065]
(ii)以下基因中的任意两个或更多个的基因区域,包括上游2kb:
[0066]
(1)bcat1和/或(2)ikzf1,
[0067]
其中,相对于对照水平,组(i)和/或组(ii)的dna区域中的至少一个的甲基化水平较高指示食管赘生物或胃部赘生物、或者食管赘生物或胃部赘生物的发病倾向,以及任选地在所述甲基化水平高于所述对照水平时,提供、指导或建议所述个体接受结肠镜检查、恶性组织的手术移除、和/或放射、化学疗法或免疫疗法。
[0068]
2.一种对个体中的食管赘生物或胃部赘生物的发病或发病倾向进行筛查或者对个体中的食管赘生物或胃部赘生物进行监测的方法,所述方法包括对来自所述个体的生物样品中选自以下的dna区域的表达水平进行评估:
[0069]
(i)由如下hg19坐标所定义的区域,包含转录起始位点上游2kb:
[0070]
(1)chr12:24962958..25102393;和/或
[0071]
(2)chr7:50344378...50472798;
[0072]
或者
[0073]
(ii)以下基因的基因区域,包括上游2kb:
[0074]
(1)bcat1和/或(2)ikzf1;
[0075]
其中,相对于对照水平,组(i)和/或组(ii)的dna区域中的至少一个的表达水平较低指示食管赘生物或胃部赘生物、或者赘生物的发病倾向,以及任选地在所述甲基化水平低于所述对照水平时,提供、指导或建议所述个体接受结肠镜检查、恶性组织的手术移除、和/或放射、化学疗法或免疫疗法。
[0076]
3.根据替代方式1或2所述的方法,其中,所述方法涉及对所述生物样品中的bcat1或ikzf1进行筛查。
[0077]
4.根据替代方式1或2所述的方法,所述方法涉及对所述生物样品中的bcat1和ikzf1两者进行筛查。
[0078]
5.根据替代方式4所述的方法,其中,所述bcat1和ikzf1中仅一种表现出被调节的甲基化或表达。
[0079]
6.根据替代方式4所述的方法,其中,所述bcat1和ikzf1中的两者均表现出被调节的甲基化或表达。
[0080]
7.根据替代方式1
‑
6中任一项所述的方法,其中,所述赘生物是恶性赘生物。
[0081]
8.根据替代方式7所述的方法,其中,所述恶性赘生物为腺癌。
[0082]
9.根据替代方式1
‑
6中任一项所述的方法,其中,所述赘生物不是恶性的。
[0083]
10.根据替代方式9所述的方法,其中,所述非恶性赘生物为腺瘤。
[0084]
11.根据替代方式1
‑
10中任一项所述的方法,其中,所述对照水平为非赘生物性水平。
[0085]
12.根据替代方式1
‑
10中任一项所述的方法,其中,所述对照水平为来自所述个体的先前筛查的生物样品的水平。
[0086]
13.根据替代方式12所述的方法,其中,相对于所述对照水平而言甲基化水平降低或者相对于所述对照水平而言dna表达水平增加指示所述赘生物的清除。
[0087]
14.根据替代方式1
‑
13中任一项所述的方法,其中,所述赘生物为胃部赘生物。
[0088]
15.根据替代方式1
‑
13中任一项所述的方法,其中,所述赘生物为食管赘生物。
[0089]
16.根据替代方式1
‑
15中任一项所述的方法,其中,所述生物样品为手术切除、组织活检、唾液、尿液或血液样品。
[0090]
17.根据替代方式16所述的方法,其中,所述血液样品为全血、血清、血浆、外泌体或血沉棕黄层。
[0091]
18.根据替代方式17所述的方法,其中,所述dna甲基化筛查涉及无细胞dna。
[0092]
19.根据替代方式18所述的方法,其中,所述无细胞dna为循环肿瘤dna。
[0093]
20.根据替代方式1所述的方法,其中,对选自以下的一个或多个染色体亚区中的所述甲基化进行评估:
[0094]
(1)bcat1亚区:chr12:25101992
‑
25102093(seq id no:11或相应的负链)和chr12:25101909
‑
25101995(seq id no:16或相应的负链);
[0095]
(2)ikzf1亚区:chr7:50343867
‑
50343961(seq id no:2或相应的负链)和chr7:50343804
‑
5033895(seq id no:24或相应的负链)。
[0096]
21.根据替代方式20所述的方法,所述方法包括对选自以下的一个或多个胞嘧啶残基或者相对的dna链上n 1位处的相应胞嘧啶的甲基化进行评估:
[0097]
(ikzf1)
[0098][0099]
22.根据替代方式2所述的方法,其中,所述表达水平为mrna表达或蛋白质表达。
[0100]
23.根据替代方式1
‑
22中任一项所述的方法,其中,所述哺乳动物为人。
附图说明
[0101]
为了描述可以获得本发明的上述列举的优点和特征以及其它优点和特征的方式,将通过参考在附图中示出的本发明的特定实施方式来给出更具体的描述。理解这些附图仅描绘典型实施方式并且因此不被认为是对其范围的限制,将通过使用附图进一步具体且详细地描述和解释本发明。
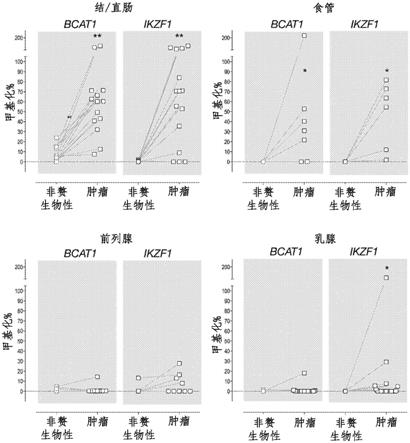
[0102]
图1是赘生物性和非赘生物性的结直肠组织、食管组织、前列腺组织和乳腺组织中bcat1和ikzf1的%甲基化水平的图示。
具体实施方式
[0103]
除非另外定义,否则本文使用的所有技术术语和科学术语具有与本领域普通技术人员通常理解的含义相同的含义。除非另有说明,以引用的方式将本文引用的所有专利、申请、公开的申请和其它出版物以其整体明确地并入。本文中的术语有多种定义的情况中,除非另有说明,以本节中的定义为准。
[0104]
冠词“一个/一种”(a和an)在本文中用于指该冠词的一个或多于一个(例如至少一个)的语法对象。举例来说,“一个/一种要素”表示一个/一种要素或多于一个/一种的要素。
[0105]
如本文所使用的术语“约(about)”或“大约(around)”意味着相对于参考数量、水平、值、数值、频率、百分比、尺寸、大小、量、重量或长度变化多达30%、25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0.5%的数量、水平、值、数值、频率、百分
比、尺寸、大小、量、重量或长度。
[0106]
在整个申请文件中,除非上下文另有要求,词语“包含/包括/含有”将被理解为暗示囊括所指明的步骤或要素或者步骤或要素的组,但不排除任意其它的步骤或要素或者步骤或要素的组。
[0107]“由......组成”意味着包括并限于跟随短语“由......组成”的任意事物。因此,短语“由......组成”表示所列的要素是必需的或强制性的,并且没有其它要素可存在。“基本上由......组成”意味着包括在该短语之后列出的任意要素,并且限于不干扰或有助于本公开中针对所列的要素指明的活性或作用的其它要素。因此,短语“基本上由......组成”表示所列的要素是必需的或强制性的,但是其它要素是任选的并且可存在或不存在,取决于它们是否实质上影响所列的要素的活性或作用。
[0108]
除非特别相反地指出,否则本公开的实践将采用分子生物学和重组dna技术的常规方法,其中的许多在下文中出于说明的目的而描述。此类技术是本领域普通技术人员已知和常用的。
[0109]
本公开涉及癌症或肿瘤的分期以确定所述癌症或肿瘤在患者内扩散的进展。公认的实体瘤分类标准是tnm分类标准,该标准基于肿瘤的大小(t)、扩散到淋巴结的程度(n)和转移(m)来对肿瘤进行区分。这些分类进一步分组为阶段,其中,0期生长为非恶性赘生物,i期肿瘤和ii期肿瘤被包含在局部,iii期肿瘤已扩散到附近的淋巴结,而iv期肿瘤已转移。虽然tnm标准是广泛使用的分类方法,也可以采用可代表特定癌症类型的行为的替代或改进的标准。因此,虽然这些标准对于确定进展而言有用,但癌症或肿瘤的早期或晚期的预后独立于具体分类。
[0110]
本发明部分地基于表征食管赘生物和胃部赘生物的dna甲基化状况的阐明。该发现现在促进开发基于某些基因相对于对照水平的甲基化增加来筛查食管赘生物和胃部赘生物的发病或发病倾向或者监测食管赘生物和胃部赘生物的常规方法。根据本发明,确定了在甲基化的差异变化方面,基因bcat1和/或ikzf1可以被改变,这取决于所讨论的细胞是否是赘生物性的。应当理解的是,所讨论的基因在本文中通过参考它们的名称和它们的染色体坐标来进行描述。就列出与基因名称对应的染色体坐标而言,这些坐标与2009年2月发布的人类基因组数据库版本hg19相一致(本文中称为“hg19坐标”)。还应当理解的是,bcat1和ikzf1在本文中也被称为标志物的“组”。
[0111]
因此,本发明的一个方面涉及对个体中的食管赘生物或胃部赘生物的发病或发病倾向进行筛查或者对个体中的食管赘生物或胃部赘生物进行监测的方法,所述方法包括对来自所述个体的生物样品中选自以下的dna区域的甲基化状况进行评估:
[0112]
(i)由如下hg19坐标所定义的区域,包括转录起始位点上游2kb:
[0113]
(1)chr12:24962958..25102393;和/或
[0114]
(2)chr7:50344378...50472798;
[0115]
或者
[0116]
(ii)以下基因的基因区域,包括上游2kb:
[0117]
(1)bcat1;和/或(2)ikzf1;
[0118]
其中,相对于对照水平,组(i)和/或组(ii)的dna区域中的至少一个的甲基化水平较高指示食管赘生物或胃部赘生物、或者食管或胃部赘生物性状态的发病倾向。
[0119]
就本发明涉及其中dna区域(标志物)“中的一个”表现出较高甲基化水平的方法的实施方式而言,这些实施方式被设计为基于组中的任一标志物被高甲基化而取得结果。应当理解的是,不一定是相同的标志物在每个样品中被高甲基化。相反,只是构成所述组的部分的标志物之一被高甲基化。还应当理解的是,对于一些样品,所述组的两个标志物均可被高甲基化。
[0120]
提及“食管”,通常称为食物管或食道(gut),应理解为对食物穿过其中从咽到胃的器官的提及。不将本发明限制于任何一种理论或作用方式,食管是纤维肌肉管,在成人中约25cm长,其在气管和心脏后经过,穿过膈并流入到胃的最上部区域。食管是消化系统的上部部分之一。食管开始于口腔后部,在其上部区段上有味蕾。食管在顶部和底部被两个肌肉环包围,分别称为食管上括约肌和食管下括约肌。仍然不以任何方式限制本发明,在没有吞咽食物时这些括约肌发挥闭合食管的作用。食管上括约肌围绕食管的上部部分并由骨骼肌组成,但不受自主控制。食管下括约肌或胃食管括约肌在食管和胃之间的接合处围绕食管的下部部分。它也被称为贲门括约肌或贲门食管括约肌。胃食管接合处(也称为食管胃接合处)是食管和胃之间的接合处,位于食管的下端。从食管黏膜到胃黏膜的过渡可以看作不规则的锯齿形线,通常称为z线。组织学检查揭示食管的分层鳞状上皮和胃的简单柱状上皮之间的突然转变。通常,胃贲门紧邻z线的远端,z线与贲门胃皱襞的上限重合。然而,当barret食管中黏膜解剖结构发生扭曲时,胃食管接合处可以通过胃皱襞的上限而不是黏膜过渡来识别。食管下括约肌的功能位置通常位于z线下方约3cm。食管的壁从腔向外由黏膜、黏膜下层(结缔组织)、纤维组织层之间的肌纤维层、和结缔组织外层组成。黏膜是约三层鳞状细胞的分层鳞状上皮,这与胃的单层柱状细胞形成对比。尽管横纹肌在其上三分之一占优势,但大部分肌肉是平滑肌。因此,提及“食管”应理解为对上述结构的任何部分的提及。
[0121]
提及“胃部的”应理解为对胃的提及,胃是胃肠道中的肌肉性、中空器官。胃表现出扩张的结构,并作为重要的消化器官发挥作用。它在腹腔左上部,位于食管和小肠之间。它分泌消化酶和胃酸来帮助食物消化。幽门括约肌控制部分消化的食物(食糜)从胃进入十二指肠,在十二指肠中蠕动接管以使其移动通过其余的肠。在人中,胃位于食管和十二指肠之间。被称为大网膜的脏腹膜的大双褶皱从胃的大弯处垂下。两个括约肌保持所含的胃的内容物;食管和胃的接合处的食管下括约肌(见于贲门区域),以及胃与十二指肠接合处的幽门括约肌。
[0122]
人的胃从贲门开始分为四个部分,每个部分包括不同的细胞和功能。
[0123]
贲门是食管内容物排空入胃的地方。
[0124]
胃底形成于上部弯曲部分中。
[0125]
胃体是胃的主要的中央区域。
[0126]
幽门是将其内容物排入十二指肠的胃的下部部分。
[0127]
贲门被定义为胃食管接合处的“z线”之后的区域,在该点处上皮从分层的鳞状变为柱状。靠近贲门的是食管下括约肌。在不以任何方式限制本发明的情况下,贲门不是胃的解剖学上不同的区域,而是食管内衬的区域。
[0128]
人胃壁由外黏膜、内黏膜下层、外肌层和浆膜组成。胃的胃黏膜由上皮和固有层(由松散的结缔组织构成)组成,有层薄的平滑肌(称为黏膜肌层)将其与下方的黏膜下层分开。黏膜下层位于黏膜下方,并由纤维结缔组织组成,将黏膜与下一个层分开。迈斯纳神经
丛出现在该层。外肌层位于黏膜下层下方,与胃肠道的其它器官不同,由三层组成:
[0129]
内斜层:该层负责产生搅动和物理分解食物的运动。它是这三层中未出现在消化系统的其它部分的唯一的层。相比胃底,胃窦在其壁中具有较厚的皮肤细胞,并且进行更有力的收缩。
[0130]
中环层:在该层,幽门被厚的环形肌肉壁包围,该壁通常紧张性收缩,形成功能性幽门括约肌,其控制食糜进入十二指肠的移动。
[0131]
奥尔巴赫神经丛(auerbach's plexus)(肌间神经丛)见于外纵层和中环层之间,并负责两者的神经支配。
[0132]
外纵层负责通过肌肉缩短将食团向胃的幽门移动。
[0133]
胃还具有由与腹膜连续的结缔组织层组成的浆膜。在人中,在胃腺的不同层处发现了不同类型的细胞。这三种腺体都位于胃黏膜内的胃小凹下方。贲门腺见于胃贲门中,包围着食管连接至胃的开口。此处只发现了贲门腺,它们主要分泌黏液。它们的数量比其它胃腺少,并且较浅地定位在黏膜中。胃底腺存在于胃底和胃体中,幽门腺位于幽门窦中。它们分泌由它们的g细胞所产生的胃泌素。提及“胃”应理解为对上述所述的任何区域的提及。
[0134]
提及“赘生物”应理解为对包含赘生物性细胞的病灶、肿瘤、或其它包裹或未包裹的团块或生长的其它形式。“赘生物性细胞”应理解为对表现出异常生长的细胞的提及。术语“生长”应以其最广泛的意义来理解并包括对增殖的提及。在这方面,异常细胞生长的实例是细胞不受控的增殖。另一实例是细胞凋亡失败,从而将其通常的寿命延长。赘生物性细胞可为良性细胞或恶性细胞。提及良性赘生物包括非恶性赘生物、癌前赘生物或其它癌前状态。在优选的实施方式中,目标赘生物为腺瘤或腺癌。在对其没有明确规定的情况中,提及“腺瘤”应理解为也指发育异常。不将本发明限制于任何一种理论或作用方式,腺瘤通常为从上皮组织衍生而来或表现出明确定义的上皮结构的上皮来源的良性肿瘤。这些结构可能呈现腺体外观,通常在组织学上以发育异常为特征。可在腺瘤内包含恶性细胞群,例如随着良性腺瘤或良性赘生物性病灶向恶性腺癌的发展而发生。
[0135]
优选地,所述赘生物性细胞为腺瘤、发育异常或腺癌,甚至更优选为食管的或胃部的腺瘤、发育异常或腺癌。
[0136]
提及“dna区域”应理解为对基因组dna的特定部分的提及。这些dna区域通过引用基因名称或一组染色体坐标来指定。基因名称和染色体坐标都是本领域技术人员公知并了解的。如前所述,染色体坐标对应于基因组的hg19版本。通常,基因可以通过参考其名称(通过该方式可以常规获得其序列和染色体位置)或者通过参考其染色体坐标(通过该方式也可常规获得基因名称和其序列)进行常规鉴别。
[0137]
提及上文详述的每个基因/dna区域应理解为对这些分子的所有形式及其片段或变体的提及。如本领域技术人员将理解的,已知一些基因在个体之间表现出等位基因变异或单核苷酸多态性。snp涵盖不同大小的插入和缺失以及简单的序列重复,例如二核苷酸和三核苷酸重复。变体包括来自相对于本文所述的dna区域具有至少90%、95%、98%或99%序列同一性的相同区域的核酸序列,即具有一个或多个缺失、添加、置换、反向序列等。因此,本发明应被理解为扩展至此类变体,就当前的诊断应用而言,尽管个体之间可能存在实际核酸序列之间的微小遗传变异,但这些变体取得相同的结果。因此,本发明应被理解为扩展到由任何其它突变、多态性或等位基因变异产生的所有形式的dna。
[0138]
应当理解的是,作为测试对象的“个体”可以是任何人或非人哺乳动物。非人哺乳动物的实例包括灵长类动物、家畜动物(例如马、牛、羊、猪或驴)、实验室测试动物(例如小鼠、大鼠、兔或豚鼠)、伴侣动物(例如狗或猫)或圈养野生动物(如鹿或狐)。
[0139]
优选地,所述哺乳动物为人。
[0140]
根据这些方面和实施方式,在又一实施方式中,所述对照水平是非赘生物性水平。
[0141]
在一个实施方式中,所述方法涉及对生物样品中的bcat1或ikzf1进行筛查。
[0142]
在另一实施方式中,所述方法涉及对生物样品中的bcat1和ikzf1两者进行筛查。
[0143]
在另一实施方式中,所述方法涉及对bcat1和ikzf1两者进行筛查,但其中所述基因中仅一种表现出较高水平的甲基化。
[0144]
在进一步的实施方式中,所述方法涉及对bcat1和ikzf1两者进行筛查,但其中所述基因中的两种均表现出较高水平的甲基化。
[0145]
在又一实施方式中,所述赘生物是恶性的,例如腺癌。
[0146]
在进一步的实施方式中,所述赘生物是非恶性的,例如腺瘤或发育异常。
[0147]
在筛查这些基因区域的甲基化方面,应当理解的是,可将测定设计为筛查本文所列的特定区域(对应于基因的“正”链)或互补的“负”链。基于本文提供的染色体坐标来选择对哪条链进行分析以及靶向那条链完全在本领域技术人员的技能范围内。在一些情况下,可以建立测定来筛查两条链。
[0148]
应当理解,可以专门筛查指定的标志物的组,或者可以选择额外地筛查其它标志物,例如其它dna高甲基化标志物、其它rna表达水平标志物或其它蛋白质标志物。这些其它标志物可以例如提供与所讨论的患者的健康状况有关的额外信息。
[0149]
不将本发明限制于任何一种理论或作用方式,尽管跨这些dna区域测量甲基化水平可用于诊断食管或胃部的赘生物性状况,但已确定离散的亚区在这方面特别有用,因为这些亚区含有高密度的cpg二核苷酸,所述cpg二核苷酸在食管赘生物或胃部赘生物(如食管癌或胃癌)中经常被高甲基化。该发现使这些亚区成为对分析而言特别有用的靶标,因为它既简化了筛查程序,因为需要分析的dna区域更短更明确限定,而且,来自这些区域的结果将在关于高甲基化存在与否方面提供与如果跨整个dna区域进行分析将获得的相比显著更明确的结果。因此,该发现既简化了筛查程序,又提高了赘生物形成诊断的敏感性和特异性。
[0150]
参考它们在其中被发现的基因和染色体区域,已确定表现出特定效用的亚区列于下方:
[0151]
(1)bcat1亚区:chr12:25101992
‑
25102093(seq id no:1或相应的负链)和chr12:25101909
‑
25101995(seq id no:2或相应的负链);以及
[0152]
(2)ikzf1亚区:chr7:50343867
‑
50343961(seq id no:3或相应的负链)和chr7:50343804
‑
5033895(seq id no:4或相应的负链)。
[0153]
不将本发明限制于任何一种理论或作用方式,对于每个基因标志物技术人员可以对一个或多个亚区进行筛查。
[0154]
在一个实施方式中,对于每个所选定的基因标志物进行测试的甲基化标志物亚区为:
[0155]
(1)由seq id no:1或seq id no:2或相应的负链所定义的bcat1亚区;和
[0156]
(2)由seq id no:3或seq id no:4或相应的负链所定义的ikzf1亚区;
[0157]
不将本发明限制于任何一种理论或作用方式,dna甲基化在细菌、植物和动物中是普遍的。dna甲基化是dna的一种化学修饰形式,它在多轮细胞分裂中稳定,但不涉及有机体的基础dna序列的变化。染色质和dna修饰是表观遗传学的两个重要特征,在细胞分化过程中发挥作用,使细胞尽管含有相同的基因组物质,但仍能稳定保持不同的特征。在真核有机体中,dna甲基化仅发生在胞嘧啶嘧啶环的5号碳上。在哺乳动物中,dna甲基化主要发生在cpg二核苷酸胞嘧啶的5号碳上。cpg二核苷酸占约1%的人基因组。
[0158]
所有cpg的70%
‑
80%被甲基化。cpg可被分组为称为“cpg岛”的簇,它们存在于许多基因的5'调控区中,并且经常未甲基化。在许多疾病过程(例如癌症)中,基因启动子和/或cpg岛获得异常高甲基化,这与可遗传的转录沉默有关。dna甲基化可以两种方式影响基因的转录。首先,dna的甲基化本身可在物理上阻碍转录蛋白结合至基因,从而阻断转录。第二,甲基化的dna可被称为甲基
‑
cpg
‑
结合结构域蛋白(mbd)的蛋白所结合。然后,mbd蛋白将额外的蛋白(例如可修饰组蛋白的组蛋白去乙酰化酶和其它染色质重塑蛋白)募集至基因座,从而形成致密的、无活性的染色质,称为沉默染色质。dna甲基化和染色质结构之间的这种联系非常重要。特别是,甲基
‑
cpg结合蛋白2(mecp2)的缺失与rett综合征有关,并且甲基
‑
cpg结合结构域蛋白2(mbd2)介导癌症中高甲基化基因的转录沉默。
[0159]
在人中,dna甲基化过程由三种酶进行,dna甲基转移酶1、3a和3b(dnmt1、dnmt3a、dnmt3b)。认为dnmt3a和dnmt3b是在发育早期建立dna甲基化模式的从头甲基转移酶。dnmt1是拟议的维持甲基转移酶,负责在dna复制过程中将dna甲基化模式复制到子链。dnmt3l是与其它dnmt3同源但没有催化活性的蛋白质。相反,dnmt3l通过增加它们对dna结合的能力并刺激它们的活性来协助从头甲基转移酶。最后,dnmt2已被鉴别为“神秘的(enigmatic)”dna甲基转移酶同源物,其包含所有dna甲基转移酶共有的所有10个序列基序;然而,dnmt2不可甲基化dna,而是已证实使小rna甲基化。
[0160]
因此,“甲基化状况”应理解为对dna区域内一个或多个特定核苷酸处的甲基化的存在、不存在和/或数量或水平的提及。特定dna序列(例如本文所述的dna区域)的甲基化状况可指示序列中每个碱基的甲基化状态或可指示序列内的碱基对子集的甲基化状态(例如序列内的一个或多个特定限制性酶识别序列的甲基化状态或胞嘧啶的甲基化状态),或者可指示关于序列内区域甲基化密度的信息,而无需提供甲基化发生在序列中的何处的精确信息。甲基化状态可以任选地由“甲基化值”表示或指示。例如,甲基化值可以通过在用甲基化依赖性限制性酶进行限制性消化后对存在的完整dna的量进行量化来生成。在该实例中,如果使用定量pcr对dna中的特定序列进行量化,则约等于模拟处理的对照的模板dna的量指示该序列没有高度甲基化,而实质上低于模拟处理的样品中所出现的量的模板的量指示该序列处存在甲基化dna。因此,例如来自上述所述实例的值、甲基化值代表甲基化状况,并且因此可以用作甲基化状况的量化指标。当期望将样品中序列的甲基化状况与阈值进行比较时,这特别有用。
[0161]
本发明的方法基于生物样品的特定dna区域的甲基化水平与这些dna区域的对照甲基化水平的比较。“对照水平”可为“正常水平”,其为非赘生物性的相应的胃部或食管的细胞或细胞群的dna区域的甲基化水平,或者可从中分离dna用于测定的另一生物样品中相应的胃部或食管的细胞或细胞群的dna区域的甲基化水平。
[0162]
正常(或“非赘生物性”)甲基化水平可以使用衍生自作为测试受试者的同一个体的非赘生物性组织来确定。然而,可以理解的是,这对有关个体来说可能是相当侵入性的,因此,相对于从所讨论的患者以外的个体获得的集体结果或反映个体的标准结果来分析测试结果可能更为方便。该后一种分析形式实际上是优选的分析方法,因为它使得能够设计需要收集和分析单个生物样品(为感兴趣的测试样品)的试剂盒。提供正常甲基化水平的标准结果可以通过本领域技术人员公知的任何合适方式进行计算。例如,关于本发明的基因的甲基化水平,可以对正常组织的群体进行评估,从而提供标准值或值范围,所有未来的测试样品都针对所述标准值或值范围进行分析。还应当理解的是,正常水平可以从特定组群的受试者中来确定并且用于关于衍生自该组群的测试样品。因此,可以确定与组群相对应的多个标准值或范围,所述组群在例如年龄、性别、族群或健康状况等特征方面不同。所述“正常水平”可为离散的水平或水平范围。受试者基因的甲基化水平相对于正常水平增加指示组织为赘生物性的。
[0163]
术语“甲基化”应理解为意指通过dna甲基转移酶的作用添加到核酸区域(例如基因组dna)中的一个或多个胞嘧啶碱基的甲基的存在。如本文所述,对于确定核酸甲基化水平或程度存在本领域技术人员已知的若干方法来。
[0164]“较高水平”是指相比对照样品,在所诊断的受试者中存在较高数量的甲基化的cpg二核苷酸,即在特定cpg位点处甲基化的dna分子的比例较高或者受试者中存在较高数量的分开的甲基化cpg位点。应当理解,术语“增强”和“增加/提高”与术语“较高”可互换使用。所诊断的受试者中较高数量的甲基化cpg二核苷酸可为比对照样品中多1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、96%、97%、98%、99%、100%、200%、300%、400%、或500%、或由上述百分比中的任何两个所定义的范围内的任何数量。
[0165]
关于检测“较高水平”的甲基化,应当理解的是,在一些情况下,正常水平将实际上对应于不存在任何可检测的甲基化,而赘生物性水平将对应于甲基化存在本身。在这种情况下,诊断方法相对简单,因为只需要单单筛查甲基化的存在(例如,仅进行定性评估),而不用评估相对于对照甲基化水平的甲基化水平(该分析必然涉及量化测量)。不以任何方式限制本发明,在血液衍生的样品中观察到,例如,在一些标志物的情况下,赘生物形成时该标志物的甲基化变化是从不可检测的甲基化水平转变为存在可检测的甲基化。在这些情况下,可以进行相对简单的定性评估,其中只需筛查测试样品以确定是否存在甲基化。在本文提供的定义的上下文中,提及“较高水平”涵盖标志物的甲基化水平的相对增加或在先前无明显甲基化的情况下甲基化发生。如前文所详述的,可以为每个患者重新评估对照水平,或者可以存在针对其对所有测试样品进行评估的标准结果。如果已知感兴趣的标志物上不存在甲基化,则只需要筛查是否存在甲基化,因为对照水平是不存在甲基化,并且因此“较高水平”为存在任意量的甲基化。
[0166]
还应当理解的是,对照水平可为来自另一个体(例如,健康受试者或患有癌症的受试者)或来自同一测试个体的先前测试的生物样品的甲基化水平。如下文更详细地讨论的,这在监测患者的复发、治疗功效等的情况下特别有用。
[0167]
本发明不限于被认为可诊断受试者中赘生物形成的甲基化残基的精确数量,因为患者样品之间会发生一些变化。本发明也不限于甲基化残基的定位。
[0168]
不过,也已经鉴定了在这些亚区内经历高甲基化的许多特定胞嘧啶残基。因此,在另一实施方式中,可以采用筛查方法,该方法特异性涉及对这些残基或相对dna链上n 1位处的相应胞嘧啶中的一个或多个的甲基化状况进行评估。
[0169]
本领域技术人员应当理解的是,这些个体的残基通过参考hg19进行编号,这也对应于上文列出的特定亚区的编号,并且在每个亚区的坐标编号应用于序列表中提供的相应亚区序列时其可以被进一步鉴别。应当理解的是,这些残基已在所述亚区dna的背景下被鉴别。然而,在亚区本身之外但在亚区所衍生自的较大dna区域内存在被高甲基化的其它残基。因此,这些特定的残基代表在本文公开的dna区域和亚区的背景下经历高甲基化的个体胞嘧啶残基的特别有用的子集。这些个体的残基根据它们所存在的dna区域而分组如下。这些dna区域通过参考hg19染色体坐标和基因区域名称二者而被识别。
[0170]
就本发明的方法包括分析ikzf1而言,所述目标残基为以下或位于相对dna链上n 1位处的相应胞嘧啶:
[0171][0172]
本发明的检测方法可以在任何合适的生物样品上进行。为此,提及“生物样品”应理解为对衍生自动物的生物材料的任何样品的提及,例如但不限于细胞材料、生物流体(例如血液)、组织活检样本、唾液、尿液、手术样本或被引入动物体内并随后被取出的流体。根据本发明的方法测试的生物样品可以直接进行测试,或者在测试之前可能需要一种形式的处理。例如,活检或手术样品可能需要在测试前均质化,或者可能需要切片以原位测试个体基因的定性表达水平。或者,细胞样品可能需要在测试前进行透化。此外,在生物样品不是液体形式的情况下(如果测试需要此类形式),可能需要添加试剂(例如缓冲剂)以使样品移动化。
[0173]
就感兴趣的dna区域存在于生物样品中的情况而言,可以直接测试生物样品,或者可以在测试之前分离生物样品中存在的全部或一些核酸。在又一实例中,可以在分析之前对样品进行部分纯化或进行富集。例如,就生物样品包含非常多样的细胞群的情况而言,对特别感兴趣的亚群进行富集可能是期望的。在本发明的范围内的是,在测试之前对靶标细胞群或由其衍生的分子进行处理,例如,活病毒的灭活。还应该理解的是,生物样品可以是新鲜收获的,或者在测试之前被储存过(例如通过冷冻),或者在测试之前被处理过(例如通过经历培养)。
[0174]
根据本文公开的方法选择何种类型的样品最适合测试将取决于情况的性质。优选地,所述样品是手术切除样品、组织活检样品或血液样品(例如全血、血清、血浆、外泌体或血沉棕黄层)。提及“血沉棕黄层”应理解为对血液密度梯度离心后包含大部分白血球和血
小板的抗凝血液样品级分的提及。
[0175]
提及如本文所使用的“外泌体”应理解为约10nm至100nm的膜结合胞外囊泡,其在质膜与含有腔内囊泡的内体多囊泡体融合期间从细胞释放。这些外泌体携带生物分子,包括但不限于脂质、蛋白质、rna、dna、胆固醇、鞘脂类、神经酰胺、脂肪酸、磷脂类、表面标志物、抗原呈递蛋白、主要组织相容性复合物、粘附素、免疫抑制蛋白、细胞骨架蛋白、运输蛋白(trafficking proteins)、信使rna(mrna)、微小rna(mirna)、长非编码rna(lncrna)、双链dna(dsdna)、基因组dna(gdna)、外泌体dna、甲基化dna或它们的任意组合,所述生物分子来源自起源细胞的胞质,并可以通过这些成分对其它细胞产生下游影响。外泌体牵涉于许多癌症增殖过程中,例如侵入至附近组织、建立转移前生境(pre
‑
metastatic niches)、迁移、转移、免疫调节和血管生成。来自正常细胞和患病细胞两者的外泌体可见于生物流体中,例如血液、尿液、淋巴液和脑脊液。因此,使用外泌体的非侵入性或微侵入性诊断可以帮助确定疾病(例如癌症)的发病或发病倾向。可以使用本领域已知的技术从所述生物流体或从体外细胞培养基中纯化外泌体,所述技术包括但不限于离心、超速离心、密度梯度超速离心、过滤、超滤、色谱、尺寸排阻色谱、亲和色谱、沉淀、或微流控,或它们的任意组合。纯化的外泌体可以使用本领域已知的技术进行加工(例如提取脂质、蛋白质、rna或dna组成)用于后续分析,包括但不限于聚合酶链式反应(pcr)、定量pcr(qpcr)、逆转录pcr(rtpcr)、质谱、色谱、电泳、测序、或添加至其它体内或体外生物系统中以诱导效应。
[0176]
更优选地,所述生物样品为血液样品或活检样品。
[0177]
更优选地,所述方法涉及对血浆衍生的无细胞dna(例如循环肿瘤dna)的甲基化进行筛查。
[0178]
如前文所详述的,本发明被设计为对位于食管或胃中的赘生物性细胞或细胞群进行筛查。因此,对“细胞或细胞群”的提及应理解为对个体细胞或细胞的组的提及。所述细胞的组可为分散的细胞群、细胞悬液、包裹的细胞群或采取组织形式的细胞群。
[0179]
对赘生物(例如腺瘤或腺癌)的“发病”的提及应理解为对表现出发育异常的个体的一个或多个细胞的提及。在这方面,所述腺瘤或腺癌可能发育良好,其中已发育出发育异常的细胞团块。或者,所述腺瘤或腺癌可能处于非常早期的阶段,其中在诊断时仅出现了相当少的异常细胞分裂。在一些实施方式中,发育异常之前为化生或其它发育异常前(predysplastic)阶段。在一些实施方式中,食道发育异常之前可能为barrett柱状内衬的食道黏膜的发展,这可能进一步进展为类似于肠化生。在一些实施方式中,这些发育异常前阶段的细胞可表现出改变的甲基化水平。本发明还扩展至对个体的赘生物(例如腺瘤或腺癌)发展的倾向的评估。不以任何方式限制本发明,与对照相比,改变的甲基化水平可指示该个体发展为赘生物形成的倾向,例如腺瘤或腺癌或者另一腺瘤或腺癌的未来发展。
[0180]
尽管优选的方法是出于诊断赘生物形成发展或其倾向的目的而对甲基化水平进行评估,但在某些情况下可能期望检测所述甲基化水平的相反变化,例如用以监测针对调节赘生物性病症(例如腺瘤或腺癌发展)的治疗性或预防性治疗的有效性。例如,当升高的甲基化水平指示个体已发展出以腺瘤或腺癌发展为特征的病症时,可利用在治疗性治疗方案开始后筛查甲基化水平降低来指示成功清除赘生物性细胞。在另一实例中,可以使用这种方法来测试肿瘤切除边缘处的组织,以确定肿瘤的整个边缘是否已经被移除。
[0181]
在一些实施方式中,本方法因此可用于诊断,预后,分类,疾病风险的预测,疾病复
发的检测,治疗的选择,或对多种类型的发育异常前、发育异常、赘生物形成前(preneoplasias)和赘生物形成的监测。在一些实施方式中,可以检测处于任何进展阶段的癌症,包括但不限于发育异常前、发育异常、赘生物形成前、赘生物性、非赘生物性、原发性、转移性或复发性癌症。
[0182]
本发明提供了用于以下的方法:确定哺乳动物(例如人)是否具有食管或胃的赘生物形成,取自哺乳动物的生物样品是否包含赘生物性细胞或衍生自赘生物性细胞的dna,评价哺乳动物发展出赘生物的可能性或风险,监测抗癌治疗的功效,或选择患有癌症的哺乳动物的适当的抗癌治疗。此类方法基于确定赘生物性细胞在本文所述的dna区域中具有与正常细胞不同的甲基化状况。因此,通过确定细胞在本文所述的dna区域中是否含有不同甲基化的序列,可以确定细胞是赘生物性的。
[0183]
本发明的方法可用于评价已知或怀疑具有赘生物形成的个体或作为常规临床测试,例如在不一定怀疑具有赘生物形成的个体中。可以进行进一步的诊断分析或测试以确认个体中赘生物形成的类型和状况,例如内窥镜检查。
[0184]
此外,本方法可用于评估治疗过程的功效。例如,可以通过在具有癌症的哺乳动物中随时间监测本文所述序列的dna甲基化来评估抗癌治疗的功效。例如,与在治疗前或治疗早期取自哺乳动物的样品中的水平相比,在治疗后取自该哺乳动物的生物样品中的本发明的任意诊断序列的甲基化减少或不存在指示有效的治疗。
[0185]
因此,本发明的方法作为以下项目是有用的:一次性测试、或对被认为处于赘生物形成发展风险中的那些个体的持续监测、或旨在抑制或减缓赘生物形成发展的治疗性或预防性治疗方案的有效性的监测。在这些情况下,绘制生物样品中的任何一个或多个种类中甲基化水平的调节是个体状况或当前使用的治疗性或预防性方案的有效性的有价值的指标。因此,本发明的方法应理解为扩展到监测相对于它们的正常水平(如上文所定义)或相对于从个体的生物样品确定的一个或多个较早期甲基化水平而言的所述个体的甲基化水平的增加或降低。
[0186]
用于检测赘生物形成的方法可以包括检测一种或多种其它癌症相关的多核苷酸或多肽序列。因此,通过本发明的方法检测甲基化可以单独使用,或与用于赘生物形成的诊断或预后的其它筛查方法组合使用。
[0187]
用于检测dna甲基化的任何方法均可用于本文所述的方法中。许多方法可用于在原始组织样品或患者样品(如血液、尿液、粪便或唾液)中检测特定基因座处差异甲基化的dna(综述于kristensen和hansen clin chem.55:1471
‑
83,2009;ammerpohl等,biochim biophys acta.1790:847
‑
62,2009;shames等,cancer lett.251:187
‑
98,2007;clark等,nat protoc.1:2353
‑
64,2006)。为了分析靶基因中dna甲基化的比例或程度,通常用亚硫酸氢钠处理dna,并使用将独立于dna的甲基化状况进行扩增的pcr条件和引物来扩增感兴趣的区域。然后可以通过测序(包括焦磷酸测序)、限制性酶消化(cobra)或者通过熔解曲线分析来评估整个扩增子或个体cpg位点的甲基化。或者,可以使用基于连接的方法来分析特定cpg位点的甲基化。检测从肿瘤释放并进入到体液中的异常甲基化的dna正在被开发为癌症诊断的手段。此处,在高甲基化的序列的情况下,有必要使用允许从未甲基化的正常细胞dna背景中选择性扩增甲基化dna序列的敏感方法。例如,基于亚硫酸氢盐处理的dna的这类方法包括甲基化选择性pcr(msp)、heavymethyl pcr、headloop pcr或辅助依赖型链式反应
(helper
‑
dependent chain reaction)(pct/au2008/001475)。
[0188]
简而言之,在一些实施方式中,用于检测甲基化的方法包括随机剪切或随机片段化基因组dna,用甲基化依赖性或甲基化敏感的限制性酶切开dna,并随后选择性地鉴别和/或分析被切开的或未切开的dna。选择性鉴别可包括,例如,将被切开的和未切开的dna(例如,按大小)分离并量化被切开或者未被切开的感兴趣序列。参见,例如,美国专利号7,186,512。或者,该方法可涵盖在限制性酶消化后扩增完整dna,从而仅扩增到在所扩增的区域中未被限制性酶切割的dna。参见,例如,美国专利申请系列号10/971,986;11/071,013;和10/971,339。在一些实施方式中,可以使用基因特异性的引物进行扩增。或者,可以将接头添加到随机片段化的dna的末端,可以用甲基化依赖性或甲基化敏感的限制性酶消化dna,可以使用杂交至接头序列的引物来扩增完整dna。在这种情况下,可以进行第二步以确定所扩增的dna池中特定基因的存在、不存在或数量。在一些实施方式中,使用实时定量pcr扩增dna。
[0189]
在一些实施方式中,所述方法包括量化基因组dna的群内的靶标序列中的平均甲基化密度。在一些实施方式中,所述方法包括:在允许基因座中潜在限制性酶切割位点的至少一些拷贝保持未切割的条件下,使基因组dna与甲基化依赖性的限制性酶或甲基化敏感的限制性酶接触;对基因座的完整拷贝进行量化;以及,将扩增产物的量与代表对照dna甲基化量的对照值进行比较,从而量化与对照dna的甲基化密度相比而言所述基因座中的平均甲基化密度。
[0190]
dna基因座的甲基化量可以通过如下进行确定:提供包含该基因座的基因组dna样品;用甲基化敏感的或甲基化依赖性的限制性酶切割dna;以及,然后对完整的dna进行量化或者对感兴趣的dna基因座处的被切开的dna的量进行量化。完整dna或被切开的dna的量将取决于包含基因座的基因组dna的初始量、基因座中甲基化的量、以及基因组dna中甲基化的基因座中的核苷酸的数量(例如分数)。可通过将完整dna或被切开的dna的量与代表类似处理的dna样品中的完整dna或被切开的dna的量的对照值进行比较来确定dna基因座中的甲基化量。对照值可以代表已知或预测的甲基化核苷酸数量。或者,对照值可以代表来自第二种基因座或在另一(例如,正常的、未患病的)细胞中的相同基因座的完整dna或被切开的dna的量。
[0191]
通过以下可确定基因座的平均甲基化密度:在允许基因座中潜在限制性酶切割位点的至少一些拷贝保持未切割的条件下使用至少一种甲基化敏感的限制性酶或甲基化依赖性的限制性酶,以及随后对剩余的完整拷贝进行量化,并将所述量与对照进行比较。甲基化敏感的酶是如果其识别到序列未甲基化则切开dna的一种酶;而甲基化依赖性酶如果其识别到序列已甲基化,则切开dna。如果在允许基因座中潜在限制性酶切割位点的至少一些拷贝保持未切割的条件下使甲基化敏感的限制性酶与dna基因座的拷贝接触,则剩余的完整dna将与甲基化密度直接成比例,并因此可以与对照进行比较以确定样品中该基因座的相对甲基化密度。类似地,如果在允许基因座中潜在限制性酶切割位点的至少一些拷贝保持未切割的条件下使甲基化依赖性的限制性酶与dna基因座的拷贝接触,则剩余的完整dna将与甲基化密度成反比,并且因此可以与对照进行比较以确定样品中该基因座的相对甲基化密度。此类测定公开于例如美国专利申请系列号10/971,986。
[0192]
用于上述方法的试剂盒可以包括例如以下物质中的一种或多种:甲基化依赖性的限制性酶、甲基化敏感的限制性酶、扩增(例如pcr)试剂、探针和/或引物。
[0193]
定量扩增方法(例如定量pcr或定量线性扩增)可用于量化限制性消化后侧翼有扩增引物的基因座内的完整dna的量。定量扩增的方法公开于,例如,美国专利号6,180,349、6,033,854、和5,972,602;以及,公开于例如gibson等,genome research 6:995
‑
1001(1996);degraves等,biotechniques 34(1):106
‑
10,112
‑
5(2003);deiman b等,mol.biotechnol.20(2):163
‑
79(2002)。可以“实时”监测扩增。
[0194]
用于检测dna甲基化的另外的方法可以涉及在用亚硫酸氢盐处理dna之前和之后的基因组测序。参见,例如,frommer等,proc.natl.acad.sci.usa 89:1827
‑
1831(1992)。当亚硫酸氢钠与dna接触时,未甲基化的胞嘧啶转化为尿嘧啶,而甲基化的胞嘧啶不被修饰。
[0195]
在一些实施方式中,将从亚硫酸氢盐转化的dna扩增的pcr产物的限制性酶消化用于检测dna甲基化。参见,例如,sadri&hornsby,nucl.acids res.24:5058
‑
5059(1996);xiong&laird,nucleic acids res.25:2532
‑
2534(1997)。
[0196]
在一些实施方式中,甲基化特异性pcr(“msp”)反应单独使用或与其它方法组合使用以检测dna甲基化。msp分析需要通过亚硫酸氢钠对dna进行初始修饰,将所有未甲基化的胞嘧啶(而不是甲基化的胞嘧啶)转化为尿嘧啶,然后用相对于未甲基化的dna而言对甲基化的dna具有特异性的引物进行扩增。参见,herman等,proc.natl.acad.sci.usa 93:9821
‑
9826(1996);美国专利号5,786,146。
[0197]
在一些实施方式中,methylight测定单独使用或与其它方法组合使用以检测dna甲基化(参见,eads等,cancer res.59:2302
‑
2306(1999))。简而言之,在methylight过程中,基因组dna在亚硫酸氢钠反应中转化(亚硫酸氢盐过程将未甲基化的胞嘧啶残基转化为尿嘧啶)。然后,使用杂交至cpg二核苷酸的pcr引物进行感兴趣的dna序列的扩增。通过使用只杂交至由甲基化dna亚硫酸氢盐转化产生的序列(或替代地只杂交至未甲基化的序列)的引物,扩增可以指示引物所杂交的序列的甲基化状况。此外,可以用特异性结合亚硫酸氢盐处理未甲基化的dna产生的序列的探针来检测扩增产物。如果需要,引物和探针均可用于检测甲基化状况。因此,与methylight一起使用的试剂盒可以包含亚硫酸氢钠,以及区分用亚硫酸氢盐处理的甲基化和未甲基化dna的可检测标记的探针(包括但不限于taqman或分子信标探针)或引物。其它试剂盒成分可包括,例如,dna扩增所需的试剂,包括但不限于pcr缓冲剂、脱氧核苷酸;和热稳定聚合酶。
[0198]
在一些实施方式中,单独使用ms
‑
snupe(甲基化敏感的单核苷酸引物延伸)反应或与其它方法组合使用以检测dna甲基化(参见,gonzalgo&jones,nucleic acids res.25:2529
‑
2531(1997))。ms
‑
snupe技术是用于基于dna的亚硫酸氢盐处理然后是单核苷酸引物延伸来评估特定cpg位点处甲基化差异的定量方法(gonzalgo&jones,见上)。简而言之,基因组dna与亚硫酸氢钠反应以将未甲基化的胞嘧啶转化为尿嘧啶,而5
‑
甲基胞嘧啶保持不变。然后,使用对亚硫酸氢盐转化的dna具有特异性的pcr引物进行期望靶序列的扩增,以及分离所得产物并用作感兴趣的cpg位点处的甲基化分析的模板。
[0199]
用于ms
‑
snupe分析的典型试剂(例如,可能见于典型的基于ms
‑
snupe的试剂盒中)可包括但不限于:用于特定基因(或甲基化改变的dna序列或cpg岛)的pcr引物;优化的pcr缓冲剂,脱氧核苷酸;凝胶提取试剂盒;阳性对照引物;对于特定基因的ms
‑
snupe引物;反应缓冲剂(用于ms
‑
snupe反应);或可检测标记的核苷酸,或它们的任意组合。此外,亚硫酸氢盐转化试剂可包括:dna变性缓冲剂;磺化缓冲剂;dna回收试剂或试剂盒(例如沉淀、超滤、
亲和柱);脱硫缓冲剂;或dna回收组分。
[0200]
额外的甲基化检测方法包括但不限于甲基化cpg岛扩增(参见,toyota等,cancer res.59:2307
‑
12(1999));以及,描述于以下中的那些方法:例如,美国专利公开2005/0069879;rein等,nucleic acids res.26(10):2255
‑
64(1998);olek等,nat.genet.17(3):275
‑
6(1997);和pct公开号wo 00/70090。
[0201]
下面提供了关于这些一般描述的方法中的数种的更详细的信息:
[0202]
(a)探针或引物设计和/或生产
[0203]
本文描述的用于诊断赘生物形成的数种方法使用一个或多个探针和/或引物。设计用于例如pcr或杂交的探针和/或引物的方法是本领域已知的并且描述于例如dieffenbach和dveksler(编著)(in:pcr primer:a laboratory manual,cold spring harbor laboratories,ny,1995)。此外,一些软件包是公开可用的,它们为各种分析设计最佳探针和/或引物,所述软件包例如可从基因组研究中心,cambridge,mass.,usa获得的primer3。
[0204]
显然,探针或引物的潜在用途应在其设计过程中加以考虑。例如,如果探针或引物生产用于甲基化特异性的pcr或连接酶链式反应(lcr)测定,则3'端(或lcr情况下的5'端)的核苷酸应优选对应于核酸中甲基化的的核苷酸。
[0205]
对用于检测与赘生物形成相关的序列有用的探针和/或引物进行评估,例如,以确定所述探针和/或引物不形成发夹、自引发,或者形成引物二聚体(例如,与检测测定中所用的另一探针或引物)。此外,通常对探针或引物(或其序列)进行评估以确定其从靶核酸变性的温度(例如,探针或引物的解链温度,或tm)。评价tm的方法是本领域已知的,并且例如描述于:santa lucia,proc.natl.acad.sci.usa,95:1460
‑
1465,1995;或bresslauer等,proc.natl.acad.sci.usa,83:3746
‑
3750,1986。
[0206]
产生/合成本发明的探针或引物的方法是本领域已知的。例如,寡核苷酸合成描述于gait(编著)(in:oligonucleotide synthesis:a practical approach,irl press,oxford,1984)。例如,探针或引物可以通过生物合成(例如通过用限制性核酸内切酶消化核酸)或通过化学合成获得。对于短序列(多至100个核苷酸或约100个核苷酸),化学合成是优选的。
[0207]
对于较长的序列,分子生物学中采用的标准复制方法是有用的,例如,如messing,methods enzymol,101,20
‑
78,1983所述的将m13用于单链dna。用于寡核苷酸合成的其它方法包括:例如,磷酸三酯和磷酸二酯方法(narang等,meth.enzymol 68:90,1979),和在支持物上的合成(beaucage等,tetrahedron letters 22:1859
‑
1862,1981);以及氨基磷酸酯技术,caruthers,m.h.等,methods in enzymology,vol.154,pp.287
‑
314(1988);以及,在“synthesis and applications of dna and rna,”s.a.narang,编著,academic press,new york,1987以及其中引用的参考文献中描述的其它方法。包含锁核酸(lna)的探针按照如下文献中描述的进行合成:例如,nielsen等,j.chem.soc.perkin trans.,1:3423,1997;singh和wengel,chem.commun.1247,1998.;而包含肽
‑
核酸(pna)的探针按照如下文献中所描述的进行合成:例如,egholm等,am.chem.soc.,114:1895,1992;egholm等,nature,365:566,1993;以及orum等,nucl.acids res.,21:5332,1993。
[0208]
本文所述的引物、探针或其它核酸包含核碱基。原始的、经典的、天然的或未修饰
的碱基是腺嘌呤(a)、胞嘧啶(c)、鸟嘌呤(g)、胸腺嘧啶(t)和尿嘧啶(u)。在一些实施方式中,可以优选设计在特定位置具有多个可能的替代核碱基(简并碱基)的引物、探针或其它核酸,例如,以增加引物或探针与特定核酸、核酸等位基因的群、或亚硫酸氢盐处理的核酸和未处理的核酸的群的退火。简并碱基根据国际纯粹与应用化学联合会(iupac)标准进行表示。这些表示包括但不限于:w(a和t)、s(c和g)、m(a和c)、k(g和t)、r(a和g)、y(c和t)、b(c、g和t)、d(a、g和t)、h(a、c和t)、v(a、c和g)或n(a、c、g和t)。其它“非经典”核碱基包括但不限于:嘌呤、嘧啶、经修饰的核碱基、5
‑
甲基胞嘧啶、假尿苷、二氢尿苷、2,6
‑
二氨基嘌呤、肌苷、7
‑
甲基鸟苷、次黄嘌呤、黄嘌呤、5,6
‑
二氢尿嘧啶、5
‑
羟甲基胞嘧啶、5
‑
溴尿嘧啶、异鸟嘌呤、异胞嘧啶、氨基烯丙基碱基、染料标记的碱基、荧光碱基或生物素标记的碱基。
[0209]
(b)dna的甲基化敏感的核酸内切酶消化
[0210]
在一个实例中,使用如下过程确定样品中增加的甲基化,所述过程包括在足以使核酸被消化的条件下使核酸与一定量的甲基化敏感的限制性核酸内切酶接触,然后对所产生的片段进行检测。示例性的甲基化敏感的核酸内切酶包括例如hhai或hpaii。优选地,测定包括内部对照,所述内部对照用与所用甲基化敏感的酶具有相同特异性的甲基化不敏感的酶进行消化。例如,甲基化不敏感的酶mspi是甲基化敏感的酶hpaii的同裂酶。
[0211]
杂交测定形式
[0212]
在一个实例中,核酸的消化通过探针或引物对未消化的核酸的选择性杂交来进行检测。或者,探针选择性地杂交至被消化的和未消化的核酸两者,但促进两种形式之间的区分,例如通过电泳。用于实现与杂交探针的选择性杂交的合适检测方法包括,例如,southern或其它核酸杂交(kawai等,mol.cell.biol.14:7421
‑
7427,1994;gonzalgo等,cancer res.57:594
‑
599,1997)。
[0213]
合适的杂交条件基于包含探针的核酸双链体的解链温度(tm)而确定。技术人员将意识到,尽管可以应用一些一般性,对于每个探针的最佳杂交反应条件应该凭经验确定。优选地,使用短寡核苷酸探针的杂交在低至中等严格性下进行。在富含gc的探针或引物或者较长的探针或引物的情况下,优选高严格性杂交和/或洗涤。高严格性在本文中定义为在如下的条件下进行的杂交和/或洗涤:0.1
×
ssc缓冲液或约0.1
×
ssc缓冲液和/或0.1%(w/v)sds或约0.1%(w/v)sds,或更低的盐浓度,和/或在至少65℃的温度,或同等条件。本文提及的特定严格性水平涵盖使用本领域技术人员已知的除ssc之外的洗涤/杂交溶液的同等条件。
[0214]
根据实例,测试样品和阴性对照样品产生的片段的差异指示受试者具有赘生物形成。类似地,在对照样品包含来自肿瘤、癌症组织或癌细胞或癌前细胞的数据的情况下,测试样品和对照样品之间的相似性(尽管不一定是绝对一致)指示阳性诊断(例如,癌症)。一旦确定样品具有与对照不同的甲基化水平,可以向受试者提供疗法或治疗方案,或指导或建议受试者接受疗法或治疗方案,所述疗法或治疗方案与所获得的诊断结果相对应(例如,结肠镜检查、手术移除恶性组织、和/或放射、化学疗法或免疫疗法)。
[0215]
扩增测定形式
[0216]
在替代方式中,使用扩增系统检测由限制性酶产生的片段,所述扩增系统例如聚合酶链式反应(pcr)、滚环扩增(rca)、反向聚合酶链式反应(ipcr)、原位pcr(singer
‑
sam等,nucl.acids res.18:687,1990)、链置换扩增(sda)或循环探针技术。
[0217]
pcr的方法是本领域已知的,并且描述于例如mcpherson等,pcr:a practical approach.(系列编著,d.rickwood和b.d.hames),irl press limited,oxford.pp 1
‑
253,1991,以及dieffenbach(编著)和dveksler(编著)(in:pcr primer:a laboratory manual,cold spring harbour laboratories,ny,1995),以引用的方式将其内容各自以其整体并入。通常,对于pcr,将包含1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个或50个核苷酸的两个非互补核酸引物分子在其各自的退火位点处杂交至核酸模板分子的不同链,并且对介于所述退火位点之间的模板的特定核酸分子拷贝进行酶促扩增。在一些实施方式中,所述两个非互补核酸引物分子的长度为至少18个核苷酸或至少约18个核苷酸。在一些实施方式中,所述两个非互补核酸引物分子的长度为至少20
‑
30个核苷酸或至少约20
‑
30个核苷酸。可以对扩增产物进行检测,例如,使用电泳以及用结合核酸的可检测标记进行的检测。或者,将寡核苷酸中的一种或多种用可检测标志物(例如荧光团)标记,并使用例如lightcycler(perkin elmer,wellesley,mass.,usa,roche applied science,indianapolis,in,usa)来检测扩增产物。
[0218]
链置换扩增(sda)利用寡核苷酸引物、dna聚合酶和限制性核酸内切酶来扩增靶标序列。寡核苷酸杂交至靶标核酸,聚合酶用于产生介于引物退火位点之间的区域的拷贝。所拷贝的核酸和靶标核酸的双链体然后用核酸内切酶进行切刻,所述核酸内切酶特异性识别所拷贝的核酸开始处的序列。dna聚合酶识别经切刻的dna,并在取代先前生成的核酸的同时生成靶标区域的另一拷贝。sda的优势在于它以等温形式发生,从而有利于高通量自动化分析。
[0219]
循环探针技术使用嵌合的合成引物,所述引物包含能够杂交至靶标序列的dna
‑
rna
‑
dna。在杂交至靶标序列后,所形成的rna
‑
dna双链体为rnaseh的靶标,从而切割所述引物。然后,例如使用质谱或电泳检测经切割的引物。
[0220]
对于侧翼于或临近甲基化敏感的核酸内切酶识别位点的引物,优选此类引物仅侧翼于赘生物形成中高甲基化的那些位点,以确保产生诊断性扩增产物。在这方面,当限制性位点没有被切割(即当它被甲基化)时,才会产生扩增产物。因此,检测到扩增产物指示感兴趣的cpg二核苷酸被甲基化。
[0221]
如技术人员将知晓的,扩增产物的精确长度将根据引物之间的距离而变化。显然,如果每个二核苷酸都处于甲基化敏感的限制性核酸内切酶位点内,这种形式的分析可用于确定多个cpg二核苷酸的甲基化状况。在这些方法中,引物中的一种或多种可以用可检测标志物进行标记,以有利于所扩增核酸的快速检测,所述可检测标志物例如荧光标记(例如cy5或cy3)或放射性同位素(例如
32
p)。
[0222]
通常使用例如非变性琼脂糖凝胶电泳、非变性聚丙烯酰胺凝胶电泳、质谱、液相色谱(例如hplc或dhplc)或毛细管电泳(例如maldi
‑
tof)来对扩增的核酸进行分析。对于本文所述的所有测定形式,尤其优选高通量检测方法,例如基质辅助激光解吸/电离飞行时间(maldi
‑
tof)、电喷雾电离(esi)、质谱(包括串联质谱,例如lc ms/ms)、生物传感器技术、倏逝光纤技术(evanescent fiber
‑
optics technology)或dna芯片技术(例如,wo98/49557;wo 96/17958;fodor等,science 767
‑
773,1991;美国专利号5,143,854;以及美国专利号5,
837,832,以引用的方式将其内容全部并入本文)。或者,核酸的扩增可以使用如本文和/或例如美国专利号6,174,670(以引用的方式并入本文)中描述的熔解曲线分析方法来连续监测。
[0223]
(c)其它测定形式
[0224]
在替代实例中,样品中增加的甲基化通过执行包括以下的程序进行确定:在足以使核酸被消化的条件下,用一定量的dnase i处理含有所述核酸的染色质,然后对所产生的片段进行检测。这种测定形式基于以下的理解:含有甲基化dna(例如高甲基化dna)的染色质比非高甲基化dna具有更紧密闭合的构象,因此更不易受到dnase i的核酸内切酶消化。
[0225]
根据该方法,相比非甲基化dna而言,通过dnase i消化甲基化dna产生不同长度的dna片段。例如,使用早前描述的测定来检测此类不同的dna片段。或者,基本上按照例如在gregory和feil,nucleic acids res.,27,e32i
‑
e32iv,1999中描述的,使用pcr
‑
sscp检测所述dna片段。在使pcr
‑
sscp适应本发明中,侧翼于或包含核酸中的一个或多个cpg二核苷酸的扩增引物用于扩增dnase i生成的片段,其在赘生物形成样品中对dnase i消化耐受,但在健康/正常对照或健康/正常测试样品中对dnase i消化不耐受。在这种情况下,使用dnase i产生特定核酸片段可诊断赘生物形成,因为dna未被有效降解。相比之下,来自健康/正常受试者样品的模板dna通过dnase i的作用被降解,因此,扩增无法产生离散的扩增产物。pcr
‑
sscp的替代方法(例如pcr
‑
dhplc)也是本领域已知的,并且在本发明的考虑之列。
[0226]
(d)非甲基化dna的选择性诱变
[0227]
在替代方法中,使用包括如下的程序来确定样品中增加的甲基化:在足以诱导诱变的条件下,使核酸与一定量的化合物接触,所述化合物选择性地突变cpg二核苷酸内的非甲基化胞嘧啶残基。
[0228]
优选的化合物将胞嘧啶突变为尿嘧啶或胸苷,例如亚硫酸氢盐,如亚硫酸氢钠或亚硫酸氢钾(frommer等,1992,见上)。已知dna的亚硫酸氢盐处理通过突变不受甲基化保护的胞嘧啶残基来区分甲基化和非甲基化的胞嘧啶残基,所述胞嘧啶残基包括不在cpg二核苷酸内的胞嘧啶残基或位于未经受甲基化的cpg二核苷酸内的胞嘧啶残基。
[0229]
基于序列的检测
[0230]
在一个实例中,一个或多个突变核苷酸的存在或突变序列的数量通过对突变的dna进行测序来确定。一种形式的分析包括使用本文所述的扩增反应(例如pcr)扩增突变的核酸。然后,直接对扩增产物进行测序,或进行克隆,并对所克隆的产物进行测序。用于dna测序的方法是本领域已知的,包括例如双脱氧链终止法或maxam
‑
gilbert法(参见sambrook等,molecular cloning,a laboratory manual(第二版,cshp,new york 1989),或zyskind等,recombinant dna laboratory manual,(acad.press,1988))。
[0231]
由于核酸与化合物(例如亚硫酸氢盐)的接触使得未甲基化胞嘧啶突变为尿嘧啶(并因此在扩增程序后为胸苷),因此分析序列确定甲基化核苷酸的存在或不存在。例如,通过比较使用对照样品或未用亚硫酸氢盐处理的样品获得的序列或感兴趣区域的已知核苷酸序列与经接触的样品,有利于核苷酸序列差异的检测。与对照样品或未处理的样品相比,在经接触样品中的胞嘧啶位点处检测到的任何胸腺嘧啶残基都可被认为是由亚硫酸氢盐接触引起的突变所产生的。使用亚硫酸氢盐处理的核酸测序检测甲基化的合适方法描述
于:例如,frommer等,1992,见上;或clark等,nucl.acids res.22:2990
‑
2997,1994。
[0232]
在另一方法中,使用焦磷酸测序检测亚硫酸氢盐处理的样品中突变或非突变的核苷酸的存在,例如,如uhlmann等,electrophoresis,23:4072
‑
4079,2002中所述。本质上,这种方法是实时测序的形式,它使用引物杂交到邻近或接近甲基化的胞嘧啶位点的位点。在引物和模板杂交后,在dna聚合酶存在下,根据预定的分配顺序分别加入四种修饰的脱氧核苷三磷酸中的每一种。仅掺入与亚硫酸氢盐处理的样品互补的添加核苷酸,并释放无机焦磷酸盐(ppi)。然后ppi驱动反应,引起可检测水平的光产生。此种方法允许确定与引物杂交位点相邻的特定核苷酸的身份。
[0233]
固相焦磷酸测序的方法是本领域已知的并且在例如landegren等,genome res.,8(8):769
‑
776,1998中进行了综述。此类方法能够实现多个cpg二核苷酸的甲基化的高通量检测。
[0234]
确定亚硫酸氢盐接触的核苷酸序列的相关方法为甲基化敏感的单核苷酸引物延伸(me
‑
snupe)或snapmeth。合适的方法描述于:例如,gonzalgo和jones,1997,见上;或uhlmann等,electrophoresis,23:4072
‑
4079,2002。使用杂交至邻近甲基化的胞嘧啶位点的核酸区域的寡核苷酸。然后,将该寡核苷酸与聚合酶和游离核苷二磷酸或双脱氧核苷三磷酸一起用于引物延伸方案,所述游离核苷二磷酸或双脱氧核苷三磷酸对应于亚硫酸氢盐处理后出现在该位点的任一或任何可能碱基(即胸腺嘧啶或胞嘧啶)。优选地,将核苷
‑
二磷酸用可检测的标志物(例如荧光团)进行标记。引物延伸后,将未结合的标记的核苷二磷酸移除(例如使用尺寸排阻色谱或电泳)或水解(使用例如碱性磷酸酶),并且对标记的核苷酸掺入至寡核苷酸进行检测,指示存在于该位点的碱基。
[0235]
本发明涵盖其它高通量测序方法。此类方法包括,例如,固相微测序(如在例如southern等,genomics,13:1008
‑
1017,1992中所述),或用fret进行的微测序(如在例如chen和kwok,nucleic acids res.25:347
‑
353,1997中所述)。
[0236]
基于限制性核酸内切酶的测定形式
[0237]
在一种方法中,基本上如xiong和laird,2001,见上所述,使用联合亚硫酸氢盐限制性分析(cobra)对非突变序列的存在进行检测。该方法利用了与选择性突变未甲基化胞嘧啶残基的化合物(例如亚硫酸氢盐)接触后甲基化和非甲基化核酸之间的限制性酶识别位点的差异。
[0238]
在亚硫酸氢盐处理后,使用本文所述的扩增反应(例如pcr)来扩增包含一个或多个cpg二核苷酸的感兴趣的区域,所述一个或多个cpg二核苷酸是甲基化的并包含在限制性核酸内切酶识别序列中。然后,将扩增产物与在所述cpg二核苷酸位点处切割的限制性酶在足以发生切割的条件下接触一段时间。可以选择限制性位点来指示甲基化的存在或不存在。例如,限制性核酸内切酶taqi切割序列tcga,在亚硫酸氢盐处理非甲基化核酸后,该序列将为ttga,因此将不被切割。然后使用本领域已知的检测手段(例如电泳和/或质谱法)检测消化的和/或未消化的核酸。核酸的切割或未切割指示受试者中的癌症。显然,该方法可用于关于癌症诊断的阳性读出或阴性读出系统中。
[0239]
阳性读出测定形式
[0240]
在一个实施方式中,所述测定形式包括阳性读出系统,其中,将来自已经例如用亚硫酸氢盐处理的样品的dna检测为阳性信号。优选地,来自健康或正常对照受试者的非高甲
基化dna未被检测到或仅被微弱地检测到。
[0241]
在优选的实施方式中,受试者样品中增加的甲基化使用包括以下的方法进行确定:
[0242]
(i)在足以诱导诱变的条件下,使核酸与一定量的选择性突变非甲基化胞嘧啶残基的化合物接触,从而产生突变的核酸;
[0243]
(ii)在使得与非突变核酸选择性杂交发生的条件下,使核酸杂交至探针或引物,所述探针或引物包含与含有甲基化胞嘧啶残基的序列互补的核苷酸序列;以及
[0244]
(iii)检测所述选择性杂交。
[0245]
在此上下文中,术语“选择性杂交”意指探针或引物与非突变核酸的杂交以相比相同探针或引物与对应突变序列的杂交而言更高的频率或速率发生,或者相比相同探针或引物与对应突变序列的杂交而言具有更高的最大反应速度。优选地,所述探针或引物在所使用的反应条件下不杂交至携带突变的非甲基化序列。
[0246]
基于杂交的测定形式
[0247]
在一个实施方式中,使用southern、斑点印迹、狭缝印迹或其它核酸杂交手段来检测杂交(kawai等,1994,见上;gonzalgo等,1997,见上)。除了适当的探针选择外,此类测定形式在上文中进行了一般性描述,并且对于目前描述的选择性诱变方法而进行必要的变更。
[0248]
优选地,使用连接酶链式反应形式来区分突变的核酸和非突变的核酸。连接酶链式反应(在ep 320,308和美国专利号4,883,750中描述)使用至少两种寡核苷酸探针,它们以在靶标核酸上放置于彼此旁边(juxtaposed)的方式退火至靶标核酸。在连接酶链式反应测定中,靶标核酸杂交至与所述靶标序列的诊断部分(例如包含一个或多个甲基化cpg二核苷酸的核酸)互补的第一探针(诊断探针),并在其中所述诊断探针保持大体上仅与所述靶标核酸结合的条件下,和与所述诊断部分连续的核苷酸序列互补的第二探针(连续探针)杂交。诊断探针和连续探针可以具有不同的长度和/或具有不同的解链温度,使得可以调节杂交的严格性以允许它们对靶标进行选择性杂交,其中,具有较高解链温度的探针在较高严格性下杂交,在洗涤移除未结合和/或非选择性结合的探针后,具有较低解链温度的另一探针在较低严格性下杂交。然后将诊断探针和连续探针例如使用t4 dna连接酶共价连接,从而产生与靶标序列互补的更大的靶标探针,并通过修改杂交严格性将未连接的探针移除。在这方面,与已连接的探针相比,未连接的探针将在较低严格性的杂交条件下选择性杂交。因此,杂交的严格性可以增加到至少与杂交较长探针所用的严格性一样高的严格性,并且优选为由于连接后较短探针贡献的增加的长度而引起的较高的严格性。
[0249]
在另一实例中,探针中的一个或两个被标记,使得靶标序列的存在或不存在可以通过以下方式来测试:解链靶标
‑
探针双链体,洗脱解离的探针,以及对标记进行测试。当两种探针都被标记时,使用不同的配体以允许区分连接的探针和未连接的探针,在这种情况下,同一洗脱液级分中两种标记的存在证实了连接事件。如果靶标核酸结合到固体基质上,例如在southern杂交、狭缝印迹、斑点印迹或微芯片测定形式中,诊断探针和连续探针两者的存在可以直接确定。
[0250]
也可以使用甲基化特异性微阵列(mso)。合适的方法例如在adorjan等,nucl.acids res.,30:e21,2002中有描述。mso使用与选择性突变非甲基化胞嘧啶残基的化
合物(例如亚硫酸氢盐)接触的核酸作为扩增突变核酸和非突变核酸两者的扩增反应的模板。用包含可检测标记(例如荧光团,如cy3或cy5)的至少一种引物进行扩增。
[0251]
为了产生用于检测突变核酸的微阵列,将寡核苷酸点样至例如载玻片上,优选具有一定程度的冗余(例如,如golub等,science,286:531
‑
537,1999中所述)。优选地,对于每个分析的cpg二核苷酸,使用两种不同的寡核苷酸。每种寡核苷酸包含序列n2‑
16cgn2‑
16或n2‑
16tgn2‑
16(其中,n为与感兴趣的cpg二核苷酸相邻或其旁边的核苷酸数量),反映了cpg二核苷酸的甲基化或非甲基化状况。
[0252]
然后,在能够检测单核苷酸差异的条件下,将标记的扩增产物与微阵列上的寡核苷酸杂交。洗涤移除未结合的扩增产物后,使用例如微阵列扫描仪对杂交进行检测。这种方法不仅允许确定大量cpg二核苷酸的甲基化状况,而且是半定量的,能够确定所分析的每个cpg二核苷酸处的甲基化程度。由于单个样品中可能存在一定程度的甲基化异质性,此类量化可能有助于癌症的诊断。
[0253]
基于扩增的测定形式
[0254]
在替代实例中,使用扩增系统检测杂交。在甲基化特异性pcr形式(msp;herman等,proc.natl.acad.sci.usa 93:9821
‑
9826,1992)中,使用包括扩增亚硫酸氢盐处理的dna的程序来检测杂交。因此,通过使用在中等和/或高严格性下特异性退火至未突变序列的一种或多种探针或引物,仅使用包含甲基化核苷酸的样品的情况产生扩增产物。cottrell等,nucl.acids res.32:e10,2003(heavymethyl pcr);rand等,nucl.acids res.33:e127,2005(headloop pcr);rand等,epigenetics 1:94
‑
100,2006(亚硫酸氢盐差异变性pcr)和pct/au07/000389(末端特异性pcr,end
‑
specific pcr)提供了替代测定,所述测定提供从亚硫酸氢盐处理的dna混合物中选择性扩增甲基化组分或未甲基化组分。
[0255]
可以使用本文所述的任何扩增测定形式,例如聚合酶链式反应(pcr)、滚环扩增(rca)、反向聚合酶链式反应(ipcr)、原位pcr(singer
‑
sam等,1990,见上)、链置换扩增或循环探针技术。pcr技术已被开发用于检测基因突变(kuppuswamy等,proc.natl.acad.sci.usa 88:1143
‑
1147,1991)和等位基因特异性表达的量化(szabo和mann,genes dev.9:3097
‑
3108,1995;以及singer
‑
sam等,pcr methods appl.1:160
‑
163,1992)。此类技术使用内部引物,所述内部引物退火至pcr生成的模板,并紧邻待测定的单个核苷酸的5'端终止。这种形式容易与上文所述的连接酶链式反应结合。实时定量测定形式的使用也是有用的。除了合适引物的选择外,此类测定形式在上文中一般性描述,并且对于当前描述的选择性诱变方法而进行必要的变更。
[0256]
本发明还考虑甲基化特异性熔解曲线分析(基本上如worm等,clin.chem.,47:1183
‑
1189,2001中所述)。该程序利用了使用亚硫酸氢盐处理的甲基化或未甲基化核酸产生的扩增产物中解链温度的差异。本质上来讲,在特异性结合双链dna的荧光染料(例如sybr green i)存在的情况下,进行亚硫酸氢盐处理的样品的非歧视性扩增。通过提高扩增产物的温度同时监测荧光,确定了解链特性并因此确定了扩增产物的序列。荧光的降低反映了扩增产物中至少一个结构域的解链。荧光降低时的温度指示所扩增的核酸的核苷酸序列,从而允许确定一个或多个cpg二核苷酸位点处的核苷酸。
[0257]
本发明的方面还涵盖使用实时定量形式的pcr(例如taqman(holland等,proc.natl.acad.sci.usa,88:7276
‑
7280,1991;lee等,nucleic acid res.21:3761
‑
3766,
1993))来执行该实施方式。例如,eads等,nucl.acids res.28:e32,2000的methyllight方法使用改进的taqman测定来检测cpg二核苷酸的甲基化。本质上来讲,该方法包括用亚硫酸氢盐处理核酸样品,以及使用扩增反应(例如pcr)扩增包含一个或多个cpg二核苷酸的核酸,所述cpg二核苷酸在赘生物性细胞中被甲基化,而在对照样品中不被甲基化。扩增反应在三种寡核苷酸、正向引物和反向引物以及探针的存在下进行,其中,所述正向引物和反向引物位于感兴趣的区域侧翼,所述探针在两种引物之间杂交至一个或多个甲基化cpg二核苷酸的位点。所述探针用5’荧光报告分子和3’淬灭剂(反之亦然)双重标记。当探针完好时,由于它们的接近度,淬灭剂染料吸收报告分子的荧光。在退火至pcr产物后,所述探针被例如taq dna聚合酶的5’至3’核酸外切酶活性切割。这一切割将报告分子从淬灭剂释放,从而引起荧光信号增加,这可用于评价初始模板甲基化水平。通过使用选择性杂交至未突变核酸(即甲基化核酸)的探针或引物,例如使用标准曲线,对甲基化水平进行确定。
[0258]
用于标记核酸的荧光报告分子包括但不限于:荧光素、6
‑
荧光素亚磷酰胺(6
‑
fam)、5
‑
羧基四甲基罗丹明(5
‑
tamra)、6
‑
羧基
‑
4',5'
‑
二氯
‑
2',7'
‑
二甲氧基荧光素(6
‑
joe)、cy3、cy5、cy5.5、四氯荧光素(tet)、yakima六氯荧光素(hex)、texastex615、罗丹明、atto染料、alexa染料、或或它们的任意组合。用于标记核酸的荧光淬灭剂包括但不限于:iowafq(3'iabkfq)、iowarq、black hole(bhq)、dabcyl、qxl、或zen,或它们的任意组合。
[0259]
或者,不使用需要切割的标记探针,而是使用例如分子信标的探针(参见,例如,mhlanga和malmberg,methods 25:463
‑
471,2001)。分子信标是具有茎环结构的单链核酸分子。所述环结构与一个或多个cpg二核苷酸周围的区域互补,所述cpg二核苷酸在赘生物性样品中被甲基化而在对照样品中不被甲基化。所述茎结构通过将彼此互补的两个“臂”退火而形成,所述两个“臂”位于探针(环)的两侧。荧光部分结合至一个臂,淬灭部分结合至另一个臂,所述淬灭部分在分子信标没有结合到靶标序列时阻遏任何可检测的荧光。环区结合至其靶标核酸后,臂分开,荧光是可检测的。然而,即使单个碱基错配也显著改变样品中检测到的荧光水平。因此,特定碱基的存在或不存在通过检测到的荧光水平进行确定。此类测定有助于检测核酸中的一个或多个未突变位点(即甲基化核苷酸)。
[0260]
荧光标记的锁核酸(lna)分子或荧光标记的蛋白质
‑
核酸(pna)分子对检测核苷酸差异而言有用(例如,如simeonov和nikiforov,nucleic acids research,30(17):1
‑
5,2002中所述)。lna和pna分子以高亲和力结合至核酸(特别是dna)。当探针杂交至靶标核酸后,与lna或pna探针缀合的荧光团(特别是罗丹明或六氯荧光素)发出明显较高水平的荧光。然而,荧光增加的水平没有增强到即便发生单个核苷酸错配时的相同水平。因此,在样品中检测到的荧光程度指示lna或pna探针与靶标核酸之间存在错配,例如,在甲基化cpg二核苷酸中存在突变胞嘧啶的情况下。优选地,荧光标记的lna或pna技术用于检测核酸中的至少单个碱基变化,所述核酸先前已经使用例如本领域已知和/或本文所述的扩增方法进行了扩增。
[0261]
对于熟练技术人员来说将显而易见的是,通过将lna或pna探针固定到固体支持物上,lna或pna检测技术可适用于一种或多种标志物的高通量检测,如在orum等,clin.chem.45:1898
‑
1905,1999中所述。
[0262]
或者,将实时测定(例如所谓的heavymethyl测定(cottrell等,2003,见上))用于
确定测试样品中的核酸甲基化的存在或水平。本质上来讲,该方法使用一种或多种不可延伸的核酸(例如寡核苷酸)阻断剂(blocker),所述阻断剂以甲基化特异性方式结合至亚硫酸氢盐处理的核酸(例如,所述阻断剂在中等严格性至高严格性下特异性结合至未突变的dna)。使用一种或多种引物进行扩增反应,所述引物可以任选地是甲基化特异性的但位于一种或多种阻断剂的侧翼。在未甲基化核酸(例如,非突变dna)存在的情况下,所述阻断剂结合并且不产生pcr产物。使用基本上如上文所述的taqman测定,对样品中的核酸甲基化水平进行确定。
[0263]
在用选择性突变非甲基化胞嘧啶残基的化合物处理后检测甲基化核酸的其它基于扩增的方法包括:例如,甲基化特异性单链构象分析(ms
‑
ssca)(bianco等,hum.mutat.,14:289
‑
293,1999)、甲基化特异性变性梯度凝胶电泳(ms
‑
dgge)(abrams和stanton,methods enzymol.,212:71
‑
74,1992)和甲基化特异性变性高效液相色谱法(ms
‑
dhplc)(deng等,chin.j.cancer res.,12:171
‑
191,2000)。这些方法中的每一种使用不同的技术基于核苷酸序列和/或二级结构的差异来检测扩增产物中的核酸差异。此类方法在本文中明确地被考虑在内。
[0264]
与其它基于扩增的测定形式一样,使用一系列程序分析扩增产物,所述程序包括凝胶电泳、凝胶过滤、质谱,以及在标记引物的情况下,通过鉴别扩增产物中的标记。在替代的实施方式中,从亚硫酸氢盐转化的dna扩增的pcr产物的限制性酶消化基本上如sadri和hornsby,nucl.acids res.24:5058
‑
5059,1996;以及xiong和laird,nucl.acids res.25:2532
‑
2534,1997所描述的进行,用以分析所形成的产物。
[0265]
也可以采用高通量检测方法,例如基质辅助激光解吸/电离飞行时间(maldi
‑
tof)、电喷雾电离(esi)、质谱法(包括串联质谱法,例如lc ms/ms)、生物传感器技术、倏逝光纤技术或dna芯片技术。
[0266]
与本文所述的利用杂交和/或扩增检测系统的其它测定形式一样,本发明的基于选择性诱变的测定形式特别考虑了上文所述的此类程序的组合。在一个实例中,通过执行包括以下的程序来检测增加的甲基化:
[0267]
(i)在足以诱导诱变的条件下,使核酸与一定量的选择性突变cpg二核苷酸内的非甲基化胞嘧啶残基的化合物接触,从而产生经突变的核酸;
[0268]
(ii)在使得发生与非突变核酸杂交的条件下,将所述核酸与两个非重叠且非互补的引物杂交,其中,所述引物中的每个包含与含有甲基化胞嘧啶残基的dna中的序列互补的核苷酸序列;
[0269]
(iii)扩增介于杂交的引物之间的核酸,从而产生由包含引物序列的序列组成的dna片段;
[0270]
(iv)在使得发生与非突变核酸杂交的条件下,将扩增的dna片段与探针杂交,所述探针包含对应于包含甲基化胞嘧啶残基的序列的核苷酸序列或与包含甲基化胞嘧啶残基的序列互补的核苷酸序列;以及对所述杂交进行检测。
[0271]
阴性读出测定
[0272]
在另一实例中,所述测定形式包括阴性读出系统,其中,将来自健康/正常对照样品的dna甲基化减少检测为阳性信号,并且优选地,来自赘生物性样品的甲基化dna不被检测到或仅被微弱地检测到。
[0273]
在优选的实施方式中,减少的甲基化使用包括以下的程序来确定:
[0274]
(i)在足以诱导诱变的条件下,使核酸与一定量的选择性突变cpg岛内的非甲基化胞嘧啶残基的化合物接触,从而产生经突变的核酸;
[0275]
(ii)在使得发生与经突变的核酸选择性杂交的条件下,使所述核酸与探针或引物杂交,所述探针或引物包含与含有突变的胞嘧啶残基的序列互补的核苷酸序列;以及
[0276]
(iii)对所述选择性杂交进行检测。
[0277]
在此上下文中,术语“选择性杂交”意指相比相同探针或引物与对应的非突变序列的杂交而言,该探针或引物与经突变的核酸的杂交以较高的频率或速率发生,或者该探针或引物与经突变的核酸的杂交具有较高的最大反应速度。优选地,所述探针或引物在所使用的反应条件下不杂交至甲基化序列(或非突变序列)。
[0278]
基于杂交的测定形式
[0279]
在一个实施方式中,使用southern、斑点印迹、狭缝印迹或其它核酸杂交手段检测杂交(kawai等,1994,见上;gonzalgo等,1997,见上)。除了适当的探针选择外,此类测定形式在上文中进行了一般性描述,并且对于目前描述的选择性诱变方法进行必要的变更。优选地,采用连接酶链式反应形式来区分非突变核酸和突变核酸。在这方面,测定要求和条件如上文针对阳性读出测定所描述的,并且对于本形式进行必要的变更。但是,探针的选择将不同。对于阴性读出测定,选择与突变序列而不是非突变序列选择性杂交的一种或多种探针。
[0280]
优选地,连接酶链式反应探针具有包含cpg二核苷酸的3'
‑
末端和/或5'
‑
末端序列,所述cpg二核苷酸在健康对照样品中未甲基化但在癌症中高甲基化,从而使得仅当所述cpg二核苷酸的胞嘧啶突变为胸苷时(例如在非甲基化胞嘧啶残基的情况下),诊断探针和连续探针才能够连接。
[0281]
对熟练的技术人员将显而易见的是,上文描述的mso方法可适用于阳性读出测定和/或阴性读出测定中的任一者或两者。这是因为所描述的分析检测突变序列和非突变序列,从而有助于确定甲基化水平。然而,仅检测甲基化序列或非甲基化序列的测定在本文的考虑之列。
[0282]
基于扩增的测定形式
[0283]
在替代实例中,使用扩增系统检测杂交,所述扩增系统使用如上文所述的用于阳性读出测定的任何扩增测定形式,尽管使用选择性杂交至突变核酸的引物(和探针,如果适用)。
[0284]
在使上述heavymethyl测定适应于阴性读出形式时,以甲基化特异性方式结合亚硫酸氢盐处理的核酸的阻断剂在中等严格性至高严格性下特异性结合至突变的dna。使用一种或多种引物进行扩增反应,所述引物可任选地是甲基化特异性的(例如,仅结合突变的核酸)但位于一个或多个阻断剂侧翼。在甲基化核酸(例如,突变的dna)存在的情况下,阻断剂结合并且不产生pcr产物。
[0285]
在一个实例中,正常/健康对照受试者中减少的甲基化通过进行包括以下的程序来检测:
[0286]
(i)在足以诱导诱变的条件下,使核酸与一定量的选择性突变非甲基化胞嘧啶残基的化合物接触,从而产生经突变的核酸;
[0287]
(ii)在使得发生与经突变核酸杂交的条件下,使所述核酸与两个非重叠且非互补的引物杂交,所述引物中的每个包含与含有突变的胞嘧啶残基的dna中的序列互补的核苷酸序列;
[0288]
(iii)扩增介于杂交的引物之间的核酸,从而产生由包含引物序列的序列组成的dna片段;
[0289]
(iv)在使得发生与经突变的核酸杂交的条件下,将扩增的dna片段与探针杂交,所述探针包含对应于含有突变的胞嘧啶残基的序列的核苷酸序列或与含有突变的胞嘧啶残基的序列互补的核苷酸序列;以及
[0290]
(v)对所述杂交进行检测。
[0291]
对熟练的技术人员将显而易见的是,阴性读出测定优选包括合适的对照样品,以确保阴性结果是由甲基化的核酸而不是反应失败引起的。
[0292]
本发明还提供用于使用本文所述的方法检测和/或量化本发明的诊断序列、或其表达或甲基化的试剂盒。
[0293]
对于用于检测甲基化的试剂盒,本发明的试剂盒可包含至少一种多核苷酸和用于检测基因甲基化的至少一种试剂,所述多核苷酸与本发明的诊断序列中的至少一种杂交。用于检测甲基化的试剂包括:例如,亚硫酸氢钠;多核苷酸,其被设计为如果本发明的生物标志物序列不是甲基化的(例如,包含至少一个c
→
u转化),则与作为所述生物标志物序列的产物的序列杂交;和/或甲基化敏感的限制性酶或甲基化依赖性的限制性酶。所述试剂盒还可包括代表序列的甲基化或非甲基化形式的天然的或合成的对照dna序列。所述试剂盒可提供处于适于在测定中使用的测定装置形式的固体支持物。所述试剂盒还可包含可检测的标记,所述可检测的标记任选地连接至试剂盒中的多核苷酸(例如探针)。所述试剂盒中还可以包括在进行测定中有用的其它材料,包括试管、移液管等。所述试剂盒还可包含关于本文所述的任何测定中的这些试剂中的一种或多种的使用的书面说明。
[0294]
如前文所述,高甲基化与转录沉默有关。因此,除了这些基因的甲基化水平增加提供了筛查食管赘生物或胃部赘生物的倾向或发病的基础之外,这些基因表达水平的下调也具有诊断价值。根据本发明的这个方面,对基因“表达产物”或“基因的表达”的提及是对转录产物(例如初级rna或mrna)或翻译产物(例如蛋白质)的提及。在这方面,可以通过对以下进行筛查来评估基因表达水平的变化:所产生的表达产物(例如,rna或蛋白质)水平的变化、与基因相关的染色质蛋白的变化(例如,在第9或27位氨基酸处赖氨酸上甲基化(抑制性修饰)的组蛋白h3的存在)、或发挥下调表达作用的dna本身的变化(例如dna甲基化的变化)。这些基因及其基因表达产物(无论它们是rna转录物、发挥下调表达作用的dna变化还是编码的蛋白质)统称为“赘生物性标志物”。
[0295]
因此,本发明的另一方面涉及对个体中的食管赘生物或胃部赘生物的发病或发病倾向进行筛查或者对个体中的食管赘生物或胃部赘生物进行监测的方法,所述方法包括对来自所述个体的生物样品中选自以下的dna区域的表达水平进行评估:
[0296]
(i)由如下hg19坐标所定义的区域,包括转录起始位点上游2kb:
[0297]
(1)chr12:24962958..25102393;和/或
[0298]
(2)chr7:50344378...50472798;
[0299]
或者
[0300]
(ii)以下的基因区域,包括上游2kb:
[0301]
(1)bcat1;和/或(2)ikzf1;
[0302]
其中,相对于对照水平,组(i)和/或组(ii)的dna区域中的至少一个的表达水平较低指示食管赘生物或胃部赘生物、或者赘生物性状态的发病倾向。
[0303]
在一个实施方式中,所述对照水平是非赘生物性水平。
[0304]
在另一实施方式中,所述方法涉及对生物样品中的bcat1或ikzf1表达进行筛查。
[0305]
在又一实施方式中,所述方法涉及对生物样品中的bcat1和ikzf1两者的表达进行筛查。
[0306]
在又一实施方式中,所述方法涉及筛查bcat1和ikzf1两者的表达,但其中所述基因中的仅一个表现出较低的表达水平。
[0307]
在进一步的实施方式中,所述方法涉及筛查bcat1和ikzf1两者的表达,但其中所述基因中的两者均表现出较低水平的表达。
[0308]
在又一实施方式中,所述赘生物是恶性的,例如腺癌。
[0309]
在进一步的实施方式中,所述赘生物是非恶性的,例如腺瘤或发育异常。
[0310]
本发明这一方面的方法基于生物样品的赘生物性标志物的水平与这些标志物的对照水平的比较。所述“对照水平”可为“正常水平”,所述正常水平为由非赘生物性的对应的食管或胃部的细胞或细胞群表达的标志物水平;或者它可以是先前分析的样品的标志物表达水平,例如在监测环境中会发生的情况。
[0311]
如前文详述的,正常(或“非赘生物性”)水平可以使用衍生自作为测试受试者的同一个体的组织来确定。然而,将会理解的是,这对有关个体来说可能是相当侵入性的,因此相对于反映从所讨论的患者以外的个体获得的集体结果或个体的标准结果来分析测试结果可能更方便。
[0312]
如上文详述的,本发明被设计为筛查位于食管或胃中的赘生物性细胞或细胞群。因此,对“细胞或细胞群”的提及应理解为对个体细胞或细胞的组的提及。所述细胞的组可为扩散的细胞群、细胞悬液、包裹的细胞群或采取组织形式的细胞群。
[0313]
对“表达”的提及应理解为对核酸分子的转录和/或翻译的提及。对“rna”的提及应理解为涵盖对任何形式的rna的提及,例如初级rna或mrna或非翻译rna(例如mirna等)。不以任何方式限制本发明,引起rna合成增加或减少的基因转录的调节也可能与这些rna转录物(例如mrna)中的一些翻译产生蛋白质产物相关。因此,本发明还扩展至检测方法学,所述检测方法学涉及筛查作为细胞或细胞群的赘生物性状态的指标的赘生物性标志物蛋白产物的调节水平或模式。尽管一种方法是筛查mrna转录物和/或相应的蛋白质产物,但应理解本发明不限于这方面,而是扩展到筛查任何其它形式的赘生物性标志物表达产物,例如,初级rna转录物。
[0314]
对“核酸分子”的提及应理解为对脱氧核糖核酸分子和核糖核酸分子两者及其片段的提及。因此,本发明扩展至直接筛查生物样品中的mrna水平或筛查已从感兴趣的mrna群逆转录的互补cdna两者。设计涉及筛查dna或rna的方法学完全在本领域技术人员的技能范围内。如上所述,本发明的方法还扩展至筛查从目标mrna或基因组dna本身翻译的蛋白质产物。
[0315]
在一个优选的实施方式中,通过参考编码蛋白质产物的基因来测量基因表达水
平,并且更特别是,在蛋白质水平测量所述表达水平。
[0316]
本发明应理解为涵盖基于鉴别一种或多种生物样品中的蛋白质和/或核酸分子两者的检测方法。这可能特别重要,因为感兴趣的赘生物性标志物中的一些可能对应于不编码蛋白质产物的基因或基因片段。因此,就这种情况发生而言,将无法测试蛋白质,并且必须基于转录表达谱或基因组dna的变化来评估目标标志物。
[0317]
术语“蛋白质”应理解为涵盖肽、多肽和蛋白质(包括蛋白质片段)。蛋白质可为糖基化的或未糖基化的和/或可包含与该蛋白质融合、连接、结合或缔合的一系列其它分子,例如氨基酸、脂质、碳水化合物、或其它肽、多肽或蛋白质。本文提及的“蛋白质”包括包含氨基酸序列的蛋白质以及与其它分子(例如氨基酸、脂质、碳水化合物、或其它肽、多肽或蛋白质)缔合的蛋白质。
[0318]
由本发明的赘生物性标志物编码的蛋白质可处于多聚体形式,这意味着两个以上的分子缔合在一起。当相同的蛋白质分子缔合在一起时,复合体是同多聚体。同多聚体的实例是同二聚体。当至少一种标志物蛋白质与至少一种非标志物蛋白质相缔合,则复合物是异多聚体,例如异二聚体。
[0319]
可以通过本领域技术人员公知的任何合适的方法来实现评估生物样品中受试者所表达的赘生物标志物的手段。对此,将会理解的是,就检查同质细胞群(例如从异质起始群富集的细胞群或肿瘤活检)或组织切片而言,可以利用范围广泛的技术,例如原位杂交、通过微量测定来评估表达谱、免疫测定等(下文将更详细地描述),来检测感兴趣的一种或多种标志物的表达水平的缺失或下调。然而,就筛查异质细胞群或其中发现异质细胞群的体液(例如血液样品)而言,特定标志物的表达水平的缺失或减少可能由于存在于样品中的非赘生物性细胞的标志物的固有表达而无法检测到。也就是说,可能无法检测到细胞的亚组的表达水平的降低。在这种情况下,检测赘生物性亚群中本发明的一种或多种标志物表达水平的减少的更合适机制是通过间接手段,例如对表观遗传变化的检测。
[0320]
检测基因表达水平变化的方法(除了前文详细描述的甲基化分析之外),特别是在目标生物样品没有被大量非赘生物性细胞污染的情况下,包括但不限于:
[0321]
(i)体内检测。
[0322]
在给予能够揭示肠组织中标志物的表达改变的成像探针或试剂之后,可使用分子成像。
[0323]
分子成像(moore等,bba,1402:239
‑
249,1988;weissleder等,nature medicine 6:351
‑
355,2000)是与目前使用“经典”诊断成像技术可视化的宏观特征相关的分子表达的体内成像,所述“经典”诊断成像技术例如x射线、计算机断层扫描(ct)、mri、正电子发射断层扫描(pet)或内窥镜检查。
[0324]
(ii)通过原位荧光检测细胞中rna表达的下调
[0325]
杂交(fish),或通过例如定量逆转录酶聚合酶链式反应(qrtpcr)或竞争性rt
‑
pcr产物的流式细胞术鉴定等技术在来自细胞的提取物中(wedemeyer等,clinical chemistry 48:9 1398
‑
1405,2002)。
[0326]
(iii)rna表达谱的评估,例如通过阵列技术(alon等,proc.natl.acad.sci.usa:96:6745
‑
6750,1999年6月)。
[0327]“微阵列”是在固体支持物的表面上形成的优选离散区域的线性或多维阵列,每个
区域具有确定的范围。微阵列上离散区域的密度由单个固相支持物表面上待检测的靶标多核苷酸总数决定。如本文所使用的,dna微阵列是置于芯片或其它表面上用于扩增或克隆靶标多核苷酸的寡核苷酸探针阵列。由于在阵列中每个特定探针组的位置是已知的,可以基于它们对微阵列中特定位置的结合来确定靶标多核苷酸的身份。
[0328]
dna微阵列技术使得能够在单个固相支持物上对多个靶标核酸分子进行大规模测定。美国专利号5,837,832(chee等)和相关专利申请描述了固定寡核苷酸探针阵列用于杂交和检测样品中的特定核酸序列。将从感兴趣的组织中分离的感兴趣的靶标多核苷酸与dna芯片杂交,并基于靶标多核苷酸的偏好以及离散探针位置处的杂交程度来检测特定序列。阵列的一个重要用途是在对差异基因表达的分析中,其中,将不同细胞或组织(通常是感兴趣的组织和对照组织)中基因的表达谱进行比较,并鉴别各个组织之中基因表达的任何差异。此类信息对于鉴别在特定组织类型中表达的基因类型和基于表达谱的病症诊断有用。
[0329]
(iv)对细胞提取物中改变的赘生物性标志物蛋白水平的测量,例如通过免疫测定。
[0330]
可以通过本领域技术人员熟知的多种合适方法中的任一种来进行生物样品中蛋白质性赘生物性标志物表达产物的测试。合适方法的实例包括但不限于组织切片、活检样本或体液样品的抗体筛查。就使用基于抗体的诊断方法而言,标志物蛋白的存在可以以多种方式进行确定,例如通过蛋白质印迹、elisa或流式细胞术程序。当然,这些包括非竞争性类型的单点和双点或“夹心”测定,以及传统的竞争性结合测定。这些测定还包括标记抗体对靶标的直接结合。
[0331]
(v)确定细胞表面上蛋白质赘生物性标志物的表达改变,例如通过免疫组织化学。
[0332]
(vi)除了以上(iv)点和(v)点中详述的那些之外,基于任何合适的功能测试、酶促测试或免疫学测试来确定改变的蛋白质表达。
[0333]
作为常规程序,本领域普通技术人员可以确定将给定方法应用于特定类型的生物样品的适当性。
[0334]
本发明的相关方面提供了分子阵列,所述阵列包括以下的多个:
[0335]
(i)包含对应于前文所述的赘生物性标志物dna中的任意两种或多种的核苷酸序列或与其具有至少80%同一性的序列的核酸分子,或所述核酸分子的功能衍生物、片段、变体或同源物;或者
[0336]
(ii)包含能够在中等严格性条件下与(i)的序列中的任意一个或多个杂交的核苷酸序列的核酸分子,或所述核酸分子的功能衍生物、片段、变体或同源物;或者
[0337]
(iii)包含能够在中等严格性条件下与(i)的序列中的任意两个或多个杂交的核苷酸序列的核酸探针或寡核苷酸,或所述核酸分子的功能衍生物、片段、变体或同源物;或者
[0338]
(iv)能够结合至由(i)的核酸分子所编码的蛋白质中的任意两个或多个的探针,或其衍生物、片段或同源物,
[0339]
其中,(i)
‑
(iii)的所述标志物基因或(iv)的蛋白质的表达水平指示衍生自食管或胃的细胞或细胞亚群的赘生物性状态。
[0340]
优选地,所述百分比同一性是至少85%、90%、91%、92%、93%、94%、95%、96%、
97%、98%或99%。
[0341]“杂交”是指核酸链通过碱基配对与互补链连接的过程。杂交反应可以是敏感和选择性的,使得即使在特定的感兴趣序列以低浓度存在的样品中也可以将其鉴别出。严格性条件可以通过例如预杂交和杂交溶液中盐或甲酰胺的浓度进行限定或通过杂交温度进行限定,并且这是本领域公知的。例如,可以通过减少盐浓度、增加甲酰胺浓度或提高杂交温度、改变杂交时间来增加严格性,如下文所详细描述的。在替代的方面中,如本文所述,本发明的核酸由它们在各种严格性条件(例如,高、中等和低)下杂交的能力来定义。
[0342]
本文提及的低严格性包括并涵盖:至少0%或至少约0%至至少15%或至少约15%v/v甲酰胺和至少1m或至少约1m至至少2m或至少约2m盐用于杂交,以及至少1m或至少约1m至至少2m或至少约2m盐用于洗涤条件。通常,低严格性为25
‑
30℃或约25
‑
30℃至42℃或约42℃。可以改变温度,较高的温度用于代替甲酰胺和/或提供替代的严格性条件。可在需要的情况下应用替代的严格性条件,例如中等严格性或高严格性,所述中等严格性条件包括并涵盖至少16%v/v或至少约16%v/v至至少30%v/v或至少约30%v/v甲酰胺和至少0.5m或至少约0.5m至至少0.9m或至少约0.9m的盐用于杂交,以及至少0.5m或至少约0.5m至至少0.9m或至少约0.9m盐用于洗涤条件;所述高严格性包括并涵盖至少31%v/v或至少约31%v/v至至少50%v/v或至少约50%v/v甲酰胺和至少0.01m或至少约0.01m至至少0.15m或至少约0.15m的盐用于杂交,以及至少0.01m或至少约0.01m至至少0.15m或至少约0.15m的盐用于洗涤条件。通常,洗涤在t
m
=69.3 0.41(g c)%(marmur和doty,j.mol.biol.5:109,1962)进行。然而,随着错配碱基对数量每增加1%,双链体dna的t
m
降低1℃(bonner和laskey,eur.j.biochem.46:83,1974)。在这些杂交条件下甲酰胺是可选的。因此,特别优选的严格性水平按照如下来定义:低严格性为25
‑
42℃下6
×
ssc缓冲液,0.1%w/v sds;中等严格性为在温度范围为20℃至65℃下2
×
ssc缓冲液,0.1%w/v sds;高严格性为0.1
×
ssc缓冲液,0.1%w/v sds,温度为至少65℃。
[0343]
当本发明的核酸由它们在高严格性下杂交的能力定义时,这些条件包含在37℃或约37℃至42℃或约42℃下50%或约50%甲酰胺。在一方面中,本发明的核酸由它们在降低的严格性下杂交的能力来定义,所述降低的严格性包括在30℃或约30℃至35℃或约35℃下在35%或约35%至25%或约25%甲酰胺中的条件。或者,本发明的核酸由它们在高严格性下杂交的能力来定义,所述高严格性包括在42℃下在50%甲酰胺、5
×
sspe、0.3%sds和重复序列阻断核酸(例如cot
‑
1或鲑鱼精dna(例如,200n/ml剪切和变性的鲑鱼精dna))中的条件。在一方面中,本发明的核酸由它们在降低的严格性条件下杂交的能力来定义,所述降低的严格性条件包括在35℃的降低温度下35%甲酰胺。
[0344]
优选地,目标探针被设计成以使非特异性反应的发生率最小化的特异性水平结合它们所针对的核酸或蛋白质。然而,将会理解的是,可能无法消除所有潜在的交叉反应性或非特异性反应性,这是任何基于探针的系统的固有局限。
[0345]
就用于检测目标蛋白的探针而言,它们可以采用任何合适的形式,包括抗体和适体。
[0346]
核酸或蛋白质探针的文库或阵列提供丰富且高度有价值的信息。此外,此类序列的两个以上的阵列或谱(从使用阵列获得的信息)是用于将测试组结果与参考(例如另一样品或存储的校准物)进行比较的有用工具。在使用阵列时,个体探针通常固定在不同的位置
并允许反应以进行结合反应。与组装的标志物集相关的引物对于制备序列文库或直接检测来自其它生物样品的标志物有用。
[0347]
基因标志物的文库(或阵列,当指的是对应于文库中的至少一些序列的物理分离的核酸时)表现出高度期望的特性。这些特性与特定条件相关,并且可以表征为调控谱。此处所称的谱是指提供最初衍生出标志物的组织的诊断信息的成员集。在许多情况下,谱包括由沉积序列制成的阵列上的一系列点。
[0348]
通常通过使用阵列来制备特征性患者谱。阵列谱可以与一个或多个其它阵列谱或其它参考谱进行比较。比较结果可以提供关于疾病状态、发育状态、对疗法的接受度以及有关患者的其它信息的丰富信息。
[0349]
本发明的另一方面提供了用于分析生物样品的诊断试剂盒,所述试剂盒包含用于检测一种或多种赘生物性标志物的一种或多种药剂和对促进所述药剂的检测有用的试剂。还可包括进一步的手段,例如,用以接收生物样品。所述药剂可以是任何合适的检测分子。
[0350]
本文使用肯定的语言来描述许多实施方式,大体上公开了本发明。本发明还包括在其中全部或部分排除主题(如物质或材料、方法步骤和条件、方案或程序)的实施方式。
[0351]
通过参考以下非限制性实例进一步描述本发明。本领域技术人员将理解的是,许多其它实施方式也落入本发明的范围内,如上文和权利要求中所描述的。
[0352]
实施例
[0353]
实施例1:食管癌的分析
[0354]
研究组群
[0355]
进行了观察性研究,所述研究在原发性癌症的任何治疗或切除之前收集来自患有前列腺(n=94)、乳腺(32)、食管(49)或结肠/直肠(211)的侵入性腺癌的患者的血液,以及来自没有已知的既往或当前腺癌的253名经临床评估对照的血液,表1。此外,在治疗前或手术时从前列腺癌(n=9)、乳腺癌(26)、食管癌(6)和结肠/直肠癌(15)患者的癌症和邻近的非赘生物性组织中收集活检。
[0356]
方法
[0357]
从4ml k3edta血浆和10mg
‑
20mg组织中提取dna并进行亚硫酸氢盐转化。使用实时多重pcr测定来测定所有dna样品的甲基化bcat1和ikzf1 dna。关于bcat1和ikzf1中的甲基化,对共5ng亚硫酸氢盐转化的组织dna进行测定,并将表达水平表示为总输入的百分比(通过actb确定)。如果任一基因的甲基化%高于非赘生物性组织水平的第75个百分位,则认为组织样品为阳性。具有任一甲基化标志物的任何可检测信号的血液样品被认为是阳性的。根据表5中描述的方案进行实时pcr。表6中描述了用于bcat1和ikzf1 pcr的探针和引物。
[0358]
结果
[0359]
组织
[0360]
对于bcat1和ikzf1二者,结直肠癌(crc)和食管癌组织与匹配的非赘生物性组织相比具有显著较高的甲基化水平,图1(上子图)
[0361]
前列腺癌(bcat1,0.3%;ikzf1,0.1%)和乳腺癌(0%)组织中的中位(或四分位距,iqr)甲基化水平比在crc(60.4%;70.7%)和食管癌(31.0;63.7%)组织中测量的水平低2
‑
3个数量级,表1&图1(下子图)。
[0362]
使用在非赘生物性组织中测量的第75个百分位数作为阳性截止值(cutoffs),癌
症组织阳性率为:crc,14/15,93.3%(95%ci:68.1
‑
99.8);食管,6/6,100%(54.1
‑
100);前列腺,4/9,44.4%(13.7
‑
78.8);乳腺,11/26,42.3%(23.4
‑
63.1)。
[0363]
血液
[0364]
与对照(16/253,6.3%,3.7
‑
10.1;p<0.01)相比,循环肿瘤dna(ctdna)阳性率仅在crc(126/211,59.7%,95%ci:52.8
‑
66.4)和食管癌(26/49,53.1%,38.3
‑
67.5)病例中显著较高。
[0365]
ctdna在晚期癌症中更可能呈阳性(表2)。其它癌症和阳性状态与任何患者人口统计学或肿瘤特征没有显著关联(p>0.05)。
[0366]
结论
[0367]
与对照相比,只有结直肠癌和食管癌患者具有显著较高的ctdna阳性率(使用甲基化bcat1/ikzf1)。这也反映在癌症组织中显示甲基化的病例的比例较高。
[0368]
应进一步研究甲基化bcat1/ikzf1血液测试作为对于食管癌的筛查和监测工具,以及其现有的对于crc的用途。
[0369]
表1:研究组群
[0370][0371][0372]
表2:早期v晚期癌症的血液阳性
[0373][0374]
*1个前列腺癌未分期
[0375]
实施例2:胃癌的分析
[0376]
癌组织和非癌组织样本中bcat1和ikzf1的甲基化
[0377]
所有癌组织的甲基化水平显著高于相邻的非肿瘤组织(chi2检验,p<0.05)。胃癌组织中癌组织阳性率高(9/12,75.0%)(表3)。
[0378]
表3
[0379] 正常组织癌组织胃腺癌1/12(8.3%)9/12(75%)
[0380]
血液样品中bcat1和ikzf1的甲基化
[0381]
关于甲基化生物标志物,在胃癌患者中观察到血液样品的高阳性率(表4)。
[0382]
表4:腺癌中甲基化bcat1和ikzf1的血液阳性
[0383]
癌症类型阳性率,阳性数量/总数(%)健康对照16/253(6.3%)胃部9/22(40.9%)*
[0384]
*与对照相比p<0.05
[0385]
实施例3:实施例1和实施例2的详细方法
[0386]
方法
[0387]
将来自参与者的静脉血(18ml)收集到k3edta vacuette管(greiner bio
‑
one,frickenhausen,德国)中。血浆处理前(自采血未有44h),将血液管保持在4℃。血浆通过在4℃下以1,500g离心10min(在最低设置下减速)而制备,随后回收血浆级分并重复离心。产生的血浆储存在
‑
80℃。将冷冻血浆样品在干冰上运送到clinical genomics technologies(悉尼,澳大利亚),并在
‑
80℃下储存直至测试。
[0388]
血液dna甲基化测试。关于甲基化的bcat1和ikzf1 dna的存在,将至少3.9ml的所有血浆样品在clinical genomics technologies进行测定。按照pedersen s,symonds e,baker r等(evaluation of an assay for methylated bcat1 and ikzf1 in plasma for detection of colorectal neoplasia.bmc cancer 2015;15:654)中所描述的,以22个样品加两个处理对照的批次对样品进行加工和测定,但具有如下变化:亚硫酸氢盐转化设置和随后的纯化在qiacube ht仪器(qiagen,hilden,德国)上自动化,并且甲基化特异性pcr测定中的ikzf1组分被修饰以能够检测部分甲基化的ikzf1靶标区域(表5)。用在light cycler 480ii仪器(roche diagnostics,in,usa)上进行的实时pcr,对来自每个血浆样品的亚硫酸氢盐转化的dna以三重复进行测定。如果至少一个pcr复制关于bcat1或ikzf1 dna甲基化呈阳性,则认为样品定性为阳性。
[0389]
统计分析。主要结果测量为诊断的阳性率。假设二项式分布用于计算95%置信区间(95%ci)。配对阳性比例和一致性分析的差异使用mcnemar检验进行分析,而非配对比例的差异使用χ2检验(双尾;显著性水平,0.05)。通过多元逻辑回归分析来分析潜在的混杂协变量(年龄、性别)。测试敏感性评价表示为真阳性与真阳性加假阴性总和的比率。在没有crc的情况下,特异性评价为1
‑
阳性率。由于排泄物免疫化学测试(fit)是定量的,并且阳性的截止值可变化,因此通过进行受试者工作特征曲线分析以及以与血液dna测试等效的特异性评价相对真阳性率(以及因此的敏感性)来促进测试比较。graphpad在线科学软件工具用于上述统计学分析。p值<0.05被认为统计学上显著。
[0390]
引物和探针
[0391]
bcat1 pcr靶标扩增子的野生型dna序列位于12号染色体负链;
[0392][0393]
ikzf1 pcr靶标扩增子的野生型dna序列位于7号染色体正链;
[0394][0395]
用于测量样本中ikzf1和bcat1甲基化水平的pcr方案
[0396]
表5:实时pcr方案bcat1和ikzf1
[0397][0398]
表6
[0399]
[0400][0401]
将来自参与者的静脉血(18ml)收集到k3edta vacuette管(greiner bio
‑
one,frickenhausen,德国)中。血浆处理前(自采血未有44h),将血液管保持在4℃。血浆通过在4℃下以1,500g离心10min(在最低设置下减速)而制备,随后回收血浆级分并重复离心。所得的血浆储存在
‑
80℃。将冷冻血浆样品在干冰上运送到clinical genomics technologies(悉尼,澳大利亚),并在
‑
80℃下储存直至测试。
[0402]
实施例4:使用外泌体样品进行分析
[0403]
从患有4期食道癌(iv期oec)的受试者和未患有任何癌症的对照受试者收集血清。从血清样品中分离出外泌体。根据实施例3中描述的方法分析所分离的外泌体样品以确定bcat1和ikzf1的甲基化水平。关于甲基化生物标志物,在癌症患者中观测到外泌体样品中的高阳性率,但在对照患者中未观测到(表7)。
[0404]
表7:甲基化bcat1和ikzf1的外泌体阳性
[0405]
外泌体来源阳性率,阳性数/总数(%)健康对照(n=3)0/3(0%)食道受试者(n=3)2/3(67%)
[0406]
在至少一些先前描述的实施方式中,实施方式中使用的一个或多个要素可以互换地用于另一实施方式中,除非这种替换在技术上不可行。本领域技术人员将理解,在不脱离所要求保护的主题的范围的情况下,可以对上述方法和结构进行各种其它省略、添加和修改。所有这些修改和变化都旨在落入由所附权利要求限定的主题的范围内。
[0407]
关于本文中任意复数和/或单数术语的实质使用,本领域技术人员可以视上下文和/或应用的情况而从复数转换为单数和/或从单数转换为复数。为清楚起见,本文可以明确地阐述各种单数/复数的置换。
[0408]
本领域技术人员将理解,通常,本文使用的术语、尤其是所附权利要求(例如所附权利要求的正文)中使用的术语通常旨在作为“开放式”术语(例如术语“包括”应解释为“包
括但不限于”,术语“具有”应解释为“具有至少”,术语“包含”应解释为“包含但不限于”等)。本领域技术人员将进一步理解,如果期望特定数量的介绍性的权利要求详述,在权利要求中将明确地详述该期望,并且在缺少这样的详述的情况下,不存在这样的期望。例如,为了帮助理解,以下所附权利要求可以包含介绍性短语“至少一个”和“一个或多个”的使用以引入权利要求详述。然而,即使当相同的权利要求包含介绍性短语“一个或多个”或“至少一个”,以及诸如“一种/一个”的不定冠词(例如“一种”和/或“一个”应该被解释为“至少一个/一种”或“一个或多个/一种或多种”),这些短语的使用也不应被解释为暗示由不定冠词“一个/一种”介绍的权利要求详述将包含这种介绍性权利要求详述的任意特定权利要求限制于仅包含一个这样的详述的实施方式;对于用于介绍权利要求详述的定冠词的使用也是如此。另外,即使明确地引述了特定数量的介绍性权利要求详述,本领域技术人员将认识到,这种引述应该被解释为至少表示所引述的数字(例如,仅有“两个详述”而没有其它修饰语的详述表示至少两个详述或两个以上的详述)。此外,在使用类似于“a、b和c等中的至少一个”的惯例的情况下,通常这样的结构旨在在本领域技术人员将理解该惯例的意义上进行的(例如,“具有a、b和c中的至少一个的系统”将包括但不限于具有单独的a、具有单独的b、具有单独的c、a和b一起具有、a和c一起具有、b和c一起具有、和/或a、b和c一起具有的系统等)。在使用类似于“a、b和c等中的至少一个”的惯例的情况下,通常这样的结构旨在在本领域技术人员将理解该惯例的意义上进行的(例如,“具有a、b和c中的至少一个的系统”将包括但不限于具有单独的a、具有单独的b、具有单独的c、a和b一起具有、a和c一起具有、b和c一起具有、和/或a、b和c一起具有的系统等)。本领域技术人员将进一步理解,无论是在说明书、权利要求或附图中,实际上呈现两个以上的替代术语的任意转折词和/或短语都应该被理解为考虑包括这些术语之一、任意一个术语或两个术语的可能性,例如,短语“a或b”将被理解为包括“a”或“b”或“a和b”的可能性。
[0409]
另外,在以马库什组描述本公开的特征或方面的情况下,本领域技术人员将认识到,本公开也因此以马库什组的任意个体成员或成员亚组的形式来描述。
[0410]
如本领域技术人员将理解的,出于任意和所有目的(如就提供书面描述而言),本文公开的所有范围还涵盖该范围的任意和所有可能的子范围及子范围的组合。任意列出的范围都可以容易地被认为充分描述并且使得相同的范围被分成至少相等的两等分、三等分、四等分、五等分、十等分等。作为非限制性实例,本文所讨论的每个范围可以被容易地分成下三分之一、中三分之一和上三分之一等。如本领域技术人员还将理解的,如“多达”、“至少”、“大于”、“小于”等的所有语言包括所引述的数字,并且涉及如上所讨论的可以随后分成子范围的范围。最后,如本领域技术人员将理解的,范围包括每个个体成员。因此,例如具有1
‑
3个物品的组是指具有1、2或3个物品的组。类似地,具有1
‑
5个物品的组是指具有1、2、3、4或5个物品的组等。
[0411]
虽然本文已经公开了各种方面和实施方式,但是其它方面和实施方式对于本领域技术人员而言将是显而易见的。本文公开的各个方面和实施方式是出于说明的目的而不是旨在限制,真正的范围和精神由所附权利要求指示。
[0412]
应当理解,本文描述的实例和实施方式仅出于说明的目的。根据其的各种修改或变化将被本领域技术人员提出并将被包括在本技术的精神和界限以及所附权利要求的范围内。本文引用的所有出版物、专利和专利申请出于所有目的以引用的方式将其整体并入
此处。
[0413]
在本公开中引用的所有文章、专利、专利申请和其它出版物均以引用的方式将其整体各自并入本文。
[0414]
参考文献
[0415]
abrams and stanton,methods enzymol.,212:71
‑
74,1992
[0416]
adorjan et al.nucl.acids res.,30:e21,2002
[0417]
alon et al.,proc.natl.acad.sci.usa:96:6745
‑
6750,june 1999
[0418]
ammerpohl et al.biochim biophys acta.1790:847
‑
62,2009
[0419]
beaucage,et al.tetrahedron letters 22:1859
‑
1862,1981
[0420]
bianco et al.,hum.mutat.,14:289
‑
293,1999
[0421]
bonner and laskey,eur.j.biochem.46:83,1974
[0422]
bresslauer et al.,proc.natl.acad.sci.usa,83:3746
‑
3750,1986
[0423]
caruthers,m.h.,et al.,methods in enzymology,vol.154,pp.287
‑
314(1988)
[0424]
chen and kwok,nucleic acids res.25:347
‑
353,1997
[0425]
clark et al.nat protoc.1:2353
‑
64,2006
[0426]
clark et al.,nucl.acids res.22:2990
‑
2997,1994
[0427]
cottrell et al.,nucl.acids res.32:e10,2003
[0428]
degraves,et al.,biotechniques 34(1):106
‑
10,112
‑
5(2003)
[0429]
deiman b,et al.,mol.biotechnol.20(2):163
‑
79(2002)
[0430]
deng et al.chin.j.cancer res.,12:171
‑
191,2000
[0431]
dieffenbach(ed)and dveksler(ed)(in:pcr primer:a laboratory manual,cold spring harbour laboratories,ny,1995
[0432]
eads et al.,nucl.acids res.28:e32,2000
[0433]
egholm et al.,am.chem.soc.,114:1895,1992
[0434]
egholm et al.,nature,365:566,1993
[0435]
fodor et al.,science 767
‑
773,1991
[0436]
frommer et al.,proc.natl.acad.sci.usa 89:1827
‑
1831(1992)
[0437]
gibson et al.,genome research 6:995
‑
1001(1996)
[0438]
golub et al.,science,286:531
‑
537,1999
[0439]
gonzalgo&jones,nucleic acids res.25:2529
‑
2531(1997)
[0440]
gonzalgo et al.,cancer res.57:594
‑
599,1997
[0441]
gregory and feil,nucleic acids res.,27,e32i
‑
e32iv,1999
[0442]
havelange et al.,blood 2011,118:2827
[0443]
herman et al.proc.natl.acad.sci.usa 93:9821
‑
9826(1996)
[0444]
holland et al.,proc.natl.acad.sci.usa,88:7276
‑
7280,1991
[0445]
javierre et al.,mol.cancer res.9(8):1139
‑
51,2011
[0446]
kawai et al.,mol.cell.biol.14:7421
‑
7427,1994
[0447]
kibriya et al.,bmc 2011,4:50
[0448]
kristensen and hansen clin chem.55:1471
‑
83,2009
[0449]
kuppuswamy et al.,proc.natl.acad.sci.usa 88:1143
‑
1147,1991
[0450]
landegren et al.,genome res.,8(8):769
‑
776,1998
[0451]
lee et al.,nucleic acid res.21:3761
‑
3766,1993
[0452]
markowitz and bertagnolli,2009,n.engl.j.med.361(25):2449
‑
60
[0453]
marmur and doty,j.mol.biol.5:109,1962
[0454]
martinez et al.,am.j.surg pathol.2012,36:296
[0455]
mcpherson et al.,pcr:a practical approach.(series eds,d.rickwood and b.d.hames),
[0456]
irl press limited,oxford.pp 1
‑
253,1991
[0457]
messing,methods enzymol,101,20
‑
78,1983
[0458]
mhlanga and mahnberg,methods 25:463
‑
471,2001
[0459]
moore et al.,bba,1402:239
‑
249,1988
[0460]
narang,et al.meth.enzymol 68:90,1979
[0461]
nevrivy et al.jbc 2000,275(22):16827
‑
36
[0462]
nielsen et al.j.chem.soc.perkin trans.,1:3423,1997
[0463]
olek,et al.nat.genet.17(3):275
‑
6(1997)
[0464]
orum et al.,clin.chem.45:1898
‑
1905,1999
[0465]
orum et al.,nucl.acids res.,21:5332,1993
[0466]
oster et al.,int.j.cancer 2011,129:2855
[0467]
pathak et al.plos one 2011,6:e22628
[0468]
rand et al.epigenetics 1:94
‑
100,2006
[0469]
rand et al.nucl.acids res.33:e127,2005
[0470]
rein,et al.nucleic acids res.26(10):2255
‑
64(1998)
[0471]
sadri&hornsby.nucl.acids res.24:5058
‑
5059(1996)
[0472]
sambrook et al.,molecular cloning,a laboratory manual(2nd ed.,cshp,new york 1989)
[0473]
santa lucia,proc.natl.acad.sci.usa,95:1460
‑
1465,1995
[0474]
shames et al.cancer lett.251:187
‑
98,2007
[0475]
simeonov and nikiforov,nucleic acids research,30(17):1
‑
5,2002
[0476]
singer
‑
sam et al.,nucl.acids res.18:687,1990
[0477]
singer
‑
sam et al.,pcr methods appl.1:160
‑
163,1992
[0478]
singh and wengel,chem.commun.1247,1998
[0479]
slattery et al.,carcinogenesis 2011,32:160
[0480]
southern et al.,genomics,13:1008
‑
1017,1992
[0481]
szabo and mann,genes dev.9:3097
‑
3108,1995
[0482]
toyota et al.,cancer res.59:2307
‑
12(1999)
[0483]
uhlmann et al.,electrophoresis,23:4072
‑
4079,2002
[0484]
wedemeyer et al.,clinical chemistry48:9 1398
‑
1405,2002
[0485]
weissleder et al.,nature medicine 6:351
‑
355,2000
[0486]
weitzel jn(december 1999),cancer 86(11 suppl):2483
‑
92
[0487]
worm et al.,clin.chem.,47:1183
‑
1189,2001
[0488]
xiong&laird,nucleic acids res.25:2532
‑
2534(1997)
[0489]
yamashita et al.(cancer sci.2010,101:1708)
[0490]
zyskind et al.,recombinant dna laboratory manual,(acad.press,1988)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

