具有i型光敏反应和光热协同效应的酞菁
‑
奋乃静偶联物与在制药领域的应用
技术领域
1.本发明属于光动力治疗药物和光热治疗药物领域,具体涉及一种具有i型光敏反应和光热协同效应的酞菁
‑
奋乃静偶联物及其合成与在制药领域的应用。
背景技术:
2.当前恶性肿瘤已成为影响人类健康、威胁人类生命的主要疾病之一,但是传统的肿瘤治疗方法包括手术和化疗等均存在较大缺点和不足,致使肿瘤的防治已经成为当前急需解决的问题。随着科技的发展,一些新型的恶性肿瘤治疗方法不断涌现,这其中就包括了光动力治疗(photodynamic therapy, pdt)。pdt作为一种非侵入性的治疗手段,因其具有非侵入性、毒副作用小、收效快、重复应用下不会产生耐药性等优点而备受人们关注与期待。
3.光敏剂(光动力药物)是决定光动力治疗效果的关键因素。光敏剂光敏化产生活性氧的机制有i型反应和ii型反应二种类型。光激发处于非激发态(s0)的光敏剂吸收光子的能量跃迁到激发单线态(s1),激发单线态通过系间窜越转换至寿命相对较长的激发三线态(t1),之后,处于激发三线态的光敏剂通过电子转移和底物相互作用,产生超氧阴离子(o2·
-
)等活性氧,此过程称为ⅰ型反应。处于激发三线态的光敏剂也可直接将能量转移给基态的分子氧,产生活性较高的单线态氧(1o2),此过程称为ii型反应。无论是i型反应还是ii型反应,它们产生的活性氧都可以起到杀伤癌细胞、破坏肿瘤组织的治疗作用。大部分光敏剂是通过ii型反应产生活性氧,具有有效i型光敏机制的光敏剂极少见。ii型机制高度依赖于环境中氧气的存在,而i型机制对氧的依赖性较低。由于缺氧是实体肿瘤的主要特征之一,不依赖氧气的i型机制光敏剂在光动力抗实体瘤将拥有更好的应用价值。
4.由于具有光敏化能力强、在光疗窗口(600
‑
800 nm)有强吸收、暗毒性低且结构易于修饰等优点,酞菁作为新一代光敏剂的应用备受关注。酞菁属于苯并氮杂卟啉类衍生物,是由18个π电子组成的大环共轭体系。可通过引入不同的周环取代和轴向取代,以及更换不同的中心离子来合成不同结构和功能的酞菁。目前已经有四种酞菁配合物进入临床试验,它们分别是photosens
®
、pc 4、cgp55847(znpc)和photocyanine(福大赛因)。但是,以上酞菁光敏剂都是通过对氧气依赖性较大的ii型机制发挥作用的,对实体瘤的光动力治疗效果受到限制。奋乃静是临床常用药,生物安全性有保障,且其化学结构中包含富电子的吩噻嗪结构。因此,将奋乃静通过共价偶联引入到酞菁中,有望获得通过电子转移的i型光敏剂。
技术实现要素:
5.本发明的目的在于一种具有i型光敏反应和光热协同效应的酞菁
‑
奋乃静偶联物及其制备方法与应用,该偶联物不但可产生有效的i型光敏反应而且可产生光热效应,在乏氧实体瘤的光治疗中具有显著的应用前景。
6.为实现上述目的,本发明采用如下技术方案。
7.本发明的目的之一是保护一种酞菁
‑
奋乃静偶联物,该偶联物为酞菁锌
‑
奋乃静偶联物或酞菁硅
‑
奋乃静偶联物,其在水中能够发生自组装。
8.所述酞菁锌
‑
奋乃静偶联物具体为单取代酞菁锌
‑
奋乃静偶联物,其结构式为:,或为四取代酞菁锌
‑
奋乃静偶联物,其结构式为:。
9.所述酞菁硅
‑
奋乃静偶联物具体为轴向不对称取代酞菁硅
‑
奋乃静偶联物,其结构式为:,或为轴向对称取代酞菁硅
‑
奋乃静偶联物,其结构式为
。
10.本发明的目的之二是保护上述酞菁
‑
奋乃静偶联物的制备方法,其中:所述单取代酞菁锌
‑
奋乃静偶联物的制备是以1
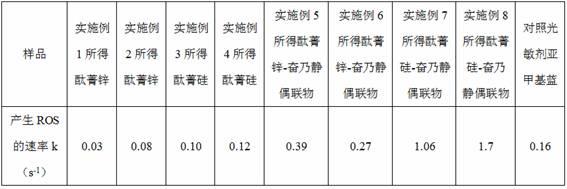
‑
(4
‑
(2
‑
羧基乙基)苯氧基)酞菁锌()和奋乃静为反应物,n,n
‑
二甲基甲酰胺为溶剂,加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐为缩合剂、4
‑
二甲氨基吡啶为催化剂,于25
‑
45 ℃下搅拌反应12
‑
48小时,通过薄层色谱法监控反应终点,再通过溶剂法或色谱法纯化目标产物,得到单取代酞菁锌
‑
奋乃静偶联物;所用1
‑
(4
‑
(2
‑
羧基乙基)苯氧基)酞菁锌、奋乃静、1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐和4
‑
二甲氨基吡啶的投料摩尔比为1:(1.2~5):(1.4~5.7):(1.9~7.5)。
11.所述四取代酞菁锌
‑
奋乃静偶联物的制备是以1,8(11),15(18),22(25)
‑
四(4
‑
(2
‑
羧基乙基)苯氧基)酞菁锌()和奋乃静为反应物,使用n,n
‑
二甲基甲酰胺为溶剂,加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐为缩合剂、4
‑
二甲氨基吡啶为催化剂,于25
‑
45 ℃下搅拌反应12
‑
48小时,通过薄层色谱法监控反应终点,再通过溶剂法或色谱法纯化目标产物,得到四取代羧酸基酞菁锌
‑
奋乃静偶联物;所用1,8(11),15(18),22(25)
‑
四(4
‑
(2
‑
羧基乙基)苯氧基)酞菁锌、奋乃静、1
‑
(3
‑
二甲
氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐和4
‑
二甲氨基吡啶的投料摩尔比为1:(4.8~20):(5.6~22.8):(7.6~30)。
12.所述轴向不对称取代酞菁硅
‑
奋乃静偶联物的制备是以轴向不对称单羧基取代硅酞菁()和奋乃静为反应物,使用n,n
‑
二甲基甲酰胺为溶剂,加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐为缩合剂、4
‑
二甲氨基吡啶为催化剂,于25
‑
45 ℃下搅拌反应12
‑
48小时,通过薄层色谱法监控反应终点,再通过溶剂法或色谱法纯化目标产物,得到轴向不对称取代酞菁硅
‑
奋乃静偶联物;所用轴向不对称单羧基取代硅酞菁、奋乃静、1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐和4
‑
二甲氨基吡啶的投料摩尔比为1:(1.2~5):(1.4~5.7):(1.9~7.5)。
13.所述轴向对称取代酞菁硅
‑
奋乃静偶联物的制备是以轴向对称二羧基取代硅酞菁()和奋乃静为反应物,使用n,n
‑
二甲基甲酰胺为溶剂,加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐为缩合剂、4
‑
二甲氨基吡啶为催化剂,于25
‑
45 ℃下搅拌反应12
‑
48小时,通过薄层色谱法监控反应终点,再通过溶剂法或色谱法纯化目标产物,得到轴向对称取代酞菁硅
‑
奋乃静偶联物;所用轴向对称二羧基取代硅酞菁、奋乃静、1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐和4
‑
二甲氨基吡啶的投料摩尔比为1:(2.4~10):(2.8~11.4):(3.8~15)。
14.本发明的目的之三是保护上述酞菁
‑
奋乃静偶联物的应用,其具体是将所述酞菁
‑
奋乃静偶联物或其自组装体用于制备光动力药物、光热药物或光动力
‑
光热联用药物。所述光动力药物为i型机制光敏剂。所述光热药物包括光热成像试剂。
15.所述光动力药物,或称光敏药物制剂,又称为光敏剂,可用于光动力治疗、光动力诊断或光动力消毒。所述光动力治疗可以是恶性肿瘤的光动力治疗,或是白血病的骨髓体外光动力净化治疗,或是非癌症疾病的光动力治疗,如真菌感染、细菌感染、口腔疾病、黄斑变性眼病、动脉硬化、创伤感染、皮肤病、病毒感染。所述光动力消毒可以是血液或血液衍生物的光动力灭菌净化,或是水的光动力灭菌消毒,或是医用或生活用器具的光动力消毒。
16.本发明所述酞菁
‑
奋乃静偶联物在光动力治疗、光动力诊断、光动力消毒和光动力降解污染物中的应用,需配套适宜的光源,所述适宜的光源可以由普通光源连接合适的滤光片来提供或由特定波长的激光或led灯或其他灯源来提供,光源的波长范围为680~710 nm。
17.本发明的有益效果和突出优势是:(1)在水中,本发明所述酞菁
‑
奋乃静偶联物及其自组装体不但可产生有效的i型光敏反应而且可产生光热效应,因而可作为光敏剂、光热剂或光动力
‑
光热联用药物,且其在作为光动力
‑
光热联用药物时,可在近红外激光的照射及乏氧条件下产生较高量的超氧阴离子活性氧与明显的光热效应。其中,其所发挥的i型光敏机制以及i型光敏机制协同光热效应是其他类型酞菁偶联物不具有的。
18.(2)细胞实验证明,利用所述偶联物或其自组装体所制备的光动力
‑
光热联用药物,在有氧与无氧条件下都具有较高的抗癌活性,显示了较高的光动力治疗和光热治疗协同效应。动物实验表明,所述偶联物或其自组装体具有良好的肿瘤靶向性和光动力/光热联合治疗效应,在乏氧肿瘤的治疗领域具有显著的应用前景。
19.(3)本发明所述酞菁
‑
奋乃静偶联物可以在水中发生自组装,自组装体的形成可增强其i型光敏效率和光热效应。
20.(4)本发明酞菁
‑
奋乃静偶联物的制备过程操作简单、性质稳定、便于储存、有利于在工业生产中大批量的制备,产业化前景良好。
附图说明
21.图1为实施例16中注射24小时后小鼠各个组织器官中酞菁
‑
奋乃静偶联物的荧光成像分布情况图。
具体实施方式
22.为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
23.实施例1
1
‑
(4
‑
(2
‑
羧基乙基)苯氧基)酞菁锌()的合成:(1)邻苯二甲腈衍生物()的制备:以3
‑
硝基邻苯二甲腈(10 mmol)和对羟基苯丙酸(10
‑
40 mmol,优选20 mmol)为反应物,以二甲亚砜(dmso)(20
‑
100 ml,优选30 ml)为溶剂,在碳酸钾(30
‑
90 mmol,优选50 mmol)存在和氮气保护下,20
‑
45 ℃(优选45 ℃)下搅拌反应17
‑
24小时,,通过薄层色谱监控反应终点。反应结束后,将反应液加入到300 ml的冰水中,加入1 m hcl使其析出大量棕黄色沉淀,用布什漏斗抽滤,用大量的去离子水洗至滤液为中性,收集粗产物。干燥后将粗产物加入少量的丙酮溶解,然后加入去离子水进行重结晶,抽滤,水洗,干燥,得产物,产率为85%。
24.表征数据:1h nmr (dmso
‑
d6, ppm): 12.16 (s, 1h, cooh); 7.94
‑
7.68 (m, 2h, ar
‑
h); 7.49
‑
7.28 (d, j = 7.9 hz, 2h, ar
‑
h); 7.25 (m 1h, ar
‑
h); 7.18 (d, j = 4.19 hz, 2h, ar
‑
h); 2.87 (t, j = 24.4, 17.1 hz, ar
‑
ch2); 2.58 (t, j = 7.6 hz, 2h, ch2). hrms(esi): m/z calcd for c
17
h
11
n2o
3 [m
‑
h]
‑ 291.0781, found: 291.0764。
[0025]
(2)目标酞菁锌配合物的制备:将上述邻苯二甲腈衍生物(1.0 mmol)和邻苯二甲腈(5.0 mmol)为反应物,以正戊醇(20
‑
35 ml,优选30 ml)为溶剂,加入无水醋酸锌(1
‑
4 mmol,优选2 mmol),以1,8
‑
二氮杂二环[5.4.0]十一碳
‑7‑
烯(0.4
‑
1.2 ml,优选0.6 ml)为催化剂,130
‑
150 ℃下搅拌反应12
‑
48小时,通过薄层色谱监控反应终点,生成相应的锌酞菁配合物。反应结束后旋蒸至干,用少量n,n
‑
二甲基甲酰胺(dmf)溶解,过硅胶柱,分别以二氯甲烷(dcm)和乙酸乙酯(ea)为洗脱剂洗去蓝色无取代酞菁带,最后以dmf为洗脱剂(可加入少量的乙酸)洗下酞菁带并收集,旋蒸去除有机溶剂,加入少量的dmf溶解,过bio
‑
beads s
‑
x3型dmf凝胶柱,收集第一带酞菁带,旋蒸除去dmf,再过一遍硅胶柱,以ea为洗脱剂洗去杂质带,以dmf为洗脱剂收集酞菁带,旋蒸去除有机溶剂,加入少量的dmf溶剂溶解,倒入300 ml的去离子水中析出抽滤,加入去离子水冲洗后,45 ℃烘干得产物,产率为27%。
[0026]
表征数据:1h nmr (400 mhz, dmso, ppm): 9.30 (d, j = 12.4 hz, 5h. pc
‑
h
α
), 8.90 (s, 1h pc
‑
h
α
), 8.22 (s, 4h, pc
‑
h
α
, pc
‑
h
β
), 7.74 (s, 2h, pc
‑
h
β
), 7.54 (s, 1h, pc
‑
h
β
), 7.42 (s, 4h, pc
‑
h
β
, ar
‑
h), 7.07 (s, 2h, ar
‑
h), 2.80 (s, 4h, ch2). hrms (esi): m/z calcd for c
41
h
25
n8o3zn [m h]
, 741.1336; found 741.1342。
[0027]
实施例21,8(11),15(18),22(25)
‑
四(4
‑
(2
‑
羧基乙基)苯氧基)酞菁锌(
)的合成将实施例1合成的邻苯二甲腈衍生物(1.0 mmol)为反应物,以正戊醇(20
‑
40 ml,优选30 ml)为溶剂,加入无水醋酸锌(1
‑
4 mmol,优选2 mmol),以1,8
‑
二氮杂二环[5.4.0]十一碳
‑7‑
烯(0.4
‑
1.2 ml,优选0.6 ml)为催化剂,130
‑
150 ℃下搅拌反应12
‑
48小时,通过薄层色谱监控反应终点,生成相应的锌酞菁配合物。反应结束后旋蒸至干,加入少量的dmf溶解,倒入200 ml的去离子水中,加入1 m的hcl析出抽滤,用去离子水洗涤除去黄色杂质,45 ℃干燥,加入少量的dmf溶解,过硅胶柱,以ea为洗脱剂,洗下杂质带,最后使用dmf为洗脱剂,洗下酞菁带(可加入少量的乙酸),旋蒸除去有机溶剂,过bio
‑
beads s
‑
x3型dmf凝胶柱,收集第一带酞菁带,旋蒸除去dmf获得粗产品。利用硅胶柱进一步纯化,以ea为洗脱剂洗去杂质带,以dmf为溶剂收集酞菁带,旋蒸除去有机溶剂,加入少量的dmf溶解,倒入200 ml的去离子水中析出,抽滤,大量去离子水洗涤,45 ℃烘干,得产物,产率为25%。
[0028]
表征数据:1h nmr (400 mhz, dmso, ppm): 12.15 (s, 4h,
ꢀ‑
cooh), 9.14 (dd, j = 21.7, 15.6 hz, 2h, pc
‑
h
α
), 8.72 (d, j = 7.0 hz, 2h, pc
‑
h
α
), 8.62 (d, j = 7.5 hz, 1h, pc
‑
h
β
), 8.13 (t, j = 16.7 hz, 3h, pc
‑
h
β
), 7.99 (s, 1h, pc
‑
h
β
), 7.71 (d, j = 7.1 hz, 2h, pc
‑
h
β
), 7.41 (dd, j = 28.6, 7.3 hz, 10h, pc
‑
h
β
, ar
‑
h), 7.19 (dd, j = 34.5, 8.5 hz, 7h, ar
‑
h), 2.95
ꢀ–ꢀ
2.79 (m, 8h, ch2), 2.63 (d, j = 5.8 hz, 4h, ch2), 2.54 (d, j = 8.8 hz, 4h, ch2). hrms (esi): m/z calcd for c
68
h
48
n8o
12
zn [m]
, 1232.2678; found 1232.2635。
[0029]
实施例3轴向不对称单羧基取代硅酞菁()的合成:
2.24
ꢀ‑ꢀ
2.11 (m, 4h, ar
‑
h), 1.86 (t, j = 8.0 hz, 4h, ch2), 1.65 (t, j = 8.0 hz, 4h, ch2). hrms (esi): m/z calcd for c
50
h
34
n8o6si [m]
, 870.2365; found 870.2371。
[0033]
实施例5单取代酞菁锌
‑
奋乃静偶联物()的合成:将实施例1合成的1
‑
(4
‑
(2
‑
羧基乙基)苯氧基)酞菁锌(0.055 mmol)以及奋乃静(0.168 mmol)作为反应物,以1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(edci,0.078
‑
0.314 mmol,优选0.157 mmol)为缩合剂以及4
‑
二甲氨基吡啶(dmap,0.102
‑
0.410 mmol,优选0.205 mmol)为催化剂,以dmf(5
‑
15 ml,优选10 ml)为溶剂,25
‑
45 ℃下搅拌反应12
‑
48小时,通过薄层色谱监控反应终点,待反应结束后,旋蒸除去反应溶剂,加少量的dcm溶解,过硅胶柱,先以己烷:ea=1:1(v/v)为洗脱剂,后逐渐增加洗脱剂的极性至ea:dmf=1:1(v/v),洗下并收集蓝色酞菁带,旋蒸去除有机溶剂,加入少量的thf,过bio
‑
beads s
‑
x3型凝胶柱,收集蓝色酞菁带,旋蒸除去thf获得粗产品。然后再次通过硅胶柱以相同洗脱条件进一步纯化获得目标产物,产率为51%。
[0034]
表征数据:1h nmr (400 mhz, dmso, ppm): 9.37
ꢀ–ꢀ
9.21 (m, 5h, pc
‑
h
α
), 9.02
ꢀ–ꢀ
8.79 (m, 2h, pc
‑
h
α
), 8.28
ꢀ–ꢀ
8.08 (m, 6h, pc
‑
h
β
), 7.84
ꢀ–ꢀ
7.75 (m, 1h, pc
‑
h
β
), 7.56
ꢀ–ꢀ
7.28 (m, 5h, pc
‑
h
β
, ar
‑
h), 7.17
ꢀ–ꢀ
6.94 (m, 4h, ar
‑
h), 6.85 (dd, j = 21.5, 8.2 hz, 3h, ar
‑
h), 3.89 (s, 2h, ch2), 3.60 (d, j = 25.1 hz, 2h, ch2), 2.93
ꢀ–ꢀ
2.79 (m, 4h, ch2), 2.66
ꢀ–ꢀ
2.56 (m, 2h, ch2), 2.34 (s, 2h, ch2), 2.24 (s, 1h, ch2), 2.17 (s, 1h, ch2), 2.08 (s, 6h, ch2), 1.46 (s, 2h, ch2). hrms (esi): m/z calcd for c
62
h
48
n
11
o3szncl [m]
, 1125.2637; found 1125.2670. reletive error: 2.93 ppm。
[0035]
实施例6四取代酞菁锌
‑
奋乃静偶联物()的合成:
7.6 hz, 2h, ar
‑
h), 5.47 (d, j = 7.6 hz, 2h, ar
‑
h), 5.16 (d, j = 8.4 hz, 2h, ar
‑
h), 3.87 (t, j = 8.2 hz, 2h, ch2), 3.75 (t, j = 7.8 hz, 2h, ch2), 2.68 (t, j = 8.1 hz, 2h, ch2), 2.34 (t, j = 8.0 hz, 2h, ar
‑
h), 2.24 (t, j = 8.0 hz, 4h, ch2), 2.08 (t, j = 8.0 hz, 4h, ch2), 1.92 (t, j = 8.2 hz, 2h, ch2), 1.76 (t, j = 8.1 hz, 4h, ch2), 1.24 (t, j = 7.7 hz, 2h, ch2), 0.21 (t, j = 7.6 hz, 2h, ch2),
ꢀ‑
0.47 (t, j = 7.5 hz, 2h, ch2). hrms (esi): m/z calcd for c
71
h
58
n
11
o6sclsi [m h]
, 1256.3823; found 1256.3833。
[0039]
实施例8轴向对称取代酞菁硅
‑
奋乃静偶联物()的合成:将实施例4合成的轴向对称二羧基取代硅酞菁(0.055 mmol)以及奋乃静(0.336 mmol)作为反应物,以edci(0.157
‑
0.628 mmol,优选0.314 mmol)为缩合剂以及dmap(0.205
‑
0.820 mmol,优选0.410 mmol)为催化剂,以dmf(5
‑
15 ml,优选10 ml)为溶剂,25
‑
45 ℃下搅拌反应12
‑
48小时,待反应完全后,旋蒸除去反应溶剂,加入少量的dcm,过硅胶,分别使用dcm和ea为洗脱剂,洗下酞菁带,旋蒸除去有机溶剂,加入少量的thf溶解,过bio
‑
beads s
‑
x3型凝胶柱,收集第一带蓝色酞菁带,旋蒸除去thf,获得粗产品。然后再次通过硅胶柱以相同洗脱条件进一步纯化获得目标产物,产率为47%。
[0040]
表征数据:1h nmr (400 mhz, dmso, ppm): 9.77
ꢀ–ꢀ
9.61 (m, 8h, pc
‑
h
α
), 9.13 (s, 2h, ar
‑
h), 8.57
–ꢀ
8.44 (m, 8h, pc
‑
h
β
), 8.27 (s, 2h, ar
‑
h), 7.25
ꢀ–ꢀ
7.10 (m, 5h, ar
‑
h), 7.05
ꢀ–ꢀ
6.95 (m, 5h, ar
‑
h), 5.48
–ꢀ
5.35 (m, 8h, ar
‑
h, o
‑
ch2), 3.95
ꢀ–ꢀ
3.65 (m, 8h, ch2), 3.03 (t, j = 7.9 hz, 2h, ch2), 2.23
ꢀ–ꢀ
2.16 (m, 6h, ar
‑
h, ch2), 2.10
ꢀ–ꢀ
2.00 (m, 8h, ch2), 1.95
ꢀ–ꢀ
1.85 (m, 4h, ch2), 1.76
ꢀ–ꢀ
1.65 (m, 4h, ch2), 1.35 (s, 1h, ch2), 1.31 (s, 1h, ch2), 1.28
ꢀ–ꢀ
1.20 (m, 6h, ch2), 0.94 (t, j = 6.8 hz, 2h, ch2), 0.86 (t, j = 7.0 hz, 2h, ch2). hrms (esi): m/z calcd for c
92
h
83
cl2n
14
o6s2si [m h]
, 1641.5202; found 1641.5206。
[0041]
实施例9将实施例5
‑
8所述制备的酞菁
‑
奋乃静偶联物溶于dmf中,配置成1 mm的母液,利用紫外
‑
可见吸收光谱仪测试它们在不同溶液中的分散状态,不同的溶液包括n,n
‑
二甲基甲酰胺、1% cel以及纯水。详细的实验步骤可参照eur. j. med. chem., 2016, 114, 380
‑
389。
[0042]
测试结果表明,实施例5
‑
8所得酞菁
‑
奋乃静偶联物在n, n
‑
二甲基甲酰胺以及1% cel中的q带(650
‑
750nm)为强而尖的峰,说明在n,n
‑
二甲基甲酰胺以及1% cel中所得酞菁
‑
奋乃静偶联物均是以单体的形式存在。但是在纯水中呈现出宽而矮的q带,说明在纯水中所得酞菁
‑
奋乃静偶联物均是以聚集体形式存在的。
[0043]
实施例10利用粒度分布仪测定实施例5
‑
8所制备的酞菁
‑
奋乃静偶联物在水中的粒径分布情况以及粒径的稳定性。详细的实验步骤可参照j. mater. chem. b, 2021,9, 2845。
[0044]
测试结果表明,实施例5
‑
8所制备的酞菁
‑
奋乃静偶联物(10 μm)在水中均可以发生自组装,形成均一的纳米颗粒,并且所形成的纳米颗粒都具有较好的稳定性。实施例5所得酞菁
‑
奋乃静偶联物在水中形成的纳米颗粒的粒径大小为150 nm左右,可以稳定存在7天;实施例6所得酞菁
‑
奋乃静偶联物在水中形成的纳米颗粒的粒径大小为110 nm左右,可以稳定存在9天;实施例7所得酞菁
‑
奋乃静偶联物在水中形成的纳米颗粒的粒径大小为150 nm左右,可以稳定存在11天;实施例8所得酞菁
‑
奋乃静偶联物在水中形成的纳米颗粒的粒径大小为120 nm左右,可以稳定存在7天。
[0045]
实施例11将实施案1
‑
4制备的羧酸基修饰的酞菁配合物以及实施例5
‑
8所制备的酞菁
‑
奋乃静偶联物分别溶于dmf,配置成1 mm的母液,再分别稀释到去离子水中和1�l的溶液中,测试它们的活性氧总量(ros)。
[0046]
活性氧总量测试采用水解的2,7
‑
二氯荧光素二乙酸酯(dcfh
‑
da)作为荧光探针。dcfh
‑
da是一种常用于检测活性氧的探针,dcfh
‑
da能够被氧活化形成能在波长520 nm处发射荧光信号的二氯荧光素。2,7
‑
双氯荧光素蛋白乙酸盐(dcfh)的制备方法是:将2,7
‑
二氯荧光素二乙酸酯(dcfh
‑
da)溶解于甲醇配置成5 mm的dcfh
‑
da溶液,
‑
20℃保存。待测时,将dcfh
‑
da溶液与0.1 mol/l的氢氧化钠溶液混合避光反应30 min后,用ph 7.4的pbs溶液稀释成为浓度为200 mm的母液。
[0047]
在石英比色皿中配置总量为2 ml的酞菁(4 μm)和上述活化好的活性氧探针(5 μm)的混合去离子水溶液,使用≥610 nm的红光(15 mw/cm2)对比色皿进行照射,测定不同光照时间下活性氧探针荧光强度的变化情况(488 nm激发,扫描范围在500 nm
‑
600 nm处的荧光)。将 522 nm处的相对荧光强度(f
‑
f0/f0)与光照时间(t)作图,得到线性关系的斜率,斜率越大说明产生ros的能力越强。
[0048]
上述波长≥610 nm的红光是通过500 w的卤素灯连接隔热水槽加大于610 nm的滤光片来提供的。
[0049]
实验结果见表1。
[0050]
表1 不同样品产生活性氧的速率对比
从表中可见,酞菁锌
‑
奋乃静偶联物产生ros的能力分别高于相应酞菁锌的13和3.4倍;酞菁硅
‑
奋乃静偶联物产生ros的能力分别高于相应酞菁硅的10.6和14.2倍。同时,酞菁锌
‑
奋乃静偶联物和酞菁硅
‑
奋乃静偶联物产生ros的能力也显著高于常见光敏剂亚甲基蓝(是亚甲基蓝的1.7
‑
10倍)。
[0051]
实施例12将实施例1
‑
4制备的羧酸基修饰的酞菁配合物以及实施例5
‑
8所制备的酞菁
‑
奋乃静偶联物溶于dmf,配置成1 mm的母液,再分别稀释到去离子水中,测试它们在常氧条件下产生超氧阴离子(o2·
‑
)的能力,以及实施例5
‑
8所制备的酞菁
‑
奋乃静偶联物在缺氧条件下产生超氧阴离子(o2·
‑
)的能力。测试过程中,采用常见光敏剂亚甲基蓝(mb)作为对照组。
[0052]
采用二氢乙锭(dhe)作为检测超氧阴离子的探针。在超氧阴离子的存在下,dhe被氧化成溴化乙锭,再与四周的rna或者dna结合后,发出明亮的红色荧光(激发波长在500
‑
510 nm左右,发射波长在600 nm左右)。荧光越强说明产生的超氧阴离子的量越多。具体的步骤为:在去离子水中加入所需测定的酞菁配合物及其酞菁
‑
奋乃静偶联物(酞菁浓度为4 μm),dhe探针(25 μm),以及小牛胸腺dna(250 μg/ml),混合均匀。测试开始时的荧光强度,之后使用波长≥610 nm的红光(光照密度为1 mw/cm2)光照20 min,使用荧光分度计来记录探针荧光强度的变化,以此来判断超氧阴离子的产生。
[0053]
缺氧条件下的测试超氧阴离子的方法:测试前将所使用的净化水煮沸20 min并超声以排除氧气,之后大量通入氮气以防氧气的进入,并使用上海雷磁 jpb607a 型便携式溶解氧测定仪对氧气含量进行检测,以检查水中的缺氧状态。选取提前备好的去氧水(氧气量1.0
‑
2.5 mg/l),加入所需测定的酞菁
‑
奋乃静偶联物(酞菁浓度为4 μm),dhe探针(25 μm),以及小牛胸腺dna(250 μg/ml)混合均匀后通入一定时间的氮气,密封,测试开始时的荧光强度,之后使用波长≥610 nm的红光(光照密度为1 mw/cm2)光照20 min,光照期间使用搭配好的装置继续通入氮气除氧,然后使用荧光分度计来记录探针荧光强度的变化,以此来判断超氧阴离子的产生。
[0054]
上述波长≥610 nm的红光是通过500 w的卤素灯连接隔热水槽加大于610 nm的滤光片来提供的。
[0055]
实验结果见表2、3。
[0056]
表2 不同样品在常氧条件下产生产生超氧阴离子的荧光强度对比
表3 不同样品在无氧条件下产生产生超氧阴离子的荧光强度对比从表2可见,在常氧条件下,酞菁
‑
奋乃静偶联物产生超氧阴离子的能力高于相应的酞菁(高了3.2
‑
1.6倍),且显著高于常见光敏剂mb(高了3.3
‑
2.3倍)。
[0057]
从表3可见,酞菁
‑
奋乃静偶联物在无氧条件下也可高效产生超氧阴离子,产生能力与在有氧条件下接近,且显著高于常见光敏剂mb(高了2.5
‑
4.2倍)。
[0058]
以上实验结果表明,在酞菁光敏剂母体结构上引入奋乃静基团,可使得偶联物具有显著的通过电子转移产生活性氧的能力,进而使得偶联物无论是在有氧条件还是在无氧条件下,均可有效产生超氧阴离子,并且两种情况下的荧光强度差距较小,表明超氧阴离子的产生与氧气的浓度无明显相关性。
[0059]
实施例13将实施例1
‑
4制备的羧酸基修饰的酞菁配合物及实施例5
‑
8所制备的酞菁
‑
奋乃静偶联物分别溶于dmf,配置成1 mm的母液,再分别稀释到去离子水中,测试它们产生光热的能力以及光热转换效率。
[0060]
利用光热成像仪测试酞菁在纯水中以及在近红外光照射下的温度变化情况。使用去离子水将配置好的1 mm的酞菁母液稀释至10 μm,取100 μl加入到96孔板中,使用685 nm的激光照射(0.5 w/cm2)并使用光热成像仪检测温度变化情况(测试期间最好保持室温条件大致相同且黑暗的条件下进行)。以常见光热剂icg作为参照。光热转换效率实验条件与上述相一致,先测定光照10 min的升温情况,再测试并记录下关闭光照时的降温情况(10 min),通过以温度(℃)与时间(t)作图,并依据相关文献(chem. sci., 2018, 9, 2098)计算出光热转换效率。
[0061]
实验结果表明:实施例1
‑
4制备的羧酸基修饰的酞菁配合物在水中几乎没有任何的光热效应,而实施例5
‑
8所制备的酞菁
‑
奋乃静偶联物具有光热效应,光照下可以分别升至57.3 ℃,61.2 ℃,57.3 ℃和66.7 ℃,光热转换效率分别为:17.2%,19.8%,18.3%,20.6%。而参照物icg的光热转换效率为7.8%。这说明酞菁
‑
奋乃静偶联物具有较高的光热效应,光热转换效率显著高于常见光热剂icg。
[0062]
实施例14利用本发明所述的酞菁
‑
奋乃静偶联物制备光敏剂或光疗(光动力/光热治疗)药
物的方法是:先将酞菁
‑
奋乃静偶联物使用dmf或dmso或乙醇溶解配置成1
‑
2 mm的母液,再使用水进行稀释,配置成一定浓度的药物水溶液。
[0063]
本发明所制备的酞菁
‑
奋乃静偶联物光敏剂或者光疗药物,在应用过程中需要配套适宜的光源,适宜的光源可以用普通光源连接合适的滤光片来提供或由特定波长的激光或相应波长范围的led光来提供,光源的波长范围为300~800 nm,优选680~720 nm。
[0064]
实施例15测试酞菁
‑
奋乃静偶联物在常氧与乏氧条件下在人肝癌细胞hepg2中产生超氧阴离子的情况以及光疗抗癌活性。
[0065]
常氧与乏氧条件下细胞内超氧阴离子的测定:使用二氢乙锭(dhe)为探针检测细胞内的超氧阴离子的产生情况。在放置有洁净无菌盖玻片的培养板中接种处于对数生长期的hepg2细胞(每板细胞的数量约为1
×
105个),分别在37 ℃、5% co2(常氧条件)或者3% o2、5% co2和92% n2(乏氧条件)进行培养,24 h后移出培养液,并加入混合有酞菁
‑
奋乃静偶联物光敏剂的培养基(400 μl),继续培养2 h。之后加入pbs缓冲溶液进行两次清洗,清洗掉含药物的培养基,再加入配置好的探针dhe继续孵育30 min,使用波长λ≥610 nm的红光(光照密度为15 mw/cm2,光照剂量为27 j/cm2)对细胞光照10 min,之后利用荧光共聚焦仪进行检测,激发波长为488 nm,收集570
‑
630 nm的荧光信号。
[0066]
常氧与乏氧条件下光疗抗癌活性的测定:将实施例5
‑
8的酞菁
‑
奋乃静偶联物溶于dmf配置成1 mm的母液,进而将其稀释到细胞培养液中,制成含不同浓度偶联物的细胞培养液。在放置有洁净无菌盖玻片的培养板中接种处于对数生长期的hepg2细胞(每板细胞的数量约为1
×
105个),分别在37 ℃、5% co2(常氧条件)或者3% o
2、
5% co2和92% n2(乏氧条件)进行培养,24 h后移出培养液,将癌细胞分别在含有不同浓度偶联物的培养液中培养2小时,之后弃培养液,用pbs缓冲溶液清洗细胞后,加入新的培养液(不含上述所述偶联物)。对于光照实验组,使用激发光光源为波长685 nm的激光对细胞进行红光照射30分钟,照射光的功率为15 mw/cm2;对于不照光组,将细胞置于暗处30分钟。最后对于两组实验的细胞的存活率使用mtt法考察。详细实验步骤参见eur. j. med. chem., 2018, 155, 24
‑
33。
[0067]
实验结果表明,无论是在常氧还是在乏氧条件下,实施例5
‑
8制备的酞菁
‑
奋乃静偶联物均能导致hepg2细胞内超氧阴离子荧光探针的响应,且常氧与乏氧条件下超氧阴离子探针荧光强度几乎一样,说明酞菁
‑
奋乃静偶联物在细胞能有效光敏产生超氧阴离子,且在乏氧条件下也能高效产生超氧阴离子。
[0068]
实验结果还表明:在不进行光照时,实施例5
‑
8所得酞菁
‑
奋乃静偶联物对hepg2细胞均没有杀伤和生长抑制作用,表明上述酞菁
‑
奋乃静偶联物没有暗毒性。但经光照射后,实施例5
‑
8所得酞菁
‑
奋乃静偶联物均显示出高的光动力抗癌活性,且呈现量效关系。以上结果说明本发明制备的酞菁
‑
奋乃静偶联物在常氧与乏氧条件下对hepg2细胞均具有较高的光动力抗癌活性,特别是实施例7所制备的不对称轴向单边硅酞菁
‑
奋乃静偶联物的光动力抗癌活性最好,ic
50
值(半数致死浓度,即杀死50%癌细胞所需的药物浓度)低至80
‑
90 nm(参见表4)。
[0069]
表4 常氧光照及乏氧光照条件下不同样品的ic
50
值对比
实施例16将实施例7的酞菁
‑
奋乃静偶联物溶于dmf,配置成1 mm的母液,再用水进行稀释,制成浓度为200 μm的光敏药剂水溶液。测试其对种有肝癌细胞(h22)的固体瘤的km小鼠的荧光成像和光热成像情况。
[0070]
对种有h22的荷瘤小鼠尾静脉注射100 μl浓度为200 μm的上述光敏药剂水溶液。使用小动物荧光成像仪监测上述药物在小鼠肿瘤部位的富集情况,24小时后对小鼠进行解剖,使用小动物荧光成像仪监测药物在小鼠各个组织器官的分布情况。详细实验步骤参见acs appl. mater. interfaces 2019, 11, 36435
−
36443。
[0071]
对种有h22的荷瘤小鼠尾静脉注射100 μl浓度为200 μm的上述光敏药剂水溶液。使用小动物光热成像仪监测上述药物在小鼠肿瘤部位的富集情况,并每隔两个小时使用685 nm的激光(光照强度0.5 w/cm2)对小鼠的肿瘤部位照射3 min,使用小动物光热成像仪监测小鼠肿瘤部位的温度变化情况。详细实验步骤参见acs appl. mater. interfaces 2019, 11, 36435
−
36443。
[0072]
在体荧光成像实验结果表明:实施例7所制备的酞菁
‑
奋乃静偶联物显示出了较高的肿瘤靶向性。在静脉注射光敏剂后,刚开始全身各部几乎没有任何的荧光显示,之后逐渐在肿瘤部位观察到荧光,在10小时达到峰值,而且只能在肿瘤部位看到荧光。24小时后,小鼠进行解剖获取各器官,并观察它们的荧光成像情况,发现除了小鼠的肿瘤部位可以观察到较为明显的荧光,其它各个器官组织中未发现明显的药物残留情况。
[0073]
在体光热成像实验结果表明:尾静脉注射光敏剂溶液后,肿瘤部位的温度逐渐升高,在静脉注射10小时后肿瘤部位的温度达到最高47.3 ℃,之后肿瘤部位的温度逐渐降低。这也说明本发明所制备的酞菁
‑
奋乃静偶联物在小鼠体内具有较好在肿瘤部位富集,且具有光热成像功能。如果将上述实验中的685 nm激光的光照强度调低至0.5 w/cm2,保持其他条件不变,则观察不到肿瘤温度的明显升高,说明低强度的激光照射下,光敏剂不能有效产生光热效应。
[0074]
实施例17测试实施例7所制备的酞菁
‑
奋乃静偶联物光疗(光动力治疗/光热治疗)抗肿瘤效果。参照文献方法(acs appl. mater. interfaces 2019, 11, 36435
−
36443)建立皮下移植h22肝癌细胞的km小鼠。将h22荷瘤km小鼠分为6个实验组:单纯给药组,单纯pbs组,单纯激光1组,单纯激光2组,给药 激光1组,给药 激光2组,每组5只;给药 激光照射是待肿瘤长到60
‑
100 mm3大小时,静脉注射100 μl浓度为200 μm的酞菁
‑
奋乃静水溶液,然后在给药10小时后使用685 nm激光照射肿瘤部位10分钟,激光照射1组使用的光照强度0.1 w/cm2,激光2组使用的光照强度为0.5 w/cm2。将各组小白鼠按要求处理后,继续饲养小白鼠,隔日观
察小鼠情况,测量小白鼠的体重,用游标卡尺测量肿瘤的长直径与短直径,一共测量14天。按照文献方法(acs appl. mater. interfaces 2019, 11, 36435
−
36443)计算抑瘤率。
[0075]
使用小动物光热成像仪监测药物在小鼠尾静脉注射后光热治疗情况,使用685 nm(光照强度0.5 w/cm2)的激光对小鼠的肿瘤部位连续照射10 min,使用小动物光热成像仪连续监测小鼠肿瘤部位的温度变化情况。
[0076]
实验结果显示:(1)单纯给药组、单纯激光1组、单纯激光2组对小鼠肿瘤均无抑制肿瘤生长效应(肿瘤增长了大约14倍)。(2)给药 激光1组显示了良好的抑制肿瘤生长的作用,抑瘤率可达64%(p<0.001),给药 激光2组显示了极高的抑制肿瘤生长活性,抑瘤率高达94%(p<0.001)。由此进一步证明,0.5 w/cm2的光照强度可有效引发光热效应和光动力效应,且给药 激光2组的极高抑瘤率应该是酞菁
‑
奋乃静偶联物光动力治疗和光热效应协同作用的结果。(3)单纯给药组、给药 激光1组、给药 激光2组的小鼠在14天内体重呈增加趋势,说明酞菁
‑
奋乃静偶联物对小鼠均没有明显毒性,具有良好的生物相容性。
[0077]
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。