1.本发明属于色谱和质谱领域,具体涉及一种在纳升级液相色谱
‑
质谱仪上进行磷酸化多肽自动化在线分析的用于磷酸化蛋白质组学的在线自动化分析装置和分析方法。
背景技术:
2.许多重要的生命调节过程与蛋白质的磷酸化有关,对细胞中蛋白质的磷酸化事件进行定性定量分析,有助于揭示磷酸化修饰蛋白在信号通路中的调控机制,挖掘关键基因或指导药物研发的靶点。液相色谱
‑
高分辨质谱联用仪结合bottom
‑
up分析策略是当前蛋白质组学研究的核心方法,然而由于磷酸化肽的丰度极低、电离效率差以及受到非磷酸化肽的信号抑制,使得从全蛋白酶切物中直接分析磷酸化肽非常困难,在分析之前从酶切样品中对磷酸化肽进行选择性富集是必不可少的操作。
3.固定化金属离子亲和层析(imac)是磷酸化蛋白质组学中最主要的富集技术,螯合配体如亚氨基二乙酸(ida)和次氮基三乙酸(nta)可将金属阳离子(如cu
2
、fe
3
、ni
2
或ga
3
等)固定在固相基质表面,这些固定化金属离子可以与多肽的磷酸基团通过路易斯酸碱相互作用而结合,从而从全蛋白酶切物中富集磷酸化肽,后者随后被碱性的缓冲液洗脱下来,再经过酸化、除盐、浓缩等步骤后才能进行质谱分析。由于imac通常为微球、磁性材料或微量柱的形式,故上述流程需通过涡流、离心/磁吸或移液器吸打的方式手动进行,比较耗时耗力,且繁琐的人工操作难免会造成较大的误差或者错误。
4.一种解决上述问题的思路是发明一种色谱柱形式的imac,可与液相色谱系统相结合,通过对液路的合理设计及对自动进样器、十通阀和流动相的控制,或许能实现自动化的磷酸化肽富集、分析。在实际的蛋白质组学分析任务中使用的是纳升级液相色谱
‑
质谱联用仪,而开发纳升级的磷酸化肽富集柱往往会遇到背压过高、上样率低、灵敏度差等难题,另一大难点是将磷酸化肽从捕获柱洗脱需要高ph溶液,与后续c18分析柱的上样条件不兼容,最后,如何设计液相系统的连接以及自动化分析程序也是技术难题,故目前尚无商品化的装置可用于磷酸化蛋白质组的在线、自动化分析。
技术实现要素:
5.本发明的目的是提供一种用于磷酸化蛋白质组学的在线自动化分析装置。
6.本发明的用于磷酸化蛋白质组学的在线自动化分析装置,其为液相色谱
‑
质谱联用仪,所述的液相色谱包括磷酸化肽捕获柱和分析柱,其特征在于,所述的磷酸化肽捕获柱是atp修饰的固定化金属离子亲和色谱柱;
7.所述的atp修饰的固定化金属离子亲和色谱柱的制备方法为:
8.将钾水玻璃、γ
‑
缩水甘油醚氧丙基三甲氧基硅烷和水溶解的三磷酸腺苷二钠混合搅拌,然后加入用水溶解的甲酰胺搅拌获得反应液,将反应液注满色谱柱,然后注满的色谱柱的反应液反应固化,再经洗涤,获得atp修饰的固定化金属离子亲和色谱柱。
9.本发明的atp修饰的固定化金属离子亲和色谱柱的制备原理示意图如下所示:
10.1、钾水玻璃的制备
11.mkoh nsio2→
mk2o
·
(n
‑
m)sio2 mh2o
12.2、钾水玻璃在甲酰胺、加热条件下水解
[0013][0014]
3、与步骤2同时进行的硅偶联剂与atpna2的反应:
[0015][0016]
4、硅胶基底上的atp修饰
[0017][0018]
5、填料发挥富集功能
[0019][0020]
优选,所述的钾水玻璃、γ
‑
缩水甘油醚氧丙基三甲氧基硅烷、三磷酸腺苷二钠盐和甲酰胺的用量比是500
‑
2000∶1
‑
10∶2
‑
50∶20
‑
130。
[0021]
进一步优选,所述的钾水玻璃、γ
‑
缩水甘油醚氧丙基三甲氧基硅烷、三磷酸腺苷二钠盐和甲酰胺的用量质量比是1000∶6∶7.5∶68。
[0022]
优选,所述的钾水玻璃的模数范围2
‑
4,波美度范围为20
‑
50。
[0023]
进一步优选,所述的钾水玻璃的模数3.3,波美度为40。
[0024]
优选,所述的固化是在温度100℃下固化10小时;所述的洗涤是先后用1m硝酸铵、0.1m硝酸和水洗涤。
[0025]
优选,所述的色谱柱是弹性石英毛细管。
[0026]
进一步优选,所述的弹性石英毛细管是外径360微米、内径150微米、长度15厘米的弹性石英毛细管
[0027]
优选,所述的用于磷酸化蛋白质组学的在线自动化分析装置,包括上样部分和分析部分,所述的上样部分包括第一组流动相储液瓶、第二组流动相储液瓶、脱气机、上样泵、自动进样器、磷酸化肽捕获柱,所述的分析部分包括nc泵、c18预柱、十通阀、c18分析柱、nano
‑
esi和高分辨质谱仪,所述的第一组流动相储液瓶、脱气机、上样泵、自动进样器中的六通阀、磷酸化肽捕获柱和十通阀通过管道顺序相连,六通阀上还设有定量环与六通阀的两个通道相连,自动进样器中还设有样品盘和注射器分别与六通阀相连,第二组流动相储液瓶、nc泵和十通阀通过管道顺序相连,在十通阀上还设有c18预柱,c18预柱与十通阀通过管道相连,十通阀还与c18分析柱相连,c18分析柱出口端能与nano
‑
esi和高分辨质谱仪顺序相连,十通阀还连有废液瓶。
[0028]
本发明的第二个目的是提供一种用于磷酸化蛋白质组学的分析方法,其包括以下步骤:
[0029]
a、磷酸化肽捕获柱经zrcl4洗脱,使得atp修饰的固定化金属离子亲和色谱柱填料螯合zr
4
;
[0030]
b、取样品流经步骤a的磷酸化肽捕获柱,完成对磷酸化肽的富集;
[0031]
c、清洗液流经步骤b的磷酸化肽捕获柱,完成对非特异性结合多肽的清洗;
[0032]
d、洗脱液流经步骤b的磷酸化肽捕获柱,对富集的磷酸化肽进行洗脱,洗脱的磷酸
化肽进入c18预柱;
[0033]
e、用流动相洗脱c18预柱,磷酸化肽进入c18分析柱、再经质谱仪鉴定。
[0034]
优选为:
[0035]
s1.自动进样器中的进样瓶中分别装有0.1m zrcl4、样品溶液、洗涤液体积分数80%acn、1%tfa、洗脱液1m nh4h2po4、清洗液体积分数40%acn、5%nh4oh;
[0036]
s2.自动进样器吸取0.1m zrcl4进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
废液瓶,上样泵流动相为体积分数0.1%fa,nc泵控制的流动相体积分数80%acn、0.1%fa流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱;
[0037]
s3.将样品溶解于体积分数80%acn、1%tfa的溶液中,自动进样器吸取样品溶液进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
废液瓶,上样泵流动相为体积分数0.1%fa,nc泵控制的流动相体积分数80%acn、0.1%fa流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱;
[0038]
s4.自动进样器吸取洗涤液体积分数80%acn、1%tfa进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
废液瓶,上样泵流动相为体积分数0.1%fa,nc泵控制的流动相体积分数0.1%fa流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱;
[0039]
s5.十通阀切阀,自动进样器吸取洗脱液1m nh4h2po4进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
c18预柱
→
十通阀
→
废液瓶,上样泵流动相为体积分数0.1%fa;nc泵控制的流动相体积分数0.1%fa流经十通阀
→
c18分析柱;洗脱后,十通阀切阀,让nc泵的流动相a体积分数0.1%甲酸,2%乙腈流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱,继续冲洗除盐;
[0040]
s6.十通阀切阀,自动进样器吸取清洗液体积分数40%乙腈、5%nh4oh进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀废液瓶,上样泵流动相为体积分数0.1%fa,同时开启质谱检测;nc泵控制的流动相体积分数40%acn、0.1%fa流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱
→
喷针
→
nano esi源,用质谱仪检测。
[0041]
本发明的atp修饰的固定化金属离子亲和色谱柱中的填料,其具有疏松多孔、比表面积高、背压低、物理化学稳定性好、机械稳定性好、选择性高、灵敏度高、富集倍数高的优点。
[0042]
本发明通过一步反应法制备的atp修饰的固定化金属离子亲和毛细管整体柱,制备步骤简单快速、重复性和良品率高、制备成本低。仅需将原料混合均匀后经历一次烘烤反应便可得到,其物理化学稳定性好,多次使用后具有较好的重现性。与本领域常用的微球或者磁性材料形式的富集材料相比,本发明的atp修饰的固定化金属离子亲和毛细管整体柱具备与纳升级液相系统联用的潜力,结合自动进样系统,可使劳动密集的上金属离子、上样、洗涤、洗脱等操作自动化进行,同时本发明对磷酸化肽的位点覆盖率、检出限、选择性也达到业界一流的水平。
[0043]
与现有技术相比,本发明所述的一种用于磷酸化蛋白质组学的在线自动化分析装置具有以下有益效果:
[0044]
本发明提供了一种磷酸化蛋白质组学在线分析装置的设计,以及如何利用该装置实现自动化分析,这种自动化装置的首要优势是将研究人员从富集磷酸化肽所需的上金属离子、上样、洗涤、洗脱、除盐、挥干、复溶等繁杂人力操作中解放出来,提升了实验效率;第
二,仪器对于进样量和液相条件的精准控制有利于减小人为操作带来的误差,能提升平行实验结果的一致性;第三,相比于在离心管中进行富集的传统方法,这种将捕获柱与纳升级液相系统结合进行在线富集的优势是提高了上样效率,对于灵敏度有一点的提升;最后,本发明提出将1m nh4h2po4作为洗脱液,酸性的nh4h2po4溶液符合c18预柱对ph的要求,磷酸化肽可被其从捕获柱上洗脱并被随后的c18预柱上保留,多余的磷酸盐可被上样缓冲液冲洗除去,不会影响质谱分析,是本方法能够实现的关键。
附图说明
[0045]
图1是atp修饰的固定化金属离子亲和毛细管整体柱的横切面电镜图,分别为200μm及5μm尺度。
[0046]
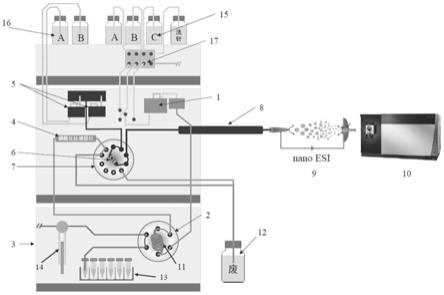
图2是用于磷酸化蛋白质组学的在线自动化分析装置的结构示意图,其中1、上样泵;2、六通阀;3、自动进样器(分别装有1ml 0.1m zrcl4、100μl多肽样品溶于(按体积分数计,80%乙腈、1%三氯乙酸tfa)、1ml洗涤液(按体积分数计,80%乙腈、1%tfa洗涤液)、1ml 1m磷酸二氢铵、1ml清洗液(按体积分数计,40%乙腈、5%nh4oh),共五种溶液);4、磷酸化肽捕获柱;5、nc泵;6、c18预柱;7、十通阀;8、c18分析柱;9、nano
‑
esi离子源;10、高分辨质谱仪;11、20微升定量环;12、废液瓶;13、样品盘;14、注射器(样品盘、注射器、六通阀、定量环是自动进样器的四大组成部件);15、第一组流动相储液瓶;16、第二组流动相储液瓶;17、脱气机。
[0047]
图3是用于磷酸化蛋白质组学的在线自动化分析装置的自动化流程示意图;
[0048]
图4是用于磷酸化蛋白质组学的在线自动化分析装置从标准蛋白α
‑
casein酶切产物中磷酸化肽的一级质谱图。
[0049]
图5是不同上样量(从上到下依次为2ng、20ng、40ng、100ng、200ng,这个量是指10ul进样体积所含的多肽质量)时富集所得磷酸化肽的质谱图,表明方法的检测限低至100fmol。图6是磷酸化肽的信号强度与上样量之间的线性关系。
具体实施方式
[0050]
下面将结合具体实施例来进一步说明本发明,应该说明的是,下述实施例仅是为了解释本发明,并不对其内容进行任何形式的限定。本发明的设计思想或同类物质的简单替代,均应包含在本发明的保护范围之内。除非特别说明,本发明采用的试剂、材料、方法和设备均为本技术领域现有常规的试剂、材料、方法和设备。
[0051]
实施例1atp修饰的固定化金属离子亲和毛细管整体柱的制备
[0052]
本发明通过一步反应法制备的atp修饰的固定化金属离子亲和毛细管整体柱,具体包括以下步骤:
[0053]
s1.在微型反应瓶中加入740微升(约1000mg)钾水玻璃(模数3.3,波美度40),在室温搅拌条件下缓慢加入6微升(约6mg)γ
‑
缩水甘油醚氧丙基三甲氧基硅烷(glymo,cas号:2530
‑
83
‑
8),持续在室温条件下充分搅拌30分钟。
[0054]
s2.称取7.5mg三磷酸腺苷二钠,用160微升去离子水溶解后,缓慢加入s1步骤中的反应液中,继续持续在室温条件下充分搅拌30分钟。
[0055]
s3.取60微升(约68mg)甲酰胺,与40微升去离子水混匀后,缓慢加入s2步骤中的反
fusion(赛默飞)。
[0065]
取1mg标准磷酸化蛋白α
‑
casein溶解于1ml的50mm碳酸氢铵,用20μg胰蛋白酶处理8小时,获得1mg/ml的α
‑
casein蛋白酶切液。(标准磷酸化蛋白α
‑
casein含有α
‑
s1
‑
casein和α
‑
s2
‑
casein两种磷酸化蛋白,分别有9和10个磷酸化位点被报道,经胰蛋白酶处理后,能产生一系列的单磷酸化肽、多磷酸化肽和非磷酸化肽,未经特异性富集时在质谱中主要观察到非磷酸化肽的信号)。使用前,取10μl的1mg/mlα
‑
casein蛋白酶切液用(80%acn、1%tfa)的溶液逐级稀释,获得20ng/μl、10ng/μl、4ng/μl、2ng/μl、0.2ng/μl的α
‑
casein蛋白酶切物待分析液,分析时按照进样量从低到高的顺序进行分析。
[0066]
具体步骤如下(图3):
[0067]
s1.自动进样器中的进样瓶中分别装有0.1m zrcl4、不同浓度的α
‑
casein蛋白酶切液(溶于80%acn、1%tfa)、洗涤液(80%acn、1%tfa)、洗脱液(1m nh4h2po4)、清洗液(40%acn、5%nh4oh),在仪器控制软件xcaliur中编辑各步骤的色谱及质谱方法,在任务列表中依次建立相应的分析任务。后续的s2
‑
s6均在xcaliur软件的控制下自动进行。
[0068]
s2.自动进样器吸取10微升0.1m zrcl4进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
废液瓶,上样泵流动相为0.1%fa,流速为5微升/分钟,持续时间为6分钟。nc泵控制的流动相(80%acn、0.1%fa)流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱,持续时间为6分钟,nc泵流速为300纳升/分钟。
[0069]
s3.将α
‑
casein蛋白酶切液溶解于80%acn、1%tfa的溶液中,自动进样器吸取10微升α
‑
casein蛋白酶切液进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
废液瓶,上样泵流动相为0.1%fa,流速为5微升/分钟,持续冲洗时间为6分钟。nc泵控制的流动相(80%acn、0.1%fa)流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱,nc泵流速为300纳升/分钟,持续时间为6分钟。
[0070]
s4.自动进样器吸取10微升洗涤液(80%acn、1%tfa)进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
废液瓶,上样泵流动相为0.1%fa,流速为5微升/分钟,持续冲洗时间为6分钟。nc泵控制的流动相(0.1%fa)流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱,nc泵流速为300纳升/分钟,持续时间为6分钟。重复洗涤一次。
[0071]
s5.十通阀切阀,自动进样器吸取10微升洗脱液(1m nh4h2po4)进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
c18预柱
→
十通阀
→
废液瓶,上样泵流动相为0.1%fa,流速为5微升/分钟。nc泵控制的流动相(0.1%fa)流经十通阀
→
c18分析柱,nc泵流速为300纳升/分钟。冲洗20分钟时间后,十通阀切阀,让nc泵的流动相a(按体积分数计,0.1%甲酸,2%乙腈)流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱,继续冲洗除盐10分钟。
[0072]
s6.十通阀切阀,自动进样器吸取10微升清洗液(40%乙腈、5%nh4oh)进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀废液瓶,上样泵流动相为0.1%fa,流速保持5微升/分钟。同时开启质谱检测(orbitrap fusion,质谱参数为常规一级质谱图全扫描参数:喷雾电压2000v、扫描范围350
‑
2000m/z,agc target为2e5),nc泵控制的流动相(40%acn、0.1%fa)流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱
→
喷针
→
nano esi源,用orbitrap fusion质谱仪检测一级质谱图,nc泵流速为300纳升/分钟,上样泵推动。
[0073]
实验结果如附图4、5、6及表1所示,从α
‑
casein中富集分析磷酸化肽的实验表明,本发明对单、多磷酸化肽均有富集效果,具有高达95%的磷酸化位点覆盖率(18/19),还有低至100fmol的检测限,磷酸化肽的信号强度与上样量(2ng、20ng、40ng、100ng、200ng)之间具有良好的线性关系,且多次重复实所得结果具有非常高的一致性。
[0074]
表1.本发明从α
‑
casein酶切物中鉴定所得磷酸化肽信息
[0075]
[0076]
[0077][0078]
实施例2 对玉米全蛋白酶切物的在线分析
[0079]
本实施例在实施例1基础上做了一些改进,包括采用实际生物样品、优化了洗涤条件、采用了适合实际样品的质谱采集参数。所用样品是300微克的玉米全蛋白酶切物。所述的玉米全蛋白酶切物的制备方法为:称取发育至二叶期的玉米幼苗1g,用液氮研磨至粉状;加入10ml提取缓冲液(0.1m tris
‑
cl(ph=8.0)、10mm edta、0.9m蔗糖、20mm dtt、蛋白酶和磷酸酶抑制剂(赛默飞,a32961)2片),涡流混匀后,加入10ml tris
‑
cl饱和酚,混匀后冰浴超声处理(10s开/10s停,10循环);离心(8000g,4℃,10min),取上层苯酚相,加入5倍体积的含0.1m乙酸铵的冷甲醇,置于
‑
20℃过夜;离心(8000g,4℃,10min),弃上清液,用冷甲醇、冷丙酮、冷甲醇洗涤蛋白沉淀;用320μl(6m尿素、50mm碳酸氢铵)复溶蛋白;bca法测定蛋白质浓度;加入dtt至10mm,37℃水浴1小时;加入碘代乙酰胺至40mm,暗处孵育1小时;上述溶液用50mm碳酸氢铵溶液稀释至6倍体积,按酶/蛋白为1/50的质量比加入测序级胰蛋白酶,37℃水浴12小时。用pierce
tm
多肽脱盐离心柱除盐,根据bca法所测浓度将洗脱液按1mg样品/管分装,冻干后放
‑
20℃保存。使用前取1管用66ul(80%乙腈、200mg/ml 2,5
‑
二羟基苯甲酸(dhb)、2%tfa)复溶。
[0080]
因为分析实际样品所需的进样量更高且样品更为复杂,本实施例在图3的步骤中做了一点改进,具体为上样液和洗涤液中增加了dhb、加倍了tfa浓度,已有文献证明这可以增强对磷酸化肽的选择性,随后用不含dhb的洗涤液2除去dhb残留。
[0081]
具体步骤如下:
[0082]
s1.自动进样器中的进样瓶中分别装有0.1m zrcl4、玉米幼苗全蛋白质酶切液(1mg溶于60μl(80%乙腈、200mg/ml dhb、2%tfa)、洗涤液1(80%乙腈、200mg/ml dhb、2%tfa)、洗涤液2(80%乙腈、1%tfa)、洗脱液(1m nh4h2po4)、清洗液(40%acn、5%nh4oh),在仪器控制软件xcaliur中编辑各步骤的色谱及质谱方法,在任务列表中依次建立相应的分析任务。后续的s2
‑
s6均在xcaliur软件的控制下自动进行。
[0083]
s2.自动进样器吸取10微升0.1m zrcl4进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
废液瓶,上样泵流动相为0.1%fa,流速为5微升/分钟,持续时间为6分钟。nc泵控制的流动相(80%acn、0.1%fa)流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱,持续时间为6分钟,nc泵流速为300纳升/分钟。
[0084]
s3.自动进样器吸取20μl玉米幼苗全蛋白质酶切液(1mg溶于60μl(80%乙腈、200mg/ml dhb、2%tfa)进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
废液瓶,上样泵流动相为0.1%fa,流速为5微升/分钟,持续冲洗时间为6分钟。nc泵控制的流动相(80%acn、0.1%fa)流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱,nc泵流速为300纳升/分钟,持续时间为6分钟。
[0085]
s4.自动进样器吸取10微升洗涤液1(80%乙腈、200mg/ml dhb、2%tfa)进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
废液瓶,上样泵流动相为0.1%fa,流速为5微升/分钟,持续冲洗时间为6分钟。nc泵控制的流动相(0.1%fa)流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱,nc泵流速为300纳升/分钟,持续时间为6分钟。用洗涤液1重复洗涤一次,再用洗涤液2(80%乙腈、1%tfa)重复洗涤一次。
[0086]
s5.十通阀切阀,自动进样器吸取10微升洗脱液(1m nh4h2po4)进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀
→
c18预柱
→
十通阀
→
废液瓶,上样泵流动相为0.1%fa,流速为5微升/分钟。nc泵控制的流动相(按体积分数计,0.1%fa)流经十通阀
→
c18分析柱,nc泵流速为300纳升/分钟。冲洗20分钟时间后,十通阀切阀,让nc泵的流动相a(按体积分数计,0.1%甲酸,2%乙腈)流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱,继续冲洗除盐10分钟。
[0087]
s6.十通阀切阀,自动进样器吸取10微升清洗液(40%乙腈、5%nh4oh)进入定量环,六通阀切阀,在上样泵推动下流经磷酸化肽捕获柱
→
十通阀废液瓶,上样泵流动相为0.1%fa,流速为5微升/分钟保持。同时开启质谱检测(orbitrap fusion,质谱参数为常规磷酸化蛋白质组学分析参数,喷雾电压2000v,离子传输管温度320℃,ms的检测器为orbitrap,分辨率120k,msms的检测器为ion trap,扫描速率为rapid),nc泵控制的120分钟乙腈梯度流动相(4
‑
32%acn,0.1fa)流经十通阀
→
c18预柱
→
十通阀
→
c18分析柱
→
喷针
→
nano esi源,流速为300纳升/分钟。
[0088]
s7.质谱下机的raw文件用proteome discoverer 2.4软件进行鉴定,选择从uniprot下载的zea mays(up000007305)蛋白质组fasta文件为数据库,将(s、t、y)磷酸化设为可变修饰,前体离子的质量容差为10ppm,碎片离子的质量容差为0.2da,用percolator进行质控,fdr值设为0.01。
[0089]
实验结果表明本次分析共鉴定出1747个磷酸化肽,2129个磷酸化位点,来自1173个磷酸化蛋白,非常理想。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。