一种t7噬菌体识别的锚定序列、dna疫苗重组质粒及应用
技术领域
1.本发明属于基因工程技术领域,涉及一种t7噬菌体识别的锚定序列、包含该锚定序列的dna疫苗重组质粒、包含该dna疫苗重组质粒的噬菌体宿主菌株、一种包裹、转运dna疫苗载体的方法,以及它们的应用,具体涉及从t7噬菌体基因组中筛选锚定序列并插入dna疫苗载体,验证t7噬菌体对携带锚定序列的dna疫苗载体的包裹能力,噬菌体转运dna疫苗载体进入细胞实现外源基因的表达。
背景技术:
2.dna疫苗是上世纪90年代发展起来的一种新型疫苗,是指将含有抗原编码基因的真核表达载体导入细胞,通过胞内表达抗原从而诱导机体产生免疫反应。该免疫途径不仅能激发体液免疫反应,还能诱导高水平的细胞免疫,尤其是细胞毒性t淋巴细胞(ctl)反应,在疾病的防治中具有较大优势。dna疫苗作为第三代疫苗的代表有着广阔的前景,但dna疫苗在进入细胞前都易受到体内各种酶的消化而逐渐被降解,从而导致有效进入细胞内的dna疫苗数量骤减,免疫保护效率不尽如人意。虽然可以通过生物材料包裹和改进注射方式等策略提高dna疫苗免疫效率,但终因工艺和成本等因素制约而难以推广,故而创新dna疫苗转运技术成为了当前和今后的研究热点。
3.t7噬菌体是一种感染大肠杆菌的烈性噬菌体,在大肠杆菌胞质内进行复制、组装,其核酸物质被包裹在直径约为50nm的头部衣壳内。衣壳内部空间可以用来装载外源dna疫苗载体,犹如给原本裸露的dna疫苗穿上了一件盔甲。利用t7噬菌体作为dna疫苗的转运载体,容易被免疫细胞识别、吞噬、降解,其噬菌体颗粒的不对称性有利于诱发t细胞依赖的免疫反应。噬菌体颗粒本身稳定性强,对理化因素有很强的抵抗力,在体液环境中保持稳定从而有效地保护内部包裹的dna疫苗载体,进而高效地将dna疫苗载体转运到细胞内实现抗原表达。
4.公开于该背景知识的信息旨在增加对该发明的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
技术实现要素:
5.本发明的目的就是为了解决dna疫苗载体在转运过程中遇到的困难而提供一种t7噬菌体识别的锚定序列、dna疫苗重组质粒、t7噬菌体包裹、转运dna疫苗载体的方法及应用。
6.为了实现上述目的,本发明的第一方面提供一种t7噬菌体识别的锚定序列,所述锚定序列为seq id no.1所示。具体地,本发明基于t7噬菌体复制、组装过程的机理,从其基因组中遴选t7噬菌体组装过程中的识别区域,并进行优化组合,最终确定一段锚定序列,如seq id no.1所示。
7.本发明的第二方面提供一种具有t7噬菌体识别的锚定序列的dna疫苗重组质粒,该dna疫苗重组质粒包括dna疫苗载体和上述的t7噬菌体识别的锚定序列。
8.本发明对所述dna疫苗载体没有特别限定,可选自pcdna、pegfp、psv2、pbv、pjv或pbj。优选地,所述dna疫苗载体为pcdna3.0。
9.本发明的第三方面提供一种噬菌体宿主菌株,该噬菌体宿主菌株中导入有上述的dna疫苗重组质粒。所述菌株可以为大肠杆菌bl21。
10.根据本发明一种具体实施方式,利用分子生物学方法将锚定序列插入dna疫苗载体(真核表达载体)pcdna3.0非必需区域,将该重组质粒载体导入t7噬菌体大肠杆菌bl21宿主。用t7噬菌体侵染携带dna疫苗载体的大肠杆菌宿主,回收子代t7噬菌体。用建立的荧光定量pcr方法检测包裹在t7噬菌体内部的dna疫苗载体含量;将该噬菌体接种到培养的dc细胞中,共聚焦检测细胞中报告基因(egfp)的表达。
11.本发明的第四方面提供一种包裹、转运dna疫苗载体的方法,该方法包括:将上述的t7噬菌体识别的锚定序列插入dna疫苗载体,t7噬菌体复制组装过程中通过识别锚定序列将真核表达载体包裹在衣壳内部,利用完整的t7噬菌体颗粒作为转运工具,实现dna疫苗载体向细胞内转运,并在胞内进行蛋白表达。
12.根据本发明,t7噬菌体转运的靶目标为真核细胞。
13.本发明上述t7噬菌体识别的锚定序列、dna疫苗重组质粒、t7噬菌体包裹、转运dna疫苗载体的方法可用于dna疫苗开发中。
14.本发明利用基因工程方法,调取t7噬菌体基因组左右两侧重复序列中的基因片段,并进行优化组合拼接成候选锚定序列,然后将其插入dna疫苗质粒载体;建立荧光定量pcr检测方法,评价t7噬菌体对携带候选锚定序列的dna疫苗载体的包裹效率,最终确定最佳锚定序列。应用t7噬菌体识别锚定序列并包裹dna疫苗载体,并在细胞上验证t7噬菌体介导dna疫苗载体转运、表达。
15.相较于现有技术,本发明的有益效果是:
16.(1)本发明筛选到最佳锚定序列,能够高效的被t7噬菌体识别并包裹90%以上的dna疫苗载体。
17.(2)本发明的t7噬菌体包裹dna疫苗载体能有效抵抗核酸酶的降解,降低dna疫苗在转运过程中被降解的风险。
18.(3)本发明的携带锚定序列的dna疫苗载体可独立于t7噬菌体进行基因的插入或替换,操作方便、运用广泛。
19.本发明的其它特征和优点将在随后具体实施方式部分予以详细说明。
附图说明
20.通过结合附图对本发明示例性实施方式进行更详细的描述,本发明的上述以及其它目的、特征和优势将变得更加明显。
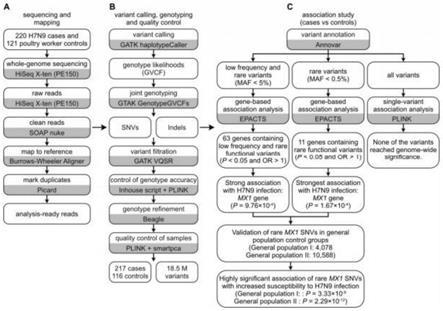
21.图1为本发明t7噬菌体包裹dna疫苗载体的技术路线图。
22.图2示出了候选锚定序列的拼接与重组dna疫苗载体构建。
23.图3示出了携带锚定序列的dna疫苗载体表达能力检测结果。
24.图4示出了t7噬菌体包裹对dna疫苗载体的保护。
25.图5示出了dna疫苗载体荧光定量pcr方法。
26.图6示出了t7噬菌体包裹不同锚定序列的效率比较。
27.图7示出了t7噬菌体转运dna疫苗载体进入胞内表达。
具体实施方式
28.下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。
29.实施例1携带候选锚定序列重组dna疫苗载体构建,构建路线方法如图1所示
30.1、候选锚定序列的pcr扩增
31.以t7噬菌体基因组为模板,引物f1/r1扩增基因组左侧1到276位(片段a),如图2
‑
a中2泳道所示;引物f2/r2扩增右侧39681到39936位(片段b),如图2
‑
a中3泳道所示;引物f3/r3扩增右侧38981到39371位(片段c),如图2
‑
a中1泳道所示。由于a片段的5’端与b片段的3’端互补,在pcr体系中片段a、b可以拼接成完整序列,以完整序列为模板,设计引物f4/r4(对应片段d)、f5/r5(对应片段e)、f6/r6(对应片段f)和f7/r7(对应片段g),pcr扩增模板序列不同区域约250bp大小的片段,如图2的b所示。利用soe
‑
pcr方法,将片段c分别与片段d、e、f和g进行拼接,操作步骤如下:重新设计片段c下游反向引物r3d、r3e、r3f和r3g,并在引物5’端引入20bp长度的片段d、e、f和g上游序列;以片段c为模板,引物f3/r3d、f3/r3e、f3/r3f、和f3/r3g进行二次扩增,回收所扩增片段分别与片段d、e、f和g混合作为模板,引物f3/r4、f3/r5、f3/r6和f3/r7进行soe
‑
pcr拼接,获得4个候选锚定序列(anchor sequence)as1、as2、as3和as4,如图2的c所示。所用引物序列如表1所示。
32.pcr扩增条件如下:
[0033][0034]
反应程序为:94℃3min;94℃30sec,54℃30sec,72℃30sec,30个循环;72℃10min。
[0035]
soe
‑
pcr扩增条件如下:
[0036][0037][0038]
反应程序为:94℃30sec,56℃30sec,72℃5min;sec 94℃3min;94℃30sec,56℃30sec,72℃45sec,30个循环;72℃10min。
[0039][0040][0041]
2、携带锚定序列的重组dna疫苗载体构建
[0042]
将扩增的候选锚定序列、dna疫苗载体(真核表达载体)pcdna3.0经bglⅱ、nruⅰ双
酶切处理,胶回收载体与片段进行连接,转化dh5α插入真核表达载体pcdna3.0,构建含有锚定序列的重组dna疫苗载体。真核表达载体pcdna3.0双酶切条件如下:
[0043][0044]
混匀上述反应体系,并置于37℃水浴作用4小时,酶切产物经2%琼脂糖凝胶电泳鉴定后,胶回收试剂盒进行切胶回收鉴定。
[0045]
将回收的锚定序列与dna疫苗载体进行连接,反应体系如下:
[0046]
锚定序列
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2.0μl
[0047]
pcdna3载体
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3.0μl
[0048]
ligation mix
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5μl
[0049]
混匀上述反应体系,并置于16℃水浴作用1小时,化学转化大肠杆菌dh5α感受态细胞,在氨苄青霉素抗性平板上筛选阳性菌落。提取重组质粒,bglⅱ、nruⅰ双酶切鉴定锚定序列的插入情况,如图2的d所示,成功插入约650bp的目的基因。
[0050]
3、重组dna疫苗载体报告基因的表达验证
[0051]
大量提取实施例1步骤2中构建的插入锚定序列的dna疫苗载体,nanodrop测定重组质粒的含量,调整浓度到100ng/μl浓度。取10μl重组dna疫苗载体、2μl turbofect(thermo)转染试剂加入到100μl无血清的dmem培养液中混匀,室温下作用15分钟。将混合液加到接种在24孔板中长至单层的293t细胞,轻轻混匀。二氧化碳培养箱中继续培养,24小时候荧光显微镜检测报告基因egfp表情况。从图3可以看出,在pcdna3.0非必需区插入锚定序列,并不影响载体多克隆位点处的egfp报告基因表达。
[0052]
实施例2t7噬菌体包裹对dna疫苗载体的保护
[0053]
1、包裹dna疫苗载体的t7噬菌体小量制备
[0054]
在氨苄抗性平板上四区划线培养实施例1步骤2中构建的重组菌。挑取单克隆菌落接种3ml含氨苄抗性的lb培养液,37℃摇床过夜培养。同时培养携带dna疫苗载体(未插入锚定序列)的大肠杆菌作为对照。次日,将培养的两组种子液以1:100转接3ml新鲜培养液,继续培养至od
600
nm=1.0,分别接种5μl t7噬菌体种子(10
10
pfu/ml),继续培养2
‑
3小时,直至大肠杆菌完全裂解。此时,t7噬菌体侵染携带锚定序列的重组菌,衣壳内部则包裹dna疫苗载体;侵染不携带锚定序列的大肠杆菌,衣壳内部则不包裹dna疫苗载体,如图4的b,e所示。
[0055]
2、pcr验证t7噬菌体衣壳包裹对dna疫苗载体的保护
[0056]
将上述步骤中制备的小量t7噬菌体进行离心,5000转、10分钟,去除大肠杆菌碎片。取500μl上清液,加入添加终浓度为1μl/ml的rnase a、dnase i,37℃消化2小时,去除体系中的大肠杆菌基因组及游离的dna疫苗载体,等体积氯仿抽提核酸酶,终止消化反应。将消化产物做连续10倍稀释,取1μl作为模板,利用pcr检测dna疫苗载体中的报告基因egfp。egfp报告基因的pcr扩增条件如下:
[0057][0058]
反应程序为:94℃3min;94℃30sec,54℃30sec,72℃30sec,30个循环;72℃10min。
[0059]
从图4的c,f可以看出,未插入锚定序列的dna疫苗载体不能被t7噬菌体包裹,载体游离在噬菌体之外,核酸酶消化处理前pcr可以检测到报告基因而消化处理后则不能检测到(图4的c)。相比之下,插入锚定序列的dna疫苗载体可以被t7噬菌体包裹,由于噬菌体衣壳的保护,核酸酶不能破坏dna疫苗载体,在消化前后均能检测到报告基因(图4的f)。
[0060]
实施例3t7噬菌体包裹dna疫苗载体效率评价
[0061]
1、dna疫苗载体荧光定量pcr方法的建立
[0062]
以实施例1步骤2中制备重组dna疫苗载体为模板,通过检测报告基因egfp建立荧光定量pcr方法。首先,利用nanodrop对重组dna疫苗载体(质粒)进行定量,并依据重组dna疫苗载体分子量计算质粒拷贝数与质量的对应关系。调整dna疫苗载体浓度,分别梯度稀释到1、10、100、1000、10000、100000和1000000个拷贝/μl,取1μl载体稀释液作为模板,建立荧光定量pcr检测方法,绘制标准曲线如图5的c所示,得到计算公式y=
‑
3.257x 38.45,用于计算待检样品中dna疫苗载体的拷贝数。
[0063]
2、不同锚定序列对t7噬菌体包裹效率的影响
[0064]
将实施例1步骤1中获得的锚定序列as1、as2、as3和as4基因片段,按照施例1步骤2中的技术途径分别插入dna疫苗载体,构建4个重组dna疫苗载体。t7噬菌体分别侵染携带不同重组dna疫苗载体的大肠杆菌,按照实施例2步骤1方法小量制备t7噬菌体包裹重组dna疫苗载体的样品,并以实施例2步骤2方法对样品进行核酸酶消化,同时设置未消化对照。根据实施例3步骤1建立的荧光定量pcr方法,分别测定待检样品消化前后的重组dna疫苗载体(质粒)拷贝数。以公式:包裹效率=(消化后质粒拷贝数/消化前质粒拷)
×
100%,计算不同锚定序列对包裹的影响。从图6的a中可以看出,携带锚定序列as2的dna疫苗载体可以高效的被t7噬菌体所包裹,其包裹效率高达95%(图6的b),为最佳锚定序列,其基因序列如seq id no.1所示。
[0065]
实施例4t7噬菌体转运dna疫苗载体进入胞内表达
[0066]
1、包裹dna疫苗载体的t7噬菌体大量制备与纯化
[0067]
在氨苄抗性平板上四区划线培养携带as2锚定序列dna疫苗载体的重组菌。挑取单克隆菌落接种5ml含氨苄抗性的lb培养液,37℃摇床过夜培养。同时培养携带dna疫苗载体(未插入锚定序列)的大肠杆菌作为对照。次日,将培养的两组种子液以1:100转接500ml新
鲜培养液,继续培养至od
600
nm=1.0,分别接种500μl t7噬菌体种子(10
10
pfu/ml),继续培养2
‑
3小时,直至大肠杆菌完全裂解。在培养体系中加入终浓度为添加终浓度为1μl/ml的rnase a、dnase i,37℃摇床继续培养30分钟。5000转、15分钟离心,回收上清,并加入终浓度为10%peg
‑
8000和3m nacl,充分混匀,4℃静置过夜。次日,12000转、15分钟离心,回收t7噬菌体沉淀,5ml sm缓冲液重悬。往重悬液中加入终浓度为1%的trition
‑
114溶液,充分混合,4℃作用30分钟,然后37℃水浴作用10分钟,8000转离心10分钟,回收上层清液,重复上述操作一次。双层琼脂夹心法测定回收t7噬菌体滴度,调整浓度到10
11
pfu/ml,冻存备用。
[0068]
2、t7噬菌体转运dna疫苗载体进入胞内表达
[0069]
采用inaba法制备spf鸡骨髓源树突状细胞,将诱导培养至第6天的树突状细胞经胰酶消化后调整细胞密度到10
×
106个/ml。在24孔细胞板中铺上细胞爬片,均匀接种1ml树突状细胞,于二氧化碳培养箱37℃过夜培养。次日,接种50μl实施例4步骤1中冻存的t7噬菌体与树突状细胞孵育1小时,吸出孔中的培养液并用pbs缓冲液轻轻洗涤一次。每孔添加1ml10%fbs的dmem培养液,继续培养36小时。取出细胞爬片,pbs洗涤1次。用1%细胞固定液,室温作用15分钟,固定爬片上的细胞,pbs洗涤2次。在载玻片上加一滴含有dapi的封片液,将爬片上细胞面盖向封片液,激光共聚焦显微镜观察t7噬菌体包裹的dna疫苗载体上报告基因egfp表达情况。从图7可以看出,t7噬菌体包裹dna疫苗载体可以进入树突状细胞,并实现胞内的蛋白表达。
[0070]
综上所述,本发明通过筛选最佳锚定序列,用于插入dna疫苗载体,构建重组载体导入大肠杆菌,t7噬菌体在该大肠杆菌内部复制、组装时能识别重组dna疫苗载体,并将其包裹在衣壳内部,一方面保护dna疫苗载体免受酶的破坏,另一方面利用完成t7噬菌体颗粒作用转运工具,实现dna疫苗载体在细胞内实现蛋白表达。本发明为dna疫苗的研发搭建了良好的平台。
[0071]
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
![一种5-卤代-2[(烷氧基羰基)氨基]-3-甲基苯甲酸的制备方法与流程](/upload/img/202111/alq13fxki5y.jpg)