1.本发明涉及生物技术领域,特别是涉及一株烈性沙门氏菌噬菌体及其在禽类动物致病性沙门氏菌感染中的应用。
背景技术:
2.沙门氏菌病是公共卫生学上具有重要意义的人畜共患病之一,是一种常见的食源性致病菌。鸡是沙门氏菌最重要的宿主,沙门氏菌可引起鸡急性或慢性疾病,感染沙门氏菌的鸡也可通过产出带菌的蛋导致沙门菌的垂直传播,从而形成恶性循环。当鸡群暴发沙门氏菌病时死亡率可达80%,对养禽业造成巨大的经济损失。人一旦摄入了含有大量沙门氏菌的动物性食品,可导致食源性中毒,据统计在世界各国的种类细菌性食物中毒中,沙门氏菌引起的食物中毒常列榜首。抗生素一直以来被作为治疗细菌感染的首选而得到广泛应用。但随着抗生素的广泛使用甚至滥用,目前细菌对抗生素的耐药性问题已十分严重,抗生素耐药性正在对全球健康构成威胁。
3.噬菌体(bacteriophage或phage)是自然界中最丰富的生物之一,在地球上大约蕴藏着10
31
的噬菌体颗粒,也就是平均每1g土壤或水中包含了多达108数量的噬菌体。长期以来,其一直被认为可作为治疗药物和杀菌剂使用。噬菌体对某些细菌菌株具有高度特异性,其取决于噬菌体吸附器官和受体菌表面受体的分子结构和互补性,不会影响生物体或内源性组织的正常运转。另外,即使随着细菌耐药性的发展,噬菌体仍会大量保持。在过去几年中,使用噬菌体来检测和控制食品和环境中致病菌及腐败菌的生长受到越来越多研究者的关注,并且该方法已有许多研究支持。bmvko lyu等讨论了噬菌体检测致病菌的优缺点,指出利用噬菌体检测食品安全及加工制造过程等方面存在的致病菌具有极大的应用前景。例如在蜜瓜切片、鸡胸肉、白菜、牛奶、鸡皮、豆芽菜等食品中发现使用噬菌体制剂后沙门氏菌菌量显著减少。另外,已从多种食物如碎牛肉、猪肉等肉制品、奶制品、生菜等分离出沙门氏菌噬菌体,因此,噬菌体是食品中的天然微生物。本试验从现代化肉鸡养殖场病鸡体内采集样品,筛选能裂解多株病原菌的沙门氏菌烈性噬菌体,并对其生物学特性进行分析,以期为噬菌体防治沙门氏菌的研究提供理论依据。
技术实现要素:
4.本发明的目的在于提供一株烈性沙门氏菌噬菌体rdp
‑
sa
‑
20051,旨在解决养殖场禽类因感染沙门氏菌,发病急而治疗不及时,且因致病菌耐药性而导致用药无效等问题。
5.为实现上述目的,本发明采用如下技术方案:
6.一株烈性沙门氏菌噬菌体rdp
‑
sa
‑
20051,透过电镜观察,头部呈正六边形,头部直径约为52nm,尾部长度为110nm,为长尾科噬菌体,经测定,该沙门氏菌噬菌体rdp
‑
sa
‑
20051不具有毒力基因和溶原基因,该噬菌体于2021年03月25日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为:北京市朝阳区北辰西路1号院3号,保藏编号cgmcc no.21996。
7.进一步地,该沙门氏菌噬菌体rdp
‑
sa
‑
20051在80℃高温条件下作用30min,效价保持在1.0
×
108pfu/ml以上,具有良好的耐高温特性;该噬菌体在ph在5
‑
9范围作用6小时,其效价保持在1
×
10
10
pfu/ml之上,具有明显的嗜碱性;在ph=12以及ph=2时,仍有噬菌体存活,该噬菌体的酸碱耐受范围较宽。
8.进一步地,该沙门氏菌噬菌体rdp
‑
sa
‑
20051具有广谱的杀灭沙门氏菌的能力。
9.本发明的另一目的在于提供该沙门氏菌噬菌体rdp
‑
sa
‑
20051在制备预防和或治疗沙门氏菌引起的疾病的药物中的用途。
10.本发明的另一目的在于提供该沙门氏菌噬菌体rdp
‑
sa
‑
20051在制备预防和或治疗沙门氏菌引起的疾病的饲料中的用途。
11.本发明还提供了一种用于防治沙门氏菌的杀菌组合物,包括有效量的沙门氏菌噬菌体rdp
‑
sa
‑
20051。
12.本发明的另一目的在于提供一种沙门氏菌噬菌体的应用,该目的是通过将沙门氏菌噬菌体rdp
‑
sa
‑
20051用作为由沙门氏菌引起的细菌感染提供潜在的治疗药物或保健品来实现的。
13.本发明的另一目的在于提供一种预防和或治疗沙门氏菌引起的疾病的添加剂,该目的是通过其有效成分包括沙门氏菌噬菌体rdp
‑
sa
‑
20051来实现的。
14.本发明还提供了一种清洁剂或消毒剂,包括沙门氏菌噬菌体rdp
‑
sa
‑
20051。
15.本发明的有益效果体现在:
16.(1)本发明从山东一养殖场病死鸡体内分离得到了沙门氏菌bs
‑
20062,并通过实验确定了bs
‑
20062的强毒和耐药性,以bs
‑
20062为宿主,从环境中分离得到一株烈性沙门氏菌噬菌体,该噬菌体rdp
‑
sa
‑
20051对禽类养殖环境中致病性沙门氏菌bs
‑
20062具有强裂解效用,为工业化生产噬菌体用于禽类养殖环境中致病性沙门氏菌bs
‑
20062的防治提供了噬菌体来源;
17.(2)本发明所提供的沙门氏菌噬菌体rdp
‑
sa
‑
20051是从自然界中分离的烈性噬菌体,经毒理实验证明其安全、无任何副作用;供试噬菌体不含毒力基因或不良基因;本发明未对供试噬菌体进行任何遗传修饰;
18.(3)本发明沙门氏菌噬菌体rdp
‑
sa
‑
20051在80℃高温条件下作用30min,效价保持在1.0
×
108pfu/ml以上,具有良好的耐高温特性;该噬菌体在ph在5
‑
9范围作用6小时,其效价保持在1
×
10
10
pfu/ml之上,在ph=12以及ph=2时,仍有噬菌体存活,该噬菌体的酸碱耐受范围较宽;
19.(4)本发明沙门氏菌噬菌体rdp
‑
sa
‑
20051裂解谱广,可裂解肠炎沙门氏菌、鸡沙门氏菌、汤卜逊沙门氏菌、鼠伤寒沙门氏菌、山夫登堡沙门氏菌、斯坦利沙门氏菌等不同血清型的沙门氏菌,裂解率达98.9%,具有更强的裂解性能,在治疗沙门氏菌感染疾病具有很好的优势,效价高,防治效果好;
20.(5)本发明所提供的沙门氏菌噬菌体rdp
‑
sa
‑
20051可作为应用于环境消毒的各种产品的有效成分,例如包括但不限于以液体浸泡、喷洒、与含水性载体联合使用等形式对配水系统、医疗设施、养殖业设施、公共及私人设施或其他环境表面进行消毒去污,可有效控制目标细菌的生长及活性;所述液体浸泡、喷洒形式包括但不限于洗涤剂、消毒剂、去污剂等;所述含水性载体包括但不限于磷酸盐缓冲液、lb培养基、氯游离水等;
21.(6)本发明的沙门氏菌噬菌体rdp
‑
sa
‑
20051,可用于制备组合物,试剂,或试剂盒;可应用于沙门氏菌的快速检测,其包括但不限于以试纸、试剂盒等形式对目标样本中的沙门氏菌进行检测,或对临床样本中的目标致病菌进行筛选,可有效确保检测的灵敏度;
22.(7)本发明的沙门氏菌噬菌体rdp
‑
sa
‑
20051可以单独或混合使用,用作为生物杀菌剂,饲料添加剂,或因沙门氏菌引起的细菌感染的治疗药物、保健品及医疗器械;沙门氏菌噬菌体rdp
‑
sa
‑
20051可应用于治疗或预防由沙门氏菌引起的感染性疾病;可被沙门氏菌感染的寄主包括人类、家畜(猪、牛、羊等)、家禽(鸡、鸭、鹅等),以及各种兽类、鱼类、鼠类等;
23.(8)本发明的沙门氏菌噬菌体rdp
‑
sa
‑
20051可以应用于工业生产,可由宿主菌特异性扩增,可应用标准病毒纯化方法高度纯化,具有极好的推广前景;本领域技术人员可以根据本发明的记载及本领域常识将本发明所述沙门氏菌噬菌体rdp
‑
sa
‑
20051或其组合物制备成应用于医疗,检测,消毒及食品防护等方面的各种产品加以工业应用;产品形式可包括但不限于以载体携带、浓缩注射或药剂浸泡等形式施用于被防治的寄主体表、口部、直肠、胸膜内部等部位;作为实施方案之一,所述载体携带形式包括但不限于口服含水性载体、口服无水性载体、乳膏制剂等;浓缩注射形式包括但不限于疫苗注射、胸膜腔注射、经脉注射等;药剂浸泡形式包括但不限于气雾剂、漂洗剂等。
附图说明
24.本发明上述的以及其他的特征、性质和优势将通过下面结合附图和实施例的描述而变的更加明显:
25.图1为沙门氏菌bs
‑
20062毒力基因pcr扩增结果图;
26.图2为本发明噬菌体rdp
‑
sa
‑
20051的噬菌斑形态图;
27.图3为本发明噬菌体rdp
‑
sa
‑
20051的电镜图;
28.图4为本发明噬菌体rdp
‑
sa
‑
20051对沙门氏菌bs
‑
20062生长曲线的作用图;
29.图5为本发明噬菌体rdp
‑
sa
‑
20051的酸碱耐受性示意图;
30.图6为本发明噬菌体rdp
‑
sa
‑
20051的热稳定性示意图。
具体实施方式
31.下面结合附图和实施例对本发明作进一步说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
32.本发明从山东省某养殖场病死鸡体内分离得到沙门氏菌bs
‑
20062,并通过实验确定了bs
‑
20062的致病性和耐药性,以bs
‑
20062为宿主,从环境中分离得到一株烈性沙门氏菌噬菌体,并通过全基因组序列确定了rdp
‑
sa
‑
20051的基因型。
33.本发明所提供的沙门氏菌噬菌体rdp
‑
sa
‑
20051在治疗沙门氏菌感染疾病具有很好的优势,裂解谱广,而且不会对益生菌造成伤害,效价较高,防治效果好。
34.实施例1病原菌及噬菌体的分离及鉴定
35.1、致病性沙门氏菌bs
‑
20062的分离及其鉴定
36.从病死鸡的内脏中取样,采用无菌操作的方法,在ss培养基上划线,37℃培养18
‑
24h后,在ss琼脂平板上呈现中心黑色边缘白色整齐菌落,直径约2~3mm;挑取典型菌落在lb琼脂上平板划线,37℃培养10
‑
24h后,在lb琼脂平板上呈现扩散生长,挑取典型菌落继续划线纯化3次,然后挑取单菌落接种于5ml的lb液体培养基中,37℃,200rpm振荡培养8h,得到均匀浑浊的细菌悬浮液。再通过16srna分子鉴定,确定为沙门氏菌,将其中一株命名为bs
‑
20062。
37.2、沙门氏菌bs
‑
20062的耐药性实验
38.将分离得到的沙门氏菌进行6类抗生素10种抗菌药物的体外药敏试验,所选药物及耐药性结果如表1所示。按照clsi标准,采用圆纸片扩散法进行。
[0039][0040][0041]
注:r,耐药;i,中介度;s,敏感。
[0042]
由实验结果可以看出,该沙门氏菌bs
‑
20062对大多数抗生素具有耐药性。
[0043]
3、沙门氏菌毒力基因鉴定
[0044]
根据国内外对沙门氏菌毒力因子的研究结果,在genbank中查找10对影响沙门氏菌毒力的基因,设计并合成基因引物:fima(9)、pipc(1)、stn(2)、invj(3)、ssel(5)、spvc(4)、spvb(6)、spvd(7)、spvr(8)、ssab(10),提取沙门氏菌bs
‑
20062的dna模板,然后pcr扩增,扩增完成后,1%琼脂糖凝胶电泳检测。相关毒力基因pcr扩增检测结果如图1所示。该菌含有的毒力基因有9种fima、pipc、stn、invj、spvc、spvb、spvd、spvr、ssab。通过毒力基因检测推断该致病菌发病率极高,而且药敏实验发现该菌耐药性极强。
[0045]
4、沙门氏菌噬菌体的分离鉴定
[0046]
(1)取样:本发明试验用样品为2020年从发病养殖场周边污水中采集,作为噬菌体
分离的水样。
[0047]
取污水10毫升,10000rpm离心5分钟,出去较大杂质及大部分细菌后,再用0.22微米微孔滤膜过滤除菌。取3毫升滤液和3毫升宿主菌菌悬液,一起加入20毫升高压灭菌后的2216e液体培养基中,然后置37℃培养箱中,过夜培养。培养后取5毫升,10000rpm离心5分钟,再用0.22微米微孔滤器过滤除菌,滤液即为拟含有噬菌体的原液。然后,采用双平板法鉴定是否有噬菌体,若有噬菌斑则有噬菌体,反之需从新筛选。
[0048]
(2)噬菌体的纯化
[0049]
初次分离的噬菌斑大小、形态常常不一致,因此需要进一步的纯化。在有噬菌斑的双层平板上挑取单个独立、形态均匀、清晰透明的噬菌斑,置1毫升生理盐水中,浸泡10分钟后,取清液,用0.22微米微孔过滤器过滤,然后将滤液适当稀释(铺双平板时有单个噬菌斑)后,与宿主菌悬液铺双层平板,此步骤重复3~4次,待双平板上各噬菌斑大小、形态和清晰度一致时即得到纯化的噬菌体。
[0050]
(3)噬菌体效价的测定
[0051]
将纯化好的噬菌体铺双层平板,然后取单个噬菌斑,加入lb液体培养基中,同时加入宿主菌悬液,将噬菌体增殖后,再将增殖液10000rpm离心5分钟后再用0.22微米微孔过滤器过滤,将滤液做10倍梯度稀释至108倍,取最后3个稀释度的噬菌体稀释液0.1毫升和宿主菌悬液0.1毫升,铺双层平板,测定噬菌体效价。
[0052]
噬菌体效价(pfu/ml)=噬菌斑数
×
稀释倍数
÷
0.1
[0053]
结果如图2所示,其噬菌斑形态、大小和清晰度一致,有典型的裂解性噬菌体特征。该噬菌体的效价可达10
13
pfu/ml以上。
[0054]
实施例2噬菌体的形态观察
[0055]
运用磷钨酸负染法:在石蜡片上滴噬菌体液(效价10
10
pfu/m l)100μl,将铜网有膜的一面置于噬菌体液滴上,10min后取下,在空气中自然干燥2
‑
3min,然后在铜网上滴一滴2%的磷钨酸(pta)水溶液进行染色,10min后取下,在空气中干燥10~15min,用电子显微镜观察,选取清晰的噬菌体图像进行拍照。由电镜照片图3可看出,该噬菌体rdp
‑
sa
‑
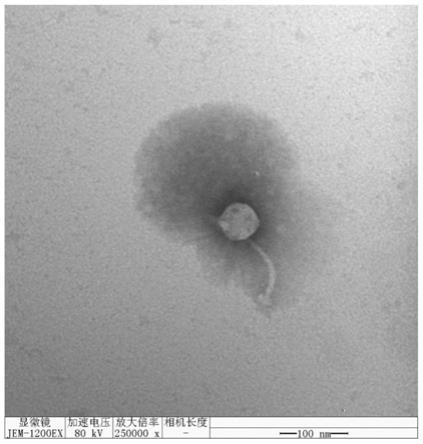
20051为长尾科噬菌体,头部呈正六边形,头部直径约为52nm,尾部长度为110nm。
[0056]
实施例3噬菌体rdp
‑
sa
‑
20051基因组测序
[0057]
通过对单株噬菌体的富集培养后,在4℃条件下8000g离心15分钟,加入10%peg8000和0.5m nacl静置过夜,再加入等量氯仿混匀,静置分层后5000g下离心10min,去处氯仿层和peg层后,加入限制性核酸内切酶消化处理,并采用梯度密度氯化铯条件下悬浮噬菌体,后期采用tm缓冲液透析3次,每次30min,最后将透析好的噬菌体送华大基因生物测序公司进行全基因组测序。
[0058]
实施例4最佳感染复数实验
[0059]
按照感染复数为1:100、1:10、1:1、10:1、100:1的比例将噬菌体增殖液和宿主加入lb液体培养基中,并且确保培养体系的总体积相同;于37℃200rpm振荡培养6h后,常温下12000r/min离心5min,取上清液铺双平板测定其效价;结果如表1所示。
[0060]
表1噬菌体最佳感染复数试验
[0061][0062]
由表1数据可知,当感染复数为1:1时,培养6h后,增殖液较为清澈,效价最高,表明本发明沙门氏菌噬菌体rdp
‑
sa
‑
20051的最佳感染复数为1:1。
[0063]
实施例5噬菌体rdp
‑
sa
‑
20051对沙门氏菌bs
‑
20062生长曲线作用图
[0064]
将培养6h的宿主菌悬液以3%的比例接种到100ml lb液体培养基中,以最佳感染复数,加入噬菌体增殖液,同时以不加噬菌体的作为对照,做3组平行对照,取其平均值;结果如图4所示。
[0065]
由图4可知,未加入噬菌体的宿主,随着时间延长,宿主不断增殖,其od600逐渐增加,而加入噬菌体的宿主,随着噬菌体的数量的指数增加,在5h内,噬菌体裂解宿主,其od600没有明显的提升,而且略有下降,但在6h后对噬菌体耐受的宿主菌增殖起来,但在第10小时的时候,宿主菌又被压制住,最后随着时间的延长,其od600逐渐增大,最终趋于平稳。
[0066]
沙门氏菌噬菌体rdp
‑
sa
‑
20051加入到宿主菌bs
‑
20062菌悬液中,作用5h内,od600几乎不变,对宿主菌出现一定的裂解效果,与对照组相比,未加入噬菌体的宿主od600增加明显,说明该噬菌体对宿主有较强的裂解能力,能够持续的对宿主菌进行裂解。持续作用6h后,混合菌液出现返浊,被突变的耐受菌所取代的一种菌群交替,但是该噬菌体应对此现象产生对抗策略,使od600又下降,持续压制细菌数量的增长,具体应对机制尚不清楚。总之,该噬菌体可对该病原菌有很好的抑制作用。
[0067]
实施例6酸碱稳定性的测定
[0068]
用稀盐酸和稀naoh溶液调节生理盐水的酸碱度,配成ph值为2、3、4、5、6、7、8、9、10、11、12的缓冲液,再将配置好的缓冲溶液将噬菌体稀释成1
×
10
10
pfu/ml,将稀释液在37℃下,水浴1h,用生理盐水10倍比稀释后铺双平板,37℃倒置培养4
‑
6h后计数;结果如图5所示。
[0069]
由图5可知,该噬菌体在ph在5
‑
9范围作用6小时,其效价保持在1
×
10
10
pfu/ml之上,在ph=7时,效价最高;说明该噬菌体rdp
‑
sa
‑
20051最适生长在中性环境;在ph=12以及ph=2时,仍有噬菌体存活,表明该噬菌体的酸碱耐受范围较宽;
[0070]
实例例7热稳定性的测定
[0071]
将噬菌体原液分装到ep管中,分别在30℃、40℃、50℃、60℃、70℃、80℃、90℃的条
件下孵育30min,然后用生理盐水10倍比稀释后,铺双平板计数;结果如图6所示。
[0072]
由图6可知,该噬菌体rdp
‑
sa
‑
20051在30℃
‑
60℃范围内,效价保持稳定,在1.0
×
109pfu/ml以上;在80℃高温条件下作用30min,效价保持在1.0
×
108pfu/ml以上,具有良好的耐高温特性。
[0073]
实施例8裂解率实验
[0074]
无菌条件下,分别取1ml样品和1ml宿主菌菌液(1
×
105cfu/ml),37℃孵育15分钟,混匀后用生理盐水稀释至10
‑1‑
10
‑3个梯度,每个梯度取100μl涂布于lb琼脂平板上,置于37℃,培养24小时,每个梯度重复两次。同时取1ml生理盐水和1ml宿主菌菌液(1
×
105cfu/ml)作为空白对照,重复以上步骤。选取30
‑
300个菌落数的平板进行计数。该试验重复3次,取其平均值。噬菌体裂解率=(1
‑
处理组菌落数/对照组菌落数)
×
100%。
[0075]
结果可知,rdp
‑
sa
‑
20051的裂解率达98.9%,对宿主有较好的裂解效果,适合在养殖过程中使用。
[0076]
应当指出的是,具体实施方式只是本发明比较由代表性的例子,显然本发明的技术方案不限于上述实施例,还可以有很多变形。本领域的普通技术人员,以本发明所明确公开的或根据文件的书面描述毫无异议的得到的,均应认为是本专利所要保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。