1.本发明属于组织芯片技术领域,具体涉及一种高稳定性骨及骨肿瘤组织微阵列芯片及其制备方法。
背景技术:
2.组织芯片也称组织微阵列,是生物芯片技术的一个重要分支,是将许多不同个体组织标本以规则阵列方式排布于同一载体(使用载玻片最多)上,主要用于研究同一种基因或蛋白质分子在不同细胞或组织中表达的情况。该技术自1998年问世以来,以其大规模、高通量、标准化等优点得到大范围的推广应用。其最大优势在于,芯片上的组织样本实验条件完全一致,有极好的质量控制。节省时间、节省试剂更是显而易见的。
3.我国组织芯片制备技术日趋成熟,但是对于一些特殊组织,比如骨组织和骨肿瘤组织,由于其硬度大,脱钙处理后酸度强,导致组织粘附性差,因此给制作高质量组织芯片造成较大难度,制作起来费时、费力,而且经常出现掉点、脱片现象,组织芯片质量差直接影响到后续实验结果。另外,骨肿瘤组织芯片由于含量多,受组织脱钙影响等原因,有效靶组织细胞少,经常会因为固定、脱钙等前期组织处理不稳定因素而使细胞变性,导致组织芯片组织点内有效靶组织数量和质量得不到保障。
4.鉴于以上原因,特突出本发明。
技术实现要素:
5.为了解决现有技术存在的以上问题,本发明提供了一种高稳定性骨及骨肿瘤组织微阵列芯片及其制备方法,本发明所述的芯片解决了芯片掉点和有效靶组织少及细胞变性等问题,节约了时间及成本,提高了组织芯片核心质量。
6.本发明的第一目的,提供了一种高稳定性骨及骨肿瘤组织微阵列芯片的制备方法,包括如下步骤:
7.(1)收集骨及骨肿瘤组织样本,对所述的组织样本进行处理;
8.(2)将处理后的组织样本石蜡包埋,再进行切片he染色,将he染色片进行扫描;
9.(3)由病理医生结合扫描图在显微镜下诊断,标记有效靶组织,按照设计的组织微阵列及点径大小制作组织芯片受体蜡块,对照he切片标记的有效靶组织区域,在供体蜡块上打孔取样,取出样本柱芯埋放入受体蜡块孔内,全部填埋完毕后,将组织微阵列蜡块放置在57℃恒温箱1.5h固蜡融合,然后室温放置4h,转入2
‑
6℃下冷藏保存6小时以上,进行切片、烤片和he常规染色,制成的所述的高稳定性骨及骨肿瘤组织微阵列芯片。
10.本发明的蜡块选用莱卡蜡,熔点52℃
‑
56℃。
11.进一步的,步骤(1)中所述的组织样本进行处理具体为:将骨及骨肿瘤样本固定于体积分数为10%福尔马林溶液中24小时后再锯取厚度为0.5cm骨片或带骨肿瘤组织,然后在体积分数为10%的福尔马林溶液中固定48小时,将骨或带骨肿瘤组织置于脱钙剂中直至骨组织容易被针刺透,进行脱水、透明、浸蜡、切片。
12.本发明中的脱钙剂为含盐酸脱钙液,浓盐酸15ml、氯化钠7.5ml、蒸馏水加至100ml得到所述的脱钙剂。每日需要更换新的脱钙剂直至骨组织容易被针刺透,流水冲洗24小时去酸,然后进行下一步处理。
13.进一步的,步骤(3)中将组织微阵列蜡块放置在54℃下1h固蜡融合,然后室温放置4h,转入4℃下冷藏保存6小时以上。
14.本发明人经过大量试验发现,采用本发明的温度和时间进行固蜡以及室温放置,特定温度冷藏,可以使得组织柱芯充分和受体蜡块相容,避免点片脱落。
15.本发明中浸蜡过程具体如下:
16.(1)75%酒精,37度,2小时;(2)95%酒精,37度,2小时;(3)95%酒精,37度,2小时;(4)100%酒精,37度,2小时;(5)100%酒精,37度,1.5
‑
2小时;(6)二甲苯i,45分钟;(7)二甲苯ii,45分钟;(8)石蜡i,60度,30分钟;(9)石蜡ii,60度,60分钟;(10)石蜡iii,60度,90分钟。
17.本发明中包埋操作具体如下:
18.提前两小时打开包埋机电源总开关,让包埋机处于工作状态,调高温度,让包埋蜡温至58℃左右。包埋前先打开冷冻台。取出包埋模型,由脚踩踏控制出蜡量,注入少量的石蜡后,挟入组织块,组织应完全压平,包埋方向根据组织形状和解剖结构具体制定,如管状和皮肤组织应竖起来包埋,然后再压上包埋盒(5mm厚度规格),包埋盒上再注入少量石蜡,包埋完后,将其置于冷冻台上,当冷冻台上的包埋块表面出现凝结时,取出蜡块,修削去周边的余蜡,按顺序排列好,放置冰箱冷冻室(﹣18℃)备用。
19.本发明中的he染色具体操作如下:
20.将包埋好的蜡块固定于切片机上,切成3微米厚薄蜡片,连续切下的薄蜡片往往皱折叠加,将薄蜡片按照25
‑
30度角斜拉放到加热(水温45℃)的水中烫平,再贴到载玻片上,放45℃恒温箱中烘干一小时。
21.(1)把烘干带薄组织片载玻片依次轻柔插入染色架内;(2)二甲苯i,5分钟;(3)二甲苯ii,10分钟;(4)无水乙醇i,1分钟;(5)无水乙醇ii,1分钟;(6)95%酒精i,1分钟;(7)95%酒精ii,1分钟;(8)90%酒精,1分钟;(9)85%酒精,1分钟;(10)苏木精染色1分钟;(11)自来水洗1分钟;(12)1%盐酸酒精分化20秒;(13)自来水洗1分钟;(14)1%氨水反蓝30秒;(15)蒸馏水洗1分钟;(16)伊红染色1分钟;(17)自来水洗1分钟;(18)85%酒精1分钟;(19)90%酒精1分钟;(20)95%酒精1分钟;(21)无水乙醇i,1分30秒;(22)无水乙醇ii,2分30秒;(23)二甲苯i,1分钟;(24)二甲苯ii,1分钟;(25)中性树胶封片;(26)染色结果:细胞核呈蓝色,细胞浆呈桃红色。
22.本发明中所述的he(苏木精
‑
伊红染色)染色片扫描(40
×
倍率)具体为:
23.(1)载玻片左手边磨砂区贴标签,内容包括中科光华logo、编号、流水号和he字样;
24.(2)依次放入扫描载片盘,轻推入扫描仪中(优纳precice 500b型扫描仪);
25.(3)自动识别图像及对焦进行扫描;
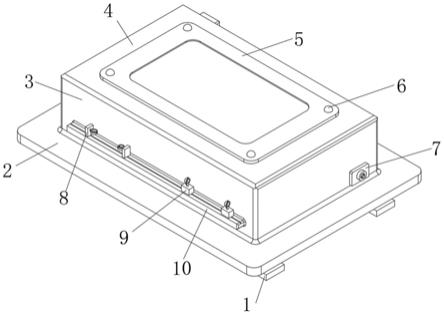
26.(4)打开扫描图观察扫描细胞清晰,色泽鲜艳。
27.本发明的第二目的,提供了一种所述的方法制备的高稳定性骨及骨肿瘤组织微阵列芯片。
28.本发明中使用beecher mta
‑
1阵列仪。
29.进一步的,所述的高稳定性骨及骨肿瘤组织微阵列芯片包括载玻片片基、专用标签和附着在载玻片上的具有靶信息点样组织。
30.进一步的,所述的高稳定性骨及骨肿瘤组织微阵列芯片的组合排列方式为单一骨肿瘤矩阵排列或多病理类型骨肿瘤矩阵排列。
31.进一步的,所述的单一骨肿瘤矩阵排列为单一骨肿瘤匹配和/或不匹配瘤旁、肿瘤边缘及正常骨组织组合矩阵排列,所述的多病理类型骨肿瘤矩阵排列为多病理类型骨肿瘤匹配和/或不匹配瘤旁、肿瘤边缘及正常骨组织组合矩阵排列。
32.进一步的,所述的瘤旁、肿瘤边缘及正常骨组织为一例一点或一例多点。
33.可以是完全匹配(芯片上所有骨肿瘤组织点搭配同例瘤旁和/或同例肿瘤边缘组织)或不完全匹配(芯片上所有骨肿瘤搭配部分同例和/或部分不同例瘤旁及边缘组织)。正常骨组织可以是匹配,也可以不匹配,可以放置在组织微阵列任何点位(包括标记点)。
34.进一步的,含骨量多组织点位于所述的组织微阵列芯片中央或近中央区域,靠边行和列组织点放置骨量少、瘤细胞丰富组织。
35.进一步的,所述的组织微阵列芯片用于骨肿瘤免疫组化、核酸原位杂交、荧光核酸原位杂交或原位pcr检测。
36.与现有技术相比,本发明的有益效果为:
37.采用本发明的方法制备的骨及骨肿瘤组织微阵列芯片,较好的解决了芯片掉点和有效靶组织少及细胞变性等问题,本发明从物理学和平面排列及实用性角度综合设计出最佳骨肿瘤组织芯片排列方式,节约了时间及成本,提高了组织芯片核心质量,在抗体研发、肿瘤研究和基因检测等领域得到了广大科研,临床及教学机构的好评,基本满足组织、蛋白、基因分子等领域肿瘤生物治疗上对于靶向药物的研发和肿瘤诊断及发生机制、转归所需要的对照组样本需求,从而更快捷、便利、全面、严谨的提升科研水平。
附图说明
38.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
39.图1是本发明的一种骨及骨髓组织芯片包含10例正常骨及骨髓组织微阵列芯片的图片;
40.图2是本发明的第一种微阵列芯片的排列方式;
41.图3是本发明的一种骨肉瘤及正常骨组织芯片含骨肉瘤50例及正常骨组织1例微阵列芯片的图片;
42.图4是本发明的第二种微阵列芯片的排列方式;
43.图5是本发明的一种骨肉瘤及正常骨组织芯片含骨肉瘤70例及正常骨组织1例微阵列芯片的图片;
44.图6是本发明的第三种微阵列芯片的排列方式。
具体实施方式
45.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
46.本发明中的载玻片可以是玻璃例如:防脱/粘附免疫组化载玻片、免疫荧光原位杂交载玻片、多聚赖氨酸载玻片,也可以是硅化防脱载玻片和生物膜。
47.本发明的载玻片片基上带靶信息点样组织,每一点根据不同需求直径大小可以是0.6mm,1.0mm,1.5mm,2.0mm。组织芯间距与组织芯直径按照1:3比列分别为0.2mm,0.3mm,0.5mm,0.6mm。
48.从左到右按照行x列方式排列,水平方向每行按数字编号,垂直方向每列按字母编号,分别从1
‑
a开始。每张载玻片片基上可以702点到4点不等。标记微阵列截止最后一点,末行最后一点为标记点(可以是骨或骨肿瘤组织,也可以是碳芯等),作为微阵列组织芯片结束如图1所示。其排列方式可以为长方矩阵列方式、正方矩阵列方式和其他形状排列如图2
‑
6所示,其中图4和6中斜体字点位组织含骨量少,瘤细胞丰富。
49.本发明还可以根据需要制作多组合微阵列方式排列组织芯片,即在阵列受体块划分对称或不对称矩阵列区域,可以是长方形也可以是正方形矩阵列,按照研究设计模型,增大行间距和/或列间距划分出多个矩阵列组合。行或列间距可以是0.3mm,0.4mm,0.5mm,0.6mm,0.8mm,1.0mm,1.5mm,2.0mm,3.0mm。也可以根据研究需要切片时连续或不连续(相隔一张切片或多张切片)捞片,间隔1个组织芯直径或2个组织芯直径距离对称裱于载玻片上。
50.以下实施例中所述的浸蜡过程具体如下:
51.(1)75%酒精,37度,2小时;(2)95%酒精,37度,2小时;(3)95%酒精,37度,2小时;(4)100%酒精,37度,2小时;(5)100%酒精,37度,1.5
‑
2小时;(6)二甲苯i,45分钟;(7)二甲苯ii,45分钟;(8)石蜡i,60度,30分钟;(9)石蜡ii,60度,60分钟;(10)石蜡iii,60度,90分钟。
52.包埋操作具体如下:
53.提前两小时打开包埋机电源总开关,让包埋机处于工作状态,调高温度,让包埋蜡温至58℃左右。包埋前先打开冷冻台。取出包埋模型,由脚踩踏控制出蜡量,注入少量的石蜡后,挟入组织块,组织应完全压平,包埋方向根据组织形状和解剖结构具体制定,如管状和皮肤组织应竖起来包埋,然后再压上包埋盒(5mm厚度规格),包埋盒上再注入少量石蜡,包埋完后,将其置于冷冻台上,当冷冻台上的包埋块表面出现凝结时,取出蜡块,修削去周边的余蜡,按顺序排列好,放置冰箱冷冻室(﹣18℃)备用。
54.本发明中的he染色具体操作如下:
55.将包埋好的蜡块固定于切片机上,切成3微米厚薄蜡片,连续切下的薄蜡片往往皱折叠加,将薄蜡片按照25
‑
30度角斜拉放到加热(水温45℃)的水中烫平,再贴到载玻片上,放45℃恒温箱中烘干一小时。
56.(1)把烘干带薄组织片载玻片依次轻揉插入染色架内;(2)二甲苯i,5分钟;(3)二甲苯ii,10分钟;(4)无水乙醇i,1分钟;(5)无水乙醇ii,1分钟;(6)95%酒精i,1分钟;(7)95%酒精ii,1分钟;(8)90%酒精,1分钟;(9)85%酒精,1分钟;(10)苏木精染色1分钟;(11)
自来水洗1分钟;(12)1%盐酸酒精分化20秒;(13)自来水洗1分钟;(14)1%氨水反蓝30秒;(15)蒸馏水洗1分钟;(16)伊红染色1分钟;(17)自来水洗1分钟;(18)85%酒精1分钟;(19)90%酒精1分钟;(20)95%酒精1分钟;(21)无水乙醇i,1分30秒;(22)无水乙醇ii,2分30秒;(23)二甲苯i,1分钟;(24)二甲苯ii,1分钟;(25)中性树胶封片;(26)染色结果:细胞核呈蓝色,细胞浆呈桃红色。
57.本发明中所述的he(苏木精
‑
伊红染色)染色片扫描(40
×
倍率)具体为:
58.(1)载玻片左手边磨砂区贴标签,内容包括中科光华logo、编号、流水号和he字样;
59.(2)依次放入扫描载片盘,轻推入扫描仪中(优纳precice 500b型扫描仪);
60.(3)自动识别图像及对焦进行扫描;
61.(4)打开扫描图观察扫描细胞清晰,色泽鲜艳。本发明的第二目的,提供了一种所述的方法制备的高稳定性骨及骨肿瘤组织微阵列芯片。
62.实施例1
63.本实施例的一种高稳定性骨及骨肿瘤组织微阵列芯片的制备方法,包括如下步骤:
64.(1)收集骨及骨肿瘤组织样本,对所述的组织样本进行处理;
65.所述的组织样本进行处理具体为:将骨及骨肿瘤样本固定于体积分数为10%福尔马林溶液中24小时后再锯取厚度为0.5cm骨片或带骨肿瘤组织,然后在体积分数为10%的福尔马林溶液中固定48小时,将骨或带骨肿瘤组织置于脱钙剂中,浓盐酸15ml、氯化钠7.5ml、蒸馏水加至100ml得到所述的脱钙剂,每日需要更换新的脱钙剂直至骨组织容易被针刺透,进行脱水、透明、浸蜡、切片;
66.(2)将处理后的组织样本石蜡包埋,再进行切片he染色,将he染色片进行扫描;
67.(3)由病理医生结合扫描图在显微镜下诊断,标记有效靶组织,按照设计的组织微阵列及点径大小制作组织芯片受体蜡块,对照he切片标记的有效靶组织区域,在供体蜡块上打孔取样,取出样本柱芯埋放入受体蜡块孔内,全部填埋完毕后,将组织微阵列蜡块放置在57℃恒温箱1.5h固蜡融合,然后室温放置4h,转入2℃下冷藏保存6小时以上,进行切片、烤片和he常规染色,制成的所述的高稳定性骨及骨肿瘤组织微阵列芯片。
68.本实施例所述的高稳定性骨及骨肿瘤组织微阵列芯片包括载玻片片基、专用标签和附着在载玻片上的具有靶信息点样组织;所述的高稳定性骨及骨肿瘤组织微阵列芯片的组合排列方式为单一骨肿瘤矩阵排列;所述的单一骨肿瘤矩阵排列为单一骨肿瘤匹配;含骨量多组织点位于所述的组织微阵列芯片中央或近中央区域,靠边行和列组织点放置骨量少、瘤细胞丰富组织。
69.实施例2
70.本实施例的一种高稳定性骨及骨肿瘤组织微阵列芯片的制备方法,包括如下步骤:
71.(1)收集骨及骨肿瘤组织样本,对所述的组织样本进行处理;
72.所述的组织样本进行处理具体为:将骨及骨肿瘤样本固定于体积分数为10%福尔马林溶液中24小时后再锯取厚度为0.5cm骨片或带骨肿瘤组织,然后在体积分数为10%的福尔马林溶液中固定48小时,将骨或带骨肿瘤组织置于脱钙剂中,浓盐酸15ml、氯化钠7.5ml、蒸馏水加至100ml得到所述的脱钙剂,每日需要更换新的脱钙剂直至骨组织容易被
针刺透,进行脱水、透明、浸蜡、切片;
73.(2)将处理后的组织样本石蜡包埋,再进行切片he染色,将he染色片进行扫描;
74.(3)由病理医生结合扫描图在显微镜下诊断,标记有效靶组织,按照设计的组织微阵列及点径大小制作组织芯片受体蜡块,对照he切片标记的有效靶组织区域,在供体蜡块上打孔取样,取出样本柱芯埋放入受体蜡块孔内,全部填埋完毕后,将组织微阵列蜡块放置在57℃恒温箱1.5h固蜡融合,然后室温放置4h,转入4℃下冷藏保存6小时以上,进行切片、烤片和he常规染色,制成的所述的高稳定性骨及骨肿瘤组织微阵列芯片。
75.本实施例所述的高稳定性骨及骨肿瘤组织微阵列芯片包括载玻片片基、专用标签和附着在载玻片上的具有靶信息点样组织;所述的高稳定性骨及骨肿瘤组织微阵列芯片的组合排列方式为多病理类型骨肿瘤匹配和/或不匹配瘤旁、肿瘤边缘及正常骨组织组合矩阵排列;所述的瘤旁、肿瘤边缘及正常骨组织为一例一点或一例多点;含骨量多组织点位于所述的组织微阵列芯片中央或近中央区域,靠边行和列组织点放置骨量少、瘤细胞丰富组织。
76.实施例3
77.本实施例的一种高稳定性骨及骨肿瘤组织微阵列芯片的制备方法,包括如下步骤:
78.(1)收集骨及骨肿瘤组织样本,对所述的组织样本进行处理;
79.所述的组织样本进行处理具体为:将骨及骨肿瘤样本固定于体积分数为10%福尔马林溶液中24小时后再锯取厚度为0.5cm骨片或带骨肿瘤组织,然后在体积分数为10%的福尔马林溶液中固定48小时,将骨或带骨肿瘤组织置于脱钙剂中,浓盐酸15ml、氯化钠7.5ml、蒸馏水加至100ml得到所述的脱钙剂,每日需要更换新的脱钙剂直至骨组织容易被针刺透,进行脱水、透明、浸蜡、切片;
80.(2)将处理后的组织样本石蜡包埋,再进行切片he染色,将he染色片进行扫描;
81.(3)由病理医生结合扫描图在显微镜下诊断,标记有效靶组织,按照设计的组织微阵列及点径大小制作组织芯片受体蜡块,对照he切片标记的有效靶组织区域,在供体蜡块上打孔取样,取出样本柱芯埋放入受体蜡块孔内,全部填埋完毕后,将组织微阵列蜡块放置在57℃恒温箱1.5h固蜡融合,然后室温放置4h,转入6℃下冷藏保存6小时以上,进行切片、烤片和he常规染色,制成的所述的高稳定性骨及骨肿瘤组织微阵列芯片。
82.本实施例所述的高稳定性骨及骨肿瘤组织微阵列芯片包括载玻片片基、专用标签和附着在载玻片上的具有靶信息点样组织;所述的高稳定性骨及骨肿瘤组织微阵列芯片的组合排列方式为单一骨肿瘤矩阵排列;所述的单一骨肿瘤矩阵排列为单一骨肿瘤匹配;含骨量多组织点位于所述的组织微阵列芯片中央或近中央区域,靠边行和列组织点放置骨量少、瘤细胞丰富组织。
83.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。