用于治疗癌症的组合疗法
1.相关申请的交叉引用
2.本技术要求于2020年12月15日提交的印度临时申请号in202011054571的优先权,其全部公开内容通过引用并入本文。
背景技术:
3.免疫检查点抑制剂是一类癌症治疗剂,其作用是逆转t细胞抑制和肿瘤免疫逃避。免疫检查点抑制剂包括特异性结合并抑制免疫检查点蛋白的抗体,例如程序性细胞死亡蛋白1(pd1)或其配体程序性细胞死亡配体1(pdl1)和细胞毒性t淋巴细胞相关抗原4(ctla4)。然而,抗体免疫检查点抑制剂在功效和患者间变异性方面仍然与数个临床问题相关。靶向调节免疫反应的多个非冗余途径的组合疗法可能增强免疫检查点抑制剂功效。然而,并非所有组合都提供相对于单一疗法成分的协同效应。因此,需要与单一疗法和其他免疫疗法组合相比具有可接受的安全特性和增强抗肿瘤免疫反应的高功效的组合疗法。
技术实现要素:
4.本文提供了治疗受试者的癌症的方法,其包括施用与特异性结合egfr和结合tgfβ的融合蛋白(例如,本文所述的融合蛋白)组合的特异性结合pd1的药剂。本文公开的组合治疗可特别用于治疗egfr驱动的癌症。
5.因此,在一个方面,本公开内容提供了一种治疗有需要的人类受试者的癌症的方法,所述方法包括:向所述受试者施用特异性结合程序性细胞死亡蛋白1(pd1)的抗体或其功能片段或功能变体;和向所述受试者施用包含靶向部分和免疫调节部分的融合蛋白,其中:i)所述靶向部分特异性结合表皮生长因子受体(egfr);和(ii)所述免疫调节部分包含转化生长因子-β受体ii(tgfβrii)的胞外结构域的氨基酸序列。
6.在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体是全长抗体、单链可变片段(scfv)、scfv2、scfv-fc、fab、fab'、f(ab')2或f(v)。
7.在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体抑制pd1与pdl1的结合。在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体抑制pd1的信号传导。
8.在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体包含vh,所述vh包含vh cdr1、vh cdr2和vh cdr3,其中vh cdr1包含与seq id no:1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2包含与seq id no:2的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3包含与seq id no:3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
9.在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体包含vl,所述vl包含vl cdr1、vl cdr2和vl cdr3,其中vl cdr1包含与seq id no:4的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2包含与seq id no:5的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3包含与
seq id no:6的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
10.在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体包含vh,该vh包含与seq id no:7的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
11.在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体包含vl,该vl包含与seq id no:8的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
12.在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体包含重链区,所述重链区包含与seq id no:9的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
13.在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体包含重链区,所述重链区包含与seq id no:10的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
14.在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体包含轻链区,所述轻链区包含与seq id no:11的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
15.在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体包括派姆单抗(pembrolizumab)、纳武单抗(nivolumab)、西米普利单抗(cemiplimab)、斯巴达珠单抗(spartalizumab)、卡瑞利珠单抗(camrelizumab)、替雷利珠单抗(tislelizumab)、多塔利单抗(dostarlimab)、西利单抗(cetrelimab)、匹地利珠单抗(pidilizumab)、medi0680、ssi-361、amp-224、pdr001、pf-06801591、bgb-a317、tsr-042、agen-2034、a-0001、bgb-108、bi-754091、cbt-501、enum-003、enum-388d4、ibi-308、jnj-63723283、js-001、jtx-4014、jy-034、cla-134、stia-1110、244c8和388d4,或前述任一种的功能片段或功能变体。
16.在一些实施方案中,特异性结合pd1的所述抗体或其功能片段或功能变体包括派姆单抗或前述任一种的功能片段或功能变体。
17.在一些实施方案中,特异性结合egfr的所述靶向部分包括特异性结合egfr的抗体或其功能片段或功能变体。在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体是全长抗体、单链可变片段(scfv)、scfv2、scfv-fc、fab、fab'、f(ab')2或f(v)。
18.在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体包含vh,所述vh包含vh cdr1、vh cdr2和vh cdr3,其中vh cdr1包含与seq id no:34的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2包含与seq id no:35的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3包含与seq id no:36的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
19.在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体包含vl,所述vl包含vl cdr1、vl cdr2和vl cdr3,其中vl cdr1包含与seq id no:37的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2包含与seq id no:38的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3包含与seq id no:39的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序
列。
20.在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体包含vh,所述vh包含与seq id no:40的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
21.在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体包含vl,所述vl包含与seq id no:41的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
22.在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体包含重链,所述重链包含与seq id no:42的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
23.在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体由重链组成,所述重链包含与seq id no:43的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
24.在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体包含重链,所述重链由与seq id no:42的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列组成。
25.在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体由重链组成,所述重链由与seq id no:43的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列组成。
26.在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体包含轻链,所述轻链包含与seq id no:44的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
27.在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体由轻链组成,所述轻链由与seq id no:44的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列组成。
28.在一些实施方案中,特异性结合egfr的所述抗体或其功能片段或功能变体包括西妥昔单抗或帕尼单抗,或前述任一种的功能片段或功能变体。
29.在一些实施方案中,所述免疫调节部分包含与seq id no:56至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,所述免疫调节部分由与seq id no:56的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列组成。
30.在一些实施方案中,所述免疫调节部分间接融合至所述靶向部分。在一些实施方案中,所述免疫调节部分经由肽接头间接融合至所述靶向部分。在一些实施方案中,所述免疫调节部分经由足够长度的肽接头间接融合至所述靶向部分,使得所述免疫调节部分和所述靶向部分可以同时结合各自的靶标。
31.在一些实施方案中,所述接头包含seq id no:57、58、59、60或61的氨基酸序列。在一些实施方案中,所述接头包含seq id no:57的氨基酸序列。在一些实施方案中,所述接头由seq id no:57的氨基酸序列组成。
32.在一些实施方案中,所述免疫调节部分融合至所述靶向部分的c末端。在一些实施
方案中,所述免疫调节部分融合至所述靶向部分的n末端。
33.在一些实施方案中,所述靶向部分是包含轻链和重链的抗体,并且其中所述免疫调节部分融合至所述靶向部分的所述重链的c末端。在一些实施方案中,所述靶向部分是包含轻链和重链的抗体,并且其中所述免疫调节部分融合至所述靶向部分的所述轻链的c末端。
34.在一些实施方案中,所述靶向部分是特异性结合表皮生长因子受体(egfr)的抗体,其包含重链和轻链,所述重链包含与seq id no:43的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,所述轻链包含与seq id no:44的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,并且其中所述免疫调节部分包含与seq id no:56的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,并且其中所述免疫调节部分的n末端通过接头间接融合至所述重链或所述轻链的c末端,并且其中所述接头包含与seq id no:57的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
35.在一些实施方案中,所述靶向部分是特异性结合表皮生长因子受体(egfr)的抗体,其包含重链和轻链,所述重链包含与seq id no:43的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,所述轻链包含与seq id no:44的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,并且其中所述免疫调节部分包含与seq id no:56的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,并且其中所述免疫调节部分的n末端通过接头间接融合至所述轻链的c末端,并且其中所述接头包含与seq id no:57的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
36.在一些实施方案中,所述靶向部分包含抗体,所述抗体包含重链和轻链,所述重链包含与seq id no:43的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;所述轻链包含与seq id no:62的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
37.在一些实施方案中,所述癌症是实体瘤。在一些实施方案中,所述癌症选自乳腺癌、肛门癌、胰腺癌、甲状腺癌、肝癌、卵巢癌、肺癌、皮肤癌、脑癌、脊髓癌、头癌、颈癌和头颈癌。
38.在一些实施方案中,所述癌症是头颈癌。在一些实施方案中,所述癌症是头颈鳞状细胞癌(hnscc)。在一些实施方案中,所述癌症是复发性hnscc。在一些实施方案中,所述癌症是转移性hnscc。在一些实施方案中,所述癌症是复发性和转移性hnscc。
39.在一些实施方案中,所述癌症是肛管鳞状细胞癌(sccac)。在一些实施方案中,所述癌症是复发性sccac。在一些实施方案中,所述癌症是转移性sccac。在一些实施方案中,所述癌症是复发性和转移性sccac。
40.在一些实施方案中,以约100mg至500mg、100mg至400mg、100mg至300mg或100mg至200mg的剂量向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。
41.在一些实施方案中,以约100mg、200mg、300mg、400mg或500mg的剂量向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。在一些实施方案中,以约200mg的剂量向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。
在一些实施方案中,以约300mg的剂量向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。
42.在一些实施方案中,每1、2、3或4周向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。在一些实施方案中,每3周向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。
43.在一些实施方案中,以约50mg至2000mg、100mg至2000mg、150mg至2000mg、200mg至2000mg、300mg至2000mg、400mg至2000mg、500mg至2000mg、600mg至2000mg、700mg至2000mg、800mg至2000mg、9000mg至2000mg、1000mg至2000mg、1500mg至2000mg、50mg至100mg、50mg至500mg、50mg至400mg、50mg至300mg、50mg至200mg、50mg至100mg、100mg至500mg、100mg至400mg、100mg至300mg或100mg至200mg的剂量向所述人类受试者施用所述融合蛋白。在一些实施方案中,以约200mg至2000mg的剂量向所述人类受试者施用所述融合蛋白。在一些实施方案中,以约50mg、60mg、64mg、100mg、150mg、200mg、240mg、250mg、300mg、400mg、500mg、600mg、700mg、800mg、900mg、1000mg、1100mg、1200mg、1300mg、1400mg、1500mg、1600mg、1700mg、1800mg、1900或2000mg的剂量向所述人类受试者施用所述融合蛋白。在一些实施方案中,以约64mg、240mg、800mg或1600mg的剂量向所述人类受试者施用所述融合蛋白。
44.在一些实施方案中,每1、2、3或4周向所述人类受试者施用所述融合蛋白。在一些实施方案中,每周向所述人类受试者施用所述融合蛋白。在一些实施方案中,每3周向所述人类受试者施用所述融合蛋白。
45.在一些实施方案中,所述融合蛋白与特异性结合pd1的所述抗体或其功能片段或功能变体共同施用、在特异性结合pd1的所述抗体或其功能片段或功能变体之前施用或在特异性结合pd1的所述抗体或其功能片段或功能变体之后施用。
附图说明
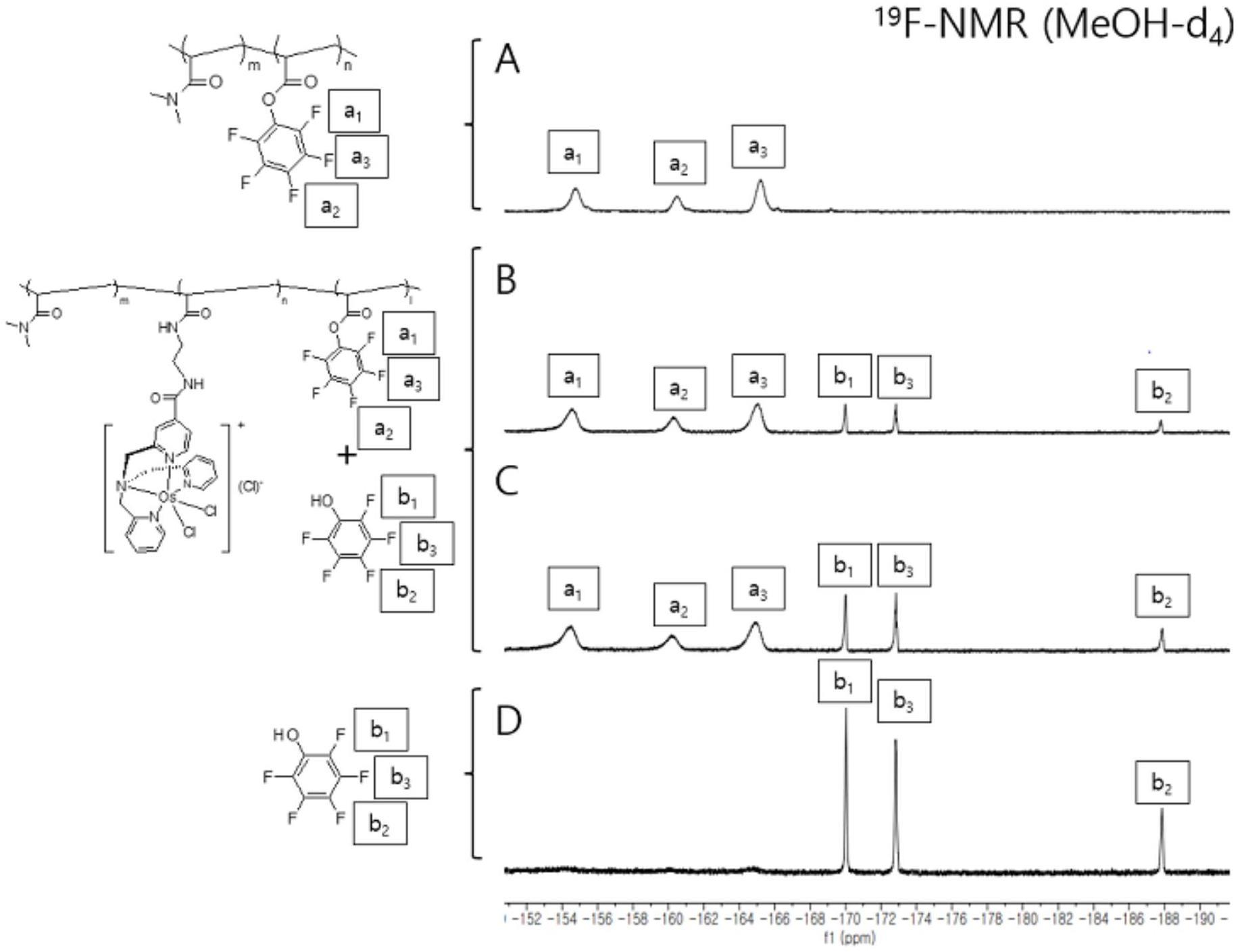
46.图1是显示西妥昔单抗、bca101(融合体mab抗egfr tgfβrii ecd)、抗pd1(派姆单抗)和bca101 抗pd1(派姆单抗)在携带pc-3异种移植肿瘤的hunog-exl小鼠中在21天的过程中对肿瘤体积的作用的线图。值表示为每组中8-10只动物的平均值
±
sem。通过双向anova,然后使用graph pad prism(版本8.3.0)的bonferroni后检验来进行统计分析。当在第18天将各治疗组与同种型对照组比较时存在***显著性(p《0.001)差异。当在第18天将组合治疗组分别与bca101和派姆单抗进行比较时,存在
$$$
显著性(p《0.001)和
#
显著性(p《0.05)差异。
47.图2a-2e是显示在21天的过程中hunog-exl小鼠pc-3肿瘤异种移植物的个体肿瘤生长曲线的线图。图2a是显示21天内同种型对照组中个体肿瘤生长的线图。图2b是显示21天内西妥昔单抗治疗组中个体肿瘤生长的线图。图2c是显示21天内bca101治疗组中个体肿瘤生长的线图。图2d是显示21天内抗pd1(派姆单抗)治疗组中个体肿瘤生长的线图。图2e是显示21天内bca101 抗pd1(派姆单抗)治疗组中个体肿瘤生长的线图。
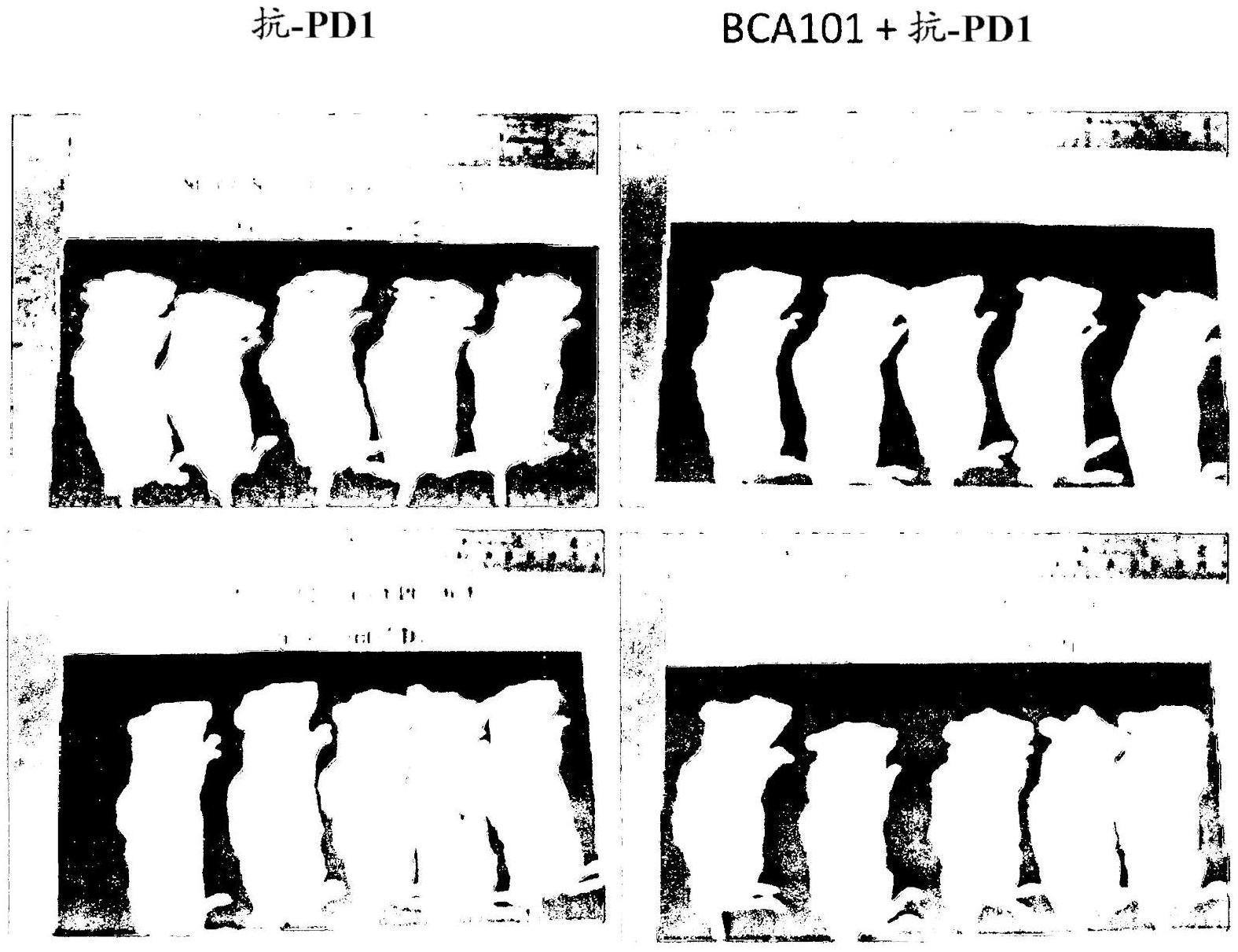
48.图3a显示来自对照组(同种型对照)、西妥昔单抗治疗组和bca101治疗组的携带pc-3肿瘤的hunog-exl小鼠的照片。照片拍摄于研究的第19天。图3b显示来自抗pd1(派姆单抗)治疗组和bca101 抗pd1(派姆单抗)治疗组的携带pc-3肿瘤的hunog-exl小鼠的照片。照片拍摄于研究的第19天。
49.图4是显示西妥昔单抗、bca101、抗pd1(派姆单抗)和bca101 抗pd1(派姆单抗)对携带pc-3肿瘤异种移植物的hunog-exl小鼠的体重的百分比变化的效果的线图。值表示为每组中8-10只动物的平均值
±
sem。在所有组中存在逐渐的体重下降。在任何治疗组中均没有可见的临床症状或异常行为。
50.通过引用并入
51.本说明书中提及的所有出版物、专利和专利申请均通过引用并入本文,其程度如同每个单独的出版物、专利或专利申请被具体且单独地指示通过引用并入一样。
52.发明详述
53.概览
54.本公开内容尤其提供了新的组合疗法,其包含特异性结合并抑制pd1的功能的药剂和结合tgfβ的egfr靶向免疫调节融合蛋白。本文描述的组合疗法提供了相对于每种单一疗法的协同效应和改善的功效。在一些实施方案中,egfr融合蛋白包含特异性结合egfr的靶向部分和包含转化生长因子-β受体ii(tgfβrii)的胞外结构域的氨基酸序列的免疫调节部分。本文公开的组合治疗可特别用于治疗egfr驱动的癌症,例如头颈癌和肛门癌。
55.定义
56.除非另有定义,本文使用的所有技术和科学术语具有与所要求保护的主题所属领域的技术人员通常理解的相同含义。应当理解,前面的一般描述和下面的详细描述仅是示例性和解释性的,并且不限制所要求保护的任何主题。在本技术中,除非另外具体说明,否则单数的使用包括复数。
57.必须指出的是,如说明书和所附权利要求中所使用的,单数形式“一个”、“一种”和“该”包括复数指示物,除非上下文另有明确说明。此外,术语“包括”以及其他形式(例如“包含”、“含有”和“具有”)的使用不是限制性的。
58.应当理解,本文中无论在何处用语言“包括”描述各方面,均还提供了用“由...组成”和/或“基本上由...组成”来描述的其他类似方面。
59.本文使用的章节标题仅用于组织目的,不应被解释为限制所描述的主题。
60.本文使用的术语“和/或”应被视为两个指定特征或组件中的每一个(与或不与另一个一起)的具体公开。因此,本文中诸如“a和/或b”的短语中使用的术语“和/或”旨在包括“a和b”、“a或b”、“a”(单独)和“b”(单独)。类似地,如在诸如“a、b和/或c”的短语中使用的术语“和/或”旨在涵盖以下方面中的每一个:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);和c(单独)。
61.除非另有定义,本文中使用的所有技术和科学术语具有与本公开内容相关领域的普通技术人员通常理解的相同含义。例如,concise dictionary of biomedicine and molecular biology,juo,pei-show,2nded.,2002,crc press;the dictionary of cell and molecular biology,3rd ed.,1999,academic press;和the oxford dictionary of biochemistry and molecular biology,revised,2000,oxford university press为技术人员提供了本公开内容中使用的许多术语的通用词典。
62.单位、前缀和符号以其国际单位制(si)接受的形式表示。数字范围包括定义该范围的数字。本文提供的标题不是对本公开内容的各个方面的限制,其可以通过参考整个说明书而获得。因此,下面紧接着定义的术语通过参考整个说明书来更全面地定义。
63.如本文所述,任何浓度范围、百分比范围、比率范围或整数范围应理解为包括所述范围内的任何整数的值,并且在适当时,包括其分数(例如整数的十分之一和百分之一),除非另有说明。
64.术语“约”或“基本上包含”是指在由本领域普通技术人员确定的特定值或组合物的可接受的误差范围内的值或组合物,这将部分取决于如何测量或确定该值或组合物,即测量系统的限制。例如,“约”或“基本上包含”可以意指按照本领域的实践在1个或多于1个标准偏差内。或者,“约”或“基本上包含”可以意指高达20%的范围。此外,特别是对于生物系统或过程,这些术语可以意指高达一个数量级或值的高达5倍。当在申请和权利要求中提供特定值或组合物时,除非另有说明,否则“约”或“基本上包含”的含义应当被假定在该特定值或组合物的可接受的误差范围内。
65.术语“程序性细胞死亡蛋白1”和“pd1”在本文中可互换使用并且是指属于cd28家族的免疫抑制性受体。pd1在体内主要在先前激活的t细胞上表达,并与两个配体pdl1和pdl2结合。本文使用的术语pd1包括人pd1(hpd1)、hpd1的变体、同种型和物种同源物,以及与hpd1具有至少一个共同表位的类似物。完整的hpd-1序列可在genbank登录号u64863中找到。
66.术语“表皮生长因子受体”和“egfr”在本文中可互换使用,并且是指作为细胞外蛋白配体的表皮生长因子家族(egf家族)成员的受体的跨膜蛋白。本文使用的术语egfr包括人egfr(hegfr)、hegfr的变体、同种型和物种同源物,以及与egfr具有至少一个共同表位的类似物。完整的hegfr序列可在genbank基因id:1956中找到。
67.术语“受试者”和“患者”在本文中可互换使用并且包括任何人类或非人类动物。术语“非人类动物”包括但不限于脊椎动物例如非人类灵长类动物、绵羊、狗和啮齿动物例如小鼠、大鼠和豚鼠。在一些实施方案中,受试者是人类。
68.如本文所用,术语“施用”是指使用本领域技术人员已知的各种方法和递送系统中的任何一种将治疗剂(或在受试者体内代谢或改变以在体内产生治疗剂的治疗剂前体)物理引入受试者。示例性途径包括静脉内、肌内、皮下、腹膜内、脊髓或其他肠胃外施用途径,例如通过注射或输注。本文所用的术语“肠胃外施用”是指除肠内和局部施用之外的施用方式,通常通过注射,并且包括但不限于静脉内、肌内、动脉内、鞘内、淋巴内、病灶内、囊内、眼眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注,以及体内电穿孔。治疗剂可以通过非肠胃外途径或口服施用。其他非肠胃外途径包括局部、表皮或粘膜施用途径,例如鼻内、阴道、直肠、舌下或局部。施用还可以进行例如一次、多次和/或在一个或多个延长的时期内进行。
69.术语“癌症”和“肿瘤”在本文中可互换使用,是指以体内异常细胞不受控制的生长为特征的一大类各种疾病。不受调节的细胞分裂和生长分裂和生长导致恶性肿瘤的形成,所述恶性肿瘤侵入邻近组织,并且还可能通过淋巴系统或血流转移到身体的远处部位。
70.药物或治疗剂的“治疗有效量”或“治疗有效剂量”是当单独或与另一种治疗剂组合使用时,保护受试者免于疾病发作或促进疾病消退的药物或治疗剂的任何量,所述疾病消退通过疾病症状严重程度的降低、无疾病症状期的频率和持续时间的增加或防止由于疾病折磨而导致的损伤或残疾来证明。治疗剂促进疾病消退的能力可以使用技术人员已知的多种方法进行评估,例如在临床试验期间在人类受试者中、在预测在人类中的功效的动物
模型系统中或通过在体外测定中测定药剂的活性。
71.如本文所用的术语“基于体重的剂量”是指基于患者的体重计算施用至患者的剂量。例如,当体重60kg的患者需要3mg/kg的抗pd-1抗体时,可以计算并使用合适量的抗pd-1抗体(即180mg)用于施用。
72.如本文所用的术语“固定剂量”是指单一组合物中的两种或更多种不同蛋白质(例如,抗pd-1抗体和融合蛋白)以彼此特定(固定)的比例存在于组合物中。在一些实施方案中,固定剂量基于蛋白质的重量(例如,mg)。在某些实施方案中,固定剂量基于蛋白质的浓度(例如,mg/ml)。
73.如本文所用的术语“平剂量(flat dose)”是指不考虑患者的体重或体表面积(bsa)而施用至患者的剂量。因此,平剂量不以mg/kg剂量提供,而是以药剂(例如,融合蛋白和/或抗pd-1抗体)的绝对量提供。例如,60kg的人和100kg的人会接受相同剂量的抗体。
74.术语“抗体”在本文中以最广泛的含义使用并且涵盖完全组装的抗体;其可以结合抗原的功能性抗体片段及功能性变体(例如,fab、f(ab’)2、fv、单链可变片段(scfv)、单结构域抗体(例如,vhh)、双抗体、抗体嵌合体、杂合抗体、双特异性抗体等);和结合抗原的非抗体片段(例如重组纤连蛋白结构域)和包含前述的重组多肽。除非另有说明,提及抗体中特定氨基酸残基位置的编号是根据eu编号系统,如kabat等人,u.s.dept.of health and human services,sequences of proteins of immunological interest(1983)(“kabat”)中所述。
75.如本文所用,“可变区”是指参与抗体与抗原结合的抗体重链或轻链的结构域。天然抗体的重链和轻链(分别为vh和vl)的可变结构域通常具有相似的结构,每个结构域包含四个保守框架区和三个互补决定区。
76.如本文所用,术语“互补决定区”指抗体可变结构域的每个区域,其在序列上高度可变并形成结构上限定的环(“高变环”)。一般来说,天然四链抗体包含六个cdr;vh中的3个(h1、h2、h3),和vl中的3个(l1、l2、l3)。kabat等人,u.s.dept.of health and human services,sequences of proteins of immunological interest(1983)(“kabat”)和chothia等人,j mol biol 196:901-917(1987)描述了cdr,其中定义包括彼此比较时氨基酸残基的重叠或子集。然而,应用任一定义来指代抗体的cdr旨在落入本文所定义和使用的术语的范围内。给定抗体的可变区氨基酸序列,本领域技术人员可以常规地确定哪些残基包含特定cdr。除非另有说明,cdr是根据kabat系统定义的。
77.本文所用的术语“融合蛋白”和语法等同物是指包含源自至少两种单独蛋白质的氨基酸序列的蛋白质。所述至少两种单独的蛋白质的氨基酸序列可以通过肽键直接连接;或者可以通过氨基酸接头可操作地连接。因此,术语融合蛋白涵盖其中例如蛋白a的氨基酸序列通过肽键直接连接至蛋白b的氨基酸序列的实施方案(蛋白a-蛋白b),以及其中例如蛋白a的氨基酸序列通过氨基酸接头可操作地连接至蛋白b的氨基酸序列的实施方案(蛋白a-接头-蛋白b)。
78.本文使用的术语“融合”及其语法等同物是指衍生自一种蛋白质的氨基酸序列与衍生自不同蛋白质的氨基酸序列的可操作连接。术语融合涵盖两个氨基酸序列通过肽键的直接连接和通过氨基酸接头的间接连接。
79.如本文所用,关于核酸序列的术语“修饰”是指与参考核酸序列相比包含至少一个
核苷酸取代、添加或缺失的核酸序列。如本文所用,关于氨基酸序列的术语“修饰”是指与参考核酸序列相比包含至少一个氨基酸残基的取代、添加或缺失的氨基酸序列。出于确定两个氨基酸序列的百分比同一性的目的,天然存在的氨基酸衍生物不被认为是修饰的氨基酸。例如,出于确定两个氨基酸序列的同一性百分比的目的,谷氨酸氨基酸残基至焦谷氨酸氨基酸残基的天然存在的修饰不被认为是氨基酸修饰。此外,例如,谷氨酸氨基酸残基至焦谷氨酸氨基酸残基的天然存在的修饰将不被认为是本文定义的氨基酸“修饰”。修饰可包括包含非天然存在的氨基酸残基。
80.关于核酸序列或氨基酸序列的术语“相同”或“百分比同一性”是指分别具有特定百分比的当比较和比对以获得最大对应性时相同的核苷酸或氨基酸的至少两个核酸或至少两个氨基酸序列或子序列,如使用序列比较算法或通过目视检查所测量的。对于序列比较,通常将一个序列充当与测试序列进行比较的参考序列。当使用序列比较算法时,将测试序列和参考序列输入计算机,如果需要,指定子序列坐标,并指定序列算法程序参数。然后,序列比较算法基于指定的程序参数计算测试序列相对于参考序列的序列同一性百分比。适合于确定百分比序列同一性和序列相似性的算法的例子是blast和blast2.0算法,其分别在altschul等人(1990)j.mol.biol.215:403-410和altschul等人(1977)nucleic acids res.25:3389-3402中描述。用于执行blast分析的软件可通过国家生物技术信息中心公开获得。两个序列之间的同一性百分比可以使用类似于上文描述的那些的技术来确定,无论是否允许存在间隙。在计算同一性百分比时,通常只计算精确匹配。如上所述,百分比同一性基于两种蛋白质中较小的蛋白质之间的氨基酸匹配。
81.抗pd1抗体
82.在某些方面,本文提供了治疗癌症的方法,其包括向患有癌症的受试者施用与本文所述的融合蛋白组合的特异性结合程序性死亡蛋白1(pd1)的抗体或其功能片段或功能变体。pd-1是受体的cd28家族的成员,该家族包括cd28、ctla-4、icos、pd-1和btla。已鉴定出pd1的两种细胞表面糖蛋白配体,即程序性死亡配体1(pdl1)和程序性死亡配体2(pdl2),它们在抗原呈递细胞以及许多人类癌症上表达,并已被证明在与pd1结合后下调t细胞激活和细胞因子分泌。
83.在一些实施方案中,抗体是全长抗体、单链可变片段(scfv)、scfv2、scfv-fc、fab、fab’、f(ab’)2、f(v)、单结构域抗体、单链抗体或vhh。
84.以高亲和力与pd1特异性结合的示例性人单克隆抗体已公开于美国专利号8,008,449中。公开于美国专利号8,008,449中的每种抗pd-1人单克隆抗体已被证明表现出以下一种或多种特性:(a)与人pd1结合,其kd为1
×
10-7
m或更小,如使用biacore生物传感器系统通过表面等离振子共振测定的;(b)基本上不与人cd28、ctla-4或icos结合;(c)在混合淋巴细胞反应(mlr)测定中增加t细胞增殖;(d)在mlr测定中增加干扰素-γ的产生;(e)在mlr测定中增加il-2分泌;(f)与人pd-1和食蟹猴pd-1结合;(g)抑制pdl1和/或pdl2与pd1的结合;(h)刺激抗原特异性记忆反应;(i)刺激抗体反应;和/或(j)抑制体内肿瘤细胞生长。可用于本公开内容的抗pd1抗体包括特异性结合人pd1并表现出至少一种、至少两种、至少三种、至少四种或至少五种前述特征的单克隆抗体。在其他实施方案中,抗pd-1抗体选自美国专利号8,008,449中描述的人类抗体17d8、2d3、4h1、4a11、7d3或5f4。其它抗pd1单克隆抗体已描述于例如美国专利号6,808,710、7,488,802、8,168,757和8,354,509,以及pct公开号
wo2012/145493。
85.在一些实施方案中,抗pd-1抗体选自纳武单抗(也称为5c4、bms-936558、mdx-1106和ono-4538)、派姆单抗(merck;也称为lambrolizumab和mk-3475;参见例如wo2008/156712)、pdr001(novartis;也称为斯巴达珠单抗;参见例如wo2015/112900)、medi0680(astrazeneca;也称为amp-514;参见例如wo2012145493)、西米普利单抗(regeneron;也称为regn-2810;参见例如wo2015112800)、js001(taizhou junshi pharma;参见例如si-yang liu等人,j.hematol.oncol.70:136(2017)),bgb-a317(tislelizumab beigene;参见例如wo201535606和us20150079109)、incshr1210(jiangsu hengrui medicine;也称为shr-1210;参见例如wo2015085847;si-yang liu等人,j.hematol.oncol.70:136(2017))、tsr-042(tesaro biopharmaceutical;也称为ab011;参见例如wo2014179664)、gls-010(wuxi/harbin gloria pharmaceuticals;也称为wbp3055;参见例如si-yang liu等人,j.hematol.oncol.70:136(2017))、am-0001(armo)、sti-1110(sorrento therapeutics;参见例如wo2014194302)、agen2034(agenus;参见例如wo2017/040790)、mga012(macrogenics,参见例如wo201719846)、ibi308(innovent;参见例如wo2017024465、wo2017025016、wo2017132825和wo2017133540)和bcd-100(biocad)。
86.在一些实施方案中,抗pd1抗体选自派姆单抗、纳武单抗、西米普利单抗、斯巴达珠单抗、卡瑞利珠单抗、替雷利珠单抗、多塔利单抗、西利单抗、匹地利珠单抗、medi0680、ssi-361、amp-224、pdr001、pf-06801591、bgb-a317、tsr-042、agen-2034、a-0001、bgb-108、bi-754091、cbt-501、enum-003、enum-388d4、ibi-308、jnj-63723283、js-001、jtx-4014、jy-034、cla-134、stia-1110、244c8和388d4。
87.在一些实施方案中,抗pd1抗体是派姆单抗、纳武单抗、斯巴达珠单抗、西米普利单抗、卡瑞利珠单抗、替雷利珠单抗、多塔利单抗、西利单抗、匹地利珠单抗、medi0680、ssi-361、amp-224、pdr001、pf-06801591、bgb-a317、tsr-042、agen-2034、a-0001、bgb-108、bi-754091、cbt-501、enum-003、enum-388d4、ibi-308、jnj-63723283、js-001、jtx-4014、jy-034、cla-134、stia-1110、244c8或388d4的功能片段。
88.在一些实施方案中,抗pd1抗体是派姆单抗、纳武单抗、斯巴达珠单抗、西米普利单抗、卡瑞利珠单抗、替雷利珠单抗、多塔利单抗、西利单抗、匹地利珠单抗、medi0680、ssi-361、amp-224、pdr001、pf-06801591、bgb-a317、tsr-042、agen-2034、a-0001、bgb-108、bi-754091、cbt-501、enum-003、enum-388d4、ibi-308、jnj-63723283、js-001、jtx-4014、jy-034、cla-134、stia-1110、244c8或388d4的功能变体。
89.派姆单抗
90.在一些实施方案中,抗pd-1抗体是派姆单抗。派姆单抗(也称为lambrolizumab和mk-3475)是一种针对人细胞表面受体pd1的人源化单克隆igg4抗体。派姆单抗描述于例如美国专利号8,900,587中。在一些实施方案中,抗pd1抗体与派姆单抗交叉竞争。在一些实施方案中,抗pd1抗体与派姆单抗结合相同的表位。在一些实施方案中,抗pd1抗体具有与派姆单抗相同的cdr。
91.在一些实施方案中,抗pd1抗体包含可变重链(vh),其包含三个互补决定区:vh cdr1、vh cdr2和vh cdr3。在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:1的氨基酸序列;vh cdr2,其包含具有0、1、2
或3个氨基酸修饰的seq id no:2的氨基酸序列;和vh cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:3的氨基酸序列。
92.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含seq id no:1的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:1的氨基酸序列;vh cdr2,其包含seq id no:2的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:2的氨基酸序列;和vh cdr3,其包含seq id no:3的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:3的氨基酸序列。
93.在一些实施方案中,抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:4的氨基酸序列;vl cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:5的氨基酸序列;和vl cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:6的氨基酸序列。
94.在一些实施方案中,抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含seq id no:4的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:4的氨基酸序列;vl cdr2,其包含seq id no:5的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:5的氨基酸序列;和vl cdr3,其包含seq id no:6的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:6的氨基酸序列。
95.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:1的氨基酸序列;vh cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:2的氨基酸序列;和vh cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:3的氨基酸序列;并且抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:4的氨基酸序列;vl cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:5的氨基酸序列;和vl cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:6的氨基酸序列。
96.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含seq id no:1的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:1的氨基酸序列;vh cdr2,其包含seq id no:2的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:2的氨基酸序列;和vh cdr3,其包含seq id no:3的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:3的氨基酸序列;并且抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含seq id no:4的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:4的氨基酸序列;vl cdr2,其包含seq id no:5的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:5的氨基酸序列;和vl cdr3,其包含seq id no:6的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:6的氨基酸序列。
97.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含与seq id no:1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与seq id no:2的氨基酸序列的至少95%、96%、97%、98%、99%或100%的氨基酸序列;和vh cdr3,其包含与seq id no:3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
98.在一些实施方案中,抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含与seq id no:4的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,
其包含seq id no:5的氨基酸序列的至少95%、96%、97%、98%、99%或100%的氨基酸序列;和vl cdr3,其包含与seq id no:6的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
99.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含与seq id no:1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与seq id no:2的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与seq id no:3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;并且抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含与seq id no:4的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与seq id no:5的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与seq id no:6的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
100.在一些实施方案中,抗pd1抗体包含与seq id no:7的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vh。在一些实施方案中,抗pd1抗体包含与seq id no:8的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vl。在一些实施方案中,抗pd1抗体包含与seq id no:7的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vh;和与seq id no:8的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vl。
101.在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:10的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含轻链,所述轻链包含与seq id no:11的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:10的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:11的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
102.在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:9的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:9的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:11的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
103.纳武单抗
104.在一些实施方案中,抗pd1抗体是纳武单抗。纳武单抗(也称为以前命名为5c4、bms-936558、mdx-1106或ono-4538)是一种全人igg4(s228p)pd-1免疫检查点抑制剂抗体,其选择性阻止与pd1配体(pdl1和pdl2)的相互作用,从而阻断抗肿瘤t细胞功能的下调(美国专利号8,008,449;wang等人,2014cancer immunol res.2(9):846-56;在wo2006/121168中称为5c4)。在一些实施方案中,抗pd1抗体与纳武单抗交叉竞争。在一些实
施方案中,抗pd-1抗体与纳武单抗结合相同的表位。在一些实施方案中,抗pd-1抗体具有与纳武单抗相同的cdr。
105.在一些实施方案中,抗pd1抗体包含可变重链(vh),其包含三个互补决定区:vh cdr1、vh cdr2和vh cdr3。在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:12的氨基酸序列;vh cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:13的氨基酸序列;和vh cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:14的氨基酸序列。
106.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含seq id no:12的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:12的氨基酸序列;vh cdr2,其包含seq id no:13的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:13的氨基酸序列;和vh cdr3,其包含seq id no:14的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:14的氨基酸序列。
107.在一些实施方案中,抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:15的氨基酸序列;vl cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:16的氨基酸序列;和vl cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:17的氨基酸序列。在一些实施方案中,抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含seq id no:15的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:15的氨基酸序列;vl cdr2,其包含seq id no:16的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:16的氨基酸序列;和vl cdr3,其包含seq id no:17的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:17的氨基酸序列。
108.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:12的氨基酸序列;vh cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:13的氨基酸序列;和vh cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:14的氨基酸序列;并且抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:15的氨基酸序列;vl cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:16的氨基酸序列;和vl cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:17的氨基酸序列。
109.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含seq id no:12的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:12的氨基酸序列;vh cdr2,其包含seq id no:13的氨基酸序列,或具有1、2或3个氨基酸修饰的seq idno:13的氨基酸序列;和vh cdr3,其包含seq id no:14的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:14的氨基酸序列;和vl,所述vl包含:vl cdr1,其包含seq id no:15的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:15的氨基酸序列;vl cdr2,其包含seq id no:16的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:16的氨基酸序列;和vl cdr3,其包含seq id no:17的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:17的氨基酸序列。
110.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含与seq id no:12的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与seq id no:13的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与seq id no:14的氨基酸序列至少95%、96%、97%、98%、99%
或100%相同的氨基酸序列。
111.在一些实施方案中,抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含与seq id no:15的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与seq id no:16的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与seq id no:17的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
112.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含与seq id no:12的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与seq id no:13的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与seq id no:14的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;并且抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含与seq id no:15的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与seq id no:16的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与seq id no:17的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
113.在一些实施方案中,抗pd1抗体包含与seq id no:18的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vh。在一些实施方案中,抗pd1抗体包含与seq id no:19的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vl。在一些实施方案中,抗pd1抗体包含与seq id no:18的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vh;和与seq id no:19的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vl。
114.在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:21的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含轻链,所述轻链包含与seq id no:22的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:21的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:22的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
115.在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:20的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:20的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:22的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
116.西米普利单抗
117.在一些实施方案中,抗pd1抗体是西米普利单抗,其是针对pd1受体的单克隆抗体。在一些实施方案中,抗pd1抗体与西米普利单抗交叉竞争。在一些实施方案中,抗pd-1抗体
与西米普利单抗结合相同的表位。在一些实施方案中,抗pd-1抗体具有与西米普利单抗相同的cdr区。
118.在一些实施方案中,抗pd1抗体包含可变重链(vh),其包含三个互补决定区:vh cdr1、vh cdr2和vh cdr3。在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:23的氨基酸序列;vh cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:24的氨基酸序列;和vh cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:25的氨基酸序列。在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含seq id no:23的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:23的氨基酸序列;vh cdr2,其包含seq id no:24的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:24的氨基酸序列;和vh cdr3,其包含seq id no:25的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:25的氨基酸序列。
119.在一些实施方案中,抗pd1抗体包含可变轻链(vl),其包含三个互补决定区:vl cdr1、vl cdr2和vl cdr3。在一些实施方案中,所述抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:26的氨基酸序列;vl cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:27的氨基酸序列;和vl cdr3,其包含具有0、1、2或3个氨基酸修饰的seq idno:28的氨基酸序列。在一些实施方案中,抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含seq id no:26的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:26的氨基酸序列;vl cdr2,其包含seq id no:27的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:27的氨基酸序列;和vl cdr3,其包含seq id no:28的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:28的氨基酸序列。
120.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:23的氨基酸序列;vh cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:24的氨基酸序列;和vh cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:25的氨基酸序列;和vl,所述vl包含:vl cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:26的氨基酸序列;vl cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:27的氨基酸序列;和vl cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:28的氨基酸序列。
121.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含seq id no:23的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:26的氨基酸序列;vh cdr2,其包含seq id no:24的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:24的氨基酸序列;和vh cdr3,其包含seq id no:25的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:25的氨基酸序列;和vl,所述vl包含:vl cdr1,其包含seq id no:26的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:26的氨基酸序列;vl cdr2,其包含seq id no:27的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:27的氨基酸序列;和vl cdr3,其包含seq id no:28的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:28的氨基酸序列。
122.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含与seq id no:23的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与seq id no:24的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与seq id no:25的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
123.在一些实施方案中,抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含与seq id no:26的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与seq id no:27的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与seq id no:28的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
124.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含与seq id no:23的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与seq id no:24的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与seq id no:25的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;并且抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含与seq id no:26的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与seq id no:27的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与seq id no:28的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
125.在一些实施方案中,抗pd1抗体包含与seq id no:29的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vh。在一些实施方案中,抗pd1抗体包含与seq id no:30的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vl。在一些实施方案中,抗pd1抗体包含与seq id no:29的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vh;和与seq id no:30的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vl。
126.在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:32的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含轻链,所述轻链包含与seq id no:33的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:32的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:33的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
127.在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:31的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含重链,所述重链包含与seq id no:31的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:33的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
128.在一些实施方案中,抗pd1抗体包含表1中的抗体。在一些实施方案中,抗pd1抗体是表1中的抗体。
129.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含与表1中的vh cdr1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,
其包含与表1中的vh cdr2的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与表1中的vh cdr3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
130.在一些实施方案中,抗pd1抗体包含vl,所述vl包含:vl cdr1,其包含与表1中的vl cdr1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与表1中的vl cdr2的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与表1中vl cdr3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
131.在一些实施方案中,抗pd1抗体包含vh,所述vh包含:vh cdr1,其包含与表1中的vh cdr1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与表1中的vh cdr2的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与表1中的vh cdr3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl,所述vl包含:vl cdr1,其包含与表1中的vl cdr1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与表1中的vl cdr2的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与表1中vl cdr3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
132.在一些实施方案中,抗pd1抗体包含重链,所述重链包含与表1中的重链的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含轻链,所述轻链包含与表1中的轻链的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含重链,所述重链包含与表1中的重链的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与表1中的轻链的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
133.在一些实施方案中,抗pd1抗体包含vh,所述vh包含与表1中的抗体的vh的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含vl,所述vl包含与表1中的抗体的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗pd1抗体包含vh,所述vh包含与表1中的抗体的vh的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl,所述vl包含与表1中的抗体的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
134.表1.示例性抗pd1抗体
135.136.137.138.139.140.[0141][0142]
制备抗pd1抗体的方法
[0143]
本文所述的抗-pd1抗体可以通过本领域已知的任何常规技术来制备,例如重组技术或化学合成(例如,固相肽合成)。在一个实施方案中,抗pd1抗体是通过在细胞中重组表达来制备的。简而言之,可以通过合成编码抗pd1抗体的dna并将该dna克隆到任何合适的表达载体中来制备抗pd1抗体。许多克隆载体是本领域技术人员已知的,并且合适的克隆载体的选择是选择的问题。该基因可以置于启动子、核糖体结合位点(用于细菌表达)和任选地操纵子的控制下,以便编码融合蛋白的dna序列在由含有该表达构建体的载体转化的宿主细胞中转录成rna。编码序列可以含有或可以不含有信号肽或前导序列。可以将异源前导序列添加到导致表达的多肽从宿主生物体分泌的编码序列中。也可能需要其他调节序列,其允许相对于宿主细胞的生长调节蛋白质序列的表达。此类调节序列是本领域技术人员已知的,并且实例包括响应于化学或物理刺激(包括调节化合物的存在)而引起基因表达开启或关闭的那些。其他类型的调节元件也可以存在于载体中,例如增强子序列。在插入载体例如上述克隆载体之前,可以将控制序列和其他调节序列连接至编码序列。或者,可以将编码序列直接克隆到已经含有控制序列和适当的限制性位点的表达载体中。
[0144]
然后可以使用表达载体转化合适的宿主细胞。许多哺乳动物细胞系是本领域已知的并且包括可从美国典型培养物保藏中心(atcc)获得的永生化细胞系,例如但不限于中国仓鼠卵巢(cho)细胞、cho悬浮细胞(cho-s)、hela细胞、hek293、幼仓鼠肾(bhk)细胞、猴肾细胞(cos)、vero、hepg2、madindarby牛肾(mdbk)细胞、nos、u2os、a549、ht1080、cad、p19、nih3t3、l929、n2a、mcf-7、y79、so-rb50、dukx-x11和j558l。在一些实施方案中,抗pd1抗体在cho或cho-s细胞中产生。
[0145]
取决于所选的表达系统和宿主,抗pd1抗体是通过在表达抗pd1抗体的条件下生长由上文所述的表达载体转化的宿主细胞来产生的。抗pd1抗体然后从宿主细胞中分离并纯化。如果表达系统将抗pd1抗体分泌到生长培养基中,则可以直接从培养基中纯化抗pd1抗体。如果抗pd1抗体不被分泌,则其从细胞裂解物中分离出来。合适的生长条件和回收方法的选择在本领域技术范围内。纯化后,可以确定抗pd1抗体的氨基酸序列,即通过edman降解的重复循环,然后通过hplc进行氨基酸分析。氨基酸测序的其他方法也是本领域已知的。一旦纯化,抗pd1抗体的功能性可以通过本领域已知的任何常规方法例如elisa来评估。
[0146]
融合蛋白
[0147]
在某些方面,本文提供了治疗癌症的方法,其包括向患有癌症的受试者施用与包
含靶向部分和免疫调节部分的融合蛋白组合的例如本文所述的特异性结合程序性死亡蛋白1(pd1)的抗体或其功能片段或功能变体,其中:i)所述靶向部分特异性结合表皮生长因子受体(egfr);和(ii)所述免疫调节部分包含转化生长因子-β受体ii(tgfβrii)的胞外结构域的氨基酸序列。
[0148]
egfr靶向部分
[0149]
在一些实施方案中,egfr靶向部分包含抗体或其功能片段或功能变体。在一些实施方案中,抗体是全长抗体、单链可变片段(scfv)、scfv2、scfv-fc、fab、fab’、f(ab’)2、f(v)、单结构域抗体、单链抗体或vhh。在一些实施方案中,egfr靶向部分结合egfr并抑制通过结合的egf受体的下游信号传导。
[0150]
在一些实施方案中,抗egfr抗体选自西妥昔单抗和帕尼单抗。在一些实施方案中,抗egfr抗体是西妥昔单抗和帕尼单抗的功能片段。在一些实施方案中,抗egfr抗体是西妥昔单抗和帕尼单抗的功能变体。
[0151]
西妥昔单抗
[0152]
在一些实施方案中,抗egfr抗体是西妥昔单抗。在一些实施方案中,抗egfr抗体与西妥昔单抗交叉竞争。在一些实施方案中,抗egfr抗体与西妥昔单抗结合相同的表位。在一些实施方案中,抗egfr抗体具有与西妥昔单抗相同的cdr。
[0153]
在一些实施方案中,抗egfr抗体包含可变重链(vh),其包含三个互补决定区:vh cdr1、vh cdr2和vh cdr3。在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:34的氨基酸序列;vh cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:35的氨基酸序列;和vh cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:36的氨基酸序列。在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含seq id no:34的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:34的氨基酸序列;vh cdr2,其包含seq id no:35的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:35的氨基酸序列;和vh cdr3,其包含seq id no:36的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:35的氨基酸序列。
[0154]
在一些实施方案中,抗egfr抗体包含可变轻链(vl),其包含三个互补决定区:vl cdr1、vl cdr2和vl cdr3。在一些实施方案中,抗egfr抗体包含vl,所述vl包含:vl cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:37的氨基酸序列;vl cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:38的氨基酸序列;和vl cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:39的氨基酸序列。在一些实施方案中,抗egfr抗体包含vl,所述vl包含:vl cdr1,其包含seq id no:37的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:37的氨基酸序列;vl cdr2,其包含seq id no:38的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:38的氨基酸序列;和vl cdr3,其包含seq id no:39的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:39的氨基酸序列。
[0155]
在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:34的氨基酸序列;vh cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:35的氨基酸序列;和vh cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:36的氨基酸序列;vl,所述vl包含:vl cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:37的氨基酸序列;vl cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:38
的氨基酸序列;和vl cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:39的氨基酸序列。
[0156]
在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含seq id no:34的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:34的氨基酸序列;vh cdr2,其包含seq id no:35的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:35的氨基酸序列;和vh cdr3,其包含seq id no:36的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:36的氨基酸序列;和vl,所述vl包含:vl cdr1,其包含seq id no:37的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:37的氨基酸序列;vl cdr2,其包含seq id no:38的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:38的氨基酸序列;和vl cdr3,其包含seq id no:39的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:39的氨基酸序列。
[0157]
在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含与seq id no:34的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与seq idno:35的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与seq id no:36的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0158]
在一些实施方案中,抗egfr抗体包含vl,所述vl包含:vl cdr1,其包含与seq id no:37的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与seq id no:38的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与seq id no:39的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0159]
在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含与seq id no:34的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与seq id no:35的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与seq id no:36的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;并且抗egfr抗体包含vl,所述vl包含:vl cdr1,其包含与seq id no:37的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与seq id no:38的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与seq id no:39的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0160]
在一些实施方案中,抗egfr抗体包含与seq id no:40的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vh。在一些实施方案中,抗egfr抗体包含与seq id no:41的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vl。在一些实施方案中,抗egfr抗体包含与seq id no:40的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vh;和与seq id no:41的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vl。
[0161]
在一些实施方案中,抗egfr抗体包含重链,所述重链包含与seq id no:43的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗egfr抗体包含轻链,所述轻链包含与seq id no:44的氨基酸
序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗egfr抗体包含重链,所述重链包含与seq id no:43的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:44的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0162]
在一些实施方案中,抗egfr抗体包含重链,所述重链包含与seq id no:42的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗egfr抗体包含重链,所述重链包含与seq id no:42的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:44的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0163]
帕尼单抗
[0164]
在一些实施方案中,抗egfr抗体是帕尼单抗。在一些实施方案中,抗egfr抗体与帕尼单抗交叉竞争。在一些实施方案中,抗egfr抗体与帕尼单抗结合相同的表位。在一些实施方案中,抗egfr抗体具有与帕尼单抗相同的cdr。
[0165]
在一些实施方案中,抗egfr抗体包含可变重链(vh),其包含三个互补决定区:vh cdr1、vh cdr2和vh cdr3。在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:45的氨基酸序列;vh cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:46的氨基酸序列;和vh cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:47的氨基酸序列。在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含seq id no:45的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:45的氨基酸序列;vh cdr2,其包含seq id no:46的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:46的氨基酸序列;和vh cdr3,其包含seq id no:47的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:47的氨基酸序列。
[0166]
在一些实施方案中,抗egfr抗体包含可变轻链(vl),其包含三个互补决定区:vl cdr1、vl cdr2和vl cdr3。在一些实施方案中,抗egfr抗体包含vl,所述vl包含:vl cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:48的氨基酸序列;vl cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:49的氨基酸序列;和vl cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:50的氨基酸序列。在一些实施方案中,抗egfr抗体包含vl,所述vl包含:vl cdr1,其包含seq id no:48的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:48的氨基酸序列;vl cdr2,其包含seq id no:49的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:49的氨基酸序列;和vl cdr3,其包含seq id no:50的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:50的氨基酸序列。
[0167]
在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:45的氨基酸序列;vh cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:46的氨基酸序列;和vh cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:47的氨基酸序列;和vl,所述vl包含:vl cdr1,其包含具有0、1、2或3个氨基酸修饰的seq id no:48的氨基酸序列;vl cdr2,其包含具有0、1、2或3个氨基酸修饰的seq id no:49的氨基酸序列;和vl cdr3,其包含具有0、1、2或3个氨基酸修饰的seq id no:50的氨基酸序
列。
[0168]
在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含seq id no:45的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:45的氨基酸序列;vh cdr2,其包含seq id no:46的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:46的氨基酸序列;和vh cdr3,其包含seq id no:47的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:47的氨基酸序列;和vl,所述vl包含:vl cdr1,其包含seq id no:48的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:48的氨基酸序列;vl cdr2,其包含seq id no:49的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:49的氨基酸序列;和vl cdr3,其包含seq id no:50的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:50的氨基酸序列。
[0169]
在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含与seq id no:45的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与seq id no:46的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与seq id no:47的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0170]
在一些实施方案中,抗egfr抗体包含vl,所述vl包含:vl cdr1,其包含与seq id no:48的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与seq id no:49的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与seq id no:50的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0171]
在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含与seq id no:45的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与seq id no:46的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与seq id no:47的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;并且抗egfr抗体包含vl,所述vl包含:vl cdr1,其包含与seq id no:48的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与seq id no:49的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与seq id no:50的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0172]
在一些实施方案中,抗egfr抗体包含与seq id no:51的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vh。在一些实施方案中,抗egfr抗体包含与seq id no:52的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vl。在一些实施方案中,抗egfr抗体包含与seq id no:51的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vh;和与seq id no:52的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的vl。
[0173]
在一些实施方案中,抗egfr抗体包含重链,所述重链包含与seq id no:54的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗egfr抗体包含轻链,所述轻链包含与seq id no:55的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸
序列。在一些实施方案中,抗egfr抗体包含重链,所述重链包含与seq id no:54的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:55的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0174]
在一些实施方案中,抗egfr抗体包含重链,所述重链包含与seq id no:53的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗egfr抗体包含重链,所述重链包含与seq id no:53的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:55的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0175]
在一些实施方案中,抗egfr抗体包含表2中的抗体。在一些实施方案中,抗egfr抗体是表2中的抗体。
[0176]
在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含与表2中的vh cdr1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与表2中的vh cdr2的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与表2中的vh cdr3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0177]
在一些实施方案中,抗egfr抗体包含vl,所述vl包含:vl cdr1,其包含与表2中的vl cdr1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与表2中的vl cdr2的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与表2中的vl cdr3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0178]
在一些实施方案中,抗egfr抗体包含vh,所述vh包含:vh cdr1,其包含与表2中的vh cdr1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vh cdr2,其包含与表2中的vh cdr2的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vh cdr3,其包含与表2中的vh cdr3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl,所述vl包含:vl cdr1,其包含与表2中的vl cdr1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;vl cdr2,其包含与表2中的vl cdr2的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl cdr3,其包含与表2中的vl cdr3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0179]
在一些实施方案中,抗egfr抗体包含重链,所述重链包含与表2中的重链的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗egfr抗体包含轻链,所述轻链包含与表2中的轻链的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗egfr抗体包含重链,所述重链包含与表2中的重链的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与表2中的轻链的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0180]
在一些实施方案中,抗egfr抗体包含vh,所述vh包含与表2中的抗体的vh的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗egfr抗体包含vl,所述vl包含与表2中的抗体的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,抗egfr抗体包含vh,所述vh包含与表2中的抗体的vh的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和vl,所述vl包含与表2中的抗体的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0181]
表2.示例性抗egfr抗体
[0182]
[0183]
[0184]
[0185][0186]
tgfβtrap
[0187]
在某些方面,本文提供了治疗癌症的方法,其包括向患有癌症的受试者施用与包含靶向部分和免疫调节部分的融合蛋白组合的例如本文所述的特异性结合程序性死亡蛋白1(pd1)的抗体或其功能片段或功能变体,其中:i)所述靶向部分特异性结合表皮生长因子受体(egfr);和(ii)所述免疫调节部分包含转化生长因子-β受体ii(tgfβrii)的胞外结构域(ecd)的氨基酸序列。
[0188]
在一些实施方案中,tgfβrii ecd结合至少一种tgfβ同种型。在一些实施方案中,tgfβrii ecd结合tgfβ1。在一些实施方案中,tgfβrii ecd结合tgfβ3。在一些实施方案中,tgfβrii ecd不结合tgfβ2。
[0189]
在一些实施方案中,tgfβrii ecd包含天然存在的tgfβrii ecd的足够的序列以使
id no:57-61中任一项的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:57-61中任一项的氨基酸序列。
[0201]
在一些实施方案中,接头包含与seq id no:57的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,接头包含与seq id no:57的氨基酸序列100%相同的氨基酸序列。在一些实施方案中,接头包含seq id no:57的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:57的氨基酸序列。在一些实施方案中,接头基本上由与seq id no:57的氨基酸序列100%相同的氨基酸序列组成。在一些实施方案中,接头由与seq id no:57的氨基酸序列100%相同的氨基酸序列组成。在一些实施方案中,接头由seq id no:57的氨基酸序列或具有1、2或3个氨基酸修饰的seq id no:57的氨基酸序列组成。
[0202]
在一些实施方案中,接头包含与seq id no:58的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,接头包含与seq id no:58的氨基酸序列100%相同的氨基酸序列。在一些实施方案中,接头包含seq id no:58的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:28的氨基酸序列。在一些实施方案中,接头基本上由与seq id no:58的氨基酸序列100%相同的氨基酸序列组成。在一些实施方案中,接头由与seq id no:58的氨基酸序列100%相同的氨基酸序列组成。在一些实施方案中,接头由seq id no:58的氨基酸序列或具有1、2或3个氨基酸修饰的seq id no:58的氨基酸序列组成。
[0203]
在一些实施方案中,接头包含与seq id no:59的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,接头包含与seq id no:59的氨基酸序列100%相同的氨基酸序列。在一些实施方案中,接头包含seq id no:59的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:59的氨基酸序列。在一些实施方案中,接头基本上由与seq id no:59的氨基酸序列100%相同的氨基酸序列组成。在一些实施方案中,接头由与seq id no:59的氨基酸序列100%相同的氨基酸序列组成。在一些实施方案中,接头由seq id no:59的氨基酸序列或具有1、2或3个氨基酸修饰的seq id no:59的氨基酸序列组成。
[0204]
在一些实施方案中,接头包含与seq id no:60的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,接头包含与seq id no:60的氨基酸序列100%相同的氨基酸序列。在一些实施方案中,接头包含seq id no:60的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:60的氨基酸序列。在一些实施方案中,接头基本上由与seq id no:60的氨基酸序列100%相同的氨基酸序列组成。在一些实施方案中,接头由与seq id no:60的氨基酸序列100%相同的氨基酸序列组成。在一些实施方案中,接头由seq id no:60的氨基酸序列或具有1、2或3个氨基酸修饰的seq id no:60的氨基酸序列组成。
[0205]
在一些实施方案中,接头包含与seq id no:61的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,接头包含与seq id no:61的氨基酸序列100%相同的氨基酸序列。在一些实施方案中,接头包含seq id no:61的氨基酸序列,或具有1、2或3个氨基酸修饰的seq id no:61的氨基酸序列。在一些实施方案中,接头基本上由与seq id no:61的氨基酸序列100%相同的氨基酸序列组成。在一些实施方案
中,接头由与seq id no:61的氨基酸序列100%相同的氨基酸序列组成。在一些实施方案中,接头由seq id no:61的氨基酸序列或具有1、2或3个氨基酸修饰的seq id no:61的氨基酸序列组成。
[0206]
表4.示例性接头
[0207][0208][0209]
示例性融合蛋白
[0210]
表5中提供了本公开内容的示例性融合蛋白。
[0211]
在一个实施方案中,融合蛋白包含bca101。bca101是一种双功能融合蛋白,其包含抗egfr抗体和融合至抗egfr抗体轻链的c末端的tgfβrii的胞外结构域。
[0212]
在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:43的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含轻链,所述轻链包含与seq id no:62的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:43的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:62的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0213]
在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:43的氨基酸序列100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含轻链,所述轻链包含与seq id no:62的氨基酸序列100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:43的氨基酸序列100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:62的氨基酸序列100%相同的氨基酸序列。
[0214]
在一些实施方案中,融合蛋白包含重链,其中所述重链的氨基酸序列包含seq id no:43的氨基酸序列。在一些实施方案中,融合蛋白包含轻链,其中所述轻链的氨基酸序列包含seq id no:62的氨基酸序列。在一些实施方案中,所述融合蛋白包含重链,其中所述重链的氨基酸序列包含seq id no:43的氨基酸序列;和轻链,其中所述轻链的氨基酸序列包含seq id no:62的氨基酸序列。
[0215]
在一些实施方案中,融合蛋白包含重链,所述重链包含具有1、2或3个氨基酸修饰的seq id no:43的氨基酸序列。在一些实施方案中,融合蛋白包含轻链,所述轻链包含具有1、2或3个氨基酸修饰的seq id no:62的氨基酸序列。在一些实施方案中,融合蛋白包含重链,所述重链包含具有1、2或3个氨基酸修饰的seq id no:43的氨基酸序列;和轻链,所述轻
链包含具有1、2或3个氨基酸修饰的seq id no:62的氨基酸序列。
[0216]
在一些实施方案中,融合蛋白包含由与seq id no:43的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链。在一些实施方案中,融合蛋白包含由与seq id no:62的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。在一些实施方案中,融合蛋白包含由与seq id no:43的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链;和由与seq id no:62的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成轻链。
[0217]
在一些实施方案中,融合蛋白包含由与seq id no:43的氨基酸序列100%相同的氨基酸序列组成的重链。在一些实施方案中,融合蛋白包含由与seq id no:62的氨基酸序列100%相同的氨基酸组成的轻链。在一些实施方案中,融合蛋白包含由与seq id no:43的氨基酸序列100%相同的氨基酸序列组成的重链;和轻链,其包含与seq id no:62的氨基酸序列100%相同的氨基酸序列。
[0218]
在一些实施方案中,融合蛋白包含由具有1、2或3个氨基酸修饰的seq id no:43的氨基酸序列组成的重链。在一些实施方案中,融合蛋白包含由具有1、2或3个氨基酸修饰的seq id no:62的氨基酸序列组成的轻链。在一些实施方案中,融合蛋白包含由具有1、2或3个氨基酸修饰的seq id no:43的氨基酸序列组成的重链;以及由具有1、2或3个氨基酸修饰的seq id no:62的氨基酸序列组成的轻链。
[0219]
在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:63的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含轻链,所述轻链包含与seq id no:44的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:63的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:44的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0220]
在一些实施方案中,融合蛋白包含由与seq id no:63的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链。在一些实施方案中,融合蛋白包含由与seq id no:44的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。在一些实施方案中,融合蛋白包含由与seq id no:63的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链;和由与seq id no:44的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。
[0221]
在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:42的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含轻链,所述轻链包含与seq id no:62的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:42的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:62的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0222]
在一些实施方案中,融合蛋白包含由与seq id no:42的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链。在一些实施方案中,融合蛋白包含由与seq id no:62的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。在一些实施方案中,融合蛋白包含由与seq id no:42的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链;和由与seq id no:62的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。
[0223]
在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:64的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含轻链,所述轻链包含与seq id no:44的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:64的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:44的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0224]
在一些实施方案中,融合蛋白包含由与seq id no:64的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链。在一些实施方案中,融合蛋白包含由与seq id no:44的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。在一些实施方案中,融合蛋白包含由与seq id no:64的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链;和由与seq id no:44的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。
[0225]
在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:53的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含轻链,所述轻链包含与seq id no:65的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:53的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:65的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0226]
在一些实施方案中,融合蛋白包含由与seq id no:53的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链。在一些实施方案中,融合蛋白包含由与seq id no:65的氨基酸序列至少90%、91%、
92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。在一些实施方案中,融合蛋白包含由与seq id no:53的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链;和由与seq id no:65的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。
[0227]
在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:66的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含轻链,所述轻链包含与seq id no:55的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:66的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:55的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0228]
在一些实施方案中,融合蛋白包含由与seq id no:66的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链。在一些实施方案中,融合蛋白包含由与seq id no:55的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。在一些实施方案中,融合蛋白包含由与seq id no:66的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链;和由与seq id no:55的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。
[0229]
在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:54的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含轻链,所述轻链包含与seq id no:65的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:54的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:65的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0230]
在一些实施方案中,融合蛋白包含由与seq id no:54的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链。在一些实施方案中,融合蛋白包含由与seq id no:65的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。在一些实施方案中,融合蛋白包含由与seq id no:54的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链;和由与seq id no:65的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。
[0231]
在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:67的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸
序列。在一些实施方案中,融合蛋白包含轻链,所述轻链包含与seq id no:55的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,融合蛋白包含重链,所述重链包含与seq id no:67的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和轻链,所述轻链包含与seq id no:55的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0232]
在一些实施方案中,融合蛋白包含由与seq id no:67的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链。在一些实施方案中,融合蛋白包含由与seq id no:55的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。在一些实施方案中,融合蛋白包含由与seq id no:67的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的重链;和由与seq id no:55的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列组成的轻链。
[0233]
表5.示例性融合蛋白
[0234]
[0235]
[0236]
[0237]
[0238]
[0239]
[0240]
[0241]
[0242][0243]
制备融合蛋白的方法
[0244]
本文描述的融合蛋白可以通过本领域已知的任何常规技术来制备,例如重组技术或化学合成(例如,固相肽合成)。在一个实施方案中,融合蛋白通过在细胞中重组表达来制备。简而言之,可以通过合成编码融合蛋白的dna并将该dna克隆到任何合适的表达载体中来制备融合蛋白。许多克隆载体是本领域技术人员已知的,并且合适的克隆载体的选择是选择的问题。该基因可以置于启动子、核糖体结合位点(用于细菌表达)和任选地操纵子的控制下,以便编码融合蛋白的dna序列在由含有该表达构建体的载体转化的宿主细胞中转录成rna。编码序列可以含有或可以不含有信号肽或前导序列。可以将异源前导序列添加到导致表达的多肽从宿主生物体分泌的编码序列中。也可能需要其他调节序列,其允许相对于宿主细胞的生长调节蛋白质序列的表达。此类调节序列是本领域技术人员已知的,并且实例包括响应于化学或物理刺激(包括调节化合物的存在)而引起基因表达开启或关闭的那些。其他类型的调节元件也可以存在于载体中,例如增强子序列。在插入载体例如上述克隆载体之前,可以将控制序列和其他调节序列连接至编码序列。或者,可以将编码序列直接克隆到已经含有控制序列和适当的限制性位点的表达载体中。
[0245]
然后可以使用表达载体转化合适的宿主细胞。许多哺乳动物细胞系是本领域已知的并且包括可从美国典型培养物保藏中心(atcc)获得的永生化细胞系,例如但不限于中国仓鼠卵巢(cho)细胞、cho悬浮细胞(cho-s)、hela细胞、hek293、幼仓鼠肾(bhk)细胞、猴肾细胞(cos)、vero、hepg2、madindarby牛肾(mdbk)细胞、nos、u2os、a549、ht1080、cad、p19、nih3t3、l929、n2a、mcf-7、y79、so-rb50、dukx-x11和j558l。在一些实施方案中,融合蛋白在cho或cho-s细胞中产生。
[0246]
取决于所选择的表达系统和宿主,融合蛋白是通过在表达融合蛋白的条件下生长由上文所述的表达载体转化的宿主细胞来产生的。然后,从宿主细胞中分离并纯化融合蛋白。如果表达系统将融合蛋白分泌到生长培养基中,可以直接从培养基中纯化融合蛋白。如果融合蛋白不被分泌,则其从细胞裂解物中分离出来。合适的生长条件和回收方法的选择在本领域技术范围内。纯化后,可以确定融合蛋白的氨基酸序列,即通过edman降解的重复循环,然后通过hplc进行氨基酸分析。氨基酸测序的其他方法也是本领域已知的。一旦纯化,可以评估融合蛋白的功能性,例如,如本文所述的,例如利用双功能elisa。
[0247]
如上所述,可以通过本领域已知的任何方法例如elisa来测试融合蛋白的功能性。
每个功能可以在单独的测定中测量,例如,tgfβ结合和egfr结合可以在两个单独的elisa中测量。例如,可以用egfr fc嵌合体包被elisa板,并将其用于评估egfr结合;并且可以用tgfβ-1包被单独的elisa板来评估tgfβ-1结合。这两种功能也可以在双功能elisa中进行评估。例如,针对西妥昔单抗的抗独特型mab(用于与bca101融合蛋白一起使用)可用于捕获bca101,并且可通过针对tgfβrii ecd的酶标记多克隆抗体来检测结合的bca101。样品中bca101的浓度可以从bca101校准曲线反算。靶标结合也可以通过biocore进行评估,其中egfr和tgfβ1靶标被固定在激活的cm5芯片上,然后与系列浓度的融合蛋白一起孵育。还可以进行额外的体外功能测定(包括例如通过流式细胞术进行的细胞表面结合、细胞增殖的抑制、adcc测定、tgfβ1诱导的il-11释放的中和;tgfβ1诱导的smad信号传导的中和)来评估融合蛋白。
[0248]
使用方法
[0249]
在一个方面,本文提供了通过向患有癌症的受试者施用特异性结合pd1的药剂(例如本文所述的药剂)和包含靶向部分和免疫调节部分的融合蛋白治疗受试者中的癌症的方法,其中:i)所述靶向部分特异性结合表皮生长因子受体(egfr);和(ii)所述免疫调节部分包含转化生长因子-β受体ii(tgfβrii)的胞外结构域的氨基酸序列。
[0250]
在一些实施方案中,使用本文公开的方法代替标准护理疗法。在某些实施方案中,标准护理疗法与本文公开的任何方法组合使用。用于不同类型癌症的标准护理疗法是本领域技术人员众所周知的。例如,由美国21个主要癌症中心组成的国家综合癌症网络(nccn)发布了《nccn肿瘤学临床实践指南》(nccn),其提供了有关多种癌症的标准护理治疗的详细最新信息。在一些实施方案中,本文公开的方法在标准护理治疗失败后使用。
[0251]
在一些实施方案中,融合蛋白与特异性结合pd1的抗体或其功能片段或功能变体共同施用、在特异性结合pd1的抗体或其功能片段或功能变体之前施用或在特异性结合pd1的抗体或其功能片段或功能变体之后施用。
[0252]
在一些实施方案中,融合蛋白与特异性结合pd1的抗体或其功能片段或功能变体共同施用。在一些实施方案中,融合蛋白与特异性结合pd1的抗体或其功能片段或功能变体同时施用。在一些实施方案中,融合蛋白在特异性结合pd1的抗体或其功能片段或功能变体的施用的30分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时或12小时内施用。
[0253]
在一些实施方案中,在施用特异性结合pd1的抗体或其功能片段或功能变体之前施用融合蛋白。在一些实施方案中,在施用特异性结合pd1的抗体或其功能片段或功能变体之前至少30分钟、1小时、3小时、6小时、12小时、24小时、48小时、72小时、4天、5天、6天、7天或14天施用融合蛋白。
[0254]
在一些实施方案中,在施用特异性结合pd1的抗体或其功能片段或功能变体之后施用融合蛋白。在一些实施方案中,在施用特异性结合pd1的抗体或其功能片段或功能变体之后至少30分钟、1小时、3小时、6小时、12小时、24小时、48小时、72小时、4天、5天、6天、7天或14天施用融合蛋白。
[0255]
示例性癌症
[0256]
在一些实施方案中,癌症是转移性的。在一些实施方案中,癌症是复发性的。在一
些实施方案中,癌症是转移性的和复发性的。在一些实施方案中,癌症对于批准的标准护理是难治的。在一些实施方案中,癌症对于至少一种批准的标准护理是难治的。在一些实施方案中,癌症对至少所有批准的标准护理疗法是难治的。
[0257]
在一些实施方案中,癌症是egfr驱动的。在一些实施方案中,癌症是实体瘤。在一些实施方案中,癌症是血液恶性肿瘤。在一些实施方案中,癌症选自乳腺癌、肛门癌、胰腺癌、甲状腺癌、肝癌、卵巢癌、肺癌、皮肤癌、脑癌、脊髓癌、头癌、颈癌和头颈癌。
[0258]
在一些实施方案中,癌症是头颈癌。在一些实施方案中,癌症是头颈鳞状细胞癌(hnscc)。在一些实施方案中,癌症是复发性hnscc。在一些实施方案中,癌症是转移性hnscc。在一些实施方案中,癌症是转移性和复发性hnscc。在一些实施方案中,癌症是肛管癌。在一些实施方案中,癌症是肛管鳞状细胞癌(sccac)。在一些实施方案中,癌症是复发性sccac。在一些实施方案中,癌症是转移性sccac。在一些实施方案中,癌症是转移性和复发性sccac。
[0259]
给药方案和时间表
[0260]
抗pd1抗体
[0261]
在一些实施方案中,将特异性结合pd1的抗体或其功能片段或功能变体以治疗有效剂量施用至患有癌症的受试者。在一些实施方案中,将特异性结合pd1的抗体或其功能片段或功能变体以固定剂量施用至患有癌症的受试者。在一些实施方案中,将特异性结合pd1的抗体或其功能片段或功能变体以平剂量施用至患有癌症的受试者。在一些实施方案中,将特异性结合pd1的抗体或其功能片段或功能变体以基于体重的剂量施用至患有癌症的受试者。
[0262]
在一些实施方案中,以约100mg至500mg、100mg至400mg、100mg至300mg或100mg至200mg的剂量向患有癌症的受试者施用特异性结合pd1的抗体或其功能片段或功能变体。在一些实施方案中,以约100mg、200mg、300mg、400mg或500mg的剂量向患有癌症的受试者施用特异性结合pd1的抗体或其功能片段或功能变体。在一些实施方案中,以约200mg的剂量向患有癌症的受试者施用特异性结合pd1的抗体或其功能片段或功能变体。在一些实施方案中,以约300mg的剂量向患有癌症的受试者施用特异性结合pd1的抗体或其功能片段或功能变体。
[0263]
在一些实施方案中,约每1、2、3、4、5、6、7或8周向患有癌症的受试者施用特异性结合pd1的抗体或其功能片段或功能变体。在一些实施方案中,约每1周向患有癌症的受试者施用特异性结合pd1的抗体或其功能片段或功能变体。在一些实施方案中,约每两周向患有癌症的受试者施用特异性结合pd1的抗体或其功能片段或功能变体。在一些实施方案中,约每3周向患有癌症的受试者施用特异性结合pd1的抗体或其功能片段或功能变体。
[0264]
在一些实施方案中,特异性结合pd1的抗体或其功能片段或功能变体是派姆单抗。在一些实施方案中,以约100mg至500mg、100mg至400mg、100mg至300mg或100mg至200mg的剂量向受试者施用派姆单抗。在一些实施方案中,派姆单抗以约100mg、200mg、300mg、400mg或500mg的剂量施用。在一些实施方案中,派姆单抗以约200mg的剂量施用。在一些实施方案中,派姆单抗以约300mg的剂量施用。在一些实施方案中,派姆单抗以约400mg的剂量施用。
[0265]
在一些实施方案中,约每1、2、3、4、5、6、7或8周向受试者施用派姆单抗。在一些实施方案中,约每2周向受试者施用派姆单抗周。在一些实施方案中,约每3周向受试者施用派
姆单抗。在一些实施方案中,约每4周向受试者施用派姆单抗。在一些实施方案中,约每5周向受试者施用派姆单抗。在一些实施方案中,约每6周向受试者施用派姆单抗。
[0266]
在一些实施方案中,派姆单抗每3周以约200mg的剂量施用至受试者。在一些实施方案中,派姆单抗每6周以约400mg的剂量施用至受试者。
[0267]
在一些实施方案中,特异性结合pd1的抗体或其功能片段或功能变体是纳武单抗。在一些实施方案中,以约100mg至500mg、100mg至400mg、100mg至300mg或100mg至200mg的剂量向受试者施用纳武单抗。在一些实施方案中,纳武单抗以约100mg、200mg、300mg、400mg或500mg的剂量施用。在一些实施方案中,纳武单抗以约200mg的剂量施用。在一些实施方案中,纳武单抗以约240mg的剂量施用。在一些实施方案中,纳武单抗以约300mg的剂量施用。在一些实施方案中,纳武单抗以约360mg的剂量施用。在一些实施方案中,纳武单抗以约400mg的剂量施用。在一些实施方案中,纳武单抗以约480mg的剂量施用。在一些实施方案中,纳武单抗以约500mg的剂量施用。
[0268]
在一些实施方案中,以约1mg/kg至5mg/kg、1mg/kg至4mg/kg、1mg/kg至3mg/kg或1mg/kg至2mg/kg的剂量向受试者施用纳武单抗。在一些实施方案中,纳武单抗以约1mg/kg、2mg/kg、3mg/kg、4mg/kg或5mg/kg的剂量施用。在一些实施方案中,纳武单抗以约1mg/kg的剂量施用。在一些实施方案中,纳武单抗以约2mg/kg的剂量施用。在一些实施方案中,纳武单抗以约3mg/kg的剂量施用。
[0269]
在一些实施方案中,约每1、2、3、4、5、6、7或8周向受试者施用纳武单抗。在一些实施方案中,约每2周向受试者施用纳武单抗周。在一些实施方案中,约每3周向受试者施用纳武单抗。在一些实施方案中,约每4周向受试者施用纳武单抗。在一些实施方案中,约每5周向受试者施用纳武单抗。在一些实施方案中,约每6周向受试者施用纳武单抗。
[0270]
在一些实施方案中,每2周以约240mg的剂量向受试者施用纳武单抗。在一些实施方案中,每4周以约480mg的剂量向受试者施用纳武单抗。在一些实施方案中,纳武单抗每3周以约360mg的剂量施用。在一些实施方案中,每3周以约1mg/kg的剂量向受试者施用纳武单抗。在一些实施方案中,每2周以约3mg/kg的剂量向受试者施用纳武单抗。
[0271]
融合蛋白
[0272]
在一些实施方案中,融合蛋白(即包含靶向部分和免疫调节部分的融合蛋白,其中:i)所述靶向部分特异性结合表皮生长因子受体(egfr);和(ii)所述免疫调节部分包含转化生长因子-β受体ii(tgfβrii)的胞外结构域的氨基酸序列)以治疗有效剂量施用至患有癌症的受试者。在一些实施方案中,以固定剂量向患有癌症的受试者施用融合蛋白。在一些实施方案中,以平剂量向患有癌症的受试者施用融合蛋白。在一些实施方案中,以基于体重的剂量向患有癌症的受试者施用融合蛋白。
[0273]
在一些实施方案中,以约50mg至2000mg、100mg至2000mg、150mg至2000mg、200mg至2000mg、300mg至2000mg、400mg至2000mg、500mg至2000mg、600mg至2000mg、700mg至2000mg、800mg至2000mg、9000mg至2000mg、1000mg至2000mg、1500mg至2000mg、50mg至100mg、50mg至500mg、50mg至400mg、50mg至300mg、50mg至200mg、50mg至100mg、100mg至500mg、100mg至400mg、100mg至300mg或100mg至200mg的剂量向受试者施用融合蛋白。在一些实施方案中,以约200mg至2000mg的剂量向受试者施用融合蛋白。在一些实施方案中,以约50mg、60mg、64mg、100mg、150mg、200mg、240mg、250mg、300mg、400mg、500mg、600mg、700mg、800mg、900mg、
1000mg、1100mg、1200mg、1300mg、1400mg、1500mg、1600mg、1700mg、1800mg、1900或2000mg的剂量向受试者施用融合蛋白。在一些实施方案中,以约64mg、240mg、800mg或1600mg的剂量向受试者施用融合蛋白。在一些实施方案中,以约64mg的剂量向受试者施用融合蛋白。在一些实施方案中,以约240mg的剂量向受试者施用融合蛋白。在一些实施方案中,以约800mg的剂量向受试者施用融合蛋白。在一些实施方案中,以约1600mg的剂量向受试者施用融合蛋白。
[0274]
在一些实施方案中,每1、2、3、4、5或6周向受试者施用融合蛋白。在一些实施方案中,每周向受试者施用融合蛋白。在一些实施方案中,每2周向受试者施用融合蛋白。在一些实施方案中,每3周向受试者施用融合蛋白。在一些实施方案中,每4周向受试者施用融合蛋白。在一些实施方案中,将融合蛋白施用至受试者5周。在一些实施方案中,每6周向受试者施用融合蛋白。
[0275]
试剂盒
[0276]
在一个方面,本文提供了用于治疗用途的包含本文所述的抗pd-1抗体和融合蛋白的试剂盒。试剂盒通常包括标签,其指示试剂盒内容物的预期用途和使用说明。术语标签包括试剂盒上提供的或随试剂盒提供的或以其他方式随附于试剂盒的任何书写或记录材料。因此,本公开内容提供了用于治疗患有癌症的受试者的试剂盒,该试剂盒包含:(a)抗pd-1抗体的剂量;和(b)本文所述的融合蛋白的剂量和(c)在本文公开的任何组合治疗方法中使用抗pd-1抗体和融合蛋白的说明。在某些实施方案中,抗pd-1抗体、融合蛋白可以以单位剂型共同包装。在用于治疗人类患者的某些实施方案中,试剂盒包含本文公开的抗人pd-1抗体,例如派姆单抗。
[0277]
本发明通过以下实施例进一步说明,但不应将其视为进一步限制。本技术全文引用的所有参考文献的内容均明确地通过引用并入本文。
实施例
[0278]
实施例1。在携带皮下pc-3肿瘤异种移植物的hunog-exl小鼠中评估与抗pd1抗体组合的bca101的抗癌活性。
[0279]
本研究的目的是评估单独的和与抗pd1抗体派姆单抗组合的bca101的体内抗癌活性。
[0280]
材料和方法
[0281]
小鼠
[0282]
此研究利用免疫缺陷的hgm-csf/hil3转基因nog小鼠,该小鼠在移植人类造血干细胞后表现出类似人类的免疫系统(人类起源的淋巴和骨髓谱系)。该模型使得能够研究参与免疫治疗相关药剂的功效的关键先天机制,并为建立人类异种移植物提供合适的模型。
[0283]
雄性hgm-csf/hil3 nog小鼠获自taconic biosciences。移植人类cd34 造血干细胞(hsc)的hgm-csf/hil3 nog小鼠早在注射后6至8周就稳定地发育出广泛的细胞谱系。骨髓和淋巴谱系细胞均存在于外周血、骨髓、胸腺和脾脏以及包括肺和肝脏的非淋巴组织中。使用在外周血中具有多于25%的hcd45 的hunog-exl小鼠。每项研究开始时小鼠的年龄为13-14周,每组动物的平均体重为约26克。
[0284]
肿瘤细胞的制备及皮下注射
[0285]
所有程序均按照无菌技术在层流罩中进行。使用活力》90%的pc-3(人前列腺腺癌)细胞。将约5x106个细胞重悬于保存在冰中的含有50%基质胶的200μl无血清培养基中。
[0286]
通过将细胞皮下注射到小鼠的右侧胁腹区域,在雄性hunog-exl小鼠中繁殖pc-3细胞系。监测植入区域的肿瘤生长。一旦肿瘤达到可触知阶段和所需体积,基于肿瘤体积(平均肿瘤体积约119mm3)对小鼠进行随机分组并开始给药。研究时间表如表6所示。
[0287]
表6.研究时间表
[0288][0289][0290]
抗体剂量的配制
[0291]
将所需量的人igg1同种型对照、西妥昔单抗、bca101和派姆单抗稀释在稀释缓冲液中,以获得适当的工作浓度以递送预期剂量。对于所有动物维持10ml/kg的腹膜内剂量体积。而在第0天的组合治疗(第v组)中,对于bca101和派姆单抗给药均使用5ml/kg的剂量体积,以维持每只小鼠10ml/kg的总剂量体积。
[0292]
观察结果
[0293]
体重和临床体征
[0294]
实验期间每三天测量个体体重。计算并记录个体小鼠体重的变化%。在实验期间
观察小鼠的可见临床体征并每三天记录一次。
[0295]
肿瘤体积
[0296]
在随机化当天(第0天)以及然后在实验期间每三天用数字游标卡尺二维测量肿瘤的长度(l)和宽度(w)来确定肿瘤体积。使用以下公式计算肿瘤体积(tv):肿瘤体积(mm3)=(l x w2)/2,其中l=长度(mm)并且w=宽度(mm)。计算各个组的平均值、标准差(sd)或平均值标准误差(sem)。
[0297]
抗肿瘤活性
[0298]
抗肿瘤活性被评价为相对于同种型对照组的最大肿瘤生长抑制。使用microsoft excel中的标准计算进行数据评估。
[0299]
测试/对照值%(%t/c)
[0300]
使用以下公式计算特定天的肿瘤抑制(t/c,以%表示):%t/c第x天=((第x天测试组的平均tv
–
第0天测试组的平均tv)/(第x天对照组的平均tv
–
第0天对照组的平均tv))x100%;其中tv=以mm3为单位的肿瘤体积。实验过程中为特定测试组记录的最小(或最佳)%t/c值代表相应治疗的最大抗肿瘤活性。
[0301]
肿瘤生长抑制(tgi)
[0302]
tgi使用以下公式计算:tgi=(1-t/c)
×
100%;其中t=(测试组在第x天的平均tv
–
测试组在第0天的平均tv;和c=(对照组在第x天的平均tv
–
对照组在第0天的平均tv)。
[0303]
统计分析
[0304]
为了评估肿瘤抑制的统计显著性,使用graph pad prism v 8.3.0进行双向anova,然后进行bonferroni事后检验。p值《0.05指示组间存在统计学显著差异。
[0305]
尸检
[0306]
基于伦理原因和肿瘤终点,显示肿瘤坏死/溃疡和肿瘤负荷(肿瘤体积》1500mm3)的动物在第21天被人道安乐死并进行尸检。
[0307]
样品采集
[0308]
第21天,对所有治疗组的剩余动物进行血液采样。采集后,使血液在室温下凝结20分钟。此外,通过在2,000xg下离心10分钟来分离血清并储存在-80℃下以供进一步使用。所有动物均被人道安乐死,收获肿瘤(根据肿瘤可用性)并分成两部分。肿瘤的一部分被快速冷冻,第二部分固定在10%中性缓冲福尔马林(nbf)中。
[0309]
结果
[0310]
西妥昔单抗、bca101和派姆单抗作为独立疗法或组合疗法(bca101 派姆单抗)对于针对pc-3肿瘤异种移植物的抗肿瘤活性进行了评估。西妥昔单抗、bca101和派姆单抗分别以8.1、10和10mg/kg的剂量腹膜内施用。使用相同的剂量和方案测试了bca101 派姆单抗的组合治疗。所有治疗组的所有动物在第18天时均存活。因此,选择第18天进行功效评估。使用西妥昔单抗、bca101、派姆单抗和bca101 派姆单抗的治疗表明,相对于hu igg1(同种型对照)治疗组,%t/c分别为65%、60%、48%和22%(表7)。
[0311]
表7.西妥昔单抗、bca101和派姆单抗在携带pc-3肿瘤异种移植物的hunog-exl中的作用。
[0312][0313]
***各治疗组与同种型对照组相比较时具有统计学显著性差异(p《0.001)。使用graph pad prism(版本8.3.0)通过双向anova然后bonferroni后检验进行统计分析。
[0314]
同种型对照组显示在整个实验过程中的渐进肿瘤生长,其中在第18天平均肿瘤体积为1216
±
89mm3(表8)。西妥昔单抗、bca101、派姆单抗和bca101 派姆单抗治疗组的平均肿瘤体积在第18天分别记录为834
±
175、776
±
127、647
±
145和362
±
120mm3(表8)。此期间的肿瘤生长概况和个体肿瘤生长曲线分别如图1和图2a-2e所示。在第19天对携带pc-3肿瘤的动物拍照(图3a和图3b)。
[0315]
表8.携带pc-3异种移植肿瘤的动物的平均肿瘤体积。
[0316][0317]
*数值表示为每组中8-10只动物的平均值。
[0318]
相对于同种型对照组,西妥昔单抗、bca101、派姆单抗和bca101 派姆单抗组的%tgi值分别计算为35%、40%、52%和78%(第18天)(表9)。与同种型对照组相比,西妥昔单抗、bca101、派姆单抗和bca101 派姆单抗治疗组显示肿瘤生长的显著减少(p《0.001;第18天)。在bca101(1/10只小鼠)、派姆单抗(2/10只小鼠)和bca101 派姆单抗(4/10只小鼠)治疗组中观察到部分肿瘤生长消退。基于肿瘤终点(肿瘤负荷;肿瘤体积》1500mm3)和伦理原因(肿瘤坏死/溃疡),该研究于第21天终止,所有动物均被人道安乐死。
[0319]
表9.在携带pc-3肿瘤异种移植物的hunog-exl小鼠中测试化合物的通过delta测试的肿瘤生长抑制百分比(%tgi)。
[0320][0321]
死亡率和体重变化
[0322]
在实验期间从同种型对照(第19天-d147-a35和第21天-d147-a2)、bca101(第19天-d147-a38)、组合治疗bca101 派姆单抗(第20天-d148-a9和第21天-d149-a65)观察动物死亡率。在任何治疗组中均未观察到异常行为的明显临床迹象。此外,在所有治疗组中都观察到体重逐渐下降。在第21天研究结束时,所有治疗动物均观察到严重的体重减轻(大于-10%)。所有组的动物体重变化百分比总结于表10和图4中。
[0323]
表10.pc-3异种移植研究期间动物的平均体重和体重变化百分比。
[0324][0325]
*%bwc=相对于动物初始体重的体重变化。
[0326]
**数值表示为每组中8-10只动物的平均值。
[0327]
结论
[0328]
在此pc-3肿瘤异种移植模型中,与同种型对照组相比,在给定剂量和方案下使用西妥昔单抗、bca101、派姆单抗和bca101 派姆单抗的治疗显示肿瘤生长的显著减少。在测试的剂量和方案中,与派姆单抗(部分消退-2/10只小鼠)和bca101(部分消退-1/10只小鼠)然后是西妥昔单抗(无部分肿瘤消退)的单独治疗相比,组合治疗(bca101 派姆单抗)表现出最大的肿瘤生长抑制作用,具有更多数量的部分肿瘤消退(4/10只小鼠)。严重的体重减轻可能很大程度上归因于同种型对照中的肿瘤负荷和治疗组的测试剂量。总之,bca101是癌症治疗的候选物,并且与免疫检查点抑制剂(例如抗pd1抗体)组合使用可能对各种异种移植模型表现出更好的疗效。
[0329]
实施例2.单独和与抗pd1抗体(派姆单抗)组合使用的bca101在egfr驱动的晚期实体瘤患者中的安全性和耐受性的1a/1b期剂量递增和队列扩展研究
[0330]
一般来说,本研究旨在评估单独和与派姆单抗组合的bca101在egfr驱动的晚期实体瘤患者中的安全性、耐受性、pk、药效学和疗效。这是一项1/1b期开放标签研究,其由单药bca101和bca101加派姆单抗的组合的剂量递增部分(a部分)和扩展队列(b部分)组成。
[0331]
目标
[0332]
此研究的剂量递增(a部分)的主要目标是1)评估单药bca101在对标准护理难治或
无可用的标准护理的患有特定egfr驱动的晚期实体瘤的患者中的安全性和耐受性;2)评估与派姆单抗组合的bca101在头颈鳞状细胞癌(hnscc)或肛管鳞状细胞癌(sccac)患者中的安全性和耐受性,这些患者的肿瘤对标准护理难治或这些患者没有可用的标准护理;和3)鉴定使用bca101单一疗法或bca101与派姆单抗的组合的治疗第一个周期期间的剂量限制毒性(dlt)。患者将按照“3 3”序贯设计入组。
[0333]
一旦确定了最大耐受剂量(mtd)/推荐剂量(rd),剂量扩展(b部分)的主要目标是进一步评估1)单药bca101在特定癌症患者中的安全性和耐受性;和2)与派姆单抗组合的bca101在hnscc和sccac患者中的安全性和耐受性。用于评估单药bca101的患者队列包括1)pd-l1阴性,egfr扩增的鳞状细胞肺癌(sqclc);2)ras野生型,微卫星稳定结直肠癌(ras wt、mss crc);3)egfr扩增的三阴性乳腺癌;和4)具有kras g12d或g13d突变的任何实体瘤。
[0334]
将基于研究的a部分的结果,在mtd或rd每7天静脉注射bca101。派姆单抗将根据用于特定适应症的批准产品标签进行施用。继续进行每个队列的决定将基于对累积安全性、pk、临床数据和任何pd数据(如果有)的审查,并将旨在确保mtd或rd的风险效益比证明将患者纳入扩展队列的合理性。患者将继续每周输注,直到疾病进展、不可接受的毒性、患者撤回同意或者如果研究者认为停止研究药物的治疗符合患者的最佳利益。
[0335]
本研究的次要目标是:1)根据recist v1.1和irecist确定研究的各部分中的客观缓解率;2)根据recist v1.1和irecist确定研究的各部分中的临床受益率;3)根据recist v1.1和irecist确定研究的各部分中的无进展生存期(pfs);4)根据recist v1.1和irecist确定研究的各部分中的缓解持续时间;5)确定研究的各部分中的存活率;6)bca101和派姆单抗的auc;7)bca101和派姆单抗的cmax;8)bca101和派姆单抗的tmax;9)bca101和派姆单抗的浓度相对时间曲线;10)bca101和派姆单抗的半衰期;和11)通过抗药物抗体的发生率和滴度确定的bca101和派姆单抗的免疫原性。
[0336]
本研究的探索性目标是检查bca101的药效标记物和生物标记物。探索性血清终点包括tgfβ1、tgfβ2、tgfβ3、可溶性egfr、vegf和其他相关细胞因子、白细胞介素和趋化因子的水平。探索性血细胞终点包括通过流式细胞术进行免疫表型分析,以用于外周血的多参数免疫分析。探索性肿瘤组织终点包括对存档、治疗前和治疗后活检样品进行全外显子组测序和下一代dna测序的分析;针对相关egfr和tgfβ信号传导途径标记物、肿瘤浸润免疫细胞和其他相关标记物的免疫组化。
[0337]
研究计划
[0338]
研究的总体设计与计划
[0339]
这是一项1/1b期开放标签研究,其由单药bca101和bca101加派姆单抗的组合的剂量递增部分(a部分)和扩展队列(b部分)组成。
[0340]
剂量递增(a部分)
[0341]
单药bca101将通过静脉输注以64mg、240mg、800mg或1600mg的剂量每周施用至患者。患有以下肿瘤类型的患者符合资格:1)鳞状细胞肺癌(sqclc),2)头颈鳞状细胞癌(hnscc),3)ras野生型微卫星稳定结直肠癌(ras wt mss crc),4)三阴性乳腺癌(tnbc),5)脊索瘤,6)肛管鳞状细胞癌(sccac),7)葡萄膜黑色素瘤,8)胶质母细胞瘤(gbm),9)胃癌,10)具有kras g12d或g13d突变的任何实体瘤,11)具有egfr扩增的任何实体瘤,12)上皮性卵巢癌,13)肝细胞癌(hcc),14)甲状腺未分化癌(atc),15)胰腺癌,16)其他egfr驱动的晚
期实体瘤(如果有令人信服的数据或证据来纳入患有除1-15中列出的那些以外的肿瘤类型的患者,治疗医生可以与申办者讨论该患者以确定资格)。
[0342]
bca101和派姆单抗的组合将每3周通过静脉输注向患者施用。患有以下肿瘤类型的患者符合资格:hnscc和sccac。
[0343]
队列扩展(b部分)
[0344]
患者必须患有当前标准护理治疗无效的经组织学或细胞学证实的egfr驱动的晚期实体瘤。患有以下肿瘤类型的患者将有资格接受单药bca101治疗:pd-l1阴性和egfr扩增的sqclc ras wt mss crc egfr扩增的tnbc,具有kras g12d或g13d突变的任何实体瘤。
[0345]
患有以下肿瘤类型的患者将有资格接受bca101和派姆单抗的组合疗法的治疗:1)hnscc,2)sccac。
[0346]
排除标准:
[0347]
在研究药物的第一个剂量的4周内暴露于抗egfr抗体,或有抗tgfβ疗法的任何治疗史。
[0348]
对西妥昔单抗或其他抗egfr治疗或其他鼠蛋白有≥2级不耐受或超敏反应的既往史,或在与治疗相关的毒性的情况下先前停止治疗。
[0349]
仅对于b部分:对免疫检查点抑制剂有≥2级不耐受或超敏反应的既往史,或在对免疫检查点抑制剂的毒性的情况下而停止治疗的任何历史。
[0350]
孕妇或哺乳期妇女。
[0351]
在研究药物的第一个剂量之前14天内需要使用皮质类固醇(每天》10mg强的松或等效物)或其他免疫抑制药物进行全身治疗的任何病况,但局部、鼻内、支气管内或眼部类固醇除外。
[0352]
人类免疫缺陷病毒(hiv)或活动性乙型肝炎(乙型肝炎表面抗原;hbsag)或丙型肝炎的已知病例。
[0353]
既往感染过乙型肝炎病毒(hbv)或已治愈hbv感染(定义为hbsag检测呈阴性且乙型肝炎核心抗原[抗hbc]抗体检测呈阳性)的患者符合资格。仅当聚合酶链反应对于hcv rna呈阴性时,丙型肝炎病毒(hcv)抗体呈阳性的患者才符合资格。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。