技术特征:
1.一种治疗有需要的人类受试者的癌症的方法,所述方法包括:a.向所述受试者施用特异性结合程序性细胞死亡蛋白1(pd1)的抗体或其功能片段或功能变体;和b.向所述受试者施用包含靶向部分和免疫调节部分的融合蛋白,其中:i)所述靶向部分特异性结合表皮生长因子受体(egfr);和(ii)所述免疫调节部分包含转化生长因子-β受体ii(tgfβrii)的胞外结构域的氨基酸序列。2.权利要求1的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体是全长抗体、单链可变片段(scfv)、scfv2、scfv-fc、fab、fab'、f(ab')2或f(v)。3.权利要求1或2的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体抑制pd1与pdl1的结合。4.前述权利要求中任一项的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体抑制pd1的信号传导。5.前述权利要求中任一项的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体包含vh,所述vh包含vh cdr1、vh cdr2和vh cdr3,其中a.vh cdr1包含与seq id no:1的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;b.vh cdr2包含与seq id no:2的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和c.vh cdr3包含与seq id no:3的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。6.前述权利要求中任一项的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体包含vl,所述vl包含vl cdr1、vl cdr2和vl cdr3,其中a.vl cdr1包含与seq id no:4的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;b.vl cdr2包含与seq id no:5的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和c.vl cdr3包含与seq id no:6的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。7.前述权利要求中任一项的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体包含vh,所述vh包含与seq id no:7的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。8.前述权利要求中任一项的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体包含vl,所述vl包含与seq id no:8的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。9.前述权利要求中任一项的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体包含重链区,所述重链区包含与seq id no:9的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。10.前述权利要求中任一项的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体包含重链区,所述重链区包含与seq id no:10的氨基酸序列至少95%、96%、97%、
98%、99%或100%相同的氨基酸序列。11.前述权利要求中任一项的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体包含轻链区,所述轻链区包含与seq id no:11的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。12.前述权利要求中任一项的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体包括派姆单抗、纳武单抗、西米普利单抗、斯巴达珠单抗、卡瑞利珠单抗、替雷利珠单抗、多塔利单抗、西利单抗、匹地利珠单抗、medi0680、ssi-361、amp-224、pdr001、pf-06801591、bgb-a317、tsr-042、agen-2034、a-0001、bgb-108、bi-754091、cbt-501、enum-003、enum-388d4、ibi-308、jnj-63723283、js-001、jtx-4014、jy-034、cla-134、stia-1110、244c8和388d4,或前述任一种的功能片段或功能变体。13.权利要求12的方法,其中特异性结合pd1的所述抗体或其功能片段或功能变体包括派姆单抗或前述任一种的功能片段或功能变体。14.前述权利要求中任一项的方法,其中特异性结合egfr的所述靶向部分包括特异性结合egfr的抗体或其功能片段或功能变体。15.权利要求14的方法,其中特异性结合egfr的所述抗体或其功能片段或功能变体是全长抗体、单链可变片段(scfv)、scfv2、scfv-fc、fab、fab'、f(ab')2或f(v)。16.权利要求14或15的方法,其中特异性结合egfr的所述抗体或其功能片段或功能变体包含vh,所述vh包含vh cdr1、vh cdr2和vh cdr3,其中a.vh cdr1包含与seq id no:34的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;b.vh cdr2包含与seq id no:35的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和c.vh cdr3包含与seq id no:36的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。17.权利要求14-16中任一项的方法,其中特异性结合egfr的所述抗体或其功能片段或功能变体包含vl,所述vl包含vl cdr1、vl cdr2和vl cdr3,其中a.vl cdr1包含与seq id no:37的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;b.vl cdr2包含与seq id no:38的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;和c.vl cdr3包含与seq id no:39的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。18.权利要求14-17中任一项的方法,其中特异性结合egfr的所述抗体或其功能片段或功能变体包含vh,所述vh包含与seq id no:40的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。19.权利要求14-18中任一项的方法,其中特异性结合egfr的所述抗体或其功能片段或功能变体包含vl,所述vl包含与seq id no:41的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。20.权利要求14-19中任一项的方法,其中特异性结合egfr的所述抗体或其功能片段或
功能变体包含重链,所述重链包含与seq id no:42的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。21.权利要求14-19中任一项的方法,其中特异性结合egfr的所述抗体或其功能片段或功能变体由重链组成,所述重链包含与seq id no:43的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。22.权利要求14-19中任一项的方法,其中特异性结合egfr的所述抗体或其功能片段或功能变体包含重链,所述重链由与seq id no:42的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列组成。23.权利要求14-19中任一项的方法,其中特异性结合egfr的所述抗体或其功能片段或功能变体由重链组成,所述重链由与seq id no:43的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列组成。24.权利要求14-23中任一项的方法,其中特异性结合egfr的所述抗体或其功能片段或功能变体包含轻链,所述轻链包含与seq id no:44的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。25.权利要求14-23中任一项的方法,其中特异性结合egfr的所述抗体或其功能片段或功能变体由轻链组成,所述轻链由与seq id no:44的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列组成。26.权利要求14的方法,其中特异性结合egfr的所述抗体或其功能片段或功能变体包括西妥昔单抗或帕尼单抗,或前述任一种的功能片段或功能变体。27.前述权利要求中任一项的方法,其中所述免疫调节部分包含与seq id no:56的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。28.前述权利要求中任一项的方法,其中所述免疫调节部分由与seq id no:56的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列组成。29.前述权利要求中任一项的方法,其中所述免疫调节部分间接融合至所述靶向部分。30.权利要求29的方法,其中所述免疫调节部分通过肽接头间接融合至所述靶向部分。31.权利要求30的方法,其中所述免疫调节部分通过足够长度的肽接头间接融合至所述靶向部分,使得所述免疫调节部分和所述靶向部分可以同时结合各自的靶标。32.权利要求30或31的方法,其中所述接头包含seq id no:57、58、59、60或61的氨基酸序列。33.权利要求30或31的方法,其中所述接头包含seq id no:57的氨基酸序列。34.权利要求30或31的方法,其中所述接头由seq id no:57的氨基酸序列组成。35.权利要求1-34中任一项的方法,其中所述免疫调节部分融合至所述靶向部分的c末端。36.权利要求1-34中任一项的方法,其中所述免疫调节部分融合至所述靶向部分的n末端。37.权利要求1的方法,其中所述靶向部分是包含轻链和重链的抗体,并且其中所述免疫调节部分融合至所述靶向部分的所述重链的c末端。38.权利要求1的方法,其中所述靶向部分是包含轻链和重链的抗体,并且其中所述免疫调节部分融合至所述靶向部分的所述轻链的c末端。
39.权利要求1的方法,其中所述靶向部分是特异性结合表皮生长因子受体(egfr)的抗体,其包含重链和轻链,所述重链包含与seq id no:43的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,所述轻链包含与seq id no:44的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,并且其中所述免疫调节部分包含与seq id no:56的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,并且其中所述免疫调节部分的n末端通过接头间接融合至所述重链或所述轻链的c末端,并且其中所述接头包含与seq id no:57的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。40.权利要求1的方法,其中所述靶向部分是特异性结合表皮生长因子受体(egfr)的抗体,其包含重链和轻链,所述重链包含与seq idno:43的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,所述轻链包含与seq id no:44的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,并且其中所述免疫调节部分包含与seq id no:56的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列,并且其中所述免疫调节部分的n末端通过接头间接融合至所述轻链的c末端,并且其中所述接头包含与seq id no:57的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。41.权利要求1的方法,其中所述靶向部分包含抗体,所述抗体包含重链和轻链,所述重链包含与seq id no:43的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列;所述轻链包含与seq id no:62的氨基酸序列至少95%、96%、97%、98%、99%或100%相同的氨基酸序列。42.前述权利要求中任一项的方法,其中所述癌症是实体瘤。43.权利要求42的方法,其中所述癌症选自乳腺癌、肛门癌、胰腺癌、甲状腺癌、肝癌、卵巢癌、肺癌、皮肤癌、脑癌、脊髓癌、头癌、颈癌和头颈癌。44.权利要求43的方法,其中所述癌症是头颈癌。45.权利要求44的方法,其中所述癌症是头颈鳞状细胞癌(hnscc)。46.权利要求45的方法,其中所述癌症是复发性hnscc。47.权利要求45的方法,其中所述癌症是转移性hnscc。48.权利要求45的方法,其中所述癌症是复发性和转移性hnscc。49.权利要求43的方法,其中所述癌症是肛管鳞状细胞癌(sccac)。50.权利要求49的方法,其中所述癌症是复发性sccac。51.权利要求49的方法,其中所述癌症是转移性sccac。52.权利要求49的方法,其中所述癌症是复发性和转移性sccac。53.前述权利要求中任一项的方法,其中以约100mg至500mg、100mg至400mg、100mg至300mg或100mg至200mg的剂量向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。54.前述权利要求中任一项的方法,其中以约100mg、200mg、300mg、400mg或500mg的剂量向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。55.前述权利要求中任一项的方法,其中以约200mg的剂量向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。
56.权利要求53-54中任一项的方法,其中以约400mg的剂量向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。57.前述权利要求中任一项的方法,其中每1、2、3或4周向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。58.权利要求57的方法,其中每3周向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。59.权利要求1-52中任一项的方法,其中每3周以约200mg的剂量向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。60.权利要求1-52中任一项的方法,其中每6周以约400mg的剂量向所述人类受试者施用特异性结合pd1的所述抗体或其功能片段或功能变体。61.前述权利要求中任一项的方法,其中所述融合蛋白以约50mg至2000mg、100mg至2000mg、150mg至2000mg、200mg至2000mg、300mg至2000mg、400mg至2000mg、500mg至2000mg、600mg至2000mg、700mg至2000mg、800mg至2000mg、9000mg至2000mg、1000mg至2000mg、1500mg至2000mg、50mg至100mg、50mg至500mg、50mg至400mg、50mg至300mg、50mg至200mg、50mg至100mg、100mg至500mg、100mg至400mg、100mg至300mg或100mg至200mg的剂量施用至所述人类受试者。62.前述权利要求中任一项的方法,其中所述融合蛋白以约200mg至2000mg的剂量施用至所述人类受试者。63.前述权利要求中任一项的方法,其中所述融合蛋白以约50mg、60mg、64mg、100mg、150mg、200mg、240mg、250mg、300mg、400mg、500mg、600mg、700mg、800mg、900mg、1000mg、1100mg、1200mg、1300mg、1400mg、1500mg、1600mg、1700mg、1800mg、1900或2000mg的剂量施用至所述人类受试者。64.前述权利要求中任一项的方法,其中所述融合蛋白以约64mg、240mg、800mg或1600mg的剂量施用至所述人类受试者。65.前述权利要求中任一项的方法,其中每1、2、3或4周向所述人类受试者施用所述融合蛋白。66.权利要求65的方法,其中每周向所述人类受试者施用所述融合蛋白。67.权利要求65的方法,其中每3周向所述人类受试者施用所述融合蛋白。68.权利要求1-65中任一项的方法,其中每7天向所述人类受试者施用所述融合蛋白。69.根据前述权利要求中任一项的方法,其中所述融合蛋白通过静脉内注射施用至所述人类受试者。70.前述权利要求中任一项的方法,其中所述融合蛋白与特异性结合pd1的所述抗体或其功能片段或功能变体共同施用、在特异性结合pd1的所述抗体或其功能片段或功能变体之前施用或在特异性结合pd1的所述抗体或其功能片段或功能变体之后施用。
技术总结
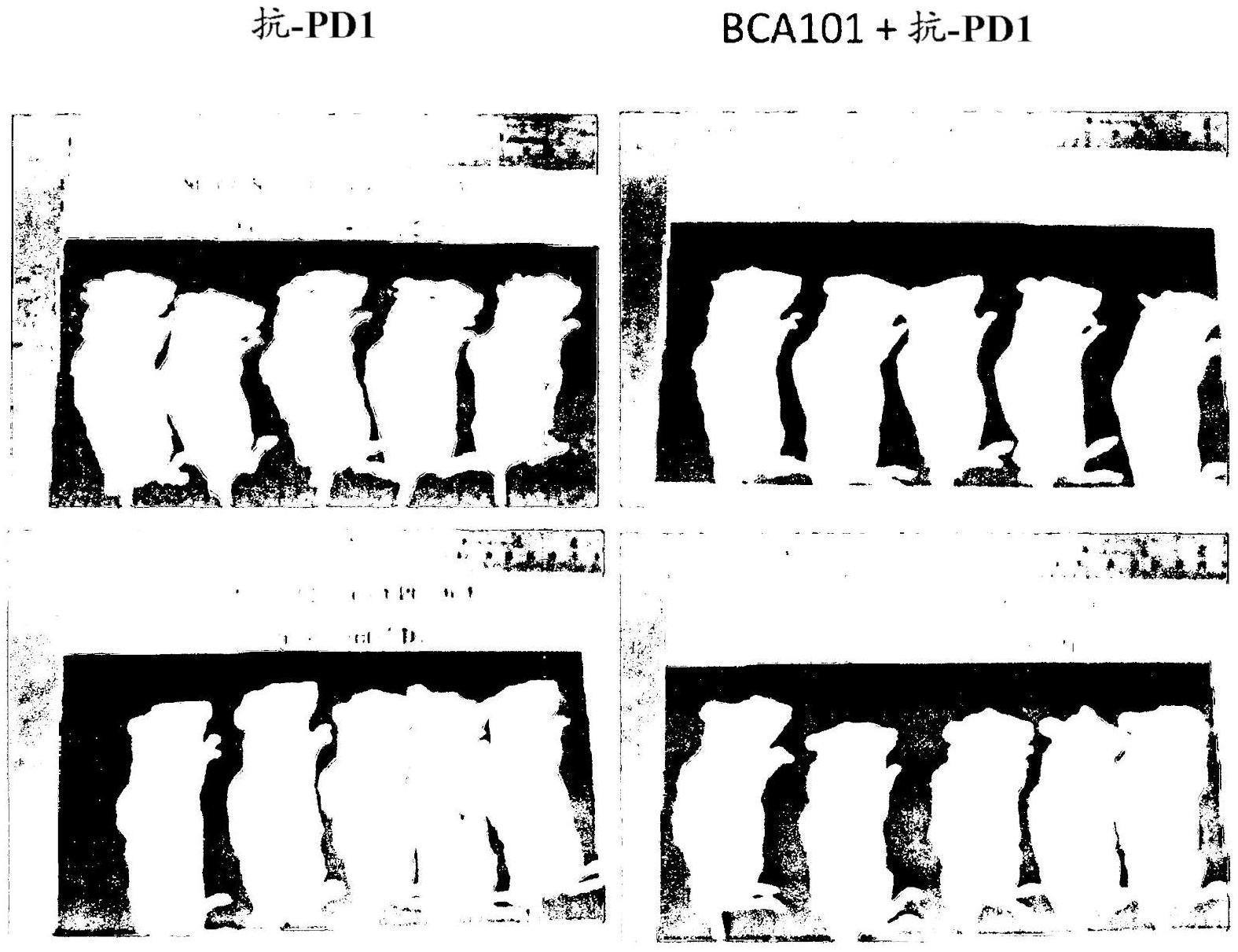
本文提供了通过向患有癌症的受试者施用特异性结合程序性细胞死亡蛋白1(PD1)的抗体或其功能片段或功能变体;以及包含靶向部分和免疫调节部分的融合蛋白来治疗癌症的方法,其中:i)所述靶向部分特异性结合表皮生长因子受体(EGFR);和(ii)所述免疫调节部分包含转化生长因子-β受体II(TGFβRII)的胞外结构域的氨基酸序列。基酸序列。基酸序列。
技术研发人员:S
受保护的技术使用者:比卡拉治疗股份有限公司
技术研发日:2021.12.15
技术公布日:2023/10/25
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。