检测牛细小病毒3型的实时pcr方法
1.本技术要求2020年12月17日提交的美国临时申请号63/126,939和2021年6月17日提交的美国临时申请号63/211,607的权益,将二者整体通过引用并出于所有目的特此并入,如同在本文中完全阐述本技术连同电子格式的序列表一起提交。
2.序列表以标题为a-2741-wo-pct_st25.txt的文件提供,该文件创建于2021年12月9日,大小为6kb。电子格式的序列表中的信息通过引用以其全文并入本文。
技术领域
3.本发明涉及生物药剂制造领域。具体来说,本发明提供了一种带有任选的内部对照的pcr测定,其用于定性或定量检测测试样本的经提取的dna中的牛细小病毒(bovine parvovirus)3型(bpv-3)基因组dna污染。
背景技术:
4.使用细胞培养方法制造治疗性生物学药物具有传播病毒污染物的固有风险。此类污染物可能来自多种来源,包括材料和设备、在制造期间使用动物来源的试剂、以及通过由于gmp过程中的缺失对制造系统造成的污染。动物源性原料(诸如牛血清(fbs))有时用作基于细胞培养的制造方法中的组分并且是生物制造过程中牛源性病毒污染的主要来源之一。为了符合监管卫生要求,以确保在来源于哺乳动物细胞的生物治疗药中不含外源因子,生物制造商需要采取措施检测、去除和/或灭活病毒污染。可以在使用前对原料测试病毒污染并采取补救措施。根据正在制造的生物分子,可以为下游纯化工艺增设专门的病毒灭活和去除步骤以确保生物治疗药的病毒安全性。
5.细小病毒科(parvoviridae)包括单链dna(ssdna)病毒,其衣壳较小、无包膜,呈t=1二十面体对称,这些病毒统称为细小病毒。其直径范围介于18-26nm之间。病毒衣壳包裹一个约5kb的基因组,该基因组编码两种主要的蛋白质,即非结构(ns)蛋白和结构衣壳(vp)蛋白。细小病毒科病毒感染多种宿主且分为两个亚科:细小病毒亚科(parvovirinae)和浓病毒亚科(densovirinae),二者分别感染脊椎动物和节肢动物宿主。
6.牛细小病毒3型(bpv-3)属于细小病毒亚科、红细胞细小病毒(erythroparvovirus)属(有蹄类红细胞细小病毒(ungulate erythroparvovirus)1型物种)。尽管已知bpv-3感染牛类,但其发病机制和临床表现仍不清楚。
7.根据美国联邦法规中的测试要求(9cfr113),需要通过以下方式来评估在生物制剂生产中使用的动物源性成分中是否存在某些病毒:在特定指示细胞上孵育动物源性原料,且随后观察病毒诱发的细胞病变效应并通过血细胞吸附或抗体荧光进行测试。在牛细小病毒中,bpv-1能够在至少一种选定的指示细胞系中复制并且可以通过9cfr 113测试来检测。
8.然而,迄今为止尚未确定支持bpv-3复制的允许细胞系(permissive cell line),因此,无法通过常规9cfr 113测试来检测bpv-3。尽管数年前已通过下一代测序(ngs)检测bpv-3,但它仍是一种可获得信息有限的新兴病毒。传统的基于细胞培养的病毒测试不能够
3)基因组dna的测定中用作内部阳性对照引物探针组合的试剂,该试剂包含引物探针组合。在相关实施例中,内部阳性对照引物探针组合具有seq id no:16、seq id no:17和seq id no:18的核酸序列。在一个实施例中,seq id no:18具有荧光报告染料和/或非荧光淬灭剂。在相关实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,该试剂包含seq id no:7、seq id no:8和seq id no:9。
13.本发明提供了一种用于检测测试样本的经提取的dna中的牛细小病毒3型基因组dna的引物探针组合,其与用于检测牛细小病毒3型(bpv-3)基因组dna的内部阳性对照引物探针组合联合使用。在一个实施例中,该引物探针组合选自由以下各项组成的组:a)具有seq id no:1、seq id no:2和seq id no:3的核酸序列的引物探针组合;b)具有seq id no:4、seq id no:5和seq id no:6的核酸序列的引物探针组合;c)具有seq id no:7、seq id no:8和seq id no:9的核酸序列的引物探针组合;d)具有seq id no:10、seq id no:11和seq id no:12的核酸序列的引物探针组合;e)具有seq id no:13、seq id no:14和seq id no:15的核酸序列的引物探针组合;f)具有seq id no:20、seq id no:21和seq id no:22的核酸序列的引物探针组合;g)具有seq id no:23、seq id no:24和seq id no:25的核酸序列的引物探针组合;以及h)具有seq id no:26、seq id no:27和seq id no:28的核酸序列的引物探针组合。在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12或seq id no:15具有荧光报告染料和/或非荧光淬灭剂。在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:22、seq id no:25或seq id no:28中的一者或多者在5’末端具有荧光报告染料6-羧基荧光素(fam)且/或在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)或者具有zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,该引物探针组合检测测试样本中的编码牛细小病毒3型的结构衣壳(vp)蛋白和/或非结构(ns)蛋白的dna。在一个实施例中,具有seq id no:16、seq id no:17和seq id no:18的核酸序列的内部阳性对照引物探针组合与如上文所描述的用于检测测试样本中的牛细小病毒3型(bpv-3)基因组dna的引物探针组合联合使用。在相关实施例中,seq id no:20具有荧光报告染料和/或非荧光淬灭剂。在相关实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。
14.本发明提供了一种用于检测测试样本的经提取的dna中的牛细小病毒3型基因组dna的编码dna的引物探针组合,该引物探针组合包含seq id no:7、seq id no:8和seq id no:9,其与包含seq id no:16、seq id no:17和seq id no:18的内部阳性对照引物探针组合联合使用,其中seq id no:9在5’末端具有荧光报告染料6-羧基荧光素并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)非荧光淬灭剂,并且seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。
15.本发明提供了一种用于检测测试样本的经提取的dna中的牛细小病毒3型(bpv-3)基因组dna污染的试剂盒,该试剂盒包括检测编码bpv-3的dna的引物探针组合,该引物探针组合选自由以下各项组成的组:a)具有seq id no:1、seq id no:2和seq id no:3的核酸序列的引物探针组合;b)具有seq id no:4、seq id no:5和seq id no:6的核酸序列的引物探
针组合;c)具有seq id no:7、seq id no:8和seq id no:9的核酸序列的引物探针组合;d)具有seq id no:10、seq id no:11和seq id no:12的核酸序列的引物探针组合;以及e)具有seq id no:13、seq id no:14、seq id no:15的核酸序列的引物探针组合,f)具有seq id no:20、seq id no:21和seq id no:22的核酸序列的引物探针组合;g)具有seq id no:23、seq id no:24和seq id no:25的核酸序列的引物探针组合;以及h)具有seq id no:26、seq id no:27和seq id no:28的核酸序列的引物探针组合;并且任选地,具有seq id no:16、seq id no:17和seq id no:18的核酸序列的内部阳性对照引物探针组合。在一个实施例中,该试剂盒包括检测编码bpv-3的dna的引物探针组合,该引物探针组合选自由以下各项组成的组:a)具有seq id no:1、seq id no:2和seq id no:3的核酸序列的引物探针组合;b)具有seq id no:4、seq id no:5和seq id no:6的核酸序列的引物探针组合;c)具有seq id no:7、seq id no:8和seq id no:9的核酸序列的引物探针组合;d)具有seq id no:10、seq id no:11和seq id no:12的核酸序列的引物探针组合;以及e)具有seq id no:13、seq id no:14和seq id no:15的核酸序列的引物探针组合;f)具有seq id no:20、seq id no:21和seq id no:22的核酸序列的引物探针组合;g)具有seq id no:23、seq id no:24和seq id no:25的核酸序列的引物探针组合;以及h)具有seq id no:26、seq id no:27和seq id no:28的核酸序列的引物探针组合;以及具有seq id no:16、seq id no:17和seq id no:18的核酸序列的内部阳性对照引物探针组合。
16.本发明提供了一种用于确定测试样本的经提取的dna中是否存在牛细小病毒3型基因组dna的方法,该方法包括1)包含以下各项的反应混合物:测试样本,阳性对照,bpv-3_ipc阳性对照质粒dna,核酸扩增试剂,具有seq id no:16、seq id no:17和seq id no:18的核酸序列的内部阳性对照引物探针组合,以及对牛细小病毒3型的dna序列具有选择性的引物探针组合,其中seq id no:18在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂,该对牛细小病毒3型的dna序列具有选择性的引物探针组合选自由以下各项组成的组:a)具有seq id no:1、seq id no:2和seq id no:3的核酸序列的引物探针组合,其中seq id no:3在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;b)具有seq id no:4、seq id no:5和seq id no:6的核酸序列的引物探针组合,其中seq id no:6在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;c)具有seq id no:7、seq id no:8和seq id no:9的核酸序列的引物探针组合,其中seq id no:9在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;d)具有seq id no:10、seq id no:11和seq id no:12的核酸序列的引物探针组合,其中seq id no:12在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;e)具有seq id no:13、seq id no:14和seq id no:15的核酸序列的引物探针组合,其中seq id no:15在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;g)具有seq id no:23、seq id no:24和seq id no:25的核酸序列的引物探针组合,其中seq id no:25在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;以及h)具有seq id no:26、seq id no:27和seq id no:28的核酸序列的引物探针组合,其中seq id no:28在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;2)对该反应混合物进行定量pcr技术以获得目标序列的拷贝,2)对该反应混合物进行定量pcr技术以获得目标序列的拷贝,3)测量任何荧光信号增加,其中荧光信号增加表明该测试样本中存在牛细小病毒3型基因组dna。在一个实施例中,该荧光报告染料是6-羧基荧光素(fam)并且该非荧光淬灭剂是小
沟结合剂-非荧光淬灭剂(mgb-nfq)或是zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,本发明进一步包括一个或多个阴性提取对照、无模板对照、阳性提取对照、阳性对照和/或抑制对照。在一个实施例中,检测的灵敏度或分析限是每个反应22个基因组拷贝。在一个实施例中,样本检出限是每个反应25个基因组拷贝。在一个实施例中,对牛细小病毒3型的dna序列具有选择性的引物探针组合检测编码牛细小病毒3型的非结构(ns)蛋白和/或结构衣壳(vp)蛋白的基因组dna。在一个实施例中,对牛细小病毒3型的dna序列具有选择性的引物探针组合扩增144bp片段。在一个实施例中,对牛细小病毒3型的dna序列具有选择性的引物探针组合包含seq id no:7、seq id no:8和seq id no:9的组合,其中seq id no:9在5’末端具有6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,该方法进一步包括内部阳性对照引物探针组合。在相关实施例中,该引物探针组合具有seq id no:16、seq id no:17和seq id no:18的核酸序列。在相关实施例中,seq id no:18具有荧光报告染料和/或非荧光淬灭剂。在相关实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。
17.本发明提供了一种在pcr反应中定量1e3至1e8个基因组拷贝的牛细小病毒3型基因组dna的方法,该方法包括1)包含以下各项的反应混合物:测试样本的经提取的dna,阳性对照,bpv-3_ipc阳性对照质粒dna,核酸扩增试剂,具有seq id no:16、seq id no:17和seq id no:18的核酸序列的内部阳性对照引物探针组合,以及对牛细小病毒3型的dna序列具有选择性的引物探针组合,其中seq id no:18在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂,该对牛细小病毒3型的dna序列具有选择性的引物探针组合选自由以下各项组成的组:a)具有seq id no:1、seq id no:2和seq id no:3的核酸序列的引物探针组合,其中seq id no:3在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;b)具有seq id no:4、seq id no:5和seq id no:6的核酸序列的引物探针组合,其中seq id no:6在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;c)具有seq id no:7、seq id no:8和seq id no:9的核酸序列的引物探针组合,其中seq id no:9在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;d)具有seq id no:10、seq id no:11和seq id no:12的核酸序列的引物探针组合,其中seq id no:12在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;e)具有seq id no:13、seq id no:14和seq id no:15的核酸序列的引物探针组合,其中seq id no:15在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;f)具有seq id no:20、seq id no:21和seq id no:22的核酸序列的引物探针组合,其中seq id no:22在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;g)具有seq id no:23、seq id no:24和seq id no:25的核酸序列的引物探针组合,其中seq id no:25在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;以及h)具有seq id no:26、seq id no:27和seq id no:28的核酸序列的引物探针组合,其中seq id no:28在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;2)对该反应混合物进行定量pcr技术以获得目标序列的拷贝,以及3)测量任何荧光信号增加。在一个实施例中,该方法的检出限(lod95%)是每个反应27个基因组拷贝的牛细小病毒3型基因组dna且95%置信区间为每个反应22个至34个基因组拷贝。在一个实施例中,该方法的线性相关系数(r2)≥0.98且pcr扩增效率在90%-110%内。在一个实施例中,该方法具有数量%cv等于或小于25%的重复性
值。在一个实施例中,该方法具有数量%cv等于或小于30%的中间精密度值。在一个实施例中,该方法在测定的整个动态范围内具有在可接受参考值(st)的
±
30%内的准确度值。在一个实施例中,该方法具有如下定量限:重复性的数量%cv≤25%,中间精密度≤30%且准确度的接受准则在预期标准参考值的
±
30%内。在另一个实施例中,该方法具有稳健性,其重复性的数量%cv≤25%,中间精密度≤30%并且所测试组合矩阵条件的数量平均值的准确度在最佳化条件的数量平均值的
±
30%内。在另一个实施例中,该方法包括无模板对照、阳性对照、阴性提取对照、阳性提取对照、抑制对照、内部阳性对照和标准品中的一者或多者。
附图说明
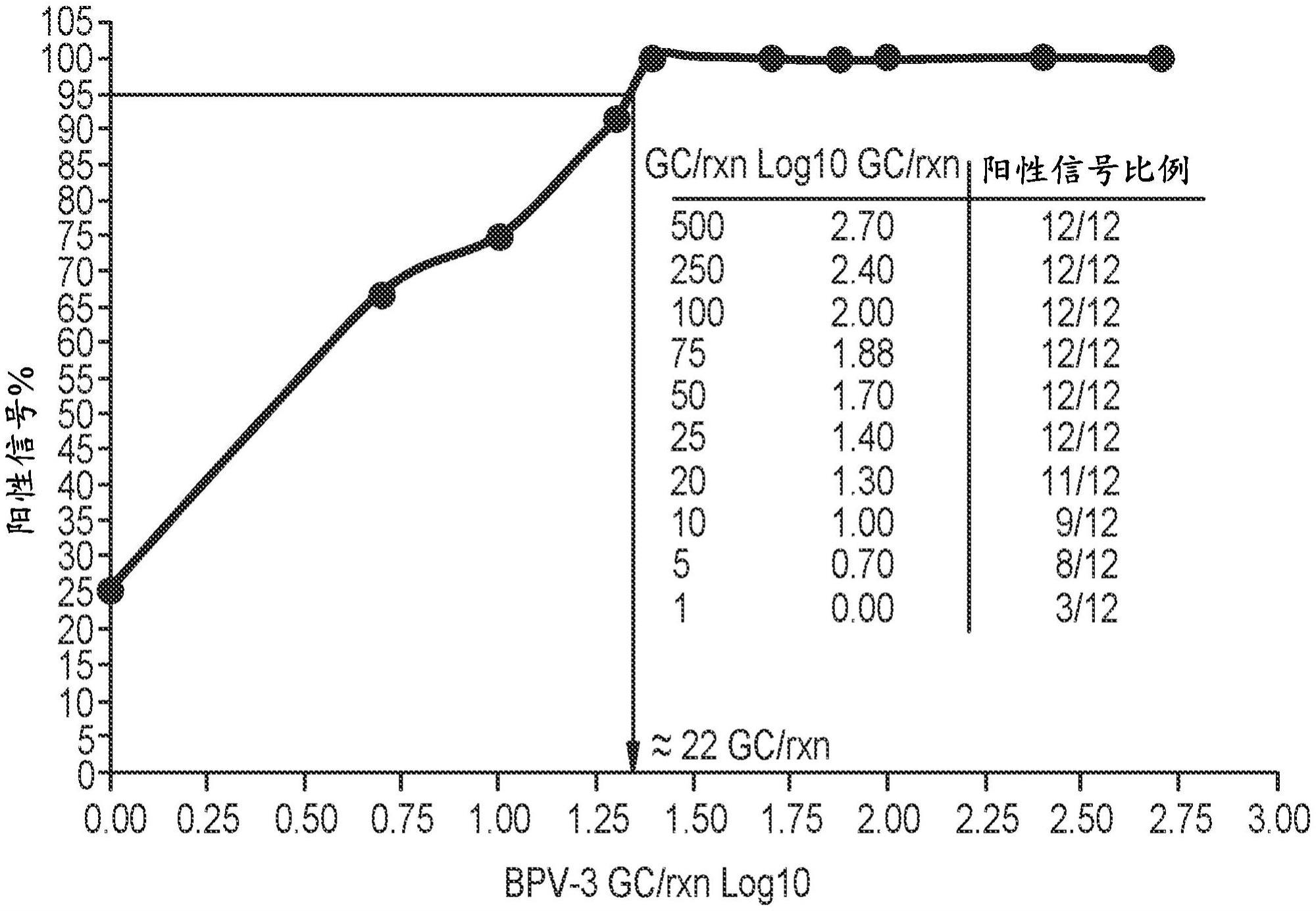
18.图1.用于以95%概率(lod95%)在bpv-3qpcr中确定alod的probit分析。
19.图2.pod图形和lod95%分析结果。
具体实施方式
20.如本文所描述,已开发出一种检测经提取的测试样本中可能存在的牛细小病毒3型(bpv-3)基因组dna污染的定性实时prc方法。使用鉴定参数(包括特异性、检出限(lod)、稳健性和重复性)来测试并证实该测定的性能。
21.该测定利用最佳化引物探针组合来检测测试样本的经提取的dna中的牛细小病毒3型(bpv-3)基因组dna。bpv-3pcr引物扩增编码bpv-3基因组中bpv-3非结构(ns)蛋白和/或结构衣壳(vp)蛋白的基因中的保守区。在该测定的设计和开发过程中查阅并借鉴了“method validation of u.s.environmental protection agency(epa)microbiological methods of analysis[美国国家环境保护局(epa)微生物分析方法的方法确效]”,修订版:2016年12月21日。
[0022]
本发明提供了寡核苷酸引物探针组合,这些寡核苷酸引物探针组合可以用于检测方法中(诸如在定量聚合酶链反应(qpcr)技术中)来检测编码牛细小病毒3型基因组(bpv-3)的dna,且供在用于确定测试样本的经提取的dna中是否存在bpv-3的方法中使用。
[0023]
如本文所用,“寡核苷酸”是短的单链合成dna或rna分子,长度小于200个核苷酸,典型地长度在13-25个核苷酸的范围内。寡核苷酸与其互补寡核苷酸结合以形成双链体。因此,寡核苷酸常用于各种需要检测特定dna或rna序列是否存在的应用中。具体来说,寡核苷酸可用作供在聚合酶链反应(pcr)中使用的引物。合成寡核苷酸的方法是本领域已知的,生产寡核苷酸的设备可商购并且存在将按需制备定制寡核苷酸的服务提供商。寡核苷酸还可通过分解较大核酸分子来获得,或者获自天然存在的寡核苷酸,诸如微小rna。
[0024]
本发明提供了一种组合物,其包含选自由以下各项组成的组的寡核苷酸:a)具有seq id no:1、seq id no:2和seq id no:3的核酸序列的寡核苷酸;b)具有seq id no:4、seq id no:5和seq id no:6的核酸序列的寡核苷酸;c)具有seq id no:7、seq id no:8和seq id no:9的核酸序列的寡核苷酸;d)具有seq id no:10、seq id no:11和seq id no:12的核酸序列的寡核苷酸;e)具有seq id no:13、seq id no:14和seq id no:15的核酸序列的寡核苷酸,f)具有seq id no:20、seq id no:21和seq id no:22的核酸序列的寡核苷酸,g)具有seq id no:23、seq id no:24和seq id no:25的核酸序列的寡核苷酸,以及h)具有
seq id no:26、seq id no:27和seq id no:28的核酸序列的寡核苷酸。在一个实施例中,该组合物包含具有seq id no:7、seq id no:8和seq id no:9的核酸序列的寡核苷酸。
[0025]
在一个实施例中,该组合物任选地包含第二组合物,该第二组合物包含具有seq id no:16、seq id no:17和seq id no:18的序列的寡核苷酸,该第二组合物与一种或多种上文所提及的引物探针组合联合使用。在一个实施例中,该组合物包含具有seq id no:7、seq id no:8、seq id no:9、seq id no:16、seq id no:17和seq id no:18的核酸序列的寡核苷酸。在一个实施例中,该组合物包含第一组合物以及第二组合物,该第一组合物包含具有seq id no:7、seq id no:8和seq id no:9的核酸序列的寡核苷酸,该第二组合物包含具有seq id no:16、seq id no:17和seq id no:18的序列的寡核苷酸。
[0026]
在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:18、seq id no:22、seq id no:25和seq id no:28中的一者或多者可以在5’末端包括至少一种荧光报告染料且/或在3’末端包括至少一种非荧光淬灭剂。在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:18、seq id no:22、seq id no:25和seq id no:28中的一者或多者在5’末端具有至少一种荧光报告染料并且在3’末端具有至少一种非荧光淬灭剂。在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:18、seq id no:22、seq id no:25和seq id no:28中的一者或多者在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂。
[0027]
在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:18、seq id no:22、seq id no:25和seq id no:28中的一者或多者在5’末端具有选自6-羧基荧光素(fam)或2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)的荧光报告染料。在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:22、seq id no:25和seq id no:28在5’末端具有荧光报告染料6-羧基荧光素(fam)。在一个实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)。
[0028]
在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:18、seq id no:22、seq id no:25和seq id no:28中的一者或多者在3’末端具有非荧光淬灭剂。在一个实施例中,3’末端的淬灭剂选自小沟结合剂-非荧光淬灭剂(mgb-nfq)以及zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,seq id no:6、seq id no:9、seq id no:12、seq id no:15和seq id no:18中的一者或多者在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:3、seq id no:22、seq id no:25和seq id no:28中的一者或多者在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。
[0029]
在一个实施例中,seq id no:3在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,seq id no:6在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:9在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:12在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧
光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:15在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:22在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,seq id no:25在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,seq id no:28在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。
[0030]
本发明提供了一种用于检测牛细小病毒3型(bpv-3)基因组dna的试剂。该试剂可用于确定测试样本的经提取的dna中是否存在牛细小病毒3型基因组dna。
[0031]
如本文所用,“测试样本”意指需要确定是否存在bpv-3的任何经提取的dna样本。测试样本可以已知或疑似含有bpv-3。测试样本可以来自原料,诸如用于制造生物治疗药的原料。原料包括已知或疑似具有动物来源或含有来自动物来源、尤其牛来源的组分的原料或者已知或疑似与其他具有动物来源、尤其牛来源的材料有过接触的原料,包括像胎牛血清(fetal bovine serum/fetal calf serum)这样的原料。测试样本还可以来自细胞培养基、尤其含有胎牛血清的细胞培养基。培养基可以在细胞培养之前或期间获得,或者在从细胞培养操作中收获细胞培养基之后获得。在细胞培养期间可以定期采集样本,此可为一天多次、每天、在培养期间的关键时刻(尤其在培养的开始和收获时)。测试样本还可以来自在生物治疗药制造中所使用的细胞系,包括牛来源的细胞和细胞系。测试样本还可以来自在下游处理期间采集的样本(例如来自下游纯化步骤的洗脱液),样本可以取自原料药和药品。
[0032]
本发明提供了一种用于检测测试样本的经提取的dna中的牛细小病毒3型(bpv-3)基因组dna的试剂,该试剂选自由以下各项组成的组:a)具有seq id no:1、seq id no:2和seq id no:3的核酸序列的引物探针组合;b)具有seq id no:4、seq id no:5和seq id no:6的核酸序列的引物探针组合;c)具有seq id no:7、seq id no:8和seq id no:9的核酸序列的引物探针组合;d)具有seq id no:10、seq id no:11和seq id no:12的核酸序列的引物探针组合;以及e)具有seq id no:13、seq id no:14和seq id no:15的核酸序列的引物探针组合。在一个实施例中,该引物探针组合包含seq id no:7、seq id no:8和seq id no:9的核酸序列。
[0033]
在一个实施例中,该试剂任选地包含内部阳性对照引物探针组合。在一个实施例中,该试剂进一步包含内部阳性对照引物探针组合。在一个实施例中,该内部阳性对照引物探针组合包含seq id no:16、seq id no:17和seq id no:18的核酸。在一个实施例中,该试剂具有seq id no:7、seq id no:8、seq id no:9的核酸序列的引物探针组合,以及具有seq id no:16、seq id no:17和seq id no:18的核酸序列的引物探针组合。
[0034]
在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15或seq id no:18中的一者或多者可以在5’末端包括至少一种荧光报告染料且/或在3’末端包括至少一种非荧光淬灭剂。在相关实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15或seq id no:18中的一者或多者在5’末端具有至少
一种荧光报告染料并且在3’末端具有至少一种非荧光淬灭剂。在相关实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15和seq id no:18中的一者或多者在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂。
[0035]
在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15和seq id no:18中的一者或多者在5’末端具有选自6-羧基荧光素(fam)或2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)的荧光报告染料。在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12和seq id no:15在5’末端具有荧光报告染料6-羧基荧光素(fam)。在一个实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)。
[0036]
在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15或seq id no:18中的一者或多者在3’末端具有非荧光淬灭剂。在一个实施例中,3’末端的淬灭剂选自小沟结合剂-非荧光淬灭剂(mgb-nfq)以及zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,seq id no:6、seq id no:9、seq id no:12、seq id no:15和seq id no:18中的一者或多者在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:3在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。
[0037]
在一个实施例中,seq id no:3在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,seq id no:6在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:9在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:12在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:15在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。
[0038]
本发明提供了靶向bpv-3的结构衣壳(vp)蛋白的引物探针组合。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3535-3554;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3667-3643;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3571-3588。在一个实施例中,该引物探针组合正向引物具有seq id no:1的核酸序列,反向引物具有seq id no:2的核酸序列,并且探针具有seq id no:3的核酸序列。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1734-1716;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1618-1645;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1665-1678。在一个实施例中,该引物探针组合正向引物具有seq id no:13的核酸序列,反向引物具有seq id no:14的核酸序列,并且探针具有seq id no:15的核酸序列。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置2862-2878;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株
的寡核苷酸位置2963-2938;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置2902-2930。在一个实施例中,该引物探针组合正向引物具有seq id no:20的核酸序列,反向引物具有seq id no:21的核酸序列,并且探针具有seq id no:22的核酸序列。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3051-3068;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3134-3114;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3079-3102。在一个实施例中,该引物探针组合正向引物具有seq id no:23的核酸序列,反向引物具有seq id no:24的核酸序列,并且探针具有seq id no:25的核酸序列。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3061-3079;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3140-3122;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3081-3103。在一个实施例中,该引物探针组合正向引物具有seq id no:26的核酸序列,反向引物具有seq id no:27的核酸序列,并且探针具有seq id no:28的核酸序列。
[0039]
本发明提供了靶向bpv-3的非结构(ns)蛋白和结构衣壳(vp)蛋白的引物探针组合。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置2190-2209;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置2256-2236;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置2213-2226。在一个实施例中,该正向引物具有seq id no:4的核酸序列,该反向引物具有seq id no:5的核酸序列,并且该探针具有seq id no:6的核酸序列。
[0040]
本发明提供了靶向bpv-3的非结构(ns)蛋白的引物探针组合。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1331-1352;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1474-1453;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1377-1391。在一个实施例中,该正向引物具有seq id no:7的核酸序列,该反向引物具有seq id no:8的核酸序列,并且该探针具有seq id no:9的核酸序列。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1453-1474;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1562-1539;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1507-1522。在一个实施例中,该正向引物具有seq id no:10的核酸序列,该反向引物具有seq id no:11的核酸序列,并且该探针具有seq id no:12的核酸序列。
[0041]
在一个实施例中,用于检测样本中的bpv-3基因组dna的试剂与内部阳性对照引物组合联合使用。本发明提供了一种用于检测测试样本的经提取的dna中的牛细小病毒3型基因组dna的编码dna的引物探针组合,该引物探针组合与包含seq id no:16、seq id no:17和seq id no:18的内部阳性对照引物探针组合联合使用。本发明提供了一种用于检测测试样本的经提取的dna中的牛细小病毒3型基因组dna的编码dna的引物探针组合,该引物探针组合包含seq id no:7、seq id no:8和seq id no:9,其与包含seq id no:16、seq id no:
17和seq id no:18的内部阳性对照引物探针组合联合使用,其中seq id no:9在5’末端具有荧光报告染料6-羧基荧光素并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)非荧光淬灭剂,并且seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:18具有荧光报告染料和/或非荧光淬灭剂。在一个实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。
[0042]
本发明提供了一种用于检测测试样本的经提取的dna中的牛细小病毒3型基因组dna的引物探针组合,其与用于检测牛细小病毒3型(bpv-3)基因组dna的内部阳性对照引物探针组合联合使用。在一个实施例中,提供了如上文所描述的用于检测牛细小病毒3型基因组dna的引物探针组合,其中该引物探针组合选自由以下各项组成的组:a)具有seq id no:1、seq id no:2和seq id no:3的核酸序列的引物探针组合;b)具有seq id no:4、seq id no:5和seq id no:6的核酸序列的引物探针组合;c)具有seq id no:7、seq id no:8和seq id no:9的核酸序列的引物探针组合;d)具有seq id no:10、seq id no:11和seq id no:12的核酸序列的引物探针组合;e)具有seq id no:13、seq id no:14和seq id no:15的核酸序列的引物探针组合;f)具有seq id no:20、seq id no:21和seq id no:22的核酸序列的引物探针组合;g)具有seq id no:23、seq id no:24和seq id no:25的核酸序列的引物探针组合;以及h)具有seq id no:26、seq id no:27和seq id no:28的核酸序列的引物探针组合。在一个实施例中,提供了引物探针组合,其中seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:22、seq id no:25和seq id no:28具有荧光报告染料和/或非荧光淬灭剂。在一个实施例中,提供了引物探针组合,其中seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:22、seq id no:25和seq id no:28中的一者或多者在5’末端具有荧光报告染料6-羧基荧光素(fam)且/或在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)或者具有zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,该引物探针组合检测测试样本中的编码牛细小病毒3型的结构衣壳(vp)蛋白和/或非结构(ns)蛋白的dna。
[0043]
在一个实施例中,一种用于检测测试样本的经提取的dna中的牛细小病毒3型(bpv-3)基因组dna的内部阳性对照引物探针组合,其与用于检测牛细小病毒3型基因组dna的引物探针组合联合使用,其中该引物探针组合具有seq id no:16、seq id no:17和seq id no:18的核酸序列。在一个实施例中,seq id no:18具有荧光报告染料和/或非荧光淬灭剂。在一个实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。
[0044]
还提供了一种用于检测测试样本的经提取的dna中的牛细小病毒3型基因组dna的引物探针组合,该引物探针组合包含seq id no:7、seq id no:8和seq id no:9,其与包含seq id no:16、seq id no:17和seq id no:18的内部阳性对照引物探针组合联合使用,其中seq id no:9在5’末端具有荧光报告染料6-羧基荧光素并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)非荧光淬灭剂,并且seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。
[0045]
本发明提供了一种用于确定测试样本的经提取的dna中是否存在牛细小病毒3型基因组dna的方法。该方法包括包含以下各项的反应混合物:测试样本的经提取的dna、核酸扩增试剂、对牛细小病毒3型基因组dna具有选择性的引物探针组合、以及任选的内部阳性对照引物探针组合;对反应混合物进行实时pcr技术(qpcr)以获得目标序列的拷贝;测量任何荧光信号增加,其中荧光信号增加表明测试样本中存在牛细小病毒3型基因组dna。本文所描述的试剂还可以用于定量测试样本中的bpv-3基因组拷贝数(例如)以确定阳性水平(即病毒载量,以每ml测试样本的病毒基因组数量表示)。
[0046]
反应混合物包含进行定量pcr技术所需的组分。标准预混液、组分混合物及诸如此类是可商购的2x 通用pcr预混液(美商应用生物系统公司(applied biosystems))。这些组分典型地包括dntp(datp、dctp、dgtp、dttp或dutp)、镁、taq dna聚合酶、缓冲液和上样染料(如果所使用的pcr热循环仪需要)。其他包括quantabio、perfecta qpcr supermix、low rox(美商量子生物科学有限公司(quantabio),美国马萨诸塞州贝弗利市)。还存在各种可商购的热循环仪。本领域技术人员将能够确定哪些符合他们的需要。
[0047]
实时pcr或qpcr是一种需要相对较少量dna、cdna或rna的技术,可以对这些dna、cdna或rna定量并且有助于随着反应的进行实时监测pcr的进程。这种pcr技术利用寡核苷酸引物与双标记寡核苷酸探针的组合。探针充当报告剂,如果被扩增,则其会随着pcr反应的每个循环而积累。
[0048]
可以使用一种或多种标记有荧光报告染料和淬灭染料的寡核苷酸探针进行扩增产物的特异性检测。此类探针是本领域技术人员已知的并且是可商购的,包括分子信标、双标记探针、fret(荧光共振能量转移)探针和探针。寡核苷酸探针可以标记有荧光报告染料和一种或多种淬灭染料。荧光报告染料的实例包括6-羧基荧光素(fam或6-fam)、2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)、tet
tm
、hex
tm
、joe、3、5、5.5、tamra、rox
tm
、lc red 610、texaslc640、sun
tm
、max
tm
、atto
tm 550、atto 647
tm
、cal fluor gold 540和orange 560、txrd(磺酰罗丹明(sulforhodamine)101-x)、quasar 570和670。荧光淬灭剂的实例包括小沟结合剂(mgb-nfq)、zen-ib、black hole(bhq 1、2和3)、tamra、iowafq和rq。
[0049]
例如,双标记探针可以在5’末端标记有一种或多种荧光报告染料,该染料在互补目标存在时发出荧光;并且在3’末端标记有一种或多种非荧光淬灭剂。双标记探针被设计为与两种引物之间的模板杂交并与具有固有5’至3’内切核酸酶活性的dna聚合酶结合使用。当探针完整时,报告染料的荧光因接近淬灭剂而淬灭。在每个pcr循环的延伸阶段期间,dna聚合酶的5’外切核酸酶活性切割退火的探针,从探针释放报告染料,从而导致荧光增加。此荧光增加与反应中存在的经扩增目标dna的量成正比。在整个pcr反应过程中持续监测荧光。在pcr反应的早期循环期间,荧光量低于仪器的检测阈值。继续监测荧光信号,记录检测到荧光的第一个pcr循环。反应开始时样本中存在的目标dna越多,越早检测到荧光,其与样本目标dna数量成反比。
[0050]
在一个实施例中,对牛细小病毒3型的dna序列具有选择性的引物探针组合扩增144bp片段。在一个实施例中,具有seq id no:7、seq id no:8和seq id no:9的核酸序列的引物探针组合扩增144
[0051]
bp片段。
[0052]
该反应混合物还包含对牛细小病毒3型的dna序列具有选择性的引物探针组合。在一个实施例中,该引物探针组合选自由以下各项组成的组:a)具有seq id no:1、seq id no:2和seq id no:3的核酸序列的引物探针组合,其中seq id no:3在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;b)具有seq id no:4、seq id no:5和seq id no:6的核酸序列的引物探针组合,其中seq id no:6在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;c)具有seq id no:7、seq id no:8和seq id no:9的核酸序列的引物探针组合,其中seq id no:9在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;d)具有seq id no:10、seq id no:11和seq id no:12的核酸序列的引物探针组合,其中seq id no:12在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;e)具有seq id no:13、seq id no:14和seq id no:15的核酸序列的引物探针组合,其中seq id no:15在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;f)具有seq id no:20、seq id no:21和seq id no:22的核酸序列的引物探针组合,其中seq id no:22在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;g)具有seq id no:23、seq id no:24和seq id no:25的核酸序列的引物探针组合,其中seq id no:25在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;以及f)具有seq id no:26、seq id no:27和seq id no:28的核酸序列的引物探针组合,其中seq id no:28在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂。
[0053]
在一个实施例中,该反应混合物任选地包含内部阳性对照引物探针组合。在一个实施例中,该混合物包含内部阳性对照引物探针组合。在一个实施例中,该内部阳性对照引物探针组合具有seq id no:16、seq id no:17和seq id no:18的核酸序列,其中seq id no:18在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂。
[0054]
在一个实施例中,该方法进一步包括内部阳性对照引物探针组合。在一个实施例中,该引物探针组合具有seq id no:16、seq id no:17和seq id no:18的核酸序列。在一个实施例中,seq id no:18具有荧光报告染料和/或非荧光淬灭剂。在一个实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。
[0055]
在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:18、seq id no:22、seq id no:25和seq id no:28中的一者或多者在5’末端具有选自6-羧基荧光素(fam)或2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)的荧光报告染料。在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:22、seq id no:25和seq id no:28在5’末端具有荧光报告染料6-羧基荧光素(fam)。在一个实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)。
[0056]
在一个实施例中,seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15、seq id no:18、seq id no:22、seq id no:25和seq id no:28中的一者或多者在3’末端具有非荧光淬灭剂。在一个实施例中,3’末端的淬灭剂选自小沟结合剂-非荧光淬灭剂(mgb-nfq)以及zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,seq id no:6、seq id no:9、seq id no:12、seq id no:15和seq id no:18中的一者或多者在3’末端具有
小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:3、seq id no:22、seq id no:25和seq id no:28中的一者或多者在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。
[0057]
在一个实施例中,seq id no:3在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,seq id no:6在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:9在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:12在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:15在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。在一个实施例中,seq id no:22在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,seq id no:25在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。在一个实施例中,seq id no:28在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有zen-ib与iowa black荧光淬灭剂(ibfq)。
[0058]
在一个实施例中,该引物探针组合靶向bpv-3的非结构(ns)蛋白。在一个实施例中,该引物探针组合靶向bpv-3的非结构(ns)蛋白和结构衣壳(vp)蛋白。在一个实施例中,该引物探针组合靶向bpv-3的结构衣壳(vp)蛋白。
[0059]
在一个实施例中,该引物探针组合靶向bpv-3的结构衣壳(vp)蛋白。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3535-3554;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3667-3643;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3571-3588。在一个实施例中,在该引物探针组合中,正向引物具有seq id no:1的核酸序列,反向引物具有seq id no:2的核酸序列,并且探针具有seq id no:3的核酸序列。在一个实施例中,在该引物探针组合中包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1734-1716;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1618-1645;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1665-1678。在一个实施例中,在该引物探针组合中,正向引物具有seq id no:13的核酸序列,反向引物具有seq id no:14的核酸序列,并且探针具有seq id no:15的核酸序列。在一个实施例中,在该引物探针组合中包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置2862-2878;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置2963-2938;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置2902-2930。在一个实施例中,在该引物探针组合中,正向引物具有seq id no:20的核酸序列,反向引物具有seq id no:21的核酸序列,并且探针具有seq id no:22的核酸序列。在一个实施例中,在该引物探针组合
中包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3051-3068;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3134-3114;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3079-3102。在一个实施例中,在该引物探针组合中,正向引物具有seq id no:24的核酸序列,反向引物具有seq id no:25的核酸序列,并且探针具有seq id no:26的核酸序列。在一个实施例中,在该引物探针组合中包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3061-3079;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3140-3122;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置3081-3103。在一个实施例中,在该引物探针组合中,正向引物具有seq id no:26的核酸序列,反向引物具有seq id no:27的核酸序列,并且探针具有seq id no:28的核酸序列。
[0060]
在一个实施例中,该引物探针组合靶向bpv-3的结构衣壳(vp)蛋白和非结构(ns)蛋白。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置2190-2209;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置2256-2236;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置2213-2226。在一个实施例中,该正向引物具有seq id no:4的核酸序列,该反向引物具有seq id no:5的核酸序列,并且该探针具有seq id no:6的核酸序列。
[0061]
在一个实施例中,该引物探针组合靶向bpv-3的非结构(ns)蛋白。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1331-1352;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1474-1453;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1377-1391。在一个实施例中,该正向引物具有seq id no:7的核酸序列,该反向引物具有seq id no:8的核酸序列,并且该探针具有seq id no:9的核酸序列。在一个实施例中,该引物探针组合包含正向引物,该正向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1453-1474;反向引物,该反向引物靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1562-1539;和探针,该探针靶向具有genbank登录号af406967的bpv-3分离株的寡核苷酸位置1507-1522。在一个实施例中,该正向引物具有seq id no:10的核酸序列,该反向引物具有seq id no:11的核酸序列,并且该探针具有seq id no:12的核酸序列。
[0062]
在一个实施例中,该引物探针组合包含seq id no:7、seq id no:8和seq id no:9,其与包含seq id no:16、seq id no:17和seq id no:18的内部阳性对照引物探针组合联合使用,其中seq id no:9在5’末端具有荧光报告染料6-羧基荧光素并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)非荧光淬灭剂,并且seq id no:18在5’末端具有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)。
[0063]
用于本文所描述方法中的反应混合物可以进一步包含一种或多种对照。这些对照包括下列中的一者或多者:无模板对照,其含有除dna模板外的所有pcr试剂;阴性提取对照,用于监测核酸提取期间的交叉污染并验证测定未因非特异性背景dna而产生假阳性结
果;阳性提取对照,用于评估在测试样本制备期间的dna提取性能并验证测定未产生假阴性结果;阳性对照,用于验证qpcr组分已准确地发挥作用并且产生目标序列的特异性pcr扩增信号;抑制对照,用于确定样本干扰/抑制水平;标准品,用于确定pcr效率、线性范围以及定量经提取的测试样本/对照dna中目标序列的绝对拷贝数;和/或内部阳性对照,用于监测在样本制备和测定进行期间使用的测试样本中阳性对照质粒的交叉污染。
[0064]
优先证明该测定的精密度、准确度和线性的合适水平在本文所描述的分析测定的动态范围内,尤其对于定量测定而言。测定的精密度是基于重复性(测定内(intra-assay)精密度)和中间精密度(实验室内精密度)。重复性是由同一分析者、在同一实验室内、使用同一设备、在相同的样本上在短时间内使用同一方法获得的结果的变异系数(cv)。为了确定测定的重复性,从相应浓度的各组pcr反应中计算数量(每个反应的目标序列的基因组拷贝,gc/rxn)的平均值和标准差(stddev)以及数量%cv。中间精密度解释了固有可变性,诸如不同分析者、不同检测系统、不同时间。为了确定测定的中间精密度,在一段时间段内从独立实验的所有相应浓度的所有组pcr反应中计算数量的平均值和stddev以及数量%cv。
[0065]
准确度(也称为正确度)比较了从一系列样本(诸如具有所定义浓度的阳性对照质粒)获得的值与实际值或参考值(称为标准(st)参考值)。为了确定测定的准确度,从相应浓度的各组pcr反应中计算数量平均值(每个反应的目标序列的基因组拷贝,gc/rxn)。
[0066]
定量qpcr测定的定量限(loq)是能够以合适的精密度(重复性和中间精密度)和准确度定量地确定的样本中目标序列的最低量。为了确定loq,测试了范围最低值、范围最高值和一些范围中间值。制备范围最低值、范围中间值和范围最高值浓度的阳性对照质粒并加标至经提取的外源dna中,并且在标准曲线存在下在适当数量的重复中进行定量,优选地由不同分析者在不同日期进行测定。
[0067]
测定的检出限(lod)或灵敏度是通过测定能检测到的目标序列的最低量,但不必定量为精确值。
[0068]
可以根据youden和steiner的方法(youden,steiner,statistical manual of the association of official analytical chemists[美国官方分析化学家协会统计手册],association of official analytical chemists[美国官方分析化学家协会]编,阿林顿市,1975,第33-36、70-71、82083页)来确定测定的稳健性。例如,可以评估某些关键试剂浓度的变化。可以选择某些关键pcr因素并加以轻微变化。接受准则将要求,针对所应用的微小变化从任何稳健性条件获得的响应应符合建立的测定接受准则。
[0069]
本发明提供了一种用于定量测试样本的经提取的dna中的牛细小病毒3型基因组dna的测定。在一个实施例中,提供了一种用于在pcr反应中定量1e3至1e8个基因组拷贝的牛细小病毒3型基因组dna的测定。
[0070]
本发明提供了一种在pcr反应中定量1e3至1e8个基因组拷贝的牛细小病毒3型基因组dna的方法,该方法包括1)包含以下各项的反应混合物:测试样本的经提取的dna,阳性对照,bpv-3_ipc阳性对照质粒dna,核酸扩增试剂,具有seq id no:16、seq id no:17和seq id no:18的核酸序列的内部阳性对照引物探针组合,以及对牛细小病毒3型的dna序列具有选择性的引物探针组合,其中seq id no:18在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂,该对牛细小病毒3型的dna序列具有选择性的引物探针组合选自由以下各项组成的组:a)具有seq id no:1、seq id no:2和seq id no:3的核酸序列的引物探针组合,
其中seq id no:3在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;b)具有seq id no:4、seq id no:5和seq id no:6的核酸序列的引物探针组合,其中seq id no:6在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;c)具有seq id no:7、seq id no:8和seq id no:9的核酸序列的引物探针组合,其中seq id no:9在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;d)具有seq id no:10、seq id no:11和seq id no:12的核酸序列的引物探针组合,其中seq id no:12在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;e)具有seq id no:13、seq id no:14和seq id no:15的核酸序列的引物探针组合,其中seq id no:15在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;f)具有seq id no:13、seq id no:20和seq id no:21的核酸序列的引物探针组合,其中seq id no:21在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;g)具有seq id no:23、seq id no:24和seq id no:25的核酸序列的引物探针组合,其中seq id no:25在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;以及h)具有seq id no:26、seq id no:27和seq id no:28的核酸序列的引物探针组合,其中seq id no:28在5’末端具有荧光报告染料并且在3’末端具有非荧光淬灭剂;2)对该反应混合物进行定量pcr技术以获得目标序列的拷贝,以及3)测量任何荧光信号增加。
[0071]
在一个实施例中,动态范围是1e3至1e8 gc/rxn。在一个实施例中,定量下限是1e3 gc/rxn。在一个实施例中,定量上限是1e8gc/rxn。在一个实施例中,定量测定的检出限(lod95%)为每个反应27个基因组拷贝且95%置信区间为每个反应22个至34个基因组拷贝。在一个实施例中,该测定的线性相关系数(r2)≥0.98且pcr扩增效率在90%-110%内。在一个实施例中,该测定具有数量%cv等于或小于25%的重复性值。在一个实施例中,该测定具有数量%cv等于或小于30%的中间精密度值。在一个实施例中,该测定在该测定的整个动态范围内具有在可接受参考值(st)的
±
30%内的准确度值。在一个实施例中,该测定具有如下定量限:重复性的数量%cv≤25%,中间精密度≤30%并且准确度的接受准则(范围最低值、范围中间值和范围最高值)在预期标准(st)参考值的
±
30%内。在一个实施例中,该测定具有稳健性,其重复性的数量%cv≤25%,中间精密度≤30%并且所测试组合矩阵条件的数量平均值的准确度在最佳化条件的数量平均值的
±
30%内。
[0072]
本发明提供了一种用于检测测试样本的经提取的dna中的牛细小病毒3型(bpv-3)基因组dna污染的试剂盒,该试剂盒包括检测编码bpv-3的dna的引物探针组合,该引物探针组合选自由以下各项组成的组:a)具有seq id no:1、seq id no:2和seq id no:3的核酸序列的引物探针组合;b)具有seq id no:4、seq id no:5和seq id no:6的核酸序列的引物探针组合;c)具有seq id no:7、seq id no:8和seq id no:9的核酸序列的引物探针组合;d)具有seq id no:10、seq id no:11和seq id no:12的核酸序列的引物探针组合;e)具有seq id no:13、seq id no:14和seq id no:15的核酸序列的引物探针组合;f)具有seq id no:20、seq id no:21和seq id no:22的核酸序列的引物探针组合;g)具有seq id no:23、seq id no:24和seq id no:25的核酸序列的引物探针组合;以及g)具有seq id no:26、seq id no:27和seq id no:28的核酸序列的引物探针组合;并且任选地,具有seq id no:16、seq id no:17和seq id no:18的核酸序列的内部阳性对照引物探针组合。
[0073]
尽管在本技术中使用的术语是本领域中的标准术语,但本文提供了某些术语的定义以确保权利要求的含义的清楚性和确定性。单位、前缀和符号可以用它们的国际单位制
(si)接受形式表示。本文列举的数值范围包括限定该范围的数值并且包括并支持所限定范围内的每个整数。除非另外指示,否则本文所描述的方法及技术通常根据本领域中熟知的常规方法且如贯穿本说明书所援引及论述的各种通用及更特定参考文献中所描述来进行。在本技术中所引用的所有文件或文件的部分(包括但不限于专利、专利申请、论文、书籍和专著)均特此通过引用清楚地并入。
[0074]
本发明在范围上不受本文所描述的特定实施例的限制,这些特定实施例旨在作为本发明各个方面的单个说明,并且功能上等效的方法和组分在本发明的范围内。实际上,根据前述说明和附图,除了本文中所显示和描述的那些情形之外的本发明的各种修改对于本领域技术人员将变得显而易见。此类修改旨在包含在所附权利要求的范围内。在本发明的一个方面或实施例中描述的内容可以与本发明的其他方面和/或实施例组合。
[0075]
以下实例(包括所进行的实验和所实现的结果)仅用于说明目的而提供,并且不应解释为限制所附权利要求的范围。
[0076]
实例
[0077]
实例1bpv-3引物/探针组开发
[0078]
为了定位bpv-3基因组上的保守区,从genbank中检索了所有已发布的bpv-3分离株全长基因组序列(表1)。
[0079]
表1.genbank登录号。
[0080][0081]
进行了多次比对并选择了编码bpv-3非结构(ns)蛋白和结构衣壳(vp)蛋白的基因中的不同保守区,并且使用这些保守区来设计八种不同的引物/探针组(bpv-3v1.0-bpv-3v8.0)。这些探针在5’末端标记有荧光报告染料6-羧基荧光素(fam)并且在3’末端标记有小沟结合剂-非荧光淬灭剂(mgb-nfq)或者标记有zen-ib与iowa black荧光淬灭剂(ibfq)(美商应用生物系统公司,加利福尼亚州卡尔斯巴德市或美商集成dna技术有限公司(integrated dna technologies,inc.),美国爱荷华州克拉尔维尔市)。表2提供了探针与引物组的寡核苷酸位置和序列。合成了引物/探针组并且使用5种对数浓度范围的阳性对照质粒(1e7至1e3)进行了6个重复测试。
[0082]
表2.bpv-3v3.0所使用的引物和探针序列。探针/引物的寡核苷酸位置是基于bpv-3分离株genbank登录号af406967。
[0083]
[0084]
[0085][0086]
基于lod、动态范围、pcr效率和r2值,选择bpv-3v3.0用于测定的开发和鉴定。这些引物扩增bpv 3的144bp片段。该探针在5’末端具有荧光报告染料6-羧基荧光素(fam)并且在3’末端具有小沟结合剂-非荧光淬灭剂(mgb-nfq)(美商应用生物系统公司,加利福尼亚
州卡尔斯巴德市)。通过计算机分析,经设计的bpv-3v3.0引物/探针序列与细小病毒亚科序列的全部五个序列均完全匹配。与其他细小病毒的多重比对未产生匹配,表明该引物探针组合的序列对bpv-3具有特异性。
[0087]
内部阳性对照引物/探针组和bpv-3_ipc阳性对照质粒dna
[0088]
设计内部阳性对照(ipc)来监测提取效率以及加标阳性对照质粒与测试样本的经提取的dna之间的任何意外交叉污染。ipc探针(ipc v2.0)在5’末端标记有荧光报告染料2
’‑
氯-7’苯基-1,4-二氯-6-羧基-荧光素(vic)并且在3’末端标记有小沟结合剂-非荧光淬灭剂(mgb-nfq)(美商应用生物系统公司,加利福尼亚州卡尔斯巴德市)。ipc引物/探针组扩增67-bp片段,以便于将其与bpv-3引物/探针区分开。表3提供了探针与引物的寡核苷酸功能和序列。该探针/引物组用于bpv-3测定的进一步开发和鉴定。
[0089]
表3.ipc v2.0所使用的引物和探针序列。
[0090][0091]
为了生成bpv-3_ipc阳性对照质粒dna,合成了bpv-3和ipc的目标序列并克隆到puc57载体中。阳性对照序列的5’末端携带bpv-3目标基因组并且阳性对照序列的3’末端携带ipc目标序列。因此,阳性对照质粒同时携带bpv-3序列和ipc序列,其充当bpv-3阳性对照和内部阳性对照以监测提取效率和任何意外交叉污染。阳性对照dna的序列示于表4中。
[0092]
表4.bpv-3_ipc阳性对照质粒dna。
[0093][0094]
实例2 bpv-3定性测定
[0095]
样本制备
[0096]
对于含有细胞的测试样本,在dna提取前将样本于室温下以320
×
g至1000
×
g进行低速离心(lsc)10分钟。收集上清液用于dna提取。无细胞样本直接处理。
[0097]
向250μl测试样本中添加10μl的rnase cocktail
tm
酶混合物(美商赛默飞世尔科技
公司(thermo fisher),加利福尼亚州卡尔斯巴德市)与0.5m edta(ph 8.0)的(9μl:1μl)混合物。使用automate express
tm
核酸提取系统(美商赛默飞世尔科技公司(thermofisher))从测试样本中提取dna。在automate上,为dna提取程序选择prepseq(ps)express 1-2-3方案,其参数如下:1小时蛋白酶k(pk)消化和100μl洗脱。
[0098]
对经提取的dna进行目视检查,且如果经洗脱的dna中存在任何残留磁珠,则使用dynamag
tm-2磁力架台式工作站(美商赛默飞世尔科技公司)去除经洗脱的dna中的任何残留磁珠。dna立即使用或储存在-30℃下。
[0099]
除了从测试样本中提取的dna外,还如上文所描述制备并运行bpv-3_ipc(pec)质粒对照和阴性提取对照(nec)。对于阳性提取对照,用62,000个基因组拷贝(gc)bpv-3_ipc质粒dna对250μl无菌1x磷酸盐缓冲盐水(pbs)加标。使用阳性提取对照来评估样本制备期间的dna提取效率。假设dna提取效率为100%,则最终洗脱的dna应含有500gc/μl。阴性提取对照含有250μl无菌1
×
pbs。阴性提取对照用于监测核酸提取期间可能发生的任何意外交叉污染。
[0100]
其他bpv-3检测测定对照的制备
[0101]
无模板对照(ntc):无模板对照含有除dna模板外的所有pcr试剂。此对照用作阴性对照以验证qpcr原料没有任何dna污染。
[0102]
阳性对照(pc):阳性对照含有2000gc/反应的bpv-3_ipc重组质粒dna。阳性对照用于验证测定的准确度。
[0103]
抑制对照(ihn):抑制对照用于监测pcr扩增和由测试样本基质产生的干扰或抑制水平。用与阳性对照相同量的bpv-3_ipc质粒(2000gc/反应)对从测试样本中最终提取的dna加标( s)。ct(循环阈值)是荧光信号超过阈值(即超出背景水平)所需的循环数。将抑制对照( s)的平均循环阈值(ct)值与阳性对照的平均ct值进行比较以作为干扰或抑制的量度。δct值应小于3.32ct(等于1log dna浓度)。将抑制或干扰计算为δct=|pc(平均ct)-ihn(平均ct)。
[0104]
bpv-3qpcr和ipc qpcr检测测定设置
[0105]
制备了两种不同的预混液:用于bpv_3ppcr测定的bpv-3qpcr预混液和用于ipc qpcr测定的ipc qpcr预混液。
[0106]
bpv-3qpcr检测测定设置含有bpv-3v3.0引物/探针组以检测从测试样本中提取的dna中的bpv-3dna。bpv-3qpcr预混液包含bpv-3v3.0引物-探针组、水和2x通用pcr预混液(美商应用生物系统公司)。2x通用pcr预混液含有qpcr反应的基本组分,包括用于扩增富含g/c的序列的最佳化缓冲液、含dutp的dntp、amplitaq gold
tm dna聚合酶、rox染料(作为钝态内参)和amperase
tm ung(用于消除含有du的残留污染pcr产物的尿嘧啶-dna糖基化酶)。
[0107]
表5提供了在bpv-3 qpcr反应中每个经测试的样本的每个反应组分的量,经测试的样本为从测试样本中提取的dna以及五种对照:阴性提取对照(nec)、无模板对照(ntc)、阳性提取对照(pec)、抑制对照(ihn)和阳性对照(pc)(处于两个不同浓度:高于检出限(adl)量和检出限(dl)量)。
[0108]
表5抑制对照、阳性对照以检出限以及高于检出限进行测试
[0109][0110]
对于ipc qpcr反应,制备了ipc引物/探针预混液,其包含ipc引物-探针、水和2x通用pcr预混液(美商应用生物系统公司)。测试样本以及以下四种对照的每个反应组分的量提供于表6中:阴性提取对照、无模板对照、阳性提取对照和阳性对照(处于两个不同浓度:高于检出限(adl)量和检出限(dl)量)。
[0111]
表6ipc qpcr反应组分(定性测定)
[0112][0113]
在96孔反应板中对每个样本和对照皆至少一式三份(3个pcr反应孔)进行bpv_3qpcr反应和ipc qpcr反应。可以手动或者使用液体处理机器人(诸如qiagility hepa/uv液体处理器(德商凯杰公司(qiagen),美国马里兰州日耳曼敦市))设置反应组分。使用microamp光学96孔板(美商应用生物系统公司)容纳qpcr反应混合物并用microamp光学粘性膜(美商应用生物系统公司)覆盖。每个pcr反应中的pcr试剂组分、样本和对照的量列于表6和表7中。然后将经密封的板装入quantstudio
tm 7flex实时pcr系统(美商应用生物系统公司)中。
[0114]
使用quantstudio
tm 7flex实时pcr系统(美商应用生物系统公司)进行qpcr反应。将热循环程序设定为以下反应时间和温度:50℃2分钟,95℃ 10分钟,以及40个循环的95℃ 15秒,60℃ 1分钟(数据收集)。表7提供了所选实验属性。
[0115]
表7bpv-3qpcr与ipc qpcr的quantstudio
tm
软件实验属性。
[0116]
[0117][0118]
有效测试和测试样本评估的标准
[0119]
在评估测试样本之前,该测定必须符合系统适用性和测定接受准则方能视为有效测定。如果不符合测定接受准则,则必须重复该测定。如果测试样本有效且为阳性,则应重复该测定以证实所取得的阳性结果。bpv-3定性测定的有效测定和测试结果评估的准则概述于表8中。如果测试样本呈现阳性扩增信号,则ihn和δct对照无关紧要且不应视为系统适用性和测定接受准则的一部分。
[0120]
表8系统适用性和测定接受准则。
[0121]
[0122][0123]
测试样本结果接受准则
[0124]
如果该测定符合系统适用性和测定接受准则,则表9提供了测试样本接受准则。定性测定的结果报告为“阳性”或“阴性”。
[0125]
表9测试样本接受准则。
[0126][0127]
重复测试策略
[0128]
如果使用纯dna样本时δct不符合接受准则,则可以使用按1:2稀释的经提取的dna重复该测定。稀释将减少样本基质干扰。在这种情况下,所有样本和对照dna必须用分子生物学级水按1:2稀释之后重复该测定。
[0129]
如果测试样本显示目标ipc的阳性扩增信号,则此指示阳性对照质粒dna与测试样本的交叉污染。在这种情况下,测定是无效的并且在按照现场适用的程序实施去污后,需要重复该测定。
[0130]
实例3测试bpv3定性测定。
[0131]
特异性:样本基质效应(为了测试不存在假阳性)
[0132]
测试了三种样本基质(达尔伯克氏改良伊格尔培养基(dulbecco’smodified eagle medium,dmem)(美商赛默飞世尔科技公司)和两种胎牛血清(fbs)(safc,美国密苏里州圣路易斯市,和美商海克隆公司(hyclone),美国犹他州洛根市))以证明培养基组分与bpv-3v3.0和ipc v2.0引物/探针组之间不存在假阳性结果。测定程序和设置如实例2中所描述。
[0133]
表10显示经测试的样本以及使用bpv-3和ipc测定的qpcr测试的结果。该程序的接受准则要求,所有经测试的样本在两种引物/探针组中均显示阴性结果。当所有实施的对照和系统适用性均符合接受准则时,来自有效实验的结果揭示,所有经测试的样本均为阴性且显示无扩增信号(ct=40.00)。
[0134]
表10来自样本基质的结果。
[0135][0136]
bpv-3检测(为了测试不存在假阴性)
[0137]
由于缺少可商购bpv-3病毒原液或bpv-3基因组dna,故使用bpv-3_ipc阳性对照质粒来测试bpv-3v3.0引物/探针组的特异性。对bpv-3_ipc质粒进行测序且通过blast分析来证实bpv-3ns基因的准确度。
[0138]
使用如实例2中所描述的测定。作为特异性测试的一部分,两个胎牛血清样本和一个含有fbs的未处理非gmp批量收获物样本充当真阳性样本,这些样本经证实为bpv-3dna阳性(使用bioreliance(brel)qpcr牛细小病毒检测套装(qpcr bovine parvo panel),美商生物信赖公司(bioreliance),美国马里兰州罗克维尔市)。通过测序证实阳性对照(pc)。
[0139]
此程序的接受准则要求,所有经测试的样本在使用bpv-3测定时均显示阳性结果,并且该测定不会对先前经证实的阳性bpv-3样本产生假阴性结果。
[0140]
表11显示在pc中的bpv-3检测的结果,这些结果均符合接受准则。值得注意的是,ipc v2.0引物/探针正如预期在阳性fbs和含有fbs的未处理非gmp批量收获物样本中为阴性,并且仅在使用阳性对照质粒(bpv-3_ipc)时才产生阳性结果。ipc qpcr反应的结果正如预期且符合接受准则。
[0141]
表11真阳性样本测试的结果。
[0142][0143]
交叉反应性
[0144]
为了测试bpv-3 v3.0和ipc v2.0引物/探针组的交叉反应性的影响,使用如实例2中所描述的测定来评估来源于不同病毒和细胞系的经提取的核酸。与bpv-3最接近的可商购细小病毒是牛细小病毒1型(bpv-1)(vr-767
tm
)和小鼠微小病毒(mouse minute virus)(mmv,啮齿动物细小病毒),包括它们以测试交叉反应性。包括几种其他dna病毒以测试交叉反应性:猪圆环病毒(porcine circovirus)2型(pcv 2)、单纯疱疹病毒(herpes simplex virus)1型(hsv 1)、伪狂犬病病毒(pseudorabies virus,prv)。还测试了来自四种细胞系的dna:非洲绿猴肾细胞系(vero)、幼仓鼠肾细胞系(bhk)、中国仓鼠卵巢细胞系(cho)、msv转化的猫脑细胞系(pg 4)。如实例2中所描述来提取dna。
[0145]
使用内部特定qpcr或下一代测序(ngs)方法证实了从所有病毒中提取的核酸的准确度。
[0146]
该程序的接受准则要求,所有经测试的物种在使用bpv-3v3.0和ipc v2.0引物/探针组时均显示阴性结果(ct=40.00)。表12显示,交叉反应性测试结果揭示,所有经测试的物种均为bpv-3阴性且符合接受准则。
[0147]
表12交叉反应性测试的结果。
[0148][0149]
检出限(lod)
[0150]
bpv-3qpcr方法旨在获得定性结果,不需要证明线性。实际上,将lod确定为样本系列的阳性检出率为95%时的临界点(形式上为最小扩增目标序列数),称其为lod95%。
[0151]
为了确定该方法的灵敏度或分析检出限(alod),将bpv-3_ipc质粒dna按不同浓度(1、5、10、20、25、50、75、100、250、500gc/pcr反应)稀释。alod是目标dna的浓度,在该浓度下检测到扩增产物的概率至少为0.95(lod95%)。为了测试这一点,使用如实例2中所描述的测定在不存在样本基质的情况下评估了来自每个质粒dna浓度的12个pcr重复测量值。具有最低基因组拷贝数且全部12个重复均为阳性的浓度水平被认为是lod95%的近似值。
[0152]
使用probit分析以95%的相关概率计算bpv-3qpcr测定的alod。分析结果证明,bpv-3qpcr测定的alod约为每个反应22个基因组拷贝(图1)。
[0153]
样本检出限(slod)是在存在样本基质时用给定置信水平(lod95%)能够检测到的最小目标序列的量。以与alod实验相同的方式进行确定slod的实验;不同之处在于将不同浓度水平(25、50、75和100gc/反应)的阳性对照质粒dna加标至从不同样本基质中提取的dna中,而不是加标至分子生物学级水(mbgw)中。
[0154]
在本研究中,使用不同的样本基质,参见表13。使用qiagility液体处理器(德商凯杰公司)以每个反应25、50、75和100个基因组拷贝(bpv-3_ipc阳性对照质粒)对每个样本加标并且使用实例2中所描述的bpv-3qpcr检测测定进行测试。在12个重复中对所有样本进行评估。表14和表15呈现了slod的结果。结果揭示,bpv-3qpcr测定的slod为每个pcr反应25个基因组拷贝。ipc qpcr测定获得了类似结果(表16)。
[0155]
表13用于slod确定的基质样本。
[0156]
样本dna量fbs10μl dna/qpcr反应
vero30ng/10μl dna/qpcr反应bhk30ng/10μl dna/qpcr反应cho50ng/10μl dna/qpcr反应
[0157]
表14使用fbs和vero细胞的bpv-3测定slod结果。
[0158][0159]
表15使用bhk和cho细胞的bpv-3测定slod结果。
[0160][0161][0162]
表16使用fbs和vero细胞的ipc测定slod结果。
[0163][0164]
稳健性
[0165]
为了评估bpv-3qpcr检测测定的稳健性,测试了含有fbs的未处理非gmp批量收获物样本以及fbs样本(表17)。接受准则将符合所提出的系统适用性和测定接受准则以及样本接受准则,如实例2中所描述。预先通过诸如ngs、桑格(sanger)dna测序或bioreliance(brel)牛细小病毒检测套装qpcr测定等替代方法证实了样本为bpv-3dna阴性或阳性。
[0166]
如实例2中所描述对样本进行dna提取。制备所有对照并与测试样本平行地进行qpcr,且然后进行如实例2中所描述的bpv-3qpcr检测测定。如实例2中所描述来解释bpv-3qpcr测定的结果并报告为“阳性”或“阴性”。
[0167]
表17用于bpv-3测定稳健性评估的测试样本。
[0168][0169]
来自表17的阴性测试样本的结果显示于表18-20中。通过测定对照的结果证明了该测定的有效性,这些结果包括:在3个pcr反应重复中的3个中,ntc和nec在bpv-3和ipc测定中为阴性结果;在3个pcr反应重复中的3个中,pc在bpv-3和ipc测定中检测到目标扩增信号;在3个pcr反应重复中的3个中,pec在bpv-3和ipc测定中检测到扩增信号,表明提取回收率准确;在3个pcr反应重复中的3个中在加标测试样本( s)中检测到bpv-3以及δct结果表明无样本基质干扰。在3个pcr反应重复中的3个中,测试样本在ipc测定中为阴性,表明阳性对照与样本之间不存在交叉污染;另外,在3个pcr反应重复中的3个中,测试样本在bpv-3测定中为阴性,表明不存在bpv-3dna。总之,bpv-3测定结果表明,符合并通过测定和样本接受准则,并且测试样本有效且为bpv-3“阴性”。
[0170]
表18fbs样本的结果
[0171][0172]
表19经辐照的fbs#1的结果
[0173]
[0174][0175]
表20特级fbs的结果
[0176][0177]
阳性测试样本(两个含有fbs的未处理非gmp批量收获物样本以及两个fbs样本(fbs#2和fbs#3)的bpv-3测定结果显示于表21-24中。证明了该测定的有效性,测定对照的
结果包括以下预期结果:在3个pcr反应重复中的3个中,ntc和nec在bpv-3和ipc测定中为阴性结果;以及在3个pcr反应重复中的3个中,pc在bpv-3测定中检测到目标扩增信号。
[0178]
当测试样本显示阳性扩增信号并检测到bpv-3时,对加标测试样本(ihc)和δct的评估变得无关紧要且无需视为测定接受准则的一部分。在3个pcr反应重复中的3个中,pec在bpv-3测定和ipc测定中检测到扩增信号,表明提取回收率准确;在3个pcr反应重复中的3个中,测试样本在ipc测定中为阴性信号,表明阳性对照与样本之间不存在交叉污染。在3个pcr反应重复中的3个中,测试样本在bpv-3测定中呈现阳性扩增信号,表明存在bpv-3dna。总之,结果表明,符合并通过测定和样本接受准则,并且测试样本有效且为bpv-3阳性。
[0179]
表21未处理非gmp批量收获物样本1的结果
[0180][0181][0182]
表22未处理非gmp批量收获物样本2的结果
[0183][0184]
表23fbs#2的结果
[0185][0186]
表24fbs#3的结果
[0187]
[0188][0189]
重复性
[0190]
为了测试重复性,将从bhk和vero细胞中提取的dna(30ng/pcr反应)制成未加标的或者加标有25个基因组拷贝的bpv-3_ipc阳性对照质粒(以slod水平加标)。在不同日期的12个pcr反应重复中进行bpv-3检测测定(如实例2中所描述)。
[0191]
该程序的接受准则要求,对于经过bpv-3和ipc qpcr测定的未加标样本,12个重复中至少有11个显示无扩增信号;并且对于经过bpv-3和ipc qpcr测定的加标样本,12个样本中至少有11个显示阳性扩增信号。重复性测定的结果揭示,12个未加标样本(表25)以及加标样本(表26)中有12个符合接受准则,证明了bpv-3检测测定的重复性。
[0192]
表25关于未加标测试样本的bpv-3qpcr的重复性。
[0193][0194]
表26在两个不同日期关于加标测试样本的bpv-3qpcr结果的测定内和测定间(inter-assay)重复性。
[0195][0196]
总之,所有经测试的样本均符合定性测定所要求的鉴定规范,包括特异性、检出限、稳健性和重复性。合格的bpv-3检测测定允许稳健地检出每个pcr反应25个bpv-3基因组拷贝。所有经测试的样本均符合所提出的系统适用性和测定接受准则以及测试样本接受准则。因此,合格的bpv-3实时pcr测定允许检测测试样本中的bpv-3dna。
[0197]
实例4牛细小病毒3型(bpv-3)实时定量聚合酶链反应测定
[0198]
样本制备
[0199]
对于含有细胞的测试样本,在dna提取前将细胞于室温下以320
×
g进行低速离心(lsc)10分钟。收集上清液用于dna提取。无细胞样本直接处理。
[0200]
向250μl测试样本中添加10μl的rnase cocktail
tm
酶混合物(美商赛默飞世尔科技公司,加利福尼亚州卡尔斯巴德市)与0.5m edta(ph 8.0)的(9μl:1μl)混合物。使用automate express
tm
核酸提取系统(美商赛默飞世尔科技公司)提取200μl测试样本。在automate上,为dna提取程序选择prepseq(ps)express 1-2-3方案,其参数如下:1小时蛋白
酶k(pk)消化和100μl洗脱。对经提取的dna进行目视检查,且如果经洗脱的dna中存在任何残留磁珠,则使用dynamag
tm-2磁力架台式工作站(美商赛默飞世尔科技公司)去除经洗脱的dna中的任何残留磁珠。dna立即使用或储存在-20℃下。
[0201]
除了测试样本外,还如上文所描述制备并运行bpv-3_ipc(pec)质粒对照和阴性提取对照(nec)。对于阳性提取对照,用62,000个基因组拷贝(gc)bpv-3_ipc质粒dna对250μl无菌1x磷酸盐缓冲盐水(pbs)加标。此对照用于评估测试样本制备期间的dna提取性能并验证测定未产生假阴性结果。假设dna提取效率为100%,则最终洗脱的dna应含有500gc/μl。对于阴性提取对照,使用含约300ng人类基因组dna的1x pbs。nec用于监测核酸提取期间的交叉污染并验证测定未因非特异性背景dna而产生假阳性结果。
[0202]
其他测定对照的制备
[0203]
无模板对照(ntc):含有除dna模板外的所有pcr试剂。此对照用作阴性对照以验证qpcr原料没有任何dna污染。
[0204]
阳性对照(pc):包括三种pc浓度:2e4、2e5和2e7 gc/反应的bpv-3_ipc阳性对照质粒dna。此对照用于验证qpcr组分准确地发挥作用并且应具有目标序列的特异性pcr扩增信号。
[0205]
阳性提取对照(pec):向250μl 1
×
pbs中添加约400ng人类基因组dna(约3μl)并且此外用62,500个拷贝的bpv-3_ipc阳性对照质粒dna(6.25μl)加标,接着进行提取。
[0206]
抑制对照(ihn):含有从测试样本中提取的dna,对其用bpv-3_ipc质粒dna按2e4 gc/反应加标。此对照用于确定样本干扰/抑制水平。
[0207]
标准品(st):bpv-3_ipc质粒dna的10倍稀释液(1e8、1e7、1e6、1e5、1e4、1e3 gc/反应),其用于确定pcr效率、线性范围以及定量测试样本/对照中目标序列的绝对拷贝数。
[0208]
bpv-3qpcr和ipc qpcr检测测定设置
[0209]
bpv-3qpcr检测测定设置含有用于检测测试样本中的bpv-3dna的bpv-3v3.0引物/探针组以及用于监测阳性样本与阴性样本之间的任何意外交叉污染的ipc v2.0引物/探针组。制备了两种不同的预混液,bpv-3qpcr预混液和ipc qpcr预混液。
[0210]
bpv-3v3.0引物/探针预混液包含bpv-3v3.0引物-探针、水和2x通用pcr预混液(美商应用生物系统公司)。预混液含有qpcr反应的基本组分,包括用于扩增富含g/c的序列的最佳化缓冲液、含dutp的dntp、amplitaq gold
tm dna聚合酶、rox染料(作为钝态内参)和amperase
tm ung(用于消除含有du的残留污染pcr产物的尿嘧啶-dna糖基化酶)。表27提供了每个经测试的样本的每个反应组分的量,经测试的样本为测试样本和五种对照:阴性提取对照(nec)、无模板对照(ntc)、阳性提取对照(pec)、抑制对照(ihn)和阳性对照(pc)。
[0211]
表27bpv_3v3.0定量测定的反应组分
[0212]
[0213][0214]
在96孔反应板中一式三份(3个孔)进行样本和对照的每个反应。可以手动或使用液体处理机器人(诸如qiagility hepa/uv液体处理器(德商凯杰公司,美国马里兰州日耳曼敦市))进行qpcr反应设置。使用microamp光学96孔板(美商应用生物系统公司)容纳qpcr反应混合物且然后用microamp光学粘性膜(美商应用生物系统公司)覆盖。每个pcr反应中的pcr试剂组分、样本和对照的量列于表27和表28中。每名分析者能够设置96孔板上的样本布局,并将经密封的板装入quantstudio
tm 7flex实时pcr系统(美商应用生物科学公司(applied bioscience))中。
[0215]
使用quantstudio
tm 7flex实时pcr系统(美商应用生物科学公司)进行qpcr反应。将热循环程序设定为以下反应时间和温度:50℃2分钟(amperase
tm ung活化),95℃ 10分钟(amplitaq gold
tm dna聚合酶活化/变性),以及40个循环的95℃ 15秒,60℃ 1分钟(退火/延伸/数据收集)。表28提供了所选实验属性。
[0216]
表28bpv-3与ipc qpcr的quantstudio
tm
软件实验属性。
[0217][0218][0219]
该测定联合利用了qs7实时pcr系统(美商赛默飞世尔科技公司,马萨诸塞州沃尔
瑟姆市)与本文所描述的bpv_3和ipc引物和探针。
[0220]
该测定必须符合以下测定接受准则方能视为有效测定,参见表29。如果不符合任一测定接受准则,则应重复该测定。
[0221]
表29.有效测定接受准则
[0222]
[0223][0224]
使用excel软件(美商微软公司(microsoft),美国华盛顿州雷德蒙德市)和/或tibco 软件(美国加利福尼亚州帕洛阿尔托市)进行数据的统计分析。任何报告为“未确定”的ct值均表示不存在目标dna并转换成40.00以用于进一步的统计分析。对样本、标准品和对照品进行3个重复测试。可对来自样本、对照或标准品的ct值应用基于grubbs检验或dixon q检验的离群值规则。可对三份数据点应用离群值分析检验以确定是否可以将其中一个结果作为离群值从分析中删除。如果离群值排除是统计上显著的(显著性水平:α=0.05)并且是允许的,则使用有效的两份结果重复数据分析。基于两份数据点的结果必须符合对照和标准品的所有接受准则才有效。可以使用本领域技术人员已知的线上或线下资源来检验离群值的确定(以α为0.05的显著性水平进行双侧检验)。数据的报告和解释的实例提供于表30中。
[0225]
表30.数据的报告和解释。
[0226][0227]
实例5定量测定鉴定
[0228]
测试样本结果接受准则
[0229]
进行了定量测定的鉴定。鉴定了以下参数:特异性、检出限(lod)、线性、动态范围、精密度(包括重复性(测定内特异性)和中间精密度(实验室内精密度))、准确度、定量限(loq)和稳健性,并确定了测定验证。
[0230]
特异性:样本基质效应(为了测试不存在假阳性)
[0231]
为了证明该测定未产生假阳性结果(一种错误,其中在不存在目标序列时qpcr错误地产生阳性),测试了以下样本基质。
[0232]
所测试的细胞系:pg4(猫脑莫洛尼肉瘤病毒(moloney sarcoma virus)转化的细胞系)、vero(非洲绿猴肾细胞系)、324k(sv40转化的人新生儿肾细胞系)、l929(小鼠成纤维细胞系)、cho(中国仓鼠卵巢细胞系)、hek293(人胚胎肾细胞系)、mdbk(梅丁-达尔比(madin-darby)牛肾细胞系)、nrk(正常大鼠肾细胞系)、人白细胞系(美商普洛麦格公司(promega),美国加利福尼亚州圣路易斯奥比斯波市)。所测试的培养基:dmem、mccoy 9a、ham f12。所测试的动物血清:胎牛血清和马血清。
[0233]
接受准则要求所有经测试的样本在6个pcr重复的至少5个中显示阴性结果。在6个重复的6个中未检测到假阳性。
[0234]
特异性:bpv-3检测(为了测试不存在假阴性)
[0235]
为了证明该测定不会产生假阴性结果(一种错误,其中在存在目标序列时qpcr错误地显示为阴性),将上文所提及的细胞系、培养基和动物血清用bpv-3阳性对照质粒加标(50,000个基因组拷贝/200μl样本),接着如实例4中所描述来进行dna提取和bpv-3qpcr测定。接受准则要求6个重复中至少有5个显示阳性结果。所有经测试的样本均显示6个重复中有6个检测到bvp-3。未检测到假阴性。
[0236]
特异性:交叉反应性
[0237]
为了确定该测定的交叉反应性,评估了对近缘病毒物种/分离株的排他性和包容性。
[0238]
排他性证明了该测定未检测到与目标序列近缘的非目标病毒物种/分离株。如上文所描述来提取bpv-1(牛细小病毒1型,vr-767
tm
美国维吉尼亚州马纳萨斯市)、bpv-2(牛细小病毒2型)和mmvp(小鼠微小病毒原型)病毒。由于bpv-2无法商购,因此合成了bpv-2的全长非结构(ns)基因序列(genbank登录号:nc_006259)并将其克隆到质粒中,并且通过测序进行验证。该质粒用作bpv-2参考分离株,其浓度为每个pcr反应1e6 gc。
[0239]
将这些病毒物种/分离株用于如实例4中所描述的bpv-3qpcr测定。接受准则要求所有经测试的样本在6个重复中的至少5个中显示阴性结果。bpv-3qpcr的结果未显示与这些近缘物种的任何交叉反应性,并且符合接受准则,其中6个重复中有6个未检测到非目标物种/分离株。
[0240]
包容性证明了该测定能够特异性地检测bpv-3目标序列物种/分离株。提取先前经证实为bpv-3阳性的胎牛血清样本(通过bpv-3的全长基因组测序来证实),接着进行bpv-3qpcr测定。该程序的接受准则要求,经测试的样本在6个重复中的至少5个中显示阳性结果。bpv-3qpcr测定的结果特异性地检测到bpv-3dna并且符合接受准则,其中6个重复中有6个检测到目标分离株。
[0241]
检出限(lod)
[0242]
检出限(lod)是能检测到的目标序列的最低量,但不必定量为精确值。采用以lod95%检出限方法进行的probit分析来确定测定lod。lod95%是在qpcr测定中确保95%检测概率(pod)所要求的目标dna序列的拷贝数。
[0243]
将bpv-3阳性对照dna(1000、100、50、25、20、10、5和1个基因组拷贝/反应)加标至经提取的外源dna(约300ng人类基因组dna)中并使用如实例4中所描述的bpv-3qpcr测定进行测试。在12个pcr重复中测试每个浓度以获得统计上可靠的pod曲线,从该曲线得出具有95%置信区间(ci)的lod95%。由3名不同分析者重复该实验。任何ct值≤39.99皆视为阳性信号,并且任何未确定的ct值(ct=40.00)皆视为阴性信号。获取每个浓度的36个设定点(由所有分析者收集)来进行probit分析,以获得统计上可靠的pod曲线,从该曲线得出具有95%置信区间(ci)的lod95%,参见表31和图2。probit分析结果显示,bpv-3qpcr测定lod95%为27gc/rxn且95%置信区间为22gc/rxn至34gc/rxn。
[0244]
表31.来自所有实验的lod95%结果
[0245][0246]
动态范围和线性
[0247]
必须证明精密度、准确度和线性的合适水平在分析程序的动态范围内。为了评估标准曲线的线性、最小和最大动态(操作)范围,用具有所定义阳性对照质粒拷贝数的跨8个数量级的浓度生成了初步标准曲线并进行了评估。在bvp-3测定中对1e8、1e7、1e6、1e5、1e4、1e3、1e2和1e1个基因组拷贝/反应中的每一个使用三个重复。
[0248]
不仅根据测定的应用和预期用途,而且还根据从初步测试结果得出的可接受标准曲线性能参数,为操作范围选择最少6个数量级。对于此程序,标准曲线在6个所选数量级内(包括最大和最小设定点)的线性必须符合以下接受准则:(i)相关系数(r2)≥0.98和(ii)pcr扩增效率在90%-110%内。
[0249]
尽管在七个设定点(1e2至1e8个基因组拷贝/反应)的动态范围符合测定接受准则,但预计使用从1e2至1e8的七个设定点作为最小和最大标准范围并不稳健。因此,将更高的量级(1e3)选为定量限(loq)的下限并将标准曲线的最小和最大动态范围指定为介于1e3至1e8个基因组拷贝/反应之间的六个数据设置点(表32)。
[0250]
表32.标准曲线动态范围和性能
[0251][0252]
准确度和精密度
[0253]
确定了该测定的准确度(正确度)和精密度(重复性和中间精密度)。为了确定准确度和精密度,制备了两组独立的阳性对照质粒,其具有所限定范围的bpv-3基因组拷贝数(1e8、1e7、1e6、1e5、1e4和1e3个基因组拷贝/反应),并且在一个96孔pcr反应板中进行bvp-3测定来平行地测试。一组充当标准参考设定点,而另一组用于测定评估。由三名不同分析者在不同日期测试该程序。
[0254]
对于重复性(测定内精密度),在每个浓度下各一式三份计算数量(目标序列的基因组拷贝/反应)的平均值和标准差以及数量%cv(变异系数)。该程序的接受准则为数量%cv≤25%。
[0255]
对于中间精密度(实验室内精密度),从三个独立实验的所有浓度的所有一式三份pcr反应中计算数量的平均值和标准差以及%cv。接受准则为数量%cv≤30%。
[0256]
对于准确度(解释了进行测定的不同分析者、不同检测系统以及在不同时间/时间进行的测定的固有可变性),从每个浓度(1e8、1e7、1e6、1e5、1e4和1e3)的各一式三份pcr反应中计算数量平均值(目标序列的基因组拷贝/反应)。接受准则为针对上述每个样本浓度计算的数量%cv。接受准则为在测定的整个动态范围内定量平均值在参考值的
±
30%内。该程序的接受准则还要求每个独立实验的线性必须显示相关系数(r2)≥0.98且pcr扩增效率在90%-110%内。
[0257]
3次独立运行的结果表明,该测定符合建立的线性接受准则,参见表33-36。重复性≤25%,中间精密度≤25%且准确度在
±
30%内。线性也在可接受准则内,其相关系数(r2)≥0.98且pcr扩增效率在90%-110%内。
[0258]
表33.运行#1:第一次实验的重复性和准确度符合接受准则。
[0259][0260][0261]
表34.运行#2:第二次实验的重复性和准确度符合接受准则。
[0262][0263][0264]
*该值为按照迪克森q检验法(dixon’s q test)的离群值且从数据分析中排除。
[0265]
表35.运行#3:第三次实验的重复性和准确度符合接受准则。
[0266][0267]
表36.基于不同分析者的3次独立运行(运行#1、2和3)的中间精密度结果。
[0268][0269]
定量限
[0270]
定量qpcr测定的定量限(loq)是能够以合适的精密度和准确度定量地确定的样本中目标序列的最低量。为了确定loq,测试了动态范围的下限设定点(1e3个基因组拷贝/反应)、中间设定点(1e4与1e6个基因组拷贝/反应)和上限设定点(1e8个基因组拷贝/反应)。制备浓度为动态范围的下限设定点、中间设定点和上限设定点的阳性对照样本并加标至经提取的外源dna样本中(约300ng人类基因组dna/反应,充当背景样本基质dna),并且在标准曲线存在下在12个重复中进行bvp-3测定来评估。由三名分析者在不同日期进行该测定。用如上文所描述的接受准则如上文所描述来确定精密度(重复性和中间精密度)和准确度。
[0271]
三个独立loq实验的重复性、中间精密度和准确度(表37-39)以及线性(表40)的结果在建立的接受准则内。
[0272]
表37.运行#1:第一个loq实验的线性、重复性和准确度符合接受准则。
[0273]
[0274][0275]
表38.运行#2:第二个loq实验的线性、重复性和准确度符合接受准则。
[0276]
[0277]
[0278][0279]
表39.运行#3:第三个loq实验的线性、重复性和准确度符合接受准则。
[0280]
[0281][0282]
*值为按照iqr检验的离群值且从数据分析中排除。
[0283]
表40.基于3个独立loq实验/运行的中间精密度结果符合接受准则。
[0284][0285]
稳健性
[0286]
为了确定该测定的稳健性,按照youden和steiner的方法(同上)评估了至多20%的关键试剂浓度的变化。选择若干关键qpcr因素并加以轻微变化(表41)。提取bpv-3阳性胎牛血清测试样本并与标准曲线平行地在bpv-3测定中使用最佳化和改变的条件在12个重复中进行测试。
[0287]
表41所测试的qpcr因素
[0288][0289][0290]
该程序的接受准则要求,针对所应用的微小变化从任何稳健性条件获得的响应符合建立的测定接受准则。该程序的接受准则包括精密度,重复性和中间精密度的数量%cv≤25%,如上文所描述。对于准确度,组合矩阵条件(条件1至4)的数量平均值在最佳化条件
的数量平均值的
±
30%内。
[0291]
稳健性研究的结果表明,与最佳化条件相比,qpcr关键试剂的轻微变化是可以承受的并且稳健性结果符合精密度和准确度(118,100
±
35,430)接受准则(表42)。
[0292]
表42稳健性实验的重复性和准确度符合接受准则
[0293]
[0294]
[0295][0296]
验证
[0297]
定义了测定系统适用性和测定接受准则以按照鉴定方案验证测定性能,参见表44。为了证明该测定如预期进行,对含有目标序列的测试样本(样本a)和不含目标序列的测试样本(样本b)进行dna提取,接着进行bpv-3qpcr。由不同分析者在不同日期对该验证测试3次。测定对照、系统适用性和测定接受准则以及测试结果的报告和解释显示于表43-44中。
[0298]
表43针对bpv-3qpcr测定定义的系统适用性和测定接受准则
[0299]
[0300][0301]
表44数据的报告和解释。
[0302]
[0303][0304]
验证研究的结果
[0305]
表45、47和49呈现了三个独立实验的测定系统适用性和测定对照的结果。全部三个独立实验/运行均符合如本文所定义的建立的系统适用性和测定对照接受准则。表45、表47和表49呈现了测试样本结果(样本a:先前经证实的阳性样本,以及样本b:先前经证实的阴性样本)。验证研究的结果证明,在全部三个独立实验/运行中于阴性样本(样本b)中均未检测到bpv-3,并且在全部三个独立实验/运行中均可于阳性样本(样本a)中检测到bpv-3并定量。
[0306]
表45验证运行#1符合测定系统适用性和测定对照的接受准则。
[0307]
[0308][0309]
表46验证运行#1样本结果证明,样本b为bpv-3阴性,并且样本a为bpv-3阳性且数量在该测定的动态范围内
[0310][0311]
在样本a中检测到bpv-3且浓度为log
10 7.01
±
0.01个基因组拷贝/ml(平均值
±
stddev)。在样本b中未检测到bpv-3。
[0312]
表47验证运行#2符合测定系统适用性和测定对照的接受准则
[0313][0314]
表48验证运行#2样本结果证明,样本b为bpv-3阴性,并且样本a为bpv-3阳性且数量在该测定的动态范围内
[0315][0316]
在样本a中检测到bpv-3且浓度为log
10 7.04
±
0.01个基因组拷贝/ml(平均值
±
stddev)。在样本b中未检测到bpv-3。
[0317]
表49验证运行#3符合测定系统适用性和测定对照的接受准则。
[0318]
[0319][0320]
表50验证运行#3样本结果证明,样本b为bpv-3阴性,并且样本a为bpv-3阳性且数量在该测定的动态范围内
[0321][0322]
在样本a中检测到bpv-3且浓度为log
10 7.04
±
0.01个基因组拷贝/ml(平均值
±
stddev)。在样本b中未检测到bpv-3。
[0323]
表51呈现了建立的bpv-3测定鉴定准则。合格的定量bpv-3测定允许在每个pcr反应中定量1e3至1e8个bpv-3基因组拷贝。
[0324]
[0325][0326]
表51bpv-3测定合格准则
[0327]
测试样本a和b符合定量测定所要求的鉴定规范,包括特异性、检出限、定量限、线性、精密度、准确度和稳健性。
[0328]
所有经测试的样本(样本a和b)均符合所提出的系统适用性和测定接受准则。三次独立运行之间的定量水平显示了指示合格测定的准确度、精密度和稳健性性能的相似结果(表45、表47和表49)。定量bpv-3测定和相关鉴定数据证明,bpv-3定量实时pcr测定允许检测并定量测试样本中的bpv-3dna。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。