2、pvrig等免疫调节蛋白作为新的目标进入临床前试验。大部分这样的治疗剂以t细胞上表达的目标为靶向。
6.为了克服这样的以t细胞为中心的偏向性的目标发掘倾向,近来正在开发以在巨噬细胞、树突状细胞等骨髓(myeloid)系列的细胞中表达的免疫检查点蛋白为靶向的抑制剂。其中,csf1r、cd47、tlr7等一跃成为重要的目标。
7.作为能够通过抑制t细胞的活性使肿瘤细胞躲避免疫系统攻击的免疫检查点蛋白之一的pd-l1(程序性死亡配体1(programmed death-ligand 1))主要在淋巴系统及非淋巴组织的白细胞及非造血(nongematopoietic)细胞中表达,也在大肠癌、胰腺癌、黑色素瘤及宫颈癌等多种肿瘤细胞的表面表达。尤其与激活的t细胞表面表达的pd-1(程序性死亡蛋白1(programmed death-1))相互作用,通过抑制tcr介导的t细胞激活(tcr mediated t-cell activation)、细胞因子表达(cytokine release)及t细胞的增殖(t-cell proliferation)来反向调节t细胞的免疫反应。
8.1980年首次在人卵巢癌中鉴定为肿瘤抗原的cd47(分化簇47(cluster of differentiation 47))在包括非霍奇金淋巴瘤(nhl)、多发性骨髓瘤(mm)、急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)、慢性骨髓性白血病、膀胱癌及固体癌在内的大多数人肿瘤细胞中表达。
9.cd47在细胞表面表达,通过与sirpα(sirpa)、血小板反应蛋白-1(tsp1)及整联蛋白相互作用来与细胞的凋亡、增殖及免疫反应相关。尤其是在肿瘤细胞中表达的cd47通过与在巨噬细胞(macrophage)表面表达的sirpα相互作用来释放“不要吞噬我”的信号,从而不仅回避巨噬细胞的吞噬作用(phagocytosis),还在肿瘤环境内增殖血管并抑制效应t细胞t细胞(effector t-cell)的作用来促进肿瘤细胞的增殖及生长。
10.作为国际制药公司的吉利德科学公司的莫洛利单抗(magrolimab)为以cd47为靶向的抗体治疗剂,已在进行临床试验,最近多国国际性的制药公司正在开发基于cd47抗体治疗剂的双抗体。
11.于是,本发明人开发以作为免疫检查点蛋白的pd-l1和cd47为靶向的免疫检查点抑制剂,从而提出本技术。
12.现有技术文献
13.专利文献
14.美国公开专利第2020-0181259号
15.国际公开专利第2011-143624号
16.美国授权专利第8008449号
17.非专利文献
18.pol specenier(2016):ipilimumab in melanoma,expert review of anticancer therapy.
19.db johnson,c peng et al.nivolumab in melanoma:latest evidence and clinical potential.ther adv med oncol 2015,vol.7(2)97-106
20.liu j,wang l,zhao f,tseng s,narayanan c,shura l,et al.(2015)pre-clinical development of a humanized anti-cd47 antibody with anti-cancer therapeutic potential.plos one 10(9):e0137345.
技术实现要素:
21.技术问题
22.本发明的目的在于,提供针对作为免疫检查点蛋白的pd-l1及cd47的双特异性单域抗体及其用途。
23.技术方案
24.为了实现本发明的目的,本发明提供一种与pd-l1及cd47双特异性结合的双特异性抗体,包含:与pd-l1特异性结合的第一单域抗体(第一sdab)或其抗原结合片段;以及与cd47特异性结合的第二单域抗体(第二sdab)或其抗原结合片段。
25.在本发明的一实施方式中,上述第一sdab或其抗原结合片段可以包含:由序列2表示的氨基酸序列形成的cdr1;由序列3表示的氨基酸序列形成的cdr2;以及由序列4表示的氨基酸序列形成的cdr3。
26.并且,上述第二sdab或其抗原结合片段可以包含:由序列7表示的氨基酸序列形成的cdr1;由序列8表示的氨基酸序列形成的cdr2;以及由序列9表示的氨基酸序列形成的cdr3。
27.并且,上述第一sdab或其抗原结合片段可以包含如下vhh结构域:由序列13及序列17中的任一种表示的氨基酸序列形成的fr1;由序列14及序列18中的任一种表示的氨基酸序列形成的fr2;由序列15及序列19中的任一种表示的氨基酸序列形成的fr3;以及由序列16及序列20中的任一种表示的氨基酸序列形成的fr4。更具体地,可以包含如下vhh结构域:(1)由序列13表示的氨基酸序列形成的fr1;由序列14表示的氨基酸序列形成的fr2;由序列15表示的氨基酸序列形成的fr3;以及由序列16表示的氨基酸序列形成的fr4;或者(2)由序列17表示的氨基酸序列形成的fr1;由序列18表示的氨基酸序列形成的fr2;由序列19表示的氨基酸序列形成的fr3;以及由序列20表示的氨基酸序列形成的fr4。更加具体地,可以包含如下vhh结构域:由序列13表示的氨基酸序列形成的fr1;由序列14表示的氨基酸序列形成的fr2;由序列15表示的氨基酸序列形成的fr3;以及由序列16表示的氨基酸序列形成的fr4。在一部分实例中,上述第一sdab包含由序列1表示的氨基酸序列。
28.并且,上述第一sdab或其抗原结合片段可以为一价、二价、三价、四价或更高的价数。并且,上述第一sdab或其抗原结合片段之间可以通过肽接头相互融合,在一部分实例中,包含由序列21表示的氨基酸序列。
29.并且,上述第二sdab或其抗原结合片段可以包含如下vhh结构域:由序列13及序列17中的任一种表示的氨基酸序列形成的fr1;由序列14及序列18中的任一种表示的氨基酸序列形成的fr2;由序列15及序列19中的任一种表示的氨基酸序列形成的fr3;以及由序列16及序列20中的任一种表示的氨基酸序列形成的fr4。更具体地,可以包含如下vhh结构域:(1)由序列13表示的氨基酸序列形成的fr1;由序列14表示的氨基酸序列形成的fr2;由序列15表示的氨基酸序列形成的fr3;以及由序列16表示的氨基酸序列形成的fr4;或者(2)由序列17表示的氨基酸序列形成的fr1;由序列18表示的氨基酸序列形成的fr2;由序列19表示的氨基酸序列形成的fr3;以及由序列20表示的氨基酸序列形成的fr4。更加具体地,可以包含如下vhh结构域:由序列17表示的氨基酸序列形成的fr1;由序列18表示的氨基酸序列形成的fr2;由序列19表示的氨基酸序列形成的fr3;以及由序列20表示的氨基酸序列形成的fr4。在一部分实例中,上述第二sdab包含由序列6表示的氨基酸序列。
30.并且,上述第二sdab或其抗原结合片段可以为一价、二价、三价、四价或更高的价数。并且,上述第二sdab或其抗原结合片段之间可以通过肽接头相互融合。
31.在本发明的一实施方式中,上述第一sdab或其抗原结合片段和/或第二sdab或其抗原结合片段可以通过肽接头相互融合,在一部分实例中,包含由序列11表示的氨基酸序列。
32.在本发明的一实施方式中,上述第一sdab和/或第二sdab可以包含至少一个氨基酸取代,上述至少一个氨基酸取代可以为保守性取代,可以为氨基酸被非遗传编码氨基酸或合成氨基酸取代。
33.在本发明的一实施方式中,提供在上述第一sdab或其抗原结合片段或第二sdab或其抗原结合片段融合有fc片段的仅重链抗体(hcab)。
34.在本发明的一实施方式中,可以为包含上述第一sdab或其抗原结合片段和/或第二sdab或其抗原结合片段的两个以上复制的双特异性及多价(例如,二价、三价、四价或更高的价数)并融合有fc片段的hcab。在一部分实例中,上述hcab可以由序列12表示的氨基酸序列形成。
35.在本发明的一实施方式中,sdab可以通过肽接头与上述fc片段融合,上述fc片段可以为人igg1、igg2、igg3或igg4。
36.在本发明的一实施方式中,上述hcab可以包含至少一个氨基酸取代,上述至少一个氨基酸取代可以为保守性取代,可以为氨基酸被非遗传编码氨基酸或合成氨基酸取代。
37.在本发明的一实施方式中,可以与免疫调节剂、细胞因子、细胞毒性药物、化疗药物、诊断剂、抗病毒剂、抗微生物剂或药物偶联。于是,本发明提供包含与免疫调节剂、细胞因子、细胞毒性药物、化疗药物、诊断剂、抗病毒剂、抗微生物剂或药物偶联的上述与pd-l1及cd47双特异性结合的双特异性抗体的抗体偶联物。
38.并且,本发明提供编码上述与pd-l1及cd47双特异性结合的双特异性抗体的核酸分子。
39.并且,本发明提供包含上述核酸分子的表达载体。
40.并且,本发明提供由上述表达载体转化的宿主细胞。
41.并且,本发明提供生产与pd-l1及cd47双特异性结合的双特异性抗体的方法,包括:
42.步骤(a),在允许双特异性抗体表达的条件下培养上述宿主细胞;以及
43.步骤(b),回收表达的双特异性抗体。
44.并且,本发明提供:包含上述与pd-l1及cd47双特异性结合的双特异性抗体或上述抗体偶联物作为有效成分的用于预防或治疗癌症的药物组合物;包括以药物有效量向个体给药上述与pd-l1及cd47双特异性结合的双特异性抗体或上述抗体偶联物的步骤的预防或治疗癌症的方法;以及上述与pd-l1及cd47双特异性结合的双特异性抗体或上述抗体偶联物在癌症的预防或治疗中的用途。
45.在本发明的一实施方式中,上述癌症可以选自由黑色素瘤、肺癌、肝癌、胶质母细胞瘤、卵巢癌、大肠癌、头颈部癌、膀胱癌、肾细胞癌、胃癌、乳腺癌、转移癌、前列腺癌、胰腺癌、非霍奇金淋巴瘤、霍奇金淋巴瘤、多发性骨髓瘤、白血病、淋巴瘤、骨髓增生异常综合征、急性淋巴细胞白血病、急性骨髓性白血病、慢性淋巴细胞白血病、慢性骨髓性白血病、孤立
1的jurkat细胞确认根据本发明一实施例制备的抗pd-l1
×
cd47 hcab(ppc nb-igg4)抑制pd-l1/pd-1相互作用的能力的图。
60.图7为确认根据本发明一实施例制备的抗pd-l1
×
cd47 hcab(ppc nb-igg4)的吞噬作用的图。
61.图8为确认根据本发明一实施例制备的抗pd-l1
×
cd47 hcab(ppc nb-igg4)的人红细胞(rbc)结合能力(rbc binding)的图。
62.图9为确认根据本发明一实施例制备的抗pd-l1
×
cd47 hcab(ppc nb-igg4)的人红细胞凝集反应(hemagglutination)的图。
63.图10为向使用b16f10_pd-l1/cd47细胞株(诱导pd-l1和cd47抗原的表达的肿瘤细胞株)诱导肿瘤形成的c57bl/6小鼠腹腔给药根据本发明一实施例制备的抗pd-l1
×
cd47 hcab(ppc nb-igg4)后确认抗肿瘤效果的图。
64.图11为向使用b16f10_pd-l1/cd47细胞株(诱导pd-l1和cd47抗原的表达的肿瘤细胞株)诱导肿瘤形成的c57bl/6小鼠静脉给药根据本发明一实施例制备的抗pd-l1
×
cd47 hcab(ppc nb-igg4)后确认抗肿瘤效果的图。
具体实施方式
65.以下,详细说明本发明的实施形态以使本发明所属技术领域的普通技术人员轻松实施本发明。本发明的实施形态仅为向本发明所属技术领域的普通技术人员更为详细地说明本发明而提供。因此,本发明的实施形态可以变形为多种其他形态,本发明的范围不限定于以下说明的实施形态。
66.在本发明中,术语“表位”是指能够与抗体特异性结合的蛋白质决定因素。表位通常由分子,例如氨基酸或糖侧链的化学活性表面基团形成,通常,不仅具有特异性三维结构特征,还具有特异性电荷特性。
67.术语“治疗”是指可以使本技术中公开的障碍或疾病,例如使疾病的症状或并发症减缓、中断、终止、控制、静止、缓解或改善,或者使其病程逆转,但不是完全消除所有疾病或障碍的症状的所有过程。
68.术语“预防”是指疾病或障碍,例如疾病的预防性治疗,或者延缓疾病或障碍的发病或进程。
69.术语“个体”或“对象”是指包括人类、牛、马、猫、狗、啮齿类或灵长类在内的哺乳动物,但不限定于此。在一部分实例中,个体为人类。
70.术语“抗体”以非常广泛的含义来使用,它们表现出所希望的抗原结合活性,非限制性地,包括包含单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)、全长抗体及其抗原结合片段在内的多种抗体结构。术语“抗体”包括现有的4链抗体、单域抗体及其抗原结合片段。
71.基本的4链抗体单位为由两个相同的轻(l)链及两个相同的重(h)链构成的异四聚体糖蛋白。igm抗体由称为j链的追加的多肽与5个基本异四聚体形成,含有10个抗原结合部位,与之相反,iga抗体为了通过与j链的组合形成多价聚集物而包含能够多聚化的2个-5个基本4链单元。在igg的情况下,4链单元通常为约150000道尔顿。各l链通过一个共有的二硫键与h链结合,与之相反,两个h链依赖h链同型通过一个以上的二硫键相互连接。各个的h链
及l链还规则地具有隔开的链间双硫桥。各h链在n-末端,在α链及γ链中分别接续可变结构域(vh)具有3个恒定结构域(ch),在μ同型及ε同型中具有4个ch结构域。各l链在n-末端,在它的其他端部接续的可变结构域(vl)具有恒定结构域。vl与vh对齐,cl与重链的第一恒定结构域(ch1)对齐。vh及vl的配对同时形成单一抗原结合部位。在任意脊柱动物中,l链基于它们的恒定结构域的氨基酸序列,以称为卡帕或兰布达的两个明显区别的类型中的一个来排列。免疫球蛋白依赖其重链的恒定结构域(ch)的氨基酸序列,可以按照不同的种类或同型来排列。免疫球蛋白由5个种类:α、δ、ε、γ及μ,分别为具有指定重链的iga、igd、ige、igg及igm。γ及α种类根据ch序列及功能上相对疏水的不同,还分为子类,例如,人类表达下述子类:igg1、igg2a、igg2b、igg3、igg4、iga1及iga2。
72.术语“仅重链抗体”或“hcab”是指虽包含重链但4链抗体中通常发现的轻链不足的功能性抗体。
73.术语“单域抗体”、“纳米抗体”或“sdab”是指具有3个互补决定区(cdr)的单抗原结合多肽。sdab可以在不与含cdr的多肽配对的情况下单独与抗原结合。在一部分情况下,单域抗体从骆驼科hcab操作而来,它的重链可变结构域在本技术中称为“vhh”(重链抗体的重链的可变结构域)。基本vhh从n-末端向c-末端具有如下结构:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4,其中,fr1至fr4分别指骨架区1至骨架区4,cdr1至cdr3分别指互补决定区1至互补决定区3。
74.抗体的“可变区”或“可变结构域”是指抗体的重链或轻链的氨基-末端结构域。重链及轻链的可变结构域可以分别称为“vh”及“vl”。这些结构域通常(与相同种类的其他抗体相比)为抗体的最大可变部分,含有抗原结合部位。源自骆驼科种类的仅重链抗体具有称为“vhh”的单一重链可变区。
75.术语“可变”是指可变结构域的特定部分在抗体中的序列中广泛地不同的事实。v结构域介导抗原结合,对于特定抗原定义特定抗体的特异性。但是,可变性在可变结构域的全部范围中不均匀分布。代之以浓缩在重链及轻链可变结构域中称为互补决定区(cdr)或超可变区(hvr)的3个部分中。更为高度保护可变结构域的部分称为骨架区(fr)。天然重链及轻链的各可变结构域主要采取形成环形连接的由3个cdr连接的β-折叠结构,而且,在部分情况下包含形成β-折叠结构的一部分的4个fr区。在各链中,cdr通过fr区保持非常接近的状态,cdr从其他链在抗体的抗原结合部位的形成中起作用(参考kabat,elvin a.,sequence of immunological interest,fifth edition,national institute of health,bethesda,md.(1991))。恒定结构域虽然不直接与抗体与抗原的结合相关,但表现出多种效应器功能,例如在抗体依赖性细胞毒性中表现出抗体的参与。
76.术语“恒定结构域”为含有抗原结合部位的免疫球蛋白的其他部分,是指比可变结构域具有更多被保护的氨基酸序列的免疫球蛋白分子的部分。恒定结构域含有重链的ch1、ch2及ch3结构域(统称为ch)及轻链的chl(或者cl)结构域。
77.术语“全长抗体”、“完整的抗体”或“整个的抗体”作为与抗体片段的对照,在称呼实质上完整形态的抗体时,可以互换来使用。作为特异性,全长4链抗体包括具有包含fc区的重链及轻链的情况。全长仅重链抗体包含重链可变结构域(例如vhh)及fc区。恒定结构域可以为天然序列恒定结构域(例如人天然序列恒定结构域)或其氨基酸序列变异体。在部分情况下,完整的抗体可以具有一个以上效应器功能。
[0078]“抗体片段”或“抗原结合片段”为完整的抗体的一部分,优选地,包含完整的抗体的抗原结合部分和/或可变区。抗体片段的非限制例包括:fab、fab'、f(ab')2及fv片段;双特异抗体;线型抗体;单链抗体(scfv)分子;单域抗体(例如vhh);以及由抗体片段形成的多特异性抗体。“fv”为含有完整抗原识别部位及抗原结合部位的最小抗体片段。该片段在致密的非共价键合中形成1个重链与1个轻链可变区结构域的二聚体。“单链fv”或简称“sfv”或“scfv”为包含连接于单多肽链的vh及vl抗体结构域的抗体片段。优选地,scfv多肽为了能够形成所希望的结构以使scfv与抗原结合而在vh与vl结构域之间追加包含多肽接头。“双特异抗体”是指以在v结构域的链与链之间而非在链内配对的方式操作在vh与vl结构域之间具有接头(约5个-10个残基)的sfv片段后,通过此引起具有二价片段,即,具有两个抗原结合部位的片段来制备的小的抗体片段。双特异性双特异抗体两个抗体的vh及vl结构域存在于不同的多肽链的两个“交叉”sfv片段的异二聚体。
[0079]
术语“人源化的抗体”用作“嵌合抗体”的子集。
[0080]
非人(例如美洲驼或骆驼科)抗体的“人源化”形态为含有源自非人免疫球蛋白的最小序列的嵌合抗体。在一部分实例中,人源化的抗体为源自受体(在以下内容中定义)的cdr的残基取代为源自具有所希望的特异性、亲和度和/或收容力的非人种类(供体抗体),例如小鼠、大鼠、兔、骆驼、美洲驼、羊驼或非人的灵长类的cdr的残基的人免疫球蛋白(受体抗体)。
[0081]
在部分事例中,人免疫球蛋白的骨架区(“fr”)残基取代为相应的非人残基。并且,人源化的抗体可以包含未在受体抗体中或供体抗体中发现的残基。这些变形可以为了改善例如结合亲和性的抗体性能而实施。
[0082]
术语“超可变区”、“hvr”或“hv”在本技术中使用的情况下,是指序列中具有超可变性和/或形成结构上定义的环的抗体可变结构域的区域。通常,单域抗体包含3个hvr(或cdr):hvr1(或cdr1)、hvr2(或cdr2)及hvr3(或cdr3)。hvr3(或cdr3)表示3个hvr的最高多样性,已知在向抗体赋予细微特异性方面起到固有的作用。例如,参考hamers-casterman et al.,nature 363:446-448(1993);sheriff et al.,nature struct.biol.3:733-736(1996)。
[0083]
如kabat系统中定义的,术语“互补决定区”或“cdr”在称呼超可变区时使用。参考kabat,elvin a.,sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md.(1991)。kabat互补决定区(cdr)根据序列可变性并最常使用。
[0084]
如本技术中定义的,术语“骨架区”或“fr”残基为hvr残基以外的可变结构域残基。
[0085]
术语“特异性”是指抗原结合蛋白(例如sdab)对抗原特定表位的选择性识别。
[0086]
天然抗体为例如单特异性。本技术中使用的术语“多特异性”表示抗原结合蛋白具有多表位特异性(即,可以在一个生物分子中可以与2个、3个或以上的不同表位特异性结合,或者可以在2个、3个或以上的生物分子中与表位特异性结合)。本技术中使用的“双特异性”表示抗原结合蛋白具有2个不同的抗原结和特异性。
[0087]
本技术中使用的术语“单特异性”表示具有与相同抗原的相同的表位结合的一个以上结合部位的抗原结合蛋白。
[0088]
术语“价”表示明示的抗原结合蛋白存在的结合部位的数量。例如,术语“二价”、“三价”、“四价”、“五价”及“六价”分别表示抗原结合蛋白中存在2个结合部位、3个结合部位、4个结合部位、5个结合部位及6个结合部位。
[0089]“抗体效应器功能”是指由抗体的fc区(天然序列fc区或氨基酸序列变异体fc区)引起的生物学活性,因抗体的同种型而多样。抗体效应器功能的例包括:c1q结合及补体依赖的细胞毒性;fc受体结合;抗体依赖的细胞介导的细胞毒性作用(adcc);吞噬作用;细胞表面受体(例如b细胞受体)的下调;以及b细胞激活。“补体依赖的细胞毒性”或“cdc”是指补体存在下的靶向细胞的溶解。经典的补体途径的激活通过补体系统的第一成分(c1q)结合于与其同族抗原结合的(适当的子类的)抗体来开始。“抗体依赖的细胞介导的细胞毒性作用”或“adcc”是指与特定细胞毒性细胞(例如,自然杀伤(nk)细胞、中性粒细胞及巨噬细胞)中存在的fc受体(fcr)结合的分泌的ig使这些细胞毒性效应细胞与抗原保有靶向细胞特异性结合后,后续通过细胞毒性使靶向细胞凋亡的细胞毒性中的一种形态。
[0090]
在本技术中,术语“fc区”或“片段可结晶区”包括天然序列fc区及变异体fc区,在定义免疫球蛋白重链的c-末端区域中使用。用来在本技术中记载的抗体中使用的适当的天然序列fc区包括人igg1、igg2(igg2a、igg2b)、igg3及igg4。
[0091]“结合亲和性”通常是指分子(例如抗体)的单一接合部位与其结合配偶体(例如抗原)之间的非共有相互作用的总计的强度。若无其他明示,则“结合亲和性”是指反映结合对的构成成员之间的1∶1的相互作用的固有结合亲和性。结合亲和性能够以kd、k
off
、k
on
或ka表示。本技术中使用的术语平衡解离常数术语“k
d”或“k
d”是指特定抗体-抗原相互作用的解离常数,表示在平衡中占抗体分子的溶液中存在的所有抗体结合结构域的二分之一所需的抗原的浓度,以m的单位来表示。kd的测定以所有结合制剂在溶液内为前提。解离常数(kd或kd)用作用以表示抗体对抗原的亲和性的指标。例如,简单的分析不仅可以通过利用多种标记物制剂标记的抗体的斯卡查德作图(scatchard)方法,还可以利用试剂盒随附的使用人员说明书及操作方法指出的通常药品、测定试剂盒。可以通过使用这些方法来获得的kd值以m(摩尔(mols))的单位来表示。
[0092]
对于肽、多肽或抗体序列,“百分比(%)氨基酸序列同一性”及“同源性”定义为:为了实现百分比序列同一性,在需要的情况下,在序列对齐及缺口导入后,在不考虑保守性取代为序列同一性的一部分的情况下,特异性肽或多肽序列中的氨基酸残基与候选序列中的氨基酸残基相同的百分比。以确定百分比氨基酸序列同一性为目的的对齐可以使用本发明所属技术领域中的多种方式,例如使用可以公开使用的计算机软件来实现,例如blast、blast-2、align或megaligntm(dnatar)软件。本发明所属技术领域的普通技术人员可以为实现所要比较的序列的最大对齐所需的算法而确定适当的参数。
[0093]
本发明涉及包含(以下称为“抗pd-l1
×
cd47 bsab”)与pd-l1特异性结合的第一单域抗体(第一sdab)或其抗原结合片段(抗pd-l1sdab)以及与cd47特异性结合的第二单域抗体(第二sdab)或其抗原结合片段(抗cd47 sdab)的与pd-l1及cd47双特异性结合的双特异性抗体,例如,抗pd-l1
×
cd47 bsab,具体地,涉及融合有抗pd-l1 sdab及抗cd47 sdab的双特异性sdab、抗pd-l1
×
cd47仅重链抗体(hcab)(例如,人免疫球蛋白g(igg)的可结晶片段(fc片段)融合在抗pd-l1 sdab和/或抗cd47 sdab的抗pd-l1
×
cd47bsab-fc融合蛋白)以及它们的制备及用途。
[0094]
于是,本发明提供包含抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双
特异性抗体。
[0095]
在本发明中,上述包含抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体可以为作为第一抗原结合部分的与pd-l1特异性结合的第一单域抗体(第一sdab)或其抗原结合片段(抗pd-l1 sdab)与作为第二抗原结合部分的与cd47特异性结合的第二单域抗体(第二sdab)或其抗原结合片段(抗cd47 sdab)融合的抗pd-l1
×
cd47 bsab。
[0096]
在本发明中,上述抗pd-l1 sdab包含:由序列2表示的氨基酸序列形成的cdr1;由序列3表示的氨基酸序列形成的cdr2;以及由序列4表示的氨基酸序列形成的cdr3。
[0097]
并且,上述抗cd47 sdab包含:由序列7表示的氨基酸序列形成的cdr1;由序列8表示的氨基酸序列形成的cdr2;以及由序列9表示的氨基酸序列形成的cdr3。
[0098]
上述cdr序列在表6及表12中示出。
[0099]
在本发明中,关于fr区,上述抗pd-l1
×
cd47 bsab可以包含任意适当的序列。具体地,上述fr序列可以为下述表1至表4所示的氨基酸序列。
[0100]
表1
[0101]
nofr1序列编号1qvqlvesggglvqpggslrlscaas132qvqlvesggglvqpggslnlscavs17
[0102]
表2
[0103]
nofr2序列编号1mswvrqapgkglewvsd142vgwarqvpgkglervsr18
[0104]
表3
[0105]
nofr3序列编号1dyadsvkgrftisrdnakntlylqmnslkpedtavyyc152eyldavkgrftisrdnakntvylqmnslktedtavyyc19
[0106]
表4
[0107]
nofr4序列编号1rgqgtqvtvss162wgqgtqvtvss20
[0108]
更具体地,上述抗pd-l1 sdab可以包含下述fr1、fr2、fr3及fr4:由序列13及序列17中的任一种表示的氨基酸序列形成的fr1;由序列14及序列18中的任一种表示的氨基酸序列形成的fr2;由序列15及序列19中的任一种表示的氨基酸序列形成的fr3;以及由序列16及序列20中的任一种表示的氨基酸序列形成的fr4。
[0109]
更加具体地,上述抗pd-l1 sdab可以包含下述fr1、fr2、fr3及fr4:(1)由序列13表示的氨基酸序列形成的fr1;由序列14表示的氨基酸序列形成的fr2;由序列15表示的氨基酸序列形成的fr3;以及由序列16表示的氨基酸序列形成的fr4;或者(2)由序列17表示的氨基酸序列形成的fr1;由序列18表示的氨基酸序列形成的fr2;由序列19表示的氨基酸序列形成的fr3;以及由序列20表示的氨基酸序列形成的fr4。
[0110]
更加具体地,上述抗pd-l1 sdab可以包含下述fr1、fr2、fr3及fr4:由序列13表示
的氨基酸序列形成的fr1;由序列14表示的氨基酸序列形成的fr2;由序列15表示的氨基酸序列形成的fr3;以及由序列16表示的氨基酸序列形成的fr4。
[0111]
在本发明中,上述抗pd-l1 sdab可以包含含有上述fr区的vhh结构域。
[0112]
具体地,上述抗pd-l1 sdab可以包含由序列1表示的氨基酸序列或与上述氨基酸序列具有至少80%(例如至少任意的80%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)的序列同源性的其变异体。
[0113]
并且,上述抗cd47 sdab可以包含下述fr1、fr2、fr3及fr4:由序列13及序列17中的任一种表示的氨基酸序列形成的fr1;由序列14及序列18中的任一种表示的氨基酸序列形成的fr2;由序列15及序列19中的任一种表示的氨基酸序列形成的fr3;以及由序列16及序列20中的任一种表示的氨基酸序列形成的fr4。
[0114]
更加具体地,上述抗cd47 sdab可以包含下述fr1、fr2、fr3及fr4:(1)由序列13表示的氨基酸序列形成的fr1;由序列14表示的氨基酸序列形成的fr2;由序列15表示的氨基酸序列形成的fr3;以及由序列16表示的氨基酸序列形成的fr4;或者(2)由序列17表示的氨基酸序列形成的fr1;由序列18表示的氨基酸序列形成的fr2;由序列19表示的氨基酸序列形成的fr3;以及由序列20表示的氨基酸序列形成的fr4。
[0115]
更加具体地,上述抗cd47 sdab可以包含下述fr1、fr2、fr3及fr4:由序列17表示的氨基酸序列形成的fr1;由序列18表示的氨基酸序列形成的fr2;由序列19表示的氨基酸序列形成的fr3;以及由序列20表示的氨基酸序列形成的fr4。
[0116]
在本发明中,上述抗cd47 sdab可以包含含有上述fr区的vhh结构域。
[0117]
具体地,上述抗cd47 sdab可以包含由序列6表示的氨基酸序列或与上述氨基酸序列具有至少80%(例如至少任意的80%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)的序列同源性的其变异体。
[0118]
在本发明中,上述抗pd-l1 sdab与pd-l1的表位结合,抗cd47sdab与cd47的表位结合。
[0119]
并且,上述抗pd-l1
×
cd47 bsab分别与pd-l1及cd47结合的kd可以为10-6
m至10-12
m、10-6
m至10-11
m、10-6
m至10-10
m、10-6
m至10-9
m或10-6
m至10-8
m。
[0120]
并且,上述抗pd-l1
×
cd47 bsab的ec
50
在流式细胞荧光分选(facs)分析中可以为小于500nm,具体地,可以为0.1nm至500nm、0.1nm至400nm、0.1nm至300nm、0.1nm至200nm、0.1nm至100nm、0.1nm至50nm、0.1nm至10nm、1nm至500nm、1nm至400nm、1nm至300nm、1nm至200nm、1nm至100nm、1nm至50nm或1nm至10nm。
[0121]
在本发明中,上述抗pd-l1
×
cd47 bsab对于pd-l1及cd47各表位的价数可以为任意适当的数。具体地,抗pd-l1
×
cd47 bsab可以分别对pd-l1及cd47具有二价、三价、四价、五价、六价或更高的价数。例如,参考p.chames and d.baty,chapter 6.bispecific single domain antibodies,springer-verlag berlin heidelberg,2011。
[0122]
并且,上述抗pd-l1
×
cd47 bsab可以为抗pd-l1 sdab与抗cd47sdab通过肽键直接融合或通过肽接头间接融合。上述肽接头的长度、灵活性程度和/或其他特性可能对于一个以上特定抗原或表位的包括但不限于亲和性、特异性或结合能力在内的特性带来部分影响。例如,可以在保障两个相邻的结构域不在立体结构上互为影响的情况下选择更长的肽接头。在一部分实例中,肽接头包含灵活性残基(例如甘氨酸及丝氨酸)来在相邻的结构域
490;专利wo 06/030220;以及wo 06/003388。
[0131]
并且,本发明的sdab可以为嵌合抗体。例如,特定嵌合抗体在专利us4,816,567以及morrison et al.,proc.natl.acad.sci.usa,81:6851-6855(1984))中记载。在一部分实例中,嵌合抗体可以包含非人可变区(例如源自例如美洲驼的骆驼科的种类的可变区)及人恒定区。并且,嵌合抗体可以被人源化。典型地,与人源化减少对人类的免疫原性相反,非人抗体保持亲缘非人抗体的特异性及亲和性。通常,人源化的抗体包含hvr,例如,包含cdr(或其一部分)源自非人抗体、fr(或其一部分)源自人类抗体序列的一个以上可变结构域。并且,人源化的抗体任意地包含人恒定区的至少一部分。在一部分实例中,在人源化的抗体中,一部分fr残基,例如为了恢复或改善抗体特异性或亲和性,可以取代为来自非人抗体(例如hvr残基的源头抗体)的相应的残基。
[0132]
在本发明中,上述包含抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体可以为抗pd-l1
×
cd47 hcab或其抗原结合片段。
[0133]
具体地,抗pd-l1
×
cd47 hcab可以为本技术中记载的抗pd-l1
×
cd47 bsab与一个以上ch2和/或ch3结构域融合,例如与fc片段融合。并且,可以为本技术中记载的抗pd-l1 sdab和/或抗cd47 sdab上融合有一个以上ch2和/或ch3结构域,例如,融合有fc片段。
[0134]
上述ch2和/或ch3结构域源自免疫球蛋白。上述免疫球蛋白可以为iga、igd、ige、igg或igm。具体地,可以为igg。在一部分实例中,抗cd47 hcab可以包含igg,例如,可以包含igg1、igg2、igg3或igg4的fc片段,上述fc片段可以为人fc,例如可以为人igg1(higg1)fc、higg2 fc、higg3 fc或higg4 fc。
[0135]
上述抗pd-l1
×
cd47 hcab可以为单体性或多聚体性。并且,在多聚体性的情况下,例如,可以为包含本技术中记载的抗pd-l1 sdab及抗cd47 sdab的两个以上复制的双特异性及多价(例如,二价、三价、四价或更高的价数)。
[0136]
在本发明中,上述抗pd-l1
×
cd47 bsab、抗pd-l1 sdab或抗cd47 sdab可以通过肽接头与ch2和/或ch3结构域融合,具体地,可以通过肽接头与fc片段融合。上述肽接头的长度、灵活性程度和/或其他特性可能对于一个以上特定抗原或表位的包括但不限于亲和性、特异性或结合能力在内的特性带来部分影响。例如,可以在保障两个相邻的结构域不在立体结构上互为影响的情况下选择更长的肽接头。在一部分实例中,肽接头包含灵活性残基(例如甘氨酸及丝氨酸)来在相邻的结构域之间自由地移动。例如,甘氨酸-丝氨酸双联体可以为适当的肽接头。并且,肽接头可以为任意适当的长度。在一部分实例中,肽接头可以为至少约任意的1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、25个、30个、35个、40个、50个、75个、100个或更多的氨基酸长度。
[0137]
并且,上述肽接头可以具有自然产生的序列或非自然产生的序列。例如,源自仅重链抗体的铰链区域的序列可以用作接头。例如,参考专利wo 1996/34103。在一部分实例中,上述肽接头可以为higg1铰链、higg2铰链、higg3铰链、higg4铰链或它们的变异体。
[0138]
在本发明中,上述抗pd-l1
×
cd47 hcab可以包含由序列12表示的氨基酸序列或与上述氨基酸序列具有至少80%(例如至少任意的80%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)的序列同源性的其变异体。
[0139]
在本发明中,上述包含抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双
特异性抗体可以为抗pd-l1 sdab和/或抗cd47sdab的c-末端与ch1及cκ结构域的n-末端融合的双特异性fab样抗体片段(bispecific fab-like antibody fragment,bsfab)。
[0140]
上述ch1及cκ结构域源自免疫球蛋白。上述免疫球蛋白可以为iga、igd、ige、igg或igm,具体地,可以为igg。上述igg可以为igg1、igg2、igg3或igg4,可以为人igg1、igg2、igg3或igg4。
[0141]
本发明的bsfab及其制备技术参考p.chames and d.baty,chapter6.bispecific single domain antibodies,springer-verlag berlin heidelberg,2011。
[0142]
在本发明中,上述包含抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体可以包含氨基酸序列变异体。抗体的氨基酸序列变异体可以通过向编码抗体的核酸序列导入适当的变形或者肽合成来制备。上述变形包括例如抗体的氨基酸序列内残基的缺失和/或插入和/或取代。缺失、插入及取代的任意组合可以为最终产物的制备服务,但最终产物保有所希望的特征,例如保有抗原结合。在一部分实例中,在取代、插入或缺失等变更实质上不减少抗体与抗原结合的能力的情况下,可以在一个以上超可变区(hvr)内发生上述变更。例如,实质上不减少结合亲和性的保守性变更可以在hvr中实施。这样的变更可以为hvr“热点”或cdr的外部。
[0143]
并且,上述氨基酸取代可以为至少一个(例如,任意的1个、2个、3个、4个、5个、6个、7个、8个、9或10个)氨基酸取代。并且,上述至少一个氨基酸取代可以为保守性取代,可以为氨基酸被非遗传编码氨基酸或合成氨基酸取代。在一部分实例中,上述氨基酸取代可以在cdr区,cdr1、cdr2和/或cdr3中包含至少一个(例如,任意的1个、2个、3个或4个)氨基酸取代。在一部分实例中,上述氨基酸取代可以在fr区,可以在fr1、fr2、fr3和/或fr4中包含至少一个(例如,任意的1个、2个、3个、4个、5个或6个)氨基酸取代。
[0144]
并且,上述氨基酸序列插入不仅包括含有从1个残基到100以上残基的多肽的长度范围的氨基-和/或羧基-末端的融合,还包括单一或多氨基酸残基的序列内的插入。末端插入的例包括具有n-末端甲硫氨酰残基的抗体。抗体分子的其他插入变异体可以包括有关促进抗体的血清半衰期的多肽或(例如,adept的情况)酶的抗体的n-或c-末端的融合。
[0145]
并且,可以通过向包含本技术中提供的抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体(例如,抗pd-l1
×
cd47 hcab)的fc区导入一个以上氨基酸变形来生成fc区变异体。fc区变异体可以包含在一个以上氨基酸位置包含氨基酸变形(例如,取代)的人fc区序列(例如,人igg1、igg2、igg3或igg4 fc)。
[0146]
在本发明中,上述包含抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体可以与诊断部分或生物相容性调节剂连接、融合、偶联(例如,共有或非共有)或以其他方式与其缔合。例如,可以偶联或缔合肽或多肽(例如,生物毒素、生物标记物、纯化标签等)、蛋白质、聚合物、核酸分子、小分子、模拟剂、合成药物、无机分子、有机分子或放射性同位素。
[0147]
并且,上述包含抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体可以与可以为生物分子(例如,肽或核苷酸)、小分子、荧光团或放射性同位素的诊断剂或可检出的激动剂、标记物或报告剂偶联或缔合。标记的调节子可以在与cd47相关的疾病,例如在癌症的发生或进程的监控方面有效,或者在确定包括本技术中公开的抗体在内的特定疗法的功效方面(即,治疗诊断)有效,或者有效作为决定以后治疗过程的临床试验过程
的一部分。并且,这样的标记物或报告剂可以在纯化本技术中公开的抗体方面有效。
[0148]
并且,上述包含抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体可以与免疫调节剂、细胞因子、细胞毒性药物、化疗药物、诊断剂、抗病毒剂、抗微生物剂或药物偶联。于是,本发明提供包含与免疫调节剂、细胞因子、细胞毒性药物、化疗药物、诊断剂、抗病毒剂、抗微生物剂或药物偶联的包含含有本发明的抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体的抗体偶联物。
[0149]
并且,本发明提供编码包含本技术中公开的抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体的核酸分子、包含上述核酸分子的表达载体、由上述表达载体转化的宿主细胞。
[0150]
并且,本发明提供生产双特异性抗体的方法,包括:步骤(a),在允许双特异性抗体表达的条件下培养上述宿主细胞;以及步骤(b),回收表达的双特异性抗体。
[0151]
在本发明中,编码包含本技术中公开的抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体的脱氧核糖核酸(dna)可以使用通常的步骤(例如,在编码抗体重链及轻链的基因中使用能够特异性结合的寡核苷酸探针)轻松分离并分析序列。分离并亚克隆的杂交瘤细胞(或者噬菌体或酵母来源菌落)可以起到上述脱氧核糖核酸的优选供应源的作用。尤其,为了制备抗体,分离的脱氧核糖核酸(可被变形)可以在恒定及可变区序列的克隆中使用。
[0152]
一个例示性的方法伴有从选择的细胞提取核糖核酸(rna)、转换为互补脱氧核糖核酸(cdna)以及通过使用抗体特异性引物的聚合酶链式反应(pcr)来扩增。适当的引物在本发明所属技术领域中广为人知,可以从本技术例示的许多商业性供应源中获得并利用。为了表达通过组合文库的筛选分离的重组人或非人抗体,将编码抗体的脱氧核糖核酸克隆至重组表达载体内后,导入包括哺乳动物细胞、昆虫细胞、植物细胞、酵母及细菌在内的宿主细胞内。在一部分实例中,向不生成其他目的的构建物的猴cos细胞、ns0细胞、中国仓鼠卵巢(cho)细胞或骨髓瘤细胞内导入调节子来表达。
[0153]
在本发明中,在适当的情况下,上述核酸分子在载体内与控制核酸表达的启动子共存。上述载体以其最普遍的含义来使用,例如,包括用来将核酸导入原核和/或真核细胞内并在适当的情况下可以与基因组融合的任意中间运载工具。优选地,上述载体在细胞内复制和/或表达。载体可以包括质粒、噬菌粒、噬菌体或病毒基因组。上述质粒通常与可以独立于染色体脱氧核糖核酸复制的染色体外遗传物质构建物有关,通常圆形脱氧核糖核酸双链有关。
[0154]
可以使用本发明所属技术领域中广为人知的方法来构建包含抗体编码序列以及适当的转录即翻译控制信号的表达载体。这些技术包括例如实验室内重组脱氧核糖核酸技术、合成技术以及生物体内基因重组。
[0155]
在本发明中,上述宿主细胞或重组宿主细胞是指导入表达载体的细胞。重组宿主细胞及宿主细胞不仅指特定的对象细胞,还指这些细胞的后代。后代中虽可能因突变或环境影响发生特定变形而使这些后代与母细胞不同,但仍包括在本技术中使用的术语“宿主细胞”的范畴内。这样的细胞可以包含上述记载的载体。
[0156]
并且,可以使用本发明所属技术领域中认知的分子生物学技术及现在的蛋白质表达方法论来以实质性的量生产本技术中公开的抗体。更具体地,这样的编码抗体的核酸分
子可以整合到包括多种类型的宿主细胞在内的广为人知的商业上可获得的蛋白质生产系统内来提供以临床前、临床或商业性的量为目的的制药产品。在一部分实例中,编码抗体的核酸分子被工程化到载体或表达载体内,其提供有效整合到选择的宿主细胞以及后续中抗体的高表达水平。
[0157]
优选地,编码本技术中公开的抗体的核酸分子及包含上述核酸分子的载体不仅可以在哺乳动物、植物、细菌或酵母宿主细胞的转染中使用,还可以在原核系统中使用。转染可以通过用于将多核苷酸导入宿主细胞内的任意公知的方法来实现。将异种多核苷酸导入哺乳动物细胞内的方法在本发明所属技术领域中广为人知,包括葡聚糖介导的转染、磷酸钙沉淀、聚凝胺介导的转染、原生质体融合、电穿孔、脂质体内多核苷酸的胶囊化以及直接向细胞核内微注射脱氧核糖核酸。并且,可以通过病毒载体将核酸分子导入哺乳动物细胞内。转化哺乳动物细胞的方法在本发明所属技术领域中广为人知。并且,转化植物细胞的方法在本发明所属技术领域中广为人知,例如,包括农杆菌介导的转化、生物转化、直接注射、电穿孔及病毒转化。并且,转化病毒及酵母细胞的方法在本发明所属技术领域中广为人知。
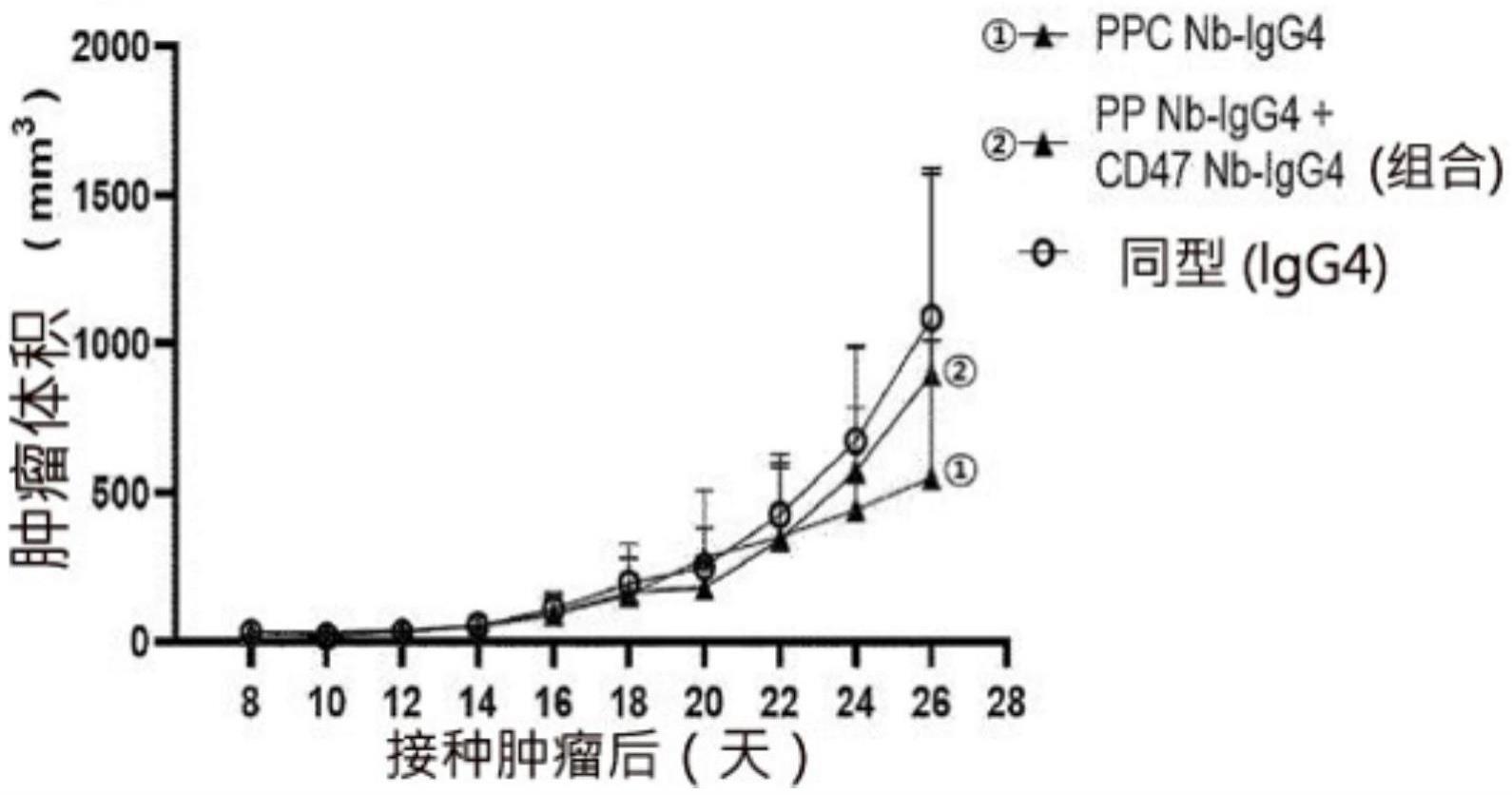
[0158]
许多商业上可获得的多种宿主表达载体系统可以用来表达本技术中公开的抗体。这样的宿主表达系统不仅示出表达所关心的编码序列并可以在后续中纯化的运载工具,还在以适当地核苷酸编码序列转化或转染的情况下示出可以在系内表达本发明的分子的细胞。这样的系统包括:由含有调节子编码序列的重组噬菌体脱氧核糖核酸、质粒脱氧核糖核酸或粘粒脱氧核糖核酸表达载体转化的微生物,例如,细菌(例如,大肠杆菌(e.coli)、枯草芽孢杆菌(b.subtilis)、链霉菌(streptomyces));由含有调节子编码序列的重组酵母表达载体转染的酵母(例如,酵母菌(saccharomyces)、毕赤酵母(pichia));由含有调节子编码序列的重组病毒表达载体(例如,杆状病毒)感染的昆虫细胞系统;由重组病毒表达载体(例如,花椰菜花叶病毒,camv;烟草花叶病毒,tmv)感染或由含有调节子编码序列的重组质粒表达载体(例如,ti质粒)转染的植物细胞系统(例如,烟草(nicotiana)、拟南芥(arabidopsis)、青萍、玉米、小麦、马铃薯等);或者由含有源自哺乳动物细胞的基因组(例如,金属硫蛋白启动子)或源自哺乳动物病毒(例如,腺病毒万起启动子;牛痘病毒7.5k启动子)的启动子的保有重组表达构建物的哺乳动物细胞系统(例如,cos、cho、bhk、293、3t3细胞)。但不限定于此。
[0159]
若本技术中公开的抗体通过重组表达或本技术中公开的其他技术中的任一种来生产,则可以通过有关免疫球蛋白的纯化的本发明所属技术领域中公知的方法,或者更普通地通过有关蛋白质的纯化的任意其他标准技术来纯化。
[0160]
并且,本发明提供包含含有本技术中公开的抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体或包含含有上述双特异性抗体的抗体偶联物作为有效成分的用于预防或治疗癌症的药物组合物。
[0161]
并且,本发明提供预防或治疗癌症的方法,包括以药物有效量向个体给药包含含有本技术中公开的抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体或含有上述双特异性抗体的抗体偶联物的药物组合物的步骤。
[0162]
并且,本发明提供包含本技术中公开的抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体或包含上述双特异性抗体的抗体偶联物,以用于预防或治疗癌症的用途。
[0163]
在本发明中,上述癌症为需要阻断免疫检查点蛋白的活性来激活t细胞的癌症,例如,选自由黑色素瘤、肺癌、肝癌、胶质母细胞瘤、卵巢癌、大肠癌、头颈部癌、膀胱癌、肾细胞癌、胃癌、乳腺癌、转移癌、前列腺癌、胰腺癌、非霍奇金淋巴瘤、霍奇金淋巴瘤、多发性骨髓瘤、白血病、淋巴瘤、骨髓增生异常综合征、急性淋巴细胞白血病、急性骨髓性白血病、慢性淋巴细胞白血病、慢性骨髓性白血病、孤立性骨髓瘤及再生障碍性贫血组成的组中,但不限定于此。
[0164]
在本发明中,有关上述包含本技术中公开的抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体或包含上述双特异性抗体的抗体偶联物的内容与前述内容相同,具体说明援引上述内容,以下,只针对药物组合物及用途的特有结构进行说明。
[0165]
本发明的药物组合物可以包含本技术中记载的一种以上(例如,2种或3种)包含本技术中公开的抗pd-l1
×
cd47 bsab的与pd-l1及cd47双特异性结合的双特异性抗体或包含上述双特异性抗体的抗体偶联物。
[0166]
本发明的药物组合物可以通过向个体,具体地,向癌症患者给药来预防或治疗癌症。
[0167]
并且,本发明的药物组合物可以根据本技术中记载的抗体的形态、所希望的输送方式及许多其他变数使用本发明所属技术领域中认知的技术来以所目标的方式配制。并且,为了在本发明所属技术领域中广为人知且便于给药或输送,能够以包含辅助活性物质加工为制药上最佳化的制剂的包括作为相对惰性物质的赋形剂及辅助剂在内的适当的制药上可接受的载体的方式来配制。例如,包括溶剂、辅助剂及稀释剂在内的多种制药上可接受的载体可以轻易从许多商业供应源中获得。并且,也可以获得制药上可接受的辅助物质的种类,例如,ph调节剂、缓冲剂、表面张力调节剂、稳定剂、湿润剂等。特定的非限制性得例示载体包括生理盐水、缓冲生理盐水、葡萄糖、水、甘油、乙醇以及它们的组合。
[0168]
并且,本发明的药物组合物可以为口服、胃肠外或局部给药而配制。事实上,可以同时使用所有三种类型的制剂来实现活性成分的全身给药。用于输送胃肠外及非胃肠外药物的赋形剂及制剂是本发明所属技术领域中公知的。适合胃肠外给药的制剂为水溶性形态的活性化合物,例如,包括水溶性盐的水溶液。并且,可以向油性注射悬混液中放入适当的活性化合物的悬混液。适当的亲脂性溶媒或溶剂包括例如芝麻油的脂肪油或者例如油酸乙酯或甘油三酯的合成脂肪酸酯。水性注射悬混液可以含有增加悬混液粘度的物质,例如,包括羧甲基纤维素钠、山梨醇和/或葡聚糖。并且,悬混液还可以包含任意稳定剂。并且,可以为了向细胞输送而使用脂质体将活性剂胶囊化。
[0169]
适合肠内给药的制剂包括硬质或软质明胶胶囊、丸剂、包括包衣的片剂在内的片剂、药水、悬混液、糖浆或吸入剂以及它们的缓释形态。
[0170]
通常,本技术中公开的抗体可以向对象通过口服、静脉内、动脉内、皮下、胃肠外、鼻腔内、肌肉内、心脏内、脑室内、气管内、颊侧、直肠、腹腔内、皮内、病灶、经皮及脊髓腔内或者异位移植或吸入来给药,但不限定于此,可以通过多种途径向生物体内给药。可以根据所希望的用途及治疗方法选择给药的适当制剂及途径。
[0171]
本发明的药物组合物能够以用于治疗或预防癌症的药物有效量来给药。上述药学上的有效量可以通过医生或其他临床医生推断,是指对象中导出生物学或医学反应的抗体或包含其的药物组合物的量。并且,为了实现具有预防和/或治疗效果的治疗方法的量,能
够以特定频度给药多剂量的抗体或包含其的药物组合物。
[0172]
典型地,上述药物有效量根据所要治疗的对象的体重、其身体状态、所要治疗的状态的广范围以及所要治疗的对象的年龄的不同而变化。通常,本技术中公开的抗体能够以约10ng/kg体重至约100mg/kg体重范围、约50μg/kg体重至约5mg/kg体重范围、约100μg/kg体重至约10mg/kg体重范围、约100μg/kg体重至约20mg/kg体重范围、0.5mg/kg体重至约20mg/kg体重范围的量来给药,但不限定于此。并且,抗体能够以至少约100μg/kg体重、至少约250μg/kg体重、至少约750μg/kg体重、至少约3mg/kg体重、至少约5mg/kg体重或至少约10mg/kg体重的剂量来给药,但不限定于此。
[0173]
并且,本发明的药物组合物能够以约100mg至约10000mg的剂量、约200mg至约9000mg的剂量、约300mg至约8000mg的剂量、约400mg至7000mg的剂量、500mg至5000mg的剂量给药,但不限定于此。
[0174]
本发明的药物组合物通常向患者多次给药。例示性的治疗方法伴随2周1次、1个月1次或者3个月至6个月1次的给药。例如,作为循环,可以每4周,例如每28天向患者给药抗体一次(例如,使用静脉内制剂)。给药频度可以根据抗体在患者中的药物动力学图形来调节。例如,抗体的半衰期可以需要2周的给药频度。在一部分方法中,可以同时给药具有不同结合特异性的2种以上的抗体,这种情况下给药的各抗体的给药量包括在提出的范围内。
[0175]
给药量及频度根据抗体在患者中的半衰期的不同而不同。通常,人抗体示出最长的半衰期,然后是人源化抗体、嵌合抗体及非人抗体。给药量及给药频度可以根据治疗的预防性或治疗性而不同。
[0176]
治疗方法的持续时间根据所要治疗的疾病、患者的年龄及状态、患者所患疾病的病程及类型、患者对治疗的反应等因素的不同而变化。临床医生密切观察治疗方法的效果并可以根据需要随时进行调整。在组合活性剂来使用的情况下,2种以上的治疗剂可以同时或以任意顺序依次给药,即,本技术中公开的抗体可以在给药第二治疗剂之前给药,或者与第二治疗剂同时给药,或者后续第二治疗剂的给药来给药。
[0177]
以下,通过实施例及实验例详细说明本发明。
[0178]
但是,下述实施例及实验例仅用于例示本发明,本发明的内容不限定于下述实施例及实验例。
[0179]
实施例1.免疫及采血
[0180]
使用人pd-l1蛋白或人cd47蛋白作为免疫抗原与免疫辅助剂(gerbu)混合后向一只羊驼肌肉注射3次来免疫。经过3次进行免疫后,在最后免疫后的第14天从羊驼采血10ml并通过酶联免疫吸附测定(elisa)分析免疫反应。抗体生成与否是利用包被缓冲液以1μg/ml的浓度将免疫抗原分注到96孔酶标板中后在4℃的温度下过夜包被。使用pbst洗涤96孔酶标板3次后,为了抑制非特异性结合,使用5%的脱脂牛奶(skim milk)在常温下处理2小时来封闭(blocking)。然后,使用pbst洗涤3次后,将免疫前(day 0)、免疫后14天(day 14)、28天(day 28)、42天(day 42)获得的血清试样按照不同梯度稀释浓度处理。然后,使用pbst洗涤96孔酶标板5次后,在常温下反应山羊抗美洲驼igg辣根过氧化物酶(goat anti-llama igg hrp)抗体1小时后通过3,3',5,5'-四甲基联苯胺(tmb)反应确认抗原是否结合抗体。
[0181]
实施例2.文库制作及评估
[0182]
通过扩增编码上述实施例1中确认的与免疫抗原结合的单域抗体的基因来构建文
库。为了构建文库,在血液中利用聚蔗糖(ficoll)来分离外周血单核细胞(pbmc)。在从分离的外周血单核细胞(pbmc)中提取的总核糖核酸(total rna)中使用特异引物(specific primer)扩增编码单域抗体的基因片段后,在pcomb3x载体(vector)中克隆。制备的免疫文库的大小为5.4
×
108。
[0183]
实施例3.文库扩增
[0184]
向xl1-blue菌株转化(transformation)上述实施例2中制作的免疫文库。向转化的xl1-blue菌株加入10ml的含有2%的葡萄糖、100μg/ml的氨苄西林的2x yt培养基后并在37℃的振荡搅拌机中培养。培养直至在od
600
中的吸光度为0.5为止,加入m13k07噬菌体(phage)(英杰公司(invitrogen))至1
×
10
11
pfu/ml。然后,在37℃的温度下静置培养30分钟后,在37℃的振荡搅拌机中以200rpm追加培养30分钟。在常温下以4000rpm离心分离培养液15分钟来去除上清液。然后,加入10ml的含有100μg/ml的氨苄西林、50μg/ml的卡那霉素的2x yt培养基使培养液的颗粒再悬浮后,在30℃的振荡培养器中以250rpm过夜培养。利用聚乙二醇(peg)沉淀法使上清液沉淀后,在4℃的温度下以12000rpm离心分离30分钟。使用磷酸盐缓冲溶液(pbs)使颗粒再悬浮后,在4℃的温度下以13000rpm离心分离5分钟,将上清液移到新的试管并在4℃的温度下保管直至使用前。
[0185]
实施例4.生物淘选(bio-panning)
[0186]
为了筛选对免疫抗原具有特异性的单域抗体,以5μg/ml浓度利用包被缓冲液将免疫抗原分注到96孔酶标板,在4℃的温度下过夜包被。用于筛选单域抗体的实验中使用的文库(上述实施例3的文库)为分注到96孔酶标板并在常温下反应30分钟。然后,重复将文库移到新的孔并在常温下反应30分钟的操作4次。这样的操作是为减少酶标板的孔中以非特异性结合的文库而实施的。将文库移到1.7ml的试管中在4℃的温度下保管直至使用前。使用pbst洗涤包被免疫抗原的酶标板5次后,加入5%的脱脂牛奶并在常温下封闭2小时。然后,使用pbst洗涤5次后,将减少非特异性结合的文库与结合溶液(2.5%的脱脂牛奶、0.5%的吐温(tween)20)一同以5
×
10
12
virions/well分注并在常温下反应30分钟。然后,使用洗涤溶液(磷酸盐缓冲溶液、0.5%的吐温20)洗涤10次后,再用pbst洗涤3次。向每孔加入5μg的免疫抗原后在常温下以500rpm反应30分钟来选择性地洗脱与免疫抗原特异性结合的单域抗体。向处于对数生长期的xl-1blue细胞感染洗脱的噬菌体后,涂抹到2x yt琼脂培养基上。为了用于第二次筛选的淘选,在与上述相同的条件下重复上述用于筛选的淘选。分别扩增琼脂培养基中生成的单一噬菌体克隆并利用流式细胞荧光分选技术(facs)筛选。
[0187]
实施例5.噬菌体筛选
[0188]
为了在expi-cho细胞中诱发免疫抗原的一时性过表达,将编码免疫抗原的基因插入pcmv6-gfp载体来构建pcmv6-免疫抗原-gfp质粒。使用dpbs洗涤expi-cho细胞后,在常温下以1200rpm离心分离3分钟。去除上清液后,使用2%的脱脂牛奶使细胞再悬浮并在4℃的温度下封闭30分钟。在常温下以1200rpm离心分离细胞3分钟并去除上清液,使用dpbs洗涤2次后,以3
×
105cells/100μl/well的量分注到96孔酶标板。向各孔中加入单克隆噬菌体并在4℃的温度下反应1小时后,使用dpbs洗涤2次。向细胞分注与噬菌体特异性结合的抗体(m13主要外壳蛋白(major coat protein)alexa flour 647(圣克鲁兹公司(santacruz)))后在阻断光线的情况下在4℃的温度下反应30分钟。使用dpbs洗涤细胞2次后,使用新的dpbs再悬浮并利用accuri c6(bd公司)设备进行流式细胞荧光分选分析。利用流式细胞荧
光分选系统选择筛选的克隆后,进行碱基序列分析。
[0189]
实施例6.融合有人igg fc结构域的单域抗体的表达及纯化
[0190]
6-1.融合有人igg fc结构域的一价单域抗体的表达及纯化
[0191]
在tgex-fc(igg1)或tgex-fc(igg4)表达载体中克隆上述实施例5中筛选的克隆。为了融合有人igg fc结构域的单域抗体的表达,计数存活率为95%~99%的expi-cho细胞并向25ml的培养基(expi-cho表达培养基(expression medium)(gibco公司))中加入7
×
106个细胞,在保持8%的co2的37℃的振荡培养器中以125rpm过夜培养。然后,向80μl的expifectamine
tm
cho试剂(reagent)(gibco公司,100033021)与920μl的optipro
tm
培养基(medium)混合液中加入20μg的编码融合有人igg fc结构域的单域抗体的质粒脱氧核糖核酸与1ml的optipro
tm
培养基的混合液并在常温下反应5分钟后,向培养的细胞中添加。在保持8%的co2的37℃的振荡培养器中以125rpm培养细胞20小时。然后,放入用于加强融合有人igg fc结构域的单域抗体的表达的150μl的expifectamine
tm
cho增强剂(enhancer)(gibco公司)与6ml的expicho feed(gibco公司)后,在保持5%的co2的振荡培养器中以125rpm培养5天。在4℃的温度下以4000rpm离心分离培养的细胞30分钟后,使用0.2μm的注射器过滤器过滤上清液。然后,向hitrap protein g hp柱(column)(ge healthcare公司)上样上清液后,使用磷酸盐缓冲溶液洗涤后,使用igg洗脱缓冲液(elution buffer)(赛默飞世尔公司(thermo))从柱上洗脱融合有人igg fc结构域的单域抗体。加入1m的tris-hcl(ph9.0)中和洗脱的试样后,在4℃的温度下保管直至使用前。
[0192]
6-2.融合有人igg4 fc结构域的二价单域抗体的表达及纯化
[0193]
利用2个g2s接头(ggsggs)连接上述实施例5中筛选的克隆来制备二价单域抗体。编码上述二价单域抗体的核苷酸通过基因合成(marcrogen公司,韩国)来获得。为了融合有人igg4 fc结构域的单域抗体的表达及纯化,将合成的基因克隆到tgex-fc(igg4)表达载体。然后,以与上述实施例6-1记载的方法相同的方法表达及纯化。
[0194]
实施例7.融合有人igg4 fc结构域的双特异性(bispecific)单域抗体的表达及纯化
[0195]
从上述实施例5中筛选的克隆中各筛选1种分别与pd-l1和cd47抗原特异性结合的单域抗体。利用肽接头连接编码各单域抗体的核苷酸序列,按照顺序连接与pd-l1特异性结合的2个单域抗体和与cd47特异性结合的单域抗体(抗pd-l1 sdab
×
抗pd-l1 sdab
×
抗cd47sdab)。通过基因合成(marcrogen公司,韩国)来获得编码上述三价双特异性单域抗体的核苷酸序列。为了融合有人igg4 fc结构域的单域抗体的表达及纯化,将合成的基因克隆到tgex-fc(igg4)表达载体。然后,以与上述实施例6-1记载的方法相同的方法表达及纯化。
[0196]
实施例8.利用流式细胞荧光分选技术评估融合有人igg fc结构域的单或双特异性单域抗体与免疫抗原的结合能力
[0197]
通过流式细胞荧光分选技术确认上述实施例6及实施例7中纯化的抗pd-l1 hcab(pdl1 nb#01-igg1)、抗pd-l1二价hcab(pp nb-igg4)、抗cd47 hcab(cd47 nb-igg4)、抗pd-l1
×
cd47 hcab(ppc nb-igg4)与免疫抗原的结合能力。
[0198]
具体地,使用dpbs洗涤cho-k1_pd-l1细胞株(过表达pd-l1抗原的cho-k1细胞)或expi-cho_cd47细胞株(过表达cd47抗原的expi-cho细胞)后,在常温下以1200rpm离心分离3分钟。去除上清液后,使用2%的脱脂牛奶使细胞再悬浮并在4℃的温度下封闭30分钟。在
hcab(cd47 nb-igg4)、抗pd-l1
×
cd47 hcab(ppc nb-igg4)的96孔酶标板(greiner公司)中以1.5nm的水平饱和结合。利用1x kinetic缓冲液(buffer)(fortebio公司)将pd-l1及cd47抗原以2倍的方式梯度稀释为10nm~400nm,在30℃的温度下以1000rpm搅拌并反应。试样的结合与解离反应分别分析200秒钟、400秒钟。结果数据利用1:1相互作用模型(全局拟合(global fitting))方法来分析。
[0206]
实施例11.评估抗pd-l1
×
cd47 hcab(ppc nb-igg4)的生物体外(in vitro)有效性及安全性
[0207]
11-1.评估对pd-l1抗原的生物体外有效性
[0208]
利用cho-k1_pd-l1细胞(诱导pd-l1抗原的过表达的cho-k1细胞)和表达pd-1的jurkat细胞评估上述实施例7中纯化的抗pd-l1
×
cd47 hcab(ppc nb-igg4)的生物体外有效性。
[0209]
具体地,向96孔酶标板的每孔分注2
×
104cell的cho-k1_pd-l1细胞(诱导pd-l1抗原的过表达的cho-k1细胞)后,在保持5%的co2的培养基中培养16小时。然后去除培养基,以不同浓度处理抗pd-l1
×
cd47 hcab(ppc nb-igg4)并反应1小时。以5
×
105cell/100μl分注jurkat细胞后,处理pha至0.5mg/ml,向处理抗pd-l1
×
cd47hcab(ppc nb-igg4)的cho-k1_pd-l1细胞中加入并反应48小时。然后,通过酶联免疫吸附测定方法测量上清液中的白细胞介素2(il-2)的浓度来评估抗pd-l1
×
cd47 hcab(ppc nb-igg4)的生物体外有效性。
[0210]
11-2.评估对cd47抗原的生物体外有效性及安全性
[0211]
上述实施例7中纯化的抗pd-l1
×
cd47 hcab(ppc nb-igg4)的生物体外有效性使用通过cd47抗原特异性结合的巨噬细胞(macrophage)的吞噬作用的激活程度和人红细胞结合(human rbc binding)、红细胞凝集反应来评价。
[0212]
具体地,将5
×
106cell的thp-1细胞分注到100毫米的皮氏培养皿中,在保持5%的co2的培养基中培养24小时。然后,使用40nm的pma反应24小时后,去除培养基,使用1μm的深红染料(deep red dye)染色。染色结束后,更换培养基后放置(resting)48小时。将使用胰蛋白酶(trypsin)分离的thp-1细胞与使用3μm的cfse染色的prey细胞(cell)(raji细胞)以8:1的比例混合后,以不同浓度处理抗pd-l1
×
cd47 hcab(ppc nb-igg4)并共培养(co-culture)4小时。然后,利用流式细胞荧光分选技术评估吞噬作用程度。
[0213]
为了确认人红细胞(red blood cell)与抗pd-l1
×
cd47 hcab(ppc nb-igg4)的结合能力,使用dpbs洗涤红细胞7次后,使用dpbs稀释至12%(v/v)。向96孔v底(96well v bottom)酶标板分注50μl的2
×
的抗pd-l1
×
cd47 hcab(ppc nb-igg4)后,加入50μl的12%(v/v)红细胞并在4℃的温度下反应1小时。使用dpbs洗涤细胞后,将特异性识别人igg4的抗体(抗人(anti-human)igg4)作为二抗来处理后,在4℃的温度下反应1小时。使用dpbs洗涤细胞后,通过流式细胞荧光分选技术评估与红细胞结合的抗pd-l1
×
cd47 hcab(ppc nb-igg4)的程度。
[0214]
为了评估抗pd-l1
×
cd47 hcab(ppc nb-igg4)的红细胞凝集反应,使用dpbs洗涤人红细胞7次后,使用dpbs稀释至6%(v/v)。向96孔u底(96well u bottom)酶标板分注50μl的2
×
的抗pd-l1
×
cd47 hcab(ppc nb-igg4)后,加入50μl的6%(v/v)的人红细胞。在常温下反应1小时后,通过肉眼观察来评估由抗pd-l1
×
cd47hcab(ppc nb-igg4)引起的红细胞凝集反应。
[0215]
实施例12.评估抗pd-l1
×
cd47 hcab(ppc nb-igg4)的生物体内(in vivo)有效性
[0216]
上述实施例7中纯化的抗pd-l1
×
cd47 hcab(ppc nb-igg4)的生物体内有效性是通过向c57bl/6小鼠注入诱导人pd-l1和人cd47的表达的肿瘤细胞株(b16f10细胞)来评估抗pd-l1
×
cd47 hcab(ppc nb-igg4)的抗肿瘤效果的。
[0217]
具体地,向6周龄-8周龄的c57bl/6雌性小鼠注入8
×
105cell/100μl的b16f10_pd-l1
×
cd47细胞株(诱导人pd-l1和人cd47的过表达的b16f10细胞)。诱导肿瘤形成,直至肿瘤横
×
纵的大小到达3mm
×
3mm。然后,间隔2天腹腔给药10mpk的抗pd-l1
×
cd47 hcab(ppc nb-igg4)共7次并测量肿瘤大小。最后一次腹腔给药后,间隔2天测量肿瘤大小1周时间来评估抗pd-l1
×
cd47 hcab(ppc nb-igg4)的生物体内有效性。
[0218]
为了确认通过静脉给药的抗pd-l1
×
cd47 hcab(ppc nb-igg4)的抗肿瘤效果,利用相同的小鼠肿瘤模型以间隔3天的方式静脉给药5mpk、10mpk的抗pd-l1
×
cd47 hcab(ppc nb-igg4)共7次后,测量肿瘤大小。最后静脉给药3天后,测量肿瘤大小来评估抗pd-l1
×
cd47 hcab(ppc nb-igg4)的生物体内有效性。
[0219]
实验例1.抗pd-l1 hcab(pdl1 nb#01-igg1)的制备及生物体外特性评估
[0220]
1-1.制备抗pd-l1 hcab(pdl1 nb#01-igg1)
[0221]
利用人pd-l1抗原作为免疫抗原以与上述实施例5中记载的方法相同的方法筛选对pd-l1抗原具有特异性的单域抗体克隆并进行碱基序列分析。上述筛选的抗pd-l1 sdab(pdl1 nb#01)的氨基酸序列如下述表5及表6所示。
[0222]
并且,利用上述筛选的抗pd-l1 sdab(pdl1 nb#01)以与实施例6-1中记载的方法相同的方法表达并纯化包含人igg1 fc结构域的对pd-l1具有特异性的一价单域抗体,将纯化的一价单域抗体命名为抗pd-l1 hcab(pdl1 nb#01-igg1)。包含人igg1 fc结构域的抗pd-l1hcab(pdl1 nb#01-igg1)的氨基酸序列如下述表7所示。
[0223]
并且,利用上述筛选的抗pd-l1 sdab(pdl1 nb#01)克隆以与实施例6-2中记载的方法相同的方法表达及纯化包含人igg4 fc的对pd-l1具有特异性的二价单域抗体,将纯化的二价单域抗体命名为抗pd-l1二价hcab(pp nb-igg4)。抗pd-l1二价hcab(pp nb-igg4)中除人igg4 fc以外的抗pd-l1二价sdab(pp nb)的氨基酸序列如下述表8所示,包含人igg4 fc结构域的抗pd-l1二价hcab(pp nb-igg4)的氨基酸序列如下述表9所示。
[0224]
表5
[0225][0226]
表6
[0227][0228]
表7
[0229][0230]
表8
[0231][0232]
表9
[0233]
[0234][0235]
1-2.评估抗pd-l1 hcab(pdl1 nb#01-igg1)及抗pd-l1二价hcab(pp nb-igg4)的抗原结合能力及对pd-1/pd-l1相互作用的抑制能力
[0236]
利用与上述实施例8和实施例9中记载的方法相同的方法利用流式细胞荧光分选技术评估上述实验例1中纯化的抗pd-l1 hcab(pdl1nb#01-igg1)及抗pd-l1二价hcab(pp nb-igg4)的抗原结合能力(图1a及图2a)及对pd-1/pd-l1相互作用的抑制能力(图1b及图2b)。
[0237]
结果如图1a及图1b所示,抗pd-l1 hcab(pdl1 nb#01-igg1)在cho-k1_pd-l1细胞(以规定量表达pd-l1抗原的cho-k1细胞)中确认到23.31nm(ec50)的抗原结合能力,确认到对pd-1/pd-l1相互作用的抑制能力为4.60nm(ic50)。
[0238]
并且,如图2a及图2b所示,抗pd-l1二价hcab(pp nb-igg4)在cho-k1_pd-l1细胞(以规定量表达pd-l1抗原的cho-k1细胞)中确认到1.93nm(ec50)的抗原结合能力,确认到对pd-1/pd-l1相互作用的抑制能力为2.86nm(ic50)。
[0239]
1-3.评估抗pd-l1 hcab(pdl1 nb#01-igg1)及抗pd-l1二价hcab(pp nb-igg4)与免疫抗原的亲和度
[0240]
以与上述实施例9中记载的方法相同的方法评估上述实验例1中纯化的抗pd-l1 hcab(pdl1 nb#01-igg1)及抗pd-l1二价hcab(pp nb-igg4)分别与pd-l1抗原的亲和度。
[0241]
结果如表10所示,确认到抗pd-l1 hcab(pdl1 nb#01-igg1)与pd-l1抗原的7.08nm的抗原亲和力,确认到抗pd-l1二价hcab(pp nb-igg4)与pd-l1抗原的4.58nm的抗原亲和力。
[0242]
表10
[0243]
[0244]
实验例2.抗c47 hcab(cd47 nb-igg4)的制备及生物体外特性评估
[0245]
2-1.制备抗c47 hcab(cd47 nb-igg4)
[0246]
利用人cd47抗原作为免疫抗原以与上述实施例5记载的方法相同的方法筛选对cd47抗原具有特异性的单域抗体克隆并进行碱基序列分析。上述筛选的抗cd47 sdab(cd47 nb#01)的氨基酸序列如下述表11及表12所示。
[0247]
并且,利用上述筛选的抗cd47 sdab(cd47_nb_#01)以与实施例6-1中记载的方法相同的方法表达并纯化包含人igg4 fc结构域的对cd47具有特异性的单域抗体,将纯化的单域抗体命名为抗cd47 hcab(cd47 nb-igg4)。包含人igg4 fc结构域的抗cd47 hcab(cd47nb-igg4)的氨基酸序列如下述表13所示。
[0248]
表11
[0249][0250]
表12
[0251][0252]
表13
[0253][0254]
2-2.评估抗cd47 hcab(cd47 nb-igg4)的抗原结合能力及对cd47/sirpalpha相互作用的抑制能力
[0255]
以与上述实施例8和实施例9中记载的方法相同的方法利用流式细胞荧光分选技术评估上述实验例2-1中纯化的抗cd47 hcab(cd47 nb-igg4)的抗原结合能力(图3a)和对cd47/sirpalpha相互作用的抑制能力(图3b)。
[0256]
结果如图3a及图3b所示,抗cd47 hcab(cd47 nb-igg4)在expi-cho_cd47细胞(以规定的量表达cd47抗原的expi-cho细胞)中确认到3.78nm(ec50)的抗原结合能力,确认到对cd47/sirpalpha相互作用的抑制能力为7.28nm(ic50)。
[0257]
2-3.评估抗cd47 hcab(cd47 nb-igg4)与免疫抗原的亲和度
[0258]
以与上述实施例10中记载的方法相同的方法评估上述实验例2-1中纯化的抗cd47 hcab(cd47 nb-igg4)与cd47抗原的亲和度。
[0259]
结果如表14所示,确认到抗cd47 hcab(cd47 nb-igg4)与cd47抗原的2.78nm的抗原亲和力。
[0260]
表14
[0261][0262]
实验例3.抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的制备及生物体外特性评估
[0263]
3-1.制备抗pd-l1
×
cd47三价hcab(ppc nb-igg4)
[0264]
利用上述实验例1-1中筛选的克隆制备包含人igg4 fc结构域的对作为免疫抗原的pd-l1及cd47抗原具有双特异性的单域抗体。利用编码上述实验例1-1中筛选的抗pd-l1 sdab(pdl1 nb#01)的核苷酸序列和编码上述实验例2-1中筛选的抗cd47 sdab(cd47 nb#01)的核苷酸序列以与上述实施例7中记载的方法相同的方法合成基因并克隆到tgex-fc(igg4)表达载体中后,表达及纯化后命名为抗pd-l1
×
cd47 hcab(ppc nb-igg4)。
[0265]
上述抗pd-l1
×
cd47三价hcab(ppc nb-igg4)中除人igg4 fc结构域以外的pd-l1
×
cd47三价sdab的氨基酸序列如下述表15所示,上述包含igg4 fc结构域的抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的氨基酸序列如下述表16所示。
[0266]
表15
[0267][0268][0269]
表16
[0270][0271]
3-2.评估抗pd-l1
×
cd47三价hcab(ppc nb-igg4)与免疫抗原的结合能力
[0272]
以与上述实施例8中记载的方法相同的方法利用流式细胞荧光分选技术确认上述实验例3-1中纯化的抗pd-l1
×
cd47三价hcab(ppc nb-igg4)与pd-l1抗原及cd47抗原的结合能力。
[0273]
结果如图4a及图4b所示,抗pd-l1
×
cd47三价hcab(ppc nb-igg4)在cho-k1_pd-l1细胞(以规定的量表达pd-l1抗原的cho-k1细胞)中确认到13.33nm(ec50)的抗原结合能力,在expi-cho_cd47细胞(以规定的量表达cd47抗原的expi-cho细胞)中确认到18.80nm(ec50)的抗原结合能力。
[0274]
3-3.评估抗pd-l1
×
cd47三价hcab(ppc nb-igg4)对pd-1/pd-l1及cd47/sirpalpha相互作用的抑制能力
[0275]
以与上述实施例9中记载的方法相同的方法利用流式细胞荧光分选技术确认上述实验例3-1中纯化的抗pd-l1
×
cd47三价hcab(ppc nb-igg4)对pd-1/pd-l1及cd47/sirpalpha相互作用的抑制能力。
[0276]
结果如图5a及图5b所示,确认到抗pd-l1
×
cd47三价hcab(ppc nb-igg4)对pd-1/pd-l1相互作用的抑制能力为9.15nm(ic50),确认到对cd47/sirpalpha相互作用的抑制能力为22.44nm(ic50)。
[0277]
3-4.评估抗pd-l1
×
cd47三价hcab(ppc nb-igg4)与免疫抗原的亲和度
[0278]
以与上述实施例10中记载的方法相同的方法评估上述实验例3-1中纯化的抗pd-l1
×
cd47三价hcab(ppc nb-igg4)与pd-l1抗原及cd47抗原的亲和度。
[0279]
结果如表17所示,确认到抗pd-l1
×
cd47三价hcab(ppc nb-igg4)对pd-l1抗原的6.84nm的优秀的亲和力,确认到对cd47抗原的3.62nm的优秀的亲和力。
[0280]
表17
[0281][0282][0283]
实验例4.评估抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的生物体外有效性及安全性
[0284]
利用上述实验例3-1中纯化的抗pd-l1
×
cd47三价hcab(ppc nb-igg4)进行生物体外有效性及安全性的评估。
[0285]
4-1.评估抗pd-l1
×
cd47三价hcab(ppc nb-igg4)对pd-l1抗原的生物体外有效性
[0286]
以与上述实施例11-1中记载的方法相同的方法使抗pd-l1
×
cd47三价hcab(ppc nb-igg4)抑制cho-k1_pd-l1细胞(以规定量表达pd-l1的cho-k1细胞)与表达pd-1的jurkat细胞间的相互作用测定jurkat细胞中表达的白细胞介素2的浓度来评估抗pd-l1
×
cd47三价hcab(ppc nb-igg4)对pd-l1抗原的生物体外有效性。
[0287]
结果如图6所示,通过抗pd-l1
×
cd47三价hcab(ppc nb-igg4)在表达pd-1的jurkat细胞与表达pd-l1的cho-k1细胞之间的干涉确认到抑制cho-k1细胞与jurkat细胞的相互作用的1.45nm(ic50)的抑制能力。
[0288]
4-2.评估对cd47抗原的抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的吞噬作用
[0289]
抗pd-l1
×
cd47三价hcab(ppc nb-igg4)对cd47抗原的生物体外有效性确认是以与上述实施例11-2中记载的方法相同的方法通过pma将thp-1细胞巨噬细胞化。然后,通过选择性地与表达cd47抗原的prey细胞(raji细胞)结合来评估通过巨噬细胞的吞噬作用程度。
[0290]
结果如图7所示,通过抗pd-l1
×
cd47三价hcab(ppc nb-igg4)在thp-1细胞与表达cd47抗原的prey细胞(raji细胞)之间的干涉确认到与表达cd47的prey细胞的1.44nm(ec50)的结合能力。
[0291]
4-3.评估对cd47抗原的抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的人红细胞结合能力
[0292]
由于人红细胞表达cd47的特征,与cd47抗原特异性结合的抗体会通过与人红细胞的结合引起贫血等副作用。因此,通过确认抗pd-l1
×
cd47三价hcab(ppc nb-igg4)与人红细胞的结合能力来评估抗体的安全性。以与上述实施例11-2中记载的方法相同的方法利用流式细胞荧光分选技术评估与人红细胞的结合能力。
[0293]
结果如图8所示,确认到作为阳性对照组的cd47单克隆抗体(竞争者(competitor))在2.93nm以上与人红细胞结合,与之相反,确认到抗pd-l1
×
cd47三价hcab(ppc nb-igg4)在实验中使用的最大的3μm的浓度下也不与红细胞结合。
[0294]
4-4.评估对cd47抗原的抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的红细胞凝集反应
[0295]
人红细胞与cd47抗原特异性抗体的结合诱发红细胞凝集反应。因此,通过与上述
实施例11-2中记载的方法相同的方法确认红细胞与抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的结合评估红细胞凝集反应来确认抗体的安全性。
[0296]
结果如图9所示,作为阳性对照组的cd47单克隆抗体(竞争者)在11.72nm以上的浓度中确认到红细胞凝集反应,与之相反,抗pd-l1
×
cd47三价hcab(ppc nb-igg4)在实验中使用的最大的3μm的浓度下也未确认到红细胞凝集反应。
[0297]
实验例5.评估抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的生物体内有效性
[0298]
利用小鼠肿瘤模型进行上述实验例3-1中纯化的抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的生物体内有效性的评估。
[0299]
5-1.确认通过腹腔给药的抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的抗肿瘤效果
[0300]
以与上述实施例12中记载的方法相同的方法通过向注入表达pd-l1和cd47抗原的肿瘤细胞(b16f10细胞)形成肿瘤的小鼠模型腹腔给药抗pd-l1
×
cd47三价hcab(ppc nb-igg4)来观察抗肿瘤效果。
[0301]
结果如图10所示,确认到与阴性对照组(同型组(isotype group))相比,抗pd-l1
×
cd47三价hcab(ppc nb-igg4)示出约49.4%的抗肿瘤效果,与联合使用构成抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的各个抗体处理(抗pd-l1二价hcab(pp nb-igg4) 抗cd47 hcab(cd47 nb-igg4))的组相比,确认到示出约38.8%的抗肿瘤效果。
[0302]
5-2.确认通过静脉给药的抗pd-l1
×
cd47三价hcab(ppc nb-igg4)的抗肿瘤效果
[0303]
以与上述实施例12中记载的方法相同的方法通过向注入表达pd-l1和cd47抗原的肿瘤细胞(b16f10细胞)形成肿瘤的小鼠模型静脉给药抗pd-l1
×
cd47三价hcab(ppc nb-igg4)来观察抗肿瘤效果。
[0304]
结果如图11所示,确认到与阴性对照组(同型组)相比,抗pd-l1
×
cd47三价hcab(ppc nb-igg4)示出最大约74.4%的抗肿瘤效果。
[0305]
产业上的可利用性
[0306]
本发明的单域抗体表现出针对作为免疫检查点蛋白的cd47的优秀的亲和性及抗肿瘤效果,可以在免疫抗癌疗法中有效地用作免疫检查点抑制剂。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。