1.本发明属于微生物领域,具体涉及一株硫酸盐还原菌及其与碳源联合修复镉污染土壤的方法。
背景技术:
2.土壤重金属污染是农业生态系统面临的严重挑战之一,其中镉(cd)是世界公认的毒性最强的重金属之一。而且,土壤中镉的移动性较强,更容易被植物根系吸收、转移到植物的可食部,从而通过食物链进入人体。因此,实现农田土壤镉污染的高效修复是业内的普遍追求。
3.现有技术中,修复方法包括物理修复、化学修复和生物修复。其中,生物修复法具有修复成本低、对环境影响较小、能够避免物理和化学修复所带来的二次污染和土壤营养元素的流失等优点,成为研究重点。硫酸盐还原菌(srb)能够消耗土壤中的碳氮源,通过还原作用将土壤中硫酸根还原为负二价硫离子,进而与镉形成较为稳定的硫化镉,降低镉在土壤中的生物可利用性。但当土壤碳源不足时,有机物无法持续提供电子,致使硫酸盐还原菌活性降低,修复效果不稳定。同时,该方法非常依赖于硫酸盐还原菌还原硫酸根的能力,单一的硫酸盐还原菌往往难以取得稳定、高效的还原效果,多种微生物制备的复合菌剂又存在成本高、在土壤中难以保持微生物组合的稳定性从而效果不稳定等缺陷。
4.因此,如果能提供一种可高效、稳定修复被镉污染的土壤,降低土壤中有效态镉含量的方法,将具有重要的现实意义。
技术实现要素:
5.本发明的目的是提供一株硫酸盐还原菌及其与碳源联合修复镉污染土壤的方法。
6.为实现上述发明目的,本发明所采用的技术方案是:一株普通脱硫弧菌(desulfovibriovulgaris)srb-cib,于2018年6月4日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏编号为:cgmcc no.15859。
7.相应的,一株普通脱硫弧菌(desulfovibrio vulgaris)srb-cib,所述普通脱硫弧菌的16s rdna序列如seq id no:1所示。
8.相应的,利用所述普通脱硫弧菌制备的或包括所述普通脱硫弧菌的菌制剂。
9.优选的,所述菌制剂的制备方法包括:利用培养基培养所述普通脱硫弧菌,所述培养基组分包括:kh2po
4 0.5g,nh4cl 1.0g,cacl2·
2h2o0.1g,na2so
4 1.0g,mgso4·
7h2o 2.0g,70%乳酸钠25ml,酵母浸汁5.0g,蒸馏水1000ml,灭菌后再加入feso4·
7h2o 15g,抗坏血酸0.1g,硫代乙醇酸钠0.1g,半胱氨酸0.5g,调ph值至8.0~8.5。
10.相应的,所述菌制剂在修复被镉污染的土壤中的应用。
11.优选的,将所述菌制剂施加到待修复土壤中。
12.优选的,所述应用包括:将碳源与菌液混匀,获得修复剂;将修复剂施加到待修复土壤中,翻耕均匀。
13.优选的,所述碳源为缓释碳源。
14.优选的,所述缓释碳源制备方法包括:
15.将聚己内酯和玉米淀粉共混,加入甘油,加热搅拌,冷却后破碎,得到颗粒1;将海藻酸钠加入纯水中,水浴加热搅拌至充分溶解,冷却至室温,加入粉碎后的玉米芯搅匀,得到胶状溶液;将颗粒1加入所述胶状溶液中搅拌,使胶状溶液充分包裹在颗粒1表面,得到颗粒2;将颗粒2取出,置于交联剂中,固化后得到所述缓释碳源。
16.相应的,所述菌制剂在降低农作物镉积累量中的应用。
17.本发明具有以下有益效果:本发明提供了一株新的硫酸盐还原菌,可在土壤中快速定殖并高效还原硫酸根离子,硫离子与镉生成硫化镉沉淀,从而高效降低土壤中有效态镉的含量,降低农作物对镉的积累。
18.本发明还提供了一种利用硫酸盐还原菌和固体缓释碳源联合修复镉污染土壤的方法。固体缓释碳源可以缓慢释放有机物,其一方面能够快速降低土壤的氧化还原电位,使之形成还原环境从而促进硫酸盐还原菌的生长,并为硫酸盐还原菌的生长提供营养;另一方面,固体缓释碳源也可以促进水稻根表铁膜的形成,进一步抑制水稻吸收镉。
19.本发明方法简单,修复效果良好,使用材料无毒无害,能够被完全降解,对土壤影响小,在修复镉污染的同时还可提高土壤肥力,环境友好,无二次污染。
附图说明
20.图1为srb-cib的电镜扫描图。
具体实施方式
21.本发明提供了一株新的硫酸盐还原菌:普通脱硫弧菌(desulfovibrio vulgaris)srb-cib,于2018年6月4日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏编号为:cgmcc no.15859,其16s rdna序列如seq id no:1所示。
22.本发明还基于所述硫酸盐还原菌提供了一种联合使用硫酸盐还原和碳源修复被镉污染的土壤的方法,具体包括如下步骤:
23.1、制备硫酸盐还原菌菌液。将所述普通脱硫弧菌活化、扩大培养至活菌浓度≥1.0
×
108cfu/ml,获得菌液。
24.2、制备碳源。所述碳源优选为缓释碳源,制备方法包括:将聚己内酯和玉米淀粉按照质量比为2~4:4~6置于反应釜中共混,加入7~8%甘油,125℃加热搅拌,冷却后破碎成2~3mm颗粒,制备得到颗粒1。
25.将海藻酸钠加入100ml纯水中,置于80℃水浴锅中,搅拌至充分溶解,冷却至室温,加入粒径约为0.5mm的粉碎后的玉米芯搅拌均匀,玉米芯与海藻酸钠的质量比为6~8:1~3,得到胶状溶液。将颗粒1加入所述胶状溶液中搅拌(20r/min,3~5min),使胶状溶液充分包裹在颗粒1表面,得到颗粒2。
26.将颗粒2取出,置于2%(质量百分比)cacl2交联剂中,4℃固化24h,取出用超纯水冲洗3次,即得固体缓释碳源。
27.3、将碳源与菌液混匀,获得修复剂。将修复剂施加到待修复土壤中,翻耕均匀。随后正常种植作物即可。以种植水稻为例:翻耕均匀后,将土壤淹水5天,再种植水稻,水稻种
植期间,保持2~3cm的浅水层淹水灌溉。优选的方案为:所述菌液添加量为土壤中镉浓度的30倍(摩尔浓度比),缓释碳源的添加量为120~200kg/亩。
28.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。所获得的数据均为进行至少3次重复后获得的平均值,且各重复获得的均为有效数据。
29.本发明涉及的培养基、试剂如下:
30.1、固体纯化培养基:kh2po
4 0.5g/l,nh4cl 1.0g/l,cacl2·
2h2o0.1g/l,mgso4·
7h2o 2.0g/l,酵母膏1.0g/l,乳酸钠(70%)5ml/l,na2so
4 1.0g/l,琼脂20g/l,121℃高压灭菌20min后冷却至约50℃,加入过滤除菌的feso4·
7h2o 1.5g/l,vc 0.1g/l,硫代乙醇酸钠0.1g/l,半胱氨酸l-cys 0.5g/l,不断搅拌下调节ph至8.0。
31.2、液体培养基a:kh2po
4 0.5g,nh4cl 1.0g,cacl2·
2h2o 0.1g,na2so
4 1.0g,mgso4·
7h2o 2.0g,乳酸钠(70%)15ml,酵母浸汁8.0g,蒸馏水1000ml。121℃,20min灭菌后再加入feso4·
7h2o 15g,抗坏血酸0.1g,硫代乙醇酸钠0.1g,半胱氨酸0.5g,通过0.22μm滤膜(pes)过滤除菌,调ph值至8.0~8.5。
32.3、液体培养基b:kh2po
4 0.5g,nh4cl 1.0g,cacl2·
2h2o 0.1g,na2so
4 1.0g,mgso4·
7h2o 2.0g,乳酸钠(70%)25ml,酵母浸汁5.0g,蒸馏水1000ml。121℃,20min灭菌后再加入feso4·
7h2o 15g,抗坏血酸0.1g,硫代乙醇酸钠0.1g,半胱氨酸0.5g,通过0.22μm滤膜(pes)过滤除菌,调ph值至8.0~8.5。
33.实施例一:微生物的筛选与鉴定
34.硫酸盐还原菌的筛选及鉴定。从中国科学院成都生物研究所保藏的硫酸盐还原微生物中筛选高产硫化物的硫酸盐还原菌,方法为:用一次性无菌注射器吸取各微生物100μl菌液在固体纯化培养基上涂布,放置于厌氧盒中,同时加入厌氧袋吸收盒子中的氧气,于35℃密闭培养4d。挑选较黑的单菌落在新的固体纯化培养基上平板划线,再次35℃密闭培养4d后取出。多次划线纯化后得到硫酸盐还原菌srb1、srb2、srb3、srb-cib。选择较黑的单菌落原因为:培养基中存在feso4·
7h2o,硫酸盐还原菌可将硫酸根还原为硫离子,硫离子与亚铁离子生成黑色的fes。因此在培养基中硫酸盐还原菌的菌落呈黑色,且菌落颜色越黑,证明该菌落产生的硫化物越多。
35.液体培养基a中碳氮源为8g/l酵母浸汁和15ml/l乳酸钠,液体培养基b中碳氮源为5g/l酵母浸汁和25ml/l乳酸钠。将各硫酸盐还原菌srb1、srb2、srb3、srb-cib分别接种10%(v/v)到液体培养基a和液体培养基b中,在35℃下厌氧培养12d。使用亚甲基蓝分光光度法(gb/t16489-1996)测定各培养液中的硫化物含量,筛选出高产硫化物的硫酸盐还原菌。结果如表1所示。
36.表1不同硫酸盐还原菌在不同培养基中产硫化物情况
37.菌株液体培养基a液体培养基bsrb11275mg/l1674mg/lsrb21216mg/l1708mg/lsrb31152mg/l1656mg/lsrb-cib1271mg/l1810mg/l
cacl2,溶解后使用6mol/l hcl调节ph=7.3,避光储存于塑料瓶中。
47.水稻根表的铁膜测定采用dcb浸提法。将水稻根部洗去表面的泥土后再用超纯水冲洗2遍,用吸水纸上吸干根上水分,将根剪成1cm小段,将0.500g新鲜根系置于离心管中,加入25ml 0.3mol/l二水合柠檬酸三钠(络合剂)与1.0mol/l nahco3(缓冲剂)的混合液及3.0g保险粉(na2s2o4)(还原剂),25℃恒温振荡3h(转速280r/min)。dcb提取后,用超纯水冲洗根部三次,将漂洗过的水倒入dcb提取物中,定容至100ml。溶液通过0.45μm水系滤膜,使用火焰原子吸收分光光度计(aas)测定fe浓度。将根在110℃下杀青30min,70℃烘干至恒重后称重,并记录干根重。
48.水稻样品根、茎叶、糙米、谷壳中的镉含量的测定采用硝酸-过氧化氢微波消解-石墨炉原子吸收分光光度法。具体方法为:称取0.1g植物组织样品放入聚四氟乙烯消解罐中,各加入5ml优级纯的浓硝酸和30%过氧化氢后,放入微波消解仪中进行消解(温度升至150℃,保持25min)。消解好的样品用超纯水在玻璃容量瓶中定容至100ml,过滤后用石墨炉原子吸收分光光度计(aas)测定cd浓度。
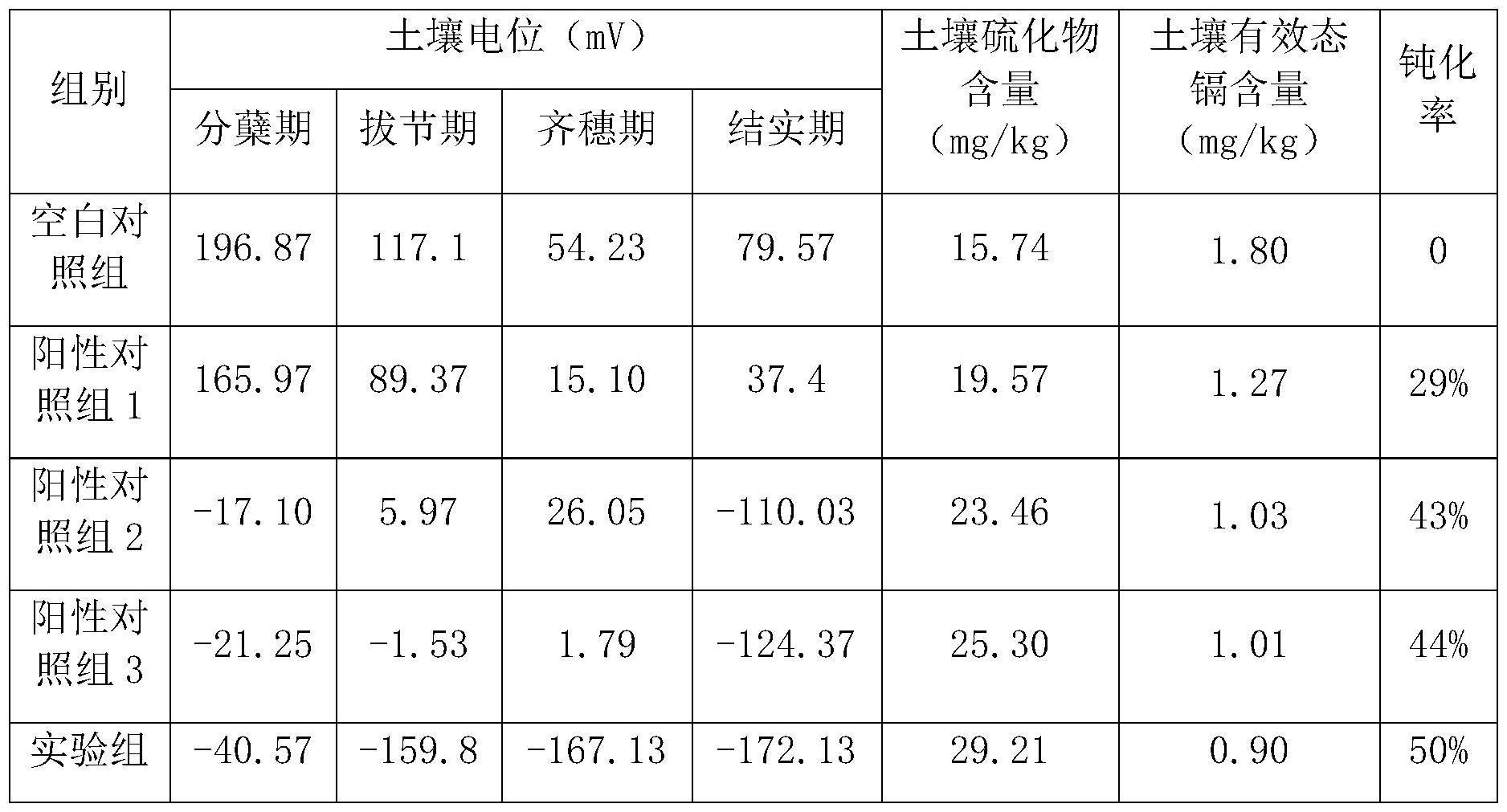
49.各组土壤电位及硫化物变化情况如表2所示。表2中钝化率指有效态镉被转化为生物难以利用形式的百分率,以空白对照组有效态镉为基础,各组钝化率=(空白对照组有效态镉含量-待计算组别的有效态镉含量)/空白对照组有效态镉含量
×
100%。
50.表2土壤电位及硫化物变化情况对照表
[0051][0052]
土壤氧化还原电位(eh)与土壤中镉的生物有效性与溶解度密切相关。当土壤eh高于0mv时,镉主要以水溶性cdso4的形态存在,从而增加土壤中镉的溶解度和生物有效性。当土壤eh降低至0mv以下时,在土壤中的厌氧微生物如硫酸盐还原菌等作用下,土壤中的锰离子、铁离子、硫酸根、硝酸根以及有机物质的异化产物被还原成价位较低的离子和一些低分子有机酸,有利于cds沉淀的形成,并可强化镉对铁或锰的羟基氧化物的吸附,从而降低镉的生物有效态。
[0053]
如表2所示,实验组的土壤eh值明显低于所有对照组,证明同时投加特定的硫酸盐还原菌和固体碳源能够使土壤eh快速转化为还原状态,有利于降低有效态镉含量和降低硫化物、硫化镉的形成。
[0054]
各组水稻根表铁膜量变化情况及组织镉积累量如表3所示。表3中增长率指根表铁膜量的增长率,以空白对照组铁膜量为基础,各组增长率=(空白对照组铁膜量-待计算组别的铁膜量)/空白对照组铁膜量
×
100%。
[0055]
表3根表铁膜量及镉积累情况对照表
[0056][0057]
由于长期生长在淹水环境中,水稻能够通过光合作用将产生的氧气输送至根部,从而氧化根系周围微环境中的fe
2
,进而自然形成了红棕色的铁氧化物胶膜(根表铁膜)。根表铁膜对水稻体内镉的积累和转运具有重要影响:根表铁膜量越多,水稻吸收镉越困难。
[0058]
从表4可以看出,特定的硫酸盐还原菌和固体碳源的投加能够显著增加水稻根表铁膜量,从而抑制水稻对镉的吸收,降低水稻各组织中镉含量,有效阻止污染土壤中的镉在生物链中的转移和富集。
[0059]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形、变型、修改、替换,均应落入本发明权利要求书确定的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。