1.本发明涉及有机合成领域,具体而言,涉及一种3,6-二氯偏苯三酸酐的合成方法。
背景技术:
2.荧光标记技术起源于20世纪40年代,当时使用荧光标记抗体来检测相应的抗原。随着分子生物学、现代医学的发展以及各种先进荧光检测技术和仪器的应用,荧光标记作为一种新的、非放射性的标记技术越来越受到人们的重视,并取得了极为迅速的发展,继而广泛应用在细胞内外的物质检测、核酸的检测与疾病早期的诊断等,在生物学及医学研究领域里发挥了重要的作用。目前用于标记的荧光探针染料主要有荧光素类、罗丹明类、邻苯二甲醛类等化合物。其中荧光素及其衍生物在生物领域的研究中占有极其重要的位置,一直是生物分析领域研究的热点。荧光素类化合物因其具有高的摩尔吸光系数、激发和发射波长都在可见光区、在水中有较高的荧光量子产率、无毒、成本低等优点,而被广泛应用于杂交的探针、降解蛋白质的测序以及抗体标记等方。
3.3,6-二氯偏苯三酸酐是合成多种氯代荧光素(如tet、hex和vic等)的关键性前体,这些氯代荧光素已广泛用于寡核苷酸标记和dna测序中。文献(organic process research & development 2001, 5, 45-49;us2002142329a1和cn107754858a)公开报道了制备3,6-二氯偏苯三酸酐的方法,其化学反应路线如下:。
4.该方法以2,5-二氯对二甲苯为原料,在三氯化铝的催化下,通过傅-克乙酰化反应与乙酰氯反应生成1-(2,5-二氯-3,6-二甲基苯基)乙-1-酮;后者与高锰酸钾反应,被氧化生成3,6-二氯苯-1,2,4-三甲酸;该3,6-二氯苯-1,2,4-三甲酸固体直接在高温条件下脱水,生成3,6-二氯偏苯三酸酐。
5.上述方法存在以下不足:1)在高锰酸钾氧化阶段,需要对三个甲基进行彻底氧化,氧化剂耗用量大,产生的固废多;2)氧化反应的前期处于一个非均相反应体系,存在突然引发反应、短时间大量放热导致反应失控的安全隐患;3)在高温脱水阶段,采用对固体反应底物直接高温加热的非常规方法,不利于体系的传质传热,也不利于物料的转移,工艺的可操作性差,不利于放大量产。因此,有必要开发出一种新的合成方法,这对于消除安全风险、易于放大量产进一步提高产品的质量和收率、减少三废排放具有重要的经济意义。
技术实现要素:
6.为了解决上述技术问题,本发明提供一种3,6-二氯偏苯三酸酐的合成方法,以2,5-二氯对二甲苯(式i)为起始原料,包括步骤:(1)在催化剂的催化下,于溶剂中,使2,5-二氯对二甲苯(式i)与草酰氯单酯(式
ii)发生傅-克酰基化反应,生成2-(2,5-二氯-3,6-二甲基苯基)-2-氧亚基乙酸单酯(式iii)。
[0007][0008]
其中r代表烷基,例如甲基或乙基。
[0009]
(2)于溶剂中,式iii所示化合物的酯基先被水解,以羧酸盐的形式溶于水相,形成均相体系,然后控制反应温度,分批加入氧化剂进行氧化反应,生成3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸(式iv)的羧酸盐,将反应液进行过滤、调酸游离等后处理,得到3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸(式iv)。
[0010][0011]
(3)于溶剂体系中,式iv所示化合物在一定的温度下进行脱羰缩合反应,生成3,6-二氯偏苯三酸酐。
[0012]
步骤(1)中,此步反应为经典的傅-克酰基化反应,常规的适合傅-克酰基化反应的溶剂(如二氯甲烷、二氯乙烷、二硫化碳、硝基甲烷和硝基苯等)及催化剂(如三氯化铝、三氯化铁、氯化锌、四氯化钛、氯化锡等lewis酸、质子酸和固体酸等)均可适用。综合考虑经济性和便利性等因素,所述溶剂为二氯甲烷或二氯乙烷;所述催化剂为三氯化铝,摩尔用量为式i的2.0-3.0倍当量。从反应原理上分析,式ii所示的草酰氯单酯均可作为备选的酰基化原料,进一步从成本和可行性考量,所述式ii中r为甲基或乙基时所对应的草酰氯单甲酯或草酰氯单乙酯作为酰基化原料更为合适,摩尔用量为式i的2.0-3.0倍当量。
[0013]
步骤(2)中,此步反应为氧化反应,可选择的方案较多,如空气(氧气)催化氧化法、高价金属氧化法,如使用重铬酸盐和高锰酸盐等。从可操作性、安全性和环保因素选择,所述氧化剂为高锰酸钾。高锰酸钾的氧化反应在酸性、中性和碱性体系下都可进行,反应介质可选适当的有机溶剂或水;在水相碱性体系下进行均相体系氧化,符合本发明的底物设计初衷,更兼顾了安全性和经济性,所用的碱可为碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾、碳酸铯、碳酸锂、氢氧化钠、氢氧化钾和氢氧化锂等,其浓度和量可根据反应的过程消耗、体系碱性氛围和搅拌混合状态进行优化调整。
[0014]
根据本发明优选的,步骤(3)中,所述溶剂体系为浓硫酸,做氧化剂和反应介质。以上步骤产物需要后处理分离,按现有技术即可。
[0015]
在一种实施方式中,本发明提供一种3,6-二氯偏苯三酸酐的合成方法,合成化合
物3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸,然后该化合物在浓硫酸中脱羰缩合得到3,6-二氯偏苯三酸酐。
[0016]
在一种实施方式中,在浓硫酸中脱羰缩合得到3,6-二氯偏苯三酸酐反应中,反应温度区间为110~130℃。
[0017]
在一种实施方式中,在浓硫酸中脱羰缩合得到3,6-二氯偏苯三酸酐反应中,质量分数98%浓硫酸用量为2~10v/w,其表示的是每克3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸,使用2-10ml的质量分数98%浓硫酸。
[0018]
在一种实施方式中,2,5-二氯对二甲苯与草酰氯单酯发生傅-克酰基化反应,生成2-(2,5-二氯-3,6-二甲基苯基)-2-氧亚基乙酸单酯,得到的化合物的酯基先被水解,以羧酸盐的形式溶于水相,形成均相体系,然后分批加入氧化剂进行氧化反应,生成3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸的羧酸盐,然后后处理,得到3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸。
[0019]
在一种实施方式中,2,5-二氯对二甲苯与草酰氯单酯发生傅-克酰基化反应的温度为35~75℃。
[0020]
在一种实施方式中,2,5-二氯对二甲苯与草酰氯单酯发生傅-克酰基化反应中使用的溶剂是二氯乙烷,溶剂用量区间为2~10v/w,其表示的是每克2,5-二氯对二甲苯,使用2-10ml的二氯乙烷溶剂。
[0021]
在一种实施方式中,2,5-二氯对二甲苯与草酰氯单酯发生傅-克酰基化反应中,草酰氯单酯用量区间为2.0~3.0当量,其表示的是草酰氯单酯物质的量是2,5-二氯对二甲苯物质的量的2.0-3.0倍。
[0022]
在一种实施方式中,2,5-二氯对二甲苯与草酰氯单酯发生傅-克酰基化反应中使用三氯化铝作为催化剂,三氯化铝用量区间为2.0~3.0当量,其表示的是三氯化铝物质的量是2,5-二氯对二甲苯物质的量的2.0-3.0倍。
[0023]
在一种实施方式中,分批加入氧化剂是高锰酸钾,高锰酸钾用量在4.2~7.0当量范围,即高锰酸钾物质的量是2-(2,5-二氯-3,6-二甲基苯基)-2-氧亚基乙酸单酯物质的量的4.2-7.0倍。
[0024]
在一种实施方式中,化合物的酯基先被水解是在10%碳酸钾水溶液中,反应体系升温至50~80℃,保温反应至酯基水解完全后,形成均相体系。
[0025]
本发明提供了一种3,6-二氯偏苯三酸酐的合成方法。通过优选酰基化原料,减少需要氧化的官能团的数量,从而减少氧化剂的用量,减少固废排放;氧化阶段采用均相氧化体系,可消除突然引发反应导致反应热聚集的潜在隐患;针对脱水缩合阶段,直接对固体底物进行高温加热的反应方式带来的传质传热的问题,以及物料不易转移的问题,本发明开发了新的反应途径,可将固体底物置于溶剂体系中进行常规的反应操作,提高了安全性和可操作性。综上所述,本发明的目的在于提供一种更安全、更易操作的方案;更具备可大量制备的优势,以提高合成效率、降低成本。
附图说明
[0026]
为了更清楚地说明本技术实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术中记载的一些实施例,对
于本领域普通技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
[0027]
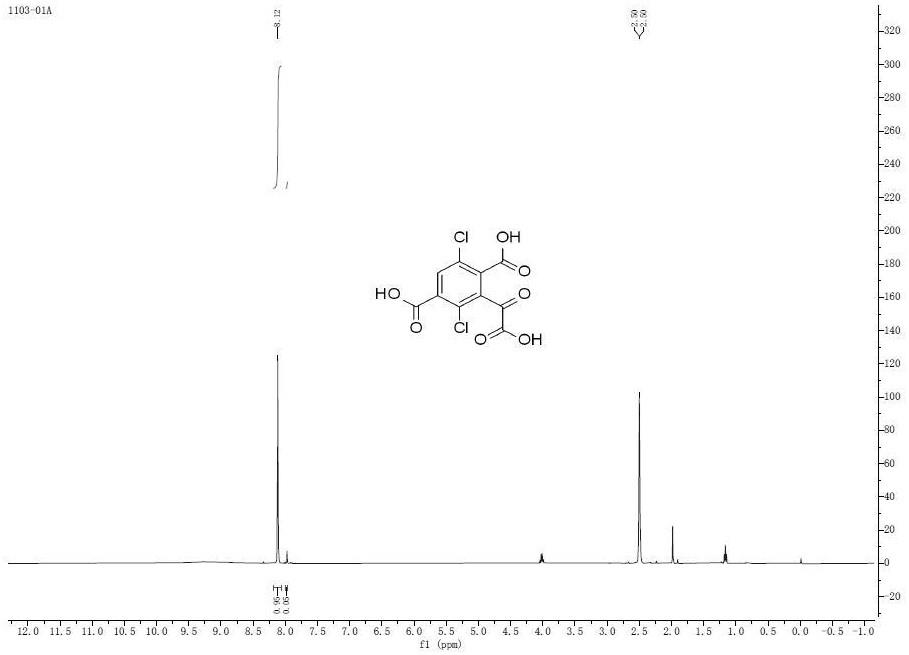
图1是 3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸的核磁共振氢谱图。
[0028]
图2是3,6-二氯偏苯三酸酐的核磁共振氢谱图。
实施方式
[0029]
为了使本领域技术人员更好地理解本技术中的技术方案,下面将结合实施例对本发明作进一步说明。显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都应当属于本技术保护的范围。下述实施例中,如无特殊说明,均为本领域常规方法。
[0030]
本发明提供了一种3,6-二氯偏苯三酸酐的合成方法,以2,5-二氯对二甲苯(式i)为起始原料,在三氯化铝为催化剂的条件下,与草酰氯单酯(式ii)发生傅-克酰基化反应,生成2-(2,5-二氯-3,6-二甲基苯基)-2-氧亚基乙酸单酯(式iii);式iii所示化合物在碳酸钾水溶液中先水解除掉酯基,形成均相体系,再用高锰酸钾氧化,得到3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸(式iv);式iv所示化合物在浓硫酸中脱羰缩合得到3,6-二氯偏苯三酸酐。
[0031]
本发明上述制备方法中所涉及的合成路线如下:
[0032]
其中r代表烷基,例如甲基或乙基。
[0033]
实施例1 合成2-(2,5-二氯-3,6-二甲基苯基)-2-氧亚基乙酸甲酯(式iii,r=甲基)的反应条件筛选向已干净干燥、配干燥管和尾气吸收装置的50ml反应瓶中,加入溶剂,室温搅拌下加入2,5-二氯对二甲苯(式i)和三氯化铝。搅拌下,缓慢滴加草酰氯单甲酯(式ii,r=甲基),滴加完毕反应体系保温继续反应。以上述操作为模型,进行一系列的参数筛选:
。
[0034]
从获取的系列实验数据中,可以得出如下结论:反应温度的考察(实验1、实验2和实验3对比):优选反应温度区间为35~75℃,高于这个区间产物易变质,低于这个区间反应很难进行。
[0035]
溶剂用量的考察(实验3和实验4对比,以及实验5、实验6、实验7和实验8对比):溶剂用量增加,反应速度减缓明显;溶剂用量减少至1v/w时,不利于反应进行。优选反应溶剂用量区间为2~10v/w,即每克2,5-二氯对二甲苯,使用2-10ml的溶剂。
[0036]
三氯化铝用量的考察(实验3和实验5对比,实验4和实验7对比,实验7和实验9对比,以及实验7和实验12对比):根据反应机理,三氯化铝的适宜用量最少为2.0当量,当用量增加时,转化速度加快,但用量如果太多,则会使产物的纯度下降。优选三氯化铝用量区间为2.0~3.0当量,即三氯化铝物质的量是2,5-二氯对二甲苯物质的量的2.0-3.0倍。
[0037]
草酰氯单甲酯(式ii,r=甲基)用量的考察(实验9、实验10和实验11对比,以及无溶剂体系反应实验14):在合适的溶剂体系中,草酰氯单甲酯(式ii,r=甲基)用量增加时,转化速度加快。综合考虑成本和可操作性,优选草酰氯单甲酯(式ii,r=甲基)用量区间为2.0~
3.0当量,即草酰氯单甲酯物质的量是2,5-二氯对二甲苯物质的量的2.0-3.0倍。
[0038]
其他溶剂的考察(实验7和实验13对比):以二氯甲烷为溶剂,限于二氯甲烷的沸点,体系的反应温度低,反应转化慢,延长反应时间可以继续转化。二氯甲烷可作为反应溶剂。
[0039]
实施例2 合成2-(2,5-二氯-3,6-二甲基苯基)-2-氧亚基乙酸甲酯(式iii,r=甲基)向已干净干燥、配干燥管和尾气吸收装置的250ml反应瓶中,加入100.0ml二氯乙烷,室温搅拌下加入25.0g 2,5-二氯对二甲苯(式i)和40.0g三氯化铝。搅拌下,缓慢滴加36.8g草酰氯单甲酯(式ii,r=甲基),滴加完毕反应体系保持35~75℃继续反应,直至原料消耗完。反应完毕后,反应液降温至室温,倒入250g冰水中充分淬灭,加入150ml二氯乙烷萃取。收取有机相,先后用250ml 15%氯化铵水溶液洗涤和250ml饱和碳酸氢钠水溶液洗涤,再用25g无水硫酸钠干燥,经过滤、洗涤、脱除溶剂得到2-(2,5-二氯-3,6-二甲基苯基)-2-氧亚基乙酸甲酯(式iii,r=甲基)35.0g,收率94.0%,hplc纯度95.5%。当r为乙基时,可得到类似的结果。
[0040]
实施例3 合成3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸(式iv)的反应条件筛选向250ml反应瓶中,加入100.0ml 10%碳酸钾水溶液,室温搅拌下加入5.0g 2-(2,5-二氯-3,6-二甲基苯基)-2-氧亚基乙酸甲酯(式iii,r=甲基)。反应体系升温至50~80℃,保温反应至酯基水解完全后,形成均相体系,分批次缓慢加入高锰酸钾,控制体系温度不超过100℃,考察高锰酸钾的加入量与转化率之间的关系。将高锰酸钾分11次加入到反应体系中,每次加完高锰酸钾,反应体系保温反应0.5小时,然后对反应液取样进行反应中控,对应的中控序号分别为1、2、3
……
10、11。
[0041]
。
[0042]
从中控数据所展示的反应转化趋势看,5.0g反应规模时,高锰酸钾加入到4.2当量,底物的转化已趋于结束;到7.0当量时,底物的转化已趋于完全。高锰酸钾用量在4.2~7.0当量范围可以满足反应转化的需要,即高锰酸钾物质的量是2-(2,5-二氯-3,6-二甲基苯基)-2-氧亚基乙酸甲酯物质的量的4.2-7.0倍。
[0043]
实施例4 合成3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸(式iv)
向2000ml反应瓶中,加入600.0ml 10%碳酸钾水溶液,室温搅拌下加入30.0g 2-(2,5-二氯-3,6-二甲基苯基)-2-氧亚基乙酸甲酯(式iii,r=甲基)。反应体系升温至50~80℃,保温反应至酯基水解完全后,分批次缓慢加入93.0g高锰酸钾,控制体系温度不超过100℃。加完后,继续回流至反应结束。降温至室温后,过滤,滤饼用适量水洗涤,合并滤液。将滤液用稀酸调节ph<1后,用300ml乙酸乙酯萃取,收取有机相,用无水硫酸钠干燥,过滤。收集滤液,真空脱除溶剂得到白色固体。白色固体用300ml庚烷打浆,过滤,干燥得到式iv所示化合物32.6g,收率92.4%,hplc纯度95.0%(ms:m-h
304.9,306.9;1h nmr(400mhz,dmso-d6):δ 8.12(s,1h)),图1为3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸的核磁共振氢谱。当r为乙基时,可得到类似的结果。
[0044]
实施例5 合成3,6-二氯偏苯三酸酐的反应条件筛选向干净干燥的反应瓶中,加入一定体积的98%浓硫酸,室温搅拌下加入3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸(式iv),反应体系升温,开展一系列的实验:。
[0045]
从获取的系列实验数据中,可以得出如下结论:1.反应温度的考察(实验1、实验2和实验3对比):优选反应温度区间为110~130℃,低于这个区间反应不进行,高于这个区间有明显的碳化副反应。
[0046]
2.98%浓硫酸用量的考察(实验2、实验4、实验5、实验6和实验7对比):在优选反应温度下,浓硫酸用量小于2v/w时,体系不易搅拌,不利于平稳操作;98%浓硫酸用量大于10v/w后,反应后处理量增大,三废量增加的同时,体系操作效率降低。优选浓硫酸用量区间为2~10v/w,即每克3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸,使用2-10ml的98%浓硫酸。
[0047]
实施例6 合成3,6-二氯偏苯三酸酐向500ml反应瓶中,加入200.0ml浓硫酸,室温搅拌下加入40.0g 3-(羧基羰基)-2,5-二氯苯-1,4-二甲酸(式iv)。反应体系升温至110~130℃,保温反应直至式iv所示化合物转化完全。反应液降温至室温后,将反应液缓慢倒入800g碎冰中,析出白色固体,用400ml乙酸乙酯萃取。收取有机相,用无水硫酸钠干燥,过滤。收集滤液,真空脱除溶剂得到白色固体。白色固体用200ml庚烷打浆,惰性氛围保护下过滤,将滤饼转至真空干燥箱中继续烘干,得到3,6-二氯偏苯三酸酐31.3g,收率92.1%,核磁纯度100%(1h nmr(400mhz,acetone-d6):δ 8.36(s,1h)),图2为3,6-二氯偏苯三酸酐的核磁共振氢谱。
[0048]
应该理解到披露的本发明不仅仅限于描述的特定的方法、方案和物质,因为这些均可变化。还应理解这里所用的术语仅仅是为了描述特定的实施方式方案的目的,而不是意欲限制本发明的范围,本发明的范围仅受限于所附的权利要求。
[0049]
本领域的技术人员还将认识到,或者能够确认使用不超过常规实验,在本文中所
述的本发明的具体的实施方案的许多等价物。这些等价物也包含在所附的权利要求中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。