一株整合端粒酶逆转录酶的cho细胞株及其应用
技术领域
1.本发明涉及一株整合端粒酶逆转录酶的cho细胞株及其应用,属于生物工程技术领域。
背景技术:
2.中国仓鼠卵巢细胞(chinese hamster ovary,cho)已是fda和nmpa等药品监管部门认可度最高的生产生物技术药物的工程细胞。目前治疗性生物制品的治疗领域已不断扩展至慢性疾病和老年病,加之药品普惠大众的医保和个人支付方式的变化,产品销售价格已是市场扩张的主要限制性因素之一。监管部门对治疗性生物制品的质量和生产过程控制的要求快速提升,大幅度降低产品生产的“产成本”已经成为技术发展的关键瓶颈问题。延长cho工程细胞的生产周期是解决这一问题的方法之一。
3.在细胞培养过程中,细胞死亡分为三个方面,细胞凋亡,细胞衰老和机械损伤。其中细胞凋亡占比最大,通过分子手段来改善细胞凋亡情况,可以有效提高cho细胞的抗逆能力。目前研究较为清楚的凋亡途径,主要包括内质网压力诱导途径、膜受体通路及线粒体激活半胱天冬酶(caspases)蛋白的生化调节途径三种。wong等人在cho细胞批次和流加培养过程中对转录组进行分析,发现早期凋亡信号基因在培养后期的表达是存在差异的。因此促凋亡基因表达的稳定下调和抗凋亡基因表达的上调,使得cho细胞表现出更高抗细胞凋亡能力,可改善细胞培养和表达性能。
4.现有技术只是改善了细胞凋亡的情况,但对细胞衰老的改善没有研究。因此通过继续改善细胞抗衰老能力,以期延长细胞培养时间。
技术实现要素:
5.为解决上述技术问题,本发明构建一株整合端粒酶逆转录酶的cho细胞株,延长cho细胞的有效培养时间从而提高表达外源蛋白能力,该细胞株的应用为cho工程细胞株的构建提供技术基础。
6.本发明的第一个目的是构建一株整合了端粒酶逆转录酶的cho细胞株,所述cho细胞株可稳定增强表达端粒酶逆转录酶。
7.进一步地,所述的端粒酶逆转录酶来源于中国仓鼠卵巢细胞,其氨基酸序列如seq idno.1所示。
8.进一步地,编码所述的端粒酶逆转录酶的核苷酸序列如seq id no.2所示。
9.进一步地,所述的端粒酶逆转录酶定点整合于cho细胞基因组中。
10.进一步地,所述的端粒酶逆转录酶定点整合于cho细胞基因组中cdk6位点。进一步优选整合于cho细胞基因组中cdk6基因内含子区域。
11.进一步地,所述的cho细胞株以cho-k1细胞为出发细胞株。
12.本发明的第二个目的是提供所述的cho细胞株的构建方法,包括如下步骤:
13.s1、将编码端粒酶逆转录酶的基因构建到质粒上得到重组质粒;
14.s2、将重组质粒转染至cho宿主细胞中,并定点整合至表达位点;
15.s3、筛选成功整合并过表达端粒酶逆转录酶的细胞株。
16.进一步地,所述质粒为puc57-bxbi-tert质粒。
17.本发明的第三个目的是提供所述的cho细胞株在表达外源蛋白中的应用。
18.进一步地,所述应用是以所述cho细胞株为出发细胞株,将待表达的外源蛋白整合至cho细胞株内,进行外源蛋白表达。
19.本发明的有益效果是:
20.本发明以cho-k1为出发细胞株构建了tert过表达细胞株cho-k1-tert。对其进行流加培养,发现细胞株cho-k1-tert通过减缓细胞衰老和细胞凋亡,将最高活细胞密度从15
×
106cells/ml提高到了25
×
106cells/ml,培养时间从13d延长到了19d。并验证了其表达外源蛋白(hsa)的能力,hsa的最终表达量可以达到783mg/l,是以cho-k1为出发细胞株构建的cho-k1-hsa-7表达量的两倍左右。该细胞株的应用为cho工程细胞株的构建提供技术基础。
附图说明:
21.图1为四个位点整合tert流式分选结果;
22.图2为定点整合tert的细胞株流加培养生长情况;
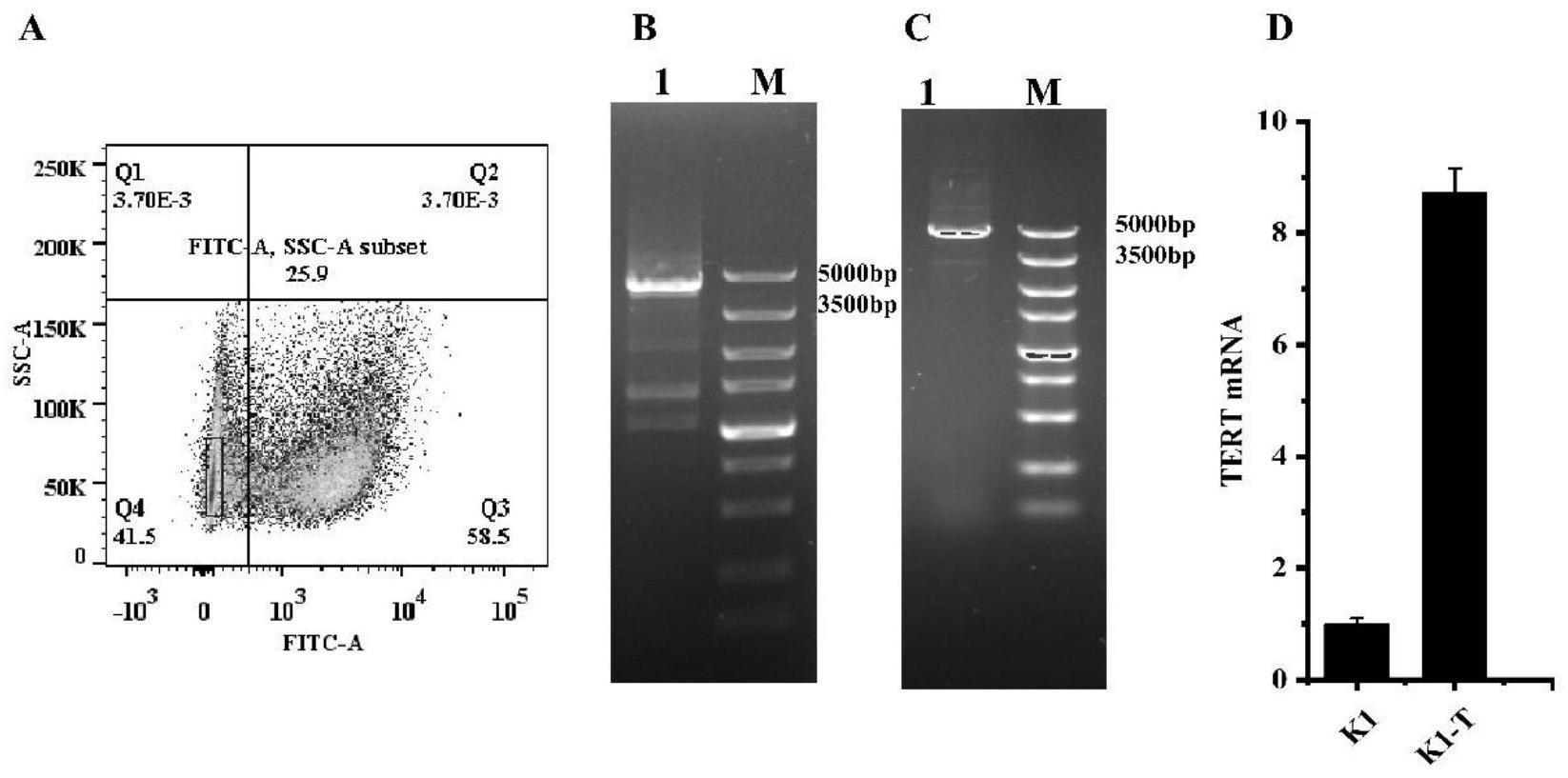
23.图3为定点整合tert基因的cho-k1细胞株;a:cho-k1-tert流式分选结果;b:5’pcr结果;c:3’pcr结果;d:细胞株cho-k1-tert qpcr结果;
24.图4为cho-k1-tert细胞株摇瓶流加培养实验结果;a:cho-k1和cho-k1-tert细胞株细胞密度和细胞活率变化曲线;b:cho-k1和cho-k1-tert细胞株细胞生长曲线c:cho-k1和cho-k1-tert细胞株细胞对数生长期拟合曲线;
25.图5为流式细胞仪检测细胞株cho-k1-tert细胞周期结果;
26.图6为细胞株cho-k1-tert细胞凋亡和细胞衰老检测结果;a:cho-k1细胞凋亡结果;b:cho-k1-tert细胞凋亡结果;c:细胞衰老结果;
27.图7为cho-k1-tert细胞株表达外源蛋白hsa情况;a:流式分选结果;b:western blot检测结果,1:kt-hsa-3、2:kt-hsa-10、3:kt-hsa-19;c:摇瓶流加培养细胞密度和细胞活率变化曲线;d:外源蛋白(hsa)表达情况。
具体实施方式
28.下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
29.涉及的检测方法:
30.一、细胞凋亡检测方法(annexin v-fitc/pi apoptosis detection kit,诺唯赞公司):
31.在正常细胞中,磷脂酰丝氨酸(ps)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸(ps)由脂膜内侧翻向外侧。annexin v是一种分子量为35-36kda的ca
2
依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,因此annexin v被公认为检测细胞早期凋亡的灵敏指标之一。
32.将annexin v进行绿色荧光(fitc)标记,以标记了的annexin v作为探针,利用荧
光显微镜或流式细胞仪可检测细胞凋亡的发生。碘化丙啶(propidium iodide,pi)是一种核酸染料,它不能透过正常细胞或早期凋亡细胞完整的细胞膜,但对凋亡中晚期的细胞和坏死细胞,pi能够透过细胞膜而使细胞核染红。因此将annexin v与pi匹配使用,就可以将处于不同凋亡时期的细胞区分开来。具体操作步骤如下。
33.(1)样本染色
34.1、收集细胞:1,800rpm(300
×
g)、4℃离心5min,弃培养基上清;
35.2、洗涤细胞:用预冷的pbs洗涤细胞两次,每次均在1,800rpm(300
×
g)、4℃离心5min。
36.3、细胞重悬:加入100μl 1
×
binding buffer,轻轻吹匀至单细胞悬液。
37.4、细胞染色:加入5μl annexin v-fitc和5μl pi staining solution,轻轻吹匀;避光、室温(20~25℃)孵育10min;加入400μl 1
×
binding buffer,轻轻混匀。染色后样品在1h内用流式细胞仪检测。
38.(2)样品分析
39.流式细胞仪激发波长为488nm;fitc的绿色荧光在fl1通道检测;pi的红色荧光在fl2通道检测,每个样本采集10,000events。用flowjo等软件进行数据分析,fl1为横坐标,fl2为纵坐标,根据fitc和pi荧光值确定两荧光参数阴阳界限,划定十字门。实验中细胞可分为三个亚群:活细胞为双阴性(annexin v-fitc-/pi-);早期凋亡细胞为annexin v-fitc单阳性(annexin v-fitc /pi-);晚期凋亡细胞为annexin v-fitc和pi双阳性(annexin v-fitc /pi )。
40.二、β-半乳糖苷酶染色方法(细胞衰老β-半乳糖苷酶染色试剂盒,碧云天公司):
41.绝大多数正常细胞被认为仅有有限的分裂能力,在不能分裂后就进入衰老(senescence)状态。此时细胞仍然是存活的,但细胞的基因和蛋白的表达谱发生了很大改变。衰老的细胞不能在一些常规的刺激下再诱导细胞分裂,并且衰老细胞的细胞周期分布也比较特殊,不同于一些损伤诱导的细胞休眠,也不同于细胞生长接触抑制的情况。衰老细胞通常体积变大,并表达在ph6.0时有高活性的β-半乳糖苷酶(β-galactosidase)。因此通过检测细胞中是否有β-半乳糖苷酶的表达来判断细胞的衰老情况。具体操作方法如下。
42.1、离心收集细胞至1.5ml离心管内,用pbs或hbss洗涤1次,加入1毫升β-半乳糖苷酶染色固定液,室温固定15分钟。固定时可以在摇床上缓慢摇动,以避免细胞结成团块。
43.2、离心,吸除细胞固定液,用pbs或hbss洗涤细胞3次,每次3分钟。
44.3、离心,吸除pbs或hbss,每管加入0.5-1毫升染色工作液。染色工作液的配制方法参考表1。
45.表1β-半乳糖苷酶染色液配制表
46.47.4、37℃孵育过夜。注意:37℃孵育不能在二氧化碳培养箱中进行。
48.5、取部分染色后的细胞,滴加到载玻片上或6孔板内,普通光学显微镜下观察。如不能及时观察计数,可以离心,去除染色工作液,然后加入1毫升pbs,4℃可以保存数天。如果离心,取细胞用于涂片,加上封片液封片后,4℃可以保存较长时间。注:如果有结晶形成,请使用70%乙醇进行洗涤处理。
49.三、细胞周期检测方法(细胞周期检测试剂盒,碧云天公司):
50.碘化丙啶(propidium,简称pi)是一种双链dna的荧光染料。碘化丙啶和双链dna结合后可以产生荧光,并且荧光强度和双链dna的含量成正比。细胞内的dna被碘化丙啶染色后,可以用流式细胞仪对细胞进行dna含量测定,然后根据dna含量的分布情况,可以进行细胞周期分析。碘化丙啶染色后,假设g0/g1期细胞的荧光强度为1,那么含有双份基因组dna的g2/m期细胞的荧光强度的理论值为2,正在进行dna复制的s期细胞的荧光强度为1-2之间。具体操作步骤如下
51.1.细胞样品的准备:1000g左右离心3-5分钟,沉淀细胞。小心吸除上清,可以残留约50μl左右的培养液,以避免吸走细胞。加入约1ml冰浴预冷的pbs,重悬细胞,并转移到
52.1.5ml离心管内。再次离心沉淀细胞,小心吸除上清,可以残留约50μl左右的pbs,以避免吸走细胞。轻轻弹击离心管底以适当分散细胞,避免细胞成团。
53.2.细胞固定:加入1ml 0℃预冷70%乙醇中,轻轻吹打混匀,4℃固定30分钟或更长时间。通常固定2小时或以上更能保证染色效果,固定12-24小时可能效果更佳。1000g左右离心3-5分钟,沉淀细胞。对于特定的细胞,如果细胞沉淀不充分,可以适当延长离心时间或稍稍加大离心力。小心吸除上清,可以残留约50μl左右的70%乙醇,以避免吸走细胞。加入约1ml0℃预冷的pbs,重悬细胞。再次离心沉淀细胞,小心吸除上清,可以残留约50μl左右的pbs,以避免吸走细胞。轻轻弹击离心管底以适当分散细胞,避免细胞成团。
54.3.碘化丙啶染色液的配制:参考表2。
55.表2碘化丙啶染色液配制表
[0056][0057]
注:配制好的碘化丙啶染色液短时间内可以4℃保存,宜当日使用。
[0058]
4.染色:每管细胞样品中加入0.5ml碘化丙啶染色液,缓慢并充分重悬细胞沉淀,37℃避光温浴30分钟。随后可以4℃或冰浴避光存放。染色完成后宜在24小时内完成流式检测,最好能在当日完成流式检测。
[0059]
5.流式检测和分析:用流式细胞仪在激发波长488nm波长处检测红色荧光,同时检测光散射情况。采用适当分析软件进行细胞dna含量分析和光散射分析。
[0060]
四、流加培养方法
[0061]
将悬浮驯化成功的重组细胞株按1
×
106cells/ml的密度,50ml的体积接种于三个
250ml的摇瓶中,加入cd基础培养基,置于37℃,5%co2,110r/min摇床上,从分瓶的第一天起,每天取相同体积的发酵液检测活细胞数、细胞粒径、活率,生化分析仪检测葡萄糖及乳酸的含量。第四天按每隔一天添加一次5%培养体积的feed 4补料培养基,糖量低于3.0g/l时添加葡萄糖的补料方式培养,当细胞活率低于85%时,结束流加培养实验。糖量换算公式如下:
[0062][0063]
实施例1:cho-k1细胞中定点整合并稳定表达tert位点的选择
[0064]
首先,通过cho细胞第三代测序结果库找到tert的cds序列(氨基酸序列如seq id no.1所示,核苷酸序列如seq id no.2所示),通过基因合成(上海生工)构建tert重组质粒pcdna3.1-tert。以pcdna3.1-tert为模板,将tert序列构建到puc57-bxbi质粒上,得到构建重组质粒puc57-bxbi-tert。将重组质粒转染进cho-k1-2c6-lps、cho-k1-2b2-lps、cho-k1-1g11-lps和cho-k1-3g10-lps细胞中,其中2c6、2b2、1g11、3g10为研究室前期验证cho细胞基因组内可稳定表达外源蛋白的位点,位点信息如表3所示。压筛后流式分选得到亚克隆细胞株cho-k1-2c6-tert、cho-k1-2b2-tert、cho-k1-1g11-tert和cho-k1-3g10-tert,结果如图1所示。
[0065]
表3位点信息
[0066][0067]
随后将分选得到的细胞株进行摇瓶流加培养,观察定点整合tert基因对cho细胞培养性能的影响。将四株细胞按1
×
106cells/ml的密度接种到装有50ml培养基的250ml摇瓶中,每一天相同时间取样检测细胞密度和细胞活率,结果如图2所示。细胞株cho-k1-3g10-tert表现最佳,vcd达到了26
×
106cells/ml,与cho-k1相比提高了近一倍,培养时间也从原来的13d延长到了18d。cho-k1-2b2-tert和cho-k1-1g11-tert细胞株的结果类似,vcd达到了20
×
106cells/ml,与cho-k1相比增加了5
×
106cells/ml,培养时间也有所延长达到了16d。
[0068]
实施例2:定点整合并稳定表达tert的cho-k1细胞株(cho-k1-tert)的构建
[0069]
将重组质粒puc57-bxbi-tert转染进细胞cho-k1-3g10-lps细胞中。博来霉素压筛结束后进行流式分选,结果如图3中a所示。得到的单克隆细胞株经过pcr和qpcr得到阳性单克隆细胞株cho-k1-tert,结果如图3中b、c所示。5’pcr和3’pcr,在5000bp均出现目的条带,与实验设计结果相符,说明已经将tert整合到位点3g10处。然后通过qpcr检测tert的转录水平,结果如图3中d所示,与cho-k1相比,细胞株cho-k1-tert的转录水平提高了7-8倍,说明tert在构建成功的阳性克隆株中进行了增强表达。
[0070]
实施例3:细胞株cho-k1-tert培养性能
[0071]
将上述实验得到的细胞株进行了摇瓶流加培养实验。并检测了相关凋亡和衰老指
标,结果如图4所示。在整个流加培养过程中cho-k1-tert细胞株的最大细胞密度约为出发细胞株cho-k1的2.5倍,最高可以达到25
×
106cells/ml,总培养时间也从13d延长到了19d,结果如图4中a所示。随后对细胞株cho-k1-tert进行细胞周期测定,拟合后的生长曲线如图4中c所示,对其取对数后发现,细胞株cho-k1-tert在4h-48h期间属于对数生长期,细胞株cho-k1-tert线性拟合方程为y=6.03035 0.01718x,r2=0.98829,经计算细胞周期为17.5h比出发细胞株cho-k1缩短了4小时。
[0072]
实施例4:cho-k1-tert细胞株细胞周期检测
[0073]
对细胞株cho-k1-tert进行了细胞周期的检测,结果如图5,与出发细胞株cho-k1相比,cho-k1-tert的s期细胞占比有明显的增加。说明,细胞株cho-k1-tert在s期进行了更多的dna修复工作。此外,细胞株cho-k1-tert的g2/m期明显缩短,g0/g1期明显延长。再次说明,在cho细胞中增强tert的表达,可以加快细胞分裂进程,提高细胞分裂能力。
[0074]
实施例5:cho-k1-tert细胞株细胞凋亡和细胞衰老检测
[0075]
对细胞株cho-k1-tert抗细胞凋亡和细胞衰老的能力进行全面的评价。在流加培养过程中,取第7d、10d、13d、16d和19d的细胞进行β-半乳糖苷酶染色检测细胞衰老,取第6d、9d、12d、15d和18d的细胞进行细胞凋亡检测。结果显示,cho-k1-tert与cho-k1相比有较强的抗凋亡效果,如图6中a、b所示。在第12d时,cho-k1凋亡细胞占比达到了27.9%(早凋:25.5%,晚凋:2.42%),cho-k1-tert的凋亡细胞占比仅为11.5%(早凋:2.06%,晚凋:9.46%),与出发细胞株cho-k1相比凋亡细胞比例下降了65%。对细胞衰老的检测发现,cho-k1在第10d时衰老细胞的比例就超过了40%,cho-k1-tert在第13d时衰老细胞的比例才达到了40%,并且维持到了第16d(图6中c)。综上所述,cho-k1-tert与cho-k1相比具有更加优越的抗凋亡和抗衰老的能力。
[0076]
实施例6:cho-k1-tert细胞株表达外源蛋白能力的研究
[0077]
以上述实验得到的抗衰老细胞株cho-k1-tert(kt)为出发细胞株,利用crispr-cas9技术将hsa定点整合到cho-k1细胞loc103162981基因内部ncrna处,通过摇瓶流加培养检测抗凋亡细胞株kt表达外源蛋白的能力。细胞构建结果如图7所示。图7中a为流式分选结果,随机挑选三株单克隆细胞株kt-hsa-3、kt-hsa-10和kt-hsa-19进行western blot检测结果如图7中b所示。随后,将阳性单克隆细胞株kt-hsa-3和cho-k1-hsa-7(实验室之前构建)进行摇瓶流加培养。细胞生长情况如图7中c所示,kt-hsa-3的最大细胞密度可以达到18
×
106cells/ml,约为cho-k1-hsa-7的两倍,同时总培养时间也延长了3d。流加培养结束后,利用尿微量白蛋白检测试剂盒测定hsa的表达量,结果如图7中d所示。kt-hsa-3最终表达量约为783mg/l,约是cho-k1-hsa-7表达量的两倍。上述结果表明cho-k1-tert(kt)细胞株具有更高的细胞密度和更长的培养时间,表达外源蛋白的能力优于cho-k1细胞株。
[0078]
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。