no. 64所示中的至少一种的dsrna来防治点蜂缘蝽(riptortus pedestris)。
10.本发明之二提供了一种核酸,其序列为如seq id no. 1、seq id no. 4、seq id no. 7、seq id no. 10、seq id no. 13、seqid no. 16、seq id no. 19、seq id no. 22、seq id no. 25、seq id no. 28、seq id no. 30、seqid no. 33、seq id no. 36、seq id no. 37、seq id no. 40、seq id no. 43、seq id no. 44、seqid no. 47、seq id no. 50、seq id no. 51、seq id no. 54、seq id no. 57、seq id no. 58、seqid no. 61和seq id no. 64所示中的至少一种。
11.本发明之三提供了一种dsrna,其正义链的序列为如seq id no. 7、seq id no. 10、seq id no. 13、seqid no. 16、seq id no. 22、seq id no. 25、seq id no. 33、seq id no. 40、seq id no. 47、seqid no. 54、和seq id no. 61所示中的至少一种。
12.需要指出的是,本领域的技术人员公知,对于dsrna来讲,需要将各序列中的t替换为u,然而为了简便起见,在本发明中不再单独列出由t替换为u的完整序列。
13.本发明的有益效果:本发明首次发现沉默昆虫体内的wa基因可使昆虫致死,特别是例如在沉默绿盲蝽中包含该基因第206至447位区域内的200 bp以上片段的第7日可使昆虫的死亡率达到95%以上,并且绿盲蝽中该基因第206至328位区域的片段的第7日可使昆虫的死亡率达到70%以上,这说明包含绿盲蝽中该基因第206至328位区域的dsrna或其他物种中与之同源的区域内的dsrna可以作为高效致死的dsrna片段。总之,通过用于沉默wa基因的rnai制剂和rnai转基因植物可以达到防治昆虫,特别是半翅目昆虫的目的。
附图说明
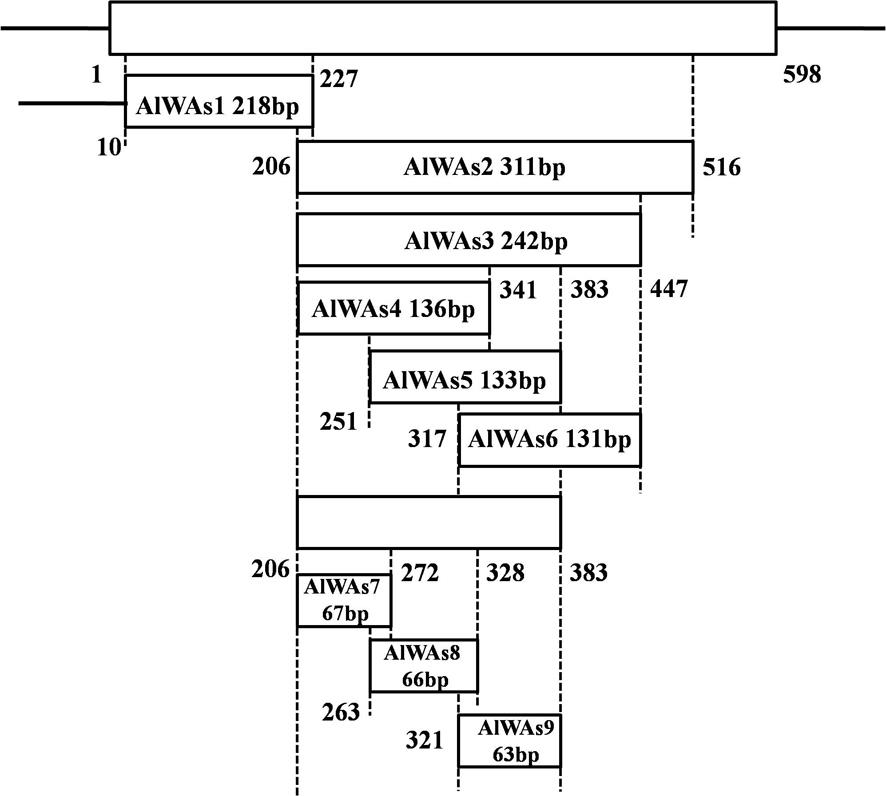
14.图1显示了绿盲蝽wa基因9条截短序列的位置关系的示意图。
具体实施方式
15.以下通过优选的实施案例的形式对本发明的上述内容作进一步的详细说明,但其不构成对本发明的限制。
16.如无特别说明,本发明的实施例中的试剂均可通过商业途径购买。
17.实施例1绿盲蝽基因的生物信息学分析利用生物信息学技术及软件对绿盲蝽转录组数据进行初步的分析,筛选到绿盲蝽(apolygus lucorum)如seq id no. 1所示的序列,暂定名为wa基因。
18.供试昆虫及组织收集将新鲜玉米(zea mays)和四季豆(phaseolus vulgaris l)的混合物作为饲料饲养绿盲蝽幼虫和成虫,饲养温度为27℃,相对湿度为65%,光照为16:8(l:d)。
19.提取rna使用绿盲蝽整只成虫用trizol试剂(4头成虫:1 ml trizol)提取总rna,最后将总rna 溶于rnase-free h2o中。取1 μl样品稀释至5 μl,其中2.5 μl进行电泳检测,2.5 μl用nanodrop仪器检测;剩余的rna用于cdna合成或者保存于
−
70 ℃冰箱。
20.合成第一链cdna
整个反转录过程在无rna酶污染的条件下进行,按revert aid first strand cdna synthesis kit的操作步骤合成cdna以用于后续dsrna的合成。
21.合成dsrna本发明从绿盲蝽的基因中选取alwas1至alwas9的9条截短的干扰靶标片段进行后续的克隆及dsrna合成。9条截短序列的位置关系的示意图如图1所示,其中,alwas1和alwas2两条截短序列的长度均在200 bp以上,且wa基因中所处的位置仅21bp的重叠;alwas3则是在alwas2的基础上进一步截短;alwas4、alwas5和alwas6三条截短序列的长度均在130 bp左右,且均是alwas3进一步的截短序列;alwas7、alwas8和alwas9三条截短序列的长度均在65 bp左右,且均是alwas4或alwas5进一步的截短序列。
22.(1)扩增alwas1至alwas9片段引物设计:根据绿盲蝽wa基因cds序列(如seq id no. 1所示),用primerpremier 5.0 软件设计绿盲蝽该基因第10-227位(alwas1)的上游引物alwa-f1(seq id no. 2)和下游引物alwa-r1(seq id no. 3)用于pcr扩增alwas1片段(seq id no. 4);绿盲蝽该基因第206-516位(alwas2)的上游引物alwa-f2(seq id no. 5)和下游引物alwa-r2(seq id no. 6)用于pcr扩增alwas2片段(seq id no. 7);绿盲蝽该基因第206-447位(alwas3)的上游引物alwa-f3(seq id no. 8)和下游引物alwa-r3(seq id no. 9)用于pcr扩增alwas3片段(seq id no. 10);绿盲蝽该基因第206-341位(alwas4)的上游引物alwa-f4(seq id no. 11)和下游引物alwa-r4(seq id no. 12)用于pcr扩增alwas4片段(seq id no. 13);绿盲蝽该基因第251-383位(alwas5)的上游引物alwa-f5(seq id no. 14)和下游引物alwa-r5(seq id no. 15)用于pcr扩增alwas5片段(seq id no. 16);绿盲蝽该基因第317-447位(alwas6)的上游引物alwa-f6(seq id no. 17)和下游引物alwa-r6(seq id no. 18)用于pcr扩增alwas6片段(seq id no. 19);绿盲蝽该基因第206-272位(alwas7)的上游引物alwa-f7(seq id no. 20)和下游引物alwa-r7(seq id no. 21)用于pcr扩增alwas7片段(seq id no. 22);绿盲蝽该基因第263-328位(alwas8)的上游引物alwa-f8(seq id no. 23)和下游引物alwa-r8(seq id no. 24)用于pcr扩增alwas8片段(seq id no. 25);绿盲蝽该基因第321-383位(alwas9)的上游引物alwa-f9(seq id no. 26)和下游引物alwa-r9(seq id no. 27)用于pcr扩增alwas9片段(seq id no. 28)。
23.(2)alwas1至alwas9片段的pcr扩增、测序及序列分析以合成的cdna为模板,以alwa-f1/r1至alwa-f9/r9分别为引物对,用prime star酶pcr扩增alwas1至alwas9片段。
24.pcr产物用1%琼脂糖凝胶(用1
×
tae缓冲液配制)电泳进行检测。检测pcr产物正确后,用琼脂糖凝胶回收试剂盒进行回收(操作步骤按试剂盒内附带的说明书进行),将回收alwas1 至alwas9 pcr片段分别连接到blunt载体上(操作步骤按试剂盒内附带的说明书进行),连接体系转化dh5α感受态细胞(转化步骤按感受态细胞附带的说明书进行),挑取单菌落进行进行质粒回收后送测序公司测序,鉴定分别得到阳性blunt-alwpas1至blunt-alwas9 重组质粒(含有alwas1至alwas9片段)及相应的dh5α/blunt-alwas1至dh5α/blunt-alwas9重组菌株。
25.(3)alwas1 dsrna至alwas9 dsrna模板的制备分别以blunt-alwas1重组质粒至blunt-alwas9重组质粒为模板,用聚合酶扩增
i 2μl,rnase 0.5μl,depc h2o1.5μl。
33.充分混匀,轻弹管底,瞬时离心后,放入金属浴37℃ 30min,加入edta试剂1μl, 65℃金属浴中放置5min终止反应。取1μl产物,稀释5倍,凝胶电泳检测产物单一性,浓度检测仪器检测浓度和od值。如果检测条带是单一明亮的条带,并且其od值为:260/280: 1.8-2.0,260/230: 1.8-2.0,则说明dsrna质量良好,然后对dsrna进行酚氯仿抽提。用无rna酶的h2o 轻弹管底,让沉淀充分均匀的溶解于无rna酶的h2o中;取1μl分别溶解的纯化的alwas1 dsrna至alwas9 dsrna产物稀释于4μldepc h2o中,用凝胶电泳检测产物单一性,并用浓度检测仪器检测浓度和od值。如果检测的条带是单一明亮的条带,并且其od值为:260/280: 1.8-2.0,260/230: 1.8-2.0,则证明alwas1 dsrna至alwas9dsrna质量良好,可以进行后续绿盲蝽rnai生物测定实验。
34.将靶标片段替换为绿色荧光蛋白基因(gfp),以相同的操作制备双链gfp dsrna 。
35.绿盲蝽rnai生物测定实验本发明中生物测定所选绿盲蝽为3龄若虫,3龄若虫的收集方法如下:收集200至300头初孵若虫,放入养虫盒中,盒中放入干净滤纸和一根去皮的新鲜玉米,约4天后所有初孵若虫成长为3龄若虫,准备铺好滤纸和7至8粒新鲜玉米粒的塑料培养皿,每个培养皿里放50只3龄若虫,放若虫时,用软毛刷轻轻挑取,以免对若虫造成不必要的机械损伤。
36.注射法模拟的是通过喷洒dsrna制剂,dsrna在昆虫机械损伤或物理渗透等作用下通过表皮或气孔等进入昆虫血淋巴系统发挥杀虫效应的过程:以gfp dsrna 作为阴性对照,采用显微注射法以5 μg/μl的浓度将dsrna用注入3龄绿盲蝽若虫体内,注射体积为41.1 nl,3次重复,每次重复50头试虫。然后以新鲜玉米为饲料,在27℃、65%的相对湿度和16:8(l:d)的光照条件下常规饲养。统计注射后7日的死亡率。结果见表1。
37.饲喂法模拟的是昆虫通过取食植物表面残留的dsrna、饵料中的dsrna、转基因作物中植物合成的dsrna后,dsrna通过消化系统进入昆虫体内发挥杀虫效应的过程:以gfp dsrna 作为阴性对照,将新鲜玉米粒浸泡在含有5 μg/μl dsrna水溶液中60s后迅速拿出置于滤纸上晾干1h,把处理过的玉米粒置于培养皿中,饲喂3龄绿盲蝽若虫。2天后更换为未经dsrna水溶液浸泡处理的新鲜玉米粒进行饲喂,3次实验重复,每次重复50头试虫。饲养条件为温度27℃,相对湿度65%,光照16:8(l:d)。统计饲喂后7日的死亡率。结果见表1。
38.表1
39.注:相同处理方法下的死亡率后的不同小写字母表示在p《0.001水平上差异显著。
40.根据表1的结果可知,注射dsrna以及饲喂dsrna的昆虫在第7日死亡率均可达到
48%以上,表现好的片段可达到74%以上,甚至可高达95%以上。不过不同的截短片段表现出了一定的差异性,其中,对于长度较为接近的截短区域不同的alwas1和alwas2来讲,alwas2的死亡率显著高于alwas1,说明alwas2区域的活性显著高于alwas1区域,alwas1区域不适合作为rnai靶标;不过alwas2中的448-494位(位于全长基因中的位置)存在一个脱靶位点,因此,为保证安全性将其删除,缩短到alwas3,结果显示alwas3依然表现出较好的活性;而alwas3区域内的长度相当的alwas4至alwas6三条截短序列的活性表现出了一定活性差异,即alwas4和alwas5的活性显著地优于alwas6;在alwas7至alwas9的三条长度相当的截短序列的活性中,alwas7和alwas8的活性显著地优于活性非常弱的alwas9,这说明alwas7和alwas8所在的区域是wa基因表现出rnai高活性的关键区域,包含此区域的dsrna片段可以作为高效致死的dsrna片段。
41.实施例2烟粉虱与实施例1的不同之处在于:烟粉虱(bemisia tabaci)用盆栽棉花苗饲养,饲养条件为温度27℃,相对湿度65%,光照14:10(l:d)。
42.根据烟粉虱wa基因cds序列(如seq id no. 30所示),用primer premier 5.0 软件设计烟粉虱该基因第146-467位(btabwas1,其同时包含与alwas7和alwas8同源的区域)的上游引物btabwa-f1(seqid no. 31)和下游引物btabwa-r1(seq id no. 32)用于pcr扩增btabwas1片段(seq id no. 33);烟粉虱该基因第287-626位(btabwas2,其在与alwas7或alwas8同源的区域以外)的上游引物btabwa-f2(seq id no. 34)和下游引物btabwa-r2(seq id no. 35)用于pcr扩增btabwas2片段(seq id no. 36)。
43.提取烟粉虱成虫的rna,然后合成cdna。以合成的cdna为模板,以btabwa-f1和btabwa-r1为引物,用prime star酶pcr扩增btabwas1片段;以合成的cdna为模板,以btabwa-f2和btabwa-r2为引物,用prime star酶pcr扩增btabwas2片段。
44.将回收的btabwas1和btabwas2 pcr片段分别连接到blunt载体上(操作步骤按试剂盒内附带的说明书进行),连接体系转化dh5α感受态细胞(转化步骤按感受态细胞附带的说明书进行),挑取单菌落进行进行质粒回收后送测序公司测序,鉴定分别得到阳性blunt-btabwas1 重组质粒(含有btabwas1片段)及相应的dh5α/blunt-btabwas1重组菌株;以及阳性blunt-btabwas2重组质粒(含有btabwas2片段)及相应的dh5α/blunt-btabwas2重组菌株。
45.分别以blunt-btabwas1重组质粒和blunt-btabwas2重组质粒为模板,用聚合酶扩增btabwas1 dsrna的模板和btabwas2 dsrna的模板。其中,扩增btabwas1 dsrna模板 的上游引物btabwads-f1由t7启动子(seq id no. 29)+btabwa-f1组成,下游引物btabwads-r1由t7启动子(seq id no. 29)+btabwa-r1组成;扩增btabwas2 dsrna模板 的上游引物btabwads-f2由t7启动子(seq id no. 29)+btabwa-f2组成,下游引物btabwads-r2由t7启动子(seq id no. 29)+btabwa-r2组成。
46.在制得btabwas1 dsrna、btabwas2 dsrna和gfp dsrna 后进行烟粉虱rnai生物测定实验。
47.以gfp dsrna 作为阴性对照,采用显微注射法以5 μg/μl的浓度将dsrna注入烟粉
虱成虫体内,注射体积为41.1 nl,3次重复,每次重复50头试虫。将试虫置于放有棉花苗叶片及茎秆的培养皿中饲养,饲养条件为温度27℃,相对湿度65%,光照14:10(l:d)。统计注射后7日的死亡率。结果见表2。
48.以gfp dsrna 作为阴性对照,将干净的棉花苗叶片及茎秆浸泡在含有5 μg/μl dsrna水溶液中60s后迅速拿出置于滤纸上晾干2h,把处理过的棉花苗叶片及茎秆置于培养皿中,饲喂烟粉虱成虫,2天后更换为未经dsrna水溶液浸泡处理过的棉花苗叶片和茎秆继续饲喂,3次实验重复,每次重复50头试虫。饲养条件为温度27℃,相对湿度65%,光照14:10(l:d)。统计饲喂后7日的死亡率。结果见表2。
49.实施例3灰飞虱与实施例1的不同之处在于:灰飞虱(laodelphax striatellus)用盆栽水稻苗饲养,饲养条件为温度27℃,相对湿度65%,光照16:8(l:d)。
50.根据灰飞虱wa基因cds序列(如seq id no. 37所示),用primer premier 5.0 软件设计灰飞虱该基因第159-603位(lstrwas1,其同时包含与alwas7和alwas8同源的区域)的上游引物lstrwa-f1(seqid no. 38)和下游引物lstrwa-r1(seq id no. 39)用于pcr扩增lstrwas1片段(seq id no. 40);灰飞虱该基因第366-625位(lstrwas2,其在与alwas7或alwas8同源的区域以外)的上游引物lstrwa-f2(seq id no. 41)和下游引物lstrwa-r2(seq id no. 42)用于pcr扩增lstrwas2片段(seq id no. 43)。
51.提取灰飞虱成虫的rna,然后合成cdna。以合成的cdna为模板,以lstrwa-f1和lstrwa-r1为引物,用prime star酶扩增lstrwas1片段;以合成的cdna为模板,以lstrwa-f2和lstrwa-r2为引物,用prime star酶扩增lstrwas2片段。
52.将回收的lstrwas1和lstrwas2 pcr片段分别连接到blunt载体上(操作步骤按试剂盒内附带的说明书进行),连接体系转化dh5α感受态细胞(转化步骤按感受态细胞附带的说明书进行),挑取单菌落进行进行质粒回收后送测序公司测序,鉴定分别得到阳性blunt-lstrwas1 重组质粒(含有lstrwas1片段)及相应的dh5α/blunt-lstrwas1重组菌株;以及阳性blunt-lstrwas2重组质粒(含有lstrwas2片段)及相应的dh5α/blunt-lstrwas2重组菌株。
53.分别以blunt-lstrwas1重组质粒和blunt-lstrwas2重组质粒为模板,用聚合酶扩增lstrwas1 dsrna的模板和lstrwas2dsrna的模板。其中,扩增lstrwas1 dsrna模板 的上游引物lstrwads-f1由t7启动子(seq id no. 29)+lstrwa-f1组成,下游引物lstrwads-r1由t7启动子(seq id no. 29)+lstrwa-r1组成;扩增lstrwas2 dsrna模板 的上游引物lstrwads-f2由t7启动子(seq id no. 29)+lstrwa-f2组成,下游引物lstrwads-r2由t7启动子(seq id no. 29)+lstrwa-r2组成。
54.在制得lstrwas1 dsrna、lstrwas2 dsrna和gfp dsrna 后进行灰飞虱rnai生物测定实验。
55.以gfp dsrna 作为阴性对照,采用显微注射法以5 μg/μl的浓度将dsrna用注入灰飞虱成虫体内,注射体积为41.1 nl,3次重复,每次重复50头试虫。将试虫置于放有新鲜水稻叶片及茎秆的培养皿中,在温度27℃,相对湿度65%,光照16:8(l:d)的条件下饲养。统计
注射后7日的死亡率。结果见表2。
56.以gfp dsrna 作为阴性对照,将干净的水稻叶片及茎秆浸泡在含有5 μg/μl dsrna水溶液中60s后迅速拿出置于滤纸上晾干2h,把处理过的叶片及茎秆置于培养皿中,饲喂灰飞虱成虫。2天后更换为未经dsrna水溶液浸泡处理过的水稻叶片和茎秆继续饲喂,3次实验重复,每次重复50头试虫。饲养条件为温度27℃,相对湿度65%,光照16:8(l:d)。统计饲喂后7日的死亡率。结果见表2。
57.实施例4茶翅蝽与实施例1的不同之处在于:茶翅蝽(halyomorpha picus)采集于北京市百望山森林公园,将新鲜玉米和四季豆(phaseolus vulgaris l)的混合物作为饲料饲养茶翅蝽的幼虫和成虫。饲养条件为温度26℃,相对湿度60%,光照14:10(l:d)。
58.根据茶翅蝽wa基因cds序列(如seq id no. 44所示),用primer premier 5.0 软件设计茶翅蝽该基因第110-480位(hhalwas1,其同时包含与alwas7和alwas8同源的区域)的上游引物hhalwa-f1(seqid no. 45)和下游引物hhalwa-r1(seq id no. 46)用于pcr扩增hhalwas1片段(seq id no. 47);茶翅蝽该基因第295-594位(hhalwas2,其在与alwas7或alwas8同源的区域以外)的上游引物hhalwa-f2(seq id no. 48)和下游引物hhalwa-r2(seq id no. 49)用于pcr扩增hhalwas2片段(seq id no. 50)。
59.提取茶翅蝽成虫的rna,然后合成cdna。以合成的cdna为模板,以hhalwa-f1和hhalwa-r1为引物,用prime star酶扩增hhalwas1片段;以合成的cdna为模板,以hhalwa-f2和hhalwa-r2为引物,用prime star酶扩增hhalwas2片段。
60.将回收的hhalwas1和hhalwas2 pcr片段分别连接到blunt载体上(操作步骤按试剂盒内附带的说明书进行),连接体系转化dh5α感受态细胞(转化步骤按感受态细胞附带的说明书进行),挑取单菌落进行进行质粒回收后送测序公司测序,鉴定分别得到阳性blunt-hhalwas1 重组质粒(含有hhalwas1片段)及相应的dh5α/blunt-hhalwas1重组菌株;以及阳性blunt-hhalwas2重组质粒(含有hhalwas2片段)及相应的dh5α/blunt-hhalwas2重组菌株。
61.分别以blunt-hhalwas1重组质粒和blunt-hhalwas2重组质粒为模板,用聚合酶扩增hhalwas1 dsrna的模板和hhalwas2 dsrna的模板。其中,扩增hhalwas1 dsrna模板 的上游引物hhalwads-f1)由t7启动子(seq id no. 29)+hhalwa-f1组成,下游引物hhalwads-r1由t7启动子(seq id no. 29)+hhalwa-r1组成;扩增hhalwas2 dsrna模板 的上游引物hhalwads-f2由t7启动子(seq id no. 29)+hhalwa-f2组成,下游引物hhalwads-r2由t7启动子(seq id no. 29)+hhalwa-r2组成。
62.在制得hhalwas1 dsrna、hhalwas2 dsrna和gfp dsrna 后进行茶翅蝽rnai生物测定实验。
63.以gfp dsrna 作为阴性对照,采用显微注射法以5 μg/μl的浓度将dsrna用注入茶翅蝽成虫体内,注射体积为41.1 nl,3次重复,每次重复50头试虫。将其置于放有新鲜玉米的培养皿中饲养,饲养条件为温度26℃,相对湿度60%,光照14:10(l:d)。统计注射后7日的死亡率。结果见表2。
64.以gfp dsrna 作为阴性对照,将新鲜玉米粒浸泡在含有5 μg/μl dsrna水溶液中60s后迅速拿出置于滤纸上晾干1h,把处理过的玉米粒置于培养皿中,饲喂茶翅蝽成虫。2天后更换为未经dsrna水溶液浸泡处理的新鲜玉米粒继续饲喂,3次实验重复,每次重复50头试虫。饲养条件为温度26℃,相对湿度60%,光照14:10(l:d)。统计饲喂后7日的死亡率。结果见表2。
65.实施例5褐飞虱与实施例1的不同之处在于:褐飞虱(nilaparvata lugens)用盆栽水稻苗饲养,饲养条件为温度27℃,相对湿度65%,光照16:8(l:d)。
66.根据褐飞虱wa基因cds序列(如seq id no. 51所示),用primer premier 5.0 软件设计褐飞虱该基因第134-396位(nlugwas1,其同时包含与alwas7和alwas8同源的区域)的上游引物nlugwa-f1(seqid no. 52)和下游引物nlugwa-r1(seq id no. 53)用于pcr扩增nlugwas1片段(seq id no. 54);褐飞虱该基因第368-588位(nlugwas2,其在与alwas7或alwas8同源的区域以外)的上游引物nlugwa-f2(seq id no. 55)和下游引物nlugwa-r2(seq id no. 56)用于pcr扩增nlugwas2片段(seq id no. 57)。
67.提取褐飞虱成虫的rna,然后合成cdna。以合成的cdna为模板,以nlugwa-f1和nlugwa-r1为引物,用prime star酶扩增nlugwas1片段;以合成的cdna为模板,以nlugwa-f2和nlugwa-r2为引物,用prime star酶扩增nlugwas2片段。
68.将回收的nlugwas1和nlugwas2 pcr片段分别连接到blunt载体上(操作步骤按试剂盒内附带的说明书进行),连接体系转化dh5α感受态细胞(转化步骤按感受态细胞附带的说明书进行),挑取单菌落进行进行质粒回收后送测序公司测序,鉴定分别得到阳性blunt-nlugwas1 重组质粒(含有nlugwas1片段)及相应的dh5α/blunt-nlugwas1重组菌株;以及阳性blunt-nlugwas2重组质粒(含有nlugwas2片段)及相应的dh5α/blunt-nlugwas2重组菌株。
69.分别以blunt-nlugwas1重组质粒和blunt-nlugwas2重组质粒为模板,用聚合酶扩增nlugwas1 dsrna的模板和nlugwas2 dsrna的模板。其中,扩增nlugwas1 dsrna模板 的上游引物nlugwads-f1由t7启动子(seq id no. 29)+nlugwa-f1组成,下游引物nlugwads-r1由t7启动子(seq id no. 29)+nlugwa-r1组成;扩增nlugwas2 dsrna模板 的上游引物nlugwads-f2由t7启动子(seq id no. 29)+nlugwa-f2组成,下游引物nlugwads-r2由t7启动子(seq id no. 29)+nlugwa-r2组成。
70.在制得nlugwas1 dsrna、nlugwas2 dsrna和gfp dsrna 后进行褐飞虱rnai生物测定实验。
71.以gfp dsrna 作为阴性对照,采用显微注射法以5 μg/μl的浓度将dsrna用注入褐飞虱成虫体内,注射体积为41.1 nl,3次重复,每次重复50头试虫。将其置于放有新鲜水稻叶片及茎秆的培养皿中饲养,饲养条件为温度27℃,相对湿度65%,光照16:8(l:d)。统计注射后7日的死亡率。结果见表2。
72.以gfp dsrna 作为阴性对照,将干净的水稻叶片及茎秆浸泡在含有5 μg/μl dsrna水溶液中60s后迅速拿出置于滤纸上晾干2h,把处理过的水稻叶片及茎秆置于培养皿
中,饲喂褐飞虱成虫,2天后更换为未经dsrna水溶液浸泡处理过的水稻叶片和茎秆继续饲喂,3次实验重复,每次重复50头试虫。饲养条件为温度27℃,相对湿度65%,光照16:8(l:d)。统计饲喂后7日的死亡率。结果见表2。
73.实施例6点蜂缘蝽与实施例1的不同之处在于:点蜂缘蝽(riptortus pedestris)采自安徽省宿州市,用品种为皖豆28的大豆苗饲养,饲养条件为温度27℃,相对湿度55%,光照16:8(l:d)。
74.根据点蜂缘蝽wa基因cds序列(如seq id no. 58所示),用primer premier 5.0 软件设计点蜂缘蝽该基因第147-403位(rpwas1,其同时包含与alwas7和alwas8同源的区域)的上游引物rpwa-f1(seq id no. 59)和下游引物rpwa-r1(seq id no. 60)用于pcr扩增rpwas1片段(seq id no. 61);点蜂缘蝽该基因第386-586位(rpwas2,其在与alwas7或alwas8同源的区域以外)的上游引物rpwa-f2(seqid no. 62)和下游引物rpwa-r2(seq id no. 63)用于pcr扩增rpwas2片段(seq id no. 64)。
75.提取点蜂缘蝽成虫的rna,然后合成cdna。以合成的cdna为模板,以rpwa-f1和rpwa-r1为引物,用prime star酶扩增rpwas1片段;以合成的cdna为模板,以rpwa-f2和rpwa-r2为引物,用prime star酶扩增rpwas2片段。
76.将回收的rpwas1和rpwas2 pcr片段分别连接到blunt载体上(操作步骤按试剂盒内附带的说明书进行),连接体系转化dh5α感受态细胞(转化步骤按感受态细胞附带的说明书进行),挑取单菌落进行进行质粒回收后送测序公司测序,鉴定分别得到阳性blunt-rpwas1 重组质粒(含有rpwas1片段)及相应的dh5α/blunt-rpwas1重组菌株;以及阳性blunt-rpwas2重组质粒(含有rpwas2片段)及相应的dh5α/blunt-rpwas2重组菌株。
77.分别以blunt-rpwas1重组质粒和blunt-rpwas2重组质粒为模板,用聚合酶扩增rpwas1 dsrna的模板和rpwas2 dsrna的模板。其中,扩增rpwas1 dsrna模板 的上游引物rpwads-f1)由t7启动子(seq id no. 29)+rpwa-f1组成,下游引物rpwads-r1)由t7启动子(seq id no. 29)+rpwa-r1组成;扩增rpwas2 dsrna模板 的上游引物rpwads-f2由t7启动子(seq id no. 29)+rpwa-f2组成,下游引物rpwads-r2由t7启动子(seq id no. 29)+rpwa-r2组成。
78.在制得rpwas1 dsrna、rpwas2 dsrna和gfp dsrna 后进行点蜂缘蝽rnai生物测定实验。
79.以gfp dsrna 作为阴性对照,采用显微注射法以5 μg/μl的浓度将dsrna用注入点蜂缘蝽成虫体内,注射体积为41.1 nl,3重复,每重复50头试虫。将其置于放有新鲜大豆叶片及茎秆的培养皿中饲养,饲养条件为温度27℃,相对湿度55%,光照16:8(l:d)。统计注射后7日的死亡率。结果见表2。
80.以gfp dsrna 作为阴性对照,将干净的大豆叶片及茎秆浸泡在含有5 μg/μl dsrna水溶液中60s后迅速拿出置于滤纸上晾干2h,把处理过的大豆叶片及茎秆置于培养皿中,饲喂点蜂缘蝽成虫,2天后更换为未经dsrna水溶液浸泡处理过的大豆叶片和茎秆继续饲喂,3次实验重复,每次重复50头试虫。饲养条件为温度27℃,相对湿度65%,光照16:8(l:d)。统计饲喂后7日的死亡率。结果见表2。
81.表2
82.注:同物种相同处理方法下的死亡率后的不同小写字母表示在p《0.001水平上差异显著。
83.根据表2的结果可知,注射dsrna以及饲喂dsrna的昆虫在第7日死亡率均可达到74%以上;不过两条截短片段表现出了一定的差异性,其中,btabwas1、lstrwas1、hhalwas1、nlugwas1和rpwas1的表现均分别显著地优于btabwas2、lstrwas2、hhalwas2、nlugwas2和rpwas2好的片段,其致死率(死亡率)可高达95%以上,说明btabwas1、lstrwas1、hhalwas1、nlugwas1和rpwas1更适合作为高效致死的dsrna片段。
84.以上结果表明wa基因在半翅目昆虫中是非常高效的rnai靶标基因,并且实验表明通过两种途径进行昆虫的基因rnai,杀虫效果均十分出色,具有极高的应用前景。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
