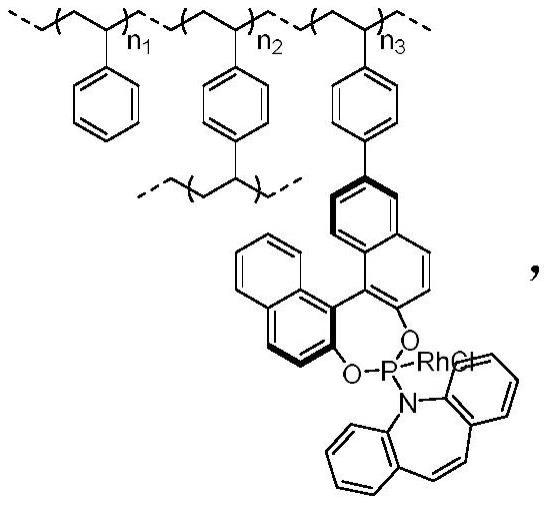
1.本发明属于生物技术领域,涉及一种分泌型糖蛋白及其在甾体激素细胞工厂中的应用。
背景技术:
2.甾体激素又称类固醇激素,是人体内源性药物,对维持人体健康有着不可替代的作用。据统计,2011年甾体激素药物销售额就已高于280亿美元,约占全球医药总销售额的6%;2016年甾体激素药物销售额就已高于1000亿美元,成为仅次于抗生素的第二大类药物受成本压力等因素影响,一种高效、清洁、稳定的甾体化合物生物合成的生产方式被迫切期待。
3.薯蓣皂素是生产甾体激素类药物的核心原料且在黄姜及穿地龙等野生植物中含量丰富。因此,历经几十年的发展,我国已经成功建立的完整的甾体激素合成上下游产业链。但由于多年来对野生薯蓣皂素资源的过度开采且人工种植品种含量较低,使近些年薯蓣皂素的价格一路攀升,给甾体激素产业的稳定发展带来一定的冲击。为此,伴随着合成生物学的快速发展,依托于酵母平台发展新型的薯蓣皂素从头合成的绿色生产工艺具有重要的学术和市场价值。但由于薯蓣皂素及其他甾体激素类化合物具有较强的疏水性且结构与细胞膜上的固醇结构太过相似,导致大量合成的甾体激素产物堆积在细胞膜上,影响宿主细胞的正常生长,这可能是限制甾体激素类化合物产量的重要因素。
4.一些用于解毒的方法已经应用在微生物细胞工厂中,如开发酿酒酵母脂滴工程,将过量生产的番茄红素储存其中减轻其对工程菌株的毒性。实际上酿酒酵母的脂滴作为储能和解毒的细胞器也会存储超过需求量类固醇脂,待细胞需要时再游离出来合成目标类固醇。除此之外,还有研究者在设计目标产物合成路径时就考虑到合成产物的毒性问题,从而将整合反应放到封闭的小室中发生。如在过氧化物酶体或线粒体中过表达鲨烯合成路径,减缓细胞膜储存过量鲨烯的压力。但是对于疏水性较大、易于在细胞膜上积累且难以脂化的薯蓣皂素的相关解毒方法尚未见报导。
技术实现要素:
5.本发明提供了一种重组菌。
6.本发明提供的重组菌,为在含有薯蓣皂素合成路径相关基因的底盘酵母菌中进行如下1)或1)和2)的改造,得到的重组菌:
7.1)调控所述底盘酿酒酵母中erg6(甾醇-c24位甲基转移酶)基因的表达;
8.2)提高所述底盘酿酒酵母中pry1(脂结合蛋白)基因的表达或该基因编码蛋白的含量;
9.所述含有薯蓣皂素合成路径相关基因的底盘酵母菌为在过表达乙酰辅酶a到鲨烯合成路径基因的ysbyt30中过表达stdwf5(土豆来源甾醇c-7位还原酶)、ggdhcr24(原鸡来源甾醇c-24位还原酶)、dgcyp90g(盾叶薯蓣来源甾醇c-16,22双羟氧化酶)、vccyp94n(山藜
芦来源甾醇c-26位羟化酶),svvcpr(葡萄来源烟酰胺腺嘌呤二核苷酸磷酸-细胞色素p450还原酶)以及vccyp90b27(山藜芦来源甾醇c-22位羟化酶)得到的重组菌。在本发明的实施例中,含有薯蓣皂素合成路径相关基因的底盘酵母菌为菌株lp104。
10.上述重组菌中,所述调控所述底盘酿酒酵母中erg6(甾醇-c24位甲基转移酶)基因的表达为将底盘酿酒酵母中erg6(甾醇-c24位甲基转移酶)基因的启动子替换为phxt1启动子或perg7启动子。
11.上述重组菌中,所述提高所述底盘酿酒酵母中pry1(脂结合蛋白)基因的表达或该基因编码蛋白的含量为将所述pry1(脂结合蛋白)基因导入所述底盘酿酒酵母中。
12.本发明还提供了一种制备上述重组菌的方法。
13.本发明提供的方法,按照上述重组菌中的改造方法制备。
14.由上述方法得到的重组菌也是本发明保护的范围。
15.上述重组菌或上述重组菌在生产薯蓣皂素或提高薯蓣皂素产量中的应用也是本发明保护的范围。
16.本发明还有一个目的是提供一种生产薯蓣皂素的方法。
17.本发明提供的方法,包括如下步骤:发酵培养上述重组菌或上述重组菌,得到薯蓣皂素。
18.本发明发现了一种cap/scp蛋白超家族成员蛋白pry1可以将异源合成的、疏水性较强的、大量积累于细胞膜上甾体激素分泌至细胞外部,缓解细胞工厂的代谢压力。在酿酒酵母中过表达该菌株可以提高薯蓣皂素产量。这一发明可应用于甾体激素类化合物的微生物细胞工厂中,为缓解甾体激素过量积累造成的细胞毒性提供新的解决思路。
19.本发明发现利用perg7下调erg6基因表达相较于阻断erg6基因表达具有明显优势,菌株生长恢复,薯蓣皂素产量提高。除此之外,发现过量生产的薯蓣皂素会被酿酒酵母排出细胞外,转录组数据显示伴随着薯蓣皂素产量的增加分泌型糖蛋白pry1表达量随之增加。在生长状态较好的lp104菌株中过表达pry1可使薯蓣皂素产量有一定提高。说明pry1对薯蓣皂素的异源合成具有重要作用,至此,为解除疏水类化合物的过量积累而产生的的毒性提供了一种新的解毒思路。
附图说明
20.图1为酿酒酵母中薯蓣皂素异源合成路径图。
21.图2为几株菌株的生长情况及胆固醇和薯蓣皂素合成情况。
22.图3为pry1蛋白在不同菌株、不同时期的表达丰度。
23.图4为lp118高密度发酵菌株生长及薯蓣皂素产量图。
24.图5为敲除pry1基因对lp118菌株生长和薯蓣皂素生产的影响。
25.图6为过表达pry1基因对lp118、lp104-17菌株生长和薯蓣皂素生产的影响。
具体实施方式
26.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
27.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
28.下述实施例中菌株lp104为ysbyt30菌株(过表达乙酰辅酶a到鲨烯合成路径的11
buffer(thermo公司)、5μl dpn1(therom公司,400,000cohesive end units/ml),80μl pcr扩增产物,补充蒸馏水至100μl,消化处理4小时,随后对处理后的产物,进行胶回收处理备用。
42.再将上述胶回收后得到的消化产物,转入trans1-t1感受态细胞中冰浴30分钟,42℃热激30秒,立即至于冰上2分钟。加入800μl lb培养基,250rpm,37℃孵育1小时,菌液涂在含有氨苄青霉素的lb平板上,过夜培养后,pcr筛选5个阳性单菌落,将阳性克隆进行液体培养,提取阳性克隆质粒进行测序验证,测序结果表明正确的质粒命名为perg6grna,该质粒包含erg6基因启动子(序列7)对应的n20序列(gtcaaatcaaccaaacagct)。
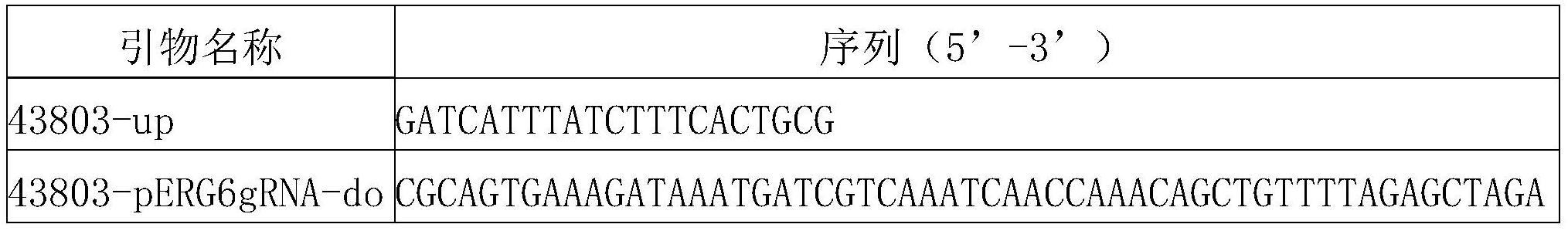
43.表1为构建erg6基因启动子、pry1位点grna质粒引物
[0044][0045][0046]
2、获得phxt1启动子同源片段和perg7启动子同源片段
[0047]
以酿酒酵母by4742(记载在carrie baker brachmann et al.,1998,yeast,14:115-132,公众可从天津工业生物技术研究所获得)基因组为模板,分别使用引物perg6-50-phxt1-up/perg6-50-phxt1-down、perg6-50-perg7-up/perg6-50-perg7-down(见表2)进行pcr扩增,方法见实施例1步骤1,获得带有erg6基因启动子同源臂的phxt1片段和带有erg6基因启动子同源臂的perg7片段,分别命名为erg6-50-phxt1(序列5)及erg6-50-perg7(序列6)。
[0048]
上述erg6-50-phxt1中,该片段包含erg6启动子部分50bp上游同源臂(序列5第1-50位)、1000bphxt1启动子(序列5第51-1051位)、52bp下游同源臂(序列5第1052-1104位);
[0049]
上述erg6-50-perg7中,该片段包含erg6启动子部分50bp上游同源臂(序列6第1-50位)、774bperg7启动子(序列6第51-825位)、52bp下游同源臂(序列6第826-878位)。
[0050]
表2为扩增调控片段引物
[0051][0052]
3、结合crispr-cas9技术调控erg6表达
[0053]
1)制备lp104菌株感受态
[0054]
将酿酒酵母lp104菌株在酵母培养基中培养,得到lp104菌株培养液(od约0.6-1.0);
[0055]
上述酵母培养基由0.8%sd-ura-his-leu-trp(北京泛基诺(功能基因组)科技有限公司),2%葡萄糖,0.01%ura.(各百分号均表示g/100ml)和水组成。
[0056]
取1ml lp104菌株培养液(od约0.6)分装到1.5ml ep管中,4℃、10000g离心1min,弃上清,沉淀用无菌水(4℃)洗涤,同样条件下离心,弃上清。菌体加入1ml处理液(10mm liac;10mm dtt;0.6m山梨醇;10mm tris-hcl(ph7.5),处理液使用时才加dtt,余量为水),25℃下放置20min。离心,弃上清,菌体中加入1ml 1m山梨醇(0.22μm水系膜过膜除菌)重悬,离心,弃上清(用1m山梨醇重悬二次),到最终体积约为80μl,制备lp104菌株感受态细胞。
[0057]
2)转化
[0058]
向上述lp104菌株感受态细胞中分别加入如下3种质粒混合物:perg6grna质粒和erg6 del oligo(表2)、perg6grna质粒和erg6-50-phxt1、perg6grna质粒和erg6-50-perg7;(每个片段各2μl,约200ng/μl),混匀后转移至电转杯中,2.7kv电击5.6ms,加入1ml 1m山梨醇,30℃复苏1h,涂布于筛选培养基平板(配方:0.8%酵母选择培养基sd-ura-his-leu-trp,2%葡萄糖,1.5%琼脂;各百分号均表示g/100ml)。筛选培养的条件为:30℃,培养36h以上。得到转化不同dna的3种单克隆的平板。
[0059]
从每种单克隆平板中任意挑选8个单克隆进行pcr验证(perg6-up tgctcgctatcctcgccatc;perg6-down ccaatatcatcaccatgtaactcccta扩增,得到1140bp、914bp、0bp为阳性克隆。),鉴定出正确的阳性克隆,分别命名为菌株lp117、lp122、lp118。
[0060]
重组菌lp117为将perg6grna质粒和erg6 del oligo转入lp104菌株中得到的重组菌,该重组菌为将erg6 del oligo替换lp104菌株的erg6基因(gene id:855003,updated on 6-dec-2021)得到的重组菌。
trp,2%葡萄糖,1.5%琼脂;各百分号均表示g/100ml)。筛选培养的条件为:30℃,培养36h以上。得到转化dna的单克隆平板。
[0092]
从单克隆平板中任意挑选8个单克隆进行pcr验证(pry1-up-94
[0093]
ggtctatcgctacgtcgtaagcta pry1-down-250 cgtatatctccagaaaatgcccagt得到376bp为阳性克隆。),鉴定出正确的阳性克隆,分别命名为菌株lp118,δpry1。
[0094]
重组菌lp118,δpry1为将ppry1grna质粒和pry1 del oligo转入lp118菌株中得到的重组菌,该重组菌为将lp104菌株基因组中erg6基因的启动子(序列7)替换为perg7启动子(序列4第51-825位),且敲除pry1基因(gene id:853366,updated on 7-nov-2021)得到的重组菌。
[0095]
二、重组菌lp118,δpry1在生产薯蓣皂素中的应用
[0096]
1、摇瓶发酵
[0097]
发酵方法与实施例1二的1相同
[0098]
2、检测发酵产物
[0099]
产物检测方法与实施例1二的1相同。
[0100]
菌株od
600
和薯蓣皂素产量结果如见图5所示,可以看出,与lp118相比,敲除pry1的lp118,δpry1菌株生长显著变差,薯蓣皂素产量显著下降。
[0101]
因此,下面尝试过表达pry1基因对薯蓣皂素产量的影响。
[0102]
三、在lp118菌株中过表达pry1
[0103]
分别在lp118、lp104菌株中用质粒prs426过表达pry1基因,具体如下:
[0104]
1、构建prs426-pry1质粒
[0105]
以酿酒酵母by4742基因组为模板,分别使用引物sexai-pry1-f/asci-pry1-r进行(见表3)进行pcr扩增,方法见实施例1一的步骤1,获得5’端带有sexai酶切位点,3’端带有asci酶切位点的pry1片段,命名为sexai-pry1-asci(序列8,该片段包含sexai酶切位点7bp、430bptef1启动子、8bpasci酶切位点)。
[0106]
以酿酒酵母by4742基因组为模板,分别使用引物sacii-tef1/sexai-tef1和asci-cyc1t/cyc1t-sacii进行(见表3)进行pcr扩增,方法见实施例1步骤1,获得5’端带sacii酶切位点,3’端带有sexi酶切位点的tef1片段,命名为sacii-tef1-sexai(序列9,该片段包含sacii酶切位点6bp、900bppry1基因、7bpsexai酶切位点)和5’端带asci酶切位点,3’端带有sacii酶切位点的cyc1片段,命名为asci-cyc1-sacii(序列10,该片段包含asci酶切位点8bp、307bpcyc1终止子、6bpsacii酶切位点)。
[0107]
表3为扩增构建prs426-pry1质粒引物
[0108][0109]
将sexai-pry1-asci pcr扩增片段用thermo公司sexa i和asc i进行双酶切,sacii-tef1-sexai pcr扩增片段、asci-cyc1-sacii pcr扩增片段分别用thermo公司sac ii和sexa i、asci ii和sac ii进行双酶切,prs426质粒用sacii进行单酶切,酶切产物胶回收备用。
[0110]
连接获得质粒prs426-pry1。连接体系:片段及骨架各50ng,5μl 2
×
quick ligation buffer(neb公司)、0.5μl quick ligase(neb公司,400,000cohesive end units/ml),补充蒸馏水至10μl,室温反应10min得到连接产物,转入trans1-t1感受态细胞中冰浴30分钟,42℃热激30秒,立即至于冰上2分钟。加入800μl lb培养基,250rpm,37℃孵育1小时,菌液涂在含有氨苄青霉素的lb平板上,过夜培养后,pcr筛选5个阳性单菌落,将验证正确的单克隆测序验证,得到质粒prs426-pry1。
[0111]
prs426-pry1为将tef1-pry1-cyc1所示的片段插入prs426质粒(atcc产品目录号:77107)的sacii酶切位点间得到的载体。tef1-pry1-cyc1所示的片段的核苷酸序列依次由序列9第7-437位、序列8第8-908位和序列10第9-304位组成。
[0112]
2、利用质粒prs426-pry1,分别在lp118、lp104-17菌株中过表达pry1基因
[0113]
考虑到lp118菌株本身pry1基因就具有较高的表达量(转录组数据图3)且调控过erg6基因对菌株生长等的多方面影响,这里选择对lp104也同时进行pry1的过表达实验。
[0114]
1)制备菌株感受态
[0115]
将lp118和lp104菌株分别在酵母培养基中培养,得到lp118菌株培养液(od约0.6-1.0)和lp104菌株培养液(od约0.6-1.0);
[0116]
上述酵母培养基由0.8%浓度sd-ura-his-leu-trp(北京泛基诺(功能基因组)科技有限公司),2%葡萄糖,0.01%ura.(各百分号均表示g/100ml)和水组成。
[0117]
感受态制备方法与实施例1相同。
[0118]
2)转化
[0119]
向上述lp118菌株感受态细胞或lp104-17菌株感受态细胞中加入2μl 200ng/μl prs426-pry1,混匀后转移至电转杯中,2.7kv电击5.6ms,加入1ml 1m山梨醇,30℃复苏1h,涂布于筛选培养基平板(配方:0.8%酵母选择培养基sd-ura-his-leu-trp,2%葡萄糖,1.5%琼脂;各百分号均表示g/100ml)。筛选培养的条件为:30℃,培养36h以上。得到转化2
种质粒的单克隆平板。
[0120]
从相应平板上挑选一个转化子并命名为lp118,ov-pry1,lp104-17,ov-pry1。
[0121]
重组菌lp118,ov-pry1为将pry1基因以重组质粒prs426-pry1形式导入lp118菌株中得到的重组菌,实现pry1过表达。
[0122]
重组菌lp104,ov-pry1为将pry1基因以重组质粒prs426-pry1形式导入lp104菌株中得到的重组菌,实现pry1过表达。
[0123]
3、摇瓶发酵
[0124]
将重组菌lp118,ov-pry1和lp104,ov-pry1按照实施例1的二的1的方法进行摇瓶发酵。
[0125]
按照实施例1的二收集摇瓶的发酵液,gc-ms检测,结果如图5所示,表明,与对照菌株lp118相比,和lp118,δpry1菌株的薯蓣皂素积累量显著降低90%。
[0126]
高拷贝2μ质粒(prs426)过表达pry1的菌株lp118,ov-pry1与lp118相比,并没有进一步促进lp118菌株薯蓣皂素的产生(图6)。考虑到pry1在lp118中已经有较高的表达水平,而erg6基因表达减弱对lp118菌株生长的负面影响也可能会干扰pry1的有效合成。
[0127]
因此,检测lp104,ov-pry1和lp104,菌株od
600
和薯蓣皂素(dsg)产量结果如图6所示,可以看出,与lp104相比,lp104,ov-pry1可以显著使薯蓣皂素的产量提高1.42倍;与lp104相比,lp118,ov-pry1可以显著使薯蓣皂素的产量提高1.32倍,结果表明,pry1有助于dsg的产生。
[0128]
上述结果表明,相较于lp104菌株而言,lp118中erg6基因的表达调控增加了薯蓣皂素的产量,且菌株生长变慢;另一方面,通过转录组数据可以看出该菌株pry1的表达强度相较于lp104明显提高,因此进一步过表达难以观察到明显现象。而在没有明显生长缺陷的前体菌株lp104菌株中过表达该基因效果更加显著。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。