1.本发明涉及一株可提高硒酶活性的高富集有机硒的格氏乳杆菌,属于微生物技术领域。
背景技术:
2.硒(selenium)是人类和动物生存的必需微量元素之一,无法由人体合成,必须从体外摄取。硒能够破坏细胞产生的过氧化物因而具有抗氧化作用。人体缺硒会导致许多疾病,如糖尿病、大骨节病、心脑血管疾病、克山病和神经退行性疾病等。硒是人体健康决定性的元素,富硒产品逐渐热销,受到广大百姓的热爱。目前,现有的补硒产品主要分为无机硒和有机硒两类。其中,无机硒主要为亚硒酸钠,由于其人体吸收利用率低且具有较大的毒副作用,国外多将其用于饲料。
3.有机硒则是由无机硒与氨基酸、蛋白质、活性多糖等有机营养成分相结合形成的一类物质,主要包括硒代半胱氨酸、硒甲基硒代半胱氨酸、硒代蛋氨酸三种。与无机硒相比,有机硒的毒副作用大大降低,安全性高,而且,有机硒在人体内更易被消化吸收,生物利用率显著高于无机硒,因此,摄取有机硒是目前主要的补硒形式。
4.三种形态的有机硒中,硒代半胱氨酸主要是以硒替代硫的方式进入人体,进而发挥增强免疫系统、调节甲状腺功能、降低患癌症的风险、减少衰老、减轻疲劳等功能;硒甲基硒代半胱氨酸需要被人体的β-裂解酶转化为甲基硒和硒代半胱氨酸后再被人体吸收,进而发挥补充硒元素等作用,生物利用率与其它有机硒相比较低;硒代蛋氨酸主要起到增强抗氧化能力、增加免疫力等作用,但由于我们人体trna无法识别蛋氨酸和硒代蛋氨酸,当蛋氨酸摄入量被限制时,大比例的硒代蛋氨酸代替蛋氨酸被非特异性的参入到体内蛋白中,导致硒在体内大量积蓄,亦存在一定的风险。因成分为硒代半胱氨酸的补硒产品市场前景最为广阔。
5.利用微生物的生物转化功能将无机硒与氨基酸、蛋白质、活性多糖等有机营养成分相结合以生产得到硒代半胱氨酸是近十几年的研究热点。与现有的植物提取法以及酶拆分法相比,其具有成本低、工艺简单以及安全性高等优势。目前,主要是利用微生物的生物转化功能将无机硒与氨基酸、蛋白质、活性多糖等有机营养成分相结合以生产得到有机硒,但是,由于现有微生物转化无机硒生产硒代半胱氨酸的转化效率过低,利用此方法生产硒代半胱氨酸的产量一直不高,这无疑阻碍了有机硒市场的进一步发展。
技术实现要素:
6.本发明提供一株可高效转化无机硒生产有机硒的格氏乳杆菌(lactobacillus gasseri),且该富硒格氏乳杆菌可有效提高机体硒酶活性。
7.本发明通过在培养过程中添加无机硒,最终筛选出一株富硒量高且有机化程度高的格氏乳杆菌ccfm1305,其干菌粉硒含量能够达到557.97mg/kg,且有机硒转化率可达到93.5%,其中有机硒中硒代半胱氨酸含量可达到82.4%。
8.本发明提供了一株格氏乳杆菌(lactobacillus gasseri)ccfm1305,所述格氏乳杆菌(lactobacillus gasseri)ccfm1305已于2023年02月13日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:63166,保藏地址为广州市先烈中路100号大院59号楼5楼。
9.所述格氏乳杆菌(lactobacillus gasseri)ccfm1305是从来源于江苏省常州市一名男性儿童的粪便样本中分离得到的,将分离得到的菌株进行pcr扩增16s rdna,pcr产物送至上海美吉生物医药科技有限公司进行测序,将测序得到的结果在ncbi中进行核酸序列比对,最终得到1株格氏乳杆菌,命名为格氏乳杆菌(lactobacillus gasseri)ccfm1305。
10.本发明提供格氏乳杆菌ccfm1305通过本发明提供的培养方法培养后具有以下特征:
11.(1)该菌株在mrs固体培养基上培养48h后呈白色,不透明,表面光滑微凸菌落;
12.(2)可将无机硒高效富集,转化为有机硒,能够被机体更好的吸收利用;
13.(3)该菌株结果富硒发酵后,每克菌粉硒含量能够达到557.97mg/kg,且有机硒转化率可达到93.5%,其中有机硒中硒代半胱氨酸含量可达到82.4%,活菌数能够达到6.6
×
10
10
cfu/g以上。
14.本发明还提供一种微生物菌剂,所述微生物菌剂中含有上述格氏乳杆菌ccfm1305或其发酵液,或含有上述格氏乳杆菌ccfm1305冻干粉;或含有经富硒培养后的格氏乳杆菌ccfm1305,或含有经富硒培养后的格氏乳杆菌ccfm1305的细胞裂解物;所述富硒培养为:将格氏乳杆菌ccfm1305接种至含有无机硒的培养基中进行发酵培养。
15.在本明的一种实施方式中,所述含有无机硒的培养基为:蛋白胨5~10g/l、酵母提取物5~15g/l、葡萄糖20~50g/l、牛肉浸膏5~10g/l、无水乙酸钠2~5g/l、柠檬酸氢二胺2~5g/l、k2hpo4·
3h2o 2~5g/l、mgso4·
7h2o 0.1~0.58g/l、mnso4·
h2o 0.05~0.30g/l、吐温80 1g/l、五水亚硒酸钠8~17mg/l。
16.在本明的一种实施方式中,所述微生物菌剂含有所述格氏乳杆菌ccfm1305,或含有格氏乳杆菌ccfm1305经富硒培养后所获得的细胞,或含有机硒的细胞裂解物的益生菌制剂。
17.在本明的一种实施方式中,每g或每ml所述益生菌制剂中的有机硒含量≥500μg。
18.在本明的一种实施方式中,每g或每ml益生菌制剂中含有≥1
×
109cfu格氏乳杆菌ccfm1305或所述经富硒培养后所获得的细胞。
19.在本明的一种实施方式中,所述细胞包括但不限于活细胞或死细胞;所述死细胞包括但不限于自然失去活性的细胞或经灭活处理后的细胞。
20.在本明的一种实施方式中,所述富硒培养是将所述格氏乳杆菌ccfm1305在含有无机硒的培养基中培养至菌体数量≥1
×
109cfu/ml。
21.在本明的一种实施方式中,所述富硒培养是将所述格氏乳杆菌ccfm1305在含有无机硒的培养基中培养一段时间;所述富硒培养基中的硒离子浓度为3~5mg/l。
22.在本明的一种实施方式中,所述格氏乳杆菌ccfm1305经富硒培养后还经过干燥处理;干燥处理的方式包括但不限于:真空冷冻干燥、喷雾干燥、真空干燥、流化床干燥。
23.本发明还提供富硒格氏乳杆菌ccfm1305的培养方法,所述方法包括如下步骤:
24.(1)将所述的格氏乳杆菌ccfm1305在改良mrs固体培养基上划线,平板于37℃倒置培养36~48h,挑取单菌落接入到改良mrs液体培养基中于37℃培养24h。再以2%(v/v)的接
种量接入到改良mrs液体培养基中37℃培养12~18h作为后续培养的种子菌液;
25.(2)将格氏乳杆菌的种子菌液以2%(v/v)的接种至富硒液体培养基中,其中硒溶液于菌株生长的对数期初期接入,继续培养8~10h;
26.(3)发酵完成后将菌液在4℃条件下8000g/min离心20min,取湿菌体用纯水漂洗2次,得到富硒乳杆菌菌泥。
27.在本明的一种实施方式中,所述步骤(2)中所述的富硒液体培养基中硒离子浓度为3~5mg/l。
28.在本发明的一种实施方式中,所述无机硒为亚硒酸钠、硒酸钠和/或单质硒。
29.在本发明的一种实施方式中,所述无机硒为亚硒酸钠。
30.在本发明的一种实施方式中,所述无机硒的添加时间在菌株的生长对数期初期。
31.在本明的一种实施方式中,所述富硒液体培养基含有:蛋白胨5~10g/l、酵母提取物5~15g/l、葡萄糖20~50g/l、牛肉浸膏5~10g/l、无水乙酸钠2~5g/l、柠檬酸氢二胺2~5g/l、k2hpo4·
3h2o 2~5g/l、mgso4·
7h2o 0.1~0.58g/l、mnso4·
h2o 0.05~0.30g/l、吐温80 1g/l、五水亚硒酸钠8~17mg/l。
32.在本明的一种实施方式中,所述富硒格氏乳杆菌菌泥还经过干燥处理,得到高富集硒代半胱氨酸的格氏乳杆菌ccfm1305菌粉。
33.在本明的一种实施方式中,所述富硒格氏乳杆菌菌泥还经过任意干燥处理;所述干燥包括但不限于喷雾干燥、真空干燥、流化床干燥或真空冷冻干燥。
34.在本明的一种实施方式中,所述富硒菌泥经过灭活后再经任意干燥方式处理,得到无细胞活性的高富集硒代半胱氨酸的格氏乳杆菌ccfm1305菌粉;所述干燥使用蛋白或糊精作填充剂,或不使用任何填充剂。
35.本发明还提供应用所述方法制备的富硒格氏乳杆菌ccfm1305菌粉。
36.本发明还提供所述格氏乳杆菌ccfm1305或所述益生菌制剂在制备食品、药品或保健品中的应用。
37.本发明还提供所述格氏乳杆菌ccfm1305或所述益生菌制剂在提高机体硒酶活性方面的应用。
38.本发明还提供了一种产品,所述产品中含有上述格氏乳杆菌ccfm1305或上述微生物菌剂,或含有经富硒培养后的格氏乳杆菌ccfm1305;所述富硒培养为:将格氏乳杆菌ccfm1305接种至含有无机硒的培养基中进行发酵培养。
39.在本发明的一种实施方式中,所述产品为食品、药品或保健品。
40.在本发明的一种实施方式中,所述产品中,格氏乳杆菌ccfm1305的添加量不低于1
×
109cfu/g或1
×
109cfu/ml。
41.在本发明的一种实施方式中,所述含有无机硒的培养基为:蛋白胨5~10g/l、酵母提取物5~15g/l、葡萄糖20~50g/l、牛肉浸膏5~10g/l、无水乙酸钠2~5g/l、柠檬酸氢二胺2~5g/l、k2hpo4·
3h2o 2~5g/l、mgso4·
7h2o 0.1~0.58g/l、mnso4·
h2o 0.05~0.30g/l、吐温80 1g/l、五水亚硒酸钠8~17mg/l。
42.本发明还提供了上述格氏乳杆菌ccfm1305或上述微生物菌剂在制备含有有机硒的产品中的应用。
43.在本发明的一种实施方式中,所述产品为食品、药品或保健品。
44.在本发明的一种实施方式中,所述药品含有富硒格氏乳杆菌、药物载体和/或药用辅料。
45.在本发明一种实施方式中,所述药物载体包含微囊、微球、纳米粒以及脂质体。
46.在本发明一种实施方式中,所述药用辅料包含赋形剂以及附加剂。
47.在本发明一种实施方式中,所述药用辅料包含抗黏合剂、渗透促进剂、缓冲剂、增塑剂、表面活性剂、消泡剂、增稠剂、包合剂、吸收剂、保湿剂、溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、ph值调节剂、黏合剂、崩解剂、填充剂、润滑剂、润湿剂、整合剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、发泡剂、助悬剂、包衣材料、芳香剂、稀释剂、絮凝剂与反絮凝剂、助滤剂以及释放阻滞剂。
48.在本发明的一种实施方式中,所述产品为食品、药品或保健品。
49.在本发明的一种实施方式中,所述食品包含使用含有富硒格氏乳杆菌的发酵剂生产得到的乳制品、豆制品或果蔬制品。
50.本发明还提供了一种生产有机硒的方法,所述方法为先将上述格氏乳杆菌ccfm1305接种至含有无机硒的培养基中进行发酵,得到含有有机硒的格氏乳杆菌ccfm1305菌体,然后将含有有机硒的格氏乳杆菌ccfm1305菌体进行提取,得到有机硒。
51.在本发明的一种实施方式中,所述含有无机硒的培养基为:蛋白胨5~10g/l、酵母提取物5~15g/l、葡萄糖20~50g/l、牛肉浸膏5~10g/l、无水乙酸钠2~5g/l、柠檬酸氢二胺2~5g/l、k2hpo4·
3h2o 2~5g/l、mgso4·
7h2o 0.1~0.58g/l、mnso4·
h2o 0.05~0.30g/l、吐温80 1g/l、五水亚硒酸钠8~17mg/l。
52.有益效果
53.(1)本发明提供了一株可高富集有机硒(硒代半胱氨酸)的格氏乳杆菌ccfm1305,该菌株能够将无机硒富集吸收并在菌体内转化为有机硒,该菌株经过富硒培养后,每克菌粉硒557.97mg/kg,且有机硒转化率可达到93.5%。其中有机硒中硒代半胱氨酸含量可达到82.4%,活菌数能够达到6.6
×
10
10
cfu/g以上。
54.(2)经该格氏乳杆菌ccfm1305菌株富集生产的有机硒能够被机体更好的吸收利用,可有效提高机体硒酶活性。通过动物实验发现,富硒格氏乳杆菌可将缺硒小鼠体内肝脏的gsh-px活性提高到11352u/mgprot,trxr活性提高到1.013u/mgprot;同时,经富硒格氏乳杆菌灌胃的小鼠肝脏中,trxr1和trxr2的表达量均高于无机硒组别。
55.生物材料保藏
56.格氏乳杆菌(lactobacillus gasseri)ccfm1305,分类命名为lactobacillus gasseri,已于2023年02月13日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:63166,保藏地址为广州市先烈中路100号大院59号楼5楼,广东省科学院微生物研究所。
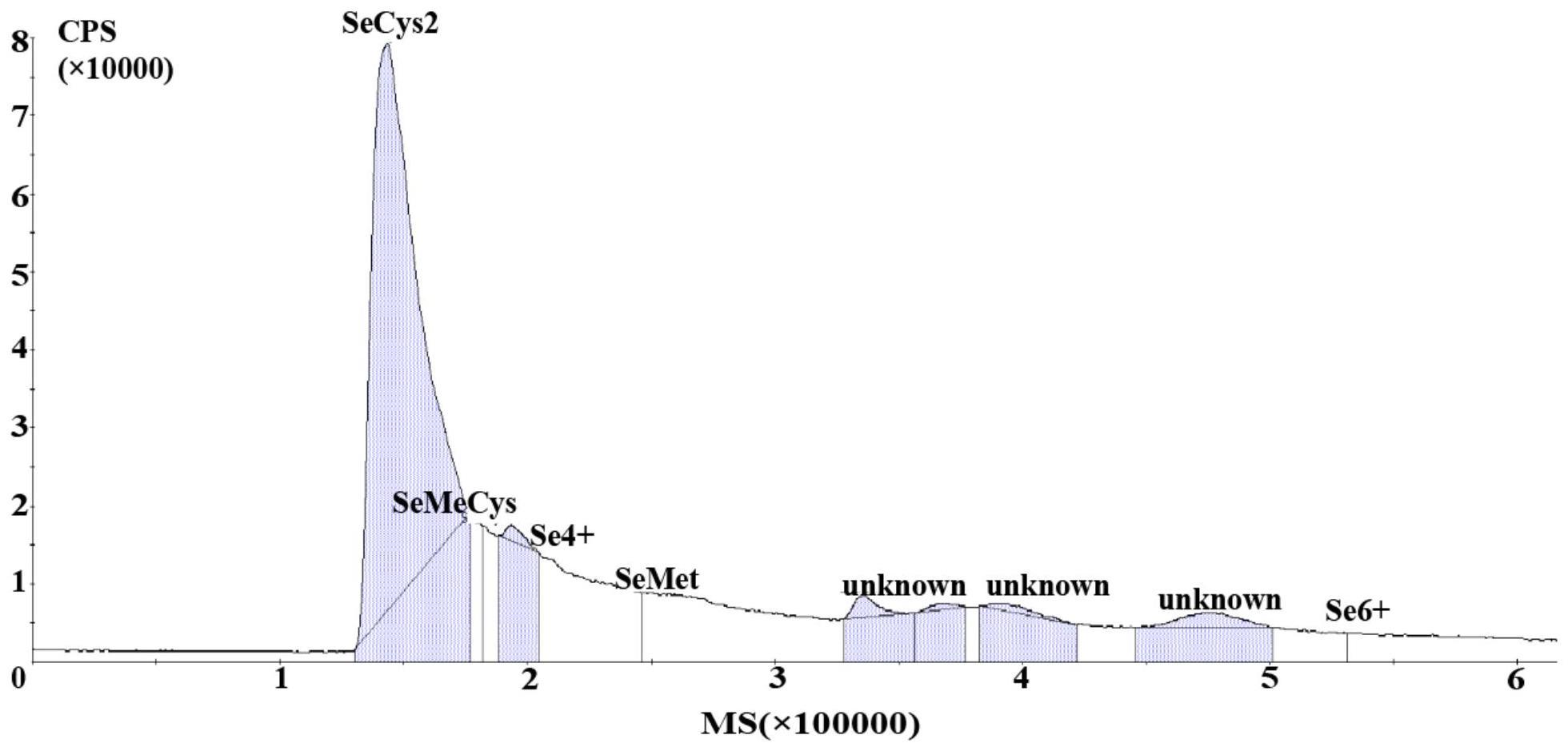
附图说明
57.图1为富硒格氏乳杆菌(lactobacillus gasseri)ccfm1305菌粉中硒形态检测质谱图。
58.图2为补硒对小鼠机体硒酶——gsh-px活性的影响;注:不同字母代表组别间具有显著性差异(**p<0.01)。
59.图3为补硒对小鼠机体硒酶——trxr活性的影响;注:不同字母代表组别间具有显
著性差异(*p<0.05)。
60.图4为补硒对小鼠肝脏中硒酶——trxr基因表达量的变化;注:不同字母代表组别间具有显著性差异(ns:没有差异,*p<0.05,**p<0.01)。
61.图5为小鼠对不同补硒方式机体吸收情况;注:不同字母代表组别间具有显著性差异(**p<0.01,****p<0.0001)。
62.图6为补硒对小鼠体内丙二醛(mda)含量的影响;注:不同字母代表组别间具有显著性差异(*p<0.05)。
具体实施方式
63.下面结合具体实施例对本发明进行进一步的阐述。
64.下述实施例中涉及的亚硒酸钠(产品编号:d16-1030015、cas:26970-82-1)购自上海创赛科技有限公司;蛋白酶xiv(产品编号:p5147、cas:9036-06-0)和蛋白酶k(产品编号:3375201、cas:39450-01-6)购自北京百灵威科技有限公司;葡萄糖购于国药集团化学试剂有限公司。
65.下述实施例中涉及的培养基如下:
66.改良mrs固体培养基:蛋白胨10g/l、酵母提取物5g/l、牛肉浸膏10g/l、葡萄糖20g/l、无水乙酸钠2g/l、柠檬酸氢二胺2g/l、k2hpo4·
3h2o 2.6g/l、mgso4·
7h2o 0.1g/l、mnso4·
h2o 0.05g/l、吐温80 1g/l、琼脂18g/l。
67.改良mrs液体培养基:蛋白胨10g/l、酵母提取物5g/l、牛肉浸膏10g/l、葡萄糖20g/l、无水乙酸钠2g/l、柠檬酸氢二胺2g/l、k2hpo4·
3h2o 2.6g/l、mgso4·
7h2o 0.1g/l、mnso4·
h2o 0.05g/l、吐温80 1g/l。
68.富硒培养基:蛋白胨10g/l、酵母提取物5g/l、葡萄糖30g/l、牛肉浸膏10g/l、无水乙酸钠2g/l、柠檬酸氢二胺2g/l、k2hpo4·
3h2o 2.6g/l、mgso4·
7h2o 0.1g/l、mnso4·
h2o0.05g/l、吐温80 1g/l、五水亚硒酸钠8~17mg/l。
69.下述实施例中涉及的检测方法如下:
70.总硒检测方法:参考《gb 5009.93-2017食品安全国家标准食品中硒的测定》中总硒分析方法。
71.有机硒检测方法:参考《gb 1903.21-2016食品安全国家标准食品营养强化剂富硒酵母》中有机硒分析方法。
72.硒形态检测方法:将样品置于研钵中加入液氮研磨破碎,取研磨后的样品0.15g于离心管中,加入6ml tris-hcl(50mmol/l、ph 7.2)溶解,超声波细胞破碎器破碎5min;之后每隔12h分别加入蛋白酶k(10mg)及蛋白酶xiv(15mg),在37℃、100r/min下振荡酶解24h,酶解后,以4000r/min离心10min,取上清液在0.22μm滤膜过滤;通过hplc-icp-ms进行形态分析。
73.下述实施例中涉及的培养方法如下:
74.乳酸菌种子液的培养:蘸取甘油管中的乳酸菌菌液在在mrs固体培养基上划线,于37℃倒置培养36h,得到单菌落;挑取单菌落接种至mrs液体培养基中,于37℃培养12h,得到培养液;将培养液以2%(v/v)的接种量接种至mrs液体培养基中,于37℃培养12h,得到种子液。
75.实施例1:格氏乳杆菌ccfm1305的筛选及菌种鉴定
76.1、筛选
77.以来源于江苏省常州市一名男性儿童的粪便为样本,用无菌生理盐水进行10倍梯度稀释至10-6
,然后分别取100μl稀释倍数为10-4
、10-5
、10-6
的稀释液于mrs固体培养基上进行平板涂布,37℃倒置培养48h,观察并记录菌落形态;挑取mrs固体培养基上不同形态的菌落进行划线分离,经37℃培养48h后,再次挑取mrs固体培养基上不同形态的单菌落进行划线分离,直至得到形态一致的纯的单菌落;挑取mrs固体培养基上的单菌落接种于富硒培养基中,37℃培养18h;将菌液转移至无菌离心管中,6000r/min离心10min后弃去上层培养基,将得到的菌泥进行冷冻干燥,得到富硒菌粉。检测冻干后菌粉的总硒和有机硒含量,筛选出硒富集较高的菌株。
78.2、鉴定
79.将分离得到的富集硒能力较强的菌株进行pcr扩增16s rdna,pcr产物送至上海美吉生物医药科技有限公司进行测序,将测序得到的结果在ncbi中进行核酸序列比对(其27f序列如seq id no.1所示,其1492r序列如seq id no.2所示),最终得到1株格氏乳杆菌,命名为格氏乳杆菌(lactobacillus gasseri)ccfm1305。
80.3、保存
81.挑取格氏乳杆菌(lactobacillus gasseri)ccfm1305的单菌落接种于mrs液体培养基中,37℃培养18h,得到菌液;取1.5ml菌液于无菌离心管中,6000r/min离心3min后弃去上层培养基,菌泥重悬于30%甘油溶液中置于-80℃中保藏。
82.实施例2:富硒格氏乳杆菌菌粉的制备方法
83.具体步骤如下:
84.(1)将实施例1筛选获得的格氏乳杆菌(lactobacillus gasseri)ccfm1305在改良mrs固体培养基上划线,平板于37℃倒置培养48h;挑取单菌落接入mrs液体培养基中于37℃培养24h;以2%(v/v)的接种量接入到改良mrs液体培养基中37℃培养12~18h作为后续培养的种子菌液。
85.(2)将步骤(1)得到的格氏乳杆菌ccfm1305的种子菌液以5%(v/v)的接种量接种至富硒液体培养基中,继续培养8~10h;
86.(3)将步骤(2)发酵完成后的菌液在4℃条件下8000g/min离心20min,取湿菌体用纯水漂洗2次,以质量分数13%的脱脂乳作为冻干保护剂,将洗涤后的湿菌体与冻干保护剂以质量比1:1混匀,冷冻干燥,得到高富集硒的格氏乳杆菌菌粉。
87.检测格氏乳杆菌(lactobacillus gasseri)ccfm1305冻干粉中的总硒含量、有机硒含量以及硒形态分布(检测结果见表1和图1)。
88.表1:格氏乳杆菌ccfm1305冻干粉中的总硒含量、有机硒含量以及硒形态分布
[0089][0090]
结果显示,由表1可知,格氏乳杆菌(lactobacillus gasseri)ccfm1305可高效转
化无机硒生产有机硒,即可使格氏乳杆菌ccfm1305冻干粉中的总硒含量高达557.97mg/kg,总硒中有机硒含量达到93.5%。其中有机硒中硒代半胱氨酸含量可达到82.4%,活菌数能够达到6.6
×
10
10
cfu/g以上。
[0091]
可选地,还可将富硒格氏乳杆菌灭活、经干燥处理制备菌粉,干燥方式可选用喷雾干燥或真空干燥或流化床干燥或真空冷冻干燥。
[0092]
实施例3:富硒格氏乳杆菌菌粉的制备方法
[0093]
具体步骤如下:
[0094]
(1)在实施例2的基础上,检索并收集不同来源的益生菌富硒培养后的有机硒含量。其中表2枯草芽孢杆菌公开于论文《富硒微生物的筛选、富硒条件优化及鉴定》,青春双歧杆菌cicc6070、两歧双歧杆菌、短双歧杆菌cicc6079、动物双歧杆菌cgmcc1353、长双歧杆菌cicc6068、动物双歧杆菌bb12、假小链双歧杆菌、乳双歧杆菌851公开于论文《富硒双歧杆菌南瓜菌粉的研制》中。
[0095]
表2:不同富硒乳杆菌的硒含量和有机化程度
[0096][0097][0098]
结果显示:表格中所列举的菌株中,格氏乳杆菌ccfm1305的富硒能力最强,可达557.97mg/kg,其余菌株的富硒含量均低于此菌株;虽假小链双歧杆菌的富硒能力可达211.83mg/kg,但其有机化程程度仅有9.76%,远不及格氏乳杆菌ccfm1305,为93.5%,这也是所列举菌株中有机化程度最高的。
[0099]
(2)按照实施例2相同的方法培养表3所示的菌株:罗伊氏乳杆菌p8-4、格氏乳杆菌fscdjy7l1、植物乳杆菌nhhmy10-l1以及鼠李糖乳杆菌fjsyc1-5、植物乳杆菌ccfm8610,制备得到冻干粉并冻干粉中的总硒含量、有机硒含量以及硒形态分布进行相关检测。其中,罗伊氏乳杆菌p8-4、格氏乳杆菌fscdjy7l1、植物乳杆菌nhhmy10-l1以及鼠李糖乳杆菌fjsyc1-5为自行筛选的富硒菌株;植物乳杆菌ccfm8610的保藏编号为cgmccno.6077,记载于公开号为cn102586148a的专利申请文本中,结果如表3所示。
[0100]
表3:罗伊氏乳杆菌p8-4冻干粉、格氏乳杆菌fscdjy7l1冻干粉、植物乳杆菌nhhmy10-l1冻干粉、鼠李糖乳杆菌fjsyc1-5冻干粉以及植物乳杆菌ccfm8610冻干粉的总硒含量、有机硒含量以及硒形态分布
[0101][0102][0103]
结果显示:通过对列举的富硒菌株进行硒形态分析,发现总硒含量最高的为鼠李糖乳杆菌fjsyc1-5,高达631.26mg/kg,但其有机硒含量很低,仅有10%;
[0104]
而格氏乳杆菌ccfm1305的总硒含量为557.97mg/kg,有机化程度高达93.5%,其中有机硒中硒代半胱氨酸的含量82.4%。剩余菌株的富硒能力与有机化程度都不及格氏乳杆菌ccfm1305。
[0105]
以上为已有文献或专利中所述的菌株,其对硒的富集含量和有机硒转化率均相对较低,无法达到本发明菌株的高富硒量、高有机硒含量的理想效果。
[0106]
实施例4:富硒格氏乳杆菌对小鼠机体硒酶活性的影响
[0107]
具体步骤如下:
[0108]
1、造模:
[0109]
选取5周龄雄性c57bl/6j小鼠40只,随机分为正常组、缺硒组、无机硒组(亚硒酸钠)、富硒格氏组4组,每组10只。
[0110]
缺硒组、无机硒组、富硒格氏组用缺硒饲料tp0656m(硒含量为0.02ppm)(订购于南通特洛菲饲料科技有限公司)缺硒喂养六周,进行缺硒造模;
[0111]
正常组喂食对照饲料(成分与缺硒饲料一样,区别在于添加硒含量为0.2ppm)。
[0112]
造模六周后,分别取正常组和缺硒组的小鼠,安乐死处理后取其全血及肝脏,检测造模第六周时小鼠的血硒含量和肝脏中硒含量,比较造模是否成功,结果如下:
[0113]
表4小鼠全血、肝脏中硒含量
[0114] 全血硒含量/ppb肝脏硒含量/ppb正常组174.27952.29缺硒组47.91166.98
[0115]
结果显示:经过六周缺硒饲料与对照饲料的喂养,缺硒组小鼠与正常组小鼠体内的硒水平差异明显,比较其血硒含量与肝脏硒含量,缺硒组的全血硒含量仅有正常组的1/
4,肝脏硒含量不足正常组的1/5,达到缺硒标准。
[0116]
2、干预:
[0117]
从第7周开始,各组小鼠按照0.2ml的灌胃量进行灌胃,持续两周。
[0118]
无机硒组:在饲喂缺硒饲料的同时按照每日0.13μg se/只剂量的亚硒酸钠溶液(每1ml亚硒酸钠溶液中含有1.42μg亚硒酸钠)进行灌胃;
[0119]
富硒格氏组:在饲喂缺硒饲料的同时按照每日0.13μg se/只剂量的菌悬液进行灌胃;所述菌悬液为,将按照硒含量计的实施例2制备的菌粉溶于生理盐水中,每1ml菌悬液中含有1.165μg的富硒格氏乳杆菌ccfm1305。
[0120]
缺硒对照组:饲喂缺硒饲料并灌胃0.2ml的生理盐水;
[0121]
正常对照组:饲喂对照饲料并灌胃0.2ml的生理盐水。
[0122]
3、实验结果:
[0123]
饲养期间定期观察小鼠反应,活动情况,精神状况,毛发变化,最后一次灌胃后24小时收集粪便,然后夜间禁食。次日对小鼠实施安乐死,采集肝脏、小肠组织在液氮中速冻并保存在-80℃。测定了小鼠肝脏中gsh-px活性、trxr活性、trxr1和trxr2的基因表达量、小肠和肝脏的硒含量、mda的含量,检测结果见图2~6。
[0124]
(1)如图2所示,缺硒组小鼠肝脏中硒酶(gsh-px)的活性为2855.24u/mgprot,比正常组(15142.19u/mgprot)显著降低;相比于缺硒组小鼠,富硒格氏组小鼠肝脏的硒酶活性明显升高,达到11352u/mgprot,亚硒酸钠组小鼠只升高了1421.48u/mgprot,无明显差异。
[0125]
(2)如图3所示,缺硒组小鼠肝脏中硒酶(trxr)的活性为0.49u/mgprot,比正常组(1.38u/mgprot)显著降低;相比于缺硒组小鼠,富硒格氏组小鼠肝脏的硒酶活性明显升高,达到1.013u/mgprot,亚硒酸钠组小鼠只升高了0.1242u/mgprot,无明显差异。
[0126]
(3)如图4所示,对于trxr1的基因表达,正常组小鼠的相对表达量比缺硒组小鼠升高了83.17%,富硒格氏组的相对表达量比缺硒组升高40.37%,而亚硒酸钠组的相对表达量只比缺硒组升高9.92%,无明显差异。
[0127]
对于trxr2的基因表达,正常组小鼠的相对表达量比缺硒组小鼠升高82.50%,富硒格氏组的相对表达量比缺硒组升高42.60%,而亚硒酸钠组的相对表达量只比缺硒组升高10.09%,无明显差异。
[0128]
(4)如图5所示,对于肝脏硒含量的检测,缺硒组小鼠肝脏的硒含量为111.44ppb,比正常组(582.32ppb)显著降低;相比于缺硒组小鼠,富硒格氏小鼠肝脏硒含量显著升高(为:232.3ppb),可达2倍多,而亚硒酸钠组小鼠肝脏硒含量(为:158.9ppb)升高了42.56%。
[0129]
对于小肠硒含量的检测,缺硒组小鼠小肠硒含量为12.50ppb,比正常组(90.62ppb)显著降低;相比于缺硒小鼠,富硒格氏小鼠小肠硒含量(为:51.56ppb)明显高于4倍,而亚硒酸钠组小鼠肝脏硒含量(为:32.0ppb)仅有缺硒组的2.5倍。
[0130]
(5)如图6所示,缺硒组小鼠肝脏中丙二醛(mda)1.44μmol/gprot,比正常组(0.76μmol/gprot)显著升高;相比于缺硒组小鼠,富硒格氏组小鼠肝脏中mda的含量明显降低,为1.204μmol/gprot,亚硒酸钠组小鼠肝脏中mda的含量为1.579μmol/gprot,无明显差异。
[0131]
我们的结果表明缺硒对小鼠机体健康有负面影响。不同的硒补充剂由于吸收利用的差异,对机体硒酶(gsh-px、trxr)活性的影响不同,而且对硒酶不同基因的表达量也存在差异,小鼠体内丙二醛(mda)的含量也有变化。富硒格氏乳杆菌ccfm1305的生物利用度要高
于无机硒,能够被机体更好的吸收利用。
[0132]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。