一种特异性结合mrp1蛋白的结合蛋白、试剂盒及其应用
技术领域
1.本发明涉及生物技术领域,具体而言,涉及一种特异性结合mrp1蛋白的结合蛋白、试剂盒及其应用。
背景技术:
2.多药耐药现象是肿瘤化疗的主要障碍,它通过多种相关蛋白质的过度表达而导致肿瘤细胞对多种抗肿瘤药产生抗药性。多药耐药相关蛋白mrp1是主要蛋白之一。mrp分子是一种完整的膜糖磷蛋白,属于与p-糖蛋白相同的atp结合盒跨膜转运蛋白超家族,在许多p-糖蛋白阴性、多药耐药细胞系和肿瘤中过度表达。mrp在耐药性中的主要功能是质膜药物外排泵,而且在胞内隔离药物影响药物的重分布,使药物不能与靶位点结合而间接产生耐药。
3.mrp1(multidrug resistance-associated protein 1)是一种被认为和乳腺癌、肺腺癌等患者多药耐药发生密切相关的跨膜转运蛋白。相对于正常组织,mrp1在乳腺癌、肺腺癌等肿瘤组织中的含量明显增高,同时在复发转移的癌组织中高表达。可见,加强对mrp1的检测对相关癌症多药耐药的检测至关重要。
4.临床上检测肿瘤细胞中蛋白表达的状况常用免疫组织化学(ihc)病理实验来检测,而ihc实验检测的准确性和灵敏度,由特异性结合蛋白的单克隆抗体的优劣性决定。因此,研制一种结合特异性较高的针对mrp1蛋白的单克隆抗体对ihc检测mrp1表达水平具有重要意义。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种特异性结合mrp1蛋白的结合蛋白、试剂盒及其应用以解决上述技术问题。
7.发明人发现,本发明提供的结合蛋白具有较高的活性,与mrp1蛋白具有较高的亲和力,可以用于开发相应的检测试剂或试剂盒,用于检测mrp1蛋白,可以提高检测的灵敏度和特异性。该结合蛋白可以用于诊断以mrp1作为标志物的疾病,本发明为mrp1的检测以及为mrp1作为标志物的疾病的诊断提供更多的蛋白选择,丰富了针对mrp1蛋白的单克隆抗体的类型。
8.名词定义
9.术语“结合蛋白”泛指包含cdr区的一切蛋白/蛋白片段,特别是抗体或抗体功能片段。“抗体功能片段”包括上述这些抗体的抗原化合物结合片段,包括fab、fab’、f(ab’)2、fd、fv、scfv、双特异抗体和抗体最小识别单位,以及这些抗体和片段的单链衍生物。抗体的类型可以选择igg1、igg2、igg3、igg4、iga、igm、ige、igd。此外,“抗体”此用语包括天然发生的抗体以及非天然发生的抗体,包括例如嵌合型(chimeric)、双功能型(bifunctional)和人源化(humanized)抗体,以及相关的合成异构形式(isoforms)。“抗体”此用语可和“免疫球蛋白”互换使用。
10.本文中的术语“抗体”在最广义上使用,其可以包括全长单克隆抗体,双特异性或多特异性抗体,嵌合抗体,以及抗体片段,只要他们展示所需的生物学活性,如特异性结合hrp-ii抗原或其片段。“抗体片段”包括全长抗体的部分,优选地其抗原结合区或可变区。抗体片段的实例包括fab,fab',f(ab')2,fd,fv,互补决定区(cdr)片段,单链抗体(例如,scfv),双价抗体或结构域抗体。
11.通常情况下,抗体的重链和轻链的可变区vh/vl可由以下编号的cdr与fr按如下组合排列连接获得:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。
12.本发明是这样实现的:
13.本发明提供了一种特异性结合mrp1蛋白的结合蛋白,结合蛋白包括抗原结合结构域,抗原结合结构域包括6个互补决定区:
14.cdr-vh1:sdfawt;
15.cdr-vh2:flsysgsttynpslks;
16.cdr-vh3:wgyfgly;
17.cdr-vl1:rssqsivhsngntyle;
18.cdr-vl2:kvsnrfs;
19.cdr-vl3:fqgsyvpwt。
20.本发明提供的结合蛋白通过上述特定的氨基酸序列组成的6个互补决定区赋予了结合蛋白较高的活性,与mrp1蛋白具有较高的亲和力,可以用于开发相应的检测试剂或试剂盒,用于检测mrp1蛋白,可以提高检测的灵敏度和特异性。该结合蛋白可以用于诊断以mrp1作为标志物的疾病,本发明为mrp1的检测以及为mrp1作为标志物的疾病的诊断提供更多的蛋白选择,丰富了针对mrp1蛋白的单克隆抗体的类型。
21.在本发明应用较佳的实施方式中,上述结合蛋白与mrp1蛋白以k≤7.68
×
109l/mol的亲和力结合。
22.例如k≤6
×
109l/mol的亲和力结合,或k≤2
×
109l/mol的亲和力结合,例如k≤8
×
108l/mol的亲和力结合,例如k≤9
×
108l/mol,k≤7
×
108l/mol,k≤6
×
108l/mol,k≤5
×
108l/mol,k≤4
×
108l/mol,k≤3
×
108l/mol,k≤2
×
108l/mol或k≤1
×
108l/mol的亲和力结合。
23.通过公式k=(n-1)/(n*ab
’‑
ab)计算亲和常数。ab'、ab为对应抗原浓度ag下产生半数吸光值的抗体浓度(mol/l)。n=ag/ag’(ag》ag’)。
24.在一种可选的实施方式中,结合蛋白为抗体或功能性片段;
25.在一种可选的实施方式中,功能性片段包括不限于f(ab’)2、fab’、fab、fv、scfv和双特异抗体中的任意一种。
26.上述抗体的功能片段通常具有与其来源抗体相同的结合特异性。本领域技术人员根据本发明记载的内容容易理解到,上述抗体的功能片段可以通过比如酶消化的方法(包括胃蛋白酶或木瓜蛋白酶)和/或通过化学还原分裂二硫键的方法获得。
27.上述抗体的功能片段还可以通过也是本领域技术人员所知的重组遗传学技术或通过例如自动肽合成仪,比如applied biosystems等销售的自动肽合成仪合成获得。
28.在本发明应用较佳的实施方式中,结合蛋白包括序列依次如seq id no:1-4所示的轻链骨架区fr1-l、fr2-l、fr3-l及fr4-l,和/或,序列依次如seq id no:5-8所示的重链
骨架区fr1-h、fr2-h、fr3-h及fr4-h。
29.seq id no:1-8的序列如下表所示:
[0030][0031][0032]
本发明还提供了一种杂交瘤细胞株,细胞株的名称为3c4。
[0033]
本发明还提供了一种结合蛋白在制备用于诊断肿瘤或mrp1免疫检测的试剂或试剂盒中的应用。
[0034]
在本发明应用较佳的实施方式中,肿瘤包括不限于上皮性肿瘤;mrp1免疫检测是以结合蛋白标记组织细胞。
[0035]
在本发明应用较佳的实施方式中,上皮性肿瘤包括不限于乳头状瘤、胃肠癌、子宫癌、卵巢癌、宫颈癌、肺癌、腺癌、乳腺癌、腺瘤或鳞癌。
[0036]
胃肠癌选自食道癌、胆囊癌、胃癌、肝癌、胰腺癌、胆管癌、小肠癌、结肠直肠癌和肛门癌,任选地,其中结肠直肠癌选自结肠癌和直肠癌。
[0037]
在一种可选的实施方式中,腺癌包括不限于肺腺癌、甲状腺癌、涎腺癌或胰腺癌;
[0038]
在一种可选的实施方式中,腺瘤包括不限于囊腺瘤、纤维腺瘤、多形性腺瘤或息肉状腺瘤。
[0039]
在一种可选的实施方式中,乳腺癌包括不限于乳腺导管癌、乳腺上皮癌或乳腺小叶癌。乳腺癌,优选ii期至iv期和/或不良分化的侵袭性导管癌、粉刺癌以及髓样癌(优选2级)。
[0040]
卵巢癌,浆液性和粘液性癌(优选地ic期至iiib期)、颗粒细胞肿瘤、表面上皮-间质肿瘤(腺癌)、囊腺癌以及子宫内膜样肿瘤。
[0041]
子宫癌,优选地包括子宫内膜样腺癌(优选地i期至iiic期)。
[0042]
膀胱癌,优选地包括移行细胞癌(优选地ii期至iv期)。
[0043]
肺癌,优选地包括小细胞肺癌(优选地i期至iiib期)、非小细胞肺癌(优选地不良至中度分化的鳞状和腺癌)以及大细胞肺癌。
[0044]
鳞癌为口腔鳞癌、咽鳞癌、喉癌、食道鳞癌(例如食管鳞癌)、唇的鳞状细胞癌、子宫鳞癌、阴道鳞癌和皮肤鳞癌中的一种或多种。
[0045]
口腔鳞状上皮细胞癌(oral squamous cell carcinoma,oscc)又称口腔鳞癌。口
腔鳞癌例如包括不限于舌鳞癌。
[0046]
在其他实施方式中,上述鳞癌也可以是支气管、膀胱、肾盂等部位通过鳞状上皮化生而形成的鳞状细胞癌。
[0047]
在本发明应用较佳的实施方式中,组织细胞为结肠、肝脏、胰腺、卵巢、子宫内膜、宫颈、肺、甲状腺和乳腺上皮、支气管、膀胱、肾盂中的至少一种。
[0048]
本发明还提供了一种用于诊断肿瘤或mrp1免疫检测的试剂或试剂盒,其含有上述的结合蛋白。
[0049]
在一种可选的实施方式中,上皮性肿瘤包括不限于乳头状瘤、胃肠癌、卵巢癌、子宫内膜样肿瘤、宫颈癌、肺癌、腺癌、腺瘤或鳞癌;在一种可选的实施方式中,腺癌包括不限于肺腺癌、甲状腺癌、涎腺癌或胰腺癌;
[0050]
在一种可选的实施方式中,腺瘤包括不限于囊腺瘤、纤维腺瘤、多形性腺瘤或息肉状腺瘤;
[0051]
在一种可选的实施方式中,乳腺癌包括不限于乳腺导管癌、乳腺上皮癌或乳腺小叶癌;
[0052]
在一种可选的实施方式中,mrp1免疫检测是以结合蛋白标记组织细胞;
[0053]
在一种可选的实施方式中,组织细胞为结肠、肝脏、胰腺、卵巢、子宫内膜、宫颈、肺、甲状腺和乳腺上皮、支气管、膀胱、肾盂中的至少一种。
[0054]
在一种可选的实施方式中,上述试剂或试剂盒还包括标记有可被检测的标记物。
[0055]
可被检测的标记物是指具有能够被肉眼直接观察或被仪器检测或探测到的特性例如发光、显色、放射性等特性的一类物质,通过该特性可以实现对相应目标物的定性或定量检测。
[0056]
在可选的实施方式中,所述可被检测的标记物包括但不限于荧光染料、催化底物显色的酶、放射性同位素、化学发光试剂和纳米颗粒类标记物。
[0057]
在实际的使用过程中,本领域技术人员可以根据检测条件或实际需要选择合适的标记物,无论使用何种标记物,其均属于本发明的保护范围。
[0058]
在可选的实施方式中,荧光染料包括但不限于荧光素类染料及其衍生物(例如包括但不限于异硫氰酸荧光素(fitc)羟基光素(fam)、四氯光素(tet)等或其类似物)、罗丹明类染料及其衍生物(例如包括但不限于红色罗丹明(rbitc)、四甲基罗丹明(tamra)、罗丹明b(tritc)等或其类似物)、cy系列染料及其衍生物(例如包括但不限于cy2、cy3、cy3b、cy3.5、cy5、cy5.5、cy3等或其类似物)、alexa系列染料及其衍生物(例如包括但不限于alexafluor350、405、430、488、532、546、555、568、594、610、33、647、680、700、750等或其类似物)和蛋白类染料及其衍生物(例如包括但不限于藻红蛋白(pe)、藻蓝蛋白(pc)、别藻蓝蛋白(apc)、多甲藻黄素-叶绿素蛋白(precp)等)。
[0059]
在可选的实施方式中,催化底物显色的酶包括但不限于辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶、葡萄糖氧化酶、碳酸酐酶、乙酰胆碱酯酶以及6-磷酸葡萄糖脱氧酶。
[0060]
在可选的实施方式中,放射性同位素包括但不限于
212
bi、
131
i、
111
in、
90
y、
186
re、
211
at、
125
i、
188
re、
153
sm、
213
bi、
32
p、
94
mtc、
99
mtc、
203
pb、
67
ga、
68
ga、
43
sc、
47
sc、
110
min、
97
ru、
62
cu、
64
cu、
67
cu、
68
cu、
86
y、
88
y、
121
sn、
161
tb、
166
ho、
105
rh、
177
lu、
172
lu和
18
f。
[0061]
在可选的实施方式中,化学发光试剂包括但不限于鲁米诺及其衍生物、光泽精、甲
壳动物荧光素及其衍生物、联吡啶钌及其衍生物、吖啶酯及其衍生物、二氧环乙烷及其衍生物、洛粉碱及其衍生物和过氧草酸盐及其衍生物。
[0062]
在可选的实施方式中,纳米颗粒类标记物包括但不限于纳米颗粒、胶体。纳米颗粒包括不限于:有机纳米颗粒、磁性纳米颗粒、量子点纳米颗粒和稀土络合物纳米颗粒。
[0063]
在可选的实施方式中,胶体包括但不限于胶体金属、分散型染料、染料标记的微球和乳胶。
[0064]
在可选的实施方式中,胶体金属包括但不限于胶体金、胶体银和胶体硒。
[0065]
本发明还提供了一种载体,其含有编码上述的结合蛋白的核酸。
[0066]
本发明还提供了一种宿主细胞,其含有上述的载体。
[0067]
本发明还提供了一种生产前述实施方式的结合蛋白的方法,其包括:
[0068]
培养前述实施方式的宿主细胞,从培养基中或从所培养的宿主细胞中分离纯化得到结合蛋白。
[0069]
生产方法可以是例如,用编码至少一部分结合蛋白的核酸载体转染宿主细胞,在合适的条件下培养该宿主细胞使其表达该结合蛋白。宿主细胞也可以用一个或多个表达载体转染,该表达载体可以单独或结合地包含编码至少一部分结合蛋白的dna。利用常规的纯化蛋白质和肽的技术可从培养基或细胞裂解物中分离结合蛋白,所述技术包括硫酸铵沉淀,层析(如离子交换,凝胶过滤,亲合层析等)和/或电泳。
[0070]
构建合适的含有目的编码和调控序列的载体可以使用本领域公知的标准连接和限制技术进行。将分离的质粒、dna序列或合成的寡核苷酸按需要的形式切割、加尾和再连接。可以用任何方法向编码序列中引入突变以产生本发明的变体,这些突变可以包含缺失或插入或置换等。
[0071]
在本发明公开了抗体或其功能性片段的氨基酸序列的基础上,本领域技术人员容易想到采用基因工程技术或其他技术(化学合成、杂交瘤细胞)制备得到该抗体或其功能性片段,例如从能够重组表达如上任一项所述的抗体或其功能性片段的重组细胞的培养产物中分离纯化得到该抗体或其功能性片段,这对本领域技术人员来说是容易实现的,基于此,无论采用何种技术制备本发明的抗体或其功能性片段,其均属于本发明的保护范围。
[0072]
一种检测mrp1的方法,其包括:将前述实施方式任一项的结合蛋白与待测样本混合。
[0073]
在可选的实施方式中,上述方法是以非疾病的诊断为目的。
[0074]
需要说明的是,本领域技术人员可以基于抗体/抗原结合形成免疫复合物的特点对待测样本中的mrp1蛋白进行定性或定量检测。
[0075]
本发明具有以下有益效果:
[0076]
本发明提供的结合蛋白具有较高的活性,与mrp1蛋白具有较高的亲和力,可以用于开发相应的检测试剂或试剂盒,用于检测相关肿瘤组织中的mrp1蛋白表达水平,可以提高检测的灵敏度和特异性。该结合蛋白可以用于诊断以mrp1作为标志物的疾病,本发明为mrp1的检测以及为多药耐药相关蛋白mrp1作为标志物的疾病的诊断提供更多的蛋白选择,丰富了针对mrp1蛋白的单克隆抗体的类型。
附图说明
[0077]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
[0078]
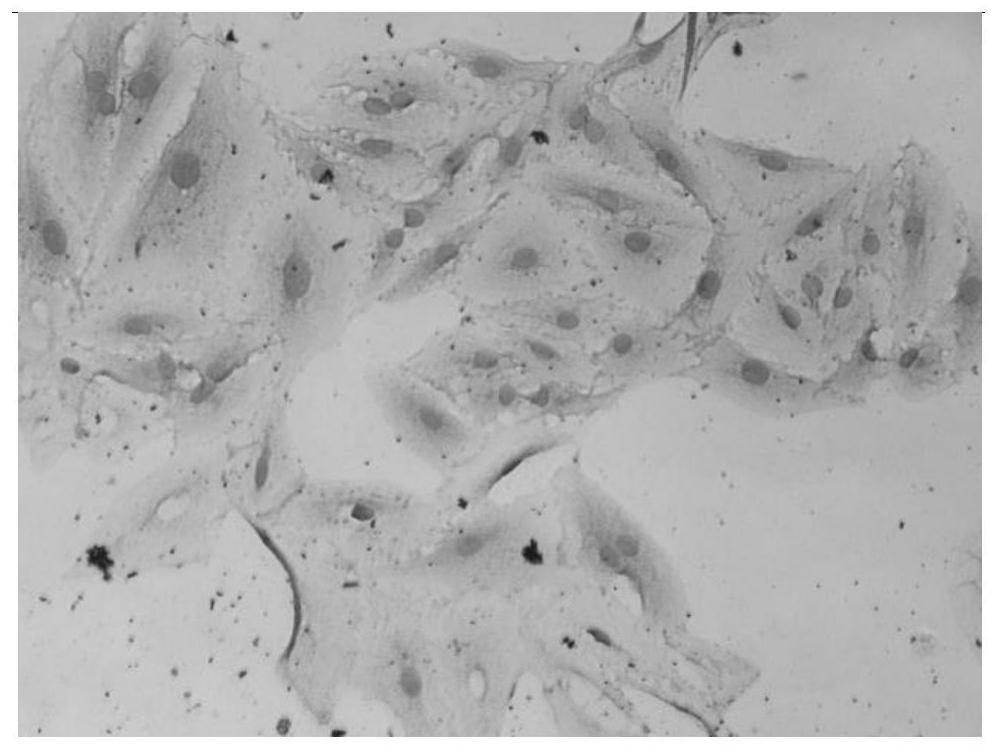
图1为细胞株3c4细胞上清做免疫细胞化学(icc)检测时,识别a549细胞(人非小细胞肺癌细胞)中mrp1蛋白的检测结果图;
[0079]
图2为:免疫组化染色胃腺癌、乳腺癌切片组织显微图;
[0080]
图3为:免疫组化染色肺腺癌切片实验结果图。
具体实施方式
[0081]
现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
[0082]
除非另外指明,否则实践本发明将采用细胞生物学、分子生物学(包含重组技术)、微生物学、生物化学和免疫学的常规技术,所述常规技术在本领域技术人员的能力范围内。文献中充分解释了这种技术,如《分子克隆:实验室手册(molecular cloning:a laboratory manual)》,第二版(sambrook等人,1989);《寡核苷酸合成(oligonucleotide synthesis)》(m.j.gait编,1984);《动物细胞培养(animal cell culture)》(r.i.freshney编,1987);《酶学方法(methods in enzymology)》(学术出版社有限公司(academic press,inc.);《实验免疫学手册(handbook of experimental immunology)》(d.m.weir和c.c.blackwell编);《哺乳动物细胞用基因转移载体(gene transfer vectors for mammalian cells)》(j.m.miller和m.p.calos编,1987);《当代分子生物学方法(current protocols in molecular biology)》(f.m.ausubel等人编,1987);《pcr:聚合酶链反应(pcr:the polymerase chain reaction)》(mullis等人编,1994);以及《当代免疫学方法(current protocols in immunology)》(j.e.coligan等人编,1991),所述文献中的每个文献均通过引用明确并入本文中。
[0083]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0084]
以下结合实施例对本发明的特征和性能作进一步的详细描述。
[0085]
实施例1
[0086]
本实施例进行特异性抗mrp1蛋白的单克隆抗体的制备。
[0087]
1.进行小鼠免疫。
[0088]
利用通用的方法,用免疫原免疫小鼠。免疫原为带his标签的重组人mrp1蛋白,同时作为检测抗原对血清效价和杂交瘤进行测定和筛选,高纯度的抗原能使得到所需单抗的机会增加,同时减轻筛选量。免疫5只小鼠,每只小鼠免疫50ug mrp1抗原。用pbs配置抗原蛋
白溶液。将适量的抗原蛋白、pbs、福氏佐剂放入注射器中,注射器出水口用塞子塞住,放在乳化仪上搅拌充分乳化,使抗原佐剂形成稳定油包水的溶液。在初免和二免后的7-10天进行第一次尾血血清效价检测,经过2到4次的加强免疫得到良好的效价。选择血清效价高的血清免疫小鼠腹腔终免后进行细胞融合。
[0089]
重组人mrp1蛋白序列如下所示:
[0090]
ssemetniva verlkeyset ekeapwqiqe tappsswpqv grvefrnycl ryredldfvl rhinvtingg ekvgivgrtg agkssltlgl frinesaege iiidginiak iglhdlrfki tiipqdpvlf sgslrmnldp fsqysdeevw tslelahlkd fvsalpdkld hecaeggenl svgqrqlvcl arallrktki lvldeataav dletddliqs tirtqfedct vltiahrlnt imdytrvivl dkgeiqeyga psdllqqrgl fysmakdagl。
[0091]
2.进行杂交瘤细胞融合与筛选。
[0092]
在细胞融合前需要做好如下的准备工作:
[0093]
(1)培养小鼠骨髓瘤细胞sp2/0至对数生长期;
[0094]
(2)在融合前一天处死一只阴性鼠,在无菌环境中用hat培养基注入小鼠腹腔取小鼠腹腔滋养层细胞并铺板在96孔板,每孔100ul,这些细胞对杂交瘤细胞生长有促进作用。
[0095]
处死免疫小鼠,在无菌环境下取脾脏,用peg化学融合脾b细胞和sp2/0骨髓瘤细胞,根据要铺板的个数,加入合适的hat培养基,最后将融合细胞铺在滋养层细胞培养板上,每孔100ul。
[0096]
7-10天后可在显微镜下观察存活的杂交瘤细胞生长情况,在铺板两周后,收集各孔上清,用elisa方法用人mrp1-his蛋白抗原进行杂交瘤细胞筛选。方法如下:
[0097]
用100ul 2ug/ml人mrp1-his蛋白抗原的pbs溶液包被酶标板37℃两小时。pbst洗板3次后,加入150ul/孔的3%脱脂奶粉的pbs溶液至于4℃封闭过夜。再洗板三次,加入80ul/孔的杂交瘤上清,37℃孵育1小时,而后洗板三次。以100ul/孔加入1:7000稀释的辣根过氧化物酶标记的羊抗小鼠二抗,37℃孵育45分钟,洗板3次,拍干。添加100ul/孔的tmb显色液,室温显色5-10分钟,用2m硫酸溶液终止,测定450nm处各孔的吸光值。挑选出阳性的杂交瘤细胞。
[0098]
将elisa阳性的融合孔,挑选出来接着做免疫细胞化学染色(icc),挑选出阳性孔做后续实验。
[0099]
icc实验步骤如下:
[0100]
(1)实验前几天将贴壁细胞a549细胞(人非小细胞肺癌细胞)用胰酶消化液消化好后铺在96孔板里,贴壁生长铺满孔板;
[0101]
(2)取出96孔板,倒掉培养基,pbs清洗3次;
[0102]
(3)加入4%多聚甲醛室温固定15-30分钟,pbs洗板三次;
[0103]
(4)0.2%tritonx-100室温10-15min,pbs漂洗三次;
[0104]
(5)3%双氧水处理15min,pbs漂洗3次;3%山羊血清37℃封闭1小时;
[0105]
(6)将融合孔elisa阳性的细胞上清去80ul加入到icc检测板上4℃过夜;
[0106]
(7)pbst漂洗后,加入二抗室温反应40min;
[0107]
(8)dab显色;
[0108]
(9)苏木素染色;
wash solution,9000g离心30秒,倒掉收集管中液体;再重复加wash solution一次,倒掉液体;孔吸附柱于9000g离心1分钟;将吸附柱放入一个干净的1.5ml离心管中,在吸附膜中央加入15-40ul elution buffer,室温静置1分钟后,离心1分钟。获得制备的dna溶液,纯化pcr产物经过测序获得抗体的可变区序列。
[0123]
实验例1
[0124]
本实验例对上述实施例1制得的单克隆抗体的亲和力和灵敏度进行检测。
[0125]
1.将实施例1中的重组人mrp1蛋白按照3mg/l、1.5mg/l、0.75mg/l、0.375mg/l包板。
[0126]
2.调整实施例1制得的单克隆抗体的浓度至10-7
mol/l水平(1*10-7
至5*10-7
mol/l均可)。然后倍比稀释1:2-1:256,加至不同抗原包被量的孔中。
[0127]
3.加入二抗,tmb显色。测450nm吸光值,测得吸光度数据见表1。
[0128]
4.根据抗原抗体结合s曲线,求出不同抗原浓度下,半数吸光值的抗体浓度。这样就有四个抗体浓度(mol/l)。9.501*10-10
mol/l、5.268*10-10
mol/l、3.3334*10-10
mol/l、2.377*10-10
mol/l。
[0129]
5.代入公式k=(n-1)/(n*ab
’‑
ab)计算亲和常数。ab'、ab为对应抗原浓度ag下(3mg/l、1.5ml/l、0.75mg/l、0.375mg/l)产生半数吸光值的抗体浓度。n=ag/ag’(ag》ag’)。
[0130]
6.当n=2时,可以得到三个k值9.652、7.143、7.042。当n=4时,可以得到两个k值7.821、7.075。当n=8时可以得到一个k值7.356.求出6个k值得平均值,为7.682*109。
[0131]
表1 450nm吸光值统计表。
[0132][0133][0134]
实验例2
[0135]
基于免疫组化(ihc)测定纯化抗体mrp1-3c4与mrp1蛋白的结合能力。
[0136]
将胃腺癌、肺腺癌或乳腺癌切片置于60℃恒温箱中烘烤60分钟,将切片用二甲苯ⅰ浸泡15分钟,更换二甲苯ⅱ后浸泡15分钟,分别在无水乙醇
①
浸泡5分钟、无水乙醇
②
浸泡5分钟,95%乙醇5分钟,85%乙醇5分钟,75%乙醇5分钟;ddh2o浸泡5分钟,清洗3次;利用高压锅进行抗原修复(煮沸法)压力锅中加入足以淹没切片的10mmol/l枸橼酸盐缓冲液(ph6.0),加热至沸腾,切片置耐热料切片架上,放入锅中,盖好锅盖,扣上压力阀,继续加热,设置保压4分钟,时间到后打开放气阀放气,压力归零后开锅盖将内锅取出放置室温冷却。
[0137]
待溶液冷却至室温后取出切片(约40min);ddh2o浸泡5分钟,清洗2次,pbst浸泡5
分钟,清洗2次;将切片放置在20ml 3%h2o
2-甲醇溶液中,避光,室温处理10分钟;pbst浸泡5分钟,清洗3次;每个组织群加入山羊血清封闭液一滴约25ul,湿盒中室温孵育45分钟;pbst浸泡5分钟,清洗3次。
[0138]
将处理好的组织切片加入罗氏的ck7抗体进行对比,其余切片加入mrp1-3c4纯化抗体。4℃湿盒中孵育过夜;从4℃冰箱取出,室温孵育60分钟;pbst轻柔冲洗后浸泡5分钟,清洗3次;每个组织群加入hrp标记的长岛公司二抗(cat#:)25ul,室温,孵育45分钟;洗涤;配制好dab显色液,避光反应10-15分钟后滴加到切片上,显色1-5分钟;用蒸馏水终止显色反应;每个组织群滴加苏木素染液50ul,染色5-10分钟,用蒸馏水冲洗干净;将切片放入1%盐酸-乙醇中脱色2-3秒后迅速取出放入蒸馏水中终止,再放入pbst(ph8.0)中反蓝5-10分钟;分别在75%乙醇中浸泡5分钟:85%乙醇中浸泡5分钟;95%乙醇中浸泡5分钟:无水乙醇中浸泡5分钟。用二甲苯浸泡10分钟,换二甲苯后再浸泡10分钟;滴加中性树胶封片,加盖玻片封片;显微镜拍片。如图2、图3所示。
[0139]
免疫组化中和实验:取一定量的mrp1抗原蛋白与mrp1-3c4纯化抗体混合,37℃中和反应1小时。按免疫组化实验步骤,作为一抗滴加到肺腺癌切片,4℃过夜,之后按同样的步骤免疫组化染色,拍片。
[0140]
图2、图3为mrp1的免疫组化实验,检测标本为不同病人的胃腺癌、乳腺癌和肺腺癌组织。图2中a为胃腺癌组织,b为乳腺癌组织,使用抗体为我们生产的mrp1-3c4抗体。图3为肺腺癌组织,a为本发明中的mrp1-3c4抗体,图3中b为国内某生物公司的mrp1抗体。由图3的染色结果可知,mrp1-3c4抗体与某生物公司的抗体相比,本发明提供的抗体染色要更强一些。证实本发明提供的mrp1抗体具有制备试剂盒的应用前景。
[0141]
图3中c为中和实验结果。中和试验中抗原蛋白反应结合了mrp1抗体,抗体无法与癌组织中的抗原结合,使得组织几乎没有染色。
[0142]
可以看出本发明实施例1提供的抗mrp1蛋白单克隆抗体mrp1-3c4可以识别人细胞中的mrp1蛋白并与之结合,在后续ihc染色实验中使得肺腺癌组织中细胞胞质呈棕色,颜色比国内某生物公司的mrp1抗体要更强一些。
[0143]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。