1.本发明提供一种诱导性多能干细胞制备通用血小板的方法,属于遗传工程技术领域。
背景技术:
2.血小板对于止血栓的形成是必不可少的。血小板输注疗法在临床上主要用于预防和治疗血小板数量减少或者功能异常所导致的出血,从而恢复和维持机体的止血和凝血功能。因此,血小板供应短缺对具有异常/罕见血型的输血依赖患者,特别是那些接受同种异体免疫的患者,以及经常发生血小板同种免疫的癌症或白血病患者会产生潜在的威胁生命的后果。
3.现有技术中,临床输注用血小板制剂依赖献血志愿者通过血细胞单采机进行单采血小板获取,单采获取的血小板制剂保质期很短,一般在4到5天。此外,来自捐献者的血小板始终面临被各种病原体污染的风险。与此同时,血小板输注在临床应用上还存在输注无效的情况,尽管首次输注时可以使用与患者不同类型的人白细胞抗原(hla)的血小板,但当重复输血时,患者体内会产生针对相应hla的特异性抗体,使得血小板在输注后迅速失效并被排斥。而且,血小板本身还具有特异性的人血小板抗原(hpa),异体hpa同样也会导致血小板输注后迅速被排斥失效,造成免疫性输注无效的问题。
4.在这种情况下,已有相关研究者着手开发体外诱导成血小板的技术。十多年来,已经研究了来自骨髓 、脐带血或外周血的人类造血干细胞用于巨核细胞和血小板的生成。 使用细胞因子、生长因子和/或基质饲养细胞的某些组合,已经从人类造血干细胞产生了功能性血小板,并取得了显着的成功。然而,人类造血干细胞仍然是从捐赠者那里收集的,在目前的培养条件下扩展能力有限,这会干扰大规模生产和未来的临床应用。人类胚胎干细胞可以在体外无限期地增殖和扩增,为人类治疗提供了一种可能取之不尽且无供体的细胞来源。在过去的十年中,已经广泛研究了人类胚胎干细胞在体外向造血细胞的分,但巨核细胞/血小板的产量和纯度较低。因此,开发异体来源的、低(无)免疫原性、可以随需随取、随取随用的人造血小板势在必行。
5.cn202110444119.8提供一种脐带来源间充质干细胞制备的通用型血小板制剂及方法,公开了一种脐带来源的间充质干细胞制备的通用型血小板制剂及方法,即对脐带来源的间充质干细胞进行多阶段诱导处理,制备血小板制剂;其中,所述血小板为低免疫原性的通用型血小板。
6.上述专利存在以下缺陷:
①
mscs随着体外扩增时间增加而逐渐老化,且表面表达hla-i(hla-a.b.c)水平升高,虽然传代次数少的mscs可以自我下调表面hla-i表达,仍能够引起免疫应答,产生免疫记忆。
7.②
mscs诱导的血小板受mscs传代次数的限制,因此不能进行大规模生产。
8.③
诱导时间长:成脂诱导13天,血小板诱导10天,至少需要23天。
9.④
在血小板诱导第8天,巨核系细胞成熟标志物cd42b的表达量最高,仅有33%。
10.⑤
mscs诱导制备的通用血小板表达hla-d。
技术实现要素:
11.针对现有技术存在的不足,本发明提供一种诱导性多能干细胞制备通用血小板的方法,实现以下发明目的:(1)本发明采用诱导性多能干细胞制备通用血小板的时间短且可以大规模生产;(2)本发明诱导的前血小板形成细胞中血小板的标志物cd41a 、cd42b 血小板的表达量达83%;(3)本发明制备的通用血小板达到正常人源血小板的功能性;(4)本发明制备的血小板不表达hla-d,低表达hla-a.b.c,能够有效避免输注无效的问题,有利于提高输注效率。
12.为解决上述技术问题,本发明采取以下技术方案:一种诱导性多能干细胞制备通用血小板的方法,所述方法包括制备低免疫原性诱导性多能干细胞、诱导生成造血内皮细胞、诱导生成巨核细胞谱系特异性祖细胞、诱导生成前血小板形成细胞、收集血小板;所述制备低免疫原性诱导性多能干细胞为将诱导性多能干细胞的β2微球蛋白敲除,获得β2微球蛋白缺陷型诱导性多能干细胞,即低免疫原性诱导性多能干细胞;所述诱导生成造血内皮细胞,将低免疫原性诱导性多能干细胞,用无饲养层诱导性多能干细胞培养基mtesr1重新悬浮,控制细胞密度为105/ml,得到细胞悬浮液;将细胞悬浮液接种在含胶原蛋白 iv的涂层容器中,添加终浓度为10μm的小分子 rock 抑制剂 y27632,置于 37℃、5%co2培养箱中贴壁培养,24小时后,去除含y27632分子的mtesr1培养基,添加等量的分化起始培养基dim进行诱导分化;所述诱导分化的具体方法为:将添加含有因子的分化起始培养基dim后的培养物转移到5%o2、37℃、5%co2环境中静置2天,第三天,更换新鲜的含有因子的分化起始培养基dim,并将培养物放回到5%o2、37℃、5%co2环境再持续2天;第5天,再次更换新鲜的含有因子的分化起始培养基dim,并将培养物置于常氧培养条件、37℃、5%co2下继续培养2天,得到造血内皮细胞;所述含有因子的分化起始培养基dim,为分化起始培养基dim中添加终浓度为50ng/ml的骨形态发生蛋白-4、50ng/ml的血管内皮生长因子、50ng/ml的碱性成纤维细胞生长因子;所述分化起始培养基dim的配置方法为:imdm作为基础培养基,添加终浓度为100μg/ml的人血清白蛋白,5μg/ml的铁饱和转铁蛋白,10μg/ml的胰岛素,2mg/ml的β-巯基乙醇,30μg/ml的可溶性低密度脂蛋白,5μg/ml的胆固醇。
13.所述诱导生成巨核细胞谱系特异性祖细胞,将造血内皮细胞的培养基,更换成含有因子的mlp 衍生和扩展培养基,控制细胞密度为105/ml,将细胞在37℃和5%co2下培养7天,得到巨核细胞谱系特异性祖细胞;所述含有因子的mlp 衍生和扩展培养基为mlp-dem中添加终浓度25ng/ml的干细胞因子、25ng/ml的血小板生成素、25ng/ml的fms-相关酪氨酸激酶3配体、10ng/ml的白细胞
介素6、10ng/ml的白细胞介素3和5 units/ml 的肝素。
14.所述mlp-dem的配置方法为:50%(v/v)imdm培养基、30%(v/v)f-12培养基和18% (v/v) 无蛋白杂交瘤细胞培养基混合,添加终浓度为100μg/ml的rh白蛋白,0.05wt%的聚乙烯醇,0.25μm的亚油酸,5μg/ml的合成胆固醇,100μm的单硫代甘油,1%(v/v)的胰岛素-转铁蛋白-硒-乙醇胺溶液,250μm的抗坏血酸-2-磷酸盐,1%(v/v)的l-丙氨酰-l-谷氨酰胺,0.5%(v/v)的青霉素/链霉素双抗溶液;所述诱导生成前血小板形成细胞的方法为将巨核细胞谱系特异性祖细胞中的培养基更换成含有因子的mk培养基,细胞密度为105/ml;39℃、5%co2中培养,培养至第3天,将细胞转移到在 37℃和 5%co2下继续培养诱导,培养至第6天得到前血小板形成细胞;所述含有因子的mk培养基,为mk培养基中添加终浓度为1ng/ml的干细胞因子,30ng/ml的血小板生成素,7.5ng/ml的白细胞介素6,13.5ng/ml的白细胞介素9,5μm的rock抑制剂y27632和20units/ml的肝素;所述mk培养基的配置方法为:50%(v/v)imdm培养基、25%(v/v)f-12培养基和23% (v/v) 无蛋白杂交瘤细胞培养基混合,添加终浓度为100μg/ml的rh白蛋白,0.05wt%的聚乙烯醇,0.25μm的亚油酸,5μg/ml的合成胆固醇,100μm的单硫代甘油,1%(v/v)的胰岛素-转铁蛋白-硒-乙醇胺溶液,250μm的抗坏血酸-2-磷酸盐,1%(v/v)的l-丙氨酰-l-谷氨酰胺,0.5%(v/v)的青霉素/链霉素双抗溶液。
15.所述β2微球蛋白缺陷型诱导性多能干细胞中,β2微球蛋白的敲除率为99.5%。
16.所述前血小板形成细胞中血小板表达标志物cd41a 、cd42b 表达量为83%。
17.所述诱导性多能干细胞是采集rgd阴性o型外周血,分离出免疫细胞,经过体外去分化为诱导性多能干细胞。
18.所述通用血小板不表达hla-d,低表达hla-a.b.c。
19.与现有技术相比,本发明取得以下有益效果:(1)本发明制备通用血小板的方法,采用低免疫原性诱导性多能干细胞先诱导生成造血内皮细胞,再诱导生成巨核细胞谱系特异性祖细胞,最后诱导生成前血小板形成细胞,诱导分化时间为19天,诱导时间短,且可以大规模生产;且在大规模生产中,均可以从冻存的巨核细胞谱系特异性祖细胞直接诱导得到前血小板形成细胞,诱导时间更短,仅需要一周左右时间。
20.(2)本发明诱导分化的前血小板形成细胞,可以收集得到血小板,前血小板形成细胞中血小板的标志物cd41a 、cd42b 血小板标志物的最高表达量达83%。
21.(3)本发明制备的通用血小板与正常人源血小板一样均对激活剂adp的刺激有反应且被激活,具有一定的聚集功能。
22.(4)本发明的诱导性多能干细胞来源于rgd阴性o型外周血,不表达hla-d(器官移植中,hla配型最重要的是hla-dr),另外采用的是低免疫原性诱导性多能干细胞(低表达β2-mg(hla-a.b.c))诱导血小板,因此,本发明制备的血小板不表达hla-d,低表达hla-a.b.c,可以避免血小板输注无效的情况。
附图说明
23.图1为本发明实施例1制备的诱导性多能干细胞的显微镜图;
图2为本发明制备的诱导性多能干细胞中相关基因的表达量的柱状图;图3为电转染前的诱导性多能干细胞中β2-mg表达率的流式图;图4为诱导性多能干细胞电转染px330a-β2-mg1后β2-mg表达量的流式图;图5为诱导性多能干细胞电转染px330a-β2-mg2后β2-mg表达量的流式图;图6为诱导性多能干细胞电转染px330a-β2-mg3后β2-mg表达量的流式图;图7为诱导性多能干细胞电转染px330a-β2-mg4后β2-mg表达量的流式图;图8为诱导性多能干细胞电转染px330a-β2-mg5后β2-mg表达量的流式图;图9为本发明诱导分化第3天得到的造血内皮细胞的特异性标志物cd31 表达量的流式图;图10为本发明诱导分化第6天得到的造血内皮细胞的特异性标志物cd31 表达量的流式图;图11为本发明诱导得到的巨核细胞谱系特异性祖细胞的细胞表面标志物cd41a 的表达量的流式图;图12为本发明诱导得到的巨核细胞谱系特异性祖细胞的细胞表面标志物cd13 的表达量的流式图;图13为本发明诱导得到的巨核细胞谱系特异性祖细胞经冷冻、复苏后检测细胞表面标志物cd31 的表达量的流式图;图14为本发明诱导得到的巨核细胞谱系特异性祖细胞经冷冻、复苏后检测细胞表面标志物cd43 的表达量的流式图;图15为本发明巨核细胞谱系特异性祖细胞诱导分化第4天得到的前血小板形成细胞中血小板表达标志物的流式图;图16为本发明巨核细胞谱系特异性祖细胞诱导分化第5天得到的前血小板形成细胞中血小板表达标志物的流式图;图17为本发明巨核细胞谱系特异性祖细胞诱导分化第6天得到的前血小板形成细胞中血小板表达标志物的流式图;图18为本发明实施例4的实验a组中细胞表面p-血清素的表达量的流式图;图19为本发明实施例4的实验b组中细胞表面p-血清素的表达量的流式图;图20为本发明实施例4的对照a组中细胞表面p-血清素的表达量的流式图;图21为本发明实施例4的对照b组中细胞表面p-血清素的表达量的流式图;图22为本发明实施例4收集的血小板表面hla(hla-a.b.c和hla-d)的表达量的流式图。
实施方式
24.实施例1 诱导性多能干细胞(ipscs)的制备采集rgd阴性o型外周血,分离出免疫细胞,经过体外去分化为诱导性多能干细胞,具体方法是按照cn108642014a中的实施例1和实施例2的方法,获得诱导性多能干细胞,如图1所示。
25.实施例2诱导性多能干细胞的鉴定然后按照cn108642014a中实施例3的方法对诱导性多能干细胞进行鉴定,结果显
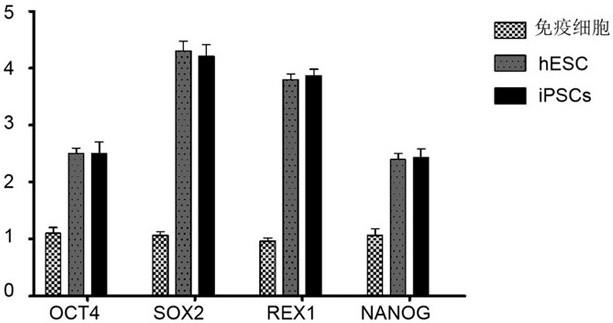
示本发明制备的诱导性多能干细胞中相关基因nanog、oct4、sox2和rex1表达量与hesc细胞的表达量相似,本发明制备的诱导性多能干细胞中相关基因nanog、oct4、sox2和rex1表达量相对于阴性参照(分离的免疫细胞)细胞的表达量显著提高(p<0.05),结果如图2所示。
26.实施例3低免疫原性诱导性多能干细胞的制备利用crispr技术敲除诱导性多能干细胞的β2微球蛋白(β2-mg),获得β2微球蛋白缺陷型诱导性多能干细胞,即低免疫原性诱导性多能干细胞。
27.β2-mg 是hla i类分子(hla-a.b.c)的轻链成员,是hla i类组装和在细胞膜上呈递所必需的。缺乏β2微球蛋白的诱导性多能干细胞在其质膜中具有低或无法检测到的 i 类 mhc 分子,从而降低了诱导性多能干细胞的免疫原性。
28.低免疫原性诱导性多能干细胞的具体制备方法如下:1、crispr/cas9敲除β2-mg表达载体的构建从ncbi中选择序列号为nm_004048.4的β2-mg基因,设计5个β2-mg基因的sgrna片段进行后续实验。
29.β2-mg sgrna1为nm_004048.4的第419-438位核苷酸对应的反义互补序列;β2-mg sgrna2为nm_004048.4的第614-633位核苷酸对应的互补序列;β2-mg sgrna3为nm_004048.4的第568-587位核苷酸对应的互补序列;β2-mg sgrna4为nm_004048.4的第187-206位核苷酸对应的反义互补序列;β2-mg sgrna5为nm_004048.4的第506-525位核苷酸对应的互补序列;将筛选得到的5个β2-mg sgrna核酸序列委托生工生物工程(上海)有限公司合成,连接至crispr/cas9表达载体px330a(购自上海遐永医药科技有限公司)的bbsi酶切位点,分别得到px330a-β2-mg1、px330a-β2-mg2、px330a-β2-mg3、px330a-β2-mg4、px330a-β2-mg5这5种表达载体。
30.2、px330a-β2-mg载体电转染ipscs细胞清洗电转杯,将电转杯置于75%酒精中浸泡2h,然后在紫外灯下照射15min。
31.取1
×
106个实施例1获得的ipscs细胞,加入500μl电转缓冲液重悬细胞,并上下吹打均匀,得到细胞悬液。
32.向上述细胞悬液中加入10μg的px330a-β2-mg1质粒,上下吹打均匀,得到含有px330a-β2-mg1质粒的ipscs细胞悬液。
33.将含有px330a-β2-mg1质粒的ipscs细胞悬液转移入电转杯中(规格为0.2cm),按照预定条件设置参数:300v,10ms,进行2次电击操作。
34.电击完成后,将电转杯置于冰上孵育10min,以使核酸充分进入细胞。
35.将电转杯从冰上取出,将细胞从电转杯中转移出来,过滤后计数,按照105个细胞/ml的细胞密度接种于新鲜的mtesr1培养基中,置于37℃、5%co2的培养箱培养。
36.培养48h后,即可进行细胞电转效率的检测。
37.px330a-β2-mg2、px330a-β2-mg3、px330a-β2-mg4、px330a-β2-mg5这4种表达载体电转染ipscs细胞的方法同px330a-β2-mg1。
38.通过流式细胞术检测β2-mg的表达来确定这5种表达载体的敲除效率,敲除效率计算公式为:(电转染前基因表达率-电转染后基因表达率)/电转染前基因表达率*100%。
39.如图3-8所示:流式细胞技术检测电转染前的ipscs细胞β2-mg表达率为99.9%,电
转染px330a-β2-mg1、px330a-β2-mg2、px330a-β2-mg3、px330a-β2-mg4、px330a-β2-mg5这5种表达载体后,β2-mg表达率为分别为1.2%、5.0%、0.5%、2.7%、3.3%。根据敲除效率计算公式可得这5种表达载体对β2-mg 基因的敲除率分别为98.8%、95.0%、99.5%、97.3%、96.7%。
40.本发明构建的敲除β2-mg基因的最高效率为99.5%,故选取敲除率为99.5%的β2微球蛋白缺陷型诱导性多能干细胞细胞进行后续试验。
41.实施例4 通用血小板的诱导将实施例3获得的β2微球蛋白缺陷型ipscs细胞(低免疫源性的ipscs细胞)体外定向诱导成通用血小板,具体步骤如下:步骤1、诱导成造血内皮细胞(pve-he)将实施例3收获的敲除率为99.5%的β2微球蛋白缺陷型ipscs细胞,用无饲养层诱导性多能干细胞培养基(mtesr1)重新悬浮,控制细胞密度为105/ml,得到细胞悬浮液。
42.将细胞悬浮液接种在含胶原蛋白 iv的涂层容器中(容器提前在4℃过夜孵育),添加终浓度为10μm的小分子 rock 抑制剂 y27632,置于37℃、5%co2培养箱中贴壁培养,24小时后,去除含y27632分子的mtesr1培养基,添加等量的含有因子的分化起始培养基(dim)进行诱导分化。
43.所述诱导分化的具体方法为:将培养物转移到低o2(5%)、37℃、5%co
2 环境中并静置2天,第三天,更换新鲜的含有因子的分化起始培养基,并将培养物放回到低o2(5%)、37℃、5%co
2 环境再持续2天。第5天,再次更换新鲜的含有因子的分化起始培养基并将培养物置于常氧培养条件(37℃、5%co2)下继续培养2天,得到造血内皮细胞。
44.分别取诱导分化第3天、第6天的一小部分细胞,进行流式细胞术检测分析造血内皮细胞特异性标志物 cd31 的表达情况,如图9-10所示,诱导第3天的细胞表达造血内皮细胞特异性标志物 cd31 ,其表达率为 40.7% ,第6天cd31 的表达量高达95%,这表明造血内皮细胞诱导成功。
45.所述含有因子的分化起始培养基dim,为分化起始培养基dim中添加终浓度为50ng/ml的骨形态发生蛋白-4(bmp-4)、50ng/ml的血管内皮生长因子(vegf)、50ng/ml的碱性成纤维细胞生长因子(bfgf)。
46.所述分化起始培养基dim的配置方法为:imdm作为基础培养基,添加终浓度为100μg/ml的人血清白蛋白,5μg/ml的铁饱和转铁蛋白,10μg/ml的胰岛素,2mg/ml的 β-巯基乙醇,30μg/ml的可溶性低密度脂蛋白 (ldl),5μg/ml的胆固醇。
47.步骤2、pve-he 细胞诱导生成巨核细胞谱系特异性祖细胞 (mlp)在将步骤1中诱导分化第6天获得的pve-he,去除含有因子的分化起始培养基dim,更换成含有因子的mlp 衍生和扩展培养基(mlp-dem)(在此期间不执行培养基更换,但如果培养物开始指示培养基耗尽(培养基显示为黄色),则会添加额外的培养基),控制细胞密度为105/ml,将细胞在 37℃和 5%co2下培养7天。收集第7天的 mlp细胞,经过200g,10min离心后,取一部分离心沉淀进行流式细胞术检测并分析mlp细胞表面标志物cd41a 、cd13 的表达。
48.如图11-12所示:该阶段诱导的细胞表面标志物cd41a 、cd13 的表达量分别为93.5%、92.9%,这表明巨核细胞谱系特异性祖细胞(mlp)细胞诱导成功。
49.收集第7天的mlp细胞,并冷冻保存备用(本发明终产品ipscs-plt均可以从冷冻保存mlp细胞开始诱导)。
50.冷冻保存mlp细胞:使用含有 10% dmso(体积比) 的细胞冷冻培养基 cs10 (sigma) 作为保存液,实现 mlp 的冷冻保存,每个冷冻管中含有1ml的保存液,含有5*106个细胞,在-80℃冰箱中储存2天,然后转移到液氮中保存。
51.复苏一管冷冻保存的 mlp 样品,经过200g,10min离心后,取一部分离心沉淀进行流式细胞术检测冻存mlp细胞cd31 、cd43 的表达,如图13-14所示。
52.如图13-14所示:本发明冷冻保存的mlp细胞群表达99.3% cd31 和98.5% cd43 ,这表明冷冻保存的mlp细胞群具有造血功能,可直接用于血小板的诱导。因此本发明终产品 ipscs-plt均可以从冷冻保存mlp细胞开始诱导,这样可以缩短诱导时间。
53.所述含有因子的mlp 衍生和扩展培养基(mlp-dem),为mlp-dem中添加终浓度25 ng/ml的干细胞因子(scf)、25ng/ml的血小板生成素(tpo)、25ng/ml的fms-相关酪氨酸激酶3配体(fl)、10ng/ml的白细胞介素6 (il-6) 、10ng/ml的白细胞介素 3(il-3)和5 units/ml 的肝素。
54.所述mlp-dem的配置方法为:50%(v/v)imdm培养基、30%(v/v)f-12培养基和18% (v/v) 无蛋白杂交瘤细胞培养基(pfhmii)混合,添加终浓度为100μg/ml 的rh白蛋白(albucult),0.05wt%的聚乙烯醇 (pva),0.25μm的亚油酸,5μg/ml的合成胆固醇(synthechol),100μm的单硫代甘油 (a-mtg),1%(v/v)的胰岛素-转铁蛋白-硒-乙醇胺溶液(its-x) ,250μm的抗坏血酸
‑ꢀ
2-磷酸盐,1%(v/v)的l-丙氨酰-l-谷氨酰胺(glutamax i),0.5%(v/v)的青霉素/链霉素双抗溶液。
55.步骤3、巨核细胞谱系特异性祖细胞生成前血小板形成细胞将步骤2分化第7天获得的mlp中的培养基更换成含有因子的mk培养基,细胞密度为105/ml;39℃、5%co2中培养。第2天诱导得到mk细胞。
56.培养至第3天,诱导得到前血小板形成细胞,将细胞转移到在37℃和 5%co2下继续培养诱导。分别收集第4、5、6天的细胞,经过200g,10min离心后,取一部分离心沉淀进行流式细胞术检测并分析血小板表达标志物cd41a 、cd42b ,如图15-17所示。
57.结果如图15-17所示,第4天前血小板形成细胞中血小板表达标志物 cd41a 、cd42b 的表达量为55.1%,第5天前血小板形成细胞中血小板表达标志物cd41a 、cd42b 表达量高达到 74.6%,第6天前血小板形成细胞中血小板表达标志物cd41a 、cd42b 表达量达到83%。
58.所述含有因子的mk培养基,为mk培养基中添加终浓度为1ng/ml的干细胞因子(scf), 30ng/ml的血小板生成素(tpo),7.5ng/ml的白细胞介素6 (il-6), 13.5ng/ml的白细胞介素9(il-9),5μm的y27632(rock抑制剂)和20units/ml的肝素。
59.所述mk培养基的配置方法为:50%(v/v)imdm培养基、25%(v/v)f-12培养基和23% (v/v) 无蛋白杂交瘤细胞培养基(pfhmii)混合,添加终浓度为100μg/ml的rh白蛋白(albucult),0.05wt%的聚乙烯醇 (pva),0.25μm的亚油酸,5μg/ml的合成胆固醇(synthechol),100μm的单硫代甘油 (a-mtg),1%(v/v)的胰岛素-转铁蛋白-硒-乙醇胺溶液(its-x),250μm的抗坏血酸-2-磷酸盐,1%(v/v)的l-丙氨酰-l-谷氨酰胺(glutamax i),0.5%(v/v)的青霉素/链霉素双抗溶液。
60.步骤4、收集血小板采用人血小板分离试剂盒 biovision收集血小板,具体方法如下:用人血清白蛋白( hsa )梯度沉降法分离血小板:hsa梯度为12%(w/v)、10%(w/v)、7%(w/v)、5%(w/v)和 2%(w/v)。
61.hsa梯度溶液制备:将 hsa 溶解在 pbs 溶液中,浓度为 12%(w/v),并通过0.22μm 过滤器过滤溶液。将浓度为12% hsa溶液用pbs溶液稀释成以下浓度:10%(w/v)、7%(w/v)、5%(w/v)和2%(w/v)。
62.hsa 梯度:在15 ml 离心管中加入 1.5 ml的12%(w/v)hsa溶液,在顶部轻轻加入 1.5ml10%(w/v)hsa使其分层,以此类推,逐步添加1.5ml 7%(w/v)hsa,1.5ml 5%(w/v)hsa,1.5 ml 2%(w/v)hsa。
63.(1)收集步骤3分化第6天的细胞和培养基, 轻轻重悬细胞培养并将细胞悬液转移到50 ml管中, 1000 g离心10分钟;(2)丢弃上清液并用2ml cgs溶液(ph6.5)重新悬浮细胞和血小板;(3)轻轻将2ml细胞悬液加载到不连续hsa 梯度顶部使其分层;(4)将 hsa 梯度80g离心15分钟;(5)丢弃梯度的0.5 ml上相并收集下一个包含plt的4.5ml上相;(6)加入等体积的1% hsa溶液稀释收集的plt,并添加1μm pge1(防止活化),1000 g 离心10分钟;(7)丢弃上清液,用保存液重悬血小板,调整浓度2
×
107plt /ml保存。
64.所述保存液为1%(体积比)热灭活人血清 (ab)和 25μm gm6001的bs1培养基(长期储存,37℃)。
65.步骤5、体外活化测定法检测ipscs-plt功能性血小板聚集功能性实验:样本
①
:步骤4中(7)丢弃上清液,用pbs溶液重悬血小板,血小板浓度2
×
107plt /ml;样本
②
:rgd阴性o型外周血,800rpm,离心5min,取上清液为富血小板血浆(将血小板浓度调整为2
×
107plt /ml);实验a组:500 μl样本
①
中加入5 μladp激活剂;对照a组:500 μl样本
①
中加入5μlpbs溶液;实验b组:500 μl样本
②
中加入5μladp激活剂;对照b组:500μl样本
②
中加入5μlpbs溶液;所述adp激活剂的终浓度为5μm。
66.室温孵育10分钟,每组加入5μl pe 标记的抗cd62p单抗,室温避光10分钟,加入1%pfa 1ml室温避光固定10分钟,pbs 洗涤2次,1200g低温离心5分钟,弃上清,用200μlpbs悬浮细胞上机分析。通过流式细胞仪检测血小板激活前后其细胞表面上表达的p-血清素(cd62p)水平,评估血小板完整性和活化状态(如图18-21所示)。
67.结果如图18-21所示:血小板被adp激活后,其细胞表面上表达的p-血清素(cd62p) 水平表达升高且高水平表达,实验a组和实验b组表达量分别为85.1%、87.8%,而没加入adp激活剂的血小板均低水平表达,对照a组和对照b组cd62p 表达量分别为12.2%、14.3%,这表
明本发明由诱导性多能干细胞诱导的血小板(ipscs-plt)与正常人源血小板一样均对激活剂adp的刺激有反应且被激活,具有一定的聚集功能。
68.步骤6、血小板hla表面标志物检测取0.2ml步骤5的样本
①
,加入5μl fitc 标记的抗hla-a.b.c单抗和5μl pe标记的抗hla-d单抗,室温避光10分钟,加入1ml1wt%pfa 室温避光固定10分钟,pbs洗涤2次,1200g低温离心5分钟,弃上清,用200μl pbs悬浮细胞上机分析。通过流式细胞仪检测血小板hla表面标志物表达(如图22所示);结果如图22所示:本发明制备的血小板不表达hla-d,低表达hla-a.b.c(表达率为0.4%),故本发明制备的血小板免疫原性极低,为通用型血小板,能够有效避免输注无效的问题,有利于提高输注效率。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。