1.本发明涉及植物性蜕皮素和半合成的植物性蜕皮素衍生物用于治疗呼吸功能受损的用途,特别是在病毒起源的病理学背景下。
背景技术:
2.病毒起源的呼吸道感染影响上呼吸道和下呼吸道。导致这些感染的病毒很多。特别是鼻病毒、呼吸道合胞病毒、流感(流行性感冒)病毒、甲型流行性感冒(h1n1)病毒和冠状病毒。
3.动物冠状病毒种类繁多。在过去的二十年里,冠状病毒向人类的传播已经导致了几次致命的流行病。人类冠状病毒引起上呼吸道和下呼吸道的感染。
4.根据所涉及的流行病和冠状病毒的不同,一部分患者会出现迅速加重的呼吸功能不全和急性呼吸窘迫综合征(ards,mckay和al-haddad 2009),导致需要插管。
5.ards代表了感染冠状病毒的患者死亡的主要原因(greenland等人,2020;zhou等人,2020)。因此,必须尽快检测出呼吸系统问题并对其进行治疗。
6.21世纪的三大主要致命性冠状病毒流行病是由sars-cov、mers-cov和sars-cov-2引起的流行病。
7.例如,当前covid-19大流行病期间患者的死亡率是3.6%。百分之十三的受影响患者被认为是严重的(即伴有呼吸代偿障碍)。目前,sars-cov-2在全世界造成500,000多病例和25,000多人死亡。
8.总而言之,呼吸功能不全在感染冠状病毒的患者中是常见的,呼吸功能不全的特征在于呼吸系统无法提供足够的氧合作用和排出二氧化碳。
9.因此,在冠状病毒感染的背景下制定和评价治疗方案方面,评价呼吸功能的功能失常是要考虑的一个重要的参数。
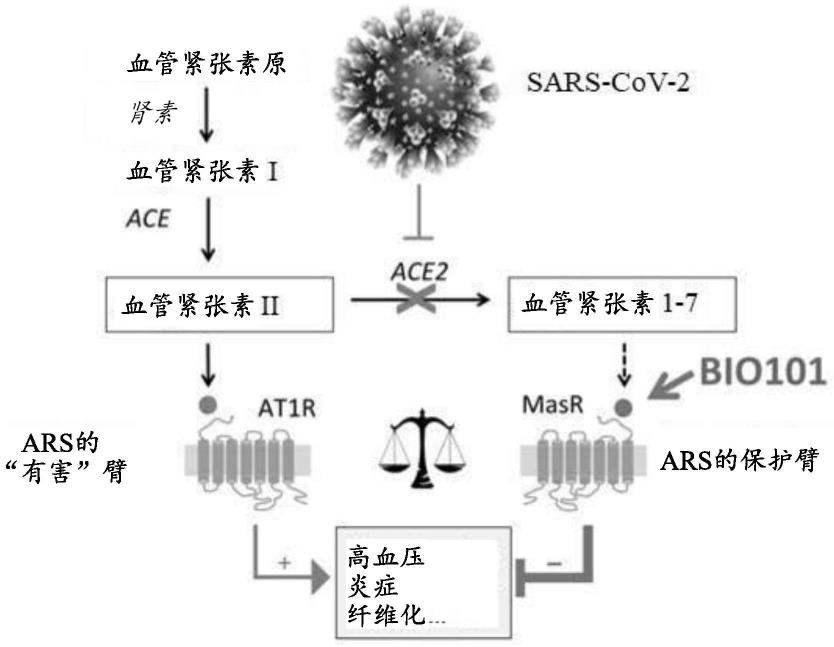
10.血管紧张素-2转换酶(ace2)、特别是在肺上皮细胞和内皮细胞中表达的ace2是造成sars流行病的sars-cov和sars-cov-2的受体(hoffmann等人,2020;wan等人,2020;xu等人,2020)。ace2形成血管紧张素肾素系统(ars)的一部分,它将血管紧张素ii(ang ii)转换为血管紧张素1-7(ang-1-7)。ang-1-7通过与mas受体(masr)结合介导抗炎性、抗氧化和血管扩张作用(magalhaes等人,2018;jiang等人,2013;van twist等人,2014)。相反,ace将血管紧张素i(ang i)转换为血管紧张素ii(ang ii)。ang ii与其受体(1型ang ii受体(at1))的结合引起血管收缩、促炎性和促氧化作用。ace/ang ii/at1轴和ace2/ang-1-7/masr轴分别被称为ars的“有害”臂和“保护”臂(santos等人,2013)。
11.基于对sars-cov积累的知识,似乎sars-cov-2与ace2的相互作用会降低ace2的活性,导致ang-1-7的产生减少以及由ace产生的ang-ii过量,从而导致对ars的总体干扰。ars的“保护”臂和“有害”臂之间的不平衡似乎在与covid-19相关的急性肺部病变(apl)和急性呼吸窘迫综合征(ards)中起着核心作用(kuba等人,2005;imai等人,2005)。
12.抑制ars的ace2/ang-1-7/masr“保护”臂以利于ace/ang ii/at1“有害”轴的信号传导,似乎是肺血管收缩(lipworth和dagg,1994)和器官的炎性/氧化病变的原因,最终在感染sars-cov-2的患者中向apl/ards进展(zhang和baker,2017)。这一理论得到了最近一项研究的支持,所述研究表明,covid-19患者的血清ang ii水平显著高于未感染的个体,更重要的是,其与病毒载量和肺部病变线性相关(liu等人,2020)。
13.一定数量的研究已证明,刺激ace2/ang-1-7/mas轴有可能对肺组织和呼吸功能产生有益作用。在肺气肿(candida bastos等人,2019)、肺纤维化(meng等人,2014;meng等人,2015;shao等人,2019)、肺动脉高压(daniell等人,2020)、肺部炎症(ye等人,2020;chen等人,2013)和烟草中毒(zhang等人,2018)的背景下特别如此。
14.此外,血管紧张素1-7具有血管扩张特性,并且具有降血压作用(benter等人,1993)和抗高血压作用(zhang等人,2019)。
15.植物性蜕皮素代表一个重要的多羟基化植物甾醇家族,其结构与昆虫蜕皮激素相似。这些分子由许多植物物种产生,并且参与它们针对昆虫有害生物的防御。主要的植物性蜕皮素是20-羟基蜕皮素(20e)。
16.20e在哺乳动物中具有药理学活性。它激活ars的保护臂上的mas受体(dilda等人,2019)。mas通过20e进行的参与使得在正常和病理背景下产生许多临床前有益活性。
17.在急性肺损伤(ali)小鼠模型中,20-羟基蜕皮素具有体内抗炎性作用。通过使用20-羟基蜕皮素进行治疗,血浆炎性细胞因子(tnf-α、il-2、il-6、il-8)和抗炎性细胞因子(il-4、il-10)分别减少和增加。炎症的调节与肺损伤的减少有关,如经处理的动物的肺的组织学检查所示(xia等人,2016;song等人,2019)。
18.bio101是20-羟基蜕皮素的口服制剂,纯度大于或等于97%。在国际专利申请wo 2018/197731(lafont等人,2018)中披露了其制备方法。bio101是一种临床上开发的用于肌肉减少症和杜氏肌营养不良症的新型候选药物。后一治疗应用是国际专利申请wo 2018/197708(dilda等人,2018)的主题。还开发了半合成的20-羟基蜕皮素衍生物,如国际专利wo 2015/177469(lafont等人,2015)中所披露的,并且将所述衍生物用于此类治疗应用。
19.一个旨在重建感染sars-cov或sars-cov-2的患者中血管紧张素肾素系统(ars)平衡的选项是使用转换酶抑制剂(ace)或血管紧张素2受体(at1)的拮抗剂抑制ars的“有害”臂。然而,在冠状病毒感染的背景下干扰ace/ang ii/at1轴似乎是不适当的,并且具有潜在的危险性。这是因为已知ace抑制剂会导致不希望的呼吸作用(kostis等人,2005),并且已知使用at1受体的拮抗剂会引起ace2(其是sars-cov和sars-cov-2受体)的表达(wang等人,2016;klimas等人,2015),这种作用容易有利于病毒进入细胞。
20.因此,寻找另一种方式重建受感染患者中血管紧张素肾素系统(ars)的平衡似乎是有利的。
技术实现要素:
21.出于此目的,本发明涉及包含至少一种植物性蜕皮素和/或至少一种半合成的植物性蜕皮素衍生物的组合物,所述组合物用于在治疗哺乳动物的由病毒感染引起的呼吸功能受损中使用。
22.使用植物性蜕皮素和/或半合成的植物性蜕皮素衍生物,经由激活mas受体来直接
激活血管紧张素-2转换酶(ace2)下游的血管紧张素肾素系统(ars)的“保护”臂,似乎是用于在哺乳动物病毒感染期间重建ars平衡的有效治疗选项。此外,植物性蜕皮素及其半合成的衍生物并未重现血管紧张素1-7(ang-1-7)的所有作用(benter等人,1993;zhang f.等人,2019)。尽管它们具有抗炎性和抗纤维化作用,但是它们对哺乳动物的心血管参数没有影响。然而,在特别是与病毒感染和休克状态相关的呼吸窘迫的情况下,可以证明降血压作用是不利的(bitker和burell等人,2019;wujtewicz等人,2020)。同样有利的是,植物性蜕皮素及其半合成的衍生物对吸气峰流速(pifr)、呼气峰流速(pefr)、呼吸频率、以及最后对penh没有影响。
23.在特定实施方式中,本发明还满足以下特征,所述特征单独地实现或者以它们的技术上可行的组合中的每一个实现。
24.有利地,将植物性蜕皮素及其衍生物纯化为药物级。
25.根据本发明可以使用的一种植物性蜕皮素是例如20-羟基蜕皮素,并且可以使用的半合成的植物性蜕皮素衍生物是例如半合成的20-羟基蜕皮素衍生物。
26.出于此目的,根据特定实施方式,组合物包括20-羟基蜕皮素和/或至少一种半合成的20-羟基蜕皮素衍生物。
27.有利地,将20-羟基蜕皮素及其衍生物纯化为药物级。
28.通过活性剂的方式,使用的20-羟基蜕皮素优选地呈富含20-羟基蜕皮素的植物提取物的形式或呈包括20-羟基蜕皮素的组合物的形式。富含20-羟基蜕皮素的植物提取物是例如,鹿草(stemmacantha carthamoides)(也称为鹿草(leuzea carthamoides))、露水草(cyanotis arachnoidea)和蓝耳草(cyanotis vaga)的提取物。
29.优选地,将获得的提取物纯化为药物级。
30.在一个实施方式中,20-羟基蜕皮素呈植物提取物或植物的一部分的提取物的形式,所述植物选自含有按所述植物的干重计至少0.5%的20-羟基蜕皮素的植物,所述提取物包括至少95%、并且优选地至少97%的20-羟基蜕皮素。优选地,将所述提取物纯化为药物级。
31.所述提取物在下文中称为bio101。它明显包括按提取物的干重计0至0.05%的杂质,例如次要化合物,所述杂质容易影响所述提取物的药物应用的无害性、可用性或功效。
32.根据本发明的一个实施方式,杂质是具有19个或21个碳原子的化合物,例如红苋甾酮、二氢红苋甾酮或坡斯特甾酮。
33.生产bio101的植物优选地选自鹿草(stemmacantha carthamoides)(也称为鹿草(leuzea carthamoides))、露水草和蓝耳草。
34.植物性蜕皮素的衍生物、特别是20-羟基蜕皮素的衍生物是通过半合成获得的,并且特别地可以按国际专利申请号wo 2015177469(lafont等人,2015)中描述的方式获得。
35.根据特定实施方式,本发明涉及组合物,所述组合物用于在治疗哺乳动物的由病毒感染引起的呼吸功能受损中使用,所述病毒选自鼻病毒、呼吸道合胞病毒、流感(流行性感冒)病毒、甲型流行性感冒病毒(h1n1)和冠状病毒。
36.经由激活mas受体来直接激活血管紧张素-2转换酶(ace2)下游的血管紧张素肾素系统(ars)的“保护”臂,似乎是用于重建ars平衡从而保护感染冠状病毒的患者免于急性呼吸窘迫综合征(ards)的有效治疗选项。
37.根据特定实施方式,本发明涉及组合物,所述组合物用于在治疗由冠状病毒的病毒感染引起的呼吸功能受损中使用,所述冠状病毒使用ace2作为哺乳动物细胞表面上的受体。
38.根据优选实施方式,本发明涉及组合物,所述组合物用于在治疗哺乳动物的由sars-cov的病毒感染引起的呼吸功能受损中使用。sars-cov是引起严重急性呼吸综合征的冠状病毒。
39.根据特定实施方式,本发明涉及组合物,所述组合物用于在治疗哺乳动物的由sars-cov-2的病毒感染引起的呼吸功能受损中使用。sars-cov-2是引起covid-19大流行病的严重急性呼吸综合征的2型冠状病毒。
40.根据特定实施方式,治疗呼吸功能受损包括预防和治疗受病毒感染影响的哺乳动物中的呼吸功能不全。
41.根据特定实施方式,治疗呼吸功能受损包括预防和治疗遭受病毒感染的哺乳动物中的急性呼吸窘迫综合征。
42.在特定实施方式中,本发明涉及组合物,所述组合物用于在治疗遭受病毒感染的哺乳动物中的呼吸功能受损中的至少一种或多种中使用,所述呼吸功能受损选自缺氧和消除co2能力的降低。
43.在特定实施方式中,治疗呼吸功能受损包括治疗呼吸肌功能。
44.在一个实施方式中,本发明涉及组合物,所述组合物用于在哺乳动物中治疗与选自以下项的参数中的至少一个的变化相关的呼吸功能受损中使用:-死亡率和治愈,所述治愈的特征在于将患者转移到其家中或普通医疗护理服务机构,-由以下定义的呼吸功能不全类型事件的数量:动脉血氧饱和度不足、需要机械通气(包括未进行插管的患者)和需要无创呼吸支持(例如呼吸道持续正压通气或高速氧气),-序贯呼吸衰竭评价评分(sofa)、肺严重程度指数(psi)以及医学影像,这使得能够对渗出性炎性病理学的进展水平进行分级,-促炎性细胞因子和抗炎性细胞因子的血浆水平。
45.在特定实施方式中,在人类中以1至15毫克/千克/天的剂量施用植物性蜕皮素。这里的植物性蜕皮素还意指普通植物性蜕皮素及其衍生物、20-羟基蜕皮素(特别是呈提取物形式)及其衍生物。
46.优选地,在成年人中一次或多次以200至1000mg/天的剂量施用植物性蜕皮素,并且在婴儿或幼儿中一次或多次以5至350mg/天的剂量施用植物性蜕皮素。这里的植物性蜕皮素意指普通植物性蜕皮素及其衍生物、20-羟基蜕皮素(特别是呈提取物形式)及其衍生物。
47.在实施方式中,组合物包括至少一种被视为植物性蜕皮素衍生物的化合物,所述至少一种化合物具有通式(i):[化学式1]
其中:v-u是单碳碳键并且y是羟基基团或氢,或v-u是c=c乙烯键;x是氧,q是羰基基团;r1选自:(c
1-c6)w(c
1-c6)基团;(c
1-c6)w(c
1-c6)w(c
1-c6)基团;(c
1-c6)w(c
1-c6)co2(c
1-c6)基团;(c
1-c6)a基团,a表示任选地被oh、ome、(c
1-c6)、n(c
1-c6)或co2(c
1-c6)型的基团取代的杂环;ch2br基团;w是选自n、o和s的杂原子,优选地是o,并且甚至更优先地是s。
[0048]
在本发明的上下文中,“(c
1-c6)”意指具有1至6个碳原子的直链或支链的任何烷基基团,特别是甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基和正己基基团。有利地是甲基、乙基、异丙基或叔丁基基团,特别是甲基或乙基基团,更特别是甲基基团。
[0049]
在优选实施方式中,在式(i)中:y是羟基基团;r1选自:(c
1-c6)w(c
1-c6)基团;(c
1-c6)w(c
1-c6)w(c
1-c6)基团;(c
1-c6)w(c
1-c6)co2(c
1-c6)基团;(c
1-c6)a基团,a表示任选地被oh、ome、(c
1-c6)、n(c
1-c6)或co2(c
1-c6)型的基团取代的杂环;w是选自n、o和s的杂原子,优选地是o,并且更优选地是s。
[0050]
在实施方式中,组合物包括选自以下化合物的至少一种化合物:编号1:(2s,3r,5r,10r,13r,14s,17s)-2,3,14-三羟基-10,13-二甲基-17-(2-吗啉代乙酰基)-2,3,4,5,9,11,12,15,16,17-十氢-1h-环戊[a]菲-6-酮,编号2:(2s,3r,5r,10r,13r,14s,17s)-2,3,14-三羟基-17-[2-(3-羟基吡咯烷-1-基)乙酰基]-10,13-二甲基-2,3,4,5,9,11,12,15,16,17-十氢-1h-环戊[a]菲-6-酮;编号3:(2s,3r,5r,10r,13r,14s,17s)-2,3,14-三羟基-17-[2-(4-羟基-1-哌啶基)乙酰基]-10,13-二甲基-2,3,4,5,9,11,12,15,16,17-十氢-1h-环戊[a]菲-6-酮;编号4:(2s,3r,5r,10r,13r,14s,17s)-2,3,14-三羟基-17-[2-[4-(2-羟乙基)-1-哌啶基]乙酰基]-10,13-二甲基-2,3,4,5,9,11,12,15,16,17-十氢-1h-环戊[a]菲-6-酮;编号5:(2s,3r,5r,10r,13r,14s,17s)-17-[2-(3-二甲基氨基丙基(甲基)氨基)乙酰基]-2,3,14-三羟基-10,13-二甲基-2,3,4,5,9,11,12,15,16,17-十氢-1h-环戊[a]菲-6-酮;编号6:2-[2-氧代-2-[(2s,3r,5r,10r,13r,14s,17s)-2,3,14-三羟基-10,13-二
甲基-6-氧代-2,3,4,5,9,11,12,15,16,17-十氢-1h-环戊[a]菲-17-基]乙基]硫烷基乙酸乙酯;编号7:(2s,3r,5r,10r,13r,14s,17s)-17-(2-乙基硫烷基乙酰基)-2,3,14-三羟基-10,13-二甲基-2,3,4,5,9,11,12,15,16,17-十氢-1h-环戊[a]菲-6-酮;编号8:(2s,3r,5r,10r,13r,14s,17s)-2,3,14-三羟基-17-[2-(2-羟乙基硫烷基)乙酰基]-10,13-二甲基-2,3,4,5,9,11,12,15,16,17-十氢-1h环戊[a]菲-6-酮。
[0051]
在实施方式中,组合物包括至少一种被视为植物性蜕皮素衍生物的化合物,所述至少一种化合物具有式(ii):[化学式2]
[0052]
具有式(ii)的化合物在下文中称为bio103。
[0053]
在实施方式中,将组合物掺入可以口服施用的药学上可接受的配制品中。
[0054]
在本发明的上下文中,“药学上可接受的”意指可用于制备通常安全无毒并且对于兽医用途和人类药剂学均可接受的药物组合物。
附图说明
[0055]
通过阅读以下通过绝非限制性的实施例给出的并且参考附图做出的描述,将更好地理解本发明,所述附图示出:
[0056]
图1示出了说明在遭受冠状病毒的患者的背景下激活ace2/ang1-7/mas臂的科学原理的图表,所述冠状病毒使用ace2作为受体。
[0057]
图2a示出了说明bio101在自发性高血压动物中不存在抗高血压作用的图。单次口服施用后评价了单独的bio101的效果。在交叉治疗中使用了六只sh大鼠,其中治疗之间的消除期为最少72小时。治疗前,这些动物配备了遥测仪器,用于测量动脉压。对于图2a中描述的实验,动物接受了以下治疗:媒介物、5mg/kg的bio101、或50mg/kg的bio101、或50mg/kg的依那普利。
[0058]
图2b示出了说明bio101在已经用抗高血压药:依那普利治疗的高血压动物中不存在降血压作用的图。依那普利是转换酶(ace)的抑制剂。在使用依那普利(30mg/kg*天)治疗4天的动物中重复施用后,评价单独的bio101的效果。在交叉治疗中使用了六只sh大鼠,其中治疗之间的消除期为最少72小时。治疗前,这些动物配备了遥测仪器,用于测量动脉压。对于图2b中描述的实验,动物接受了以下治疗:30mg/kg的依那普利,持续4天;或30mg/kg的依那普利 5mg/kg的bio101,持续4天;或30mg/kg的依那普利 50mg/kg的bio101,持续4天。
[0059]
图3a示出了说明单次口服施用后评价的bio101对平均动脉压的影响的图。在交叉治疗中使用了四只比格犬,其中治疗之间的消除期为最少72小时。治疗前,这些动物配备了遥测仪器,用于测量动脉压。对于图3a中描述的实验,动物接受了以下口服治疗:媒介物、30mg/kg的bio101、或120mg/kg的bio101、或500mg/kg的bio101。
[0060]
图3b示出了说明单次口服施用后评价的bio101对心脏频率的影响的图。在交叉治疗中使用了四只比格犬,其中治疗之间的消除期为最少72小时。治疗前,这些动物配备了遥测仪器,用于测量心脏频率。对于图3b中描述的实验,动物接受了以下口服治疗:媒介物、30mg/kg的bio101、或120mg/kg的bio101、或500mg/kg的bio101。
[0061]
图4a示出了说明口服施用单次剂量后bio101对吸气峰流速(pifr)不存在影响的图。在交叉治疗中使用了八只大鼠,其中治疗之间的消除期为最少72小时。对于此实验,动物接受了以下口服治疗:媒介物、100mg/kg的bio101、或300mg/kg的bio101、或1000mg/kg的bio101。通过4小时30分钟的体积描记术测量呼吸参数。
[0062]
图4b示出了说明口服施用单次剂量后bio101对呼吸峰流速(pefr)不存在影响的图。在交叉治疗中使用了八只大鼠,其中治疗之间的消除期为最少72小时。对于此实验,动物接受了以下口服治疗:媒介物、100mg/kg的bio101、或300mg/kg的bio101、或1000mg/kg的bio101。通过4小时30分钟的体积描记术测量呼吸参数。
[0063]
图4c示出了说明口服施用单次剂量后bio101对呼吸频率不存在影响的图。在交叉治疗中使用了八只大鼠,其中治疗之间的消除期为最少72小时。对于此实验,动物接受了以下口服治疗:媒介物、100mg/kg的bio101、或300mg/kg的bio101、或1000mg/kg的bio101。通过4小时30分钟的体积描记术测量呼吸参数。
[0064]
图4d示出了说明口服施用单次剂量后bio101对penh不存在影响的图。penh表示支气管反应性。将其计算如下:(pifr/pefr)x间歇(pause),其中间歇=(te-tr)/tr。tr=弛豫时间(呼出正常体积的65%所需的时间),并且te=呼气时间(从呼气开始到接下来的吸气开始的时间)。在交叉治疗中使用了八只大鼠,其中治疗之间的消除期为最少72小时。对于此实验,动物接受了以下口服治疗:媒介物、100mg/kg的bio101、或300mg/kg的bio101、或1000mg/kg的bio101。通过4小时30分钟的体积描记术测量呼吸参数。
[0065]
图5示出了bio101在叙利亚仓鼠血浆中的药物代谢动力学曲线。这些图示出了在单次口服施用(po)配制在于水中的甲基纤维素4000cp 0.5%培养基中的50mg/kg的bio101后(图5a)或在单次经腹腔内(ip)施用配制在0.9%nacl中的10mg/kg的bio101后(图5b),血浆浓度作为时间的函数。
[0066]
图6示出了治疗感染sars-cov-2病毒的叙利亚仓鼠中的呼吸功能受损的研究的时序图,以及各种参数。研究呈现了3组动物:未感染sars-cov-2的对照仓鼠(n=10)、用sars-cov-2感染并且用媒介物治疗的仓鼠(n=10)、以及用sars-cov-2感染并且用bio101 ip治疗的仓鼠(10mg/kg*天;n=10)。接种前和病毒感染后5天,通过全身体积描记术评价呼吸功能。研究结束时(病毒接种后7天),对感染性肺部病毒载量进行量化。
[0067]
图7示出了直方图,其说明了未感染sars-cov-2(对照)、用sars-cov-2感染并且用媒介物治疗(sars-cov-2 媒介物)、或用sars-cov-2感染并且用bio101 ip治疗(sars-cov-2 bio101)的各组对照动物的肺部病毒载量的量化。
[0068]
图8a是呼吸周期(吸气,然后呼气)记录轨迹和可以通过全身体积描记术记录的各
种数据的示意图。penh是没有单位的测量值,通过测量呼吸响应曲线的几个参数根据下式计算得出:(pifr/pefr)x间歇,其中间歇=(te-tr)/tr(adler等人,2004)。pifr:吸气峰流速,pefr:呼气峰流速,tep:远呼气间歇(tele-expiratory pause),te:呼气时间,ti:吸气时间,tr:呼出总空气体积的65%所需的呼气时间。图8b示出了未感染sars-cov-2(对照)、用sars-cov-2感染并且用媒介物治疗(sars-cov-2 媒介物)、以及用sars-cov-2感染并且用bio101 ip治疗(sars-cov-2 bio101)的对照组的penh值,其中
*
p《0.05并且
**
p《0.01。
[0069]
图9示出了通过未感染sars-cov-2(对照)、用sars-cov-2感染并且用媒介物治疗(sars-cov-2 媒介物)、或用sars-cov-2感染并且用bio101 ip治疗(sars-cov-2 bio101)的各组对照动物的全身体积描记术测量的各种呼吸参数。测量的参数是:以毫秒计的吸气时间(图9a),以毫秒计的呼气时间(图9b),以毫秒计的远呼气间歇(图9c),其中
*
p《0.05并且
**
p《0.01。
具体实施方式
[0070]
1.临床测试
[0071]
诸位发明人测试了植物性蜕皮素、且更特别是bio101对遭受导致covid-19大流行病的sars-cov-2冠状病毒的患者的呼吸功能和呼吸参数的影响。
[0072]
研究涉及年龄18岁及以上的成年人,所述成年人在过去28天期间遭受由pcr确认的sars-cov-2感染,并且在过去7天期间已经发展出定义为以下的严重表现:借助以下参数之一的呼吸代偿障碍的迹象:呼吸频率大于或等于25个呼吸周期(吸气和呼气)/分钟和/或在环境空气中氧气小于或等于92%、或3升氧气/分钟的动脉饱和度。
[0073]
每日口服施用bio101。
[0074]
bio101是一种植物提取物,选自含有按所述植物的干重计至少0.5%的20-羟基蜕皮素的植物,所述提取物包括至少97%的20-羟基蜕皮素。
[0075]
基于以下测量值,在第7、14和28天评价bio101对受sars-cov-2冠状病毒影响的患者的治疗作用:-死亡率和治愈,所述治愈的特征在于将患者转移到其家中或普通医疗护理服务机构,-由以下定义的呼吸功能不全类型事件的数量:动脉血氧饱和度不足、需要机械通气(包括未进行插管的患者)和需要无创呼吸支持(例如呼吸道持续正压通气或高速氧气),-还通过呼吸衰竭序贯评价评分(sofa,zhou等人,2020)、肺严重程度指数(psi,liu等人,2020)和医学影像这些参数评价了治疗作用,这些参数使得能够对渗出性炎性病理学的进展水平进行分级。-还评价了bio101对促炎性细胞因子和抗炎性细胞因子的血浆水平的影响。
[0076]
2.与对心血管和呼吸参数的影响相关的临床前评价
[0077]
诸位发明人在高血压动物中在按5mg/kg和50mg/kg的剂量口服施用后,通过遥测技术测试了植物性蜕皮素、且更特别是bio101对平均动脉压的影响。研究涉及高血压型sh(自发性高血压)大鼠。
[0078]
在所采用的实验条件下,5mg/kg和50mg/kg剂量的bio101不会引起高血压动物的平均动脉压的任何降低,并且无论使用何种剂量都是如此(图2a)。因此,bio101没有抗高血
压作用。另一方面,ace抑制剂依那普利具有抗高血压活性。
[0079]
当通过使用依那普利(30mg/kg,持续4天)对动物的平均动脉压进行归一化时,5mg/kg和50mg/kg剂量的bio101治疗不会引起动物的平均动脉压的任何额外降低,并且无论使用何种剂量都是如此(图2b)。这表明bio101没有任何降血压作用。
[0080]
诸位发明人在血压正常的动物中在按30mg/kg、120mg/kg和500mg/kg的剂量口服施用后,通过遥测技术测试了植物性蜕皮素、且更特别是bio101对平均动脉压和心律的影响。研究涉及比格犬。在此研究的实验条件下,单次口服施用30mg/kg、120mg/kg和500mg/kg的bio101对清醒雄性比格犬的动脉压(图3a)和心脏频率(图3b)没有影响。
[0081]
诸位发明人在机警大鼠(vigil rat)中在按100mg/kg、300mg/kg和1000mg/kg的剂量口服施用后,通过体积描记术测试了植物性蜕皮素、且更特别是bio101对呼吸参数的影响。在此研究的实验条件下,单次口服施用100mg/kg、300mg/kg或1000mg/kg的bio101对吸气峰流速(pifr,图4a)、呼气峰流速(pefr,图4b)、呼吸频率(图4c)、以及最后对penh(图4d)没有影响。
[0082]
3.在叙利亚仓鼠上实施的测试
[0083]
叙利亚仓鼠(黄金仓鼠(mesocricetus auratus))是小型哺乳动物,其已经被用作由呼吸道病毒(例如sars-cov、流行性感冒病毒或腺病毒)感染的模型(miao等人,2019;roberts等人,2005;iwatsuki-horimoto,k.等人,2018;wold等人,2012)。最近已表明,在用sars-cov-2进行实验性鼻内感染期间,叙利亚仓鼠患有中度疾患,体重逐渐减轻,而且有呼吸窘迫的迹象(chan等人,2020;boudewijns等人,2020)。在仓鼠中,sars-cov-2感染与病毒的高水平复制和疾患的组织病理学证据有关。体层密度测量法示出了受感染仓鼠的呼吸道扩张和肺部基本实变,从而也揭示了肺部疾患(boudewijns等人,2020)。
[0084]
covid-19在人类中的临床表现与感染sars-cov-2的叙利亚仓鼠中发展的肺部病理学具有共同特征,例如下呼吸道中的病毒复制、呼吸困难、双侧肺部感染(affection)以及集中性水肿(focused edemata)和炎症的存在(-fontela等人,2020)。因此,人们接受了叙利亚仓鼠构成目的为研究sars-cov-2病毒感染和传播的一个感兴趣的模型,并且其使得能够测试各种治疗方案。
[0085]
各种实验方法使得能够监测小型动物中呼吸能力受损的变化。在全身体积描记术的情况下,特别如此。这项技术的优点在于以下事实,即其使得能够对机警动物进行监测,不受动物在密闭围场内运动的影响,并且这是无创的。因此,由于处理动物而产生的压力减少,并且能够在长时期内重复测量。因此,气压体积描记术被非常多地用于测量小型动物中的呼吸功能和支气管反应性(chong等人,1998;djuric等人,1998;hoffman等人,1999)。
[0086]
a.健康仓鼠中bio101的口服和腹腔内药物代谢动力学研究
[0087]
先前在健康仓鼠(无病毒感染)中进行了bio101的药物代谢动力学研究,以确定哪种施用方法使得能够获得仓鼠的血浆暴露量,所述血浆暴露量与在1期临床研究中在14天期间口服摄入350mg bid的bio101后在人类中发现的血浆暴露量相似。
[0088]
使用6-7周龄的雌性叙利亚仓鼠进行bio101的药物代谢动力学研究。以50mg/kg体重的剂量经口(po,灌胃)、或以10mg/kg体重的剂量经腹腔内(ip)施用bio101分子。施用bio101后,在以下时间在尾部处采集血样:t=0.08h;0.25h;0.5h;1h;2h;4h;6h;8h;10h;12h和24h。
[0089]
对血样进行离心并且采集血浆。
[0090]
使用9个标准品(从10,000ng/ml至10ng/ml)和三个质控品(从4000ng/ml至40ng/ml)得出校准曲线。在仓鼠血浆中稀释标准品。将每个样品(标准溶液或质控品)的一部分转移到96孔板(200μl)中。接下来,添加4μl内标品(meoh中的10μg/ml的川膝蜕皮酮)。通过添加4体积的meoh(80μl)来脱蛋白,制备样品。离心后,将样品的上清液转移到96孔板(150μl)中,然后注射。
[0091]
lc-ms/ms分析是使用1260无限hplc系统和具有正模式的esi源的qqq6420质谱仪(mrm)进行的。注射体积是5μl。在c18反相柱(2.1*50mm,3.5μm颗粒;fortis公司)上用乙腈和水梯度(含有0.1%甲酸)且以0.3ml/min的流速洗脱bio101。
[0092]
血浆样品的分析(根据上述方法)使得能够确定药物代谢动力学参数,即cmax(其对应于施用分子后观察到的最大浓度)、tmax(其为施用分子后达到最大浓度所需的时间)、以及auc(对应于血浆暴露量的曲线下面积)。
[0093]
po施用50mg/kg后,cmax=58ng/ml,tmax=0.25h,并且血浆暴露量是243ng.h/ml(图5a)。
[0094]
ip施用10mg/kg后,cmax=3221ng/ml,tmax=0.5h,并且血浆暴露量是3393ng.h/ml(图5b)。
[0095]
ip施用bio101提供的血浆暴露量与以350mg bid口服施用bio101持续14天后在人类中发现的血浆暴露量(3841ng.h/ml)非常相似。
[0096]
因此,为了测试bio101在仓鼠中的功效,在用sars-cov-2病毒感染后,选择ip施用bio101。
[0097]
b.用sars-cov-2感染仓鼠和bio101的施用
[0098]
制备了sars-cov-2的betacov/belgium/sart-tilman/2020/1株(misset等人,2020)的储备接种物,滴度为106tcid
50
/ml。在每个仓鼠中接种由100微升此储备物组成的接种物,即在每个鼻孔中接种50微升。接种是在使用异氟醚的短暂全身麻醉下进行的。这些动物在最多90秒后从麻醉中醒来。
[0099]
每日经腹腔内(ip)施用配制在0.9%nacl培养基中的10mg/kg的bio101,持续7天。
[0100]
比较三组6-7周龄雌性仓鼠动物:未感染并且用媒介物治疗的仓鼠、用sars-cov-2感染并且用媒介物治疗的仓鼠、以及用sars-cov-2感染并且用bio101经腹腔内治疗的仓鼠(图6)。每组10只动物。
[0101]
c.用sars-cov-2感染后的肺部病毒载量的分析
[0102]
研究结束时,在接种sars-cov-2病毒后7天,比较各组动物的肺部病毒载量(图7)。
[0103]
将vero e6细胞接种(在dmem/fbs 10%培养基中,7.5x 103个细胞/100μl),然后放置一整夜进行孵育。第二天,在光学显微镜下察看细胞时,确认细胞分布均匀并且已经达到大约75%的汇合度。在3级生物安全环境中,在感染培养基(dmem/fbs 2%)中制备肺匀浆的系列稀释液(1:10)。从细胞中去除生长培养基后,将各种肺匀浆制剂转移到先前制备的veroe6细胞垫。将细胞在37℃下孵育2小时,然后向每个孔中添加100μl感染培养基。将板在37℃下孵育5天以监测各种肺匀浆的致细胞病变效应。根据标准reed和muench方法计算病毒滴度。例如,在vero e6细胞系中在5天内表示为103tcid50/ml的滴度可以翻译为:在使用vero e6细胞系期间在5天内,以1:1000稀释的1ml肺匀浆将感染50%的细胞。
[0104]
接种sars-cov-2后七天,受感染仓鼠的肺中仍然可以检测到肺部病毒载量。用sars-cov-2感染、用媒介物治疗的动物的肺部病毒载量与用sars-cov-2感染、用bio101治疗的动物中观察到的肺部病毒载量没有差异(分别为4.85
±
0.018相比于4.83
±
0.011;p=ns)。
[0105]
正如预期的那样,在每日治疗持续7天后,bio101对受感染动物的肺部病毒载量没有影响。
[0106]
d.通过全身体积描记术分析仓鼠中的呼吸功能
[0107]
在方案开始时,在任何病毒感染之前,对研究中的所有动物进行全身体积描记术分析,从而确保每一组的呼吸特性确实是相同的(未呈现结果)。在感染sars-cov-2的动物的活重的最低点(chan等人,2020),即接种病毒后5天,对三个不同的组进行呼吸功能分析:未感染并且用媒介物治疗的仓鼠、用sars-cov-2感染并且用媒介物治疗的仓鼠、以及用sars-cov-2感染并且用bio101经腹腔内治疗的仓鼠。
[0108]
在体积描记术分析期间,相对于参考室测量的压力变化使得能够定义许多呼吸参数,例如峰值及吸气和呼气压力时间、呼吸频率、以及使得能够评价支气管反应性的称为penh(增强的间歇)的无单位的量(menachery等人,2015)(图8a)。
[0109]
penh值是一个待定义的重要指标,因为其中的变化与呼吸阻力的变化平行,因此它代表了预测呼吸系统的阻力特性变化的参数(hamelmann等人,1997;bergren,2001;onclinx等人,2003)。
[0110]
此外,在感染性病毒病理学、特别是冠状病毒期间,下呼吸道受损引起通过体积描记术测量的呼吸参数的变化,例如,penh和呼气时间的增加(menachery等人,2015;dinnon等人,2020)。
[0111]
如先前在文献(menachery等人,2015;dinnon等人,2020)中所述,与未感染的对照组相比,感染sars-cov-2的、用媒介物治疗的仓鼠组的penh值显著增加(分别为0.63
±
0.11相比于0.28
±
0.01;p《0.01)。当受感染动物接受bio101治疗持续5天时,发现与用媒介物治疗的受感染动物相比,penh值(0.35
±
0.02)显著降低(p《0.05)(图8b)。
[0112]
与未感染的对照仓鼠组相比,用媒介物治疗的受感染仓鼠组的吸气时间和呼气时间倾向于增加(图8a、9a和9b)。这是因为吸气时间从75.9
±
2.9msec增加至88.4
±
6.87msec,并且呼气时间从133.2
±
7.4msec增加至150.7
±
5.2msec(p=0.06)。与用媒介物治疗的受感染组(88.4
±
6.87msec)相比,在感染sars-cov-2并且已经接受bio101治疗持续5天的仓鼠组中,观察到显著降低的吸气时间(66.4
±
2.6msec;p《0.01)。以相同方式观察到与用媒介物治疗的受感染组(150.7
±
5.2msec)相比显著降低的呼气时间(134.9
±
3.2msec;p《0.05)。
[0113]
评价了呼吸周期的另一个参数。这是远呼气间歇(tep)(图8a和9c)。tep对应于呼气结束时的呼气流速平台。在严重的呼吸病理学期间,细支气管至少部分阻塞,并且因此对气流的阻力增加,从而减缓了排空并且延长了tep(menachery等人,2015)。因此,tep的长度提供了正常体积结束时呼气困难程度的量度,并且这种困难程度与下呼吸道的阻塞(由管腔障碍物导致,或仅仅因为壁部炎性水肿使横截面变窄)程度成正比。
[0114]
正如预期的那样,与对照组中未感染的仓鼠相比,用sars-cov-2感染的仓鼠的呼气间歇时间显著增加(分别为18.8
±
1.6msec相比于12.4
±
0.5msec;p《0.01)。值得注意的
2015;10(9):e0138732.klimas j,olvedy m,ochodnicka-mackovicova k,kruzliak p et al.perinatally administered losartan augments renal ace2 expression but not cardiac or renal mas receptor in spontaneously hypertensive rats.j cell mol med 2015;19(8):1965-2015.kostis jb,kim hj,rusnak j,casale t,kaplan a,corren j,et al.incidence and characteristics of angioedema associated with enalapril.arch intern med.2005 jul;165(14):1637-42kuba k,imai y,rao s,et al.a crucial role of angiotensin converting enzyme 2(ace2)in sars coronavirus-induced lung injury.nature medicine 2005;11(8):875-879.lafont r,dilda p,dioh w,dupont p,del signore s,veillet s.pharmaceutical grade 20-hydroxyecdysone extract,use of the same and preparation thereof.pct application 2018;wo 2018197731.lafont r,dioh w,raynal s,veillet s,lepifre f,durand jd.chemical compounds and use thereof for improving muscle quality.pct application 2015;wo 2015177469.lipworth bj,dagg kd.vasoconstrictor effects of angiotensin ii on the pulmonary vascular bed.chest 1994;105(5):1360-1364.liu k,chen y,lin r,han k.clinical features of covid-19 in elderly patients:a comparison with young and elderly patients.j infection 2020;https://doi.org/10.1016/j.jinf.2020.03.005.magalhaes gs,barroso lc,reis ac,rodrigues-machado mg et al.angiotensin-(1-7)promotes resolution of eosinophilic inflammation in an experimental model of asthma.frontiers in immunology 2018;9:58.mckaya,al-haddad m.acute lung injury and acute respiratory distress syndrome.anaesthesia,critical care&pain 2009,volume 9 number 5,152-156menachery vd,gralinski le,baric rs,ferris mt.new metrics for evaluating viral respiratory pathogenesis.plos one 10(6):e0131451(2015)meng y,yu ch,li w,li t et al.angiotensin-converting enzyme 2/angiotensin-(1-7)/mas axis protects against lung fibrosis by inhibiting the mapk/nf-κbpathway.am j respir cell mol biol.2014;50(4):723-736.meng y,li t,zhou gs,chen y,yu ch et al.the angiotensin-converting enzyme 2/angiotensin(1-7)/mas axis protects against lung fibroblast migration and lung fibrosis by inhibiting the nox4-derived ros-mediated rhoa/rho kinase pathway.antioxid redoxsignal.2015;22(3):241-258.miao,j.,chard,l.s.,wang,z.&wang,y.syrian hamster as an animal model for the study on infectious diseases.front.immunol.10,2329(2019).-fontela,c.,dowling,w.e.,funnell,s.g.p.et al.animal models for covid
mice.modern preventive medicine 2016;5.xu h,zhong l,deng j et al.high expression of ace2 receptor of 2019-ncov on the epithelial cells of oral mucosa.international journal of oral science 2020;12:8.ye r,liu z.ace2 exhibits protective effect against lps-induced acute lung injury in mice by inhibiting thr lps-tlr4 pathway.experimental and molecular pathology 2020;113:104350.zhang h,baker a.recombinant human ace2:acing out angiotensin ii in ards therapy.critical care 2017;21(1):305.zhang f,tang h,sun s,luo y et al.angiotensin-(1-7)induced vascular relaxation in spontaneously hypertensive rats.nitric oxide 2019;88:1-9.zhang y,li y,shi c,fu x et al.angiotensin-(1-7)-mediated mas1 receptor/nf-kb-p65)signaling is involved in a cigarette smoke-induced chronic obstructive pulmonary disease mouse model.environmental toxicology 2018;33:5-15.
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。