用于治疗神经系统疾病的组合物和方法
相关申请的交叉引用
1.本技术要求于2020年4月15日提交的美国临时申请号63/010,179的优先权,其内容通过引用整体并入本文以用于所有目的。政府支持
2.本发明是在美国国立卫生研究院授予的资助号ns087175下在政府支持下完成的。美国政府对本发明享有一定的权利。通过引用并入序列表
3.本技术包含序列表,该序列表已通过efs-web以ascii格式提交,并在此通过引用整体并入。所述ascii副本创建于2021年4月14日,命名为“tays-010_seqlist.txt”,大小为约28.2kb。
背景技术:
4.基于腺相关病毒(aav)的基因疗法在治疗多种不同疾病中变得越来越普遍,包括治疗神经系统疾病及其相关的自主神经功能障碍。然而,最近的研究表明,针对某些aav血清型的中和抗体在人群中非常普遍。事实上,一些研究表明,针对aav1、aav2、aav5、aav6、aav8和aav9的中和抗体的流行率可能分别高达70%、70%、40%、46%、38%和47%。在中和抗体阳性的个体中,基于aav的基因疗法可能是不可行的。最后,中和抗体的存在对于如下受试者来说尤其成问题,所述受试者是先前已经接受过第一次基于aav的基因疗法并且需要:a)额外剂量的第一次基于aav的基因疗法、或b)不同的基于aav的基因疗法的受试者。因此,本领域需要用于施用基于aav的基因疗法的组合物和方法,其能够克服与受试者中存在中和抗体相关的问题。此外,本领域需要针对将基因治疗载体递送至受试者(包括对基因治疗载体如aav呈血清阳性的受试者)的自主神经系统的组合物和方法。
5.巨轴索神经病是一种罕见的破坏性神经系统疾病,始于3至4岁的儿童早期,通常表现为感觉共济失调。在外周神经系统(pns)中,该疾病逐渐影响感觉和运动神经。病理学在整个自主神经系统(ans)中也很明显,患者经常出现构音障碍、吞咽困难、胃肠动力问题和呼吸困难等形式的肠道和自主神经功能障碍。到生命的第二个十年结束时,患者通常会变得依赖轮椅,手臂使用有限,腿部几乎没有使用。此外,在生命的第二个十年期间,通常需要进行气管切开术(或其他通气方式)以及饲管。巨轴索神经病还影响中枢神经系统,因为巨轴索神经病患者的mri结果通常显示大脑和小脑的白质异常,并最终在疾病的后期出现严重的脑干和脊髓萎缩。死亡通常发生在生命的第三个十年。巨轴索神经病是一种常染色体隐性遗传疾病,由位于16号染色体16q24.1的gan基因异常引起,所述基因编码巨轴突蛋白(gigaxonin,gan)。异常的gan蛋白导致称为轴突的一部分神经细胞膨胀,伴随被称为神经丝的微小蛋白质线沉积,从而引起巨大轴突的出现。巨大轴突导致外周神经系统的退化和功能异常。目前没有治疗巨轴索神经病的方法。因此,本领域需要针对治疗巨轴索神经病的组合物和方法。
技术实现要素:
6.本公开内容总体上涉及基因治疗领域,包括但不限于基于重组腺相关病毒(raav)的基因疗法。更具体地,本公开内容总体上涉及将raav病毒载体施用于先前已被施用基于raav的基因疗法和/或对于针对一种或多种aav血清型的中和抗体呈血清阳性的受试者。本公开内容提供了用于通过注射到受试者的至少一根迷走神经中将至少一种raav病毒载体施用于受试者的组合物和方法。本公开内容还提供了包含编码巨轴突蛋白(gan)多肽的转基因序列的raav病毒载体、它们的制造和它们在递送转基因以治疗或预防疾病或病症中的用途,所述疾病或病症包括与gan基因的缺失、功能失常和/或缺陷相关的疾病。
7.本公开内容提供了一种治疗受试者的疾病和/或病症的方法,包括通过将至少一种治疗有效量的重组腺相关病毒(raav)病毒载体注射到受试者的迷走神经中向受试者施用所述至少一种治疗有效量的raav病毒载体。
8.在一些方面,迷走神经可以是受试者的左迷走神经。
9.在一些方面,疾病和/或病症可以是神经系统疾病和/或病症。
10.在一些方面,神经系统疾病和/或病症的特征在于至少一种自主神经功能障碍,并且其中通过注射到迷走神经中施用至少一种治疗有效量的raav病毒载体减轻了所述至少一种自主神经功能障碍的至少一种症状。在一些方面,所述至少一种症状可以选自构音障碍、吞咽困难、胃肠道运动控制不足、血压控制不足、呼吸困难、直立性低血压、出汗异常、泌尿道控制不足、性功能障碍及其任何组合。
11.在一些方面,疾病和/或病症可以选自脊髓性肌萎缩、friedrich共济失调、cln3 batten、cln6 batten、cln7 batten、癫痫性脑病、leigh综合征、进行性神经性腓骨肌萎缩症、巨轴索神经病、lafora病、slc13a5癫痫性脑病、先天性糖基化障碍iq型、kahrizi综合征、angelman综合征、rett综合征、痉挛性截瘫、儿童交替性偏瘫和zellweger谱系障碍。在一些方面,疾病和/或病症可以是巨轴索神经病。
12.在一些方面,raav病毒载体可以包含:(i)aav衣壳蛋白;和(ii)raav载体,其中raav载体在5’至3’方向上包含:a)第一aav itr序列;b)启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码巨轴突蛋白(gan)多肽的核酸序列;d)多腺苷酸序列;e)第二aav itr序列。
13.在一些方面,gan多肽可以包含seq id no:1所示的氨基酸序列。
14.在一些方面,编码gan多肽的核酸序列可以是编码gan多肽的经密码子优化的核酸序列,其中所述编码gan多肽的经密码子优化的核酸序列包含seq id no:3所示的核酸序列。
15.在一些方面,启动子序列可以包含seq id no:8所示的核酸序列。
16.在一些方面,多腺苷酸序列可以包含seq id no:9所示的核酸序列。
17.在一些方面,raav载体可以在5’至3’方向上包含:a)第一aav itr序列;b)包含seq id no:8所示核酸序列的启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码gan多肽的核酸序列,其中所述编码gan多肽的核酸序列包含seq id no:3所示的核酸序列;d)包含seq id no:9所示核酸序列的多腺苷酸序列;和e)第二aav itr序列。
18.在一些方面,raav载体可以包含seq id no:10所示的核酸序列。
19.在一些方面,aav衣壳蛋白可以是aav9衣壳蛋白。
20.在一些方面,raav病毒载体可以以约3.5x10
13
至约3.5x10
14
个病毒粒子的量施用。
21.在一些方面,受试者可以先前已被施用至少一种治疗有效量的初始raav病毒载体。在一些方面,初始raav病毒载体可以已通过如下途径施用给受试者:静脉内、鞘内、脑内、心室内、鼻内、气管内、耳内、眼内或眼周、经口、经直肠、经粘膜、吸入、经皮、肠胃外、皮下、皮内、肌肉内、脑池内、神经内、胸膜内、局部、淋巴管内、脑池内或神经内。在一些方面,初始raav病毒载体可以已经通过鞘内施用给受试者。
22.在一些方面,初始raav病毒载体可以是通过注射到受试者的迷走神经中所施用的相同的raav病毒载体。
23.在一些方面,受试者可以具有针对raav病毒载体的中和抗体。
24.本公开内容提供了一种治疗受试者的巨轴索神经病的方法,包括:a)向受试者鞘内施用第一治疗有效量的raav病毒载体和b)通过将至少第二治疗有效量的raav病毒载体注射到受试者的左迷走神经中施用所述至少第二治疗有效量的raav病毒载体,其中raav病毒载体包含:(i)aav9衣壳蛋白;和(ii)raav载体,其中所述raav载体包含seq id no:10所示的核酸序列。在一些方面,第一治疗有效量的raav病毒载体和所述至少第二治疗有效量的raav病毒载体可以依次施用。在一些方面,第一治疗有效量的raav病毒载体和至少第二治疗有效量的raav病毒载体可以同时施用。
25.本文描述的任何上述方面或任何其他方面可以与任何其他方面相组合。
26.除非另有定义,否则本文使用的所有技术和科学术语具有与本公开内容所属领域的普通技术人员通常理解的相同含义。在说明书中,单数形式也包括复数形式,除非上下文另有明确规定;作为示例,术语“一个”、“一种”和“该”被理解为单数或复数,并且术语“或”被理解为包含性的。例如,“一个要素”是指一个或多个要素。在整个说明书中,词语“包括”或变体诸如“包含”或“含有”将被理解为隐含了包含所述的要素、整数或步骤,或要素组、整数组或步骤组,但不排除任何其他要素、整数或步骤,或要素组、整数组或步骤组。“约”可以理解为在规定值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%以内。除非上下文另有明确说明,否则本文提供的所有数值均由术语“约”修饰。
27.尽管与本文所述的方法和材料相似或等效的方法和材料可用于本公开内容的实践或测试,但下文描述了合适的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考文献通过引用整体并入。本文引用的参考文献不被承认为所要求保护的发明的现有技术。在发生冲突的情况下,以本说明书(包括定义)为准。此外,所述材料、方法和实施例仅是说明性的而不是限制性的。本公开内容的其他特征和优点将从以下发明详述和权利要求中显而易见。附图简述
28.将通过结合附图的以下发明详述更清楚地理解上述和进一步的特征。
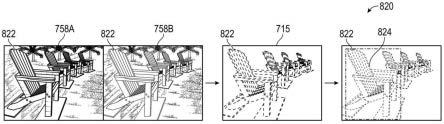
29.图1是在注射到大鼠左迷走神经后使用gfp报告蛋白显示aav9/载体转基因表达的图像。箭头表示迷走神经;*表示迷走神经背侧运动核;星号表示模糊核(nucleus ambiguous)。
30.图2是一系列图像,显示在通过鞘内注射aav9/gan预先免疫的大鼠中通过左迷走神经施用aav9/gfp病毒载体后的gfp表达。左图:左侧结节神经节的神经元细胞体。右图:左颈迷走神经纤维。
31.图3是一系列图像,显示在未免疫的大鼠(左图)或对aav9预先免疫的大鼠(右图)中,左迷走神经注射aav9/gfp后大鼠脑中的gfp表达。迷走神经背侧运动核用“dmn x”表示,孤束核用“sol nlat”表示。
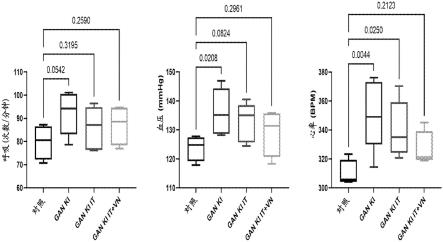
32.图4是一系列图,显示用毛果芸香碱攻击并使用本公开内容的组合物和方法处理的野生型和突变型gan敲入小鼠中与自主神经功能相关的生理反应。图形数据表示为箱线图,其中误差线表示最大值和最小值,方框线表示中值。发明详述
33.本公开内容尤其提供用于治疗受试者的疾病的组合物和方法,所述方法包括通过注射到受试者迷走神经中向受试者施用至少一种治疗有效量的重组腺相关病毒(raav)病毒载体。
34.本公开内容还尤其提供了分离的多核苷酸、重组腺相关病毒(raav)载体和包含转基因核酸分子的raav病毒载体,所述转基因核酸分子包含编码巨轴突蛋白(gan)多肽的核酸序列。本公开内容还提供了制造这些分离的多核苷酸、raav载体和raav病毒载体的方法,以及它们用于递送转基因以治疗或预防疾病或病症的用途,所述疾病或病症包括与gan基因的缺失、功能失常和/或缺陷相关的疾病,包括但不限于巨轴索神经病。
35.巨轴突蛋白(gan),也称为kelch样蛋白16,是一种由gan基因编码的人类蛋白质。gan是细胞骨架btb/kelch(broad-complex、tramtrack和bric a brac)蛋白质家族的一员。gan是一种e3连接酶衔接蛋白,可促进中间丝(if)蛋白的泛素化和降解。gan基因的突变已被证明会导致巨轴索神经病。
36.如本文所用,术语“腺相关病毒”或“aav”是指与该名称相关并属于细小病毒科依赖细小病毒属(dependoparvovirus)的病毒类别的成员。腺相关病毒是一种在细胞中生长的单链dna病毒,其中某些功能由共同感染辅助病毒提供。aav的一般信息和综述可以在例如carter,1989,handbook of parvoviruses,vol.1,第169-228页;以及berns,1990,virology,第1743-1764页,raven press,(new york)中找到。完全可以预期这些综述中描述的相同原则将适用于在综述发表日期之后表征的其他aav血清型,因为众所周知,各种血清型在结构和功能上即使在遗传水平上都非常密切相关。(参见,例如,blacklowe,1988,parvoviruses and human disease,第165-174页,j.r.pattison编辑;和rose,comprehensive virology 3:1-61(1974))。例如,所有aav血清型明显表现出由同源rep基因介导的非常相似的复制特性,并且都带有三种相关的衣壳蛋白,例如在aav2中表达的那些。异源双链核酸分子分析进一步表明了相关程度,该分析揭示了血清型之间沿基因组长度的广泛交叉杂交;并且在对应于“反向末端重复序列”(itr)的末端存在类似的自退火片段。相似的传染性模式也表明每个血清型的复制功能处于相似的调控控制之下。已知该病毒的多种血清型适用于基因递送;所有已知的血清型都可以感染各种组织类型的细胞。至少11种顺序编号的aav血清型是本领域已知的。可用于本文公开的方法的非限制性示例性血清型包括11种血清型中的任何一种,例如aav2、aav8、aav9,或变体血清型,例如aav-dj和aav php.b。aav粒子包含三种主要病毒蛋白、基本上由其组成或由其组成:vp1、vp2和vp3。在一些方面,aav是指血清型aav1、aav2、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aav13、aavphp.b、aavrh74或aavrh.10。
37.示例性的腺相关病毒和重组腺相关病毒包括但不限于所有血清型(例如,aav1、
directed mutagenesis of adeno-associated virus type 2structural protein initiation codons:effects on regulation of synthesis and biological activity".journal of virology.68(1):170
–
6,和trempe jp,carter bj(september 1988)."alternate mrna splicing is required for synthesis of adeno-associated virus vp1 capsid protein".journal of virology.62(9):3356
–
63,每一个都以引用的方式并入本文。单个共有多腺苷酸位点位于aav基因组的图谱位置95。muzyczka,current topics in microbiology and immunology,158:97-129(1992)中综述了aav的生命周期和遗传学。
41.每个vp1蛋白都包含一个vp1部分、一个vp2部分和一个vp3部分。vp1部分是vp1蛋白的n端部分,是vp1蛋白特有的。vp2部分是存在于vp1蛋白中的氨基酸序列,也存在于vp2蛋白的n端部分。vp3部分和vp3蛋白具有相同的序列。vp3部分是vp1蛋白与vp2蛋白共有的vp1蛋白的c端部分。
42.vp3蛋白可进一步分为离散可变表面区域i-ix(vr-i-ix)。每个可变表面区(vr)可以包含或含有特定的氨基酸序列,这些氨基酸序列单独或与每个其他vr的特定氨基酸序列组合可以赋予特定血清型以独特的感染表型(例如,降低的抗原性、改善的转导和/或相对于其他aav血清型的组织特异性向性),如dimatta等人,“structural insight into the unique properties of adeno-associated virus serotype 9”j.virol.,vol.86(12):6947-6958,june 2012所述,其内容通过引用并入本文。
43.aav具有独特的特性,使其作为例如在基因疗法中向细胞递送外源dna递送的载体具有吸引力。培养细胞的aav感染是非致细胞病变性的,人类和其他动物的自然感染是隐性和无症状的。此外,aav感染许多哺乳动物细胞,提供了在体内靶向许多不同组织的可能性。此外,aav转导缓慢分裂和非分裂细胞,并且可以作为转录活性核附加体(染色体外元件)在这些细胞的基本上整个生命周期内持续存在。aav前病毒基因组作为克隆dna插入质粒中,这使得重组基因组的构建变得可行。此外,由于指导aav复制和基因组衣壳化的信号包含在aav基因组的itr中,基因组内部约4.3kb(编码复制和结构衣壳蛋白,rep-cap)的部分或全部可能被外源dna替换,以生成aav载体。可以以反式提供rep和cap蛋白。aav的另一个显著特征是它是一种极其稳定和强大的病毒。它很容易地承受用于灭活腺病毒的条件(56℃至65℃,几个小时),从而降低了aav的低温保存的重要性。aav甚至可以被冻干。最后,aav感染的细胞对重复感染没有抵抗力。
44.多项研究表明肌肉中的长期(》1.5年)重组aav介导的蛋白质表达。参见,clark等人,hum gene ther,8:659-669(1997);kessler等人,proc nat.acad sc.usa,93:14082-14087(1996);和xiao等人,jvirol,70:8098-8108(1996)。还参见,chao等人,mol ther,2:619-623(2000)和chao等人,mol ther,4:217-222(2001)。此外,由于肌肉高度血管化,重组aav转导导致在肌肉内注射后在体循环中出现转基因产物,如herzog等人,proc natl acad sci usa,94:5804-5809(1997)和murphy等人,proc natl acad sci usa,94:13921-13926(1997)中所述。此外,lewis等人,j virol,76:8769-8775(2002)证明骨骼肌纤维具有正确的抗体糖基化、折叠和分泌所必需的细胞因子,表明肌肉能够稳定表达所分泌的蛋白质治疗剂。本发明的重组aav(raav)基因组包含以下、基本上由以下组成或由以下组成:编码治疗性蛋白质(例如,kctd7)的核酸分子和位于该核酸分子侧翼的一个或多个aav itr。假型
raav的产生公开于例如wo2001083692中。还考虑了其他类型的raav变体,例如具有衣壳突变的raav。参见,例如,marsic等人,molecular therapy,22(11):1900-1909(2014)。各种aav血清型的基因组的核苷酸序列是本领域已知的。
45.包含转基因序列的分离的多核苷酸
46.本公开内容提供了包含至少一种转基因核酸分子的分离的多核苷酸。
47.在一些方面,转基因核酸分子可以包含编码gan多肽的核酸序列或其至少一个片段。在一些方面,转基因核酸分子可以包含编码gan多肽的生物学等价物的核酸序列。
48.在一些方面,gan多肽包含与seq id no:1或seq id no:2中所示的氨基酸序列或其片段至少65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%(或介于两者之间的任何百分比)相同的氨基酸序列,基本上由这样的氨基酸序列组成或由这样的氨基酸序列组成。在一些方面,gan多肽包含与seq id no:1所示的氨基酸序列的至少一部分或其片段至少65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%(或介于两者之间的任何百分比)相同的氨基酸序列,基本上由这样的氨基酸序列组成或由这样的氨基酸序列组成。
49.在一些方面,编码gan多肽的核酸序列包含与seq id no:3-6中任一项所示的核酸序列至少65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%(或介于两者之间的任何百分比)相同的核酸序列,基本上由这样的核酸序列组成或由这样的核酸序列组成。在一些方面,编码gan多肽的核酸序列包含与seq id no:3所示的核酸序列至少65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%(或介于两者之间的任何百分比)相同的核酸序列,基本上由这样的核酸序列组成或由这样的核酸序列组成。
50.在一些方面,编码gan多肽的核酸序列可以是编码gan多肽的经密码子优化的核酸序列。编码gan多肽的经密码子优化的核酸序列可包含与编码gan多肽的野生型人类核酸序列不超过65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%(或介于两者之间的任何百分比)相同的核酸序列。如本文所用,“编码gan多肽的野生型人类核酸序列”是指人类基因组中编码gan多肽的核酸序列,如seq id no:7所示。seq id no:3-6是编码gan多肽的独特密码子优化的核酸序列。
51.在一些方面,编码gan多肽的经密码子优化的核酸序列,例如在seq id no:3-6中所示的那些,可以不包含供体剪接位点。在一些方面,编码gan多肽的经密码子优化的核酸序列可以包含不超过约1个、或约2个、或约3个、或约4个、或约5个、或约6个、或约7个、或约8个,或约9个,或约10个供体剪接位点。在一些方面,与编码gan多肽的野生型人核酸序列相比,编码gan多肽的经密码子优化的核酸序列包含的供体剪接位点减少至少1个、或至少2个、或至少3个、或至少4个、或至少5个、或至少6个、或至少7个,或至少8个、或至少9个、或至少10个。不希望受理论束缚,去除经密码子优化的核酸序列中的供体剪接位点可以出乎意料地和不可预测地增加体内gan多肽的表达,因为隐蔽剪接被阻止。此外,不同受试者之间的隐蔽剪接可能不同,这意味着包含供体剪接位点的gan多肽的表达水平可能在不同受试者之间发生不可预测的变化。
52.在一些方面,编码gan多肽的经密码子优化的核酸序列,例如在seq id no:3-6中所示的那些,可以具有与编码gan多肽的野生型人核酸序列的gc含量不同的gc含量。在一些方面,与编码gan多肽的野生型人核酸序列相比,编码gan多肽的经密码子优化的核酸序列
的gc含量更均匀地分布在整个核酸序列中。不希望受理论束缚,通过gc含量在整个核酸序列上更均匀地分布,经密码子优化的核酸序列在转录物的长度上表现出更均匀的解链温度(“tm”)。解链温度的均匀性出乎意料地导致经密码子优化的核酸在人类受试者中的表达增加,因为核酸序列的转录和/或翻译在较少的聚合酶和/或核糖体停滞的情况下发生。
53.在一些方面,编码gan多肽的经密码子优化的核酸序列,例如在seq id no:3-6中所示的那些,相对于编码gan多肽的野生型或非密码子优化核酸序列,在人类受试者中表现出至少5%、至少10%、至少20%、至少30%、至少50%、至少75%、至少100%、至少200%、至少300%、至少500%或至少1000%的表达增加。
54.在一些方面,gan多肽可以进一步包含蛋白质标签。不希望受理论束缚,包含蛋白质标签可以允许外源gan多肽的检测和/或可视化。如本领域技术人员将理解的,蛋白质标签的非限制性实例包括myc标签、聚组氨酸标签、flag-标签、ha-标签、sbp-标签或本领域已知的任何其他蛋白质标签。
55.aav载体
56.在一些方面,包含至少一种本文所述的转基因核酸分子的经分离的多核苷酸可以是重组aav(raav)载体。
57.如本文所用,术语“载体”是指包含完整复制子、基本上由其组成或由其组成的核酸,使得该载体在(例如通过转染、感染或转化的方法)置于细胞内时可被复制。本领域理解,一旦进入细胞,载体可作为染色体外(附加型)元件复制或可整合到宿主细胞染色体中。载体可以包括衍生自逆转录病毒、腺病毒、疱疹病毒、杆状病毒、修饰的杆状病毒、乳多空病毒或其他经修饰的天然存在的病毒的核酸。用于递送核酸的示例性非病毒载体包括裸dna;与阳离子脂质复合的dna,单独或与阳离子聚合物结合;阴离子和阳离子脂质体;包含与阳离子聚合物(例如异质聚赖氨酸、定长寡肽和聚乙烯亚胺)缩合的dna、基本上由其或由其组成的dna-蛋白质复合物和颗粒,在某些情况下包含在脂质体中;以及使用包含病毒和聚赖氨酸-dna、基本上由其组成或由其组成的三元复合物。
58.关于一般重组技术,包含启动子和克隆位点(多核苷酸可以可操作地连接到该克隆位点中)的载体是本领域公知的。此类载体能够在体外或体内转录rna,并且可从诸如agilent technologies(santa clara,calif)和promega biotech(madison,wis.)等来源商购获得。为了优化表达和/或体外转录,可能有必要去除、添加或改变克隆转基因的5'和/或3'非翻译部分,以消除额外的、潜在的不适当交替翻译起始密码子或其他可能在转录或翻译水平上干扰或减少表达的序列。可替代地,可以紧邻起始密码子的5'端插入共有核糖体结合位点以增强表达。
59.如本文所用,“raav载体”是指包含一种或多种转基因核酸分子和一种或多种aav反向末端重复序列(itr)、基本上由其组成或由其组成的载体。当存在于提供rep和cap基因产物功能的宿主细胞中时,此类aav载体可以复制并包装成感染性病毒粒子;例如,通过宿主细胞的转染进行。在一些方面,aav载体包含启动子、可编码至少一种蛋白质或rna的至少一种核酸和/或包装到感染性aav粒子中的侧翼itr内的增强子和/或终止子。衣壳化的核酸部分可以称为aav载体基因组。含有raav载体的质粒也可能含有用于制造目的的元件,例如抗生素抗性基因、复制起点序列等,但这些没有被衣壳化,因此不构成aav粒子的一部分。
60.在一些方面,raav载体可以包含至少一个转基因核酸分子。在一些方面,raav载体
itr序列、aav13 itr序列、aavrh74 itr序列或aavrh.10itr序列。
69.启动子序列和增强子
70.如本文所用,术语“启动子”和“启动子序列”是指控制序列,其是多核苷酸序列的一个区域,在该区域控制编码序列例如基因或转基因的转录起始和转录速率。例如,启动子可以是组成型、诱导型、抑制型或组织特异性的。启动子可能包含调节性蛋白和分子(例如rna聚合酶和转录因子)可以结合的遗传元件。非限制性示例性启动子包括rous肉瘤病毒(rsv)ltr启动子(任选地带有rsv增强子)、巨细胞病毒(cmv)启动子、sv40启动子、二氢叶酸还原酶启动子、β-肌动蛋白启动子、磷酸甘油激酶(pgk)启动子、u6启动子、突触蛋白启动子、h1启动子、普遍存在的鸡β-肌动蛋白杂合体(cbh)启动子、小核rna(u1a或u1b)启动子、mecp2启动子、mep418启动子、mep426启动子、mep426启动子的人变体、最小mecp2启动子、vmd2启动子、mrho启动子或ef1启动子。
71.本文提供的其他非限制性示例性启动子包括但不限于efla、ubc、人β-肌动蛋白、cag、tre、ac5、polyhedrin、camkiia、gal1、tef1、gds、adh1、ubi和α-1-抗胰蛋白酶(haat)。本领域已知可修饰此类启动子的核苷酸序列以提高或降低mrna转录的效率。参见,例如,gao等人,(2018)mol.ther.:nucleic acids 12:135-145(修饰7sk、u6和h1启动子的tata盒以消除rna聚合酶iii转录并刺激rna聚合酶ii依赖性mrna转录)。合成衍生的启动子可用于普遍性或组织特异性表达。此外,可在本文公开的方法中使用病毒衍生的启动子(其中一些如上所述),例如cmv、hiv、腺病毒和aav启动子。在一些方面,启动子与至少一个增强子一起使用以提高转录效率。增强子的非限制性实例包括间质类视黄醇结合蛋白(irbp)增强子、rsv增强子或cmv增强子。
72.在一些方面,启动子序列可以包含以下启动子序列、基本上由其组成或由其组成:rous肉瘤病毒(rsv)ltr启动子序列(任选具有rsv增强子)、巨细胞病毒(cmv)启动子序列、sv40启动子序列、二氢叶酸还原酶启动子序列、jet启动子序列、强β-肌动蛋白启动子序列、磷酸甘油激酶(pgk)启动子序列、u6启动子序列、突触蛋白启动子、h1启动子序列、普遍存在的鸡β-肌动蛋白杂合体(cbh)启动子序列、小核rna(u1a或u1b)启动子序列、mecp2启动子序列、mep418启动子、mep426启动子序列、小普遍启动子序列(也称为jeti启动子序列)、mecp2启动子序列、vmd2启动子序列、mrho启动子序列、efi启动子序列、efla启动子序列、ubc启动子序列、人β-肌动蛋白启动子序列、cag启动子序列、tre启动子序列、ac5启动子序列、polyhedrin启动子序列、camkiia启动子序列、gal1启动子序列、tef1启动子序列、gds启动子序列、adh1启动子序列、ubi启动子序列、mep426启动子或α-1-抗胰蛋白酶(haat)启动子序列。
73.增强子是增加靶序列表达的调节元件。“启动子/增强子”是包含能够提供启动子和增强子功能的序列的多核苷酸。例如,逆转录病毒的长末端重复序列包含启动子和增强子二者的功能。增强子/启动子可以是“内源性的”或“外源性的”或“异源性的”。“内源性”增强子/启动子是与基因组中给定基因天然连接的增强子/启动子。“外源性”或“异源性”增强子/启动子是通过遗传操作(即分子生物学技术)或合成技术与基因并列放置的增强子/启动子,使得该基因的转录由连接的增强子/启动子指导。用于本文提供的方法、组合物和构建体的连接的增强子/启动子的非限制性实例包括pde启动子加irbp增强子或cmv增强子加u1a启动子。本领域理解,增强子可以远距离操作,而不管它们相对于内源或异源启动子的
位置的取向如何。因此,进一步理解的是,在距启动子一定距离处操作的增强子由此与该启动子“可操作地连接”,而不管其在载体中的位置或其相对于启动子位置的取向。
74.如在整个公开内容中所使用的,术语“可操作地连接”是指基因(即,转基因)的表达,该基因在与其空间连接的启动子的控制下。启动子可以位于其控制下的基因的5'(上游)或3'(下游)。启动子可以位于受其控制的基因的5'(上游)。启动子和基因之间的距离可以与在启动子所源自的基因中该启动子和它所控制的基因的距离大致相同。可以适应启动子和基因之间距离的变化,而不会丧失启动子功能。
75.在一些方面,启动子序列可以包含jet启动子序列、基本上由其组成或由其组成。jet启动子序列可以包含与seq id no:8所示核酸序列至少65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%(或介于两者之间的任何百分比)相同的核酸序列,基本上由其组成或由其组成。
76.转基因核酸分子
77.转基因核酸分子可以包含以上在标题“包含转基因序列的分离的多核苷酸”下描述的任何转基因核酸分子,基本上由其组成或由其组成。
78.在一些方面,存在于raav载体中的转基因核酸分子可以处于同样存在于同一raav载体中的启动子序列的转录控制之下。
79.多腺苷酸序列
80.在一些方面,多腺苷酸(poly a)序列可以包含本领域已知的任何多腺苷酸序列。多腺苷酸序列的非限制性实例包括但不限于:mecp2多腺苷酸序列、视黄醇脱氢酶1(rdh1)多腺苷酸序列、牛生长激素(bgh)多腺苷酸序列、sv40多腺苷酸序列、spa49多腺苷酸序列、snrp-tk65多腺苷酸序列、snrp多腺苷酸序列或tk65多腺苷酸序列。
81.因此,多腺苷酸序列可以包含mecp2多腺苷酸序列、视黄醇脱氢酶1(rdh1)多腺苷酸序列、牛生长激素(bgh)多腺苷酸序列、sv40多腺苷酸序列、spa49多腺苷酸序列、snrp-tk65多腺苷酸序列、snrp多腺苷酸序列或tk65多腺苷酸序列,基本上由其组成或由其组成。
82.在一些方面,多腺苷酸序列可以包含与seq id no:9所示序列至少65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%(或介于两者之间的任何百分比)相同的序列,基本上由其组成或由其组成。
83.在一些方面,本公开内容的raav载体可以包含与seq id no:10所示序列至少65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%(或介于两者之间的任何百分比)相同的核酸序列,基本上由其组成或由其组成。
84.在一些方面,本公开内容的raav载体可以包含与seq id no:11所示序列至少65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%(或介于两者之间的任何百分比)相同的核酸序列,基本上由其组成或由其组成。
85.细菌质粒
86.在一些方面,本公开内容的raav载体可以包含在细菌质粒内以允许raav载体在体外增殖。因此,本公开内容提供了包含本文所述的任何raav载体的细菌质粒。细菌质粒还可包含复制起点序列。细菌质粒还可包含抗生素抗性基因。细菌质粒还可包含抗性基因启动子。细菌质粒还可包含原核启动子。在一些方面,本公开内容的细菌质粒可以包含与seq id no:10或seq id no:11所示的任何核酸序列至少65%、70%、75%、80%、85%、90%、95%、
96%、97%、98%、99%或100%(或介于两者之间的任何百分比)相同的核酸序列,基本上由其组成或由其组成。
87.复制起点序列
88.在一些方面,复制起点序列可包含本领域已知的任何复制起点序列、基本上由其组成或由其组成。复制起点序列可以是细菌复制起点序列,从而允许使用本领域标准方法在细菌中产生、繁殖和维持包含所述细菌复制起点序列的raav载体。
89.抗生素抗性基因
90.在一些方面,本公开内容的细菌质粒、raav载体和/或raav病毒载体可以包含抗生素抗性基因。
91.在一些方面,抗生素抗性基因可包含本领域已知的任何抗生素抗性基因、基本上由其组成或由其组成。本领域已知的抗生素抗性基因的实例包括但不限于卡那霉素抗性基因、壮观霉素抗性基因、链霉素抗性基因、氨苄青霉素抗性基因、羧苄青霉素抗性基因、博来霉素抗性基因、红霉素抗性基因、多粘菌素b抗性基因、四环素抗性基因和氯霉素抗性基因。
92.aav病毒载体
[0093]“病毒载体”定义为重组产生的病毒或病毒粒子,其包含要在体内、离体或体外递送到宿主细胞中的多核苷酸。病毒载体的实例包括逆转录病毒载体、aav载体、慢病毒载体、腺病毒载体、甲病毒载体等。甲病毒载体,例如基于semliki forest病毒的载体和基于sindbis病毒的载体,还已被开发用于基因疗法和免疫疗法。例如,参见schlesinger和dubensky(1999)curr.opin.biotechnol.5:434-439和ying等人,(1999)nat.med.5(7):823-827。
[0094]“aav病毒粒子”或“aav病毒颗粒”或“aav病毒载体”或“raav病毒载体”或“aav载体粒子”或“aav粒子”是指由至少一种aav衣壳蛋白和衣壳化的多核苷酸raav载体组成的病毒粒子。因此,raav病毒载体的产生必然包括raav载体的产生,因为这样的载体包含在raav载体中。
[0095]
如本文所用,术语“病毒衣壳”或“衣壳”是指病毒粒子的蛋白质壳或外壳。衣壳的功能是将病毒基因组衣壳化、保护、运输和释放到宿主细胞中。衣壳通常由蛋白质的寡聚结构亚基(“衣壳蛋白”)组成。如本文所用,术语“衣壳化”是指包裹在病毒衣壳内。aav的病毒衣壳由三种病毒衣壳蛋白的混合物组成:vp1、vp2和vp3。vp1、vp2和vp3的混合物包含60个单体,它们以1:1:10(vp1:vp2:vp3)或1:1:20(vp1:vp2:vp3)的比例以t=1二十面体对称排列,如sonntag f等人,(june 2010)."a viral assembly factor promotes aav2 capsid formation in the nucleolus".proceedings of the national academy of sciences of the united states of america.107(22):10220
–
5,和rabinowitz je,samulski rj(december 2000)."building a better vector:the manipulation of aav virions".virology.278(2):301
–
8中所述,每个都通过引用整体并入本文。
[0096]
本公开内容提供了一种raav病毒载体,其包含:a)本文所述的任何raav载体或其互补物;和b)aav衣壳蛋白。
[0097]
本公开内容提供了一种raav病毒载体,其包含:a)本文所述的任何raav载体;和b)aav衣壳蛋白。
[0098]
aav衣壳蛋白可以是本领域已知的任何aav衣壳蛋白。aav衣壳蛋白可以是aav1衣
壳蛋白、aav2衣壳蛋白、aav4衣壳蛋白、aav5衣壳蛋白、aav6衣壳蛋白、aav7衣壳蛋白、aav8衣壳蛋白、aav9衣壳蛋白、aav10衣壳蛋白、aav11衣壳蛋白、aav12衣壳蛋白、aav13衣壳蛋白、aavphp.b衣壳蛋白、aavrh74衣壳蛋白或aavrh.10衣壳蛋白。
[0099]
替代的raav载体和raav病毒载体实施方案
[0100]
1.raav载体,在5’至3’方向上包含:a)第一aav itr序列;b)启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码gan多肽的核酸序列;d)多腺苷酸序列;和e)第二aav itr序列。
[0101]
2.实施方案1的raav载体,其中gan多肽包含seq idno:1或seq id no:2所示的氨基酸序列。
[0102]
3.实施方案2的raav载体,其中所述kctd7多肽包含seq id no:1所示的氨基酸序列。
[0103]
4.实施方案2的raav载体,其中所述kctd7多肽包含seq id no:2所示的氨基酸序列。
[0104]
5.前述实施方案中任一项的raav载体,其中编码gan多肽的核酸序列包含seq id no:3-6中任一项所示的核酸序列。
[0105]
6.前述实施方案中任一项的raav载体,其中编码gan多肽的核酸序列包含seq id no:3所示的核酸序列。
[0106]
7.前述实施方案中任一项的raav载体,其中编码gan多肽的核酸序列包含seq id no:4所示的核酸序列。
[0107]
8.前述实施方案中任一项的raav载体,其中编码gan多肽的核酸序列包含seq id no:5所示的核酸序列。
[0108]
9.前述实施方案中任一项的raav载体,其中编码gan多肽的核酸序列包含seq id no:6所示的核酸序列。
[0109]
10.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav1 itr序列、aav2 itr序列、aav4 itr序列、aav5itr序列、aav6 itr序列、aav7 itr序列、aav8 itr序列、aav9itr序列、aav10 itr序列、aav11 itr序列、aav12 itr序列、aav13 itr序列、aavrh74 itr序列、aavrh.10itr序列或其任意组合。
[0110]
11.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav1 itr序列。
[0111]
12.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav2 itr序列。
[0112]
13.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav4 itr序列。
[0113]
14.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav5 itr序列。
[0114]
15.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav6 itr序
列。
[0115]
16.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav7 itr序列。
[0116]
17.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav8 itr序列。
[0117]
18.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav9 itr序列。
[0118]
19.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav10 itr序列。
[0119]
20.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav11 itr序列。
[0120]
21.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav12 itr序列。
[0121]
22.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aav13 itr序列。
[0122]
23.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aavrh74 itr序列。
[0123]
24.前述实施方案中任一项的raav载体,其中第一aav itr序列包含aavrh.10itr序列。
[0124]
25.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav1 itr序列、aav2 itr序列、aav4 itr序列、aav5 itr序列、aav6 itr序列、aav7 itr序列、aav8 itr序列、aav9 itr序列、aav10 itr序列、aav11 itr序列、aav12itr序列、aav13 itr序列、aavrh74 itr序列、aavrh.10itr序列或其任意组合。
[0125]
26.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav1 itr序列。
[0126]
27.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav2 itr序列。
[0127]
28.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav4 itr序列。
[0128]
29.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav5 itr序列。
[0129]
30.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav6 itr序列。
[0130]
31.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav7 itr序列。
[0131]
32.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav8 itr序列。
[0132]
33.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav9 itr序列。
[0133]
34.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav10 itr序列。
[0134]
35.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav11 itr序列。
[0135]
36.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav12 itr序列。
[0136]
37.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aav13 itr序列。
[0137]
38.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aavrh74 itr序列。
[0138]
39.前述实施方案中任一项的raav载体,其中所述第二aav itr序列包含aavrh.10itr序列。
[0139]
40.前述实施方案中任一项的raav载体,其中所述启动子序列包含jet启动子序列。
[0140]
41.前述实施方案中任一项的raav载体,其中所述jet启动子序列包含seq id no:8所示的核酸序列。
[0141]
42.前述实施方案中任一项的raav载体,其中所述多腺苷酸序列包含seq id no:11所示的核酸序列。
[0142]
43.前述实施方案中任一项的raav载体,在5’至3’方向上包含:a)第一aav itr序列;b)包含seq id no:8的核酸序列的启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码gan多肽的核酸序列,其中所述gan多肽包含seq id no:1或seq id no:2的氨基酸序列;d)包含seq id no:9的核酸序列的多腺苷酸序列;和e)第二aav itr序列。
[0143]
44.前述实施方案中任一项的raav载体,在5’至3’方向上包含:a)第一aav itr序列;b)包含seq id no:8的核酸序列的启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码gan多肽的核酸序列,其中所述gan多肽包含seq id no:1的氨基酸序列;d)包含seq id no:9的核酸序列的多腺苷酸序列;和e)第二aav itr序列。
[0144]
45.前述实施方案中任一项的raav载体,在5’至3’方向上包含:a)第一aav itr序列;b)包含seq id no:8的核酸序列的启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码gan多肽的核酸序列,其中所述gan多肽包含seq id no:2的氨基酸序列;d)包含seq id no:9的核酸序列的多腺苷酸序列;和e)第二aav itr序列。
[0145]
46.前述实施方案中任一项的raav载体,在5’至3’方向上包含:a)第一aav itr序列;b)包含seq id no:8的核酸序列的启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码gan多肽的核酸序列,其中所述编码gan多肽的核酸序列包含seq id no:3-6中任一项所述的核酸序列;d)包含seq id no:9的核酸序列的多腺苷酸序列;和e)第二aav itr序列。
[0146]
47.前述实施方案中任一项的raav载体,在5’至3’方向上包含:a)第一aav itr序列;b)包含seq id no:8的核酸序列的启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码gan多肽的核酸序列,其中所述编码gan多肽的核酸序列包含seq id no:3-6中任一项所述的核酸序列;d)包含seq id no:9的核酸序列的多腺苷酸序列;和e)第二aav itr序列。
[0147]
48.前述实施方案中任一项的raav载体,在5’至3’方向上包含:a)第一aav itr序列;b)包含seq id no:8的核酸序列的启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码gan多肽的核酸序列,其中所述编码gan多肽的核酸序列包含seq id no:3所示的核酸序列;d)包含seq id no:9的核酸序列的多腺苷酸序列;和e)第二aav itr序列。
[0148]
49.前述实施方案中任一项的raav载体,在5’至3’方向上包含:a)第一aav itr序列;b)包含seq id no:8的核酸序列的启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码gan多肽的核酸序列,其中所述编码gan多肽的核酸序列包含seq id no:4所示的核酸序列;d)包含seq id no:9的核酸序列的多腺苷酸序列;和e)第二aav itr序列。
[0149]
50.前述实施方案中任一项的raav载体,在5’至3’方向上包含:a)第一aav itr序列;b)包含seq id no:8的核酸序列的启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码gan多肽的核酸序列,其中所述编码gan多肽的核酸序列包含seq id no:5所示的核酸序列;d)包含seq id no:9的核酸序列的多腺苷酸序列;和e)第二aav itr序列。
[0150]
51.前述实施方案中任一项的raav载体,在5’至3’方向上包含:a)第一aav itr序列;b)包含seq id no:8的核酸序列的启动子序列;c)转基因核酸分子,其中所述转基因核酸分子包含编码gan多肽的核酸序列,其中
所述编码gan多肽的核酸序列包含seq id no:6所示的核酸序列;d)包含seq id no:9的核酸序列的多腺苷酸序列;和e)第二aav itr序列。
[0151]
52.前述实施方案中任一项的raav载体,其中所述raav载体包含seq id no:10的核酸序列。
[0152]
53.前述实施方案中任一项的raav载体,其中所述raav载体包含seq id no:11的核酸序列。
[0153]
54.raav病毒载体,包含:a)前述实施方案中任一项的raav载体或其互补物;和b)aav衣壳蛋白。
[0154]
55.raav病毒载体,包含:a)前述实施方案中任一项的raav载体;和b)aav衣壳蛋白。
[0155]
56.实施方案50或51的raav病毒载体,其中所述aav衣壳蛋白是aav1衣壳蛋白、aav2衣壳蛋白、aav4衣壳蛋白、aav5衣壳蛋白、aav6衣壳蛋白、aav7衣壳蛋白、aav8衣壳蛋白、aav9衣壳蛋白、aav10衣壳蛋白、aav11衣壳蛋白、aav12衣壳蛋白、aav13衣壳蛋白、aavphp.b衣壳蛋白、aavrh74衣壳蛋白或aavrh.10衣壳蛋白。
[0156]
57.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav1衣壳蛋白。
[0157]
58.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav2衣壳蛋白。
[0158]
59.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav3衣壳蛋白。
[0159]
60.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav4衣壳蛋白。
[0160]
61.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav5衣壳蛋白。
[0161]
62.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav6衣壳蛋白。
[0162]
63.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav7衣壳蛋白。
[0163]
64.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav8衣壳蛋白。
[0164]
65.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav9衣壳蛋白。
[0165]
66.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav10衣壳蛋白。
[0166]
67.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav11衣壳蛋白。
[0167]
68.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav12衣壳蛋白。
[0168]
69.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aav13衣壳蛋白。
[0169]
70.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aavphp.b衣壳蛋白。
[0170]
71.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aavrh74衣壳蛋白。
[0171]
72.实施方案52的raav病毒载体,其中所述aav衣壳蛋白是aavrh.10衣壳蛋白。
[0172]
组合物和药物组合物
[0173]
本公开内容提供了包含本文所述的任何分离的多核苷酸、raav载体和/或raav病毒载体的组合物。在一些方面,所述组合物可以是药物组合物。因此,本公开内容提供了包含本文所述的任何分离的多核苷酸、raav载体和/或raav病毒载体的药物组合物。
[0174]
如本文所述,药物组合物可以通过药理学领域已知或开发的任何方法配制,包括但不限于使活性成分(例如病毒粒子或重组载体)与赋形剂和/或添加剂和/或其他辅助成
分接触,将产物分割或包装成剂量单位。本公开内容的病毒粒子可配制成具有所需特征,例如增加的稳定性、增加的细胞转染、持续或延迟释放、生物分布或趋向性、被调节或增强的编码蛋白质在体内的翻译、以及编码蛋白质在体内的释放曲线。
[0175]
因此,药物组合物可以进一步包含盐水、类脂质(lipidoids)、脂质体、脂质纳米颗粒、聚合物、脂质复合物、核-壳纳米颗粒、肽、蛋白质、用病毒载体转染的细胞(例如,用于移植到受试者中)、纳米颗粒模拟物或其组合。在一些方面,药物组合物被配制成纳米颗粒。在一些方面,纳米颗粒是自组装核酸纳米颗粒。
[0176]
根据本公开内容的药物组合物可以批量、作为单一单位剂量和/或作为多个单一单位剂量来制备、包装和/或出售。活性成分的量通常等于将向受试者施用的活性成分剂量和/或此类剂量的方便部分(如,此类剂量的二分之一或三分之一)。本发明的制剂可以包括一种或多种赋形剂和/或添加剂,每种的量共同增加病毒载体的稳定性、增加病毒载体的细胞转染或转导、增加病毒载体编码的蛋白质的表达、和/或改变病毒载体编码的蛋白质的释放曲线。在一些方面,药物组合物包含赋形剂和/或添加剂。赋形剂和/或添加剂的非限制性实例包括溶剂、分散介质、稀释剂或其他液体媒介物、分散或悬浮助剂、表面活性剂、等渗剂、增稠剂或乳化剂、防腐剂或其组合。
[0177]
在一些方面,药物组合物包含冷冻保护剂。术语“冷冻保护剂”是指能够减少或消除冷冻过程中对物质的损害的试剂。冷冻保护剂的非限制性实例包括蔗糖、海藻糖、乳糖、甘油、右旋糖、棉子糖和/或甘露醇。
[0178]
如本文所用,术语“药学上可接受的载体”包括任何标准药用载体,例如磷酸盐缓冲盐水溶液、水和乳液(例如,水包油或油包水乳液),以及各种类型的润湿剂。组合物还可以包括稳定剂和防腐剂。关于载体、稳定剂和佐剂的实例,参见martin(1975)remington's pharm.sci,第15版(mack publ.co.,easton)。
[0179]
在一些方面,本公开内容的药物组合物可包含磷酸盐缓冲盐水(pbs)、d-山梨糖醇或其任何组合。
[0180]
在一些方面,药物组合物可以包含pbs,其中pbs以约100mm至约500mm、或约200mm至约400mm、或约300mm至约400mm的浓度存在。在一些方面,氯化钠可以以约350mm的浓度存在。
[0181]
在一些方面,药物组合物可以包含d-山梨糖醇,其中d-山梨糖醇以约1%至约10%,或约2.5%至约7.5%的浓度存在。在一些方面,d-山梨糖醇可以以约5%的浓度存在。
[0182]
因此,本公开内容提供了一种药物组合物,该药物组合物在包含浓度为5%的d-山梨糖醇的350mm磷酸盐缓冲盐水溶液中包含本公开内容的raav载体和/或raav病毒载体。
[0183]
使用本公开内容的组合物的方法
[0184]
本公开内容提供了所公开的组合物或药物组合物在使用所公开的组合物和药物组合物治疗如本领域已知的或如本文所述的细胞、组织、器官、动物或受试者中的疾病或病症中的用途,例如将治疗有效量的组合物或药物组合物施用所述的细胞、组织、器官、动物或受试者或与其接触。在一个方面,受试者是哺乳动物。优选地,受试者是人。术语“受试者”和“患者”在本文中可互换使用。
[0185]
本公开内容提供了预防或治疗疾病和/或病症的方法,所述方法包括、基本上由以下组成或由以下组成:向受试者施用治疗有效量的本文公开raav载体、raav病毒载体、组合
物和/或药物组合物中的任一种。
[0186]
治疗方法可以减轻本文所述的疾病和/或病症的一种或多种症状。在一个实施方案中,如果在症状变得可检测之前向携带gan基因突变的受试者施用本文所述的组合物,则本文所述的组合物的递送可预防或延迟可检测症状的发展。因此,治疗可以是治疗性的或预防性的。治疗是指抑制或逆转已建立的症状或表型。治疗也可能意味着延迟症状或表型的发作。预防是指抑制或防止尚未表现出明显症状的受试者出现症状。通过在18个月、12个月或6个月大之前进行的适当基因检测,可以在生命早期将未表现出明显症状的受试者识别为携带gan基因功能丧失突变。
[0187]
使用本公开内容的方法、组合物、药物组合物、raav载体或raav病毒载体治疗的受试者可具有本文所述的任何疾病和/或症状。
[0188]
本公开内容提供了治疗受试者的疾病和/或病症的方法,包括通过将至少一种治疗有效量的基因疗法注射到受试者的迷走神经中而向所述受试者施用所述至少一种治疗有效量的基因疗法(例如raav病毒载体)。
[0189]
本公开内容提供了一种治疗受试者的疾病和/或病症的方法,包括通过将至少一种治疗有效量的raav病毒载体注射到受试者的迷走神经中而向所述受试者施用所述至少一种治疗有效量的raav病毒载体。本公开内容提供了用于治疗受试者的疾病和/或病症的至少一种治疗有效量的raav病毒载体,其中所述raav病毒载体用于通过注射到受试者的迷走神经中而施用至所述受试者。本公开内容提供了至少一种治疗有效量的raav病毒载体在制备用于治疗受试者的疾病和/或病症的药物中的用途,其中所述至少一种治疗有效量的raav病毒载体用于通过注射到受试者的迷走神经中而施用至所述受试者。
[0190]
在一些方面,迷走神经是左迷走神经。因此,本公开内容提供了一种治疗受试者的疾病和/或病症的方法,包括通过将至少一种治疗有效量的raav病毒载体注射到受试者的左迷走神经中而向所述受试者施用所述至少一种治疗有效量的raav病毒载体。本公开内容还提供了用于治疗受试者的疾病和/或病症的至少一种治疗有效量的raav病毒载体,其中所述至少一种治疗有效量的raav病毒载体用于通过注射到受试者的左迷走神经中而施用至所述受试者。本公开内容还提供了至少一种治疗有效量的raav病毒载体在制备用于治疗受试者的疾病和/或病症的药物中的用途,其中所述至少一种治疗有效量的raav病毒载体用于通过注射到受试者的左迷走神经中而施用至所述受试者。
[0191]
在一些方面,迷走神经是右迷走神经。因此,本公开内容提供了一种治疗受试者的疾病和/或病症的方法,包括通过将至少一种治疗有效量的raav病毒载体注射到受试者的右迷走神经中而向所述受试者施用所述至少一种治疗有效量的raav病毒载体。本公开内容提供了用于治疗受试者的疾病和/或病症的至少一种治疗有效量的raav病毒载体,其中所述至少一种治疗有效量的raav病毒载体用于通过注射到受试者的右迷走神经中而施用至所述受试者。本公开内容还提供了至少一种治疗有效量的raav病毒载体在制备用于治疗受试者的疾病和/或病症的药物中的用途,其中所述至少一种治疗有效量的raav病毒载体用于通过注射到受试者的左迷走神经中而施用至所述受试者。
[0192]
本公开内容提供了减轻受试者自主神经功能障碍的至少一种症状的方法,包括将至少一种治疗有效量的基因疗法(例如raav病毒载体)施用到受试者的迷走神经中。
[0193]
本公开内容提供了减轻受试者的自主神经功能障碍的至少一种症状的方法,包括
将至少一种治疗有效量的raav病毒载体施用到受试者的迷走神经中。本公开内容还提供了在减轻受试者的自主神经功能障碍的至少一种症状的方法中使用的至少一种治疗有效量的raav载体,其中所述至少一种治疗有效量的raav病毒载体用于通过注射到受试者的迷走神经中而施用至所述受试者。本公开内容还提供了至少一种治疗有效量的raav病毒载体在制备用于减轻受试者的自主神经功能障碍的至少一种症状的药物中的用途,其中所述至少一种治疗有效量的raav病毒载体用于通过注射到受试者的迷走神经中而施用至所述受试者。在一些方面,迷走神经是左迷走神经。在一些方面,迷走神经是右迷走神经。
[0194]
自主神经功能障碍的症状可包括但不限于构音障碍(发声困难)、吞咽困难(吞咽时的困难)、胃肠道运动控制问题(导致例如食欲不振、腹胀、腹泻、便秘)、血压控制问题、和呼吸困难、直立性低血压(导致头晕和昏厥)、运动不耐受(无法通过运动改变心率)、出汗异常(出汗过多和/或出汗不足)、泌尿问题(例如,排尿困难、失禁和膀胱排空不完全)和性问题(例如,射精或维持勃起困难、阴道干燥或性高潮困难)。在一些方面,自主神经功能障碍可能与特定疾病和/或病症有关,包括但不限于神经系统病症。
[0195]
本公开内容提供了一种将基因疗法(例如,raav病毒载体)靶向受试者的自主神经系统的方法,所述方法包括将至少一种治疗有效量的基因疗法注射到受试者的迷走神经中。
[0196]
本公开内容提供了一种将raav病毒载体靶向受试者的自主神经系统的方法,所述方法包括将至少一种治疗有效量的raav病毒载体注射到受试者的迷走神经中。本公开内容还提供了用于将raav病毒载体靶向受试者的自主神经系统的方法中的至少一种治疗有效量的raav病毒载体,其中所述至少一种治疗有效量的raav用于通过注射到受试者的迷走神经中而施用至所述受试者。本公开内容还提供了至少一种治疗有效量的raav病毒载体在制备用于将raav病毒载体靶向受试者的自主神经系统的药物中的用途,其中所述至少一种治疗有效量的raav病毒载体用于通过注射到受试者的迷走神经中而施用至所述受试者。在一些方面,迷走神经是左迷走神经。在一些方面,迷走神经是右迷走神经。
[0197]
本公开内容提供了在受试者的自主神经系统中表达外源性核酸的方法,所述方法包括通过注射到受试者的迷走神经中向受试者施用包含外源性核酸的组合物。本公开内容提供了用于在受试者的自主神经系统中表达外源性核酸的方法中的包含外源性核酸的组合物,其中所述组合物用于通过注射到受试者的迷走神经中而施用至所述受试者。本公开内容提供了包含外源性核酸的组合物在制备用于在受试者的自主神经系统中表达外源性核酸的方法的药物中的用途,其中所述组合物用于通过注射到受试者的迷走神经中而施用至所述受试者。在一些方面,迷走神经是左迷走神经。在一些方面,迷走神经是右迷走神经。
[0198]
在一些方面,包含外源性核酸的组合物可以是包含在转录控制下并且与启动子序列可操作地连接的外源性核酸的组合物。在一些方面,包含外源性核酸的组合物可以是raav病毒载体,其包含外源性核酸和/或在转录控制下并且与启动子序列可操作地连接的外源性核酸。
[0199]
本公开内容提供了在受试者的自主神经系统中表达外源性多肽的方法,所述方法包括通过注射到受试者的迷走神经中而向受试者施用包含编码外源性多肽的核酸的组合物。本公开内容提供了包含编码外源性多肽的核酸的组合物,其用于在系统的自主神经系统中表达所述外源性多肽的方法中,其中所述组合物用于通过注射到受试者的迷走神经中
而施用至所述受试者。本公开内容提供了包含编码外源性多肽的核酸的组合物用于制备药物的用途,所述药物用于在受试者的自主神经系统中表达外源性多肽的方法,其中所述组合物用于通过注射到受试者的迷走神经中而施用至所述受试者。在一些方面,迷走神经是左迷走神经。在一些方面,迷走神经是右迷走神经。
[0200]
在一些方面,包含编码外源性多肽的核酸的组合物可以是包含在转录控制下并且与启动子序列可操作地连接的编码外源性多肽的核酸的组合物。
[0201]
在一些方面,包含编码外源性多肽的核酸的组合物可以是包含在转录控制下并且与启动子序列可操作地连接的编码外源性多肽的核酸的raav病毒载体。
[0202]
外源性核酸和/或多肽的表达可以包括在自主神经系统的特定区域中的外源性核酸和/或多肽的表达。自主神经系统的特定区域的非限制性实例包括延髓最后区、背侧运动核、自主神经系统的感觉神经元、自主神经系统的运动神经元、结节神经节、迷走神经背侧运动核、迷走神经回路、模糊核,或本领域已知的自主神经系统的任何其他部分。
[0203]
在本公开内容的方法和用途的一些方面,受试者可以是先前已经施用了至少一个量的基因疗法的受试者。因此,本公开内容提供了一种治疗受试者的疾病和/或病症的方法,包括通过将至少一种治疗有效量的基因疗法注射到受试者的迷走神经中而向受试者施用至少一种治疗有效量的基因疗法,其中所述受试者先前已被施用初始基因疗法。在一些方面,通过受试者的迷走神经施用的基因疗法可以是与初始基因疗法不同的基因疗法。在一些方面,通过受试者的迷走神经施用的基因疗法可以是与初始基因疗法相同的基因疗法。在一些方面,初始基因疗法可以是通过不是迷走神经的施用途径施用的。在一些方面,初始基因疗法可以是通过静脉内、鞘内、脑内、心室内、鼻内、气管内、耳内、眼内或眼周、经口、经直肠、经粘膜、吸入、经皮、肠胃外、皮下、皮内、肌肉内、脑池内、神经内、胸膜内、局部、淋巴管内、脑池内或神经内施用的。在一些方面,初始基因疗法可以是通过鞘内施用的。
[0204]
在本公开内容的方法和用途的一些方面,受试者可以是先前已被施用至少一个量的初始raav病毒载体的受试者。因此,本公开内容提供了一种治疗受试者的疾病和/或病症的方法,包括通过将至少一种治疗有效量的raav病毒载体注射到受试者的迷走神经中而向所述受试者施用所述至少一种治疗有效量的raav病毒载体,其中所述受试者先前已被施用初始raav病毒载体。在一些方面,通过受试者的迷走神经施用的raav病毒载体可以是与初始raav病毒载体不同的raav病毒载体。在一些方面,通过受试者的迷走神经施用的raav病毒载体可以与初始raav病毒载体相同。在一些方面,通过受试者的迷走神经施用的raav病毒载体可以包含第一aav衣壳蛋白并且初始raav病毒载体可以包含第二aav衣壳蛋白,其中第一aav衣壳蛋白与第二aav衣壳蛋白的血清型不同。在一些方面,通过受试者的迷走神经施用的raav病毒载体可以包含第一aav衣壳蛋白并且初始raav病毒载体可以包含第二aav衣壳蛋白,其中第一aav衣壳蛋白与第二aav衣壳蛋白的血清型相同(例如,aav9衣壳蛋白)。在一些方面,初始raav病毒载体可以已经通过不是迷走神经的施用途径施用。在一些方面,初始raav病毒载体可以是通过静脉内、鞘内、脑内、心室内、鼻内、气管内、耳内、眼内或眼周、经口、经直肠、经粘膜、吸入、经皮、肠胃外、皮下、皮内、肌肉内、脑池内、神经内、胸膜内、局部、淋巴管内、脑池内或神经内施用的。在一些方面,初始raav病毒载体可以是鞘内施用的。
[0205]
在本公开内容的方法和用途的一些方面,受试者可以是对于将通过注射到迷走神
经中施用的基因疗法呈血清阳性的受试者。因此,本公开内容提供了一种治疗受试者的疾病和/或病症的方法,包括通过将至少一种治疗有效量的基因疗法注射到受试者的迷走神经中而向所述受试者施用所述至少一种治疗有效量的基因疗法,其中受试者对所述基因疗法呈血清阳性。
[0206]
在本公开内容的方法和用途的一些方面,受试者可以是对于与将通过注射到迷走神经中施用的raav病毒载体具有相同血清型的aav粒子呈血清阳性的受试者。因此,本公开内容提供了治疗受试者的疾病和/或病症的方法,包括通过将至少一种治疗有效量的基因疗法注射到受试者的迷走神经中来向所述受试者施用至少一种治疗有效量的raav病毒载体,其中受试者对于与将通过注射到迷走神经中施用的raav病毒载体具有相同血清型的aav粒子呈血清阳性。
[0207]
如本文所用,术语“血清阳性”是指受试者血液中存在血清学标志物。因此,在一个非限制性实例中,对包含aav9衣壳的aav病毒载体呈血清阳性的受试者是在其血液中具有包含aav9衣壳的aav病毒载体的受试者。在另一个非限制性实例中,对中和抗体呈血清阳性的受试者是在其血液中具有中和抗体的受试者。
[0208]
在本公开内容的方法和用途的一些方面,受试者可以是具有针对将通过注射到迷走神经中来施用的基因疗法的中和抗体的受试者。因此,本公开内容提供了一种治疗受试者的疾病和/或病症的方法,包括通过将至少一种治疗有效量的基因疗法注射到受试者的迷走神经中而向所述受试者施用所述至少一种治疗有效量的基因疗法,其中所述受试者具有针对所述基因疗法的中和抗体。
[0209]
在本公开内容的方法和用途的一些方面,受试者可以是具有针对aav粒子的中和抗体的受试者,所述aav粒子与将通过注射到迷走神经中施用的raav病毒载体血清型相同。因此,本公开内容提供了治疗受试者的疾病和/或病症的方法,包括通过将至少一种治疗有效量的raav病毒载体注射到迷走神经中来施用所述至少一种治疗有效量的raav病毒载体,其中受试者具有针对aav粒子的中和抗体,所述aav粒子具有与raav病毒载体相同的血清型。在一个非限制性实例中,本公开内容提供了一种治疗受试者的疾病和/或病症的方法,包括通过注射至少一种治疗有效量的raav病毒到迷走神经中来施用所述至少一种治疗有效量的raav病毒载体载体,其中raav病毒载体包含aav9衣壳蛋白,其中受试者具有针对包含aav9衣壳的aav粒子的中和抗体。
[0210]
针对基因疗法或具有特定血清型的aav粒子的中和抗体的存在可以使用本领域标准的且技术人员熟知的方法来确定。
[0211]
本公开内容提供了治疗受试者的疾病和/或病症的方法,包括施用:a)至少一种治疗有效量的第一基因疗法;和b)至少一种治疗有效量的第二基因疗法,其中所述至少一种治疗有效量的第二基因疗法通过注射到受试者的迷走神经中来施用。本公开内容提供用于治疗受试者的疾病和/或病症的至少一种治疗有效量的第一基因疗法和至少一种治疗有效量的第二基因疗法,其中所述至少一种治疗有效量的第二基因疗法通过注射到受试者的迷走神经中而施用至所述受试者。本公开内容提供了至少一种治疗有效量的第一基因疗法和至少一种治疗有效量的第二基因疗法在制备用于治疗受试者的疾病和/或病症的药物中的用途,其中所述至少一种治疗有效量的第二基因疗法用于通过注射到受试者的迷走神经中而施用至所述受试者。在一些方面,迷走神经可以是左迷走神经。在一些方面,迷走神经可
以是右迷走神经。
[0212]
在前述方法和用途的一些方面,第一基因疗法和第二基因疗法可以是相同的。在前述方法和用途的一些方面,第一基因疗法和第二基因疗法可以是不同的。
[0213]
在前述方法的一些方面,第一基因疗法可以通过不是注射到受试者的迷走神经中的施用途径施用于受试者。在一些方面,第一基因疗法通过以下途径施用:静脉内、鞘内、脑内、心室内、鼻内、气管内、耳内、眼内或眼周、经口、经直肠、经粘膜、吸入、经皮、肠胃外、皮下、皮内、肌肉内、脑池内、神经内、胸膜内、局部、淋巴管内、脑池内或神经内。因此,在一个非限制性实例中,本公开内容提供了一种治疗受试者的疾病和/或病症的方法,包括施用:a)至少一种治疗有效量的第一基因疗法,其中所述至少一种治疗有效量的第一基因疗法通过鞘内施用给受试者;和b)至少一种治疗有效量的第二基因疗法,其中所述至少一种治疗有效量的第二基因疗法通过注射到受试者的迷走神经中而施用至所述受试者。
[0214]
本公开内容提供了治疗受试者的疾病和/或病症的方法,包括施用:a)至少一种治疗有效量的第一raav病毒载体;和b)至少一种治疗有效量的第二raav病毒载体,其中所述至少一种治疗有效量的第二raav病毒载体通过注射到受试者的迷走神经中来施用。本公开内容还提供了用于治疗受试者的疾病和/或病症的至少一种治疗有效量的第一raav病毒载体和至少一种治疗有效量的第二raav病毒载体,其中所述至少一种治疗有效量的第二raav病毒载体用于通过注射到受试者的迷走神经中而施用至所述受试者。本公开内容还提供了至少一种治疗有效量的第一raav病毒载体和至少一种治疗有效量的第二raav病毒载体在制备用于治疗受试者的疾病和/或病症的药物中的用途,其中所述至少一种治疗有效量的第二raav病毒载体用于通过注射到受试者的迷走神经中而施用至所述受试者。在一些方面,迷走神经可以是左迷走神经。在一些方面,迷走神经可以是右迷走神经。
[0215]
在前述方法的一些方面,第一raav病毒载体和第二raav病毒载体可以是相同的。在前述方法的一些方面,第一raav病毒载体和第二raav病毒载体可以是不同的。
[0216]
在前述方法的一些方面,第一raav病毒载体和第二raav病毒载体可以是相同的血清型。因此,在一个非限制性实例中,第一raav病毒载体包含aav9衣壳蛋白并且第二raav病毒载体包含aav9衣壳蛋白。
[0217]
在前述方法的一些方面,第一raav病毒载体通过不是注射到受试者的迷走神经中的施用途径施用于受试者。在一些方面,第一raav病毒载体通过如下途径施用:静脉内、鞘内、脑内、心室内、鼻内、气管内、耳内、眼内或眼周、经口、经直肠、经粘膜、吸入、经皮、肠胃外、皮下、皮内、肌肉内、脑池内、神经内、胸膜内、局部、淋巴管内、脑池内或神经内。因此,在一个非限制性实例中,本公开内容提供了治疗受试者的疾病和/或病症的方法,包括施用:a)至少一种治疗有效量的第一raav病毒载体,其中所述至少一种治疗有效量的第一raav病毒载体通过鞘内施用给受试者;和b)至少一种治疗有效量的第二raav病毒载体,其中将所述至少一种治疗有效量的第二raav病毒载体通过注射到受试者的迷走神经中而施用至所述受试者。
[0218]
在其中向受试者施用第一基因疗法和第二基因疗法(例如,第一raav病毒载体和第二raav病毒载体)的本公开内容的方法和用途的一些方面,第一基因疗法和第二基因疗法可以在时间上接近进行施用。
[0219]
如本文所用,术语“时间上接近”是指一种治疗组合物(例如,第一基因疗法)的施
用发生在施用另一种治疗组合物(例如,第二基因疗法)之前或之后的一段时间内,使得一种治疗剂的治疗效果与另一种治疗剂的治疗效果重叠。在一些实施方案中,一种治疗剂的治疗效果与另一种治疗剂的治疗效果完全重叠。在一些实施方案中,“时间上接近”是指一种治疗剂的施用发生在施用另一种治疗剂之前或之后的一段时间内,使得在一种治疗剂和另一种治疗剂之间存在协同效应。“时间上接近”可以根据多种因素而变化,包括但不限于,将向其施用治疗剂的受试者的年龄、性别、体重、遗传背景、医疗状况、疾病史和治疗史;要治疗或改善的疾病或病况;要达到的治疗结果;治疗剂的剂量、给药频率和给药持续时间;治疗剂的药代动力学和药效学;和施用治疗剂的途径。在一些实施方案中,“时间上接近”是指在15分钟内、30分钟内、一小时内、两小时内、四小时内、六小时内、八小时内、12小时内、18小时内、24小时内、36小时内、2天内、3天内、4天内、5天内、6天内、一周内、2周内、3周内、4周内、6周内或8周内。在一些实施方案中,“时间上接近”是指1个月内、2个月内、3个月内、4个月内、5个月内、6个月内、7个月内、8个月内、9个月内、10个月内、11个月或12个月内。在一些实施方案中,“时间上接近”是指1年内、2年内、3年内、4年内、5年内、6年内、7年内、8年内、9年内或10年内。在一些实施方案中,一种治疗剂的多次施用可以与另一种治疗剂的单次施用在时间上接近。在一些实施方案中,时间上接近可以在治疗周期期间改变或在给药方案内改变。
[0220]
在其中向受试者施用第一基因疗法和第二基因疗法(例如,第一raav病毒载体和第二raav病毒载体)的本公开内容的方法和用途的一些方面,所述第一基因疗法和第二基因疗法可以同时施用。
[0221]
在其中向受试者施用第一基因疗法和第二基因疗法(例如,第一raav病毒载体和第二raav病毒载体)的本公开内容的方法和用途的一些方面,所述第一基因疗法和第二基因疗法可以依次施用。
[0222]
在本公开内容的方法和用途的一些方面,基因疗法可以是根据本领域普通技术人员公知的标准方法设计的基因疗法,以治疗以下的至少一种或多种:脊髓性肌萎缩、friedrich共济失调、cln3 batten、cln6 batten、cln7 batten、癫痫性脑病、leigh综合征、进行性神经性腓骨肌萎缩症、巨轴索神经病、lafora病、slc13a5癫痫性脑病、先天性糖基化障碍iq型、kahrizi综合征、angelman综合征、rett综合征、痉挛性截瘫、儿童交替性偏瘫和zellweger谱系障碍。在一个非限制性实例中并且如本领域技术人员理解的,基因疗法可以是被设计用于递送编码治疗性蛋白质的核酸的基因疗法,其中治疗性蛋白质的表达导致治疗疾病和/或病症。在另一个非限制性实例中并且如本领域技术人员理解的,基因疗法可以是被设计用于递送调节性核酸(例如,sirna、mirna、反义寡核苷酸、shrna等)的基因疗法,所述调节性核酸上调或下调内源性核酸和/或蛋白质的表达和/或活性。
[0223]
基因疗法的非限制性实例包括基于病毒的基因疗法(例如,慢病毒载体、aav载体、腺病毒载体等)、非病毒基因疗法(例如,线性寡核苷酸、环状质粒、人类人工染色体)、基于crispr的基因疗法、基于反义寡核苷酸的基因疗法、纳米颗粒介导的基因疗法或本领域已知的任何其他基因疗法。基因疗法可以包括病毒载体(例如raav病毒载体)、质粒、噬菌体、细菌染色体、人工染色体、转座子或它们的任何组合。
[0224]
基因疗法可以包括基因表达盒。表达盒可以是环状或线性核酸分子。在一些情况下,在载体(例如,表达载体)中将表达盒递送至细胞(例如,多种不同的细胞或细胞类型,包
括靶细胞或细胞类型和/或非靶细胞类型)。可以设计基因表达盒以驱动基因的表达,例如密码子优化的基因。基因的实例在表1中示出。表达盒可用于研究和测试用于例如表1中所示的遗传疾病的基因取代策略。表达盒也可用于治疗由这些基因缺陷引起的病症、疾病或病况。
[0225]
基因表达盒可以在接收所述表达盒的细胞中表达功能基因。表达盒可以包括例如用于强、中或低水平表达的启动子。表达盒可以包括用于在许多或所有组织中表达的普遍存在的启动子。任何组织特异性启动子都可以包含在本文提供的表达盒中。本文提供的表达盒中包含的基因可以进行密码子优化以促进最佳基因表达。因此,基因序列可以是非天然存在的。
[0226]
在一些实施方案中,本文提供了包含编码与神经系统病症(参见例如表1)相关的基因的多核苷酸的表达盒。编码基因的多核苷酸可包含(i)例如表1中所示的多核苷酸,或(ii)与表1中所示基因具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性、至少99%同一性、至少99.5%同一性、至少99.9%同一性、以及介于其间的任何数量或范围的同一性的多核苷酸。在一个实施方案中,包含在本文提供的表达盒中的基因是人类基因。本文提供的表达盒中包含的基因可以是经密码子优化的。
[0227]
本文提供的表达盒还可包含驱动基因表达的启动子。可以使用任何启动子,包括例如普遍存在的启动子、组成型启动子、诱导型启动子和组织特异型启动子。可以使用来自任何物种的启动子,包括人、猿、猴、小鼠、大鼠、鸡等。在一个实施方案中,驱动基因表达的启动子是强的、普遍存在的启动子。在一个实施方案中,驱动基因表达的启动子是可以提供神经元特异性表达的启动子。
[0228]
可以在本文提供的表达盒中包括可以影响基因表达的其他调节元件和其他元件,例如kozak共有序列、多腺苷酸信号、例如腺相关病毒(aav)的5'和3'反向末端重复序列(itr)等。
[0229]
aav的反向末端重复序列(itr)是对称序列,每个序列约145个碱基。aav itr位于病毒基因组的5’和3’端。itr对于有效的aav基因组扩增很重要。itr序列可以在例如aav载体中的异源多核苷酸(即,不是aav来源的多核苷酸)的侧翼。
[0230]
可以在本文提供的表达盒中包含经突变的itr。可以使5’itr和/或3’itr突变。在一个实施方案中,5’itr是经突变的。在一个实施方案中,3’itr是经突变的。在一个实施方案中,5’itr和3’itr都是经突变的。itr可以突变为自互补。在一个实施方案中,3’itr经突变以实现自互补。
[0231]
在本公开内容的方法和用途的一些方面,迷走神经是左迷走神经。在本公开内容的方法和用途的一些方面,迷走神经是右迷走神经。
[0232]
在本公开内容的方法和用途的一些方面,raav病毒载体可以是本文所述的任何raav病毒载体,包括但不限于包含编码gan多肽的核酸序列的raav病毒载体。
[0233]
在一些方面,疾病和/或病症可以是涉及gan基因的遗传疾病。涉及gan基因的遗传疾病可以是gan缺失、功能失常和/或缺陷。
[0234]
在一些方面,所述疾病可以是涉及gan蛋白的疾病。涉及gan蛋白的遗传疾病可以是gan缺失、功能失常和/或缺陷。
[0235]
疾病和/或病症可以是巨轴索神经病。
[0236]
在一些方面,疾病和/或病症可以是特征在于受试者基因组中的至少一个gan基因拷贝的功能丧失的疾病和/或病症。在一些方面,疾病和/或病症可以是特征在于受试者基因组中的至少一个gan基因拷贝的功能降低的疾病和/或病症。在一些方面,疾病和/或病症可以是特征在于受试者基因组中的至少一个gan基因拷贝中的至少一个突变中的至少一个突变的疾病和/或病症。
[0237]
本文提供的方法中的受试者可能在gan基因和/或gan蛋白中有缺陷。如本文所用,“gan基因缺陷”是指受试者可能在gan基因中具有一个或多个突变或缺乏功能性gan基因。如本文所用,“gan蛋白缺陷”是指受试者可能在gan蛋白中具有一个或多个突变或缺乏功能性gan蛋白。
[0238]
gan基因或gan蛋白中的突变可以是本领域已知的任何类型的突变。突变的非限制性实例包括体细胞突变、单核苷酸变体(snv)、无义突变、插入、缺失、重复、移码突变、重复扩增、短插入和缺失(indel)、长indel、可变剪接、可变剪接的产物、翻译起始改变,翻译起始改变的产物,蛋白质组切割、蛋白质组切割的产物。
[0239]
在一些方面,疾病和/或病症可以是特征在于与没有所述疾病和/或病症的对照受试者相比受试者中gan基因表达降低的疾病和/或病症。在一些方面,表达降低可以是至少约10%、或至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%、或至少约95%、或至少约99%、或至少约100%。
[0240]
在一些方面,疾病和/或病症可以是特征在于与没有患有疾病和/或病症的对照受试者相比受试者中gan蛋白的量减少的疾病和/或病症。在一些方面,gan蛋白量的降低可以是至少约10%、或至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%、或至少约95%、或至少约99%、或至少约100%。
[0241]
在一些方面,疾病和/或病症可以是特征在于与没有所述疾病和/或病症的对照受试者相比受试者中gan蛋白的活性降低的疾病和/或病症。在一些方面,gan蛋白的活性降低可以是至少约10%、或至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%、或至少约95%、或至少约99%、或至少约100%。
[0242]
在本公开内容的方法和用途的一些方面,所述疾病和/或病症可以是神经系统的病症。
[0243]
在本公开内容的方法和用途的一些方面,所述疾病和/或病症可以是以下的一种或多种:脊髓性肌萎缩、friedrich共济失调、cln3batten、cln6 batten、cln7 batten、癫痫性脑病、leigh综合征、进行性神经性腓骨肌萎缩症、巨轴索神经病、lafora病、slc13a5癫痫性脑病、先天性糖基化障碍iq型、kahrizi综合征、angelman综合征、rett综合征、痉挛性截瘫、儿童交替性偏瘫和zellweger谱系障碍。示例性神经系统疾病(包括与疾病相关的示例性基因和多核苷酸)显示在下表1中。这些示例性基因和多核苷酸编码与一种或多种神经系统疾病相关的治疗性多肽。
[0244]
表1
[0245]
在一些方面,受试者可以小于0.5岁、或小于1岁、或小于1.5岁、或小于2岁、或小于2.5岁、或小于3岁、或小于3.5岁、或小于3.5岁、或小于4岁、或小于4.5岁、或小于5岁、或小于5.5岁、或小于6岁、或小于6.5岁、或小于7岁、或小于7.5岁、或小于8岁、或小于8.5岁、或小于9岁、或小于9.5岁、或小于10岁。在一些方面,受试者可以小于11岁、小于12岁、小于13岁、小于14岁、小于15岁、小于20岁、小于30岁、小于40岁、小于50岁、小于60岁、小于70岁、小于80岁、小于90岁、小于100岁、小于110岁或小于120岁。在一些方面,受试者可以小于0.5岁。在一些方面,受试者可以小于4岁。在一些方面,受试者可以小于10岁。
[0246]
本文公开的治疗和预防方法可以与适当的诊断技术相结合,以识别和选择患者进行治疗或预防。
[0247]
本公开内容提供增加宿主细胞中蛋白质水平的方法,包括使所述宿主细胞与本文公开的任何一种raav病毒载体接触,其中所述raav病毒载体包含本文公开的任何一种raav载体,其包含编码所述蛋白质的转基因核酸分子。在一些方面,蛋白质是治疗性蛋白质。在
一些方面,宿主细胞是体外的、体内的或离体的。在一些方面,宿主细胞来源于受试者。在一些方面,受试者患有病症,所述病症导致与正常受试者中蛋白质的水平和/或功能相比蛋白质水平和/或功能是降低的。
[0248]
在一些方面,在宿主细胞中,蛋白质的水平被增加至约1x10-7
ng、约3x10-7
ng、约5x10-7
ng、约7x10-7
ng、约9x10-7
ng、约1x10-6
ng、约2x10-6
ng、约3x10-6
ng、约4x10-6
ng、约6x10-6
ng、约7x10-6
ng、约8x10-6
ng、约9x10-6
ng、约10x10-6
ng、约12x10-6
ng、约14x10-6
ng、约16x10-6
ng、约18x10-6
ng、约20x10-6
ng、约25x10-6
ng、约30x10-6
ng、约35x10-6
ng、约40x10-6
ng、约45x10-6
ng、约50x10-6
ng、约55x10-6
ng、约60x10-6
ng、约65x10-6
ng、约70x10-6
ng、约75x10-6
ng、约80x10-6
ng、约85x10-6
ng、约90x10-6
ng、约95x10-6
ng、约10x10-5
ng、约20x10-5
ng、约30x10-5
ng、约40x10-5
ng、约50x10-5
ng、约60x10-5
ng、约70x10-5
ng、约80x10-5
ng或约90x10-5
ng的水平。
[0249]
本公开内容提供了将感兴趣的基因引入受试者的细胞的方法,包括使细胞与有效量的本文公开的任何一种raav病毒载体接触,其中raav病毒载体包含含有所述感兴趣的基因的本文公开的任何一种raav载体。
[0250]
在本公开内容的方法的一些方面,除了施用本公开内容的raav载体或raav病毒载体之外,还可以向受试者施用预防性免疫抑制剂治疗方案。在一些方面,免疫抑制剂治疗方案可以包括施用至少一种免疫抑制治疗剂。免疫抑制治疗剂的非限制性实例包括但不限于西罗莫司(雷帕霉素)、对乙酰氨基酚、苯海拉明、iv甲基泼尼松龙、泼尼松或其任何组合。免疫抑制治疗剂可以在施用raav载体和/或raav病毒载体的当天之前、与施用raav载体和/或raav病毒载体同一天、或施用raav载体和/或raav病毒载体之后的任何一天施用。
[0251]
诊断或治疗的“受试者”是细胞或动物,例如哺乳动物或人。受试者不限于特定物种,包括接受诊断或治疗的非人类动物和接受感染的那些或动物模型,包括但不限于猿、鼠、大鼠、犬科动物或兔科动物以及其他牲畜、运动动物或宠物。在一些方面,受试者是人。
[0252]
如本文所用,“治疗”或“医治”受试者的疾病是指(1)抑制所述疾病或阻止其发展;或者(2)改善所述疾病或疾病症状或导致其消退。如本领域所理解的,“治疗”是一种用于获得包括临床结果在内的有益或期望结果的方法。对于本技术的目的,有益或期望的结果可以包括以下的一种或多种但不限于此:一种或多种症状的减轻或改善、病况(包括疾病)程度的减轻、稳定(即,使其不恶化)病况(包括疾病)的状态、延迟或减缓病况(包括疾病)进展、改善或缓和病况(包括疾病)状态、和缓解(无论是部分还是全部),无论是可检测的还是不可检测的。
[0253]
如本文所用,疾病的“预防”或“防止”是指防止症状或疾病在易患或尚未表现出疾病症状的受试者中发生。
[0254]
如本文所用,术语“有效量”和/或“治疗有效量”意指足以实现所需效果的量。在治疗或预防应用的情况下,有效量将取决于所讨论病况的类型和严重程度以及个体受试者的特征,例如一般健康状况、年龄、性别、体重和对药物组合物的耐受性。在基因疗法的背景下,有效量可以是足以导致受试者中缺陷的基因恢复部分或全部功能的量。在一些方面,raav病毒载体的有效量是足以导致基因在受试者中表达从而产生gan多肽的量。在一些方面,有效量是在有需要的受试者中增加半乳糖代谢所需的量。本领域技术人员将能够根据这些和其他因素确定合适的量。
[0255]
在一些方面,有效量将取决于所讨论应用的大小和性质。它还将取决于目标受试者的性质和敏感性以及使用的方法。本领域技术人员将能够基于这些和其他考虑确定有效量。取决于实施方案,有效量可以包括组合物的一次或多次施用、基本上由其组成或由其组成。
[0256]
如本文所用,术语“施用”或“给药”意指将物质递送至受试者例如动物或人。施用可以在整个治疗过程中以一剂、连续或间断的方式进行。确定最有效的施用方式和施用剂量的方法是本领域技术人员已知的,并且会随着用于治疗的组合物、治疗的目的以及被治疗受试者的年龄、健康或性别而变化。可以进行单次或多次施用,剂量水平和模式由治疗医师选择,或者在宠物和其他动物的情况下,由治疗兽医选择。
[0257]
确定最有效的施用方式和施用剂量的方法是本领域技术人员已知的,并且会随着用于治疗的组合物、治疗的目的和被治疗的受试者而变化。可以进行单次或多次施用,剂量水平和模式由治疗医师选择。值得注意的是,剂量可能会受到施用途径的影响。合适的剂量制剂和施用方法是本领域已知的。这种合适剂量的非限制性实例可以低至每次施用109个载体基因组至多达10
17
个载体基因组。
[0258]
在本文所述的方法的一些方面,向受试者施用的病毒粒子(例如,raav病毒载体)的数量在从约109至约10
17
个的范围内。在一些方面,向受试者施用约10
10
至约10
12
、约10
11
至约10
13
、约10
11
至约10
12
、约10
11
至约10
14
、约10
12
至约10
16
、约10
13
至约10
16
、约10
14
至约10
15
、约5x10
11
至约5x10
12
、约10
11
至约10
18
、约10
13
至约10
16
或约10
12
至约10
13
个病毒粒子。
[0259]
在本文所述方法的一些方面,向受试者施用的病毒粒子(例如raav病毒载体)的数量为至少约10
10
、或至少约10
11
、或至少约10
12
、或至少约10
13
、或至少约10
14
、或至少约10
15
、或至少约10
16
、或至少约10
17
个病毒粒子。
[0260]
在本文所述方法的一些方面,向受试者施用的病毒粒子(例如raav病毒载体)的数量为约3.5x10
13
个病毒粒子。在本文所述的方法的一些方面,向受试者施用的病毒粒子(例如raav病毒载体)的数量为约3.5x10
14
个病毒粒子。在本文所述方法的一些方面,向受试者施用的病毒粒子(例如raav病毒载体)的数量为约3.5x10
13
至约3.5x10
14
个病毒粒子。
[0261]
在本文所述方法的一些方面,向受试者施用的病毒粒子(例如raav病毒载体)的数量可以取决于受试者的年龄。在非限制性实例中,7岁或以上的受试者可施用约10x10
14
个病毒粒子,约4岁至约7岁的受试者可施用约10x10
14
个病毒粒子,约3岁至约4岁的受试者可施用约9x10
14
个病毒粒子,约2岁至约3岁的受试者可施用约8.2x10
14
个病毒粒子,约1岁至约2岁的受试者可施用约7.3x10
14
个病毒粒子,约0.5岁至约1岁的受试者可施用约4x10
14
个病毒粒子,或小于0.5岁的受试者可施用3x10
14
个病毒粒子。
[0262]
在一些方面,组合物、药物组合物中病毒粒子的量或向患者施用的病毒粒子的量可以基于预计含有病毒基因组的病毒粒子的百分比来计算。
[0263]
在一些方面,本公开内容的raav病毒载体可以通过以下途径引入受试者:静脉内、鞘内、脑内、心室内、鼻内、气管内、耳内、眼内或眼周、经口、经直肠、经粘膜、吸入、经皮、肠胃外、皮下、皮内、肌肉内、脑池内、神经内、胸膜内、局部、淋巴管内、脑池内;这种引入还可以是动脉内、心脏内、心室下、硬膜外、脑内、脑室内、视网膜下、玻璃体内、关节内、腹膜内、子宫内、神经内或其任何组合。在一些方面,将病毒粒子递送至期望的靶组织,例如递送至肺、眼或cns,作为非限制性实例。在一些方面,病毒粒子的递送是全身性的。脑池内施用途
径包括将药物直接施用到脑室的脑脊液中。它可以通过直接注入小脑延髓池或通过永久定位的管来进行。在一些方面,本公开内容的raav病毒载体通过鞘内施用。
[0264]
在一些方面,本公开内容的raav病毒载体修复受试者中的基因缺陷。在一些方面,在成功治疗的细胞、组织、器官或受试者中,修复的靶多核苷酸或多肽与未修复的靶多核苷酸或多肽的比率为至少约1.5:1、约2:1、约3:1、约4:1、约5:1、约6:1、约7:1、约8:1、约9:1、约10:1、约20:1、约50:1、约100:1、约1000:1、约10,000:1、约100,000:1或约1,000,000:1。修复的靶多核苷酸或多肽的量或比例可以通过本领域已知的任何方法确定,包括但不限于蛋白质印迹、rna印迹、dna印迹、pcr、测序、质谱、流式细胞术、免疫组织化学、免疫荧光、荧光原位杂交、下一代测序、免疫印迹和elisa。
[0265]
本公开内容的raav载体、raav病毒载体、组合物或药物组合物的施用可以在整个治疗过程中以一剂、连续或间断的方式进行。在一些方面,本公开内容的raav载体、raav病毒载体、组合物或药物组合物通过注射、输注或植入以肠胃外方式施用。
[0266]
在一些方面,本公开内容的raav病毒载体显示出增强的对脑和颈椎的趋向性。在一些方面,本公开内容的raav病毒载体可以穿过血脑屏障(bbb)。
[0267]
制造方法
[0268]
可以使用多种方法来产生本公开内容的raav病毒载体。在一些方面,通过使用辅助病毒或辅助质粒和细胞系来实现包装。辅助病毒或辅助质粒包含促进病毒载体生产的元件和序列。在另一方面,辅助质粒稳定地掺入包装细胞系的基因组中,使得包装细胞系不需要用辅助质粒额外转染。
[0269]
在一些方面,细胞是包装或辅助细胞系。在一些方面,辅助细胞系是真核细胞;例如,hek 293细胞或293t细胞。在一些方面,辅助细胞是酵母细胞或昆虫细胞。
[0270]
在一些方面,细胞包含编码四环素激活蛋白的核酸,和调节四环素激活蛋白表达的启动子。在一些方面,调节四环素激活蛋白表达的启动子是组成型启动子。在一些方面,启动子是磷酸甘油酸激酶启动子(pgk)或cmv启动子。
[0271]
辅助质粒可以包含,例如,来源于不能复制的病毒基因组的至少一个病毒辅助dna序列,反式编码包装不能复制的aav所需的所有病毒体蛋白,并以高滴度产生能够包装不能复制的aav的病毒体蛋白,而不产生复制能力强的aav。
[0272]
用于包装aav的辅助质粒是本领域已知的,参见例如美国专利公开号2004/0235174a1,通过引用并入本文。如其中所述,aav辅助质粒可包含作为辅助病毒dna序列的如下非限制性实例:ad5基因e2a、e4和va,由它们各自的原始启动子或异源启动子控制。aav辅助质粒可以另外包含用于表达标记蛋白例如荧光蛋白的表达盒,以允许简单检测所需靶细胞的转染。
[0273]
本公开内容提供了产生raav病毒载体的方法,包括用本文公开的任何一种aav辅助质粒和本文公开的任何一种raav载体转染包装细胞系。在一些方面,将aav辅助质粒和raav载体共转染到包装细胞系中。在一些方面,细胞系是哺乳动物细胞系,例如人胚胎肾(hek)293细胞系。本公开内容提供了包含本文公开的任何一种raav载体和/或raav病毒载体的细胞。
[0274]
如本文所用,提及病毒或质粒的术语“辅助”是指用于提供复制和包装本文公开的任何一种raav载体所必需的附加组分的病毒或质粒。由辅助病毒编码的成分可以包括病毒
体组装、衣壳化、基因组复制和/或包装所需的任何基因。例如,辅助病毒或质粒可编码病毒基因组复制所必需的酶。适用于aav构建体的辅助病毒和质粒的非限制性实例包括phelp(质粒)、腺病毒(病毒)或疱疹病毒(病毒)。在一些方面,phelp质粒可以是phelpk质粒,其中氨苄青霉素表达盒与卡那霉素表达盒交换。
[0275]
如本文所用,包装细胞(或辅助细胞)是用于产生病毒载体的细胞。产生重组aav病毒载体需要反式提供的rep和cap蛋白以及来自腺病毒的帮助aav复制的基因序列。在一些方面,包装/辅助细胞含有稳定掺入细胞基因组中的质粒。在其他方面,包装细胞可以被瞬时转染。通常,包装细胞是真核细胞,例如哺乳动物细胞或昆虫细胞。
[0276]
试剂盒
[0277]
本文所述的分离的多核苷酸、raav载体、raav病毒载体、组合物和/或药物组合物可以组装成药物或诊断或研究试剂盒以促进它们在治疗、诊断或研究应用中的使用。在一些方面,本公开内容的试剂盒包括分离的多核苷酸、raav载体、raav病毒载体、组合物、药物组合物、宿主细胞、分离的组织中的任何一种,如本文所述。
[0278]
在一些方面,试剂盒还包括使用说明。具体而言,此类试剂盒可包括本文所述的一种或多种试剂,以及描述这些药剂的预期应用和正确使用的说明书。在一些方面,试剂盒可以包括用于混合试剂盒的一种或多种组分和/或分离和混合样品以及应用于受试者的说明。在一些方面,试剂盒中的试剂处于适合特定应用和适合试剂施用方法的药物制剂和剂量中。用于研究目的的试剂盒可能包含用于进行各种实验的适当浓度或数量的成分。
[0279]
试剂盒可以设计成便于使用本文所述的方法并且可以采用多种形式。在适用的情况下,试剂盒的每种组合物可以液体形式(例如,溶液形式)或固体形式(例如,干粉)提供。在某些情况下,一些组合物可以是可重构的或以其他方式可加工的(例如,加工为活性形式),例如,通过添加可能随试剂盒或者不随试剂盒一起提供的合适的溶剂或其他物质(例如,水或细胞培养基)。在一些方面,组合物可以在保存溶液(例如,冷冻保存溶液)中提供。保存溶液的非限制性实例包括dmso、多聚甲醛和(stem cell technologies,vancouver,canada)。在一些方面,保存溶液含有一定量的金属蛋白酶抑制剂。
[0280]
在一些方面,试剂盒在一个或多个容器中包含本文所述的任何一种或多种组分。因此,在一些方面,试剂盒可包括容纳本文所述试剂的容器。试剂可以是液体、凝胶或固体(粉末)的形式。试剂可以无菌制备、包装在注射器中并冷藏运输。可替代地,它们可以装在小瓶或其他容器中进行储存。第二个容器可以有其他无菌制备的试剂。可替代地,所述试剂盒可包括预先混合并在注射器、小瓶、管或其他容器中运输的活性剂。所述试剂盒可具有将药剂施用于受试者所需的一种或多种或所有组件,例如注射器、局部应用装置或iv针管和袋子。
[0281]
进一步定义
[0282]
除非上下文另有说明,否则本文所述的本发明的各种特征特别旨在可以以任何组合形式使用。此外,本公开内容还设想,在一些方面,可以被排除或省略本文阐述的任何特征或特征组合。为说明起见,如果说明书声明复合物包含组分a、b和c,则特别意在a、b或c中的任何一个或其组合可以单独或以任何组合被省略和放弃。
[0283]
除非另有明确说明,否则所有指定的方面、实施方案、特征和术语均意在包括所述的方面、实施方案、特征或术语及其生物学等价物。
[0284]
除非另有说明,否则本技术的实施将采用有机化学、药理学、免疫学、分子生物学、微生物学、细胞生物学和重组dna的常规技术,这些都在本领域技术范围内。参见例如sambrook,fritsch和maniatis,molecular cloning:a laboratory manual,第2版(1989);current protocols in molecular biology(fm ausubel等人编辑,(1987));酶学方法(methods in enzymology)系列(academic press,inc.):pcr 2:apractical approach(m.j.macpherson,b.d.hames和g.r.taylor编辑(1995));harlow和lane编辑(1988)antibodies,a laboratory manual,and animal cell culture(ri.freshney编辑(1987))。
[0285]
如本文所用,术语“包括”旨在表示组合物和方法包括所列举的要素,但不排除其他要素。如本文所用,过渡短语“基本上由
…
组成”(和类似表达)应解释为包括所列举的材料或步骤以及不实质上影响所述实施方案的基本和新颖特征的那些材料或步骤。因此,如本文使用的术语“基本上由
…
组成”不应解释为等同于“包括”。“由
…
组成”是指不包括多于痕量要素的其他成分和用于施用本文公开的组合物的主要方法步骤。这些过渡术语中的每一个定义的方面都在本公开内容的范围内。在本文的每个实例中,术语“包括”、“基本上由
…
组成”和“由
…
组成”中任一者都可以用其他两个术语中的任一者替换,同时保留它们的普通含义。本文所述的任何单个术语、单个要素、单个短语、术语组、短语组或要素组均可以具体地排除在权利要求之外。
[0286]
所有数字指称,例如ph值、温度、时间、浓度和分子量(包括其范围),都是近似值,其根据需要以1.0或0.1的增量变化( )或(-),或者,可替代地通过以 /-15%、10%、5%、2%变化。应当理解,尽管并不总是明确说明,所有数字指称都冠以术语“约”。还应理解,尽管并不总是明确说明,本文所述的试剂仅是示例性的并且其等价物在本领域中是已知的。如本文所用,术语“约”在提及可测量值例如量或浓度等时,意在涵盖指定量的20%、10%、5%、1%、0.5%或甚至0.1%的变化。
[0287]
术语“可接受的”、“有效的”或“足够的”当用于描述本文公开的任何组分、范围、剂型等的选择时,意指所述组分、范围、剂型等适用于所公开的目的。
[0288]
此外,如本文所用,“和/或”是指并涵盖一个或多个相关列出项目的任何和所有可能组合,以及在以选择性进行解释(“或”)时不包括组合。
[0289]
除非特别说明,否则术语“宿主细胞”包括真核宿主细胞,包括例如真菌细胞、酵母细胞、高等植物细胞、昆虫细胞和哺乳动物细胞。真核宿主细胞的非限制性实例包括猿、牛、猪、鼠、大鼠、鸟类、爬行动物和人细胞,例如hek293细胞和293t细胞。
[0290]
如本文所用,术语“分离的”是指基本上不含其他材料的分子或生物制品或细胞材料。
[0291]
如本文所用,术语“核酸序列”和“多核苷酸”可互换使用以指代任何长度的核苷酸(核糖核苷酸或脱氧核糖核苷酸)的聚合形式。因此,该术语包括但不限于单链、双链或多链dna或rna、基因组dna、cdna、dna-rna杂合体,或包含嘌呤和嘧啶碱基或其他天然的、化学或生物化学修饰的、非天然的或衍生化的核苷酸碱基的聚合物或基本上由其组成或由其组成的聚合物。
[0292]“基因”是指包含至少一个能够编码特定多肽或蛋白质的开放阅读框(orf)的多核苷酸。“基因产物”或替代表达“基因表达产物”是指当基因被转录和翻译时产生的氨基酸序
列(例如,肽或多肽)。
[0293]
如本文所用,“表达”是指多核苷酸转录成mrna的两步过程和/或转录的mrna随后翻译成肽、多肽或蛋白质的过程。如果多核苷酸来源于基因组dna,表达可以包括真核细胞中mrna的剪接。
[0294]“在转录控制下”是本领域熟知的术语,表示多核苷酸序列(通常是dna序列)的转录取决于其与有助于启动或促进转录的元件的可操作地连接。“可操作地连接”意指多核苷酸以允许它们在细胞中起作用的方式排列。一方面,启动子可以与下游序列可操作地连接。
[0295]
当应用于多核苷酸和/或核酸序列时,术语“编码”是指,如果多核苷酸和/或核酸序列的碱基序列与被翻译成多肽和/或其片段的rna转录物(例如mrna转录物)的碱基序列相同,则称其“编码”所述多肽。反义链是这种核酸的互补链,可以由此推导出编码序列。
[0296]
术语“蛋白质”、“肽”和“多肽”可互换使用并且在其最广义上是指氨基酸、氨基酸类似物或肽模拟物的两个或更多个亚基的化合物。亚基可以通过肽键连接。在另一方面,亚基可以通过其他键连接,例如酯、醚等。蛋白质或肽必须包含至少两个氨基酸,并且对蛋白质或肽的序列可以包含的、基本上组成蛋白质或肽的序列、或组成蛋白质或肽的序列的氨基酸的最大数量没有限制。如本文所用,术语“氨基酸”是指天然和/或非天然或合成氨基酸,包括甘氨酸以及d和l旋光异构体、氨基酸类似物和肽模拟物。
[0297]
如本文所用,术语“信号肽”或“信号多肽”意指通常存在于新合成的分泌或膜多肽或蛋白质的n-末端的氨基酸序列。它起到将多肽引导至特定细胞位置的作用,例如穿过细胞膜、进入细胞膜或进入细胞核。在一些方面,信号肽在定位后被去除。信号肽的实例是本领域众所周知的。非限制性实例是美国专利号8,853,381、5,958,736和8,795,965中描述的那些。在一些方面,信号肽可以是idua信号肽。
[0298]
术语“等价物”或“生物等价物”在指代特定分子、生物材料或细胞材料时可互换使用,意指具有最小同源性同时仍保持所需结构或功能的那些。等价物多肽的非限制性实例包括与参考多肽(例如,野生型多肽)具有至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%同一性或至少约99%同一性的多肽;或由与参考多核苷酸(例如,野生型多核苷酸)具有至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%同一性、至少约97%序列同一性或至少约99%序列同一性的多核苷酸编码的多肽。
[0299]“同源性”或“同一性”或“相似性”是指两个肽之间或两个核酸分子之间的序列相似性。同一性百分比可以通过比较每个序列中的可为了比较目的而被比对的位置来确定。当所比较序列中的一个位置被相同的碱基或氨基酸占据时,则分子在该位置是相同的。序列之间的同一性程度是序列共享的匹配位置数量的函数。“不相关”或“非同源”序列与本公开内容的序列之一共享小于40%的同一性、小于25%的同一性。可以通过将本文提供的核酸或氨基酸序列输入并使用clustalw(可在https://genome.jp/tools-bin/clustalw/获得)来确定所述核酸或氨基酸序列的比对和序列同一性百分比。例如,用于执行本文发现的蛋白质序列比对的clustalw参数是使用gonnet(用于蛋白质)权重矩阵生成的。在一些方面,用于使用本文发现的核酸序列进行核酸序列比对的clustalw参数是使用clustalw(用于dna)权重矩阵生成的。
[0300]
如本文所用,氨基酸修饰可以是氨基酸置换、氨基酸缺失或氨基酸插入。氨基酸置
换可以是保守氨基酸置换或非保守氨基酸置换。保守取代(也称为保守突变、保守置换或保守变异)是将蛋白质中的给定氨基酸改变为具有相似生化特性(例如电荷、疏水性或大小)的不同氨基酸的氨基酸置换。如本文所用,“保守变异”是指氨基酸残基被另一个生物学上相似的残基取代。保守变异的实例包括用一个疏水残基如异亮氨酸、缬氨酸、亮氨酸或甲硫氨酸置换另一个;或用一个带电或极性残基置换另一个,例如用精氨酸置换赖氨酸、用谷氨酸置换天冬氨酸、用谷氨酰胺置换天冬酰胺等。保守置换的其他说明性实例包括如下变化:丙氨酸到丝氨酸、天冬酰胺到谷氨酰胺或组氨酸、天冬氨酸到谷氨酸、半胱氨酸到丝氨酸、甘氨酸到脯氨酸、组氨酸到天冬酰胺或谷氨酰胺、赖氨酸到精氨酸、谷氨酰胺或谷氨酸、苯丙氨酸到酪氨酸、丝氨酸到苏氨酸、苏氨酸到丝氨酸、色氨酸到酪氨酸、酪氨酸到色氨酸或苯丙氨酸、等等。
[0301]
可以使用基因递送媒介物将本文公开的多核苷酸递送至细胞或组织。本文使用的“基因递送”、“基因转移”、“转导”等是指将外源性多核苷酸(有时称为“转基因”)导入宿主细胞的术语,而无论用于导入的方法如何。此类方法包括多种众所周知的技术,例如载体介导的基因转移(通过例如病毒感染/转染,或各种其他基于蛋白质或基于脂质的基因递送复合物)以及促进“裸”多核苷酸递送的技术(例如电穿孔、“基因枪”递送和用于导入多核苷酸的各种其他技术)。导入的多核苷酸可以稳定地或瞬时地维持在宿主细胞中。稳定维持通常需要导入的多核苷酸包含一个能够与宿主细胞相容的复制起点或整合到宿主细胞的复制子中,例如染色体外复制子(例如质粒)或核或线粒体染色体。已知许多载体能够介导基因向哺乳动物细胞的转移,如本领域已知和本文所述。
[0302]“质粒”是通常与染色体dna分离并且能够独立于染色体dna进行复制的dna分子。在许多情况下,它是环状和双链的。质粒为微生物群体内的水平基因转移提供了一种机制,并且通常在给定的环境状态下提供选择性优势。质粒可能携带在竞争环境中对天然抗生素产生抗性的基因,或者,可替代地,所产生的蛋白质在类似情况下可能充当毒素。本领域已知,虽然质粒载体通常作为染色体外环状dna分子存在,但质粒载体也可以被设计成随机或以靶向方式稳定整合到宿主染色体中,并且这种整合可以使用环状质粒或在引入宿主细胞之前已线性化的质粒来实现。
[0303]
基因工程中使用的“质粒”称为“质粒载体”。可商购获得许多质粒用于此类用途。将要复制的基因插入到包含使细胞对特定抗生素产生抗性的基因和多克隆位点(mcs,或多接头)的质粒副本中,多克隆位点是包含几个常用限制性位点(允许在这个位置轻松插入dna片段)的短区域。质粒的另一个主要用途是制造大量蛋白质。在这种情况下,研究人员培养含有质粒的细菌或真核细胞,所述质粒含有感兴趣的基因,其可以被诱导而从插入的基因中产生大量蛋白质。
[0304]
在基因转移由dna病毒载体(例如腺病毒(ad)或腺相关病毒(aav))介导的方面,载体构建体是指包含病毒基因组或其部分和转基因的多核苷酸,基本上由其组成或由其组成的多核苷酸。
[0305]
术语“组织”在本文中用于指活的或死去的生物体的组织或源自或设计成模拟活的或死去的生物体的任何组织。组织可能是健康的、患病的和/或具有基因突变。生物组织可以包括任何单个组织(例如,可以相互连接的细胞集合),或者构成有机体的器官或身体的部分或区域的一组组织。组织可以包括均质细胞材料、基本上由其组成或由其组成,或者
可以是复合结构,例如在包括胸部的身体区域中发现的复合结构,例如可以包括肺组织、骨骼组织和/或肌肉组织。示例性组织包括但不限于源自肝、肺、甲状腺、皮肤、胰腺、血管、膀胱、肾、脑、胆管、十二指肠、腹主动脉、髂静脉、心脏和肠的组织,包括其任何组合。
实施例
[0307]
实施例1—通过迷走神经施用基因疗法导致自主神经系统中的外源性蛋白质表达
[0308]
以下非限制性实施例证明,通过迷走神经施用raav病毒载体导致在自主神经系统中的外源性蛋白质表达。
[0309]
将包含编码gfp报告蛋白的核酸序列的aav9病毒载体注射到大鼠的左迷走神经中。然后通过荧光显微镜评估gfp表达。如图1所示,在连接中枢神经系统和外周神经系统的迷走神经回路中观察到gfp表达,包括在迷走神经(图1中用箭头表示)、迷走神经背侧运动核(图1中用*表示)和模糊核(在图1中用星号表示)中。这些结果表明,通过迷走神经施用基因疗法(例如,raav病毒载体)可以用于有效地将基因疗法靶向到受试者的自主神经系统,从而允许外源性蛋白质和/或核酸表达。
[0310]
实施例2—通过迷走神经施用基因疗法导致外源性蛋白质表达,即使在对基因疗法预先免疫的受试者中也是如此
[0311]
以下非限制性实施例表明,通过迷走神经施用raav病毒载体导致外源性蛋白质表达,即使在已经对raav病毒载体预先免疫(即具有针对raav病毒载体的中和抗体和/或对具有相同血清型的aav粒子呈血清阳性)的受试者中也是如此。
[0312]
在第一个实验中,通过鞘内注射包含编码巨轴突蛋白(gan)多肽的核酸的aav9病毒载体,对大鼠进行aav9病毒载体的预先免疫。随后通过注射到左迷走神经中向大鼠施用包含编码gfp报告蛋白的核酸的aav9病毒载体。然后分析gfp表达。如图2所示。在包括左侧结节神经节的神经元细胞体(图2的左图)和左侧颈迷走神经纤维(图2的右图)在内的外周神经系统中观察到强的gfp表达。
[0313]
在第二个实验中,大鼠不经处理(以下称为“未免疫大鼠”),或者通过aav9病毒载体的鞘内表达对aav9病毒载体进行预先免疫(以下称为“免疫大鼠”)。随后通过注射到左迷走神经中向大鼠施用包含编码gfp报告蛋白的核酸的aav9病毒载体。然后分析gfp表达。如图3所示,即使在预先免疫的大鼠(右图)中也观察到强的gfp表达,包括在迷走神经背侧运动核(在图3中表示为“dmn x”)和孤束核(在图3中表示为“sol n lat”)中的表达。
[0314]
这些结果表明,在可能具有针对特定血清型aav粒子的中和抗体的受试者中(例如,由于先前施用了基于aav的基因疗法),随后通过迷走神经施用基于aav的基因疗法可以避免治疗中和并有效驱动外源蛋白表达。
[0315]
实施例3—通过迷走神经施用基因疗法有效治疗巨轴索神经病大鼠模型中的自主神经功能障碍
[0316]
以下是非限制性实施例,证明通过注射到迷走神经中施用raav病毒载体可以有效治疗巨轴索神经病,更具体地,治疗与巨轴索神经病相关的自主神经功能障碍。
[0317]
在以下实验中,测试了巨轴索神经病的大鼠模型。通过将编码突变gan多肽的基因引入大鼠建立巨轴索神经病大鼠模型。这些大鼠在本文中称为gan敲入(ki)大鼠。
[0318]
在四个月大时,gan ki大鼠:a)用媒介物对照处理(以下称为“gan ki”);b)通过鞘
内注射用包含编码gan多肽(aav9/gan)的核酸的aav9病毒载体处理(以下称为“gan ki it”);或c)用通过鞘内注射并通过注射到左迷走神经中施用的aav9/gan处理(以下称为“gan ki it vn”)。在20个月大时,大鼠随后接受1mg/kg毛果芸香碱的腹膜内注射,并使用植入大鼠的无线遥测装置记录与自主神经功能相关的生理反应。该分析的结果示于图4中。
[0319]
如图4所示,与对照大鼠相比,当用毛果芸香碱处理攻击时,gan ki大鼠在呼吸(图4的左图)、血压(图4的中图)和心率(图4的右图)方面表现出自主反应的异常调节。相比之下,aav9/gan的仅it递送(gan ki it)改善了呼吸和血压。与对照的野生型大鼠相比,aav9/gan的it vn联合递送(gan ki it vn)显示出比单独使用it更大的功效,呼吸、血压和心率反应正常化。分析了4只对照大鼠并分析了每个处理组的5只gan ki大鼠。
[0320]
这些结果表明,通过注射到迷走神经中施用包含编码gan多肽的核酸的raav病毒载体可以有效地治疗巨轴索神经病,更具体地,治疗与巨轴索神经病相关的自主神经功能障碍,包括在将通过迷走神经的施用与raav病毒载体的鞘内施用联合使用时。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。