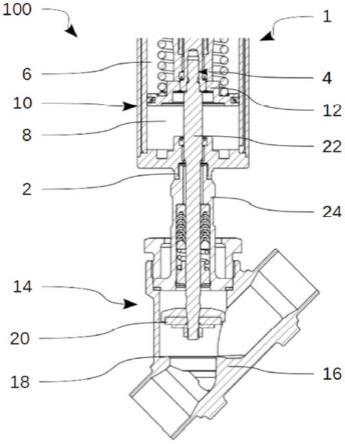
包含环状rna分子的制剂在制备治疗肿瘤的药物中的应用
技术领域
1.本公开属于生物医药领域,具体来说,本公开涉及一种包含环状rna分子的制剂在制备用于预防或治疗肿瘤的药物中的应用,包含环状rna分子的制剂,药物组合物以及预防或治疗肿瘤的方法。
背景技术:
2.近年来,肿瘤免疫治疗(cancer immunotherapy,cit)开辟了肿瘤治疗的新领域,由于其能有效弥补了传统治疗方法的一些缺陷并为肿瘤的治疗提供了新的思路和方向,因此,肿瘤免疫治疗成为是继传统的手术、化疗、放疗之后的最有效的肿瘤治疗方法。
3.目前,肿瘤免疫治疗主要包括免疫检查点抑制剂、过继免疫治疗、治疗性抗体、疫苗等。免疫检查点抑制剂(immune checkpoint inhibitor,ici)通过解除肿瘤细胞对t细胞的抑制作用,从而增强t细胞的杀伤性,并在多种肿瘤临床实验中显示出了明显的优势。过继性细胞疗法(adoptive cell therapy,act)是将il-2、ifn、tnf、gm-csf等细胞因子,或dc、cik、ctl等免疫细胞回输到患者体内,以增强患者免疫功能、实现抑制和杀伤肿瘤的作用。肿瘤免疫治疗虽然为肿瘤临床治疗开辟了新的治疗途径,但也存在一定局限性,例如,免疫检查点抑制剂比如pd-1抗体和ctla-4抗体在临床上应用很广泛,但是只有一部分病人对其响应,存在较大的个体间治疗差异。此外,系统给药的免疫治疗手段会引起免疫相关副作用(immune-related adverse events,iraes),比如高剂量注射细胞因子il-2会引起毛细管渗漏和败血症样综合征,过继细胞治疗如car-t会引起细胞因子风暴和免疫效应细胞相关神经毒性综合征(immune effector cell-associated neurotoxicity syndrome,icans)。而依赖于肿瘤新生抗原或者肿瘤相关抗原(tumor-associated antigen,taa)的肿瘤疫苗或者树突状细胞治疗,需要前期花费较高成本进行表征,并且新生抗原存在较大的个体差异性,使疫苗的设计和应用都具有一定挑战。
4.瘤内免疫治疗(intratumoral immunotherapy)包含原位免疫(in situ vaccination)和原位免疫调节(in situ immunization),是将发挥免疫激活/调节的药物直接递送到肿瘤内部。通过瘤内递送药物可降低药物产生系统性irae的可能性,提高药物递送的安全性,实现肿瘤局部高药物浓度、提高药品的生物利用度。目前,适合瘤内免疫治疗的药物有模式识别受体激动剂,比如toll样受体激动剂,溶瘤病毒,免疫检查点抑制剂,细胞因子,免疫细胞纳米药物等。开发更多适合瘤内免疫治疗的药物,提高肿瘤免疫治疗的效果,扩宽肿瘤免疫治疗的临床应用前景,是当前亟需解决的重要问题。
技术实现要素:
5.发明要解决的问题
6.鉴于现有技术中存在的问题,例如,需要开发更多适合瘤内免疫治疗的药物。为此,本公开提供了一种包含环状rna分子的制剂在制备用于预防或治疗肿瘤的药物中的应用。本公开首次发现了环状rna分子适合作为肿瘤免疫治疗药物,能够有效减缓肿瘤生长速
度,实现抑制、杀伤肿瘤的体内免疫治疗效果,在肿瘤的临床治疗中具有广阔的应用前景。
7.用于解决问题的方案
8.第一方面,本公开提供了一种包含环状rna分子的制剂在制备用于预防或治疗肿瘤的药物中的应用,其中,所述环状rna分子编码具有肿瘤免疫治疗活性的多肽。
9.在一些实施方式中,根据本公开所述的应用,其中,所述环状rna分子为未包裹的环状rna分子。
10.在一些实施方式中,根据本公开所述的应用,其中,所述包含环状rna分子的制剂为注射剂;优选地,所述注射剂还包含用于溶解所述环状rna分子的溶剂;更优选地,所述注射剂由环状rna分子和溶解所述环状rna分子的溶剂组成。
11.在一些实施方式中,根据本公开所述的应用,其中,所述环状rna分子包括编码所述具有肿瘤免疫治疗活性的多肽的编码区,和与所述编码区可操作地连接的ires元件;
12.优选地,所述ires元件包含如下(i)-(iv)组成的组中的任一项:
13.(i)包含如seq id no:11-14任一序列所组成的组中的一种或多种序列的核苷酸序列;
14.(ii)包含如seq id no:11-14任一序列所示的序列的反向互补序列的核苷酸序列;
15.(iii)在高严格性杂交条件或非常高严格性杂交条件下,能够与(i)或(ii)所示的核苷酸序列杂交的序列的反向互补序列;
16.(iv)与(i)或(ii)所示的核苷酸序列具有至少90%,可选至少95%,优选至少97%,更优选至少98%,最优选至少99%的序列同一性的序列;
17.优选地,所述ires元件选自如下(a1)-(a7)中的任一项:
18.(a1)包含如seq id no:11所示序列的核苷酸序列;
19.(a2)包含如seq id no:12所示序列的核苷酸序列;
20.(a3)包含如seq id no:13所示序列的核苷酸序列;
21.(a4)包含如seq id no:14所示序列的核苷酸序列;
22.(a5)包含如seq id no:15所示序列的核苷酸序列;
23.(a6)包含如seq id no:16所示序列的核苷酸序列;
24.(a7)包含如seq id no:17所示序列的核苷酸序列。
25.在一些实施方式中,根据本公开所述的应用,其中,所述环状rna分子还包括位于所述ires元件上游的5’间隔区,和位于所述编码区下游的3’间隔区;
26.优选地,所述5’间隔区包含如下(b1)-(b2)中任一项所示的序列:
27.(b1)如seq id no:20-21任一序列所示的核苷酸序列;
28.(b2)与(b1)所示的核苷酸序列具有至少90%,可选至少95%,优选至少97%,更优选至少98%,最优选至少99%的序列同一性的序列;
29.优选地,所述3’间隔区包含如下(c1)-(c2)中任一项所示的序列:
30.(c1)如seq id no:22-23任一序列所示的核苷酸序列;
31.(c2)与(c1)所示的核苷酸序列具有至少90%,可选至少95%,优选至少97%,更优选至少98%,最优选至少99%的序列同一性的序列。
32.在一些实施方式中,根据本公开所述的应用,其中,所述环状rna分子还包括位于
所述5’间隔区上游的第二外显子,和位于所述3’间隔区下游的第一外显子;
33.优选地,所述第二外显子包含如下(d1)-(d2)中任一项所示的序列:
34.(d1)如seq id no:19所示的核苷酸序列;
35.(d2)与(d1)所示的核苷酸序列具有至少90%,可选至少95%,优选至少97%,更优选至少98%,最优选至少99%的序列同一性的序列;
36.优选地,所述第一外显子包含如下(e1)-(e2)中任一项所示的序列:
37.(e1)如seq id no:18所示的核苷酸序列;
38.(e2)与(e1)所示的核苷酸序列具有至少90%,可选至少95%,优选至少97%,更优选至少98%,最优选至少99%的序列同一性的序列。
39.在一些实施方式中,根据本公开所述的应用,其中,所述包含环状rna分子的制剂通过瘤内给药施用于受试者体内;优选地,所述包含环状rna分子的制剂通过瘤内注射给药施用于受试者体内。
40.在一些实施方式中,根据本公开所述的应用,其中,所述环状rna分子包含编码所述具有肿瘤免疫治疗活性的多肽的编码区,其中,所述具有肿瘤免疫治疗活性的多肽选自如下的一种或多种:细胞因子、抗原结合片段、免疫检查点抑制剂;
41.可选地,所述细胞因子选自il、ifn、tnf、gm-csf、m-csf中的一种或多种;
42.可选地,所述抗原结合片段与如下的一种或多种肿瘤抗原特异性结合:cd19、cd20、cd22、cd30、cd33、cd38、cd123、cd138、cd171、afp、cea、psca、gd2、nkg2d、bcma、egfr、her2、egfrvⅲ、cd171、fap、il13rα2、vegfr1、vegfr2、gpc-3、mesothelin、claudin 18.2、epcam、muc1、muc16、epha2、epha3、cd133、psma;
43.可选地,所述免疫检查点抑制剂为如下一种或多种免疫检查点蛋白抑制剂:pd-1、pd-l1、pdl2、ctla4、lag3、tim3、tigit和cd103。
44.在一些实施方式中,根据本公开所述的应用,其中,所述编码区编码如下一种或多种的细胞因子:il-15、il-12、ifn alpha-2b、gm-csf;
45.优选地,所述il-15包含如下(j1)-(j2)任一项所示的序列:
46.(j1)如seq id no:1所示的氨基酸序列,
47.(j2)如seq id no:1所示氨基酸序列经过取代、重复、缺失或添加一个或多个氨基酸,且具有il-15的细胞因子活性的多肽;
48.优选地,所述il-12包含如下(k1)-(k2)任一项所示的序列:
49.(k1)如seq id no:2所示的氨基酸序列,
50.(k2)如seq id no:2所示氨基酸序列经过取代、重复、缺失或添加一个或多个氨基酸,且具有il-12的细胞因子活性的多肽;
51.优选地,所述ifn alpha-2b包含如下(l1)-(l2)任一项所示的序列:
52.(l1)如seq id no:3所示的氨基酸序列,
53.(l2)如seq id no:3所示氨基酸序列经过取代、重复、缺失或添加一个或多个氨基酸,且具有ifn alpha-2b的细胞因子活性的多肽;
54.优选地,所述gm-csf包含如下(m1)-(m2)任一项所示的序列:
55.(m1)如seq id no:4所示的氨基酸序列,
56.(m2)如seq id no:4所示氨基酸序列经过取代、重复、缺失或添加一个或多个氨基
酸,且具有gm-csf的细胞因子活性的多肽。
57.在一些实施方式中,根据本公开所述的应用,其中,所述制剂包含如下(g1)-(g4)的一种或多种的环状rna分子:
58.(g1)与seq id no:7所示核苷酸序列具有至少90%,可选至少95%,优选至少97%,更优选至少98%,最优选至少99%的序列同一性的环状rna分子;
59.(g2)与seq id no:8所示核苷酸序列具有至少90%,可选至少95%,优选至少97%,更优选至少98%,最优选至少99%的序列同一性的环状rna分子;
60.(g3)与seq id no:8所示核苷酸序列具有至少90%,可选至少95%,优选至少97%,更优选至少98%,最优选至少99%的序列同一性的环状rna分子;
61.(g4)与seq id no:8所示核苷酸序列具有至少90%,可选至少95%,优选至少97%,更优选至少98%,最优选至少99%的序列同一性的环状rna分子。
62.在一些实施方式中,根据本公开所述的应用,其中,所述包含环状rna分子的制剂在制备如下(f1)-(f3)至少一种药物中的应用:
63.(f1)抑制或杀伤肿瘤细胞的药物,
64.(f2)在受试者中诱导抗肿瘤免疫应答的药物,
65.(f3)降低或消除肿瘤免疫抑制微环境的药物。
66.在一些实施方式中,根据本公开所述的应用,其中,所述包含环状rna分子的制剂还包含肿瘤治疗剂,其中,所述肿瘤治疗剂选自放疗剂、化疗剂、免疫调节剂、细胞毒性剂、抗体、疫苗中的一种或多种;
67.优选地,所述肿瘤治疗剂为免疫调节剂;更优选地,所述免疫调节剂为免疫检查点抑制剂。
68.第二方面,本公开提供了一种包含环状rna分子的制剂,其用于预防或治疗肿瘤,所述包含环状rna分子的制剂如第一方面中所定义;优选地,所述包含环状rna分子的制剂为注射剂;优选地,所述包含环状rna分子的制剂通过瘤内给药施用于受试者体内;更优选地,所述包含环状rna分子的制剂是向瘤内注射施用的注射剂。
69.第三方面,本公开提供了一种药物组合物,其用于预防或治疗肿瘤,其中,所述药物组合物包括:
70.(h1)包含环状rna分子的制剂,所述包含环状rna分子的制剂如第一方面中所定义;
71.(h2)肿瘤治疗剂,所述肿瘤治疗剂如第一方面中所定义。
72.第四方面,本公开提供了一种预防或治疗肿瘤的方法,其中,所述方法包括向受试者施用包含环状rna分子的制剂,其中,所述包含环状rna分子的制剂如第一方面中所定义;
73.可选地,所述施用方式选自口服、腹膜内、静脉内、动脉内、肌肉内、皮内、皮下、经皮、鼻腔、经直肠,瘤内注射、神经鞘内注射、蛛网膜下腔注射或系统性施用;
74.优选地,所述施用方式为瘤内注射施用。
75.发明的效果
76.在一些实施方式中,本公开首次发现了编码具有肿瘤免疫治疗活性的多肽的环状rna分子能够有效抑制抑制肿瘤生长,发挥抑制、杀伤肿瘤的体内治疗效果。本公开提供过的包含环状rna分子的制剂适合作为肿瘤免疫治疗药物,在肿瘤的临床治疗中具有广阔的
应用前景。
77.在一些实施方式中,本公开的包含环状rna分子的制剂通过瘤内给药的方式施用于受试者体内,瘤内给药能够实现环状rna分子的高效表达,进而发挥高效的肿瘤杀伤、抑制效果。
78.在一些实施方式中,本公开的包含环状rna分子的制剂为注射剂,能够通过瘤内注射给药的方式被施用于受试者体内,实现向肿瘤患者体内的高效递送,且保持环状rna分子的表达稳定性、持久性和高效性,充分发挥对活体肿瘤的免疫治疗效果。
79.在一些实施方式中,本公开首次证实瘤内注射环状mrna进行免疫治疗,可将肿瘤变为疫苗,促进机体产生针对肿瘤细胞的特异性免疫反应,产生远隔效应,有效抑制肿瘤转移。
80.在一些实施方式中,本公开中包含环状rna分子的制剂,不需要以脂质体材料进行包裹,即具有较高的稳定性,能够实现向肿瘤瘤体内的高效递送,进而有效发挥肿瘤杀伤、抑制的效果。
81.在一些实施方式中,本公开提供的环状rna分子,与线性mrna分子相比具有更好的蛋白翻译水平、蛋白表达持久性,以及更为优异的肿瘤杀伤、抑制效果;并且环状rna分子不需要进行加帽、加poly(a)尾、核苷酸修饰等步骤,生产工艺简单、生产成本降低。
82.在一些实施方式中,本公开通过联合施用环状rna分子与免疫检查点抑制剂,两者协同作用,能够有效激活体内免疫反应,促进免疫细胞浸润肿瘤,有效激活机体抗肿瘤的免疫应答,提高肿瘤治疗效果。
附图说明
83.图1示出了不同给药途径对环状mrna表达的影响,(a)瘤内注射环状luciferase mrna;(b)肿瘤周围皮下注射环状luciferase mrna;正常野生型小鼠(c)肿瘤周围皮内注射环状luciferase mrna;(d)肌肉注射环状luciferase mrna;(e)腹腔注射环状luciferase mrna;(f)尾静脉注射环状luciferase mrna。
84.图2示出了在多种肿瘤模型上验证环状mrna的表达。(a)a549肿瘤模型小鼠,瘤内注射环状firefly luciferase mrna;(b)h358肿瘤模型小鼠,瘤内注射环状firefly luciferase mrna;(c)b16f10肿瘤模型小鼠,瘤内注射环状firefly luciferase mrna;(d)mc38肿瘤模型小鼠,瘤内注射环状firefly luciferase mrna。
85.图3-1示出了环状与线性mrna在b16f10肿瘤模型小鼠瘤内表达的比较。(a-e)瘤内注射线性小鼠的活体荧光成像图;(f-j)瘤内注射环状小鼠的活体荧光成像图;(a,f)瘤内注射6h后的小鼠活体荧光成像图;(b,g)瘤内注射24h后的小鼠活体荧光成像图;(c,h)瘤内注射48h后的小鼠活体荧光成像图;(d,i)瘤内注射72h后的小鼠活体荧光成像图;(e,j)瘤内注射96h后的小鼠活体荧光成像图。
86.图3-2示出了环状与线性mrna在mc38肿瘤模型小鼠瘤内表达的比较。(a-e)瘤内注射线性小鼠的活体荧光成像图;(f-j)瘤内注射环状小鼠的活体荧光成像图;(a,f)瘤内注射6h后的小鼠活体荧光成像图;(b,g)瘤内注射24h后的小鼠活体荧光成像图;(c,h)瘤内注射48h后的小鼠活体荧光成像图;(d,i)瘤内注射72h后的小鼠活体荧光成像图;(e,j)瘤内注射96h后的小鼠活体荧光成像图;。
87.图4示出了b16f10模型肿瘤生长曲线图。
①
pbs control:注射pbs的空白组;
②
luciferase control:注射环状mrna-luciferase对照组;
③
cytokine mix:注射mrna-il-15、mrna-il-12、mrna-gm-csf、mrna-ifn-α四个细胞因子环状mrna的mix组;
④
pd-1:注射anti-mouse pd-1组。
88.图5示出了mc38模型肿瘤生长曲线图。
①
control:注射pbs的空白组;
②
mrna control:注射环状mrna对照组;
③
cytokine mix:注射mrna-il-15、mrna-il-12、mrna-gm-csf、mrna-ifn-α四个细胞因子环状mrna的mix组;
④
pd-1:注射anti-mouse pd-1组;
⑤
combination:注射编码四个细胞因子环状mrna以及anti-mouse pd-1的联合治疗组。
89.图6示出了b16f10模型肿瘤生长曲线图。
①
control:注射ringer’s solution的空白组;
②
mrna control:注射环状mrna对照组;
③
cytokine mix:注射mrna-il-15、mrna-il-12、mrna-gm-csf、mrna-ifn-α四个细胞因子环状mrna的mix组;
④
pd-1:注射anti-mouse pd-1组;
⑤
combination:注射编码四个细胞因子环状mrna以及anti-mouse pd-1的联合治疗组。
90.图7示出了瘤内注射编码多种细胞因子的环状mrna组(mix组)以及与pd-1抗体的联合治疗组(combination组)对免疫细胞浸润的影响。a.b16模型第二次给药后24h后,肿瘤引流淋巴结中cd8 t细胞的激活程度。b.脾脏中cd8 t细胞的激活程度。c.肿瘤中免疫细胞占总的活细胞的百分比。d.肿瘤中cd4 t细胞的激活情况。e.肿瘤中cd8t细胞的激活情况。
具体实施方式
91.定义
92.当在权利要求和/或说明书中与术语“包含”联用时,词语“一(a)”或“一(an)”可以指“一个”,但也可以指“一个或多个”、“至少一个”以及“一个或多于一个”。
93.如在权利要求和说明书中所使用的,词语“包含”、“具有”、“包括”或“含有”是指包括在内的或开放式的,并不排除额外的、未引述的元件或方法步骤。
94.在整个申请文件中,术语“约”表示:一个值包括测定该值所使用的装置或方法的误差的标准偏差。
95.虽然所公开的内容支持术语“或”的定义仅为替代物以及“和/或”,但除非明确表示仅为替代物或替代物之间相互排斥外,权利要求中的术语“或”是指“和/或”。
96.如本公开所使用的,术语“多肽”、“肽”和“蛋白质”在本文中互换地使用并且为任意长度的氨基酸聚合物。该聚合物可以是线形或分支的,它可以包含修饰的氨基酸,并且它可以由非氨基酸隔断。该术语也包括已经被修饰(例如,二硫键形成、糖基化、脂质化、乙酰化、磷酸化或任何其他操作,如以标记组分缀合)的氨基酸聚合物。多肽可以从天然来源分离,可以通过重组技术从真核或原核宿主产生并且可以是合成方法的产物。
97.如本公开所使用的,“重组多肽”又称“工程化多肽”是指具有自然界不相连的肽序列的多肽、蛋白。重组多肽可以是利用基因工程技术,在原核或真核细胞中获得的目标多肽;也可以是利用合成技术得到的目标多肽。
98.如本公开所使用的,术语“抗原结合片段”包括完整抗体,或者比完整或完全抗体的氨基酸残基数要少的完整或完全抗体的一部分或一段,其能结合抗原或与完整抗体(即与抗原结合片段所来源的完整抗体)竞争结合抗原。可以通过重组dna技术、或通过酶或化
学切割完整的抗体制备抗原结合片段。抗原结合片段包括但不限于fab、fab’、f(ab’)2、fv、单链fv、双体抗体(diabody)、单结构域抗体(sdab)。所述fab片段是一种由vl、vh、cl和ch1结构域组成的单价片段,例如,通过木瓜蛋白酶消化完全抗体能够获得fab片段。此外,通过胃蛋白酶在铰链区的二硫键下面消化完全抗体产生f(ab’)2,其为fab’的二聚体,是二价的抗体片段。f(ab’)2可以在中性条件下通过破坏铰链区中的二硫键而被还原,由此将f(ab’)2二聚体转化为fab’单体。fab’单体基本上是具有铰链区的fab片段(其它抗体片段的更详细的描述请参见:基础免疫学(fundamental immunology),w.e.paul编辑,raven press,n.y.(1993))。所述fv片段由抗体单臂的vl和vh结构域组成。另外,虽然fv片段的两个结构域vl和vh由独立的基因编码,但是使用重组方法,可以将它们通过能够使这两个结构域作为单条蛋白链产生的合成性连接肽连接,在所述单条蛋白链中vl区和vh区配对以形成单链fv。可以通过化学方法、重组dna方法或蛋白酶消化法获得所述抗体片段。
99.如本公开所使用的,术语“环状rna”是一种呈封闭环形rna分子,主要由外显子、ires元件、蛋白编码区和间隔区。在一些优选的实施方案中,环状rna具有如下结构:“第二外显子e2-间隔区-ires元件-编码区-间隔区-第一外显子e1”。本公开所使用的环状rna具有蛋白翻译活性,又可称为“环状mrna”。
100.本公开中的“序列同一性”和“同一性百分比”指两个或更多个多核苷酸或多肽之间相同(即同一)的核苷酸或氨基酸的百分比。两个或更多个多核苷酸或多肽之间的序列同一性可通过以下方法测定:将多核苷酸或多肽的核苷酸或氨基酸序列对准且对经对准的多核苷酸或多肽中含有相同核苷酸或氨基酸残基的位置数目进行评分,且将其与经对准的多核苷酸或多肽中含有不同核苷酸或氨基酸残基的位置数目进行比较。多核苷酸可例如通过含有不同核苷酸(即取代或突变)或缺失核苷酸(即一个或两个多核苷酸中的核苷酸插入或核苷酸缺失)而在一个位置处不同。多肽可例如通过含有不同氨基酸(即取代或突变)或缺失氨基酸(即一个或两个多肽中的氨基酸插入或氨基酸缺失)而在一个位置处不同。序列同一性可通过用含有相同核苷酸或氨基酸残基的位置数目除以多核苷酸或多肽中氨基酸残基的总数来计算。举例而言,可通过用含有相同核苷酸或氨基酸残基的位置数目除以多核苷酸或多肽中核苷酸或氨基酸残基的总数且乘以100来计算同一性百分比。
101.示例性的,在本公开中,当使用序列比较算法或通过目视检查测量以最大的对应性进行比较和比对时,两个或多个序列或子序列具有至少40%、50%、60%、70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%核苷酸或氨基酸残基的“序列同一性”或“同一性百分比”。“序列同一性”或“同一性百分比”的判断/计算可以基于序列任何合适的区域上。例如,长度至少约50个残基的区域、至少约100个残基的区域,至少约200个残基的区域,至少约400个残基的区域,或至少约500个残基的区域。在某些实施方案中,所述序列在任一或两个相比较的生物聚合物(就是核酸或多肽)的整个长度上基本相同。
102.如本公开所使用的,“治疗”是指:在罹患疾病之后,使受试者接触(例如给药)本发明的环状rna、环化前体rna、重组核酸分子、重组表达载体、组合物,从而与不接触时相比使该疾病的症状减轻,并不意味着必需完全抑制疾病的症状。罹患疾病是指:身体出现了疾病症状。
103.如本公开所使用的,“预防”是指:在罹患疾病之前,通过使受试者接触(例如给药)
本发明的环状rna、环化前体rna、重组核酸分子、重组表达载体、组合物等,从而与不接触时相比减轻罹患疾病后的症状,并不意味着必需完全抑制患病。
104.如本公开所使用的,术语“有效量”指本发明的重组核酸分子、重组表达载体、环化前体rna、环状rna、疫苗或组合物的这样的量或剂量,其以单一或多次剂量施用患者后,在需要治疗或预防的患者中产生预期效果。有效量可以由作为本领域技术人员的主治医师通过考虑以下多种因素来容易地确定:诸如哺乳动物的物种;它的大小、年龄和一般健康;涉及的具体疾病;疾病的程度或严重性;个体患者的应答;施用的具体抗体;施用模式;施用制剂的生物利用率特征;选择的给药方案;和任何伴随疗法的使用。
105.如本公开所使用的,术语“个体”、“患者”或“受试者”包括哺乳动物。哺乳动物包括但不限于,家养动物(例如,牛,羊,猫,狗和马),灵长类动物(例如,人和非人灵长类动物如猴),兔,以及啮齿类动物(例如,小鼠和大鼠)。
106.如本公开所使用的,术语“肿瘤”指所有赘生性(neoplastic)细胞生长和增殖,无论是恶性的还是良性的,及所有癌前(pre-cancerous)和癌性细胞和组织。术语“癌症”、“癌性”和“肿瘤”在本文中提到时并不互相排斥。
107.如本公开所使用的,术语“癌症”和“癌性”指向或描述哺乳动物中特征通常为细胞生长不受调节的生理疾患。癌症的例子包括但不限于癌,淋巴瘤,母细胞瘤,肉瘤和白血病或淋巴样恶性肿瘤。此类癌症的更具体例子包括但不限于鳞状细胞癌(例如上皮鳞状细胞癌),肺癌(包括小细胞肺癌,非小细胞肺癌,肺的腺癌,和肺的鳞癌),腹膜癌,肝细胞癌,胃癌(包括胃肠癌和胃肠基质癌),胰腺癌,成胶质细胞瘤,宫颈癌,卵巢癌,肝癌,膀胱癌,尿道癌,肝瘤,乳腺癌,结肠癌,直肠癌,结肠直肠癌,子宫内膜癌或子宫癌,唾液腺癌,肾癌,前列腺癌,外阴癌,甲状腺癌,肝癌,肛门癌,阴茎癌,黑素瘤,浅表扩散性黑素瘤,恶性雀斑样痣黑素瘤,肢端黑素瘤,结节性黑素瘤,多发性骨髓瘤和b细胞淋巴瘤,慢性淋巴细胞性白血病(cll),急性成淋巴细胞性白血病(all),毛细胞性白血病,慢性成髓细胞性白血病,和移植后淋巴增殖性病症(ptld),以及与瘢痣病(phakomatoses),水肿(诸如与脑瘤有关的)和梅格斯氏(meigs)综合征有关的异常血管增殖,脑瘤和脑癌,以及头颈癌,及相关转移。在某些实施方案中,适合于通过本发明的抗体来治疗的癌症包括肺癌(例如非小细胞肺癌)、肝癌、胃癌或结肠癌,包括那些癌症的转移性形式。
108.如本公开所使用的,本公开中的术语“放疗剂”包括使用引起dna损伤的药物。放疗已广泛用于癌症和疾病治疗,并且包括通常称为γ射线、x射线的那些和/或将放射性同位素定向递送至肿瘤细胞。
109.本公开中的术语“化疗剂”是可用于治疗癌症的化学化合物。化疗剂的类别包括,但不限于:烷化剂、抗代谢产物、激酶抑制剂、纺锤体毒物植物生物碱、细胞毒/抗肿瘤抗生素、拓扑异构酶抑制剂、光敏剂、抗-雌激素和选择性雌激素受体调节剂、抗-孕酮、雌激素受体下调剂、雌激素受体拮抗剂、促黄体激素释放激素激动剂、抗-雄激素类、芳香化酶抑制剂、egfr抑制剂、vegf抑制剂、抑制涉及异常细胞增殖或肿瘤生长的基因表达的反义寡核苷酸。可用于本公开的治疗方法的化疗剂包括细胞生长抑制剂和/或细胞毒性剂。
110.除非另外定义或由背景清楚指示,否则在本公开中的全部技术与科学术语具有如本公开所属领域的普通技术人员通常理解的相同含义。
111.技术方案
112.seq id no:1所示的序列是细胞因子il-15的氨基酸序列;
113.seq id no:2所示的序列是细胞因子il-12的氨基酸序列;
114.seq id no:3所示的序列是细胞因子ifn alpha-2b的氨基酸序列;
115.seq id no:4所示的序列是细胞因子gm-csf的氨基酸序列;
116.seq id no:5所示的序列是荧光蛋白luciferse的氨基酸序列;
117.seq id no:6所示的序列是编码luciferse的环状rna分子的核苷酸序列;
118.seq id no:7所示的序列是编码il-15的环状rna分子的核苷酸序列;
119.seq id no:8所示的序列是编码il-12的环状rna分子的核苷酸序列;
120.seq id no:9所示的序列是编码ifn alpha-2b的环状rna分子的核苷酸序列;
121.seq id no:10所示的序列是编码gm-csf的环状rna分子的核苷酸序列;
122.seq id no:11所示的序列是cvb3 ires的核苷酸序列;
123.seq id no:12所示的序列是ev24 ires的核苷酸序列;
124.seq id no:13所示的序列是ev29 ires的核苷酸序列;
125.seq id no:14所示的序列是ev33 ires的核苷酸序列;
126.seq id no:15所示的序列是ev24与cvb3v嵌合ires的核苷酸序列;
127.seq id no:16所示的序列是ev29与cvb3v嵌合ires的核苷酸序列;
128.seq id no:17所示的序列是ev33与cvb3v嵌合ires的核苷酸序列;
129.seq id no:18所示的序列是第一外显子(e1)的核苷酸序列;
130.seq id no:19所示的序列是第二外显子(e2)的核苷酸序列;
131.seq id no:20所示的序列是5’间隔区序列1的核苷酸序列;
132.seq id no:21所示的序列是5’间隔区序列2的核苷酸序列;
133.seq id no:22所示的序列是3’间隔区序列1的核苷酸序列;
134.seq id no:23所示的序列是3’间隔区序列2的核苷酸序列;
135.seq id no:24所示的序列是构建环状mrna的dna载体中5’内含子的核苷酸序列;
136.seq id no:25所示的序列是构建环状mrna的dna载体中3’内含子的核苷酸序列;
137.seq id no:26所示的序列是构建环状mrna的dna载体中5’同源臂序列1(h1)的核苷酸序列;
138.seq id no:27所示的序列是构建环状mrna的dna载体中5’同源臂序列2(h2)的核苷酸序列;
139.seq id no:28所示的序列是构建环状mrna的dna载体中3’同源臂序列1的核苷酸序列;
140.seq id no:29所示的序列是构建环状mrna的dna载体中3’同源臂序列2的核苷酸序列。
141.包含环状rna分子的制剂
142.本公开提供的包含环状rna分子的制剂,其中,所述环状rna分子编码具有肿瘤免疫治疗活性的多肽。本公开首次发现包含环状rna分子的制剂可显著抑制肿瘤患者体内的肿瘤生长,在肿瘤小鼠模型中发挥显著的肿瘤治疗效果,为肿瘤免疫治疗提供了一种极具应用前景的新型治疗药物。
143.在一些实施方式中,环状rna分子为包裹的环状rna分子。例如,包含环状rna分子
的制剂是通过脂质体聚合物(lpr)、脂质体复合物(lp)、脂质体纳米粒(lnp)等材料包裹环状rna分子形成的包裹物。在一些实施方式中,所述环状rna分子为未包裹的环状rna分子。本公开意外地发现,本公开中的环状rna分子,不需要以脂质体材料等进行包裹即能实现高的体内递送效率和高的体内表达效率,以裸露的环状rna分子即可发挥明显的体内肿瘤治疗的效果,适合大规模的推广、使用。
144.在一些实施方式中,本公开中包含环状rna分子的制剂为注射剂。本领域技术人员普遍知晓,药物剂型对药物分子的活性具有重要影响,本公开发现,当包含环状rna分子的制剂为注射剂时,适合于向体内递送,且在递送于体内后,能够发挥高的肿瘤杀伤、抑制效果,并能特异性激发机体抗肿瘤的免疫反应,实现对肿瘤的免疫治疗。
145.在一些优选的实施方式中,所述注射剂还包含用于溶解所述环状rna分子的溶剂。示例性的,溶解环状rna分子的溶剂为水、氯化盐溶液、te缓冲液、pbs缓冲液或其他任意的适于溶解环状rna分子的溶剂。示例性的,在一些实施方式中,溶解环状rna分子的溶剂为te缓冲液,例如,1
×
te缓冲液、2
×
te缓冲液等等。在一些实施方式中,溶解环状rna分子的溶剂为pbs缓冲液,例如,1
×
pbs缓冲液、2
×
pbs缓冲液等等。在一些实施方式中,溶解环状rna分子的溶剂为氯化盐溶液,例如,0.9wt%的氯化钠溶液等等。
146.进一步的,注射剂中环状rna分子的含量可以根据多种因素如疾病状态、个体的年龄、性别和重量和环状rna分子在个体中激发所需反应的能力而变动。
147.在一些更为优选的实施方式中,注射剂由环状rna分子和溶解环状rna分子的溶剂组成。本公开中注射剂的成分简单,不包含生物毒性物质,具有生物安全性高、适合向动物体内施用的优势。在一些实施方式中,本公开中仅以环状rna分子和溶解环状rna分子的溶剂组成的注射剂即能实现高效的体内递送效率和体内表达效率,有效抑制体内肿瘤的生长,具有安全性高、稳定性好、作用效果显著等优势。
148.在一些实施方式中,本公开中包含环状rna分子的制剂通过瘤内给药的方式施用于受试者体内,瘤内给药能够极大降低引起免疫相关副作用(immune-related adverse events,iraes)的可能性,提高药物递送的安全性,实现肿瘤局部高药物浓度,提高药物的生物利用度,
149.在一些实施方式中,本公开中包含环状rna分子的制剂通过瘤内注射给药施用于受试者体内。本公开对比皮下注射、肌肉注射、皮内注射、静脉注射、腹腔注射和瘤内注射发现,环状rna分子在瘤内给药的施用方式下具有高的体内表达效率,并且通过瘤内注射给药,能够实现对小鼠肿瘤模型中肿瘤生长的明显抑制,说明本公开中包含环状rna分子在以瘤内注射给药时,能够发挥显著优于其他给药方式的肿瘤治疗效果。
150.环状rna分子
151.本公开中的环状rna分子包含编码具有肿瘤免疫治疗活性的多肽的编码区,和与所述编码区可操作地连接的ires元件。
152.在本公开中,具有肿瘤免疫治疗活性的多肽,可以是具有肿瘤免疫治疗活性的任意类型的多肽,本公开对具有肿瘤免疫治疗活性的多肽的序列不进行具体限定。
153.在一些实施方式中,具有肿瘤免疫治疗活性的多肽为细胞因子。示例性的,细胞因子包括但不限于白细胞介素(il)、干扰素(ifn)、肿瘤坏死因子(tnf)、粒细胞-巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)。环状rna分子通过表达细胞因子,能
够有效激活机体的免疫系统,杀伤肿瘤细胞,实现对肿瘤的治疗。
154.在一些实施方式中,具有肿瘤免疫治疗活性的多肽为抗原结合片段。更具体的,具有肿瘤免疫治疗活性的多肽为与肿瘤抗原特异性结合的抗原结合片段。示例性的,肿瘤抗原包括但不限于cd19、cd20、cd22、cd30、cd33、cd38、cd123、cd138、cd171、afp、cea、psca、gd2、nkg2d、bcma、egfr、her2、egfrvⅲ、cd171、fap、il13rα2、vegfr1、vegfr2、gpc-3、mesothelin、claudin 18.2、epcam、muc1、muc16、epha2、epha3、cd133、psma。环状rna分子通过靶向肿瘤细胞表面抗原或特定受体,从而阻断肿瘤生长因子信号通路,发挥杀伤肿瘤细胞的作用。
155.在本公开中,抗原结合片段包括与肿瘤抗原特异性结合的抗体,或是包含完整抗体的一部分且结合完整抗体所结合的抗原。
156.进一步的,抗原结合片段包括涵盖各种结构的天然抗体和人工抗体,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)、单链抗体(例如,scfv)、完整抗体、fv,fab,fab’,fab
’‑
sh,f(ab’)2;线性抗体;单结构域抗体;双价或双特异性抗体或其片段;骆驼科抗体;和由抗体片段形成的双特异性抗体或多特异性抗体。
157.在一些可选的实施方式中,具有肿瘤免疫治疗活性的多肽为il-15,其具有如seq id no:1所示的氨基酸序列,或者如seq id no:1所示的氨基酸序列经过取代、重复、缺失或添加一个或多个氨基酸,且具有seq id no:1所示多肽活性的突变体。
158.在一些可选的实施方式中,环状rna分子包含编码如seq id no:1所示的il-15的编码区。本公开通过向小鼠肿瘤模型的瘤内注射表达il-15的环状rna分子,实现了小鼠肿瘤的有效抑制。
159.在一些可选的实施方式中,具有肿瘤免疫治疗活性的多肽为il-12,其具有如seq id no:2所示的氨基酸序列,或者如seq id no:2所示的氨基酸序列经过取代、重复、缺失或添加一个或多个氨基酸,且具有seq id no:2所示多肽活性的突变体。
160.在一些可选的实施方式中,环状rna分子包含编码如seq id no:2所示的il-12的编码区,本公开通过向小鼠肿瘤模型的瘤内注射表达il-12的环状rna分子,实现了小鼠肿瘤的有效抑制。
161.在一些可选的实施方式中,具有肿瘤免疫治疗活性的多肽为ifn alpha-2b,其具有如seq id no:3所示的氨基酸序列,或者如seq id no:3所示的氨基酸序列经过取代、重复、缺失或添加一个或多个氨基酸,且具有seq id no:3所示多肽活性的突变体。
162.在一些可选的实施方式中,环状rna分子包含编码如seq id no:3所示的ifn alpha-2b的编码区,本公开通过向小鼠肿瘤模型的瘤内注射表达ifn alpha-2b的环状rna分子,实现了小鼠肿瘤的有效抑制。
163.在一些可选的实施方式中,具有肿瘤免疫治疗活性的多肽为gm-csf,其具有如seq id no:4所示的氨基酸序列,或者如seq id no:4所示的氨基酸序列经过取代、重复、缺失或添加一个或多个氨基酸,且具有seq id no:4所示多肽活性的突变体。
164.在一些可选的实施方式中,环状rna分子包含编码如seq id no:4所示gm-csf的编码区,本公开通过向小鼠肿瘤模型的瘤内注射表达gm-csf的环状rna分子,实现了小鼠肿瘤的有效抑制。
165.在一些优选地实施方式中,ires序列包含如seq id no:11-17任一序列所组成的
组中的一种或多种序列的核苷酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序列同一性的序列。在一些实施方案中,ires序列为seq id no:11所示核苷酸序列的cvb3 ires、seq id no:12所示核苷酸序列的ev24 ires、seq id no:13所示核苷酸序列的ev29 ires、seq id no:14所示核苷酸序列的ev33 ires。在一些实施方案中,ires序列包含cvb3v ires与ev24 ires、ev29 ires和ev33 ires中任意一种的嵌合体序列。在一些实施方式中,ires序列包含cvb3v与ev24 ires的嵌合体序列,其核苷酸序列如seq id no:15所示。在一些实施方式中,ires序列包含cvb3v与ev29ires的嵌合体序列,其核苷酸序列如seq id no:16所示。在一些实施方式中,ires序列包含cvb3v与ev33 ires的嵌合体序列,其核苷酸序列如seq id no:17所示。
166.本公开意外地发现,包含上述ires序列的环状rna分子,适合作为活体瘤内注射的注射剂施用,在未包裹的裸状分子状态,即可高效向体内递送,发挥明显的激活机体抗肿瘤免疫反应,抑制、杀伤肿瘤的免疫治疗效果。
167.在一些优选地实施方式中,环状rna分子还包括位于所述ires元件上游的5’间隔区,和位于所述编码区下游的3’间隔区。具体的,5’间隔区序列为与seq id no:20-21任一序列所示的核苷酸序列相比具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序列同一性的序列。3’间隔区序列为与seq id no:22-23任一序列所示的核苷酸序列相比具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序列同一性的序列。
168.在一些优选地实施方式中,环状rna分子还包括位于所述5’间隔区上游的第二外显子,和位于所述3’间隔区下游的第一外显子。具体的,第二外显子序列为与seq id no:19所示的核苷酸序列相比具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序列同一性的序列。第一外显子序列为与seq id no:18所示的核苷酸序列相比具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序列同一性的序列。
169.在一些优选地实施方式中,环状rna分子包含顺次连接的如下所示元件:第二外显子、5’间隔区、ires元件、编码区、3’间隔区和第一外显子。
170.本公开中通过选择特定序列的5’间隔区、3’间隔区、第二外显子以及第一外显子,能够实现环状rna分子向机体瘤内的高效递送,仅需将环状rna分子溶解后即能有效递送于瘤内,有效抑制肿瘤生长,实现对肿瘤的免疫治疗。
171.在一些优选地实施方式中,环状rna分子包含如seq id no:7所示的核苷酸序列,或者与seq id no:7所示的核苷酸序列相比具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序列同一性的序列。
172.在一些优选地实施方式中,环状rna分子包含如seq id no:8所示的核苷酸序列,或者与seq id no:8所示的核苷酸序列相比具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序
列同一性的序列。
173.在一些优选地实施方式中,环状rna分子包含如seq id no:9所示的核苷酸序列,或者与seq id no:9所示的核苷酸序列相比具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序列同一性的序列。
174.在一些优选地实施方式中,环状rna分子包含如seq id no:10所示的核苷酸序列,或者与seq id no:7所示的核苷酸序列相比具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序列同一性的序列。
175.本公开通过瘤内单独注射或联合注射上述的环状rna分子,实现了对肿瘤的生长抑制,首次证实了瘤内注射环状rna分子可用于肿瘤免疫治疗,为肿瘤的临床治疗提供了有效的免疫治疗药物。在一些优选的实施方式中,通过联合施用如seq id no:7-10所示序列环状rna分子,发现肿瘤小鼠模型中的肿瘤生长速度受到显著抑制。
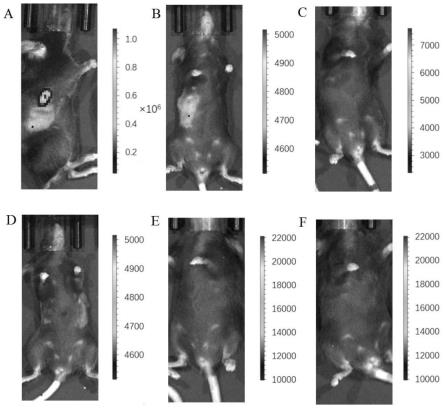
176.在一些实施方式中,本公开中包含环状rna分子的注射剂在不对环状rna分子进行包裹的条件下,即能实现高效的体内递送和体内表达,发挥肿瘤杀伤、抑制作用。
177.在一些实施方式中,本公开的环状rna分子,通过瘤内注射施用于受试者体内后,可以将肿瘤变为疫苗,促进机体产生针对肿瘤细胞的特异性免疫反应,产生远隔效应,有效抑制肿瘤转移。
178.药物组合物
179.本公开的药物组合物包括本公开中的包含环状rna分子的制剂,和肿瘤治疗剂。通过联合施用包含环状rna分子的制剂与肿瘤治疗剂,有利于提高对肿瘤治疗的疗效与特异性,拓宽其临床应用范围。
180.在一些可选的实施方式中,肿瘤治疗剂选自放疗剂、化疗剂、免疫调节剂、细胞毒性剂、抗体、疫苗中的一种或多种。在一些优选地实施方式中,肿瘤治疗剂为免疫调节剂“免疫调节剂”包含免疫检查点调节剂,例如免疫检查点蛋白受体及其配体介导t细胞介导的细胞毒性的抑制,并且通常由肿瘤或在肿瘤微环境中的无反应性t细胞上表达,并允许肿瘤逃避免疫攻击。免疫抑制检查点蛋白受体及其配体的活性的抑制剂可以克服免疫抑制性肿瘤环境,以允许肿瘤的细胞毒性t细胞攻击。免疫检查点蛋白质的实例包括但不限于pd-1、pd-l1、pdl2、ctla4、lag3、tim3、tigit和cd103。此类蛋白质的活性的调节(包括抑制)可以通过免疫检查点调节剂完成,其可以包括例如靶向检查点蛋白质的抗体、适体、小分子和检测点受体蛋白质的可溶性形式等等。此外,“免疫调节剂”还包括白细胞介素(il)、干扰素(ifn)、肿瘤坏死因子(tnf)、粒细胞-巨噬细胞集落刺激因子(gm-csf)和巨噬细胞集落刺激因子(m-csf)等细胞因子,均可以达到增强肿瘤患者或病原体感染者机体免疫应答与免疫调节的效果。
181.在一些优选的实施方式中,免疫调节剂为免疫检查点抑制剂。本公开通过瘤内注射的方式,向小鼠肿瘤模型内联合施用环状rna分子和免疫检查点抑制剂,发现两者能够协同作用,提高肿瘤浸润免疫细胞的数量,特别是能够特异性激活肿瘤浸润的cd8
t细胞,对于激发机体特异性的免疫反应,发挥肿瘤杀伤、抑制作用具有重要意义。
182.医药用途
183.本公开提供的包含环状rna分子的制剂,或包含上述制剂的药物组合物,适合作为肿瘤免疫治疗药物,用于肿瘤的预防或治疗。
184.在一些实施方式中,本公开中的包含环状rna分子的制剂用于治疗实体肿瘤,示例性的,实体肿瘤包括但不限于:肺癌、肝癌、乳腺癌、结直肠癌、鼻咽癌、肾癌、淋巴癌、卵巢癌、胃癌、胰腺癌、多发性骨髓瘤、神经胶质瘤、前列腺癌、宫颈癌、胆管癌、食管癌或黑色素瘤。
185.本公开中的包含环状rna分子的制剂可以制备为未包裹的注射剂,并且通过瘤内注射的施用方式施用于患有实体肿瘤的受试者体内,环状rna分子在受试者体内高效、稳定表达,有效激活机体抗肿瘤的免疫应答,抑制、杀伤肿瘤细胞,充分发挥对肿瘤的免疫治疗效果。
186.实施例
187.本公开的其他目的、特征和优点将从以下详细描述中变得明显。但是,应当理解的是,详细描述和具体实施例(虽然表示本公开的具体实施方式)仅为解释性目的而给出,因为在阅读该详细说明后,在本公开的精神和范围内所作出的各种改变和修饰,对于本领域技术人员来说将变得显而易见。
188.本实施例中所用到的实验技术与实验方法,如无特殊说明均为常规技术方法,例如下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所使用的材料、试剂等,如无特殊说明,均可通过正规商业渠道获得。
189.下述实施例涉及的实验动物和实验方法如下:
190.b16f10肿瘤模型
191.实验动物:雌性c57bl/6(北京维通利华实验动物技术有限公司),6-8周龄,体重在18和22克之间,研究前在饲养室适应至少三天。小鼠可以自由获取食物和无菌水。
192.饲养环境:维持12h明12h暗昼夜交替,湿度维持在40~70%且日湿差《5%;温度维持于20~25℃。按照实验动物使用的3r原则给予人道关怀。
193.b16f10细胞来自南京科佰生物技术有限公司,培养于dulbecco’s modified eagle’smedium(dmem)高糖培养基,加入10%fbs(fatal bovine serum,胎牛血清)和1%ps(penicillin-streptomycin solution,青霉素-链霉素溶液)。dmem高糖培养基和fbs购自biological industries,pbs购自hyclone。细胞计数采用台盼蓝(trypan blue solution,购自sigma)与细胞悬液1:1混合后,使用countstar细胞计数仪计数。收集细胞时,使用0.25%胰蛋白酶-edta(gibco,ref.12605-010)消化细胞,重悬于添加了matrigel(corning)的磷酸盐缓冲液(pbs,上海源培生物科技股份有限公司)中,每只雌性c57bl/6j小鼠右侧腋下皮下接种1
×
106/150μl的b16f10细胞。
194.在皮下接种肿瘤后5天左右开始肿瘤内mrna注射。每2-3天通过游标卡尺测量评估肿瘤生长,并使用以下公式计算肿瘤体积大小:a*b2/2,其中b《a。
195.mc38肿瘤模型
196.实验动物:雌性c57bl/6(北京维通利华实验动物技术有限公司),6-8周龄,体重在18和22克之间,研究前在饲养室适应至少三天。小鼠可以自由获取食物和无菌水。
197.饲养环境:维持12h明12h暗昼夜交替,湿度维持在40~70%且日湿差《5%;温度维持于20~25℃。按照实验动物使用的3r原则给予人道的关怀。
198.mc38细胞来自南京科佰生物技术有限公司,培养于dulbecco’s modified eagle’smedium(dmem)高糖培养基,加入10%fbs(fatal bovine serum,胎牛血清)和1%ps(penicillin-streptomycin solution,青霉素-链霉素溶液)。dmem高糖培养基和fbs购自biological industries,pbs购自hyclone。细胞计数采用台盼蓝(trypan blue solution,购自sigma)与细胞悬液1:1混合后,使用countstar细胞计数仪计数。收集细胞时,使用0.25%胰蛋白酶-edta(gibco)消化细胞,重悬于添加了matrigel(corning)的磷酸盐缓冲液(pbs,上海源培生物科技股份有限公司)中,每只雌性c57bl/6j小鼠右侧腋下皮下接种1
×
106/150μl的mc38细胞。
199.a549肿瘤模型
200.实验动物:雌性cd-1nude(北京维通利华实验动物技术有限公司),6-8周龄,体重在18和22克之间,研究前在饲养室适应至少三天。小鼠可以自由获取食物和无菌水。
201.饲养环境:维持12h明12h暗昼夜交替,湿度维持在40~70%且日湿差《5%;温度维持于20~25℃。
202.a549细胞购自北京中源合聚生物有限公司,培养于dulbecco’s modified eagle’smedium(dmem)高糖培养基,加入10%fbs(fatal bovine serum,胎牛血清)和1%ps(penicillin-streptomycin solution,青霉素-链霉素溶液)。dmem高糖培养基和fbs购自biological industries,pbs购自hyclone。细胞计数采用台盼蓝(trypan blue solution,sigma)与细胞悬液1:1混合后,使用countstar细胞计数仪计数。收集细胞时,使用0.25%胰蛋白酶-edta(gibco)消化细胞,重悬于添加了matrigel(corning)的磷酸盐缓冲液(pbs,上海源培生物科技股份有限公司)中,每只雌性cd-1小鼠右侧腋下皮下接种3
×
106/150μl的a549细胞。
203.nci-h358肿瘤模型
204.实验动物:雌性cd-1nude(北京维通利华实验动物技术有限公司),6-8周龄,体重在18和22克之间,研究前在饲养室适应至少三天。小鼠可以自由获取食物和无菌水。
205.饲养环境:维持12h明12h暗昼夜交替,湿度维持在40~70%且日湿差《5%;温度维持于20~25℃。
206.nci-h358细胞来自来自南京科佰生物有限公司,培养于rpmi1640培养基,加入10%fbs(fatal bovine serum,胎牛血清)和1%ps(penicillin-streptomycin solution,青霉素-链霉素溶液)。rpmi1640培养基和fbs购自biological industries,pbs购自hyclone。细胞计数采用台盼蓝(trypan blue solution,购自sigma)与细胞悬液1:1混合后,使用countstar细胞计数仪计数。收集细胞时,使用0.25%胰蛋白酶-edta(gibco)消化细胞,重悬于添加了matrigel(corning)的磷酸盐缓冲液(pbs,上海源培生物科技股份有限公司)中,每只雌性cd-1小鼠右侧腋下皮下接种3
×
106/150μl的nci-h358细胞。
207.用于体内研究的mrna的制备
208.环状mrna制备:
209.合成与构建含有表达目的基因的,用于生成环状mrna的dna质粒载体,该步骤委托苏州金唯智生物科技有限公司进行基因合成与克隆。此处所使用的构建环状mrna的dna载
体,包含t7启动子,5’同源臂,3’内含子,第二外显子e2,5’间隔区,ires元件,luciferase序列编码区,下游间隔区,5’内含子,第一外显子e1,3’同源臂,以及可用于质粒线性化的酶切位点xbai。通过质粒抽提试剂盒(天根无内毒素小量中提试剂盒)获得质粒,采用限制性内切酶xbai进行质粒线性化。采用体外转录合成环状mrna前体rna。转录体系如下:
210.表1
211.试剂体积10xreaction buffer2μlatp(20mm)2μlctp(20mm)2μlutp(20mm)2μlgtp(20mm)2μlxba i单酶切线性化dnaxμl(500-1000ng)t7 rna polymerase2μlrna inhibitor2μlrna nuclease free,h2ototal 20μl
212.t7 rna聚合酶采用purescribe
tm t7 high yield rna synthesis kit(江苏普瑞康生物医药有限公司)。所得转录产物使用硅膜离心柱法纯化(thermo,genejet rna purification kit)。rna环化得到环状mrna,条件如下:
213.表2
214.溶液体积mrna25μg rna溶液gtp solution(20mm)50μlgtp buffer补足至500ul
215.将上述溶液于55℃加热15min,环化rna产物使用硅膜离心柱法纯化(thermo,genejet rna purification kit),获得环状mrna,测定od值。将环状mrna溶于水,继续加入2
×
pbs缓冲液和水,配制得到以1
×
pbs缓冲液溶解环状mrna的注射剂,
216.线性mrna的合成步骤如下:
217.puc57-trnp-egfp-dasp质粒酶切线性化及模板纯化方法同(2)-2)。采用apexbio试剂盒hyperscribetmall in one mrna synthesis kit ii通过体外转录合成cap1结构的线性mrna,采用假尿嘧啶进行核苷修饰。最终得到cap1结构,带polya尾且具有假尿嘧啶核苷修饰的线性mrna。
218.环状mrna分装后放于-90℃冰箱,注射当天解冻,配制相应的2
×
注射溶液,并用该2
×
溶液和无酶水、环状mrna配制成相应的1
×
注射溶液,分装后用于瘤内注射。
219.线性mrna分装后放于-90℃冰箱,注射当天解冻,配制相应的2
×
注射溶液,并用该2
×
溶液和无酶水、线性mrna配制成相应的1
×
注射溶液,分装后用于瘤内注射。
220.小鼠活体荧光成像
221.小鼠瘤内注射编码luciferase的核苷酸修饰的线性mrna或者环状mrna一段时间后,腹腔内注射luciferase底物荧光素水溶液(300μl,4.5mg;promega),放入麻醉仓中麻醉。活体动物成像的荧光在腹腔注射荧光素的10min后量化。感兴趣区域(roi)被量化为平
均辐射率(photons s-1
cm-2
sr-1
,由使用caliper life sciences的living image软件叠加在小鼠灰度照片上的彩色缩放图像表示)。对于绝对定量,生物发光信号被印迹为总通量(photons s-1
)。
222.肿瘤监测
223.每周两次用游标卡尺测量肿瘤大小直至最后安乐死。当肿瘤大小达到约2000mm3或存在动物健康问题(肿瘤的20%面积溃疡)时,对动物实施安乐死。以下情况定义为肿瘤消退:研究结束时肿瘤体积《20mm3;tf/t0《1,其中tf为最终肿瘤体积,t0为第一次瘤内mrna注射当天的肿瘤体积。使用graphpad prism 8.0.2整理数据并绘制肿瘤生长曲线图和生存率曲线图。
224.肿瘤浸润免疫细胞分析
225.小鼠安乐死后,解剖后取肿瘤引流淋巴结、脾脏以及瘤体。淋巴结和脾脏研磨后过70μm滤网,离心收集细胞进行流式抗体染色。瘤体剪碎后用collagenase type iv(胶原蛋白酶iv,购自gibco)于37℃消化30min,过70μm滤网,离心收集细胞进行流式抗体染色。
226.流式抗体染色:首先用efluor780 cell viability dye染细胞死活,4℃避光染20min后离心,pbs洗一次后分别染抗体。
①
淋巴结:染cd45、cd3、cd4、cd8、cd69分别检测免疫细胞分群、t细胞分群、cd4
t细胞分群、cd8
t细胞分群、被激活的t细胞分群;
②
脾脏:染cd45、cd3、cd4、cd8、cd69分别检测免疫细胞分群、t细胞分群、cd4
t细胞分群、cd8
t细胞分群、被激活的t细胞分群;
③
肿瘤组织:分为两组,其中一组染cd45、cd3、cd4、cd8、cd69分别检测免疫细胞分群、t细胞分群、cd4
t细胞分群、cd8
t细胞分群、被激活的t细胞分群,另一组染cd45、cd11b、f4/80检测巨噬细胞分群。4℃避光染20min后离心,pbs洗一次后用200μl pbs重悬,用声波聚焦流式细胞仪(life,attune nxt)进行检测。所有流式抗体均购自biolegend。
227.实施例1.不同给药途径对环状mrna表达的影响
228.1.1实验方法
229.对于b1f10肿瘤模型小鼠,分别进行瘤内、肿瘤周围皮下以及皮内注射10μg编码firefly luciferase的环状mrna;对于正常野生型小鼠,分别肌肉、腹腔以及尾静脉注射10μg环状luciferase的mrna。6h后小鼠腹腔内注射荧光素的水溶液,活体荧光成像。通过荧光强度分析,不同给药途径对环状mrna表达的影响。
230.1.2实验结果
231.图1示出了不同给药途径对环状mrna表达的影响,如图1中b和c所示,肿瘤周围皮下和皮内注射环状mrna,未见有明显表达。其他给药方式如肌肉注射(d)、腹腔注射(e)和静脉注射(f)等,均未检测到荧光。而进行瘤内注射(a)的小鼠,整个瘤体呈现明显的荧光。因此,在没有递送系统的前提下,环状mrna的给药方式会显著影响环状mrna的表达,瘤内注射环状mrna这一方法是可行的。
232.实施例2.在多种肿瘤模型上验证环状mrna的表达
233.2.1实验方法
234.对于a549,nci-h358,b16f10和mc38肿瘤模型小鼠,分别瘤内注射10μg编码firefly luciferase的环状mrna,6h后小鼠腹腔内注射荧光素水溶液,进行活体荧光成像。通过荧光强度,分析环状mrna在不同肿瘤模型小鼠瘤内的表达情况。
235.2.2实验结果
236.图2示出了在多种肿瘤模型上验证环状mrna的表达结果,其中a-d依次为a549肿瘤模型小鼠、h358肿瘤模型小鼠、b16f10肿瘤模型小鼠、mc38肿瘤模型小鼠。由图2可知,环状mrna瘤内注射可以在a549、nci-h358、b16f10和mc38肿瘤模型上均可表达。瘤内注射环状mrna具有广泛应用在多种实体瘤的可能性。
237.实施例3.环状mrna与线性mrna在肿瘤表达的比较
238.3.1实验方法
239.对于b16f10肿瘤模型小鼠,分别瘤内注射10μg编码firefly luciferase的核苷酸修饰的线性mrna和环状mrna,6h、24h、48h、72h以及96h后小鼠腹腔内注射荧光素水溶液,进行活体荧光成像。通过荧光强度,分析线性和环状luciferase mrna在瘤内的表达情况。
240.3.2实验结果
241.图3-1为环状与线性mrna在b16f10肿瘤模型小鼠瘤内表达的比较。(a-e)示出了瘤内注射线性小鼠的活体荧光成像图;(f-j)为瘤内注射环状小鼠的活体荧光成像图。由图3-1可知,瘤内注射环状firefly luciferase mrna的小鼠在96h后,仍能观察到瘤内荧光,而瘤内注射线性luciferase mrna的小鼠在此时瘤内荧光很弱甚至消失。表明相对于线性mrna,环状mrna在瘤内更稳定,表达时间更长。
242.图3-2为环状与线性mrna在mc38肿瘤模型小鼠瘤内表达的比较。(a-e)示出了瘤内注射线性小鼠的活体荧光成像图;(f-j)为瘤内注射环状小鼠的活体荧光成像图。由图3-2可知,相对于线性mrna,环状mrna在瘤内更稳定,表达时间更长。
243.实施例4.环状mrna编码cytokine mix瘤内注射药效验证
244.4.1实验方法
245.40只c57bl/6小鼠,随机分为4组,pbs control组(pbs,hyclone)、luciferase control组、cytokine mix组、pd-1抗体组。每组8只,皮下注射1
×
106个b16f10黑色素瘤细胞进行肿瘤模型构建。注射后的小鼠,正常进行喂食喂水,使用游标卡尺持续测量肿瘤体积,达到70~90mm3时开始给药。环状mrna每隔3天给药一次,pd-1每隔1天给药一次。
246.表3
[0247][0248]
4.2实验结果
[0249]
图4示出了注射pbs control组、luciferase control组、cytokine mix组、pd-1组的b16f10模型肿瘤生长曲线图。如图4所示,瘤内注射编码多种细胞因子的环状mrna组
(cytokine mix组)在所有组中肿瘤体积最小,肿瘤生长速度显著减缓。
[0250]
实施例5.环状mrna编码cytokine mix瘤内注射联合pd-1抗体系统给药药效验证
[0251]
5.1实验方法
[0252]
在上述实施例4的基础上,将环状mrna编码cytokine mix与pd-1抗体进行联合治疗,分别建立mc-38结直肠癌模型、b16f10黑色素瘤模型进行实验。
[0253]
(1)mc-38结直肠癌模型:40只c57bl/6小鼠,随机分为5组,control组(pbs,hyclone)、mrna control组、cytokine mix组、pd-1组、combination组。每组8只,皮下注射1
×
106个mc-38细胞进行肿瘤模型构建。注射后的小鼠,正常进行喂食喂水,使用游标卡尺持续测量肿瘤体积,达到70~90mm3时开始给药。环状mrna每隔3天给药一次,pd-1每隔1天给药一次。
[0254]
(2)b16f10黑色素瘤模型:65只c57bl/6小鼠,随机分为5组,control组、mrna control组、cytokine mix组、pd-1组、combination组。每组13只,皮下注射1
×
106个b16f10细胞进行肿瘤模型构建。注射后的小鼠,正常进行喂食喂水,使用游标卡尺持续测量肿瘤体积,达到40~70mm3时开始给药。环状mrna每隔2天给药一次,pd-1每隔1天给药一次。
[0255]
表4
[0256][0257][0258]
5.2实验结果
[0259]
图5示出了注射control组、mrna control组、cytokine mix组、pd-1组、combination组的mc38模型肿瘤生长曲线图。从图5的结果来看,mc38结肠癌小鼠模型本身对pd-1抗体治疗具有一定的响应率,联合瘤内注射编码细胞因子的环状mrna以后,肿瘤平均体积更小,肿瘤生长速度明显减缓。图6示出了注射control组、mrna control组、cytokine mix组、pd-1组、combination组的b16f10模型肿瘤生长曲线图。根据图6的结果,b16f10小鼠黑色素瘤模型对pd-1抗体治疗几乎不响应,其肿瘤生长曲线与对照组无明显差
异。而瘤内注射编码细胞因子的环状mrna与pd-1抗体联合给药以后,b16f10黑色素瘤产生了对pd-1抗体的响应,并且两种治疗手段产生了协同效应,显著减缓了肿瘤生长速度。
[0260]
实施例6.环状mrna瘤内注射对肿瘤免疫浸润细胞的影响
[0261]
6.1实验方法
[0262]
在上述实施例4和5的b16f10模型基础上,每组取3只小鼠,第二次给药24小时后安乐死,分别取肿瘤、肿瘤引流淋巴结、脾,制成单细胞悬液后分成两部分,分别进行细胞死活染色和抗体标记。第一部分标记:cd45、cd3、cd4、cd8、cd69。第二部分标记:cd45、f4/80、cd11b。流式检测后分析cd45阳性细胞率,以及cd4
t细胞和cd8
t细胞的激活情况。
[0263]
6.2实验结果
[0264]
图7示出了瘤内注射编码多种细胞因子的环状mrna组(mix组)以及与pd-1抗体的联合治疗组(combination组)对免疫细胞浸润的影响。其中如a和b所示,瘤内注射编码多种细胞因子的环状mrna组(mix组)以及与pd-1抗体的联合治疗组(combination组),未引起引流部位淋巴结和脾脏cd8
t细胞的大量激活。但是在肿瘤部位,如c所示,瘤内注射多种细胞因子导致了更多免疫细胞浸润,而联合pd-1抗体治疗后,肿瘤中免疫细胞占比有了更显著的升高。除了免疫细胞所占的比例有了提高以外,免疫细胞的状态也呈现很大的不同。如d和e所示,瘤内注射编码多种细胞因子的环状mrna组(mix)组以及与pd-1抗体的联合治疗组(combination组)肿瘤浸润的cd4
t细胞和cd8
t细胞激活程度高达80%。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。