1.本发明属于药物制剂技术领域,具体涉及一种氯雷他定药物组合物及其制备方法。
背景技术:
2.过敏反应是指已产生免疫的机体在再次接受相同抗原刺激时所发生的组织损伤或功能紊乱的反应。反应的特点是发作迅速、反应强烈、消退较快;一般不会破坏组织细胞,也不会引起组织严重损伤,有明显的遗传倾向和个体差异。诱发过敏反应的抗原称为过敏原,常见的过敏原如下:(1)吸入式过敏原:如花粉、柳絮、粉尘、螨虫、动物皮屑、油烟、油漆、汽车尾气、煤气、香烟、冷空气、雾气等;(2)食入式过敏原:如牛奶、鸡蛋、鱼虾、牛羊肉、海鲜、动物脂肪、异体蛋白、酒精、毒品、抗菌素、消炎药、香油、香精、葱、姜、大蒜以及一些蔬菜、水果等;(3)接触式过敏原:如冷空气、热空气、紫外线、辐射、化妆品、洗发水、洗洁精、染发剂、肥皂、化纤用品、塑料、金属饰品(手表、项链、戒指、耳环)、细菌、霉菌、病毒、寄生虫等;(4)注射式过敏原:如青霉素、链霉素、异种血清等;(5)自身组织抗原:精神紧张、工作压力、受微生物感染、电离辐射、烧伤等生物、理化因素影响而使结构或组成发生改变的自身组织抗原,以及由于外伤或感染而释放的自身隐蔽抗原,也可成为过敏原。
3.氯雷他定(loratadine),化学名称为4-(8-氯-5,6-二氢-11h-苯并[5,6]-环庚并[1,2-b]吡啶-11-烯基)-1-哌啶羧酸乙酯,其分子式为c
22h23
cln2o2,分子量为382.89。氯雷他定是一种白色结晶性粉末,其在甲醇、乙醇中容易溶解,在0.1mol/l盐酸溶液中略微溶解,在水中几乎不溶,具有一定的脂溶性特点。
[0004]
氯雷他定是第二代抗组胺药物,分子结构中的两性离子特征使其无明显的中枢抑制作用,和第一代抗组织胺药相比,它的一大特性是无瞌睡作用。氯雷他定属于长效三环类抗组胺药,能够竞争性地抑制组胺h1受体,对h1受体有高度的选择性,从而抑制组胺所引起的过敏症状,作用强,时间长,且无明显的抗胆碱和中枢抑制作用。其临床主要用于防治过敏性鼻炎、慢性特发性荨麻疹、过敏性哮喘和特异性皮炎等疾病。
[0005]
氯雷他定属于bcs(biopharmaceutics classification system)ii类药物,即低溶解度高渗透性,此类药物的溶解度较低,药物的溶出是吸收的限速过程。这种低溶解度药物的生物利用度较低,提高药物的溶出度是改善生物利用度的有效途径。专利cn107648191b公开了一种氯雷他定片及其制备工艺,所述的氯雷他定片包括以下重量百分比计的制备原料:氯雷他定4-8%、填充剂(一)30~40%、填充剂(二)15-25%、填充剂(三)20-40%、稳定剂2-10%、山梨醇5-10%、崩解剂0.5-1.5%、润滑剂0.5-1.5%和粘合剂适量,所述的稳定剂为海藻酸和l-蛋氨酸以1:0.1-0.3的质量比组成,可促进氯雷他定片的崩解,还能提供一种酸性的环境,使氯雷他定持续有效地溶出,减少氯雷他定杂质的生成。专利cn108926542a公开了一种快速溶出的氯雷他定片及其制备方法,所述快速溶出的氯雷他定片包括如下重量份数的组分:氯雷他定10份,乳糖不低于60份,填充剂中淀粉不高于20份,粘合剂中淀粉干重4-6份,润滑剂0.5-1份。通过控制氯雷他定片中辅料乳糖、淀粉和硬
脂酸镁的组成和比例,并控制湿法制粒干燥后颗粒水分,达到使其快速溶出的目的。
[0006]
然而现有的氯雷他定制剂多为片剂、胶囊剂和糖浆剂;片剂、胶囊剂不利于儿童吞咽,且溶出度差,致使患者服用依从性较差;而糖浆剂的口感问题是氯雷他定运用于儿童普遍存在的问题。因此,亟需制备一种溶出度高、稳定性好的氯雷他定颗粒剂。
技术实现要素:
[0007]
为了解决现有技术中的上述问题,本技术提供了一种氯雷他定药物组合物及其制备方法。通过调整氯雷他定药物组合物中二氧化硅的含水量特性,从而提高了氯雷他定药物制剂的稳定性;该药物组合物还具备溶出快,生物利用度高,以及制备工艺简单,适合大规模生产等优点。
[0008]
为了实现上述发明目的,本发明提供如下技术方案:
[0009]
一方面,本发明提供了一种二氧化硅在制备氯雷他定药物组合物中的应用,所述的二氧化硅用于降低氯雷他定的降解。
[0010]
具体地,所述的二氧化硅的含水量为0.4-5%。
[0011]
进一步具体地,所述的二氧化硅的含水量为1.0-4.5%,优选为1.5-4.0%,更进一步优选为2.1-3.5%。
[0012]
进一步具体地,所述的二氧化硅的吸油值为50-200ml/100g,优选为65-150ml/100g,进一步优选为80-110ml/100g。
[0013]
另一方面,本发明提供了一种氯雷他定药物组合物,所述的氯雷他定药物组合物含有二氧化硅,所述的二氧化硅的含水量为0.4-5%。
[0014]
具体地,所述的二氧化硅的含水量为0.5-4.5%,优选为1.0-4.0%,进一步优选为1.5-4.0%,更优选为3.0-4.0%或2.1-3.5%。
[0015]
进一步具体地,所述的二氧化硅的平均粒径(激光法)为5-20μm,优选为6.1-7.7μm;所述的二氧化硅的吸油值为50-200ml/100g,优选为65-150ml/100g,进一步优选为80-110ml/100g。
[0016]
具体地,所述的氯雷他定药物组合物中氯雷他定和二氧化硅的重量比为1:0.1-8;优选为1:0.1-5;进一步优选为1:0.2-3。
[0017]
具体地,所述的氯雷他定药物组合物还含有药学上可接受的辅料;所述的辅料为填充剂或粘合剂中的一种或多种。
[0018]
进一步具体地,所述的氯雷他定、填充剂、粘合剂、二氧化硅的重量比为1:10-200:0.1-10:0.1-8,优选为1:30-150:0.2-7:0.1-5,进一步优选为1:60-130:0.3-5:0.2-3。
[0019]
进一步具体地,所述的填充剂为蔗糖、甘露醇、乳糖、淀粉或微晶纤维素中的一种或多种,所述的粘合剂包括为羟丙基纤维素、聚维酮k30、羧甲基纤维素钠或羧甲基淀粉钠中的一种或多种。
[0020]
具体地,所述的氯雷他定药物组合物的剂型为片剂、颗粒剂或胶囊剂,优选为颗粒剂。
[0021]
又一方面,本发明提供了上述药物组合物在制备抗过敏药物中的应用。
[0022]
又一方面,本发明提供了一种上述氯雷他定药物组合物的制备方法,所述的制备方法包括以下步骤:
[0023]
a)将氯雷他定、0-100%的填充剂、0%或100%的二氧化硅混合均匀;
[0024]
b)任选地加入剩余填充剂,混合均匀;
[0025]
c)湿法制粒:加入粘合剂制软材,过筛制粒;
[0026]
d)干燥、整粒:将湿颗粒干燥后过筛整粒,任选地与剩余的二氧化硅混合,制得所述药物组合物。
[0027]
具体地,步骤(a)中所述的填充剂用量为10-60%。
[0028]
又一方面,本发明提供了一种氯雷他定颗粒剂,所述的氯雷他定颗粒剂按照上述制备方法制备得到。
[0029]
与现有技术相比,本发明的积极和有益效果在于:
[0030]
(1)本发明发现不同性质的二氧化硅对氯雷他定药物组合物的稳定性有较大影响,本发明提供了一种含有特定含水量的二氧化硅在氯雷他定药物组合物中的应用,进一步提高了氯雷他定药物组合物稳定性、溶出度及安全性。
[0031]
(2)本发明所述的药物组合物含氯雷他定较少,混合较为困难,易产生含量不均匀问题,因此在混合阶段将氯雷他定与二氧化硅及部分填充剂预混后可大大改善混合不均匀的问题。
[0032]
(3)本发明中采用的制粒工艺为湿法制粒工艺,是目前最传统,最成熟的工艺,对设备要求较低,一般药厂均可生产,制备简单。
[0033]
(4)本专利所述颗粒剂易于服用,特别是对儿童和吞咽困难的老人;此外,由于颗粒剂还具有易于包装和称重并且携带方便等优点。
具体实施方式
[0034]
下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到,所用辅料,如无特殊说明,均为过80目筛。
[0035]
基础实施例:原辅料相容性实验
[0036]
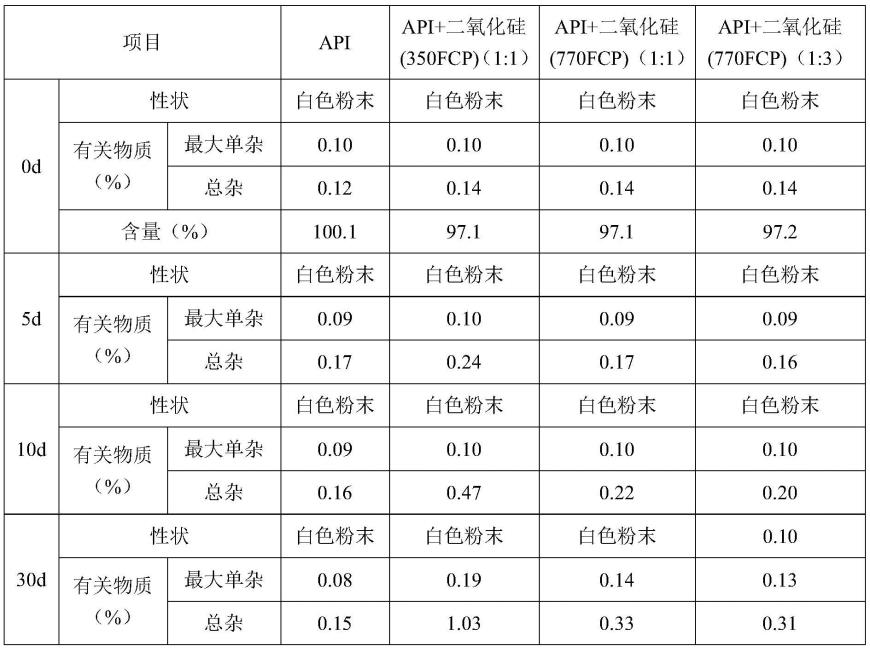
选择氯雷他定原料(简称:api)、二氧化硅(350fcp)、二氧化硅(770fcp)作为本实施例的处方组成,进行辅料相容性研究。分别将原辅料按一定比例进行混合(详见下表1备注),混合后取样品5g,置高温60℃条件放置5天、10天、30天,并与原料进行平行对照,取样检测性状、有关物质,试验结果见下表1。
[0037]
其中,二氧化硅购自日本富士硅化学株式会社,二氧化硅(770fcp)货号tk-2182,二氧化硅(350fcp)货号te-1361。二者质量控制指标重量除了粒径、吸油值、ph和含水量不同外,其他检测项基本一致,无明显差异。
[0038]
其中,二氧化硅(350fcp)的粒径为3.82μm,吸油值为321ml/100g,ph为7.7,含水量2.8%;二氧化硅770fcp的粒径为7.18μm,吸油值为100ml/100g,ph为5.7,含水量3.1%,这两种型号的二氧化硅的含水量均低于5%。
[0039]
表1
[0040][0041]
上述结果表明,在高温60℃条件下,含水量低于5%的二氧化硅(770fcp和350fcp)对原料的相容性较好,能起到降低氯雷他定降解的作用。另外,研究表明,在本发明所述的含水量下,吸油值对于降低氯雷他定降解有影响作用。
[0042]
实施例1一种氯雷他定药物组合物及其制备方法
[0043]
1、单剂量处方组成如下表2所示。
[0044]
表2
[0045][0046][0047]
其中,二氧化硅(770fcp)购自日本富士硅化学株式会社,货号tk-2182,其含水量标准为≤5.0%,平均粒径标准为6.10-7.70μm,吸油值标准为80-110ml/100g,ph标准为4.0-8.0。具体地,本实施例1所用的购买批次的二氧化硅(770fcp)的含水量为3.1%,平均粒径为7.18μm,吸油值为100ml/100g,ph为5.7。
[0048]
2、制备方法:
[0049]
(1)将1000片的处方量氯雷他定、40%的蔗糖、二氧化硅(770fcp)加入湿法制粒机,混合均匀;
[0050]
(2)加入剩余蔗糖,混合均匀;
[0051]
(3)以浓度为5%的羟丙基纤维素水溶液为粘合剂制备软材,制粒;
[0052]
(4)干燥、整粒:将湿颗粒45℃干燥后过筛整粒,制得所述药物组合物。
[0053]
实施例2一种氯雷他定药物组合物及其制备方法
[0054]
1、单剂量处方组成如下表3所示。
[0055]
表3
[0056]
成分单剂量(mg)氯雷他定5甘露醇300聚维酮k305.5二氧化硅2.5合计313
[0057]
其中,二氧化硅的含水量为3.5%,平均粒径为9.0μm,吸油值为90ml/100g,ph为7.0。
[0058]
2、制备方法:
[0059]
(1)将1000片的处方量氯雷他定、20%的甘露醇、二氧化硅加入湿法制粒机,混合均匀;
[0060]
(2)加入剩余甘露醇,混合均匀;
[0061]
(3)以浓度为8%的聚维酮k30水溶液为粘合剂制备软材,制粒;
[0062]
(4)干燥、整粒:将湿颗粒50℃干燥后过筛整粒,制得所述药物组合物。
[0063]
实施例3一种氯雷他定药物组合物及其制备方法
[0064]
1、单剂量处方组成如下表4所示。
[0065]
表4
[0066]
成分单剂量(mg)氯雷他定5蔗糖350羟丙基纤维素2.5二氧化硅1.5合计359
[0067]
其中,二氧化硅的含水量为3.0%,平均粒径为6.10μm,吸油值为105ml/100g,ph为5.0。
[0068]
2、制备方法:
[0069]
(1)将1000片的处方量氯雷他定、50%的蔗糖、二氧化硅(770fcp)加入湿法制粒机,混合均匀;
[0070]
(2)加入剩余蔗糖,混合均匀;
[0071]
(3)以浓度为4%的羟丙基纤维素水溶液为粘合剂制备软材,制粒;
[0072]
(4)干燥、整粒:将湿颗粒55℃干燥后过筛整粒,制得所述药物组合物。
[0073]
实施例4一种氯雷他定药物组合物及其制备方法
[0074]
1、单剂量处方组成如下表5所示。
[0075]
表5
[0076]
成分单剂量(mg)氯雷他定5蔗糖600羟丙基纤维素15二氧化硅(770fcp)10合计612.5
[0077]
其中,二氧化硅的含水量为3.0%,平均粒径为7.10μm,吸油值为100ml/100g,ph为5.7。
[0078]
2、制备方法:
[0079]
(1)将1000片的处方量氯雷他定、30%的蔗糖、二氧化硅加入湿法制粒机,混合均匀;
[0080]
(2)加入剩余蔗糖,混合均匀;
[0081]
(3)以浓度为5%的羟丙基纤维素水溶液为粘合剂制备软材,制粒;
[0082]
(4)干燥、整粒:将湿颗粒40℃干燥后过筛整粒,制得所述药物组合物。
[0083]
实施例5一种氯雷他定药物组合物及其制备方法
[0084]
1、单剂量处方组成如下表6所示。
[0085]
表6
[0086]
成分单剂量(mg)氯雷他定5蔗糖489.5羟丙基纤维素3二氧化硅(770fcp)2.5合计500
[0087]
其中,二氧化硅的含水量为3.0%,平均粒径为7.10μm,吸油值为100ml/100g,ph为5.7。
[0088]
2、制备方法:
[0089]
(1)将1000片的处方氯雷他定(过60目筛)、蔗糖(过60目筛)加入湿法制粒机中混合均匀;
[0090]
(2)加入10%的羟丙基纤维素水溶液,制粒;
[0091]
(3)干燥,整粒:将湿颗粒45℃干燥;
[0092]
(4)和二氧化硅混合:将干颗粒和二氧化硅混合,得到颗粒混合物。
[0093]
对比例1一种氯雷他定药物组合物及其制备方法
[0094]
1、单剂量处方组成如下表7所示。
[0095]
表7
[0096][0097][0098]
其中,二氧化硅(350fcp)购自日本富士硅化学株式会社,货号te-1361,其含水量标准为≤5.0%,平均粒径标准为3.50-4.30μm,吸油值标准为300-350ml/100g,ph标准为4.0-8.0。具体地,本对比例1所用的购买批次的二氧化硅(350fcp)的含水量为2.8%,平均粒径为3.82μm,吸油值为321ml/100g,ph为7.7。
[0099]
2、制备方法:
[0100]
(1)将1000片的处方量氯雷他定、40%的蔗糖、二氧化硅(350fcp)加入湿法制粒机,混合均匀;
[0101]
(2)加入剩余蔗糖,混合均匀;
[0102]
(3)以5%的羟丙基纤维素水溶液为粘合剂制备软材,制粒;
[0103]
(4)干燥、整粒:将湿颗粒干燥后45℃过筛整粒,制得所述药物组合物。
[0104]
对比例2一种氯雷他定药物组合物及其制备方法
[0105]
1、单剂量处方组成如下表8所示。
[0106]
表8
[0107]
成分单剂量(mg)氯雷他定5蔗糖487.5羟丙基纤维素5硬脂酸镁2.5合计500
[0108]
2、制备方法:
[0109]
(1)将1000片的处方量氯雷他定、40%的蔗糖、硬脂酸镁加入湿法制粒机,混合均匀;
[0110]
(2)加入剩余蔗糖,混合均匀;
[0111]
(3)以10%的羟丙基纤维素水溶液为粘合剂制备软材,制粒;
[0112]
(4)干燥、整粒:将湿颗粒45℃干燥后过筛整粒,制得所述药物组合物。
[0113]
对比例3一种氯雷他定药物组合物及其制备方法
[0114]
1、单剂量处方组成如下表9所示。
[0115]
表9
[0116]
成分单剂量(mg)氯雷他定5蔗糖489.5
羟丙基纤维素3胶态二氧化硅2.5合计500
[0117]
胶态二氧化硅,购自evonik公司,批号:159042214,其含水量为0.2%,ph值为4.2。
[0118]
2、制备方法:
[0119]
(1)将1000片的处方量氯雷他定(过60目筛)、蔗糖(过60目筛)加入湿法制粒机中混合均匀;
[0120]
(2)加入10%的羟丙基纤维素水溶液,制粒;
[0121]
(3)干燥,整粒:将湿颗粒45℃干燥;
[0122]
(3)和胶态二氧化硅混合:将干颗粒和胶态二氧化硅混合,得到颗粒混合物。
[0123]
实验例1稳定性实验
[0124]
将上述实施例1-5和对比例1-3的样品分别放置在高温60℃条件下,分别于5天、10天、30天检测有关物质,结果见下表10。
[0125]
表10
[0126][0127]
本发明中有关物质检测方法参见欧洲药典(ep8.8)氯雷他定有关物质检测方法。
[0128]
以上仅为本发明的实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些均属于本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。