1.本发明涉及生物样本处理技术领域,具体而言,涉及一种粘性生物样本液化组合物及其应用。
背景技术:
2.随着荧光定量pcr以及多重pcr等技术在病原体检测领域的快速发展,通过痰液样本类型检测是否感染相应的病原体种类的需求日益增加。然而痰液样本具有粘度大、蛋白多、成分复杂的特点,包含粘蛋白和其他多种蛋白(如免疫蛋白)、多种酶类、脱落细胞、微生物及其他吸入杂质等,不便于直接检测,临床上痰液样本的检测需要先对痰液进行液化处理。
3.常见的痰液液化方法为氢氧化钠法、dtt(二硫苏糖醇)法以及蛋白酶法。氢氧化钠法是最常用的痰液液化方法,该方法比较简单,利用主成分为一定浓度的氢氧化钠溶液在60℃~80℃(也可在室温条件下)液化痰液,该方法用于核酸检测时其强碱性环境易造成核酸损失。蛋白酶法的原理是利用蛋白酶消化痰液黏蛋白,该方法的酶解反应耗时较长,所需蛋白酶成本较高,且黏蛋白消化效率低。dtt(二硫苏糖醇)法是目前最常用的痰液液化方法,利用含巯基(-sh)的dtt(二硫苏糖醇)断裂痰液中导致粘稠的主要成分粘蛋白,以pbs缓冲液(磷酸盐缓冲液)提供生理缓冲,通常还会加入乙醇等固定细胞。该方法耗时长,且使用的dtt(二硫苏糖醇)成本较高,且dtt稳定性差,需要在低温条件下保存,同时dtt存在一定的毒性,不适合临床上大批量处理痰液样本。此外,由于痰液样本粘度大,常规液化处理过程中易产生混合不均的问题。痰液样本中的核酸(尤其是rna)极不稳定,通常在温室条件下数小时就被降解。然而在临床检测中,往往不能及时处理和检测痰液样本中的核酸,因此发明一种能够快速充分液化痰液同时有效保护样本核酸的方法十分必要。目前已公开的关于痰液液化及核酸保护的发明较多。然而,这些方法普遍存在成分复杂、成本高、操作复杂、样本混匀及液化不充分等问题。
4.有鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于提供一种粘性生物样本液化组合物,其包含愈创甘油醚和强碱。
6.本发明的再一目的在于提供一种试剂盒,其含有如上所述粘性生物样本液化组合物。
7.本发明的再一目的在于提供一种粘性生物样本液化方法,包括:
8.a)将粘性生物样本与如上所述的组合物混合得到混合物;
9.b)孵育所述混合物。
10.本发明还提供了粘性生物样本中核酸的释放方法,包括:
11.使用如上所述的方法将所述粘性生物样本液化;
12.使用核酸释放剂释放所述粘性生物样本中的核酸。
13.本发明还提供了粘性生物样本中核酸的提取方法,包括:
14.使用如上所述的方法释放所述粘性生物样本中的核酸;
15.使用核酸提取剂提取释放的核酸。
16.本发明还提供了粘性生物样本中核酸的扩增方法,包括:
17.使用如上所述的方法释放所述粘性生物样本中的核酸;
18.任选的使用核酸提取剂提取释放的核酸;
19.使用核酸扩增剂扩增核酸。
20.本发明还提供了粘性生物样本中核酸的检测方法,包括:
21.使用如上所述的方法释放所述粘性生物样本中的核酸;
22.任选的使用核酸提取剂提取释放的核酸;
23.任选的使用核酸扩增剂扩增核酸;
24.使用核酸检测剂检测核酸。
25.本发明的有益效果为:
26.能够快速将粘性生物样本进行液化,使样本的粘稠度下降,使得后续操作易于进行,且在室温下即可进行,对操作条件要求不苛刻,也不影响后续核酸检测,且可兼容免提取扩增体系,对样本中核酸的保存时间也无明显的影响。
附图说明
27.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
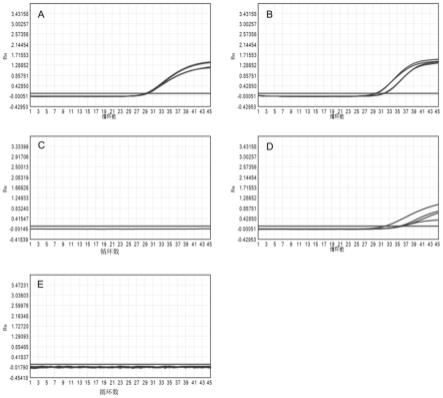
28.图1为本发明一个实施例中各组对人基因组快速检测所得扩增曲线;a实验组;b蛋白酶法;c氢氧化钠法;d dtt法;e乙酰半胱氨酸法;
29.图2为本发明一个实施例中本发明一个实施例中各组对呼吸道合胞病毒检测所得扩增曲线;a实验组;b蛋白酶法;c氢氧化钠法;d dtt法;e乙酰半胱氨酸法;
30.图3为本发明一个实施例中对免提取扩增体系(引入扩增提取的核酸未纯化)的影响验证;a为1号样本基质影响测试扩增曲线结果;b为2号样本基质影响测试扩增曲线结果;
31.图4为本发明一个实施例中试剂液化后的样本稳定性测试结果;a为实验组rna稳定性曲线;b为实验组dna稳定性曲线;c为对照组rna稳定性曲线;d为对照组dna稳定性曲线。
具体实施方式
32.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
33.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的
技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
34.本发明涉及一种粘性生物样本液化组合物,其包含愈创甘油醚和强碱。
35.在本发明中,术语“生物样本”、“样本”等是指动物样本;可以来自动物(优选至少包括哺乳动物,例如灵长类动物,包括人)的组织或器官、组织裂解液;细胞(在受试者体内、直接取自受试者、或保持在培养物中的或来自培养细胞系的细胞)、细胞裂解物(或裂解物部分)或细胞提取物;含有一种或多种衍生自细胞、细胞材料或病毒材料(例如多肽或核酸)的分子的溶液;或含有天然或非天然存在的核酸的溶液,其被或可以如本文所述进行测定。在一些实施方式中,样片中含有核酸。样品也可以是含有一种或多种细胞、细胞组分或核酸的任何体液或排泄物,包括但不限于细胞、核或无细胞核酸。特别地,本发明的生物样本优选来自体液,体液包括来自动物的液体、半固体、充气液体、液体-气体混合物等。此类体液可包括但不限于唾液、痰液、血清、血浆、血液、尿液、粘液、汗液、眼泪或其他眼部液体、耳部液体、脸(例如,来自水疱或疮)、胃液或胃汁、粪便液、胰液或汁、精液、哺乳或测定产物、脊髓液、液体骨髓或淋巴液。
[0036]“粘性生物样本”是指具有粘性的生物样本,特别是具有粘性的体液。粘性可源自于生物样本中存在大量的黏蛋白和多糖(特别是粘多糖)或者蛋白聚糖等成分。优选的粘性生物样本为痰液或宫颈粘液。“黏蛋白”是指任何提高分泌细胞周围细胞质基质粘度的粘性蛋白。“痰液”是指包含在哺乳动物的鼻腔或口腔中,或从其中排出的粘性物质(通常是从呼吸道中排出)。
[0037]
在一些实施方式中,所述的粘性生物样本液化组合物还包含刚性微颗粒。
[0038]
刚性微颗粒的材质可以是任意的硬质材料,其在混合/辅助混合粘性生物样本的时候通常不发生明显破损,且不释放干扰后续流程(如核酸的保存、释放、富集、扩增、检测中的至少一个流程)的成分。其材质包括但不限于金属(可以为单质或合金)或金属氧化物、陶瓷、玻璃、硬质塑料、天然或人工的矿物成分等。在一些优选的实施方式中,所述刚性微颗粒的材质包括氧化锆、氮化硅、陶粒、硬质不锈钢、硬质碳化钨、烧结刚玉和玛瑙中的至少一种。
[0039]
刚性微颗粒可用于辅助混匀粘性生物样本和所述粘性生物样本液化组合物,减少处理时间,增加处理效率。
[0040]
在本发明中,术语“微颗粒”可以为球体、近球体、立方体、多面体或不规则形状,优选为微球。微颗粒的平均粒径优选为毫米级,例如0.01mm~500mm、也可以为0.05mm、0.1mm、0.2mm、0.3mm、0.4mm、0.5mm、1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、20mm、30mm、40mm、50mm、100mm、200mm、300mm、400mm以及500mm,进一步优选为0.01mm~10mm。
[0041]
在本发明中,术语“强碱”是指在水溶液中电离出的阴离子全部是氢氧根离子的物质。其可以是有机强碱或无机强碱,包括但不限于氢氧化锂、氢氧化钠、氢氧化钾、氢氧化铷、氢氧化钫、氢氧化铯、氢氧化钙、胆碱、氢氧化银、氢氧化亚铊、季铵碱、氢氧化锶、氢氧化钡、氢氧化镭、氢氧化二氨合银中的至少一种。在优选的实施方式中,所述强碱为氢氧化钠和/或氢氧化钾。
[0042]
所述组合物可以是固体(优选干粉状固体)或者液体,或者介于二者之间的状态例
如凝胶态。在一些实施方式中,所述组合物为溶液。
[0043]
溶液的溶剂可以为水,例如蒸馏水、纯化水、过滤水、去离子水等;优选为无核酸水,更优选无核酸酶的水。
[0044]
在一些实施方式中,所述组合物为溶液,所述刚性微颗粒的浓度为0.1g/ml~2.0g/ml,例如0.2g/ml、0.3g/ml、0.4g/ml、0.5g/ml、0.6g/ml、0.7g/ml、0.8g/ml、0.9g/ml、1.0g/ml、1.1g/ml、1.2g/ml、1.3g/ml、1.4g/ml、1.5g/ml、1.6g/ml、1.7g/ml、1.8g/ml或1.9g/ml。
[0045]
本发明还涉及试剂盒,其含有如上所述粘性生物样本液化组合物。
[0046]
在一些实施方式中,所述的试剂盒还含有用于核酸的保存剂、释放剂、提取剂、扩增剂以及检测剂中的任意一种或多种。
[0047]
在一些实施方式中,所述核酸包括dna和/或rna,其形式是多样的,可以是短寡核苷酸、长寡核苷酸或多聚核苷酸的形式。也可以是双链dna和单链dna以及双链rna和单链rna。在一些具体的实施方式中,核酸可以是基因、cdna分子、mrna、trna、rrna、非编码rna分子等,以及上述核酸形式的片段例如寡核苷酸。
[0048]
根据本发明的再一方面,还涉及一种粘性生物样本液化方法,包括:
[0049]
a)将粘性生物样本与如上所述的组合物混合得到混合物;
[0050]
b)孵育所述混合物。
[0051]
在一些实施方式中,所述混合物的ph值≥10,例如11、11.5、12、12.5、13、13.5、14、14.5、15,优选12~14。
[0052]
在一些实施方式中,所述愈创甘油醚在所述混合物中的浓度为1mmol/l~1mol/l,例如5mmol/l、10mmol/l、50mmol/l、60mmol/l、70mmol/l、80mmol/l、90mmol/l、100mmol/l、110mmol/l、120mmol/l、130mmol/l、140mmol/l、150mmol/l、200mmol/l、300mmol/l、400mmol/l、500mmol/l、600mmol/l、700mmol/l、800mmol/l或900mmol/l。
[0053]
在一些实施方式中,所述孵育的温度为18~35摄氏度,也可以选择20、21、22、23、24、25、26、27、28、29、30、31、32、33、34摄氏度。
[0054]
在一些实施方式中,所述孵育的时间≥5min,也可以选择6min、7min、8min、9min、10min、15min、20min、30min或更多。
[0055]
在一些实施方式中,以搅拌或震荡的方式进行混合。
[0056]
根据本发明的再一方面,还涉及粘性生物样本中核酸的释放方法,包括:
[0057]
使用如上所述的方法将所述粘性生物样本液化;
[0058]
使用核酸释放剂释放所述粘性生物样本中的核酸。
[0059]
术语“核酸的释放”是指核酸从样片中释放出来并处于可提取/富集/纯化/检测的状态。核酸的释放通常伴随着细胞的裂解以及,杂质成分如蛋白、脂质、多糖等组分与核酸组分在物理状态上的分离,与生理状态下不同,它们之间可以通过简单的离心等方法分离,且核酸可以被某些检测试剂直接检测到。
[0060]
根据本发明的再一方面,还涉及粘性生物样本中核酸的提取方法,包括:
[0061]
使用如上所述的方法释放所述粘性生物样本中的核酸;
[0062]
使用核酸提取剂提取释放的核酸。
[0063]
术语“核酸的提取”是指将释放的核酸与杂质分离过程,常常伴随核酸组分的纯
化。例如离心,磁珠富集,化学试剂处理导致的样品成分分层等。
[0064]
根据本发明的再一方面,还涉及粘性生物样本中核酸的扩增方法,包括:
[0065]
使用如上所述的方法释放所述粘性生物样本中的核酸;
[0066]
任选的使用核酸提取剂提取释放的核酸;
[0067]
使用核酸扩增剂扩增核酸。
[0068]
术语“扩增(ampiifying或amplification)”在“核酸”此用语的上下文中共同出现时,指产生多个拷贝的多核苷酸、或多核苷酸的部分,通常从少量的多核苷酸开始(例如,少至单个多核苷酸分子),其中扩增产物或扩增子通常是可检测的。多核苷酸的扩增包括多种化学和酶促方法。在聚合酶链反应(pcr)、滚环扩增(rca)或连接酶链反应(lcr)过程中从一个或几个拷贝的靶dna或模板dna分子产生多个dna拷贝是扩增的形式。扩增不限于起始分子的严格复制。例如,使用逆转录rt-pcr从样品中有限量的rna产生多个cdna分子是扩增的形式。此外,在转录过程期间从单一dna分子产生多个rna分子也是扩增的形式。扩增可用于测序前的建库。
[0069]
本发明还涉及粘性生物样本中核酸的检测方法,包括:
[0070]
使用如上所述的方法释放所述粘性生物样本中的核酸;
[0071]
任选的使用核酸提取剂提取释放的核酸;
[0072]
任选的使用核酸扩增剂扩增核酸;
[0073]
使用核酸检测剂检测核酸。
[0074]
核酸的检测方法可以依赖或不依赖核酸的扩增。如本文所用,术语“核酸的检测方法”是指确定目标核酸的核苷酸组成的任何方,包括但不限于dna测序方法、探针杂交方法、结构特异性裂解测定(例如,invader测定,(hologic,inc.)并且描述于例如美国专利号5,846,717、5,985,557、5,994,069、6,001,567、6,090,543和6,872,816;lyamichev等人,nat.biotech.,17:292(1999),hall等人,pnas,usa,97:8272(2000),以及us 2009/0253142,其各自出于所有目的全文以引用的方式并入本文);酶错配裂解方法(例如,variagenics,美国专利号6,110,684、5,958,692、5,851,770,其全文以引用的方式并入本文);以上所述的聚合酶链反应(pcr);分支杂交方法(例如,chiron,美国专利号5,849,481、5,710,264、5,124,246和5,624,802,其全文以引用的方式并入本文);滚环式复制(例如,美国专利号6,210,884、6,183,960和6,235,502,其全文以引用的方式并入本文);nasba(例如,美国专利号5,409,818,其全文以引用的方式并入本文);分子信标技术(例如,美国专利号6,150,097,其全文以引用的方式并入本文);e-传感器技术(motorola,美国专利号6,248,229、6,221,583、6,013,170和6,063,573,其全文以引用的方式并入本文);环状探针技术(例如美国专利号5,403,711、5,011,769和5,660,988,其全文以引用的方式并入本文);dade behring信号扩增方法(例如美国专利号6,121,001、6,110,677、5,914,230、5,882,867和5,792,614,其全文以引用的方式并入本文);连接酶链反应(例如,baranay proc.natl.acad.sci usa 88,189-93(1991));以及夹心杂交方法(例如,美国专利号5,288,609,其全文以引用的方式并入本文)。
[0075]
下面将结合实施例对本发明的实施方案进行详细描述。
[0076]
实施例1本发明液化效果测试
[0077]
本发明试剂使用愈创甘油醚、氢氧化钠、氧化锆珠配制而成。终浓度为100mm愈创
甘油醚、10mm氢氧化钠、1g/ml氧化锆珠(通径为1mm)配制试剂使用的溶剂为纯化水,将其作为实验组。
[0078]
收集得到的4例目测较为粘稠的痰液样本(i、ii、iii、iv),将这些痰液样本每一例单独充分混合,并且每例分别取6份2ml样本,编号1~6。备用。
[0079]
向1号样本中加入实验组试剂6ml;
[0080]
向2号样本中加入6ml二硫苏糖醇溶液(2%dtt);
[0081]
向3号样本中加入6ml氢氧化钠溶液(0.1m);
[0082]
向4号样本中加入6ml终浓度为100mm乙酰半胱氨酸、10mm氢氧化钠、1g/ml氧化锆珠(通径为1mm)配制的试剂;
[0083]
向5号样本中加入6ml终浓度为100mm愈创甘油醚;
[0084]
向6号样本中加入10mm氢氧化钠室温振荡混匀5分钟处理痰液后,调ph为中性,再加入100mm愈创甘油醚室温振荡混匀5分钟;
[0085]
以上样本均振荡混匀5分钟,在室温下进行;
[0086]
利用移液器分别吸取上步得到的液化后的4例样本,观察并记录吸取过程,结果如下表所示。
[0087]
结果表明,本方法液化后的痰液可顺利被10ul移液器吸取操作,证明本方法对痰液液化效果较好,粘稠度明显下降。
[0088]
使用乙酰半胱氨替代在本方法体系中的愈创甘油醚发现液化效果出现下降。另在仅愈创甘油醚在单一组分情形下,液化效果也出现下降。
[0089][0090]
此外,进一步的,对于上述仅单独的愈创甘油醚组(常温中性条件下,未加入氧化锆珠处理30min)液化效果一般(个别浓痰吸头吸取时存在拉丝现象)。但无可见痰液。入95℃加热30min条件下可与实验组液化效果相当。
[0091]
实施例2不同浓度的液化组分配合氧化锆珠的效果测试
[0092]
本发明试剂由以下组分中的一种或多种组成;愈创甘油醚、氢氧化钠、氧化锆珠。
[0093]
实验组1:终浓度为100mm愈创甘油醚、10mm氢氧化钠、1g/ml氧化锆珠(通径为1mm)配制试剂使用的溶剂为纯化水。
[0094]
实验组2:终浓度为1mm愈创甘油醚、1000mm氢氧化钠、1g/ml氧化锆珠(通径为1mm)
配制试剂使用的溶剂为纯化水。
[0095]
实验组3:终浓度为1mm愈创甘油醚、1g/ml氧化锆珠(通径为1mm)、0.1mm氢氧化钠配制试剂使用的溶剂为纯化水。
[0096]
收集得到的4例目测较为粘稠的痰液样本(i、ii、iii、iv),将这些痰液样本每一例单独充分混合,并且每例分别取3份2ml样本,编号1~3。备用。
[0097]
向1号样本中加入实验组1试剂6ml(混合后ph=12);
[0098]
向2号样本中加入实验组2试剂6ml(混合后ph=14);
[0099]
向3号样本中加入实验组3试剂6ml(混合后ph=10);
[0100]
以上样本均振荡混匀5分钟,在室温下进行;
[0101]
利用移液器分别吸取上步得到的液化后的4例样本,观察并记录吸取过程,结果如下表所示。
[0102]
结果表明,各实验组方法液化后的痰液可顺利被10ul移液器吸取操作,证明本方法对痰液在较为宽泛的愈创甘油醚浓度和ph下液化效果均较好,粘稠度明显下降。
[0103][0104]
实施例3本试剂与其他方法对液化后痰液样本快速检测对比
[0105]
本发明试剂使用愈创甘油醚、氢氧化钠、氧化锆珠配制而成。终浓度为100mm愈创甘油醚、10mm氢氧化钠、1g/ml氧化锆珠(通径为1mm)配制试剂使用的溶剂为纯化水,将其作为实验组。
[0106]
收集得到的4例目测较为粘稠的痰液样本(i、ii、iii、iv),将这些痰液样本每一例单独充分混合,并且每例分别取5份2ml样本,编号1~5。备用。
[0107]
向1号样本中加入实验组试剂6ml;向2号样本中加入2.5g盐酸胍 0.5g乙酰半胱氨酸 2g聚丙烯颗粒(公开号cn108949748a、公开日2018-12-07的专利文件所公开的方法);向3号样本中加入6ml二硫苏糖醇溶液(2%dtt);向4号样本中加入6ml胰蛋白酶溶液(含ph7.0的缓冲体系);向5号样本中加入6ml氢氧化钠溶液(0.1m),以上样本均振荡混匀5分钟,在室温下进行;
[0108]
利用移液器分别吸取上步得到的液化后的4例样本,(未液化样本12000rmp转离心1min取上清)。
[0109]
采用圣湘生物科技股份有限公司生产的核酸提取或纯化试剂(rna一步法释放剂)进行提取,圣湘生物公司生产的六项呼吸道病原体核酸检测试剂盒(pcr-荧光探针法)进行检测。检测结果如下表所示,检测本发明液化后的4例样本,人基因组dna可正常检出(ct值均小于40)。呼吸道合胞病毒均为阳性(ct值均小于40),其他方法dna及rna检测ct值均受到不同程度的影响。说明其他方法液化样本后无法直接进行快速提取检测。对poct检测系统存在阻力。上述实验结果的扩增曲线分别如图1和图2所示。
[0110][0111]
实施例4本发明试剂对免提取扩增体系(引入扩增提取的核酸未纯化)的影响验证
[0112]
本发明试剂使用愈创甘油醚、氢氧化钠、氧化锆珠配制而成。终浓度为100mm愈创甘油醚、10mm氢氧化钠、1g/ml氧化锆珠(通径为1mm)配制试剂使用的溶剂为纯化水。
[0113]
选取2份咽拭子样本分别使用本发明试剂及生理盐水作为基质100倍稀释后,采用圣湘生物科技股份有限公司生产的核酸提取或纯化试剂(rna一步法释放剂)进行提取,圣湘生物公司生产的六项呼吸道病原体核酸检测试剂盒(pcr-荧光探针法)进行检测。检测结果如下表所示和图3所示,实验表明,本发明针对选取的2份样本稀释处理后,使用荧光定量pcr方法免提取扩增体系测试核酸浓度值与生理盐水基质稀释测试核酸浓度值差异非常小,说明本试剂对后端核酸提取及荧光定量pcr方法扩增检测无抑制作用。对后端应用友好性强。
[0114][0115]
实施例5本发明试剂液化后的样本稳定性测试。
[0116]
本发明试剂使用愈创甘油醚、氢氧化钠、氧化锆珠配制而成。终浓度为100mm愈创甘油醚、10mm氢氧化钠、1g/ml氧化锆珠(通径为1mm)配制试剂使用的溶剂为纯化水。
[0117]
收集得到的1例目测较为粘稠的痰液样本,分成2份。其中一份加入3倍体积生理盐水研磨仪研磨均质化,备用。另一份痰液样本与本发明试剂充分混合,分装成11份样本,编号1-11。备用。液化后的样本在37℃条件下放置0h、4h、8h、24h、48h、72h、96h、120h、144h、168h、192h时分别采用圣湘生物科技股份有限公司生产的核酸提取或纯化试剂(rna一步法释放剂)进行提取,圣湘生物公司生产的六项呼吸道病原体核酸检测试剂盒(pcr-荧光探针法)进行检测。检测结果如下表所示,实验表明,本发明液化处理后的样本采用快速免纯化检测系统检测rna能在24h内稳定检出,4h内浓度无明显变化。本发明液化处理后的样本采用快速免纯化检测系统检测dna能在192h内稳定检出,144h内浓度无明显变化。与对照组相比rna与dna在37℃条件下核酸被检出的能力相当。实验结果如下表和图4所示。
[0118][0119]
实施例6本发明试剂对液化宫颈粘液的效果
[0120]
本发明试剂使用愈创甘油醚、氢氧化钠、氧化锆珠配制而成。终浓度为100mm愈创甘油醚、10mm氢氧化钠、1g/ml氧化锆珠(通径为1mm)配制试剂使用的溶剂为纯化水。
[0121]
于圣维尔医学检验中心收集得到的4例目测较为粘稠的宫颈粘液样本,将宫颈粘液样本与本发明试剂按照体积比1:3进行充分混合,振荡混匀5分钟。
[0122]
利用移液器分别吸取上步得到的液化后的4个样本,观察并记录吸取过程,结果如下表所示,结果表明,本方法液化后的宫颈粘液可顺利被10ul移液器吸取操作,证明本方法对痰液液化效果较好,粘稠度明显下降。
[0123][0124]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0125]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。