1.本发明属于生物医药技术领域,具体涉及一种载物脂质体的多靶点复合体及含其的载药平台与应用。
背景技术:
2.肿瘤是一类严重危害人类生命健康的重大疾病。免疫治疗是近几年发展最为迅速的治疗肿瘤的手段,可称作肿瘤治疗的一场革命。免疫治疗利用人体自身的免疫功能,对肿瘤细胞进行攻击,控制肿瘤的发展及转移。但是,由于肿瘤在癌变之前难以被免疫监视系统发现,而在肿瘤发生发展中,免疫功能可能通过免疫检查点受到抑制,发生免疫逃逸。因此,利用自身免疫抗肿瘤的两个关键点是:(1)通过免疫通路激活剂/激动剂,增强天然免疫能力;(2)破坏免疫检查点对免疫细胞的抑制,防止免疫逃逸。肿瘤的免疫治疗包括免疫检查点抑制剂单克隆抗体药物、细胞免疫治疗等。
3.sting(干扰素基因刺激因子,stimulator of interferon genes),也称作mita、tmem73、eris、net23、mpys等,是一种内质网(er)受体蛋白,激活sting可以增强先天免疫系统抗肿瘤或抗感染的能力。在感染的哺乳动物细胞中微生物和病毒dna能通过刺激干扰素分泌诱导内源强有力的免疫应答。先天免疫sting通路激动剂cgamp在抗肿瘤方面的药效已被证实。通过免疫激活或加强先天免疫通路,激活树突状细胞等免疫细胞,进而诱导激活细胞毒性t细胞杀肿瘤细胞。
4.内质网受体蛋白(例如sting)对胞质dna的免疫应答是必需的因素。研究表明,环化cgmp-amp二核苷酸合成酶(cgas)在结合dna后的活化条件下,内源性地催化环二核苷酸cgamp的合成。cgamp作为第二信使通过sting刺激干扰素ifn-i的响应,介导tbk1和irf-3的活化,进而启动i型干扰素ifn-β基因的转录。sting是内质网的跨膜蛋白,内质网上具有一种外核苷酸焦磷酸酶/磷酸二酯酶1(ectonucleotide pyrophosphatase/phos-phodiesterase1,enpp1)的水解酶。enpp1在还原状态下以单体形式存在,分子量为115kd;在非还原情况下以二聚体形式存在,分子量为230kd。enpp1是跨膜蛋白,位于细胞膜或者内质网上,enpp1可以分泌到胞外,以可溶性的n端裂解的单体形式存在。enpp1不但可以水解天然核苷酸中的磷酸二酯键,还可以水解环二核苷酸cgamp。将小鼠的enpp1基因敲除,cgamp的半衰期有很大的提高。cgamp会通过某种特殊的方式离开病毒细胞或者癌细胞转移到其他的宿主细胞中,然后通过激活宿主细胞的sting来诱导i型干扰素的表达。cgamp会被细胞外游离的enpp1降解。因此,阻止sting激动剂cgamp被enpp1水解是保持免疫激动剂有效寿命和药效的必然选择,高效的enpp1抑制剂对于提高肿瘤免疫治疗效果有着重要的作用。
5.纳米抗体(nanobody)是一种单域抗体,天然缺失重链恒定区1(ch1)和轻链,具有结构稳定、分子小、溶解性好、耐受各类不良环境、易于人源化等优点,但是不同的纳米抗体有其特异性,在药物中的应用大多仍在临床研究中。
6.作为一种药物载体,纳米脂质体在延长药物半衰期、增强药效、靶向定点给药等方
面具有广阔的应用前景。但是,如何制备稳定性好、包封率高、易于逃过细胞保护屏障进入细胞的靶向脂质体仍然是一个挑战。为了进一步提高药物的精准靶向性和利用率,单克隆抗体等免疫靶向脂质体可以靶向免疫细胞和肿瘤微环境,但是,单克隆抗体有分子量大、制备成本昂贵且难于量产、免疫反应等问题,形成了严峻挑战。
技术实现要素:
7.本发明所要解决的技术问题是为了克服现有技术中缺少稳定性好、包封率高、药效好的可靶向定点给药的载物脂质体的缺陷,提供一种载物脂质体的多靶点复合体及含其的载药平台与应用。本发明的载物脂质体的多靶点复合体共载sting激动剂、enpp1抑制剂和免疫检查点抑制剂,能快速精准靶向肿瘤微环境,将主动免疫激活剂和防止免疫逃逸的阻断剂抗体相结合,提高抗肿瘤活性。
8.发明人研究发现,当脂质体外侧连接抗体时,脂质体在肿瘤微环境内可作为肿瘤细胞与免疫细胞的衔接器,促进肿瘤细胞与免疫细胞的相互作用。因此,发明人尝试结合免疫检查点抑制剂与免疫通路激动剂、以及肿瘤靶向试剂,发现结合后的脂质体可以有效解除肿瘤微环境内的免疫抑制,阻断免疫逃逸,从而增强靶向作用和免疫检查点抑制剂的抑制作用,并进一步可以协同增强抗肿瘤效应。但是一味抑制免疫检查点、活化免疫通路导致细胞因子风暴等免疫反应,为了平衡多种抑制剂和受体间的相互作用,发明人增加相应的抑制剂并通过大量复杂的实验获得了可以有效提高抗肿瘤作用且不产生免疫风暴的载物脂质体的多靶点复合体。为了进一步优化多靶点复合体的性能,选择分子量小、组织穿透能力好、特异性强、亲和力高、对人的免疫原性弱、避免fc段引起的补体反应的抗体作为多靶点复合体的组成部分,发明人对现有抗体或其抗原结合片段进行了大量筛选,发现纳米抗体具有较强的表位识别与结合能力,体积小,使其能够高密度地牢固结合在固相载体上捕捉微量抗原,有效提高了多靶点复合体的结合活性。
9.本发明通过以下技术方案解决上述技术问题:
10.本发明的第一方面提供一种载物脂质体的多靶点复合体,其包含:干扰素基因刺激因子(sting)激动剂、免疫检查点抑制剂、外核苷酸焦磷酸酶/磷酸二酯酶(enpp1)抑制剂和脂质体;其中,所述脂质体为具有同心脂质双层膜和亲水性内核的单室封闭囊泡,所述sting激动剂位于所述亲水性内核中,所述外核苷酸焦磷酸酶/磷酸二酯酶抑制剂位于所述同心脂质双层膜的疏水夹层中,所述免疫检查点抑制剂与所述脂质体的外表面连接;所述免疫检查点抑制剂靶向至少两个不同的免疫检查点抗原表位;
11.所述sting激动剂与所述enpp1抑制剂的质量比为10:(2.5~10),并且不为10:10;所述sting激动剂与所述免疫检查点抑制剂的质量比为10:(2.5~100),并且不为10:100。
12.在本发明一些较佳的实施方案中,所述sting激动剂与所述enpp1抑制剂的质量比为10:(2.5~5);所述sting激动剂与所述免疫检查点抑制剂的质量比为10:(2.5~50)。
13.在本发明一些更佳的实施方案中,所述sting激动剂与所述免疫检查点抑制剂的质量比为10:(5~50),进一步更佳地为10:(5~10)。
14.在本发明一些较佳的实施方案中,所述sting激动剂为cgas-sting-cgamp-irf3免疫通路的激动剂。
15.在本发明一些更佳的实施方案中,所述激动剂选自环二核苷酸类、氨基苯并咪唑
类、呫吨酮类和吖啶酮类、苯并塞吩类、苯并二茂类或其组合。
16.在本发明一些具体的实施方案中,所述激动剂为环二核苷酸或环二核苷酸金属配合物,例如为环二核苷酸2
’3’‑
cgamp(c-amp-gmp)、c-di-amp、c-di-gmp、c-di-imp、c-gmp-imp或其取代衍生物的一种或多种。
17.所述环二核苷酸金属配合物包括锌、锰等过渡金属配合物。
18.本发明中,sting为特定蛋白质名称,如不加说明,均与多数公开文献及ncbi数据库、欧洲基因数据库一致。其gene名为:tmem173;gene id为:340061;sting公开的其它命名包括:transmembrane protein 173、eris、mita、mpys、net23、savi、、hmita或hsting。
19.本发明中,若不另外说明,环二核苷酸cgamp(即2
’3’‑
cgamp)均指c
20h22n10o13
p2.2nh4。
20.在本发明一些较佳的实施方案中,所述免疫检查点抑制剂为抗免疫检查点的抗体或其抗原结合片段。
21.在本发明一些更佳的实施方案中,所述免疫检查点抑制剂为抗免疫检查点的抗体。
22.在本发明一些具体的实施方案中,所述抗体可为纳米抗体(vhh)、单克隆抗体或其vh-fc重组抗体。
23.在本发明一些更佳的实施方案中,所述免疫检查点选自pd-1/pd-l1、cd47、vegf、pvrig、tigit、nkg2a、lilrb4、lilrb2、lag-3、ox40、ctla-4、tim-3、vista、ildr2、kir、mhcii、gitr和4-1bb中的一种或多种。
24.在本发明一些具体的实施方案中,所述免疫检查点选自pd-1/pd-l1和cd47。
25.本发明中,所述外核苷酸焦磷酸酶/磷酸二酯酶抑制剂为人源外核苷酸焦磷酸酶/磷酸二酯酶1(ectonucleotide pyrophosphatase/phos-phodiesterase1,enpp1)的抑制剂。
26.在本发明一些较佳的实施方案中,所述enpp1抑制剂为4(3h)-喹唑啉酮衍生物。
27.在本发明一些更佳的实施方案中,所述enpp1抑制剂为2-[(4-甲基-(噻唑并[4,5-b]吡啶)-2-硫代)甲基]-7-氟-喹唑啉-4(3h)-酮、2-[(5-甲氧基-(咪唑并[4,5-b]吡啶)-2-硫代)甲基]-7-氟-喹唑啉-4(3h)-酮或2-[(5-氯-(咪唑并[4,5-b]吡啶)-2-硫代)甲基]-7-甲酸甲酯-喹唑啉-4(3h)-酮。
[0028]
本发明中,所述免疫检查点抗原表位可为细胞表面、胞内、分泌表达的免疫检查点抗原表位。所述至少两个不同的免疫检查点抗原表位之间具有协同作用。
[0029]
在本发明一些较佳的实施方案中,所述脂质体包含下述原料:磷脂和胆固醇(chol);所述磷脂选自氢化大豆卵磷脂(hspc)、二棕榈酰磷脂酰胆碱(dppc)、二棕榈酰磷脂酰甘油(dppg)、二棕榈酰磷脂酰乙醇胺-聚乙二醇2000(dppe-peg
2000
)、二棕榈酰磷脂酰乙醇胺-聚乙二醇2000-马来酰乙醇胺(dppe-peg
2000-mal)、1,2-二硬脂酰-sn-甘油-3-磷酰乙醇胺-n-马来酰亚胺-聚乙二醇2000(dspe-peg2000-mal)中的一种或多种;所述磷脂与胆固醇的质量比为(18~25):5。
[0030]
在本发明一些更佳的实施方案中,所述的磷脂与胆固醇的质量比为(19~21):5;例如为19:5、20:5或21:5。
[0031]
在本发明一些实施方案中,所述脂质体组合物还包含肿瘤靶向试剂;所述肿瘤靶
向试剂通过化学键桥接于所述脂质体的表面。
[0032]
较佳地,所述肿瘤靶向试剂为靶向肿瘤细胞特异性表达的受体的配体。
[0033]
更佳地,所述肿瘤靶向试剂为叶酸或整合素。
[0034]
本发明中,所述肿瘤靶向试剂可与肿瘤细胞的特异性受体结合,例如可抑制异常信号传导、环氧酶2(cox-2)、叶酸或新生血管。
[0035]
在本发明一些实施方案中,所述多靶点复合体的制备包括以下步骤:
[0036]
(1)将所述原料与所述enpp1抑制剂通过薄膜水化法得到共载脂质体;
[0037]
(2)将步骤(1)中获得的共载脂质体与所述sting激动剂进行第一阶段搅拌孵育后,加入所述免疫检查点抑制剂进行第二阶段搅拌孵育,即得;
[0038]
所述第一阶段搅拌孵育的条件为:65~75℃,1.5~2.5h;例如70℃,2h;
[0039]
所述第二阶段搅拌孵育的条件为:20~25℃,避光过夜。
[0040]
在本发明一些更佳的实施方案中,步骤(1)中,还包括将所述原料与所述enpp1抑制剂、所述肿瘤靶向试剂通过薄膜水化法得到共载脂质体。
[0041]
较佳地,所述sting激动剂与所述肿瘤靶向试剂的质量比为10:(2.5~10),并且不为10:10。
[0042]
本发明中,所述薄膜水化法为本领域常规技术,例如可将脂质体的原料在水浴中真空旋转蒸发干至成膜,然后加入(nh4)2so4水化制成空白脂质体,向该空白脂质体中加入免疫激动剂或其金属配合物、enpp1抑制剂,形成共载脂质体,然后将脂质体化学键链接免疫检查点抑制剂单克隆抗体(或纳米抗体),再通过透析和分子筛除去未包封的sting激动剂或enpp1的抑制剂药物和未链接的抗体蛋白。
[0043]
本发明的第二方面提供一种制备载物脂质体的多靶点复合体的方法,所述方法包括以下步骤:
[0044]
(1)将原料与enpp1抑制剂通过薄膜水化法得到共载脂质体;
[0045]
所述原料包括:磷脂和胆固醇;所述磷脂选自氢化大豆卵磷脂(hspc)、二棕榈酰磷脂酰胆碱(dppc)、二棕榈酰磷脂酰甘油(dppg)、二棕榈酰磷脂酰乙醇胺-聚乙二醇2000(dppe-peg
2000
)、二棕榈酰磷脂酰乙醇胺-聚乙二醇2000-马来酰乙醇胺(dppe-peg
2000-mal)中的一种或多种;
[0046]
(2)将步骤(1)中获得的共载脂质体与sting激动剂进行第一阶段搅拌孵育后,加入免疫检查点抑制剂进行第二阶段搅拌孵育,即得;
[0047]
所述sting激动剂与所述enpp1抑制剂的质量比为10:(2.5~10),并且不为10:10;所述sting激动剂与所述免疫检查点抑制剂的质量比为10:(2.5~100),并且不为10:100;
[0048]
所述第一阶段搅拌孵育的条件为:65~75℃,1.5~2.5h;例如70℃,2h;
[0049]
所述第二阶段搅拌孵育的条件为:20~25℃,避光过夜。
[0050]
在本发明一些较佳的实施方案中,所述sting激动剂与所述enpp1抑制剂的质量比为10:(2.5~5),所述sting激动剂与所述免疫检查点抑制剂的质量比为10:(2.5~50)。
[0051]
本发明的第三方面提供一种包含如第一方面所述的多靶点复合体的抗肿瘤药物或抗肿瘤转移的药物。
[0052]
在本发明的一些实施方案中,所述肿瘤为实体瘤;较佳地选自结直肠癌、乳腺癌、卵巢癌、前列腺癌、胰腺癌、睾丸癌、肺癌、鼻咽癌、食道癌、肾癌、胶质瘤、黑色素瘤、恶性淋
巴瘤、头颈部癌、甲状腺癌或成骨肉瘤。
[0053]
在本发明的一些实施方案中,所述肿瘤转移选自癌细胞肺转移、肝转移、淋巴转移、脑转移或骨转移。
[0054]
本发明的第四方面提供一种载药平台,所述载药平台包含如第一方面所述的多靶点复合体或者如第三方面所述的抗肿瘤药物或者抗肿瘤转移的药物。
[0055]
本发明中,所述载物脂质体的多靶点复合体可以根据靶向需要,连接多个靶向分子,通过脂质体共载sting激动剂和enpp1抑制剂,共载sting激动剂和抗肿瘤化药,共载sting激动剂、enpp1抑制剂和抗肿瘤化药等,形成多抗体靶向的载药平台。
[0056]
本发明的第五方面提供一种包含如第一方面所述的多靶点复合体的抗冠状病毒及其病毒性炎症的药物。
[0057]
较佳地,所述药物还包含其他治疗剂,所述其他治疗剂包括所述冠状病毒的刺突蛋白抗体或其片段。
[0058]
更佳地,所述冠状病毒选自冠状rna病毒、新型冠状病毒、流感病毒或艾滋病毒;所述病毒性炎症选自新型冠状病毒性肺炎、病毒性肾炎、病毒性脑炎、病毒性肠炎或病毒性肝炎。
[0059]
本发明的第六方面提供一种包含如第一方面所述的多靶点复合体的抗神经退行性疾病的药物。
[0060]
较佳地,所述药物还包含其他治疗剂,所述其他治疗剂包括靶向血脑屏障的受体蛋白的多肽、抗体或其片段。
[0061]
更佳地,所述神经退行性疾病选自阿尔茨海默症(ad)、帕金森症(pd)、肌萎缩侧索硬化症(als)、多发性硬化症、共济失调毛细血管扩张症、牛海绵状脑病、克雅二氏病、亨廷顿舞蹈症、小脑萎缩症、脊髓性肌萎缩症、痉挛性截瘫或重症肌无力。
[0062]
本发明的第七方面提供一种包含如第一方面所述的多靶点复合体的治疗脑部疾病的药物。
[0063]
较佳地,所述药物还包含其他治疗剂,所述其他治疗剂包括靶向血脑屏障的受体蛋白的多肽、抗体或其片段。
[0064]
更佳地,所述脑部疾病选自缺血性脑血管损伤、颅脑损伤、脑炎或脑肿瘤。
[0065]
本发明的第八方面提供一种药物组合物,所述药物组合物包含如第一方面所述的多靶点复合体和药学上可接受的载体。
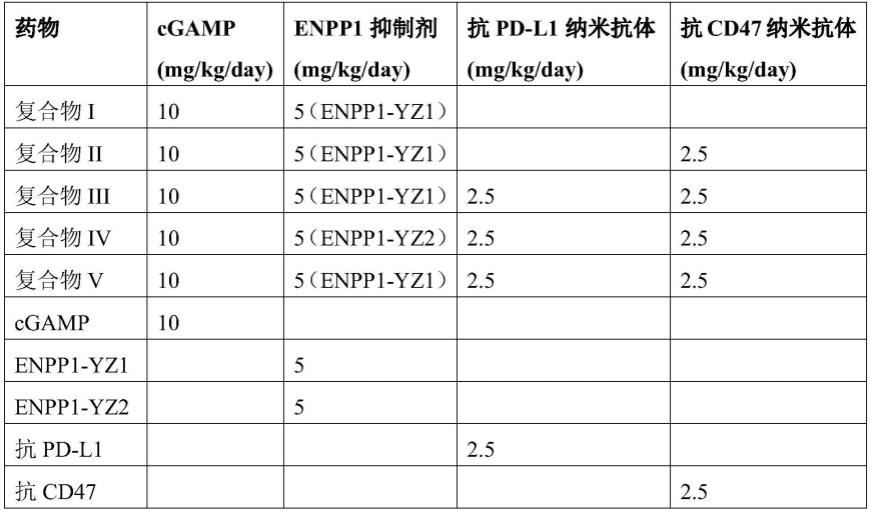
[0066]
较佳地,所述药物组合物为注射形式、滴注形式或口服形式;
[0067]
所述注射优选静脉注射、肌肉注射或皮下注射;
[0068]
所述滴注优选静脉滴注或鼻腔滴注。
[0069]
本发明的第九方面提供一种治疗疾病的方法,所述方法包括:向有需要的受试者施用如第一方面所述的多靶点复合体、如第三方面所述的抗肿瘤药物或抗肿瘤转移的药物、如第四方面所述的载药平台、如第五方面所述的抗冠状病毒及其病毒性炎症的药物、如第六方面所述的抗神经退行性疾病的药物、如第七方面所述的治疗脑部疾病的药物、或如第八方面所述的药物组合物。
[0070]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
358.0762[m h]
。
[0082]
(2-2)enpp1抑制剂enpp1-yz2的制备与表征
[0083]
将4-甲基-2-巯基苯并噻唑(91mg,0.5mmol)、2-(氯甲基)-7-氟喹唑啉-4(3h)-酮(106mg,0.5mmol)和氢氧化钠(100mg,2.5mmol)溶解在甲醇中(7ml),常温搅拌过夜。后处理反应,减压除去有机溶剂甲醇得到粗品,粗品利用300-400目的硅胶柱进行纯化,得到终产物白色固体enpp1-yz2,2-[(4-甲基-(噻唑并[4,5-b]吡啶)-2-硫代)甲基]-7-氟-喹唑啉-4(3h)-酮(100mg,产率56%)。1h nmr(400mhz,dmso)δ12.66(s,1h),8.17(dd,j=8.7,2.4hz,1h),7.86
–
7.76(m,1h),7.38(ddd,j=11.2,9.5,2.5hz,2h),7.29
–
7.20(m,2h),4.62(s,2h),2.58(s,3h)。
13
c nmr(101mhz,dmso)δ167.49,164.99,164.22,161.02,156.09,151.93,149.73,149.60,135.16,131.33,129.72,129.61,127.36,125.28,119.64,118.14,116.19,115.96,111.87,111.65,35.95,18.23.esi-ms m/z calcd for c
17h12
fn3os
2
358.0479,found 358.0488[m h]
。
[0084]
实施例2先天免疫sting激动剂cgamp和enpp1抑制剂enpp1-yz1共载脂质体的制备
[0085]
将450mg hspc、150mg胆固醇chol、120mg dppe-peg
2000
和5mg enpp1-yz1一起加入到50ml二氯甲烷中,转入1l茄形瓶中,真空旋干成膜,成膜后继续旋蒸3h以上除去残留的微量有机溶剂二氯甲烷。加入60ml浓度为250mm硫酸铵溶液进行水化(水化温度为60℃),水化后的脂质体在脂质体挤出器的挤压下来回经过100nm聚碳酸酯微孔滤膜,形成均一的单室脂质体。将匀质后的脂质体装入3500da透析袋充分透析,以除去游离的小分子抑制剂enpp1-yz1和硫酸铵(透析buffer为500ml的5%葡萄糖溶液,透析三次,每6小时更换一次透析液)。将55mg的cgamp加入到脂质体溶液中,在油浴温度为70℃的磁力搅拌器中轻微地搅拌孵育2h,将孵育后的脂质体装入3500da透析袋充分透析除去游离的cgamp(透析buffer为500ml的5%葡萄糖溶液,透析三次,每6小时更换一次透析液),透析完的脂质体加入海藻糖(质量分数为10%)进行冷冻干燥,得到cgamp/enpp1-yz1共载脂质体(复合物i)冻干粉,-20℃保存。
[0086]
共载脂质体包封率测定:取一定量的cgamp/enpp1-1共载脂质体冻干粉,加入700μl破乳剂(甲醇:异丙醇=7:3,v/v)和300μl水,振荡混匀,10000rpm离心1min,取上清跑hplc,通过浓度-峰面积标准曲线,来测定药物浓度,进而计算enpp1-yz1的包封率为97%,cgamp包封率为95%。
[0087]
实施例3抗pd-l1/抗cd47纳米抗体的制备
[0088]
(1)抗pd-l1/抗cd47纳米抗体质粒构建
[0089]
纳米抗体质粒的序列参照文献(broos,k.,et al.,oncotarget,2017.8(26):41932-41946;sockolosky,j.t.,et al.,proc natl acad sci u s a,2016.113(19):e2646-54.)进行设计,已验证此序列编码的纳米抗体可以与鼠源pd-l1/或cd47有强烈相互作用。
[0090]
以上两种基因均为鼠源纳米抗体,采用pet-22b( )为载体,携带amp 抗性,蛋白序列末端标记6his-tag帮助纯化,表达体系为大肠杆菌。质粒由通用生物系统有限公司合成。纳米抗体均用大肠杆菌高效表达。
[0091]
(a)抗pd-l1纳米抗体蛋白序列:
[0092]
qvqlqesggglvqtggslrlscaasgstvsssmmawwrqtpgnqrelvalvasgnntnyvdsvkgrft
vsrdnakntmylqmnslkpedtavyycrilsvngiwywgqgtqvtvss(seqidno:1)
[0093]
(b)抗cd47纳米抗体蛋白序列:
[0094]
qvqlvesggglvepggslrlscaasgiifkindmgwyrqapgkrrewvaastggdeaiyrdsvkdrftisrdaknsvflqmnslkpedtavyyctavistdrdgtewrrywgqgtqvtvss(seqidno:2)
[0095]
(2)纳米抗体蛋白的纯化
[0096]
按照1ml/g的比例加入p1buffer(hepes50mm,ph7.5,150mmnacl)悬浮菌体,搅拌溶菌,用超声波细胞壁破碎仪破菌,将破碎好的菌液离心,分离收取上清溶液。
[0097]
用p1buffer平衡ni-nta亲和柱,离心后的上清上柱,用含有20mm咪唑(imidazole,im)的p2buffer(hepes50mm,ph7.5,150mmnacl,20mmim)洗脱杂蛋白,随后用p1buffer和p3buffer(hepes50mm,ph7.5,150mmnacl,200mmim)梯度洗脱目的蛋白。目的蛋白洗脱液经过透析除去咪唑后,用15%(m/v)的sds-page鉴定分纯度,质谱鉴定,-80℃保存待用。
[0098]
(3)纳米抗体的鉴定
[0099]
纳米抗体蛋白质溶液r浓度约为1mg/ml。经maldi-tof-ms进行分析检测,抗pd-l1的vhh的质谱分子量为13.83kd,抗cd47的vhh的质谱分子量为14.05kd。15%(m/v)的sds-page检测鉴定其纯度均高于95%。
[0100]
(4)纳米抗体蛋白除内毒素
[0101]
用pbs平衡ni-nta柱后,将透析过后纳米抗体蛋白溶液进行上柱。用含有0.1%(v/v)tritonx-114的pbs溶液冲洗ni-nta柱(用40倍柱体积),洗去内毒素。最后用含有咪唑的lps-freepbs溶液梯度洗脱目的蛋白,收集的蛋白透析除去咪唑后,用10kd的超滤管(millipore)浓缩至1.5mg/ml左右,用内毒素试剂盒确认蛋白内毒素含量《2iu/mg,-80℃保存待用。
[0102]
实施例4抗cd47靶向的cgamp/enpp1-yz1共载脂质体的制备
[0103]
将450mghspc、150mg胆固醇chol、120mgdppe-peg
2000
、30mgdppe-peg
2000-mal和5mgenpp1-yz1一起加入到50ml二氯甲烷中,转入1l茄形瓶中,真空旋干成膜,成膜后继续旋蒸3h以上除去残留的微量有机溶剂二氯甲烷。加入60ml浓度为250mm硫酸铵溶液进行水化(水化温度为60℃),水化后的脂质体在脂质体挤出器的挤压下来回经过100nm聚碳酸酯微孔滤膜,形成均一的单室脂质体,将匀质后的脂质体装入3500da透析袋充分透析除去游离的小分子抑制剂enpp1-yz1和硫酸铵(透析buffer为500ml的5%葡萄糖溶液,透析三次,每6小时更换一次透析液)。将55mg的cgamp加入到脂质体溶液中,在油浴温度为70℃的磁力搅拌器中轻微的搅拌孵育2h,孵育完后加入已经巯基化的实施例3制备的抗cd47纳米抗体(磷脂总质量:抗-cd47纳米抗体质量=1mg:20μg)和还原剂连二亚硫酸钠溶液(终浓度为1mm),室温避光孵育过夜;将连上抗体的脂质体装入30kd透析袋充分透析除去游离的抗cd47纳米抗体和cgamp(透析buffer为500ml的5%葡萄糖溶液,透析三次,每6小时更换一次透析液),透析完的脂质体加入海藻糖(质量为脂质体的10%)进行冷冻干燥,制得复合物ii冻干粉,-20℃保存。
[0104]
多靶点免疫复合体共载脂质体复合物ii的包封率测定:取一定量的复合物ii的冻干粉,加入700μl破乳剂(甲醇:异丙醇=7:3,v/v)和300μl水,振荡混匀,10000rpm离心1min,取上清跑hplc,通过浓度-峰面积标准曲线,来测定药物浓度,进而计算enpp1-yz1的
包封率为96%,cgamp包封率为94%。
[0105]
复合物ii蛋白连接率测定:取300μl脂质体溶液,加入0.4ml甲醇,涡旋振荡30s;加入0.2ml二氯甲烷,涡旋振荡30s;加入0.1ml dd h2o,涡旋振荡30s;9000g离心1min,去除上层,得有机二氯甲烷层。再加入0.3ml甲醇,涡旋振荡30s;9000g离心2min,小心去除上清,得到白色颗粒沉淀。n2吹干残余溶剂,加入200μl hepes(20mm hepes,140mm nacl,2%sds)溶解蛋白。然后根据bca试剂盒(omni-rapid
tm
快速蛋白定量试剂盒,zj103)的测试方法,测定复合物ii的抗cd47蛋白连接率为95%。
[0106]
实施例5抗pd-l1/抗cd47双靶向cgamp和enpp1-yz1共载脂质体的制备
[0107]
将450mg hspc、150mg胆固醇chol、120mgdppe-peg
2000
、60mg dppe-peg
2000-mal和5mg enpp1抑制剂(enpp1-yz1)一起加入到50ml二氯甲烷中,转入1l茄形瓶中,真空旋干成膜,成膜后继续旋蒸3h以上除去残留的微量有机溶剂二氯甲烷。加入60ml浓度为250mm硫酸铵溶液进行水化(水化温度为60℃),水化后的脂质体在脂质体挤出器的挤压下来回经过100nm聚碳酸酯微孔滤膜,形成均一的单室脂质体,将匀质后的脂质体装入3500da透析袋充分透析除去游离的enpp1-yz1和硫酸铵(透析buffer为500ml的5%葡萄糖溶液,透析三次,每6小时更换一次透析液)。将55mg的cgamp加入到脂质体溶液中,在油浴温度为70℃的磁力搅拌器中轻微的搅拌孵育2h,孵育完后加入已经巯基化的实施例3制备的抗pd-l1纳米抗体和抗cd47纳米抗体(磷脂总质量:抗pd-l1质量:抗cd47质量=1mg:20μg:20μg)和还原剂连二亚硫酸钠溶液(终浓度为1mm),室温避光孵育过夜;将连上抗体的脂质体装入30kd透析袋充分透析除去游离的抗pd-l1和抗cd47纳米抗体和cgamp(透析buffer为500ml的5%葡萄糖溶液,透析三次,每6小时更换一次透析液),透析完的脂质体加入海藻糖(质量为脂质体的10%)进行冷冻干燥,得到复合物iii的冻干粉,-20℃保存。
[0108]
复合物iii包封率测定:取一定量的复合物iii的冻干粉,加入700μl破乳剂(甲醇:异丙醇=7:3,v/v)和300μl水,振荡混匀,10000rpm离心1min,取上清跑hplc,通过浓度-峰面积标准曲线,来测定药物浓度,进而计算enpp1-yz1的包封率为94%,cgamp包封率为95%。
[0109]
复合物iii的蛋白连接率测定:取300μl脂质体溶液,加入0.4ml甲醇,涡旋振荡30s;加入0.2ml二氯甲烷,涡旋振荡30s;加入0.1ml dd h2o,涡旋振荡30s;9000g离心1min,去除上层,得有机二氯甲烷层。再加入0.3ml甲醇,涡旋振荡30s;9000g离心2min,小心去除上清,得到白色颗粒沉淀。n2吹干残余溶剂,加入200μl hepes(20mm hepes,140mm nacl,2%sds)溶解蛋白。然后根据bca试剂盒的测试方法,测定复合物iii中的蛋白连接率分别为95%。
[0110]
实施例6抗pd-l1/抗cd47双靶向cgamp和enpp1-yz2共载脂质体的制备
[0111]
将450mg hspc、150mg胆固醇chol、120mgdppe-peg
2000
、60mg dppe-peg
2000-mal和5mg enpp1抑制剂(enpp1-yz2)一起加入到50ml二氯甲烷中,转入1l茄形瓶中,真空旋干成膜,成膜后继续旋蒸3h以上除去残留的微量有机溶剂二氯甲烷。加入60ml浓度为250mm硫酸铵溶液进行水化(水化温度为60℃),水化后的脂质体在脂质体挤出器的挤压下来回经过100nm聚碳酸酯微孔滤膜,形成均一的单室脂质体,将匀质后的脂质体装入3500da透析袋充分透析除去游离的enpp1-yz2和硫酸铵(透析buffer为500ml的5%葡萄糖溶液,透析三次,每6小时更换一次透析液)。将55mg的cgamp加入到脂质体溶液中,在油浴温度为70℃的磁力
搅拌器中轻微的搅拌孵育2h,孵育完后加入已经巯基化的实施例3制备的抗pd-l1纳米抗体和抗cd47纳米抗体(磷脂总质量:抗pd-l1质量:抗cd47质量=1mg:20μg:20μg)和还原剂连二亚硫酸钠溶液(终浓度为1mm),室温避光孵育过夜;将连上抗体的脂质体装入30kd透析袋充分透析除去游离的抗pd-l1和抗cd47纳米抗体和cgamp(透析buffer为500ml的5%葡萄糖溶液,透析三次,每6小时更换一次透析液),透析完的脂质体加入海藻糖(质量为脂质体的10%)进行冷冻干燥,得到复合物iv的冻干粉,-20℃保存。
[0112]
复合物iv的包封率测定:取一定量的复合物iv的冻干粉,加入700μl破乳剂(甲醇:异丙醇=7:3,v/v)和300μl水,振荡混匀,10000rpm离心1min,取上清跑hplc,通过浓度-峰面积标准曲线,来测定药物浓度,进而计算enpp1-yz2的包封率为95%,cgamp包封率为94%。
[0113]
复合物iv的蛋白连接率测定:取300μl脂质体溶液,加入0.4ml甲醇,涡旋振荡30s;加入0.2ml二氯甲烷,涡旋振荡30s;加入0.1ml dd h2o,涡旋振荡30s;9000g离心1min,去除上层,得有机二氯甲烷层。再加入0.3ml甲醇,涡旋振荡30s;9000g离心2min,小心去除上清,得到白色颗粒沉淀。n2吹干残余溶剂,加入200μl hepes(20mm hepes,140mm nacl,2%sds)溶解蛋白。然后根据bca试剂盒的测试方法,测定复合物iv中的蛋白连接率分别为95%。
[0114]
实施例7叶酸/抗pd-l1/抗cd47抗体多靶点靶向cgamp和enpp1-yz1共载脂质体的制备
[0115]
将450mg hspc、150mg胆固醇chol、120mg dspe-peg
2000
、30mg dspe-peg
2000-fa(叶酸)、60mg dppe-peg
2000-mal和5mg enpp1抑制剂(enpp1-yz1)一起加入到50ml二氯甲烷中,转入1l茄形瓶中,真空旋干成膜,成膜后继续旋蒸3h以上除去残留的微量有机溶剂二氯甲烷。加入60ml浓度为250mm硫酸铵溶液进行水化(水化温度为60℃),水化后的脂质体在脂质体挤出器的挤压下来回经过100nm聚碳酸酯微孔滤膜,形成均一的单室脂质体。将匀质后的脂质体装入3500da透析袋充分透析除去游离的enpp1-yz1和硫酸铵(透析buffer为500ml的5%葡萄糖溶液,透析三次,每6小时更换一次透析液)。将55mg的cgamp加入到脂质体溶液中,在油浴温度为70℃的磁力搅拌器中轻微的搅拌孵育2h,孵育完后加入已经巯基化的实施例3中制备的抗pd-l1纳米抗体和抗cd47纳米抗体(磷脂总质量:抗-pd-l1质量:抗cd47质量=1mg:20μg:20μg)和还原剂连二亚硫酸钠溶液(终浓度为1mm),室温避光孵育过夜;将连上抗体的脂质体装入30kd透析袋充分透析除去游离的抗pd-l1和抗cd47纳米抗体和cgamp(透析buffer为500ml的5%葡萄糖溶液,透析三次,每6小时更换一次透析液),透析完的脂质体加入海藻糖(质量为脂质体的10%)进行冷冻干燥,得到复合物v的冻干粉,-20℃保存。
[0116]
复合物v的包封率测定:取一定量的复合物v的冻干粉,加入700μl破乳剂(甲醇:异丙醇=7:3,v/v)和300μl水,振荡混匀,10000rpm离心1min,取上清跑hplc,通过浓度-峰面积标准曲线,来测定药物浓度,进而计算enpp1-yz1的包封率为94%,cgamp包封率为95%。
[0117]
复合物v中的蛋白连接率分别为95%。
[0118]
实施例8多靶点精准靶向免疫抗肿瘤复合体药物抑制实体肿瘤作用研究
[0119]
1、动物及其饲养条件:balb/c普通小鼠、c57bl/6普通小鼠,雄性,体重20-22g,7-8周龄,spf级,购于上海斯莱克实验动物有限责任公司。所有小鼠均自由觅食和饮水,在室温(23
±
2)℃下饲养。饲料及水均经高压灭菌处理,全部实验饲养过程为spf级。
[0120]
2、剂量设置
[0121]
腹腔注射小鼠,多靶点精准靶向免疫抗肿瘤复合体剂量设置,按每天每公斤小鼠给药复合物中分别含有效抗肿瘤成分的含量如表1所示。
[0122]
表1剂量设置表
[0123][0124]
3、试验对照
[0125]
阴性对照:pbs溶液;阳性对照:cgamp,剂量10mg/kg。
[0126]
4、给药方法
[0127]
给药途径:腹腔注射给药;
[0128]
新型多靶点精准靶向免疫复合物给药体积:200微升/只;
[0129]
给药次数:每天1次,连续21天;
[0130]
每组动物数:10只。
[0131]
5、肿瘤细胞株
[0132]
小鼠结直肠癌细胞株ct26、小鼠乳腺癌细胞株4t1和小鼠黑色素瘤细胞株b16f10均购自中国科学院细胞库。
[0133]
6、试验主要步骤
[0134]
肿瘤模型鼠的建立与干预
[0135]
细胞培养,传代,在细胞对数期收集细胞,制成浓度为(1.0
×
107)每毫升的细胞悬液,小鼠右前肢腋下注射0.2ml细胞悬液(细胞数目为2.0
×
106个/只),8天左右致瘤成功,随机均分为11组,分别为a:阴性对照组(pbs组)、b:阳性对照cgamp组(10mg/kg)、c:enpp1-yz1组(5mg/kg)、d:enpp1-yz2组(5mg/kg)、e:抗pd-l1纳米抗体(2.5mg/kg)、f:抗cd47纳米抗体(2.5mg/kg)、g:复合物i组、h:复合物ii组、i:复合物iii组、j:复合物iv组、k:复合物v组。每天给药1次,连续给药21天。21天后,处死小鼠并称瘤体重量,抑瘤率=[1-实验组平均瘤重(b、c、d、e、f、g、h、i、j、k组为实验组)/a组平均瘤重]]
×
100%。
[0136]
分别制备小鼠结直肠癌细胞株ct26,移植到balb/c普通小鼠;制备小鼠乳腺癌细胞株4t1,移植到balb/c普通小鼠;制备黑色素瘤细胞株b16f0,移植到c57bl/6小鼠,观察不同药物抗肿瘤效果。
[0137]
统计分析
[0138]
数据用x
±
s表示,利用spss10.0软件进行处理,采用单因素方差分析(one-way anova)检验比较各组瘤重差异的显著性,显著性水平a=0.05。
[0139]
实验结果
[0140]
小鼠皮下接种肿瘤细胞后制备成功皮下移植瘤模型,新型多靶点免疫复合物均可明显抑制肿瘤生长,给药21天后的瘤重均显著低于阴性对照组(p《0.05,p《0.01),新型多靶点精准靶向免疫复合物均优于单独抗肿瘤药物单独用药,包括cgamp、enpp1抑制剂、纳米抗体。表明新型多靶点免疫复合物具有显著提高的抗肿瘤作用。抗cd47/抗pd-l1纳米抗体免疫靶向复合体药物显著比单抗体(抗cd47)靶向抗肿瘤药效好,含有叶酸靶向的抗cd47/抗pd-l1纳米抗体多靶向复合体药物抗肿瘤药效显著提高,药效最好。具体结果见下表2-4。
[0141]
另外,新型多靶点精准靶向免疫复合物体药物对小鼠乳腺癌细胞肺转移显示了显著的抑制作用。对4t1乳腺癌研究已处死的小鼠进行解剖,小心剥离肺脏组织,在4%多聚甲醛固定后拍照进行观察,可以明显看到模型组小鼠肺部颜色发黑,表面存在多个大小不一的白色肿瘤结节。整个肺脏组织也因为肿瘤的存在而有体积增大的现象。sting激动剂cgamp给药组和enpp1抑制剂给药组小鼠的肺脏相比于模型组,表面肿瘤结节的个数都有所减少;抗-pd-l1和抗cd47纳米抗体组,小鼠的肺脏相比于模型组肿瘤结节的个数也有少量地减少。多靶点精准靶向复合免疫复合体给药组抑制乳腺癌细胞肺转移有显著很好的效果,小鼠的肺组织体积正常,表面肿瘤结节数很少。通过对小鼠肺组织肿瘤结节进行统计分析,抑制乳腺癌细胞肺转移的药效结果见表3。
[0142]
表2新型多靶点精准靶向免疫复合物对balb/c鼠结直肠癌细胞ct26皮下移植瘤的抑制作用(n=10,mean
±
sd)
[0143][0144][0145]
注:*p《0.05vs阴性对照组;**p《0.01vs阴性对照组。
[0146]
表3新型多靶点精准靶向免疫复合物对balb/c鼠乳腺癌4t1皮下移植瘤的抑制作
用(n=10,mean
±
sd)
[0147][0148]
注:*p《0.05vs阴性对照组;**p《0.01vs阴性对照组。
[0149]
表4新型多靶点精准靶向免疫复合物对c57bl/6鼠黑色素瘤b16f0皮下移植瘤的抑制作用(n=10,mean
±
sd)
[0150][0151][0152]
注:*p《0.05vs阴性对照组;**p《0.01vs阴性对照组。
[0153]
实施例9多重免疫靶向抗肿瘤复合体有效成分组成配比对抗肿瘤药效和安全性影响的研究
[0154]
动物及其饲养条件:balb/c普通小鼠、c57bl/6普通小鼠,雄性,体重20-22g,7-8周龄,spf级,购于上海斯莱克实验动物有限责任公司。所有小鼠均自由觅食和饮水,在室温
(23
±
2)℃下饲养。饲料及水均经高压灭菌处理,全部实验饲养过程为spf级。
[0155]
多靶点复合体的有效成分剂量比例设置情况筛选如下表5所示。
[0156]
表5多靶点复合体配比
[0157][0158]
在制备免疫靶向抗肿瘤的多靶点复合体药物时,首先考察了该多靶点复合体药物的各有效组成成分的配比对药效和安全性的影响,研究结果考察了小鼠体重、生存率和抑瘤率。腹腔注射小鼠,多靶点免疫靶向抗肿瘤复合体有效成分剂量比例,按每天每公斤小鼠给药复合物中分别含有效抗肿瘤成分的含量如表5中所示。
[0159]
试验对照
[0160]
阴性对照:pbs溶液
[0161]
给药方法
[0162]
给药途径:腹腔注射给药
[0163]
多靶点复合体给药体积:200微升/只
[0164]
给药次数:每天1次,连续21天
[0165]
每组动物数:10只
[0166]
肿瘤细胞株
[0167]
小鼠结直肠癌细胞株ct26购自中国科学院细胞库。
[0168]
肿瘤模型鼠的建立见实施例8
[0169]
实验结果
[0170]
小鼠皮下接种肿瘤细胞后制备成功皮下移植瘤模型,多种组成配比的多靶点免疫复合物给药21天后具体结果如下表6所示。
[0171]
表6不同多靶点复合体配比的效果
[0172][0173]
由以上结果可以看出,该复合物中有效成分的配比及其给药剂量对抗肿瘤药效和安全性有重要关系,调控适当配比非常关键。结果表明:在sting激动剂10mg/kg/day的情况下,enpp1抑制剂有效安全用量在2.5~5mg/kg/day,免疫检查点抑制剂(纳米抗体)用量在2.5~50mg/kg/day。在sting激动剂10mg/kg/day的情况下,enpp1抑制剂有效安全用量大于等于10mg/kg/day,免疫检查点抑制剂(纳米抗体)用量大于等于100mg/kg/day,小鼠出现死亡等严重安全性问题。小鼠死亡原因分析结果表明,sting激动剂、enpp1抑制剂和免疫检查点抑制剂,三者合力过强,造成小鼠免疫风暴,导致死亡。单独使用sting激动剂过量不会产生免疫风暴,因为体内有enpp1可以分解过多的内源性的sting激动剂cgamp(非内源性sting激动剂不能被enpp1降解);如果同时过多使用sting激动剂和enpp1抑制剂,就出现了免疫风暴现象;当然,免疫检查点抑制剂抗体,在本发明研究的多靶点复合体中发挥两种作用:一种是阻断免疫逃逸,另一种是靶向作用(靶向到肿瘤细胞/或免疫细胞),这两种作用均能增强抗肿瘤药效。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。