水稻osrge3基因及其编码蛋白与应用
技术领域
1.本发明属于基因工程技术领域,具体涉及水稻osrge3基因及其编码蛋白与应用。
背景技术:
2.水稻既是一种重要的模式植物,也是维护国家粮食安全不可或缺的农作物之一。根系作为水稻生长发育必不可少的营养器官,是水稻与土壤进行物质交换和信息交流的纽带,承载了众多生理生化功能,如固定植株、吸收水肥和运输储存养料等,间接地决定着诸多地上部产量、品质、抗逆等农艺性状的表现(吴伟明,程式华,2005;梁永书等,2016;liang et al.,2011;liang et al.,2013)。近年来,国家加大了对植物根系性状的研究。利用现代分子生物学理论与技术体系筛选、鉴定优良水稻根系基因资源,对优化改良水稻根系性状从而提高水稻产量具有十分重要的意义。
3.泛素蛋白酶体途径(ubiquitin-proteasome system,ups)是植物蛋白质修饰最重要的调控机制之一,其介导了真核生物中80%-85%的蛋白质降解,几乎参与植物生长发育的各个环节,是植物体内蛋白高效专一降解最重要、最精细的调控机制之一(smalle and vierstra,2004;vierstra,2009;santner and estelle,2010)。在ups途径中,泛素化过程主要涉及3种泛素化酶:泛素激活酶(ubiquitin-activating enzyme,e1)、泛素结合酶(ubiquitin-conjugating enzyme,e2)和泛素连接酶(ubiquitin-ligating enzyme,e3)。e1是泛素化过程中的第一个关键酶,也是泛素化的起点,负责激活泛素(ubiquitin,ub)分子并将激活的ub分子传递到e2上(schulman and harper,2009);e2负责将ub分子通过e3转移到靶蛋白上(ye and rape,2009);e3作为负责识别靶蛋白,决定了泛素蛋白与底物结合的特异性。研究表明,e3泛素连接酶涉及对光形态建成、激素信号转导、非生物胁迫、免疫防御等多个植物生长发育过程的调控。然而,相对于拟南芥和水稻中众多的e3泛素连接酶成员而言,绝大多数e3泛素连接酶的功能,特别是e3泛素连接酶在水稻根系生长发育调控中的功能,并未得到揭示和阐明。
技术实现要素:
4.本发明的目的在于提供水稻osrge3基因的核苷酸序列,并明确该基因负调控水稻萌发期根生长的功能。
5.本发明的第二个目的在于提供水稻osrge3蛋白。
6.本发明的第三个目的在于提供上述osrge3基因的克隆引物。
7.本发明的第四个目的在于提供含有上述osrge3基因的表达盒、重组载体、重组细胞或重组菌。
8.本发明的第五个目的在于提供上述osrge3基因或osrge3蛋白的应用。
9.为了实现上述目的,本发明采用以下技术方案:
10.osrge3基因,其核苷酸序列如seq id no:1或seq id no:2所示,或其编码蛋白的氨基酸序列如seq id no:3所示。
11.osrge3蛋白,其氨基酸序列如seq id no:2所示。
12.本发明提供了参与调控水稻根长的基因及其编码蛋白,该基因命名为osrge3(root growth related e3),它所编码的蛋白命名为osrge3。osrge3基因组序列全长为4855bp,外显子cds序列全长为2193bp,编码730个氨基酸,该基因来源于水稻,为调控水稻萌发期根生长提供了新的遗传资源。
13.克隆上述osrge3基因的引物,所述引物的核苷酸序列如seq id no:3-4所示。
14.含有如上述的osrge3基因的表达盒、重组载体、重组细胞或重组菌。
15.使用本发明所提供的osrge3基因构建重组表达载体导入植物细胞,获得与水稻萌发期根伸长相关的转基因植株时,在其转录起始核苷酸前可加上任何一种组成型启动子、增强启动子或诱导型启动子。为了便于对转基因植物或转基因植物细胞进行鉴定及筛选,可对所使用的载体进行加工,如加入可选择性标记(gus基因、gfp、yfp和荧光素酶基因等)或具有抗性的抗生素标记基因(抗潮霉素、抗除草剂basta等基因)。为了转基因植物释放的安全性,在构建植物表达载体时也可不携带任何标记基因,在苗期进行特定pcr分子标记筛选。含有本发明osrge3基因的植物表达载体可通过ti质粒、ri质粒、植物病毒载体、如基因枪法、花粉管通道、显微注射、电导、农杆菌介导等常规生物学方法转化到植物细胞或组织中。上述植物为双子叶植物或单子叶植物,所述单子叶植物为水稻。
16.上述osrge3基因或osrge3蛋白的应用,为以下任一所示:
17.1)在促进水稻萌发期根生长方面的应用;
18.2)在改善水稻耐旱性方面的应用。
19.优选的,通过对osrge3基因进行敲除或下调osrge3基因或osrge3蛋白的表达量,获得萌发期根长增长的植株。
20.优选的,通过crispr-cas9对osrge3基因进行敲除。
21.进一步优选的,还包括如下步骤:提取osrge3基因敲除突变体基因组dna进行pcr扩增,并对扩增产物进行测序鉴定基因突变类型;其中,所述pcr扩增的引物的核苷酸序列如seq id no:8-9所示。
22.本发明取得的有益效果:
23.本发明提供了调控水稻根生长的基因osrge3及其编码的蛋白,并进一步提供了该基因或蛋白在促进水稻萌发期根生长、提高水稻种子在干旱条件下的萌发率及改善水稻耐旱性方面的应用。本发明通过构建crispr/cas9-osrge3敲除载体,利用农杆菌介导法转化水稻,获得osrge3敲除突变体;并经过试验证明,osrge3基因功能缺失突变体cas9-n1和cas9-n2的根长较野生型nipponbare显著变长(p<0.01),表明降低osrge3基因的表达可显著促进水稻萌发期幼根的伸长,进而提高种子在萌发期干旱条件耐旱性。此外,水稻根长增长有助于植株增强养分吸收,进而影响水稻产量和品质。本发明中的osrge3基因为水稻分子育种提供了新的优异基因资源,具有良好的应用前景。
附图说明
24.图1为osrge3基因的克隆;
25.图2为osrge3编码蛋白的结构域预测;
26.图3为osrge3编码蛋白的u-box结构域序列分析;
27.图4为osrge3的u-box domain同源蛋白序列比对分析;
28.图5为osrge3基因的表达模式分析;
29.图6为osrge3基因结构示意图及crispr/cas9靶标序列位点;
30.图7为水稻nipponbare生态背景下cas9-osrge3敲除突变体材料突变位点;
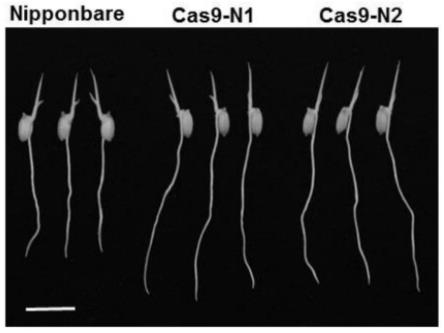
31.图8为水稻nipponbare生态背景下cas9-osrge3敲除突变体萌发3d根长表型;
32.图9为水稻nipponbare生态背景下cas9-osrge3敲除突变体萌发3d根长统计分析;
33.图10为水稻nipponbare生态背景下cas9-osrge3敲除突变体在不同浓度d-甘露醇处理2天后的表型分析。
具体实施方式
34.下面结合具体实施方式对本发明作进一步描述,但本发明的保护范围并不仅限于此;以下实施例中所涉及的仪器设备如无特别说明,均为常规仪器设备;所涉及的试剂如无特别说明,均为市售常规试剂;所涉及的试验方法,如无特别说明,均为常规方法。
35.实施例1 osrge3的基因的克隆
36.1、野生型水稻日本晴的rna提取
37.取适量野生型水稻日本晴幼苗叶片于无菌的2ml rnaase-free离心管中,液氮速冻后于组织研磨仪中迅速研磨成粉状,加入1ml trizol(invitrogen),涡旋混匀,冰上静置裂解10-15min;4℃,12,000rpm离心10min;吸取上清液于新的rnaase-free离心管中,加入200μl氯仿混匀,静置3-5min;4℃,12,000rpm离心10min;轻轻吸取600μl上清液于新的rnaase-free离心管中(注意不要吸取到杂质),加入等体积的预冷异丙醇混匀,-20℃静置30min沉降rna;4℃,12,000rpm离心10min;弃上清,75%乙醇洗涤两次;超净工作台晾干,晾干后加入50μl的rnaase-free water溶解rna,分光光度计测定rna浓度并记录。
38.2、rna反转录为cdna
39.首先进行gdna去除,待试剂在冰上融化后,涡旋混匀后置于冰上,按照表1中体系依次加入反应buffer、模板rna、rnase-free water,体系为10μl,轻轻混匀后离心,42℃孵育5-10min。
40.表1 gdna去除反应体系
[0041][0042]
将上一步得到的反应物中加入10μlplus 1st strand cdna synthesis supermix,轻轻混匀后离心,50℃孵育15-30min;然后75℃孵育5min终止反应;反应产物可直接用于后续pcr试验,保存于-20℃备用。
[0043]
3、基因克隆
[0044]
按照表2依次加入pcr反应所需试剂primestar max premix、引物(osrge3-f:atggccacggcgggctcc、osrge3-r:atctgcatttgactgaagccat,r端已去掉终止子)、模板dna,体系为50μl,并按照表3中pcr扩增反应程序依次进行预变性、变性、退火、延伸、终延伸来进行基因克隆,将得到的pcr产物进行琼脂糖凝胶电泳,根据电泳观察到的目的条带进行切
胶,并进行琼脂糖凝胶回收(利用琼脂糖凝胶回收试剂盒并参考说明书操作),得到纯化的目的片段后测序验证并于-20℃保存备用。
[0045]
表2 pcr反应体系
[0046][0047]
表3 pcr反应程序
[0048][0049]
1)琼脂糖凝胶电泳
[0050]
称取0.3g琼脂糖粉末于锥形瓶中,加入30ml的1
×
tae缓冲液(tae缓冲液配方如表4),加热溶解至透明液体,冷却至微热时加入核酸染料混匀,倒入胶床静置20-30min使其凝固;将制好的琼脂糖凝胶放入电泳槽中,用移液枪将pcr产物加入点样孔进行电泳。
[0051]
表4 50
×
tae(ph 8.5)的配置
[0052][0053]
配置好的50
×
tae母液可于室温保存,使用时用蒸馏水稀释50倍使其为1
×
tae缓冲液。
[0054]
pcr产物的琼脂糖凝胶电泳结果如图1所示,片段大小为2193bp,泳道1、2为两个重复。
[0055]
2)琼脂糖凝胶回收
[0056]
将目的条带切下放置于1.5ml干净离心管中,加入等体积pn溶液,50℃加热溶解胶块;向吸附柱中加入500μl平衡液平衡柱子;然后将溶解的胶液加入平衡过的吸附柱中,静置5-10min;12,000rpm离心1min,倒掉废液;加入600μl pw漂洗杂质,漂洗两次;12,000rpm离心2min,除尽漂洗液;风干吸附柱,加入50μl ddh2o溶解吸附柱上的dna,12,000rpm离心5min,收集纯化产物。
[0057]
将得到纯化的目的片段进行测序验证,osrge3基因的核苷酸序列如seq id no:2所示,其编码蛋白的氨基酸序列如seq id no:3所示。
[0058]
图2为osrge3编码蛋白的结构域预测,osrge3在n端有一个usp结构域,在c端有一个pkinase_tyr结构域和一个u-box结构域。图3是对图2中结构域的蛋白序列的补充。图4是在拟南芥及水稻中其他含有u-box结构域的蛋白进行的同源性分析。
[0059]
实施例2 osrge3基因的表达模式分析
[0060]
利用实时荧光定量pcr的方法对osrge3基因的表达模式进行分析,具体的,取不同时期的水稻组织样品在液氮中速冻后于-80℃的超低温冰箱中保存样品。水稻总rna的提取及rna反转录步骤参见实施例1,将得到的cdna产物稀释10倍用于荧光定量qrt-pcr。使用master mix试剂盒(promega)来配置实时定量pcr体系[qpcr-f(10μm),0.4μl;qpcr-r(10μm),0.4μl;qpcr master mix,10μl;cdna模板,5μl;rnaase-free water,4.2μl],使用cfx96 real-time系统(bio-rad)进行实时荧光定量pcr。利用2-δδc(t)方法计算平均相对基因表达水平(livak&schmittgen,2001)。所有反应均进行三个生物学重复和三个技术重复,且osactin1为内源参考基因。
[0061]
qpcr-osrge3-f:gactttggtaatgtgccatcc
[0062]
qpcr-osrge3-r:gcctctgcttcgtaggtgaa
[0063]
结果如图5所示,osrge3基因在幼苗时期主要根系表达,成熟时期在叶片和根系表达较高。
[0064]
实施例3 crispr/cas9-osrge3载体构建
[0065]
(1)引物设计
[0066]
根据测序获得的osrge3的cds序列,在其靠近5’端寻找pam(即ngg)序列,ngg前面20个碱基加对应酶切位点即为引物f的序列,其反向互补序列加对应酶切位点即为引物r的序列。靶位点为ngg前20bp(图6)。引物序列为:cas9-f:ggcagagaaggtgtacgtggcggt cas9-r:aaacaccgccacgtacaccttctc
[0067]
(2)中间载体sgrna的连接
[0068]
首先将引物稀释到100μm,等比例加入200μl离心管中,按照表5中比例配置10μl体系,并按照表6所示反应程序进行pam序列的连接,目的是将合成的两条链结合在一起。反应结束后,将连接产物稀释20倍备用。
[0069]
表5 pam序列连接体系
[0070][0071]
表6 pam序列连接程序
[0072][0073]
其次进行sgrna载体的酶切,使载体线性化,按照表7中酶切反应体系配置,并于37℃水浴锅中酶切1-2h。
[0074]
表7 sgrna载体酶切体系
[0075][0076]
将酶切后的产物进行琼脂糖凝胶电泳并进行琼脂糖凝胶回收,得到回收产物,与上一步稀释过的连接产物进行以下体系的连接,如表8所示。
[0077]
表8 sgrna与pam连接体系
[0078][0079]
25℃连接5min后再4℃过夜连接,转化于dh5α感受态细胞中(大肠杆菌dh5α感受态细胞的制备及转化过程如下),利用载体上引物u3-f和自身r引物(u3-f:agcacaggacaggcgtcttct、cas9-r:aaacaccgccacgtacaccttctc)检测菌落pcr,并送样测序,确定正确克隆的sgrna中间载体。
[0080]
①
大肠杆菌dh5α感受态细胞的制备
[0081]
用接种针蘸取保存的dh5α菌种在lb平板(无抗生素)上画线,37℃培养12-16h;挑取单菌落于5ml无抗生素的lb液体培养基摇菌,37℃振荡培养12-16h;按1:50的比例加入200ml lb液体培养基(无抗生素),37℃培养至od值为0.6;将菌液置于冰上静置冰浴10min,于4℃离心机4,000rpm离心10min收集菌体于50ml的无菌离心管中,弃上清;加入20ml预冷的0.1mol/l cacl2溶液,重悬细胞;冰浴30min,于4℃离心机4,000rpm离心10min,弃上清;加入3-5ml预冷的含15%甘油的0.1mol/l cacl2,重悬细胞;每100μl分装于1.5ml无菌离心管中,液氮速冻,即为大肠杆菌dh5α感受态细胞,-80℃冰箱中保存。
[0082]
②
大肠杆菌dh5α感受态细胞的转化
[0083]
取感受态细胞冰上融化,加入连接产物,轻轻混匀,冰浴30min;42℃热激90s,迅速冰浴2-3min;加入500μl无菌无抗lb液体培养基,37℃180rpm在摇床中振荡培养45-60min,使菌体复苏;根据试验要求,吸取适量已转化的感受态细胞加入到含相应抗生素的lb固体平板上,用玻璃涂抹棒将细胞均匀涂开;37℃倒置培养12-16h。
[0084]
(3)终载cas9-osrge3的连接
[0085]
将测序正确的中间载体entry clone与cas9终载destination vector进行lr重组,重组体系如表9,25℃反应1h。
[0086]
表9 sgrna与cas9终载lr重组体系
[0087][0088]
加入1μl proteinase k后37℃反应10min以终止反应,4℃过夜连接,转化于dh5α
感受态细胞,利用载体上引物u3-f和自身r引物检测菌落pcr,并送样测序,保存测序正确的质粒载体。
[0089]
实施例4 osrge3敲除突变体
[0090]
1、农杆菌感受态的制备及转化
[0091]
(1)农杆菌感受态的制备
[0092]
用接种针蘸取保存的eha105菌种在lb固体平板上划线,28℃培养2d;挑取新长出的单菌落于5ml lb液体培养基中,28℃在摇床中200rpm培养12-16h;将摇起来的农杆菌转接到50ml lb液体培养基中,28℃在摇床中200rpm培养3-5h至od
600
=0.4~0.5,冰浴30min后用50ml无菌离心管于4℃离心机中5,000rpm离心10min收集菌体;弃上清,加入1ml含15%甘油的0.1m cacl2溶液,重悬菌体,冰浴30min;分装100μl至1.5ml无菌离心管中,液氮速冻后-80℃保存,即得到农杆菌感受态细胞。
[0093]
(2)农杆菌转化
[0094]
冰上融化农杆菌感受态细胞,加入实施例3构建好的质粒1μl,依次冰浴5min,液氮速冻5min,37℃水浴5min,冰浴2min,于超净工作台中加入800μl lb液体培养基,28℃在摇床中200rpm培养3-4h;5,000rpm离心1min收集菌体,涂布于lb固体平板上,28℃培养30-36h。
[0095]
2、水稻遗传转化
[0096]
挑取农杆菌转化的阳性菌落,28℃振荡培养,保存菌种。
[0097]
依次进行共培养、筛选、分化、生根、炼苗等步骤,得到转基因水稻苗。
[0098]
将t0代osrge3敲除转基因植株进行单株取样,提取基因组dna。以野生型水稻nipponbare品种作为对照,对osrge3敲除突变体转基因材料进行pcr扩增,扩增片段为498bp左右,扩增产物切胶回收后测序。鉴定引物的核苷酸序列如下:f:5
’‑
agggaggcaacaagaagaga-3’,r:5
’‑
aattgagttggcctcgattg-3’。
[0099]
测序结果如图7所示,获得了两种类型的敲除材料:cas9-n1株系为插入一个单碱基t的纯合突变体(cttctccggcgagaaggtgtacgtggctggtgggggag),cas9-n2为缺少七个碱基ggcggtg的纯合突变体(cttctccggcgagaaggtgtacgtgg
‑‑‑‑‑‑‑
ggaggag)。
[0100]
实施例5转基因水稻幼苗培育及根系表型分析
[0101]
1、水稻幼苗培育
[0102]
1)水稻种子催芽萌发
[0103]
首先将水稻种子用20%次氯酸钠溶液[购买的原液与水按1:5混合(v/v)]消毒30min,然后用无菌水冲洗6-8次至没有刺鼻气味;将消毒后的种子置于铺有湿润滤纸的培养皿中,30℃黑暗培养2-3d,每日观察并更换培养皿中的水。
[0104]
2)水稻幼苗培养
[0105]
将萌发的种子铺于由泡沫板漂浮的纱布上,清水培养3-4d,1/4全营养液培养2d,1/3全营养液培养2d,1/2全营养液培养2d,然后用全营养液培养。水培营养液配方参照国际水稻所营养液等方法。
[0106]
营养液所需元素:
[0107]
①
大量元素:氮、磷、钾、钙、镁。
[0108]
②
微量元素:硅、铁、锰、硼、锌、铜。
[0109]
③
有机酸:柠檬酸。
[0110]
各营养元素母液配制:
[0111]
微量元素mn、mo、b、zn、cu以及柠檬酸(一水合物)需要分别溶解,然后和100ml浓h2so4混合在一起,加蒸馏水至2l。按照一定的比例称取含有锰、硼、锌、铜的药品以及柠檬酸,分别溶解之后混合,然后和浓硫酸混在一起,加蒸馏水进行定容即可。注意加入浓硫酸时,需要将浓硫酸加入到混合好的溶液中,并且边加边搅拌,防止浓硫酸与水混合时由于放热导致温度过高发生危险。fe制备分别溶解3.722g edta-na2和2.7802g feso4.7h2o,把edta-na2溶液放在电炉上加热至70℃后溶解,再缓缓加入feso4.7h2o溶液,溶液变为棕黄色,放入烘箱70℃保温2h。各元素营养母液的制备如下表10。
[0112]
表10营养母液制备
[0113][0114]
3)营养液的配制
[0115]
营养液配制如下表11。
[0116]
表11以制备4l营养液为例
[0117][0118]
2、水稻根系表型统计
[0119]
为测定osrge3基因功能缺失对水稻萌发期根长的影响,以野生型水稻nipponbare品种作为对照,分析osrge3基因功能缺失突变体cas9-n1和cas9-n2在种子萌发期根长生长情况。将野生型水稻和cas9-osrge3突变体材料在同一环境中正常培养,每日观察根系表型,并统计根长等根部性状,然后进行生物学统计分析。
[0120]
结果如图8-9所示,萌发3天后,osrge3基因功能缺失突变体cas9-n1和cas9-n2的
根长较野生型nipponbare显著变长(p<0.01),长约40%-45%左右,表明降低osrge3基因的表达可显著促进水稻萌发期幼根的伸长。
[0121]
实施例6萌发后甘露醇模拟干旱处理试验
[0122]
配置浓度为0.1m和0.3m的d-甘露醇,处理萌发一致的osrge3基因功能缺失突变体cas9-n1和cas9-n2及野生型nipponbare,观察表型并在处理2天后拍照记录。
[0123]
结果如图10所示,0m的d-甘露醇处理下,2天后cas9-osrge3的敲除材料根长较野生型nipponbare变长;0.1m的d-甘露醇处理下,2天后cas9-osrge3的敲除材料根长也较野生型nipponbare长,但整体与0md-甘露醇处理下相比都变短;0.3m的d-甘露醇处理下,2天后cas9-osrge3的敲除材料根长也较野生型nipponbare长,整体与0md-甘露醇处理下相比明显变短。以上结果表明cas9材料在d-甘露醇模拟干旱处理条件下,表现出较为抗旱的表型。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。