1.本发明涉及生物医药技术领域,具体涉及一种增强人脐带间充质干细胞免疫抑制功能的组合物及应用。
背景技术:
2.近年来,间充质干细胞(mesenchymal stem cells,mscs)在自身免疫性疾病的治疗中取得了一定的临床疗效,msc移植治疗系统性红斑狼疮(systemic lupus erythematosus,sle)仍局限于小规模临床试验,其在临床的应用前仍有许多亟待解决的难题。首先,msc移植治疗sle临床效果尚存争议。sle患者自体msc异常(lupus,2007,16(2):121-8),而采用异体msc移植治疗时,msc虽具有强大的免疫抑制作用,但由于sle是一种异质性疾病,不同人种或个体差异大,导致msc移植治疗sle的有效性报道并不一致。其次,基于不同的体外细胞研究体系,也有研究报道msc的免疫调节功能并不稳定,甚至对淋巴细胞无免疫抑制作用(rheumatology(oxford),2015,54(1):163-8;clin immunol,2016,163:34-41)。除此之外,msc的移植存活率和植入率受机体内氧气供应不足、活性氧或其他有害分子的存在而影响(j biomed sci,2013,20(1):69),且更易老化导致其功能减弱(arthritis&rheumatology(hoboken,nj),2017,69(8):1623-35)等。因此,在msc移植治疗sle中,亟待解决的关键科学问题之一,是在应用msc治疗sle之前,如何通过体外预处理或修饰以维持msc活性、保护其免受氧化应激,进而增强其免疫抑制功能是一种有极具前景的改造策略。
3.目前,现有技术中提出包括改进培养方式(如3d培养和共培养方法等)(mater sci eng c mater biol appl,2022:112646)、生长因子或细胞因子刺激(cytokine growth factor rev,2019,47:32-42)、缺氧诱导(biomaterials,2021,269:120633)和基因改造(int j mol sci.2020oct 2;21(19):7301;j am soc nephrol,2020,31(1):54-65)等多种策略,用来增强msc的免疫调节和抗炎特性(stem cell res ther,2020,11(1):397)。然而,上述的修饰策略至今未取得突破性进展,且仍不能解决msc可能促炎的风险。
技术实现要素:
4.本发明的目的在于克服现有技术的不足之处而提供一种增强人脐带间充质干细胞免疫抑制功能的组合物及应用。
5.为实现上述目的,本发明采取的技术方案如下:
6.第一方面,本发明提供一种增强人脐带间充质干细胞免疫抑制功能的组合物,其特征在于,所述组合物包括系统性红斑狼疮患者血清和rapamycin(雷帕霉素)。
7.本发明的组合物可增强人脐带间充质干细胞(huc-mscs)免疫抑制功能,包括增强msc合成抑炎因子(tgf-β和ido)和减弱其合成促炎因子(tnf-α、ifn-γ)的能力,以及增强msc抑制b细胞产生igg抗体的能力。本发明为临床上用msc更有效的治疗sle患者提供了一种增强其免疫抑制功能的新策略。
8.作为本发明所述的组合物的优选实施方式,所述系统性红斑狼疮患者为活动期患者。即所述系统性红斑狼疮患者的sledai>4分。
9.作为本发明所述的组合物的优选实施方式,所述血清为外周静脉血血清;具体的,抽取sle患者外周静脉血,本领域常规方法制备血清。
10.第二方面,本发明将所述组合物在制备增强人脐带间充质干细胞抗炎功能的制剂中应用。
11.用sle患者血清和rapamycin联合处理huc-mscs,可增强其合成抑炎因子的能力,减弱其合成促炎因子的能力。所述抑炎因子为tgf-β和ido,促炎因子为ifn-γ和tnf-α。
12.第三方面,本发明将所述组合物在制备增强人脐带间充质干细胞免疫抑制功能的制剂中应用。
13.第四方面,本发明将所述组合物在制备msc移植治疗系统性红斑狼疮的制剂中应用。
14.用sle患者血清联用rapamycin所培养的huc-mscs可显著抑制sle患者b细胞产生igg1、igg2、igg3总抗体的能力,igg4总抗体也有相同的趋势。所述sle患者b细胞,为活动期(sledai>4分)sle患者外周血中b细胞。
15.作为本发明所述应用的优选实施方式,所述制剂为培养基。
16.优选的,所述系统性红斑狼疮患者血清占所述培养基的质量百分比为10%-20%。
17.优选的,所述rapamycin在所述培养基中的摩尔浓度为5μm-10μm。
18.与现有技术相比,本发明的有益效果为:
19.本发明首次提出用sle患者血清和rapamycin联合处理huc-mscs,可增强其免疫抑制功能,包括增强其合成抑炎因子和减弱其合成促炎因子的能力,以及增强其抑制sle患者b细胞产生抗体的能力。为临床上用huc-mscs更有效的治疗sle患者中,增强huc-mscs的免疫抑制作用,减少其促炎副作用提供了新策略,具有广阔的临床应用前景。
附图说明
20.图1为实施例1中huc-mscs鉴定和染色图;
21.图1中,a为fcm检测huc-mscs表面标志物;b为光学显微镜观察huc-mscs形态学;c为光学显微镜观察茜素红染色后huc-mscs诱导成骨分化能力;d为光学显微镜观察油红o染色后huc-mscs诱导成脂分化能力。
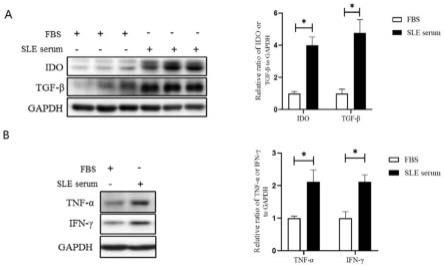
22.图2为实施例2中用sle患者血清处理huc-mscs后胞内抗炎因子和促炎因子检测结果图;
23.图2中,a为western blot检测huc-mscs经胎牛血清(fbs)、sle血清(n=12)处理后其胞内抗炎因子(tgf-β和ido)的表达水平;b为胞内促炎因子(tnf-α、ifn-γ)的表达水平;*p<0.05。
24.图3为实施例3中用sle患者血清和rapamycin(雷帕霉素)联合处理huc-mscs后抗炎因子和促炎因子的检测结果图;
25.图3中,a为western blot检测sle患者血清(n=12),较未联合用rapamycin(雷帕霉素)(5μm),或联用rapamycin(雷帕霉素)(5μm)所培养的huc-mscs合成的促炎因子(tnf-α、ifn-γ)的水平;b为抑炎因子(tgf-β、ido)的水平;*p<0.05。
26.图4为实施例4中用sle患者血清和rapamycin(雷帕霉素)联合处理huc-mscs后b细胞抗体的检测结果图;;
27.图4中,a-d分别为芯片检测b细胞igg抗体亚型表达水平;*p<0.05。
具体实施方式
28.为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。本领域技术人员应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
29.实施例中所用的试验方法如无特殊说明,均为常规方法;所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
30.实施例1:huc-mscs的制备、培养和鉴定
31.(1)huc-mscs由湖南源品生物和广东医科大学附属医院干细胞中心提供。huc-mscs按适宜密度重悬在含10% fbs、1%双抗的α-mem培养基中,置于37℃、5% co2培养箱中培养。
32.(2)当细胞长至85%融合度时,弃培养基,pbs洗1次,用0.25%胰酶消化后用完全培养基重悬,制成1
×
107cells/ml细胞悬液,细胞悬液按100μl/管加入流式管
①‑⑦
,分别加入相应抗体,即:
①
fitc anti-human cd90 5μl;
②
pe anti-human cd44 5μl;
③
percp-cy5.5 anti-human cd105 5μl;
④
apc anti-human cd73 5μl;
⑤
nothing;
⑥
msc positive isotype control cocktail 20μl、pe msc negative isotype control cocktail 20μl;
⑦
msc positive cocktail 20μl、pe msc negative cocktail 20μl,4℃,避光孵育30min,pbs洗2次,350g,5min离心,弃上清,400μl pbs重悬,上机检测。
33.(3)huc-mscs分化潜能鉴定
34.1)huc-mscs成骨分化:将脐带间质干细胞按5
×
104cells/ml密度接种于六孔板,每孔2ml完全基,置于37℃,5%co2的培养箱中培养。当细胞融合度达到60%-70%时,吸弃旧培养基,加入2ml/孔脐带间质干细胞成骨诱导分化完全培养基。间隔3d换用新鲜诱导分化培养基,2-4周后视细胞形态及成骨情况用茜素红染色。染色方法:成骨诱导分化结束后,吸弃六孔板中的诱导培养基,用pbs洗1次,加入1ml/孔4%多聚甲醛溶液,固定30min。吸弃多聚甲醛,pbs洗2次,加入1ml/孔茜素红染色液染色10min。吸弃茜素红,pbs洗2次,显微镜下观察成骨效果,并拍照。
35.2)huc-mscs成脂分化:将脐带间质干细胞按5
×
104cells/ml密度接种于六孔板,每孔2ml完全培养基,置于37℃,5%co2的培养箱中培养。当细胞融合度达到100%或过度融合时,吸弃旧培养基,加入2ml/孔脐带间质干细胞成骨诱导分化完全培养基。间隔3天换用新鲜诱导分化培养基,诱导约12-20天,当脂滴变得足够大且圆,予油红o染色。染色方法:成脂诱导分化结束后,吸弃六孔板中的诱导培养基,用pbs洗1次,加入1ml/孔4%多聚甲醛溶液,固定30min。吸弃多聚甲醛,pbs洗2次,加入1ml/孔油红o工作液染色30min(工作液按油红o贮存液:蒸馏水3:2,过滤或离心后备用)。吸弃油红o染液,pbs洗2次,显微镜下观察成脂效果,并拍照。
36.上述结果如下:
37.流式细胞术染色分析huc-mscs表面标志物发现,huc-mscs高表达cd90、cd105、
cd73>99%;低表达或不表达造血细胞表面标志物,即cd34、cd19、cd45、cd11b总和<2%(见图1a)。镜下观察可见huc-mscs贴壁生长,形态为长梭形,呈放射状或漩涡状分布(见图1b)。对huc-mscs诱导成骨分化,镜下可见钙结节被茜素红染成红色,证实huc-mscs具有成骨分化能力(见图1c);对huc-mscs诱导成脂分化,镜下可见脂滳被油红o染成红色,证实huc-mscs具有成脂分化能力(见图1d)。
38.实施例2:sle患者血清处理huc-mscs对胞内促炎因子和抗炎因子的影响
39.(1)细胞准备:取处于对数生长期huc-mscs,pbs洗1次,用0.25%胰酶消化,当细胞变圆时用完全培养基终止消化,并用含10% fbs的α-mem完全培养基重悬细胞,按2
×
104cells/cm2密度接种于六孔板;
40.(2)加处理因素:待细胞长至70%融合度时,换用含sle患者血清(10%)(n=12)的α-mem完全培养基处理24h;
41.其中,sle患者为活动期(sledai>4分)sle患者;sle患者血清为抽取以上sle患者外周静脉血所制备的血清;
42.(3)收细胞并提蛋白:收集各组培养上清,暂存-80℃备用。细胞用pbs洗3次,加入蛋白裂解液(配制:ripa裂解液:pmsf:磷酸酶抑制剂=100:1:1)70μl/孔提取蛋白;bca法测浓度;并配平,变性后备用;
43.(4)蛋白免疫沉淀法:按前述方法配制12%分离胶和浓缩胶行sds-page电泳分离蛋白,当溴盼蓝跑到分离胶底部时,即可终止电泳。后取出分离胶置于1
×
转膜缓冲液中,备好转膜架、pvdf膜(预先甲醇浸泡5min)、滤纸等,按照“三明治夹层”法将蛋白转至pvdf膜,5%bsa摇床上封闭2h,pbs-t洗膜5次,5min/次,加入鼠抗人gapdh抗体、鼠抗人tgf-β抗体、兔抗人ido抗体、兔抗人ifn-γ抗体、兔抗人tnf-α抗体,4℃摇床过夜。次日回收一抗,洗膜,加入相应二抗,室温孵育1h-2h,洗膜;曝光。
44.western blot结果如图2所示:与胎牛血清(fbs)组相比,sle患者血清培养的huc-mscs合成的抑炎因子(tgf-β、ido)显著增加,然而,合成促炎因子tnf-α、ifn-γ水平亦显著升高(图2)。说明用sle患者血清处理huc-mscs,可增强其表达抑炎因子和促炎因子的能力。
45.实施例3:用sle患者血清和rapamycin(雷帕霉素)联合处理huc-mscs对胞内促炎因子和抗炎因子的影响
46.(1)细胞准备:取对数生长期huc-mscs,pbs洗1次,用0.25%胰酶消化,当细胞变圆时用完全培养基终止消化,并用含10% fbs的α-mem完全培养基重悬细胞,按2
×
104cells/cm2密度接种于六孔板;
47.(2)加处理因素:待细胞长至70%融合度时,换用含10% sle血清(n=12)的α-mem完全培养基,培养基中加入相应浓度的rapamycin(雷帕霉素)(5μm),处理24h;
48.其中,sle患者为活动期(sledai>4分)sle患者;sle患者血清为抽取以上sle患者外周静脉血所制备的血清;
49.(3)收细胞并提蛋白:弃去培养基,细胞用pbs洗3次,加入蛋白裂解液(配制:ripa裂解液:pmsf:磷酸酶抑制剂=100:1:1)70μl/孔冰上裂解,提取蛋白;bca法测浓度;并配平,变性后备用;
50.(4)蛋白免疫沉淀法:按前述方法配制12%分离胶和浓缩胶,行sds-page电泳分离蛋白,当溴盼蓝跑到分离胶底部时,即可终止电泳。后取出分离胶置于1
×
转膜缓冲液中,备
好转膜架、pvdf膜(预先甲醇浸泡5min)、滤纸等,按照“三明治夹层”法将蛋白转至pvdf膜,5% bsa摇床上封闭2h,pbs-t洗膜5次,5min/次,加入鼠抗人gapdh抗体、鼠抗人tgf-β抗体、兔抗人ido抗体、兔抗人ifn-γ抗体、兔抗人tnf-α抗体,4℃摇床过夜。次日回收一抗,洗膜(同上),加入相应二抗,室温孵育1h-2h,洗膜;曝光。
51.western blot结果如图3所示:与sle患者血清(sle serum)未联合用rapamycin(雷帕霉素)(5μm)组相比,sle患者血清联用rapamycin(雷帕霉素)(5μm)所培养的huc-mscs合成的促炎因子(tnf-α、ifn-γ)水平则显著降低,而合成抑炎因子(tgf-β、ido)进一步显著增加(图3)。可知,用sle患者血清和rapamycin(雷帕霉素)联合处理huc-mscs,可增强其合成抑炎因子的能力,减弱其合成促炎因子的能力。
52.实施例4:用sle患者血清和rapamycin(雷帕霉素)联合处理huc-mscs对b细胞产生抗体的影响
53.(1)制备sle患者外周血b细胞
54.标本采集:edta抗凝管采集sle患者(n=12)外周血10ml,为保持细胞最佳活性,4h内尽早使用;
55.单个核细胞制备:用含2%fbs的pbs与外周血等体积混匀稀释,后缓慢加到等体积lymphoprep上面(注意不要搅动液面过剧烈),室温,800g,15min离心,此时可见液面分四层,由上往下分别为血小板层、乳白色单个核细胞层、分离液层、红细胞层。先将血小板层弃去,取中间pbmc层于另一离心管,加入等体积easyseptm buffer,混匀,300g,6min,离心,弃上清;再加入相同体积的easyseptm buffer,混匀,120g,6min,离心去除血小板;
56.b细胞负选:用easyseptm buffer重悬细胞体积为0.2ml-2ml,密度5
×
107cells/ml;加入“cocktail enhancer”及“isolation cocktail”50μl/ml,混匀后室温孵育5min;将“rapidspheres”涡旋振荡30s后按50μl/ml加入上述悬液中,无需孵育。用easyseptm buffer补充体系至2.5ml,混匀后放入easysep
tm magnet中室温孵育5min,倒入新流式管;再次放入easysep
tm magnet,室温,孵育1min,倒入新流式管,300g,5min离心,弃上清,用适量培养基重悬;
57.b细胞活性检测:取5μl悬液与5μl台盼蓝按1:1混匀,计数,记录细胞数量和细胞活力;
58.b细胞纯度检测:分别取负选前pbmc和负选后b细胞悬液各100μl,4℃,350g,离心5min,弃上清,加入pe鼠抗人cd19抗体,混匀,4℃,避光孵育30min,加入pbs 1ml/管洗2次,最后200μlpbs重悬,上机。细胞纯度cd19 b细胞》90%以上进行下一步实验。
59.(2)huc-mscs对b细胞产生抗体的影响
60.huc-mscs种板:取处于对数生长期的huc-mscs,0.25%胰酶消化后重悬成密度1
×
106cells/ml,按4μl,20μl,100μl接种于96孔板和48孔板,培养体系为含10%fbs的x-vivo,200μl/孔,约6h左右贴壁;去除未贴壁huc-mscs后,将培养上清换为含10% sle血清(n=12)的x-vivo培养基,培养基中加入(联用组)、或不加入相应浓度的rapamycin(雷帕霉素)(5μm),处理24h(其中,sle患者为活动期sledai>4分的sle患者;sle患者血清为抽取以上sle患者外周静脉血所制备的血清)。此后,洗涤huc-mscs细胞,去除rapamycin(雷帕霉素)
61.b细胞制备:方法同前,将b细胞重悬成密度1
×
106cells/ml;
62.共培养:
63.去除已贴壁huc-mscs的上清,将b细胞单独培养或b细胞:huc-mscs按1:1共培养,培养体系为含10%sle血清(n=12)的x-vivo,200μl/孔。
64.b细胞抗体检测:共培养6d后,收集所有上清于对应1.5ml ep管中,4℃,2000rpm,10min离心,取上清于新1.5ml ep管中,-80℃储存,送芯片检测或采用human igg elisa检测。
65.抗体芯片的检测结果如图4所示,与sle患者血清(sle serum)未联合用rapamycin(雷帕霉素)(5μm)组相比,sle患者血清联用rapamycin(雷帕霉素)(5μm)所培养的huc-mscs可显著抑制sle患者b细胞产生igg1、igg2、igg3总抗体的能力,igg4总抗体也有相同的趋势(图4)。
66.本发明用活动期系统性红斑狼疮(sle)患者血清和rapamycin(雷帕霉素)联合处理huc-mscs能显著增强其免疫抑制功能:可增强huc-mscs合成抑炎因子(tgf-β和ido)和减弱其合成促炎因子(tnf-α、ifn-γ)的能力,以及增强huc-mscs抑制b细胞产生igg抗体的能力。本发明为临床上用huc-mscs更有效的治疗sle患者,提供了一种增强其免疫抑制功能的新策略。
67.最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。