一种肿瘤抑制肽
1.本发明专利申请是国际申请号为pct/cn2016/090800、国际申请日为2016年7月21日、进入中国国家阶段的申请号为201680044076.1、发明名称为“一种肿瘤抑制肽”的发明专利申请的分案申请。
技术领域
2.本发明属于肿瘤治疗领域,具体涉及一种用于抑制、治疗肿瘤的多肽,所述多肽的氨基酸序列是内皮抑素n端第1个氨基酸残基起长45个氨基酸以内的片段。
背景技术:
3.内皮抑素是1997年o’reilly等从培养的小鼠内皮细胞瘤(eoma)上清中分离纯化的一种内源性血管生成抑制剂,为20kd分子量蛋白质,来源于xviii型胶原蛋白的水解产物。实验表明,内皮抑素对血管内皮和肿瘤细胞发挥抑制作用。由于重组的内皮抑素难于复性等困难因素,美国entremed公司放弃了重组内皮抑素的临床研究,目前尚无法大量制备具有较高体外活性的内皮抑素。
4.内皮抑素序列中由n端第1、3、11位三个组氨酸及第76位的天冬氨酸残基组成的锌离子结合位点,内皮抑素与锌离子结合对其活性至关重要。据报道,来源于内皮抑素n端的多肽具有一定的抑制血管内皮细胞和肿瘤细胞的活性(cancer res.2005;65(9):3656-63,美国专利us7524811b2)。然而上述试验也显示,从人内皮抑素来源含有n端1-25位氨基酸的多肽不能显著抑制接种于小鼠动物模型上的人源肿瘤的生长,内皮抑素衍生肽的活性有待提高。
技术实现要素:
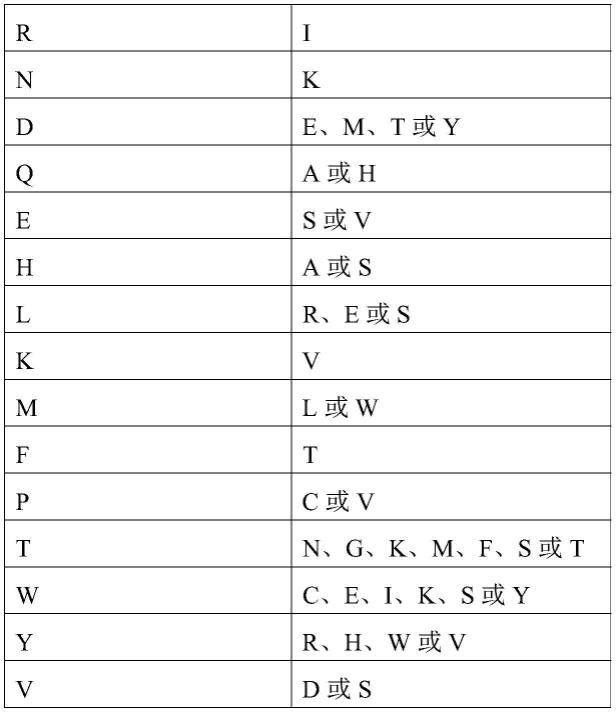
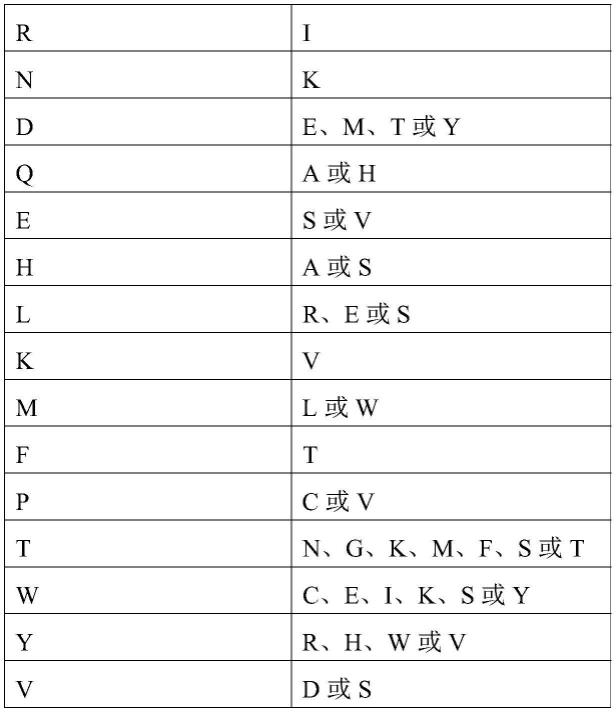
5.本发明提供一种多肽,所述多肽为内皮抑素n端长45个氨基酸残基以内的片段,且至少含有n端第1-20位氨基酸残基,且其中所述内皮抑素n端第2位氨基酸残基和第18位氨基酸残基分别选自下组:
6.第2位氨基酸第18位氨基酸amrinkde、m、t或yqa或hes或vha或slr、e或skvml或w
ftpc或vtn、g、k、m、f、s或twc、e、i、k、s或yyr、h、w或vvd或s
7.且任选地,所述内皮抑素n端第17位氨基酸为s、a、l、i或t,和/或第20位氨基酸残基为s或t,和/或如果含有第21位和/或第22位氨基酸残基,则第21位氨基酸残基为g、a、l、i或v,和/或第22位氨基酸残基为g、a、l、i或v;
8.优选地,所述内皮抑素的氨基酸序列如seq id no:1所示。
9.在一个具体实施方式中,所述多肽至少含有seq id no:38第1-22位氨基酸残基,且第2和18位氨基酸残基如前文所述。
10.在一个具体实施方式中,所述多肽至少含有seq id no:38第1-25位氨基酸残基,且第2和18位氨基酸残基如前文所述。
11.在一个具体实施方式中,所述多肽至少含有seq id no:38第1-22位氨基酸残基,优选至少含有seq id no:38第1-25位氨基酸残基,且第2位氨基酸残基为t,第18位氨基酸残基为n、g、k、m、f、s或t,且第17、20、21和22位氨基酸如前文所述。
12.在一个具体实施方式中,所述多肽至少含有seq id no:38第1-22位氨基酸残基,优选至少含有seq id no:38第1-25位氨基酸残基,且第18位氨基酸残基为n,第2位氨基酸残基为t,且第17、20、21和22位氨基酸如前文所述。
13.在一个具体实施方式中,所述多肽至少含有seq id no:38第1-22位氨基酸残基,优选至少含有seq id no:38第1-25位氨基酸残基,且第18位氨基酸残基为s,第2位氨基酸残基为e、h、l、t、w或v,且第17、20、21和22位氨基酸如前文所述。
14.在一个具体实施方式中,所述多肽的氨基酸序列如seq id no:4、5、6、7、27-30、39或41所示。
15.在一个具体实施方式中,所述多肽由seq id no:38组成,其中,第2位氨基酸残基为t,第18位氨基酸残基为n或s,且第17、20、21和22位氨基酸如前文所述。
16.在一个具体实施方式中,所述多肽选自由seq id no:4第1到第39、38、37、36、34、33、32、31、29、28、27或26位氨基酸残基组成的氨基酸序列,以及由seq id no:39第1到第39、38、37、36、35、34、33、32、31、29、28、27、26或25位氨基酸残基组成的氨基酸序列。
17.在一个具体实施方式中,所述多肽n端第1位氨基酸残基是组氨酸,该组氨酸被甲酰化、乙酰化、丙酰化或丁酰化修饰,其c端第1位氨基酸可被peg、胆固醇或酰胺化修饰。
18.在一个具体实施方式中,所述多肽选自:
19.hthrdfqpvlhlvalnsslsggmrgirgad;
20.ac-hthrdfqpvlhlvalnsslsggmrgirgad;
21.hthrdfqpvlhlvalnsslsggmrgirgad-nh2;
22.ac-hthrdfqpvlhlvalnsslsggmrgirgad-nh2;
23.ac-hthrdfqpvlhlvalnsslsggmrg-nh2;
24.ac-hthrdfqpvlhlvalnsslsggmrgirgadfqcfq-nh2;
25.ac-hthrdfqpvlhlvalnsslsggmrgirgadfqcfqqarav-nh2;
26.hthrdfqpvlhlvalnsnlsggmrgirgad;
27.ac-hthrdfqpvlhlvalnsnlsggmrgirgad;
28.hthrdfqpvlhlvalnsnlsggmrgirgad-nh2;
29.ac-hthrdfqpvlhlvalnsnlsggmrgirgad-nh2;
30.ac-hthrdfqpvlhlvalnaslsggmrgirgad-nh2;
31.ac-hthrdfqpvlhlvalnssltggmrgirgad-nh2;
32.ac-hthrdfqpvlhlvalnasltggmrgirgad-nh2;和
33.ac-hthrdfqpvlhlvalnsslsggmrgirga-nh2;
34.其中ac为乙酰化修饰,nh2为酰胺化修饰。
35.本发明还提供一种多核苷酸序列,选自:
36.(1)编码本发明多肽的多核苷酸序列;和
37.(2)(1)所述多核苷酸序列的互补序列。
38.在一个具体实施方式中,所述多核苷酸序列选自seq id no:32、33、34、35、37和40。
39.在一个具体实施方式中,所述多核苷酸序列选自由seq id no:32第1位到第117、114、111、108、102、99、96、93、87、84、81或78位碱基组成的多核苷酸序列。
40.在一个具体实施方式中,所述多核苷酸序列选自由seq id no:40第1位到第117、114、111、108、105、102、99、96、93、87、84、81、78或75位碱基组成的多核苷酸序列。
41.本发明还提供一种表达载体,含有本发明所述的多核苷酸序列。
42.本发明还提供一种药物组合物,其特征在于,它含有本发明所述的多肽和药学上可接受的载体。
43.本发明还提供本发明多肽或药物组合物在制备用于预防或治疗肿瘤的药物中的应用。
44.在一个具体实施方式中,所述肿瘤选自:肺腺癌、肺鳞癌、肝癌、结肠癌、胰腺癌、横纹肌肉瘤、成视网膜细胞瘤、尤文肉瘤、成神经细胞瘤和骨肉瘤
45.本发明还提供本发明多肽或药物组合物在制备提高化疗药物疗效用的药物中的应用。
46.在一个具体实施方式中,所述化疗药物为顺铂、卡铂或奥沙利铂。
47.本发明还提供一种本发明氨基酸序列的制备方法,该方法包括采用fmoc固相合成法合成所述氨基酸序列。
附图说明
48.图1a和1b分别显示多肽p1的hplc和mass图谱。
49.图1c和1d分别显示多肽p2的hplc和mass图谱。
50.图1e和1f分别显示多肽p2t2s18的hplc和mass图谱。
51.图1g和1h分别显示多肽p2t2n18的hplc和mass图谱。
52.图2显示p1、p2、p3、p4多肽、endostatin、endostar对huvec抑制的生物学活性。
53.图3a和3b分别显示多肽p2t2s18δ1的hplc和mass图谱。
54.图3c和3d分别显示多肽p2t2s18δ2的hplc和mass图谱。
55.图3e和3f分别显示多肽p2t2s18δ3的hplc和mass图谱。
56.图4显示部分多肽对huvec抑制的生物学活性。
57.图5a和5b分别显示数条多肽对huvec和肿瘤细胞hepg2的抑制作用。图5a中,以浓度为2.5mg/ml处的细胞存活率计,从上到下各曲线依次代表p2s18、endostar、endostatin、p2t2、p2n18、p2、p2t2n18、p2t2s18(p2t2n18和p2t2s18两者曲线部分重合)的细胞存活率。图5b中,以浓度为2.5mg/ml处的细胞存活率计,从上到下各曲线依次代表endostar、p2s18、endostatin、p2t2、p2n18、p2、p2t2n18和p2t2s18的细胞存活率。
58.图6显示p2和p2t2s18多肽诱导spc-a-1肿瘤细胞体外死亡。
59.图7a和7b分别显示多肽p2t2s18-20的hplc和mass图谱。
60.图7c和7d分别显示多肽p2t2s18-25的hplc和mass图谱。
61.图7e和7f分别显示多肽p2t2n18-35的hplc和mass图谱。
62.图7g和7h分别显示多肽p2t2n18-40的hplc和mass图谱。
63.图7i和7j分别显示多肽p2t2n18-45的hplc和mass图谱。
64.图8显示多肽对huvec体外生长的抑制。图中,以浓度180μm处的细胞存活率计,从上到下各曲线依次代表p2t2-15、p2t2s18-45、p2t2s18-40、p2t2s18-20、p2t2s18-25、p2t2s18-35和p2t2s18的细胞存活率。
65.图9显示p2和p2t2s18多肽对多种肿瘤细胞smmc7721、spc-a-1、a549、ls174t、bel7402、ck-mes-1、bxpc-3的体外抑制作用。其中针对每一种肿瘤细胞的两根柱状图,左边的柱状图为p2的结果,右边的柱状图为p2t2s18的结果。
66.图10显示多肽对肿瘤细胞及huvec体外生长的抑制。其中,以浓度0.5mg/ml处的细胞存活率计,从上到下各曲线依次代表p2、p2t2s18δ3、p2t2s18δ1、p2t2s18δ2和p2t2s18的细胞存活率。
67.图11a和11b分别显示多肽对肿瘤细胞体内生长的抑制。图11a和11b中,以给药后第1-21天的数据为例,从上到下各曲线均依次表示阴性对照、endostar、p2、endostatin、阳性对照和p2t2s18的肿瘤体积tv和相对肿瘤体积rtv。
68.图12a和12b分别显示多肽联合化疗药物对肿瘤细胞体内生长的抑制结果。图12a和12b中,以给药第1-21天的数据为例,从上到下各曲线均依次阴性对照、ddp(2mg/kg)、endostar ddp、p2 ddp、endostatin ddp、ddp(6mg/kg)和p2t2s18 ddp的肿瘤体积tv和相对肿瘤体积rtv。
69.图13显示多肽对huvec体外生长的抑制。
70.图14a和14b分别显示多肽p2t2s18-29的hplc和mass图谱。
71.图15显示多肽p2t2s18-29对huvec的抑制作用。以2.5mg/ml处的细胞存活率计,从上到下曲线依次代表endostar、endostatin、p2、p2t2s18-29和p2t2s18。
72.图16显示多肽p2t2s18-29对肿瘤细胞hepg2的抑制作用。以1mg/ml处的细胞存活率计,从上到下曲线依次代表endostar、endostatin、p2、p2t2a18和p2t2s18-29。
具体实施方式
73.本发明的多肽为内皮抑素的n端长45个以内氨基酸残基的片段,至少含有内皮抑
素n端第1-20位氨基酸残基,且其中:
74.(1)对应于内皮抑素n端第2位氨基酸的残基为a、r、n、d、q、e、h、i、l、k、m、f、p、t、w、y或v;和
75.(2)对应于内皮抑素n端第18位氨基酸的残基为a、r、n、d、c、e、g、h、i、l、k、m、f、s、t、w、y或v;
76.且所述多肽与其无突变的对应序列相比,在相同浓度条件下对huvec的抑制率高至少15%,优选至少高20%;或所述多肽与其无突变的对应序列相比,前者ic
50
浓度为后者ic
50
浓度的二分之一,优选地前者ic
50
浓度为后者ic
50
浓度的五分之一,进一步优选地优选地前者ic
50
浓度为后者ic
50
浓度的十分之一。
77.内皮抑素优选为人内皮抑素。seq id no:1显示了重组人血管内皮抑素的一个例子。优选的,本发明的氨基酸序列至少含有seq id no:1所述的内皮抑素n端第1-20位氨基酸残基,且第2位和第18位氨基酸如本文所述。
78.优选的,所述多肽对应于内皮抑素n端第2位氨基酸的残基为d、l、t、w或y。优选地,所述多肽对应于内皮抑素n端第18位氨基酸的残基为n、e、k、m、s、t或v。更优选的,所述多肽对应于内皮抑素n端第2位氨基酸的残基为d、t、w或y。更优选地,所述多肽对应于内皮抑素第18位氨基酸的残基为n、s或v。
79.在某些实施例中,所述多肽对应于内皮抑素第2位的氨基酸残基和第18位的氨基酸残基分别为以下组合:
80.[0081][0082]
或者,在某些实施例中,所述多肽对应于内皮抑素第2位的氨基酸残基和第18位的氨基酸残基分别为以下组合:
[0083][0084][0085]
应理解,“片段”指全长序列的一部分连续的序列。例如,本文的多肽优选为由内皮抑素n端第1位氨基酸到第20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44或45位氨基酸残基组成、并在第2和18位为本文所述氨基酸残基的序列。换言之,本发明多肽长度为20-45个氨基酸残基,从内皮抑素n端第1个氨基酸残基起算。更优选地,本发明的多肽长度为25-40个氨基酸残基,从n端第1个氨基酸残基起算。
[0086]
在某些实施例中,所述片段除在第2和18位为本文所述氨基酸残基外,还可任选地在第17、20、21和22位中的任一位、任二位、任三位或全部四位为以下残基:
[0087]
第17位氨基酸残基:s、a、l、i、v或t;
[0088]
第20位氨基酸残基:s或t;
[0089]
第21位氨基酸残基:g、a、l、i或v;
[0090]
第22位氨基酸残基:g、a、l、i或v。
[0091]
因此,在某些实施例中,作为内皮抑素n端长45个氨基酸残基以内的片段的本发明多肽至少含有seq id no:38第1-22位氨基酸残基,优选至少含有seq id no:38第1-25位氨基酸残基,且第2和18位为本文所述的氨基酸残基,且第17、20-22中任一位、任二位、任
三位或全部四位为上文所述的残基。更进一步地,这类多肽长25-40个氨基酸残基。
[0092]
在某些实施例中,作为内皮抑素n端长45个氨基酸残基以内的片段的本发明多肽至少含有seq id no:38第1-22位氨基酸残基,优选至少含有seq id no:38第1-25位氨基酸残基,且第2位氨基酸残基为t,第18位氨基酸残基为n、g、k、m、f、s或t(更优选为n或s),任选地,第17、20、21和22氨基酸如前文所述。更进一步地,这类多肽长25-40个氨基酸残基。
[0093]
在某些实施例中,作为内皮抑素n端长45个氨基酸残基以内的片段的本发明多肽至少含有seq id no:38第1-22位氨基酸残基,优选至少含有seq id no:38第1-25位氨基酸残基,且第18位氨基酸残基为n,第2位氨基酸残基为t,任选地,第17、20、21和22氨基酸如前文所述。更进一步地,这类多肽长25-40个氨基酸残基。
[0094]
在某些实施例中,作为内皮抑素n端长45个氨基酸残基以内的片段的本发明多肽至少含有seq id no:38第1-22位氨基酸残基,优选至少含有seq id no:38第1-25位氨基酸残基,且第18位氨基酸残基为s,第2位氨基酸残基为e、h、l、t、w或v,任选地,第17、20、21和22位氨基酸如前文所述。更进一步地,这类多肽长25-40个氨基酸残基。
[0095]
本发明优选的多肽的氨基酸序列如seq id no:4、5、6、7、27-30、39或41所示。本发明多肽还包括由seq id no:4第1到第39、38、37、36、34、33、32、31、29、28、27或26位氨基酸残基组成的氨基酸序列,以及由seq id no:39第1到第39、38、37、36、35、34、33、32、31、29、28、27、26或25位氨基酸残基组成的氨基酸序列。
[0096]
本发明的多肽n端第1位氨基酸残基是组氨酸,该组氨酸可被甲酰化、乙酰化、丙酰化、或丁酰化修饰,其c端第1位氨基酸可被peg、胆固醇、或酰胺化修饰。
[0097]
优选的,本发明多肽n端第1位氨基酸残基组氨酸被乙酰化修饰,其c端第1位氨基酸被酰胺化修饰。
[0098]
应理解,在基因克隆操作中,常常需要设计合适的酶切位点,这势必在所表达的氨基酸序列末端引入了一个或多个不相干的残基,而这并不影响目的序列的活性。又如为了构建融合蛋白、促进重组蛋白的表达、获得自动分泌到宿主细胞外的重组蛋白、或利于重组蛋白的纯化,常常需要将一些氨基酸添加至重组蛋白的n-末端、c-末端或该蛋白内的其它合适区域内,例如,包括但不限于,适合的接头肽、信号肽、前导肽、末端延伸等。本发明氨基酸序列的氨基端或羧基端还可含有一个或多个多肽片段,作为蛋白标签。任何合适的标签都可以用于本发明。例如,所述的标签可以是flag,ha,ha1,c-myc,poly-his,poly-arg,strep-tagii,au1,ee,t7,4a6,ε,b,ge以及ty1。这些标签可用于对蛋白进行纯化。使用的标签例子包括poly-arg,如rrrrr(seq id no:42);poly-his 2-10个(通常6个),如hhhhhh(seq id no:43);flag,即dykddddk(seq id no:44);strep-tagii,即wshpqfek(seq id no:45);和c-myc,即wqkliseedl(seq id no:46)。
[0099]
因此,本发明也包括含有所述标签序列或由所述标签序列与前述片段构成的多肽。
[0100]
本发明的氨基酸序列可以是化学合成的产物,或是使用重组技术从原核或真核宿主(例如,细菌、酵母、丝状真菌、高等植物、昆虫和哺乳动物细胞)中产生的重组多肽。根据重组生产方案所用的宿主,本发明的多肽可以是糖基化的,或可以是非糖基化的。
[0101]
例如,可采用本领域周知的多肽化学合成法来合成本发明的氨基酸序列。多肽化学合成方法包括固相合成法和液相合成法,其中以固相合成法常用。固相合成方法包括但
不限于fmoc和tboc两种常用方法。通常,使用树脂作为不溶性的固相载体,通常从c端(羧基端)向n端(氨基端)逐个将氨基酸连接在肽链上,每个氨基酸连接循环由以下三步反应构成:1)脱保护:被保护的氨基酸必须用一种脱保护溶剂去除氨基的保护基团;2)活化:待连接的氨基酸的羧基被活化剂所活化;和3)偶联:活化的羧基与前一个氨基酸裸露的氨基反应,形成肽键。反复循环直到肽链延伸至所需长度时即可完成。最后用切割液切割肽链和固相载体之间的连接,就可获得所需的氨基酸序列。可以在程序控制的自动化多肽合成仪上进行上述化学合成,这类仪器包括但不限于protein technologies公司推出的tribute双通道多肽合成仪、c s bio公司的uv online monitor系统、aapptec公司推出的focus xc三通道合成仪等。
[0102]
本发明也包括编码本发明多肽的多核苷酸。例如,seq id no:30显示了seq id no:1的编码序列;seq id no:31显示了seq id no:3的编码序列;seq id no:32显示了seq id no:4的编码序列;seq id no:33显示了seq id no:5的编码序列;seq id no:34显示了seq id no:6的编码序列;seq id no:35显示了seq id no:7的编码序列;seq id no:36显示了seq id no:8的编码序列;seq id no:37显示了seq id no:9的编码序列;seq id no:40显示了seq id no:39的编码序列。
[0103]
本发明的多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。编码成熟多肽的编码区序列可以与上述dna序列相同或者是简并的变异体。如本文所用,“简并的变异体”在本发明中是指编码本发明的氨基酸序列,但与如seq id no:31等所示的序列有差别的核酸序列。
[0104]
术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
[0105]
本发明中的多肽和多核苷酸优选以分离的形式提供,更佳地被纯化至均质。
[0106]
本发明的核苷酸序列通常可以用pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。
[0107]
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
[0108]
此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
[0109]
目前,已经可以完全通过化学合成来得到编码本发明氨基酸序列的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。
[0110]
本发明也涉及包含本发明多核苷酸的载体,以及用本发明的载体经基因工程产生的宿主细胞,以及经重组技术产生本发明所述多肽的方法。优选的,本发明的载体是表达载体。
[0111]
通过常规的重组dna技术,可利用本发明的多核苷酸序列来表达或生产本发明的多肽。一般来说有以下步骤:
[0112]
(1)用本发明的多核苷酸或其简并的变异体,或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
[0113]
(2)在合适的培养基中培养的宿主细胞;
[0114]
(3)从培养基或细胞中分离、纯化蛋白质。
[0115]
可将本发明的多核苷酸序列插入到重组表达载体中。术语“重组表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒或其它载体。只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
[0116]
本领域的技术人员熟知的方法能用于构建含本发明核酸序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的核酸序列可有效连接到表达载体中的适当启动子上,以指导mrna合成。这些启动子的代表性例子有:大肠杆菌的lac或trp启动子;λ噬菌体pl启动子;真核启动子包括cmv立即早期启动子、hsv胸苷激酶启动子、早期和晚期sv40启动子、反转录病毒的ltrs和其它一些已知的可控制基因在原核或真核细胞或其病毒中表达的启动子。
[0117]
此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(gfp),或用于大肠杆菌的四环素或氨苄青霉素抗性。
[0118]
包含上述的适当dna序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
[0119]
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;丝状真菌细胞、或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母、丝状真菌、植物细胞;果蝇s2或sf9的昆虫细胞;cho、cos、293细胞、或bowes黑素瘤细胞的动物细胞等。
[0120]
本发明的多核苷酸在高等真核细胞中表达时,如果在载体中插入增强子序列时将会使转录得到增强。增强子是dna的顺式作用因子,通常大约有10到300个碱基对,作用于启动子以增强基因的转录。
[0121]
本领域一般技术人员都清楚如何选择适当的载体、启动子、增强子和宿主细胞。
[0122]
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
[0123]
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
[0124]
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这
些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。现有技术已知各种通过重组技术制备多肽的方法。
[0125]
本发明还提供一种药物组合物,该药物组合物含有本发明的多肽和药学上可接受的载体。
[0126]
药物组合物中可含有治疗或预防有效量的本发明多肽。“有效量”指某成分的用量足以产生所期望的反应。具体的有效量取决于多种因素,诸如欲治疗的特定病症、患者的身体条件(如患者体重、年龄或性别)、治疗持续时间、共同施与的疗法(如果有的话)以及所用的具体配方。“有效量”也指在该用量下,本发明多肽的毒性或负面效果不及于其所带来的正面疗效。
[0127]
药学上可接受的载体通常是安全、无毒的,且广义上可包括制药产业中用于制备药物组合物的任何已知物质,如填充剂、稀释剂、凝结剂、黏合剂、润滑剂、助流剂、稳定剂、着色剂、润湿剂、崩解剂等。在选择适用于投递合成肽的赋形剂时,主要需考虑此药物组合物的给药方式,本领域技术人员熟知此项技术。
[0128]
本发明药物组合物中所述多肽的含量为约0.01
–
1000μm。
[0129]
可根据已知的药学程序来制备上述药物组合物,譬如《雷明顿制药科学》(remington’s pharmaceutical sciences)(第17版,alfonoso r.gennaro编,麦克出版公司(mack publishing company),伊斯顿,宾夕法尼亚(1985))一书中有详细的记载。
[0130]
本发明的药物组合物可以是各种合适的剂型,包括但不限于药片、胶囊、注射剂等。
[0131]
本发明的药物组合物中还可含有其它已知的化疗药物,尤其是已知用来治疗或预防肿瘤的化疗药物,包括但不限于顺铂、卡铂或奥沙利铂。
[0132]
本发明的多肽和药物组合物可用于治疗或预防已知内皮抑素能治疗或预防的各种疾病,缓和或减轻已知内皮抑素能缓和或减轻的各种症状。
[0133]
例如,本发明的多肽和药物组合物可给予需要的对象,用于治疗或预防肿瘤。对象可以是哺乳动物,尤其是人。
[0134]
肿瘤包括血管瘤和实体瘤。所述实体瘤包括但不限于横纹肌肉瘤、成视网膜细胞瘤、尤文肉瘤、成神经细胞瘤、骨肉瘤等、肺腺癌、肺鳞癌、肝癌、结肠癌和胰腺癌等。
[0135]
本发明还提供一种癌症治疗方法,该方法包括给予需要的对象本发明的多肽或药物组合物。
[0136]
本发明还提供一种提高化疗药物疗效的方法,该方法包括给予需要的对象化疗药物之前、同时或之后给予本发明的多肽或药物组合物。
[0137]
本发明还提供本发明多肽或药物组合物在制备治疗或预防肿瘤用的药物中的应用。
[0138]
本发明还提供本发明多肽或药物组合物在制备用于提高化疗药物疗效的药物中的应用。
[0139]
本发明还提供用作药物的多肽,所述多肽如本发明前文各方面或更实施方案所述。本发明还提供用于治疗或预防前文所述各种肿瘤或用于提高化疗药物疗效的多肽,所
述多肽如本发明前文各方面或各实施方案所述。
[0140]
实施例
[0141]
下面结合具体实施例,进一步阐述本发明。本发明的实施除非另外说明,将使用本领域技术人员已知的化学、生物化学、重组dna技术和免疫学的常规方法。这些技术在文献中有完整的解释。参见,如《肽:化学与生物学》,科学出版社,n.休厄德、h.d.贾库布克著,刘克良、何军林等译;《基础免疫学》(fundamental virology),第二版,第i和ii卷(b.n.fields和d.m.knipe编);《实验免疫学手册》(handbook of experimentalimmunology),第i-iv卷(d.m.weir和c.c.blackwell编,blackwell scientific publications);t.e.creighton,《蛋白质:结构和分子特性》(proteins:structures and molecular properties)(w.h.freeman and company,1993);a.l.lehninger,《生物化学》(biochemistry)(worth publishers,inc.最新版);sambrook等,《分子克隆:实验室手册》(molecular cloning:a laboratory manual),第二版,1989;《酶学方法》(methods in engymology)(s.colowick和n.kaplan编,academic press,inc.)。此外,应理解,本发明中的“含有”也包括“由
……
组成”。本文所用氨基酸序列编号,即“seq id no:1-29、38、39和41”,仅指氨基酸序列本身,不包括n端修饰和c端修饰。
[0142]
实施例一:多肽的制备和修饰
[0143]
按照多肽合成标准fmoc方案,以0.25mm树脂起始,按照下表序列自羧基端向氨基端逐个残基延伸合成,可最后添加n端修饰。肽合成结束后,经切割液切割,g6玻砂漏斗滤除树脂,滤液真空抽干,多肽的c末端可进一步酰胺化。无离子水溶解多肽产物,explorer 100型中压液相色谱仪c18柱纯化,分步收集主峰。目标峰收集样以agilent 1100型反相高压液相色谱phenomenex c18分析柱纯度鉴定,lcq advantage型质谱仪分子量鉴定。中压液相色谱纯化所得的收集液冻干,溶于pbs形成多肽储存液,0.20μm过滤除菌,-80℃冻存。hplc纯度鉴定和mass质谱分子量鉴定见图1。
[0144][0145]
实施例二:人脐静脉内皮细胞(huvec)的分离和培养
[0146]
准备脐带保存液:150ml pbs 3倍工作浓度的双抗(青/链);准备完全培养基:80ml m199 20ml fbs 1ml ecgs 1ml 100x的双抗 1ml肝素溶液(0.5%w/v) 1ml 200mm的谷氨酰胺;准备分离器械:手术弯盘1个、血管钳4-5把、手术剪2把,直径10cm左右的玻璃培养皿;i型胶原酶的配置:配置成1%(w/v)。
[0147]
取20cm近胎儿端脐带,冲洗干净,两端结扎,置于150ml脐带保存液中;置于4度冰箱保存,6小时内消化;检查脐带,去掉受损部分,将脐静脉充分冲洗干净,后将10ml胶原酶溶液注入,转移至37℃孵箱消化15分钟;取出脐带,收集消化液,并用pbs清洗,离心后重悬
培养,24小时后换液,清除不能贴壁细胞。
[0148]
实施例三:多肽对人脐静脉内皮细胞(huvec)和肿瘤细胞的抑制
[0149]
使用mtt法检测对细胞的生长抑制作用。其原理是活细胞线粒体中的琥珀酸脱氢酶能使外源性mtt(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)还原为水不溶性的蓝紫色结晶甲瓒(formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(dmso)能溶解细胞中的甲瓒,用酶联免疫检测仪在490/570nm波长处测定其光吸收值,可间接反映活细胞数量。在一定细胞数范围内,mtt结晶形成的量与细胞数成正比。对数生长期的huvec或肿瘤细胞,弃培养上清,pbs洗涤1次,加入1ml 0.25%胰酶(4℃),37℃消化2min,加入培养上清中和,吹打细胞成悬液后,1000转离心3min。弃上清,加入5ml培养基重悬。按3
×
104/ml,接种48孔板,500ul/孔。5%co2,37℃培养24小时。培养的细胞弃上清,加入含有多肽的培养基(培养基中含有zn
2
浓度为17.39μmol/l),继续培养48小时。各孔小心弃上清,450ul/孔pbs轻柔漂洗1次。每孔加入450ul mtt培养基,继续培养4h。小心弃培养上清,加入二甲基亚砜450ul/孔,置摇床上避光低速振荡10min。将150ul上清转入96孔elisa板,在酶联免疫检测仪od490nm、570nm测量各孔的吸光值。
[0150]
实施例四:多肽n端修饰和c端修饰对其活性的影响
[0151]
如实施例一所示方法合成下表所示序列如seq id no:2的多肽,带有或不带有n端和/或c端修饰,其中ac为乙酰化修饰、nh2为酰胺化修饰。对其进行hplc纯度鉴定和mass质谱分子量鉴定。
[0152]
多肽编号序列(自n端至c端)p1hshrdfqpvlhlvalnsplsggmrgirgadp2ac-hshrdfqpvlhlvalnsplsggmrgirgad-nh2p3ac-hshrdfqpvlhlvalnsplsggmrgirgadp4hshrdfqpvlhlvalnsplsggmrgirgad-nh2[0153]
重组人血管内皮抑素(endostatin,seq id no:1)可以从市场上购买获得(例如genetex货号gtx65524、biovision产品货号4799-1000、上海博升生物科技有限公司货号e2296-05、武汉博士德生物工程有限公司货号bp4153等)。已上市的重组人血管内皮抑素药物恩度(endostar,seq id no:10)从医疗机构购买。
[0154]
按照实施例三所示方法,在多肽浓度1mg/ml、重组人血管内皮抑素浓度5mg/ml(多肽和内皮抑素接近等摩尔浓度)的试验条件下对p1、p2、p3、p4多肽、endostatin、endostar对huvec抑制的生物学活性进行测定,测定结果如图2。
[0155]
实施例五:多肽的构效关系研究
[0156]
如实施例一的方法合成序列如下表的多肽,并测定其hplc纯度鉴定和mass质谱分子量。按照实施例三所示方法,在1mg/ml浓度条件下对上述多肽对huvec抑制的生物学活性进行测定,测定结果如图4。
[0157][0158]
以文献(embo j.1998mar 16;17(6):1656
–
1664)公开的血管内皮抑素结构(pdb数据库结构编号1bnl)为基础,采用insight ii软件对上述多肽进行同源模建,获得p2多肽的优势构象。再采用全活化空间自洽场(casscf)对p2多肽的最高占有轨道(homo)能量和最低空轨道(lumo)能量进行计算。在此基础上,采用我们独创的算法-多肽氨基酸2维协同迭代空间位场算法(2-d synergistic iterative algorithms in spacial point field,2-d siaspf),p2多肽中氨基酸进行两两组合模拟迭代替换,计算替换对多肽zn离子结合活性域(1h、3h、11h)引起的电子密度方差累加,并结合实际测试氨基酸组合对应的生物活性,对p2各氨基酸两位点之间生物活性协同关系进行评分,结果显示,多肽中第2位和第18位氨基酸对生物活性的协同性影响最高。
[0159]
实施例六:多肽氨基酸替换对其活性的影响
[0160]
构建第2位和第18位氨基酸的p2肽组合肽库。采用aapptec公司apex396全自动高通量多肽合成仪合成序列如下表的多肽,其中x1和x3为任意一种天然氨基酸(见下表),x2和x4为s,x5和x6为g。
[0161][0162]
按照实施例三所示方法,在1mg/ml浓度条件下对上述多肽对huvec抑制的生物学活性进行测定,测定结果见下表。
[0163][0164]
表中,小写的a、b、c、d、e、f、g、h、i和j分别表示:
[0165]
a:细胞活性0-10%;b:细胞活性11-20%;c:细胞活性21-30%;d:细胞活性31-40%;e:细胞活性41-50%;f:细胞活性51-60%;g:细胞活性61-70%;h:细胞活性71-80%;i:细胞活性81-90%;j:细胞活性91-100%。
[0166]
实施例七:多肽对肿瘤细胞及huvec体外生长的抑制
[0167]
如实施例一所示的方法合成序列如下表的多肽,并对其进行hplc纯度鉴定和mass质谱分子量鉴定。
[0168][0169]
如seq id no:1序列的重组血管内皮抑素(endostatin)、如seq id no:10序列的上市药物恩度(endostar),按照实施例三所示的方法测试对huvec和肿瘤细胞hepg2的抑制作用,测定结果见图5a、图5b及下表。结果显示p2t2s18和p2t2n18生物活性明显高于p2,其ic
50
浓度较p2降低约10倍。而携带第2位氨基酸单点突变的多肽p2t2和携带第18位氨基酸单点突变的p2n18和p2s18,其生物活性均较p2为低,因此p2t2s18和p2t2n18高生物活性是由2位氨基酸和18位氨基酸共同突变导致的难以预料的协同效应产生,可见通过常规的单点突变扫描方法难以获得本发明涉及的p2t2s18和p2t2n18高生物活性结构。
[0170][0171][0172]
实施例八:多肽诱导spc-a-1肿瘤细胞体外死亡
[0173]
如实施例三所示的方法,在多肽浓度2.5mg/ml条件下测试多肽对spc-a-1肺癌细胞系诱导细胞死亡的作用,光学显微镜下观察24小时并拍照。结果如图6所示,p2在加入培养基后4小时发挥作用,细胞出现皱缩,24小时细胞基本死亡,p2诱导细胞死亡的方式类似于凋亡。p2t2s18在加入培养基后2小时即对细胞发挥剧烈作用,但细胞不是皱缩,而是极度膨胀;4小时后膨胀进一步加剧,8小时细胞开始碎裂,至24小时仅存细胞碎片。p2t2s18导致的细胞死亡方式令人十分惊讶,目前尚无法确定该种细胞死亡为何种模式,也未见文献报道。但很显然,该种细胞死亡模式明显不同于p2导致的细胞死亡。结合实施例七的结果可见,p2t2s18不仅生物活性显著高于p2,而且导致细胞死亡的方式与p2也明显不同。
[0174]
实施例九:多肽对huvec体外生长的抑制
[0175]
如实施例一所示的方法合成序列如下表的多肽,hplc纯度鉴定和mass质谱分子量鉴定见图1和图7a-7j。
[0176][0177]
按照实施例三所示的方法测试多肽对huvec的抑制活性。各多肽在等摩尔浓度条件下测试,其中p2t2s18多肽300um浓度约相当于1mg/ml。结果见图8和下表,显示p2t2s18的c末端在一定范围内缩短或延长后仍有生物活性。
[0178]
多肽编号序列编号多肽浓度为120um时细胞存活率(%)p2t2s18-45seq id no:380p2t2s18-40seq id no:449p2t2s18-35seq id no:515p2t2s18seq id no:62p2t2s18-25seq id no:731p2t2s18-20seq id no:852p2t2-15seq id no:2495
[0179]
实施例十:多肽对多种肿瘤细胞体外生长的抑制
[0180]
按照实施例三所示的方法,在多肽浓度1mg/ml条件下测试p2(序列编号seq id no:2)和p2t2s18(序列编号seq id no:6)多肽试对多种肿瘤细胞smmc7721、spc-a-1、a549、ls174t、bel7402、ck-mes-1、bxpc-3的体外抑制作用,测试结果见图9和下表。可见,p2t2s18较p2对多种肿瘤的抑制活性明显增高,p2t2s18的ic
50
浓度均小于p2 ic
50
浓度的1/10。特别是对ls174t结肠癌细胞,p2未显示抑制活性,在药物浓度为1mg/ml时细胞存活率高达95%;而p2t2s18对该细胞的抑制活性相当显著,在相同浓度条件下几乎杀灭全部肿瘤细胞,细胞存活率仅为1%。
[0181][0182]
实施例十一:多肽对肿瘤细胞及huvec体外生长的抑制
[0183]
如实施例一的方法合成序列如下表的多肽,hplc纯度鉴定和mass质谱分子量鉴定见图1和图3a-3f。按照实施例三所示的方法测试对huvec的抑制作用,测定结果见图10。
[0184]
多肽编号序列编号序列(自n端至c端)p2seq id no:2ac-hshrdfqpvlhlvalnsplsggmrgirgad-nh2p2t2s18seq id no:6ac-hthrdfqpvlhlvalnsslsggmrgirgad-nh2p2t2s18δ1seq id no:6ac-hthrdfqpvlhlvalnsslsggmrgirgadp2t2s18δ2seq id no:6hthrdfqpvlhlvalnsslsggmrgirgad-nh2p2t2s18δ3seq id no:6hthrdfqpvlhlvalnsslsggmrgirgad
[0185]
实施例十二:在体肿瘤模型的建立
[0186]
取体外培养状态良好的对数生长期肿瘤细胞,裸鼠皮下接种含5
×
106瘤细胞的培养细胞悬液100ul。15天后取生长良好的实体瘤,无菌条件下切割成约3mm大小的均匀小块,用套管针每只裸鼠右腋皮下接种一块。接种后10-14天根据肿瘤大小重新分组,淘汰肿瘤过大和过小的动物,每组肿瘤平均体积基本一致。各组按照试验方案给予试验药物。每周2次测量瘤块的长径(a)、短径(b)。试验结束后处死动物,解剖取瘤块,称瘤重,拍照。肿瘤体积tv=1/2
×a×
b2;肿瘤相对体积rtv=vt/vo,vo为分笼时(即给药前1天)测量所得肿瘤体积,vt为每一次测量时的肿瘤体积。抑瘤率(%)=(1-t/c)*100%,其中t为治疗组平均肿瘤体积,c为阴性对照组平均肿瘤体积。
[0187]
实施例十三:多肽对肿瘤细胞体内生长的抑制
[0188]
如实施例一的方法合成序列如下表的多肽,hplc纯度鉴定和mass质谱分子量鉴定见图1。
[0189]
多肽编号序列编号序列(自n端至c端)p2seq id no:2ac-hshrdfqpvlhlvalnsplsggmrgirgad-nh2p2t2s18seq id no:6ac-hthrdfqpvlhlvalnsslsggmrgirgad-nh2[0190]
如seq id no:1序列的重组血管内皮抑素(endostatin)、如seq id no:10序列的上市药物恩度(endostar)。如实施例十所示方法,建立人肝癌bel7404肿瘤模型,试验设以下6组,除阴性对照组9只动物外,其他试验组每组6只动物。其中多肽和内皮抑素的剂量接
近等摩尔。试验结果见图11a、图11b和下表。
[0191]
1)阴性对照组(生理盐水,皮下注射sc,2次/日,连续给药21天)
[0192]
2)环磷酰胺ctx(30mg/kg,腹腔注射ip,1次/日,连续给药7天)
[0193]
3)p2组(15mg/kg/次,sc,2次/日,连续给药21天)
[0194]
4)p2t2s18组(15mg/kg/次,sc,2次/日,连续给药21天)
[0195]
5)endostatin(50mg/kg/次,sc,2次/日,连续给药21天)
[0196]
6)endostar(50mg/kg/次,sc,2次/日,连续给药21天)
[0197][0198]
各试验组之间rtv进行t检验,各p值见下表。可见,p2不能明显抑制肿瘤的增长,与阴性对照组比较没有明显差异(p=0.015)。p2t2s18则能明显抑制肿瘤的生长,在给药21天后肿瘤抑制率达到76.7%。甚至,p2t2s18对肿瘤的抑制效果与化疗药ctx接近,两组间rtv没有明显差异(p>0.01)。值得注意的是,试验中p2t2s18试验组动物未出现毒性反应,而ctx组则出现典型的化疗毒副作用。p2t2s18抑制肿瘤生长的作用明显优于p2(p<0.001)、endostatin(p<0.001)和endostar(p<0.001)。
[0199][0200]
实施例十四:多肽联合化疗药物对肿瘤细胞体内生长的抑制
[0201]
如实施例一的方法合成序列如下表的多肽,hplc纯度鉴定和mass质谱分子量鉴定见图1。
[0202]
多肽编号序列编号序列(自n端至c端)p2seq id no:2ac-hshrdfqpvlhlvalnsplsggmrgirgad-nh2p2t2s18seq id no:6ac-hthrdfqpvlhlvalnsslsggmrgirgad-nh2[0203]
如seq id no:1序列的重组血管内皮抑素(endostatin)、如seq id no:10序列的上市药物恩度(endostar)。如实施例十所示方法,建立人肺癌a549肿瘤模型,试验设以下7组,每组6只动物。其中多肽和内皮抑素的剂量等摩尔。
[0204]
1)阴性对照组:生理盐水,sc,2次/日,连续给药21天;
[0205]
2)顺铂(ddp)低剂量组:2mg/kg/day,ip,1次/日,连续给药7天);
[0206]
3)p2 ddp组:
[0207]
ddp:2mg/kg/day,ip,1次/日,连续给药7天,
[0208]
p2:15mg/kg/次,sc,2次/日,连续给药21天;
[0209]
4)p2t2s18 ddp组:
[0210]
ddp:2mg/kg/day,ip,1次/日,连续给药7天,
[0211]
p2t2s18:15mg/kg/次,sc,2次/日,连续给药21天;
[0212]
5)重组血管内皮抑素seq id no:1 ddp组:
[0213]
ddp:2mg/kg/day,ip,1次/日,连续给药7天,
[0214]
endostatin:50mg/kg/次,sc,2次/日,连续给药21天;
[0215]
6)重组血管内皮抑素seq id no:10 ddp组:
[0216]
ddp:2mg/kg/day,ip,1次/日,连续给药7天,
[0217]
endostar:50mg/kg/次,sc,2次/日,连续给药21天;
[0218]
7)ddp高剂量组:6mg/kg/day,ip,1次/日,连续给药7天。
[0219]
试验结果见图12a、图12b和下表。
[0220][0221]
各试验组之间rtv进行t检验,各p值见下表。可见,p2联合ddp(2mg/kg)不能明显提高ddp(2mg/kg)抑制肿瘤的作用,两试验组rtv比较没有明显差异(p=0.011);p2联合ddp(2mg/kg)对肿瘤的抑制作用明显差于ddp(6mg/kg),两试验组rtv比较有明显差异(p<0.001)。p2t2s18则能明显增强ddp(2mg/kg)抑制肿瘤的效果。p2t2s18联合ddp(2mg/kg)对肿瘤的抑制明显优于ddp(2mg/kg),两试验组rtv比较有明显差异(p<0.001)。甚至,p2t2s18联合ddp(2mg/kg)对肿瘤的抑制明显优于ddp(6mg/kg),p2t2s18联合ddp(2mg/kg)在给药21天后肿瘤抑制率达到99.7%,6只试验动物中仅2只动物残存肿瘤,其余4只动物的肿瘤消失。而ddp(6mg/kg)组给药21天后全部6只动物均有肿瘤残存。p2t2s18联合ddp(2mg/kg)组rtv小于ddp(6mg/kg)组,且有明显差异(p<0.001)。可见p2t2s18联合ddp(2mg/kg)疗效优于ddp(6mg/kg)。
[0222]
p2t2s18联合ddp(2mg/kg)组疗效明显优于p2联合ddp(2mg/kg)组((p<0.001)、endostatin联合ddp(2mg/kg)组((p<0.001)、endostar联合ddp(2mg/kg)组((p<0.001)。
[0223]
值得注意的是,试验中p2t2s18联合ddp(2mg/kg)试验组动物与ddp(2mg/kg)组未见明显毒性反应,而ddp(6mg/kg)组动物出现明显化疗毒性反应。
[0224][0225]
实施例十五:多肽对肿瘤细胞及huvec体外生长的抑制
[0226]
如实施例一的方法合成序列如下表的多肽,按照实施例三所示的方法在多肽浓度为0.1mg/ml条件下测试对huvec的抑制作用,测定结果见图13。
[0227][0228]
实施例十六:多肽对肿瘤细胞及huvec体外生长的抑制
[0229]
如实施例一的方法合成序列如下表的多肽,hplc纯度鉴定和mass质谱分子量鉴定见图14a和14b。按照实施例三所示的方法测试对huvec和肿瘤细胞hepg2的抑制作用。测定结果见图15和16。结果显示p2t2s18和p2t2s18-29生物活性相似,均明显高于p2。
[0230]
多肽编号序列编号序列(自n端至c端)p2t2s18-29seq id no:41ac-hthrdfqpvlhlvalnsslsggmrgirga-nh2[0231]
上述具体实施例仅仅是阐述性的,而非限制性的。本技术的保护范围将由权利要求来限定。本领域技术人员将理解,在不偏离本发明的精神和范围的情况下,可对本发明的技术方案作出各种修改和变动,这些修改和变动依然包括在本发明的范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。