瑞德西韦治疗方法
1.相关申请的交叉引用
2.本技术要求2021年5月29日提交的美国临时专利申请63/032,321的优先权,该美国临时专利申请全文并入本文以用于所有目的。
背景技术:
3.预防或治疗一些沙粒病毒科、冠状病毒科、丝状病毒科、黄病毒科、正黏液病毒、肺病毒科和副黏液病毒科病毒感染存在挑战,因为缺乏用于预防或管理由这些科的病毒引起的感染的疫苗或暴露后治疗模式。在一些情况下,患者仅接受支持疗法,诸如电解质和体液平衡、氧气、血压维持或继发感染的治疗。
4.化合物(s)-2-乙基丁基2-(((s)-(((2r,3s,4r,5r)-5-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-基)-5-氰基-3,4-二羟基四氢呋喃-2-基)甲氧基)(苯氧基)磷酰基)氨基)丙酸酯,在本文中称为式ia的化合物,已知对几个病毒科(包括沙粒病毒科、冠状病毒科、丝状病毒科、副黏液病毒科和黄病毒科病毒)表现出抗病毒特性(参见例如,warren,t.等人,nature,2016年,第531卷,第381-385页;lo mk等人,sci.reports,2017年;第7卷,第43395页;sheahan tp等人,sci.transl.med.2017年,第9卷,第eaal3653页;agostini ml等人,mbio,2018年;第9卷第2期,第e00221-18页;cell research(2020年)第30卷,第269-271页;以及wo 2017/184668)。需要开发包含式ia的化合物或其药学上可接受的盐的治疗病毒感染的方法。
[0005]
治疗有需要的人中的病毒感染的包含式ia的化合物或其药学上可接受的盐的方法应避免降低、延缓或减弱该化合物的抗病毒活性的其他剂。
技术实现要素:
[0006]
在一些实施方案中,本公开提供了一种治疗有需要的人中的病毒感染的方法,该方法包括向该人施用治疗有效量的式i、式ia或式ib的化合物或其药学上可接受的盐:
[0007]
[0008][0009][0010]
其中该人未用氯喹或其类似物或盐治疗,由此治疗该病毒感染。
[0011]
在一些实施方案中,本公开提供了一种优化有需要的人中的式ii的化合物或其药学上可接受的盐的血浆或血液浓度的方法:
[0012][0013]
该方法包括向该人施用抗病毒化合物,其中该人尚未被施用氯喹或其类似物或盐,该抗病毒化合物在向人施用后转化为式ii的化合物,并且该式ii的化合物的血浆或血液浓度在不存在氯喹或其类似物或盐的情况下被优化。
[0014]
在一些实施方案中,本公开提供了一种优化有需要的人中的式ii的化合物或其药学上可接受的盐的血浆或血液浓度的方法,该方法包括:(a)向该人施用式i、式ia或式ib的化合物或其药学上可接受的盐;(b)测量人中的式ii的化合物的血浆或血液浓度;以及(c)调节式i、式ia或式ib的化合物的任何剩余剂量,以优化该人中的式ii的化合物的血浆或血液浓度。
[0015]
在一些实施方案中,本公开提供了一种确定用于治疗有需要的人中的病毒感染的式i、式ia或式ib的化合物或其药学上可接受的盐的递送剂量的方法,该方法包括:(a)提供初始剂量的式i、式ia或式ib的化合物或其药学上可接受的盐;(b)确定是否已向该人施用氯喹或其类似物或盐;以及(c1)如果已向该人施用氯喹或其类似物或盐,则增加式i、式ia或式ib的化合物或其药学上可接受的盐的初始剂量以确定递送剂量,或者(c2)如果尚未向该人施用氯喹或其类似物或盐,则选择式i、式ia或式ib的化合物或其药学上可接受的盐的
初始剂量作为递送剂量。
[0016]
在一些实施方案中,本公开提供了一种在有需要的人中形成式ii的化合物的方法,该方法包括向该人施用治疗有效量的式ia的化合物,并指示该人不服用氯喹或其类似物或盐,其中式ia的化合物在不存在氯喹或其类似物或盐的情况下代谢为式ii的化合物,其中式ii的化合物具有以下结构:
[0017][0018][0019]
并且其中式ia的化合物具有以下结构:
[0020][0021]
在一些实施方案中,本公开提供了一种降低式ia的化合物或其药学上可接受的盐在患有病毒感染的人中功效减弱的风险的方法,该方法包括:
[0022]
(a)确定该人在施用式ia的化合物或其药学上可接受的盐之前是否已服用氯喹或其类似物或盐,(b)指示该人在用式ia的化合物或其药学上可接受的盐治疗的同时不服用氯喹或其类似物或盐,以及(c)向该人施用式ia的化合物或其药学上可接受的盐,由此降低式ia的化合物或其药学上可接受的盐的功效减弱的风险。
[0023]
在一些实施方案中,本公开提供了一种预防患有病毒感染的人中的禁忌症的方法,该方法包括:(a)确定该人在施用式ia的化合物或其药学上可接受的盐之前是否已服用氯喹或其类似物或盐,(b)指示该人在用式ia的化合物或其药学上可接受的盐治疗的同时不服用氯喹或其类似物或盐,以及(c)向该人施用式ia的化合物或其药学上可接受的盐,由此预防该人中的禁忌症。
[0024]
在一些实施方案中,本公开提供了一种保持式ia的化合物或其药学上可接受的盐在患有病毒感染的人中的功效的方法,该方法包括:(a)确定该人在施用式ia的化合物或其药学上可接受的盐之前是否已服用氯喹或其类似物或盐,(b)指示该人在用式ia的化合物或其药学上可接受的盐治疗的同时不服用氯喹或其类似物或盐,以及(c)向该人施用式ia的化合物或其药学上可接受的盐,由此保持式ia的化合物或其药学上可接受的盐的功效。
[0025]
在一些实施方案中,本公开提供了一种降低患有病毒感染的人中的式ii的化合物的血浆浓度减小的风险的方法,该方法包括:(a)确定该人在施用式ia的化合物或其药学上可接受的盐之前是否已服用氯喹或其类似物或盐,(b)指示该人在用式ia的化合物或其药
学上可接受的盐治疗的同时不服用氯喹或其类似物或盐,以及(c)向该人施用式ia的化合物或其药学上可接受的盐,由此降低式ii的化合物的血浆浓度减小的风险。
附图说明
[0026]
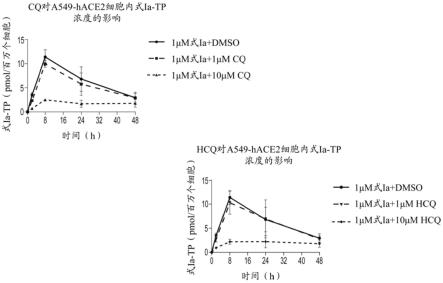
图1.示出了氯喹(cq)或羟氯喹(hcq)对a549-hace2细胞中式ia三磷酸盐(tp)形成的影响。
[0027]
图2.示出了cq或hcq对nhbe培养物中式ia三磷酸盐(tp)形成的影响。
[0028]
图3.示出了cq或hcq对hep-2细胞中式ia三磷酸盐(tp)形成的影响。
[0029]
图4.示出了与cq或hcq组合的式ia的化合物在a549-hace2细胞中的sars-cov-2抗病毒数据。
具体实施方式
[0030]
i.概述
[0031]
本公开提供了一种治疗受试者中的病毒感染的方法,该方法包括向受试者施用式i、式ia或式ib的化合物或其药学上可接受的盐,其中该受试者未用氯喹或其类似物或盐治疗。
[0032]
ii.定义
[0033]“本公开的化合物”是指以如本文所述的方法施用于受试者的化合物,并且包括式i、式ia、式ib的化合物或其药学上可接受的盐。
[0034]“药学上可接受的”或“生理上可接受的”是指化合物、盐、组合物、剂型和其他物质,其可用于制备合适兽医或人药物使用的药物组合物。
[0035]“药学上可接受的赋形剂”包括但不限于任何助剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、风味增强剂、表面活性剂、润湿剂、分散剂、悬浮剂、稳定剂、等渗剂、溶剂或乳化剂,它们已被美国食品药品监督管理局批准为可接受用于人或家畜。
[0036]“药物组合物”是指本公开的化合物和本领域通常接受的用于将生物活性化合物递送至哺乳动物(例如,人)的介质的制剂。因此,此类介质包括所有药学上可接受的赋形剂。
[0037]“有效量”或“治疗有效量”是指本公开的化合物的量,当将该量施用于有需要的患者时足以实现该化合物对其具有效用的疾病状态、病症或障碍的治疗。这样的量将足以引起组织系统或者研究人员或临床医生所寻求的患者的生物学或医学反应。构成治疗有效量的本公开的化合物的量将取决于诸如以下因素而变化:化合物及其生物活性、用于施用的组合物、施用时间、施用途径、化合物的排泄率、治疗的持续时间、所治疗的疾病状态或障碍的类型及其严重程度、与本公开的化合物组合或同时使用的药物,以及患者的年龄、体重、一般健康状况、性别和饮食。这种治疗有效量可以由本领域普通技术人员在考虑到他们自己的知识、现有技术和本公开内容后常规确定。
[0038]“治疗”(“treatment”或“treating”或“treat”)是指用于获得包括临床结果的有益或期望结果的方法。有益或期望的临床结果包括以下中的一者或多者:a)抑制疾病或病症(例如,减少由疾病或病症引起的一种或多种症状,和/或减弱疾病或病症的程度);b)减缓或阻止与疾病或病症相关联的一种或多种临床症状的发展(例如,稳定疾病或病症,预防
或延迟疾病或病症的恶化或进展,和/或预防或延迟扩散(例如,疾病或病症的转移);和/或c)缓解疾病,即导致临床症状的消退(例如,改善疾病状态、提供疾病或病症的部分或总体缓解、增强另一种药物的效果、延迟疾病的进展、增加生活质量和/或延长生存期)。
[0039]“预防”(“prevention”或“preventing”)意指任何导致疾病或病症的临床症状不发展的疾病或病症的任何治疗。在一些实施方案中,组合物可施用于处于风险或患有疾病或病症家族史的受试者(包括人)。
[0040]“受试者”或“患者”是指动物,诸如哺乳动物(包括人),其已经或将是治疗、观察或实验的对象。本文所述的方法可用于人疗法和/或兽医应用。在一些实施方案中,受试者或患者是哺乳动物。在一些实施方案中,受试者或患者是人;家畜如狗或猫;农场动物,诸如牛、马、绵羊、山羊或猪;或实验动物,诸如小鼠、大鼠、仓鼠、豚鼠、猪、兔、狗或猴。在一些实施方案中,受试者或患者是人。
[0041]“有需要的人”是指可能患有或怀疑患有将受益于某些治疗的疾病或病症的人;例如,用根据本技术的本文所公开的化合物治疗以治疗病毒感染。
[0042]
iii.使用方法
[0043]
本公开还提供了一种治疗或预防有需要的人中的病毒感染的方法,该方法包括施用本文所述的化合物。
[0044]
在一些实施方案中,本公开提供了一种治疗有需要的人中的病毒感染的方法,该方法包括向该人施用治疗有效量的式i、式ia或式ib的化合物或其药学上可接受的盐:
[0045][0046]
[0047][0048]
其中该人未用氯喹或其类似物或盐治疗,由此治疗该病毒感染。
[0049]
在一些实施方案中,本公开提供了一种确认向人施用式i、式ia或式ib的化合物的方法,该方法包括在获自该人的生物样品中鉴定式ii的化合物或其盐。在一些实施方案中,该人未用氯喹或其类似物或盐治疗。在一些实施方案中,在施用式i、式ia或式ib的化合物或其药学上可接受的盐之前,该人先前尚未用氯喹或其类似物或盐治疗。在一些实施方案中,生物样品源自血浆或血液。
[0050]
在一些实施方案中,本公开提供了一种测量式i、式ia或式ib的化合物在人中的代谢速率的方法,该方法包括在施用式i、式ia或式ib的化合物或其药学上可接受的盐后的一个或多个时间点测量该人中式ii的化合物或其盐的量。在一些实施方案中,在施用式i、式ia或式ib的化合物或其药学上可接受的盐之前,该人先前尚未用氯喹或其类似物或盐治疗。在一些实施方案中,式ii的化合物或其盐的量从获自人的生物样品中测量。在一些实施方案中,式ii的化合物或其盐的量从血液样品中测量。在一些实施方案中,式ii的化合物或其盐的量从血浆样品中测量。
[0051]
在一些实施方案中,本公开提供了一种确定人在病毒感染治疗中的预防性或治疗性响应的方法,该方法包括在施用式i、式ia或式ib的化合物或其药学上可接受的盐后的一个或多个时间点测量该人中式ii的化合物或其盐的量。在一些实施方案中,在施用式i、式ia或式ib的化合物或其药学上可接受的盐之前,该人先前尚未用氯喹或其类似物或盐治疗。在一些实施方案中,式ii的化合物或其盐的量从获自人的生物样品中测量。在一些实施方案中,式ii的化合物或其盐的量从血液样品中测量。在一些实施方案中,式ii的化合物或其盐的量从血浆样品中测量。
[0052]
a.氯喹施用
[0053]
本方法提供了对不具有可感知的氯喹或其类似物或盐的全身浓度的人的治疗。在一些实施方案中,在施用式i、式ia或式ib的化合物或其药学上可接受的盐之前,有需要的人先前尚未用氯喹或其类似物或盐治疗。
[0054]
在一些实施方案中,人先前已用氯喹或其类似物或盐治疗。在一些实施方案中,在施用式i、式ia或式ib的化合物或其药学上可接受的盐之前的一段时间内,有需要的人尚未用氯喹或其类似物或盐治疗。在一些实施方案中,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时间段允许氯喹或其类似物或盐的全身浓度降低,使得本公开的化合物的抗病毒活性不降低。例如,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时间段可允许氯喹或其类似物或盐的血浆浓度由于清除或代谢而降低。
[0055]
在一些实施方案中,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时
间段为至少1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天。在一些实施方案中,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时间段为至少14天。在一些实施方案中,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时间段为至少28天。在一些实施方案中,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时间段为至少40天。在一些实施方案中,用氯喹或其类似物治疗与施用本公开的化合物之间的时间段为至少50天。在一些实施方案中,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时间段为至少60天。在一些实施方案中,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时间段为至少90天。在一些实施方案中,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时间段为至少120天。在一些实施方案中,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时间段为至少180天。在一些实施方案中,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时间段为至少365天。
[0056]
在一些实施方案中,用氯喹或其类似物或盐治疗与施用本公开的化合物之间的时间段为至少30分钟、至少1小时、至少2小时、至少3小时、至少4小时、至少6小时、至少8小时、至少10小时、至少12小时、至少14小时、至少16小时、至少20小时或至少24小时。
[0057]
在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐之前约1天至约365天内,或在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐之前约1天至约14天、约1天至约21天、约1天至约30天、约1天至约45天、约10天至约45天、约14天至约45天、约21天至约45天、约28天至约45天、约30天至约45天、10天至约60天、约14天至约60天、约21天至约60天、约28天至约60天、约30天至约60天、约40天至约60天、约10天至约90天、约14天至约90天、约21天至约90天、约28天至约90天、约30天至约90天、约40天至约90天、约10天至约365天、约14天至约365天、约21天至约365天、约28天至约365天、约30天至约365天、约60天至约365天内已被施用氯喹或其类似物或盐。在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐之前约30天至约60天内已被施用氯喹或其类似物或盐。在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐之前约21天至约45天内已被施用氯喹或其类似物或盐。
[0058]
在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的30分钟、1小时、2小时、3小时、4小时、5小时、6小时、8小时、10小时、12小时、16小时或20小时内尚未被施用氯喹或其类似物或盐。在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天内尚未被施用氯喹或其类似物或盐。
[0059]
在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的1天内尚未被施用氯喹或其类似物或盐。在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的2天内尚未被施用氯喹或其类似物或盐。在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的5天内尚未被施用氯喹或其类似物或盐。在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的7天内尚未被施用氯喹或其类似
物或盐。在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的10天内尚未被施用氯喹或其类似物或盐。在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的90天内尚未被施用氯喹或其类似物或盐。在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的365天内尚未被施用氯喹或其类似物或盐。
[0060]
在一些实施方案中,该方法还包括指示该人在病毒感染的治疗期间不服用氯喹或其类似物或盐。
[0061]
在一些实施方案中,该方法还包括指示该人在服用氯喹或其类似物或盐之后等待约1天至约365天,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐,或在服用氯喹或其类似物或盐之后等待约1天至约4天、约1天至约7天、约1天至约10天、约1天至约14天、约10天至约45天、约14天至约45天、约21天至约45天、约28天至约45天、约30天至约45天、10天至约60天、约14天至约60天、约21天至约60天、约28天至约60天、约30天至约60天、约40天至约60天、约10天至约90天、约14天至约90天、约21天至约90天、约28天至约90天、约30天至约90天、约40天至约90天、约10天至约365天、约14天至约365天、约21天至约365天、约28天至约365天、约30天至约365天、或约60天至约365天,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐。
[0062]
在一些实施方案中,该方法还包括指示该人在服用氯喹或其类似物或盐之后等待,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,该方法还包括指示该人在服用氯喹或其类似物或盐之后等待至少1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐。
[0063]
在一些实施方案中,该方法还包括指示该人在服用氯喹或其类似物或盐之后等待约30分钟至约一天,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐。例如等待至少30分钟、至少1小时、至少2小时、至少3小时、至少4小时、至少6小时、至少8小时、至少10小时、至少12小时、至少14小时、至少16小时、至少20小时或至少24小时,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐。
[0064]
在一些实施方案中,该方法还包括指示该人在服用氯喹或其类似物或盐之后等待,然后施用式ia的化合物或其药学上可接受的盐。在一些实施方案中,该方法还包括指示该人在服用氯喹或其类似物或盐之后等待至少1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天,然后施用式ia的化合物或其药学上可接受的盐。
[0065]
在一些实施方案中,该方法还包括指示该人在服用氯喹或其类似物或盐之后等待约30分钟至约一天,然后施用式ia的化合物或其药学上可接受的盐。例如等待至少30分钟、至少1小时、至少2小时、至少3小时、至少4小时、至少6小时、至少8小时、至少10小时、至少12小时、至少14小时、至少16小时、至少20小时或至少24小时,然后施用式ia的化合物或其药学上可接受的盐。
[0066]
在一些实施方案中,在病毒感染的治疗期间不向该人施用氯喹或其类似物或盐。在一些实施方案中,该方法还包括指示该人在病毒感染的治疗期间不施用氯喹或其类似物
或盐。
[0067]
在一些实施方案中,该方法包括向该人施用治疗有效量的式i、式ia或式ib的化合物或其药学上可接受的盐,条件是在治疗开始之前尚未向该人施用氯喹或其类似物或盐,由此治疗病毒感染。在一些实施方案中,该人在开始治疗前至少1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天尚未被施用氯喹或其类似物或盐。在一些实施方案中,该人在开始治疗之前至少1天尚未被施用氯喹或其类似物或盐。在一些实施方案中,该人在开始治疗之前至少10天尚未被施用氯喹或其类似物或盐。在一些实施方案中,该人在治疗开始之前至少30分钟、至少1小时、至少2小时、至少3小时、至少4小时、至少6小时、至少8小时、至少10小时、至少12小时、至少14小时、至少16小时、至少20小时或至少24小时尚未被施用氯喹或其类似物或盐。
[0068]
可使用各种技术来确定有需要的人先前是否已服用氯喹或其类似物或盐。非限制性技术包括自我报告、采访人、审查人的医疗记录或测量人的血浆或血液中氯喹或其代谢物、类似物或盐的水平。
[0069]
还可在施用本公开的化合物(诸如式i、式ia或式ib的化合物或其药学上可接受的盐)之前,评价需要治疗病毒感染的人的氯喹或其类似物或盐的血浆或血液浓度。在一些实施方案中,需要治疗病毒感染的人具有在施用本公开的化合物之前测量的血浆或血液浓度。
[0070]
人血浆或血液中氯喹或其类似物或盐的浓度可通过本领域已知的任何方法测量。参见例如walker,o.等人,british journal clinical pharmacology(1983年),第16卷,第701-705页;kaewkhao,k.等人,bioanalysis(2019年),第11卷第5期,第333-347页;durcan,l.等人,journal of rheumatology(2015年),第42卷第11期,第2092-2097页;munster,t.等人,arthritis rheumatology(2002年),第46卷第6期,第1460-1469页。
[0071]
在一些实施方案中,在向该人施用第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐时该人具有约0.1ng/ml至约5000ng/ml,或在向该人施用第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐时该人具有约0.1ng/ml至约4000ng/ml、约0.1ng/ml至约3000ng/ml、约0.1ng/ml至约2000ng/ml、约0.1ng/ml至约1000ng/ml、约0.1ng/ml至约500ng/ml、约0.1ng/ml至约400ng/ml、约0.1ng/ml至约300ng/ml、约0.1ng/ml至约200ng/ml、约0.1ng/ml至约100ng/ml、约0.1ng/ml至约80ng/ml、约0.1ng/ml至约60ng/ml、约0.1ng/ml至约50ng/ml、约0.1ng/ml至约40ng/ml、约0.1ng/ml至约30ng/ml、约0.1ng/ml至约20ng/ml、或约0.1ng/ml至约10ng/ml、约5ng/ml至约4000ng/ml、约5ng/ml至约3000ng/ml、约5ng/ml至约2000ng/ml、约5ng/ml至约1000ng/ml、约5ng/ml至约500ng/ml、约5ng/ml至约400ng/ml、约5ng/ml至约300ng/ml、约5ng/ml至约200ng/ml、约5ng/ml至约100ng/ml、约5ng/ml至约80ng/ml、约5ng/ml至约60ng/ml、约5ng/ml至约50ng/ml、约5ng/ml至约40ng/ml、约5ng/ml至约30ng/ml、约5ng/ml至约20ng/ml、或约5ng/ml至约10ng/ml的氯喹或其类似物或盐的血浆或血液浓度。在一些实施方案中,在向该人施用第一剂量的本公开的化合物时该人具有约0.1ng/ml至约50ng/ml的氯喹或其类似物或盐的血浆或血液浓度。
[0072]
在一些实施方案中,在向该人施用第一剂量的式i、式ia或式ib的化合物或其药学
基)甲氧基)(苯氧基)磷酰基)-l-丙氨酸2-乙基丁酯。式i的化合物或其药学上可接受的盐具有以下结构:
[0083][0084]
式ia的化合物描述于wo2016/069826中。式ia的化合物的iupac名称是(s)-2-乙基丁基2-(((s)-(((2r,3s,4r,5r)-5-(4-吡啶并[2,1-f][1,2,4]三嗪-7-基)-5-氰基-3,4-二羟基四氢呋喃-2-基)甲氧基)(苯氧基)磷酰基)氨基)丙酸酯,并且cas登记号是1809249-37-3。式ia的化合物也称为瑞德西韦和gs-5734。式ia的化合物或其药学上可接受的盐具有以下结构:
[0085][0086]
式ib的化合物描述于wo2016/069826中。式ib的化合物的iupac名称是(s)-2-乙基丁基2-(((r)-(((2r,3s,4r,5r)-5-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-基)-5-氰基-3,4-二羟基四氢呋喃-2-基)甲氧基)(苯氧基)磷酰基)氨基)丙酸酯。式ib的化合物或其药学上可接受的盐具有以下结构:
[0087][0088]
在一些实施方案中,向有需要的人施用式i、式ia或式ib的化合物或其药学上可接受的盐产生式ii的化合物或其药学上可接受的盐:
[0089][0090]
式i、式ia或式ib的化合物可以任何合适的形式使用。例如,式i、式ia或式ib的化合物可以是无定形的或结晶的。在一些实施方案中,式i、式ia或式ib的化合物是无定形的。在一些实施方案中,式i、式ia或式ib的化合物是结晶的。
[0091]
可用于本公开的方法和组合物中的式ia的化合物的结晶形式描述于美国专利申请公开2018/0346504中。例如,式ia的化合物可以是结晶形式i、形式ii、形式iii或形式iv,如美国专利申请公开20180346504中所述,或它们的组合。在一些实施方案中,式ia的化合物是结晶的。
[0092]
式i、式ia和式ib的化合物或其药学上可接受的盐可与一种或多种药学上可接受的赋形剂组合。在一些实施方案中,药学上可接受的赋形剂包括含水溶媒。在一些实施方案中,本文提供的药物组合物包含式i的化合物或其药学上可接受的盐和含水溶媒。在一些实施方案中,本文提供的药物组合物包含式ia的化合物或其药学上可接受的盐和含水溶媒。在一些实施方案中,本文提供的药物组合物包含式ib的化合物或其药学上可接受的盐和含水溶媒。含水溶媒包含水和选自共溶剂、表面活性剂、悬浮剂、张力剂、缓冲剂、环糊精和抗微生物剂或防腐剂的任选的一种或多种组分。示例性制剂可见于美国专利申请公开2019/0083525。
[0093]
在一些实施方案中,治疗有需要的人中的病毒感染的方法包括向该人施用式i的化合物或其药学上可接受的盐:
[0094][0095]
在一些实施方案中,该方法包括施用式i的化合物。
[0096]
在一些实施方案中,治疗有需要的人中的病毒感染的方法包括向该人施用式ia的化合物或其药学上可接受的盐:
[0097][0098]
在一些实施方案中,该方法包括施用式ia的化合物。
[0099]
在一些实施方案中,治疗有需要的人中的病毒感染的方法包括向该人施用式ib的化合物或其药学上可接受的盐:
[0100][0101]
在一些实施方案中,该方法包括施用式ib的化合物。
[0102]
本公开的化合物可通过适于待治疗的病症的任何途径施用。合适的途径包括口服、直肠、鼻腔(包括吸入)、肺、局部(包括颊和舌下)、阴道和肠胃外(包括皮下、肌内、静脉内、真皮内、鞘内和硬膜外)、植入等。应当理解,优选的途径可例如随人的病症而改变。
[0103]
在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐通过吸入或静脉内施用。在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐静脉内施用。在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐通过吸入施用。
[0104]
在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐每天一次或每天两次施用。在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐每天施用一次。
[0105]
在一些实施方案中,人的体重为至少40kg,并且式i、式ia或式ib的化合物或其药学上可接受的盐在第1天以150mg-250mg的第一剂量施用,并且在随后的4天中的每一天以50mg-150mg的第二剂量施用。在一些实施方案中,施用50mg-150mg的第二剂量持续另外1至5天。在一些实施方案中,人的体重为至少40kg,并且式i、式ia或式ib的化合物或其药学上可接受的盐在第1天以150mg-250mg的第一剂量施用,并且在随后的4、5、6、7、8或9天中的每一天以50mg-150mg的第二剂量施用。在一些实施方案中,人的体重为至少40kg,并且式i、式ia或式ib的化合物或其药学上可接受的盐在第1天以150mg-250mg的第一剂量施用,并且在随后的9天中的每一天以mg50-150mg的第二剂量施用。在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐每天施用一次。在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐在约30分钟至约120分钟内施用。
[0106]
在一些实施方案中,人的体重为至少40kg,并且式i、式ia或式ib的化合物或其药
学上可接受的盐在第1天以200mg的第一剂量静脉内施用,并且在随后的4天中的每一天以100mg的第二剂量静脉内施用。在一些实施方案中,施用100mg的第二剂量持续另外1至5天。在一些实施方案中,人的体重为至少40kg,并且式i、式ia或式ib的化合物或其药学上可接受的盐在第1天以200mg的第一剂量静脉内施用,并且在随后的4、5、6、7、8或9天中的每一天以100mg的第二剂量静脉内施用。在一些实施方案中,人的体重为至少40kg,并且式i、式ia或式ib的化合物或其药学上可接受的盐在第1天以200mg的第一剂量静脉内施用,并且在随后的9天中的每一天以100mg的第二剂量静脉内施用。在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐每天静脉内施用一次。在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐在约30分钟至约120分钟内静脉内施用。
[0107]
在一些实施方案中,人的体重为至少40kg,并且式ia的化合物或其药学上可接受的盐在第1天以150mg-250mg的第一剂量施用,并且在随后的4天中的每一天以50mg-150mg的第二剂量施用。在一些实施方案中,施用50mg-150mg的第二剂量持续另外1至5天。在一些实施方案中,人的体重为至少40kg,并且式ia的化合物或其药学上可接受的盐在第1天以150mg-250mg的第一剂量施用,并且在随后的4、5、6、7、8或9天中的每一天以50mg-150mg的第二剂量施用。在一些实施方案中,人的体重为至少40kg,并且式ia的化合物或其药学上可接受的盐在第1天以150mg-250mg的第一剂量施用,并且在随后的9天中的每一天以mg50-150mg的第二剂量施用。在一些实施方案中,式ia的化合物或其药学上可接受的盐每天施用一次。在一些实施方案中,式ia的化合物或其药学上可接受的盐在约30分钟至约120分钟内施用。
[0108]
在一些实施方案中,人的体重为至少40kg,并且式ia的化合物或其药学上可接受的盐在第1天以200mg的第一剂量静脉内施用,并且在随后的4天中的每一天以100mg的第二剂量静脉内施用。在一些实施方案中,施用100mg的第二剂量持续另外1至5天。在一些实施方案中,人的体重为至少40kg,并且式ia的化合物或其药学上可接受的盐在第1天以200mg的第一剂量静脉内施用,并且在随后的4、5、6、7、8或9天中的每一天以100mg的第二剂量静脉内施用。在一些实施方案中,人的体重为至少40kg,并且式ia的化合物或其药学上可接受的盐在第1天以200mg的第一剂量静脉内施用,并且在随后的9天中的每一天以100mg的第二剂量静脉内施用。在一些实施方案中,式ia的化合物或其药学上可接受的盐每天静脉内施用一次。在一些实施方案中,式ia的化合物或其药学上可接受的盐在约30分钟至约120分钟内静脉内施用。
[0109]
在一些实施方案中,人的体重为3.5kg至小于40kg,并且式i、式ia或式ib的化合物或其药学上可接受的盐在第1天以2.5mg/kg-10mg/kg的第一剂量施用,并且在随后的4天中的每一天以1mg/kg-5mg/kg的第二剂量施用。在一些实施方案中,施用1mg/kg-5mg/kg的第二剂量持续另外1至5天。在一些实施方案中,人的体重为3.5kg至小于40kg,并且式i、式ia或式ib的化合物或其药学上可接受的盐在第1天以2.5mg/kg-10mg/kg的第一剂量施用,并且在随后的4、5、6、7、8或9天中的每一天以1-5mg/kg的第二剂量施用。在一些实施方案中,人的体重为3.5kg至小于40kg,并且式i、式ia或式ib的化合物或其药学上可接受的盐在第1天以2.5-10mg/kg的第一剂量施用,并且在随后的9天中的每一天以1-5mg/kg的第二剂量施用。在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐每天施用一次。在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐在约30分钟至约120分
钟内施用。
[0110]
在一些实施方案中,人的体重为3.5kg至小于40kg,并且式i、式ia或式ib的化合物或其药学上可接受的盐在第1天以5mg/kg的第一剂量静脉内施用,并且在随后的4天中的每一天以2.5mg/kg的第二剂量静脉内施用。在一些实施方案中,施用2.5mg/kg的第二剂量持续另外1至5天。在一些实施方案中,人的体重为3.5kg至小于40kg,并且式i、式ia或式ib的化合物或其药学上可接受的盐在第1天以5mg/kg的第一剂量静脉内施用,并且在随后的4、5、6、7、8或9天中的每一天以2.5mg/kg的第二剂量静脉内施用。在一些实施方案中,人的体重为3.5kg至小于40kg,并且式i、式ia或式ib的化合物或其药学上可接受的盐在第1天以5mg/kg的第一剂量静脉内施用,并且在随后的9天中的每一天以2.5mg/kg的第二剂量静脉内施用。在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐每天静脉内施用一次。在一些实施方案中,式i、式ia或式ib的化合物或其药学上可接受的盐在约30分钟至约120分钟内静脉内施用。
[0111]
在一些实施方案中,人的体重为3.5kg至小于40kg,并且式ia的化合物或其药学上可接受的盐在第1天以2.5mg/kg-10mg/kg的第一剂量施用,并且在随后的4天中的每一天以1mg/kg-5mg/kg的第二剂量施用。在一些实施方案中,施用1mg/kg-5mg/kg的第二剂量持续另外1至5天。在一些实施方案中,人的体重为3.5kg至小于40kg,并且式ia的化合物或其药学上可接受的盐在第1天以2.5mg/kg-10mg/kg的第一剂量施用,并且在随后的4、5、6、7、8或9天中的每一天以1mg/kg-5mg/kg的第二剂量施用。在一些实施方案中,人的体重为3.5kg至小于40kg,并且式ia的化合物或其药学上可接受的盐在第1天以2.5mg/kg-10mg/kg的第一剂量施用,并且在随后的9天中的每一天以1mg/kg-5mg/kg的第二剂量施用。在一些实施方案中,式ia的化合物或其药学上可接受的盐每天施用一次。在一些实施方案中,式ia的化合物或其药学上可接受的盐在约30分钟至约120分钟内施用。
[0112]
在一些实施方案中,人的体重为3.5kg至小于40kg,并且式ia的化合物或其药学上可接受的盐在第1天以5mg/kg的第一剂量静脉内施用,并且在随后的4天中的每一天以2.5mg/kg的第二剂量静脉内施用。在一些实施方案中,施用2.5mg/kg的第二剂量持续另外1至5天。在一些实施方案中,人的体重为3.5kg至小于40kg,并且式ia的化合物或其药学上可接受的盐在第1天以5mg/kg的第一剂量静脉内施用,并且在随后的4、5、6、7、8或9天中的每一天以2.5mg/kg的第二剂量静脉内施用。在一些实施方案中,人的体重为3.5kg至小于40kg,并且式ia的化合物或其药学上可接受的盐在第1天以5mg/kg的第一剂量静脉内施用,并且在随后的9天中的每一天以2.5mg/kg的第二剂量静脉内施用。在一些实施方案中,式ia的化合物或其药学上可接受的盐每天静脉内施用一次。在一些实施方案中,式ia的化合物或其药学上可接受的盐在约30分钟至约120分钟内静脉内施用。
[0113]
c.病毒感染
[0114]
可通过本公开的方法治疗任何合适的病毒感染。在一些实施方案中,病毒感染由选自由以下项组成的组的病毒引起:沙粒病毒科、冠状病毒科、丝状病毒科、黄病毒科、肺病毒科和副黏液病毒科。
[0115]
在一些实施方案中,病毒感染由沙粒病毒科病毒引起。在一些实施方案中,治疗沙粒病毒科病毒感染的方法包括施用本公开的化合物,诸如式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,该方法包括通过施用本文提供的本公开的化合物来
治疗选自由以下项组成的组的沙粒病毒科病毒感染:奥尔帕瓦约病毒(allpahuayo virus;allv)、阿马帕里病毒(amapari virus;amav)、熊峡谷病毒(bear canyon virus;bcnv)、卡塔琳娜病毒(catarina virus)、查帕雷病毒(chapare virus)、库皮科斯病毒(cupixi virus;cpxv)、丹德农病毒(dandenong virus)、弗莱克索病毒(flexal virus;flev)、瓜纳里托病毒(guanarito virus;gtov)、伊皮病毒(ippy virus;ippyv)、胡宁病毒(junv)、库多科病毒(kodoko virus)、拉沙病毒(lassa virus;lasv)、拉丁美洲砂粒样病毒(latino virus;latv)、淋巴细胞性脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus;lcmv)、卢约病毒(lujo virus)、马丘波病毒(machupo virus;macv)、莫巴拉病毒(mobala virus;mobv)、莫罗戈罗病毒(morogoro virus)、莫佩亚病毒(mopeia virus;mopv)、奥利华斯病毒(oliveros virus;olvv)、巴拉那病毒(parana virus;parv)、皮钦德病毒(pichinde virus;picv)、平哈尔病毒(pinhal virus)、皮雷特尔病毒(pirital virus;pirv)、萨比亚病毒(sabia virus;sabv)、斯金纳坦克病毒(skinner tank virus)、塔卡里伯病毒(tacaribe virus;tcrv)、塔米阿米病毒(tamiami virus;tamv)和怀特沃特阿罗约病毒(whitewater arroyo virus;wwav)。在一些实施方案中,沙粒病毒科病毒是拉沙病毒或胡宁病毒。在一些实施方案中,该方法包括通过施用本文提供的本公开的化合物来治疗拉沙病毒感染。在一些实施方案中,该方法包括通过施用本文提供的本公开的化合物来治疗胡宁病毒感染。
[0116]
在一些实施方案中,病毒感染由冠状病毒科病毒引起。在一些实施方案中,治疗冠状病毒科病毒感染的方法包括施用本公开的化合物,诸如式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,冠状病毒科病毒感染选自由以下项组成的组:严重急性呼吸道综合征(sars)感染、sars-cov-2(也称为2019-ncov和covid-19)感染、中东呼吸道综合征(mers)感染、其他人冠状病毒(229e、nl63、0c43、hku1或ww1)感染、或人畜共患冠状病毒(pedv或hku cov分离株,诸如hku3、hku5或hku9)感染。在一些实施方案中,冠状病毒科病毒是sars、sars-cov-2或mers。在一些实施方案中,冠状病毒科病毒是sars。在一些实施方案中,冠状病毒科病毒是sars-cov-2。在一些实施方案中,冠状病毒科病毒是mers。在一些实施方案中,病毒感染由与选自sars-cov聚合酶、sars-cov-2聚合酶和mers聚合酶的病毒聚合酶具有至少70%序列同源性的病毒引起。在一些实施方案中,病毒感染由与选自sars-cov聚合酶、sars-cov-2聚合酶和mers聚合酶的病毒聚合酶具有至少80%序列同源性的病毒引起。在一些实施方案中,病毒感染由与选自sars-cov聚合酶、sars-cov-2聚合酶和mers聚合酶的病毒聚合酶具有至少90%序列同源性的病毒引起。在一些实施方案中,病毒感染由与选自sars-cov聚合酶、sars-cov-2聚合酶和mers聚合酶的病毒聚合酶具有至少95%序列同源性的病毒引起。在一些实施方案中,病毒感染由与选自sars-cov聚合酶、sars-cov-2聚合酶和mers聚合酶的病毒聚合酶具有至少97%序列同源性的病毒引起。在一些实施方案中,病毒感染由与选自sars-cov聚合酶、sars-cov-2聚合酶和mers聚合酶的病毒聚合酶具有至少99%序列同源性的病毒引起。
[0117]
在一些实施方案中,病毒感染由丝状病毒科病毒引起。在一些实施方案中,治疗丝状病毒科病毒感染的方法包括施用本公开的化合物,诸如式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,丝状病毒科病毒是埃博拉病毒或马尔堡病毒。在一些实施方案中,丝状病毒科病毒是埃博拉病毒。在一些实施方案中,埃博拉病毒选自由以下项
组成的组:扎伊尔(zaire)(即埃博拉病毒,ebov)、苏丹(sudan)、塔伊森林(tai forest)、本迪布焦(bundibugyo)和雷斯顿(reston)。在一些实施方案中,丝状病毒科病毒是马尔堡病毒。
[0118]
在一些实施方案中,病毒感染由黄病毒科病毒引起。在一些实施方案中,治疗黄病毒科病毒感染的方法包括施用本公开的化合物,诸如式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,黄病毒科病毒选自由以下项组成的组:登革热、黄热病、西尼罗和寨卡。在一些实施方案中,治疗登革热病毒感染的方法包括施用本文提供的本公开的化合物。在一些实施方案中,黄病毒科病毒是黄热病病毒。在一些实施方案中,治疗黄热病病毒感染的方法包括施用本文提供的本公开的化合物。在一些实施方案中,治疗西尼罗病毒感染的方法包括施用本文提供的本公开的化合物。在一些实施方案中,治疗寨卡病毒感染的方法包括施用本文提供的本公开的化合物。在一些实施方案中,治疗丙型肝炎病毒感染的方法包括施用本文提供的本公开的化合物。
[0119]
在一些实施方案中,病毒感染由肺病毒科病毒引起。在一些实施方案中,治疗肺病毒科病毒感染的方法包括施用本公开的化合物,诸如式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,肺病毒科病毒是呼吸道合胞病毒或人偏肺病毒。在一些实施方案中,肺病毒科病毒是呼吸道合胞病毒。在一些实施方案中,肺病毒科病毒是人偏肺病毒。
[0120]
在一些实施方案中,病毒感染由副黏液病毒科病毒引起。在一些实施方案中,治疗副黏液病毒科病毒感染的方法包括施用本公开的化合物,诸如式i、式ia或式ib的化合物或其药学上可接受的盐。副黏病毒科病毒包括但不限于尼帕病毒、亨德拉病毒、麻疹、腮腺炎和副流感病毒。在一些实施方案中,副黏液病毒科病毒是尼帕病毒或副流感病毒。在一些实施方案中,副黏液病毒科病毒是尼帕病毒。在一些实施方案中,副黏液病毒科病毒是副流感病毒。
[0121]
在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其在治疗沙粒病毒科病毒感染的方法中使用。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其通过施用本文提供的本公开的化合物在治疗选自以下的组的沙粒病毒科病毒感染的方法中使用:奥尔帕瓦约病毒(allv)、阿马帕里病毒(amav)、熊峡谷病毒(bcnv)、卡塔琳娜病毒、查帕雷病毒、库皮科斯病毒(cpxv)、丹德农病毒、弗莱克索病毒(flev)、瓜纳里托病毒(gtov)、伊皮病毒(ippyv)、胡宁病毒(junv)、库多科病毒、拉沙病毒(lasv)、拉丁美洲砂粒样病毒(latv)、淋巴细胞性脉络丛脑膜炎病毒(lcmv)、卢约病毒、马丘波病毒(macv)、莫巴拉病毒(mobv)、莫罗戈罗病毒、莫佩亚病毒(mopv)、奥利华斯病毒(olvv)、巴拉那病毒(parv)、皮钦德病毒(picv)、平哈尔病毒、皮雷特尔病毒(pirv)、萨比亚病毒(sabv)、斯金纳坦克病毒、塔卡里伯病毒(tcrv)、塔米阿米病毒(tamv)和怀特沃特阿罗约病毒(wwav)。在一些实施方案中,沙粒病毒科病毒是拉沙病毒或胡宁病毒。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其在治疗拉沙病毒感染的方法中使用。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其在治疗胡宁病毒感染的方法中使用。
[0122]
在一些实施方案中,本公开提供了本文提供的本公开的化合物,其在治疗冠状病毒科病毒感染的方法中使用。在一些实施方案中,冠状病毒科病毒感染选自由以下项组成
的组:严重急性呼吸道综合征(sars)感染、sars-cov-2(也称为2019-ncov和covid-19)感染、中东呼吸道综合征(mers)感染、其他人冠状病毒(229e、nl63、0c43、hku1或ww1)感染、或人畜共患冠状病毒(pedv或hku cov分离株,诸如hku3、hku5或hku9)感染。在一些实施方案中,冠状病毒科病毒是sars、sars-cov-2或mers。在一些实施方案中,冠状病毒科病毒是sars。在一些实施方案中,本公开提供了本文提供的本公开的化合物,其在治疗严重急性呼吸道综合征(sars)感染的方法中使用。在一些实施方案中,冠状病毒科病毒是sars-cov-2。在一些实施方案中,本公开提供了本文提供的本公开的化合物,其在治疗sars-ncov-2感染的方法中使用。在一些实施方案中,冠状病毒科病毒是mers。在一些实施方案中,本公开提供了本文提供的本公开的化合物,其在治疗中东呼吸道综合征(mers)感染的方法中使用。
[0123]
在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其在治疗丝状病毒科病毒感染的方法中使用。在一些实施方案中,丝状病毒科病毒是埃博拉病毒或马尔堡病毒。在一些实施方案中,丝状病毒科病毒是埃博拉病毒。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其在治疗埃博拉病毒感染的方法中使用。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其在治疗选自由以下项组成的组的埃博拉病毒感染的方法中使用:扎伊尔(即埃博拉病毒,ebov)、苏丹、塔伊森林、本迪布焦和雷斯顿。在一些实施方案中,丝状病毒科病毒是马尔堡病毒。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其在治疗马尔堡病毒感染的方法中使用。
[0124]
在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其在治疗黄病毒科病毒感染的方法中使用。在一些实施方案中,黄病毒科病毒选自由以下项组成的组:登革热、黄热病、西尼罗和寨卡。在一些实施方案中,黄病毒科病毒是登革热病毒。在一些实施方案中,黄病毒科病毒是黄热病病毒。在一些实施方案中,黄病毒科病毒是西尼罗病毒。在一些实施方案中,黄病毒科病毒是寨卡病毒。在一些实施方案中,黄病毒科病毒是丙型肝炎病毒。
[0125]
在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其在治疗肺病毒科病毒感染的方法中使用。在一些实施方案中,肺病毒科病毒是呼吸道合胞病毒或人偏肺病毒。在一些实施方案中,肺病毒科病毒是呼吸道合胞病毒。在一些实施方案中,肺病毒科病毒是人偏肺病毒。
[0126]
在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其在治疗副黏液病毒科病毒感染的方法中使用。副黏病毒科病毒包括但不限于尼帕病毒、亨德拉病毒、麻疹、腮腺炎和副流感病毒。在一些实施方案中,副黏液病毒科病毒是尼帕病毒或副流感病毒。在一些实施方案中,副黏液病毒科病毒是尼帕病毒。在一些实施方案中,副黏液病毒科病毒是副流感病毒。
[0127]
在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗沙粒病毒科病毒感染的药物中的用途。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗选自以下的组的沙粒病毒科病毒感染的药物中的用途:奥尔帕瓦约病毒(allv)、阿马帕里病毒(amav)、熊峡谷病毒(bcnv)、卡塔琳娜病毒、查帕雷病毒、库皮科斯病毒(cpxv)、丹德农病毒、弗莱克索病毒(flev)、瓜纳里托病毒(gtov)、伊皮病毒(ippyv)、胡宁病毒(junv)、库多科病毒、拉沙病
毒(lasv)、拉丁美洲砂粒样病毒(latv)、淋巴细胞性脉络丛脑膜炎病毒(lcmv)、卢约病毒、马丘波病毒(macv)、莫巴拉病毒(mobv)、莫罗戈罗病毒、莫佩亚病毒(mopv)、奥利华斯病毒(olvv)、巴拉那病毒(parv)、皮钦德病毒(picv)、平哈尔病毒、皮雷特尔病毒(pirv)、萨比亚病毒(sabv)、斯金纳坦克病毒、塔卡里伯病毒(tcrv)、塔米阿米病毒(tamv)和怀特沃特阿罗约病毒(wwav)。在一些实施方案中,沙粒病毒科病毒是拉沙病毒或胡宁病毒。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗拉沙病毒感染的药物中的用途。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗胡宁病毒感染的药物中的用途。
[0128]
在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗冠状病毒科病毒感染的药物中的用途。在一些实施方案中,冠状病毒科病毒感染选自由以下项组成的组:严重急性呼吸道综合征(sars)感染、sars-cov-2(也称为2019-ncov和covid-19)感染、中东呼吸道综合征(mers)感染、其他人冠状病毒(229e、nl63、0c43、hku1或ww1)感染、或人畜共患冠状病毒(pedv或hku cov分离株,诸如hku3、hku5或hku9)感染。在一些实施方案中,冠状病毒科病毒是sars、sars-cov-2或mers。在一些实施方案中,冠状病毒科病毒是sars。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗sars感染的药物中的用途。在一些实施方案中,冠状病毒科病毒是sars-cov-2。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗sars-ncov-2感染的药物中的用途。在一些实施方案中,冠状病毒科病毒是mers。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗mers感染的药物中的用途。
[0129]
在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗丝状病毒科病毒感染的药物中的用途。在一些实施方案中,丝状病毒科病毒是埃博拉病毒或马尔堡病毒。在一些实施方案中,丝状病毒科病毒是埃博拉病毒。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗埃博拉病毒感染的药物中的用途。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗选自由以下项组成的组的埃博拉病毒感染的药物中的用途:扎伊尔(即埃博拉病毒,ebov)、苏丹、塔伊森林、本迪布焦和雷斯顿。在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗马尔堡病毒感染的药物中的用途。
[0130]
在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐在制造用于治疗黄病毒科病毒感染的药物中的用途。在一些实施方案中,黄病毒科病毒选自由以下项组成的组:登革热、黄热病、西尼罗和寨卡。在一些实施方案中,黄病毒科病毒是登革热病毒。在一些实施方案中,黄病毒科病毒是黄热病病毒。在一些实施方案中,黄病毒科病毒是西尼罗病毒。在一些实施方案中,黄病毒科病毒是寨卡病毒。在一些实施方案中,黄病毒科病毒是丙型肝炎病毒。
[0131]
在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其用于制造用于治疗肺病毒科病毒感染的药物。在一些实施方案中,肺病毒科病毒是呼吸道合胞病毒或人偏肺病毒。在一些实施方案中,肺病毒科病毒是呼吸道合胞病毒。在一些实施方案中,肺病毒科病毒是人偏肺病毒。
[0132]
在一些实施方案中,本公开提供了本文提供的本公开的化合物或其药学上可接受的盐,其用于制造用于治疗副黏液病毒科病毒感染的药物。副黏病毒科病毒包括但不限于尼帕病毒、亨德拉病毒、麻疹、腮腺炎和副流感病毒。在一些实施方案中,副黏液病毒科病毒是尼帕病毒或副流感病毒。在一些实施方案中,副黏液病毒科病毒是尼帕病毒。在一些实施方案中,副黏液病毒科病毒是副流感病毒。
[0133]
d.附加用途
[0134]
在一些实施方案中,本公开提供了一种优化有需要的人中的式ii的化合物或其药学上可接受的盐的血浆或血液浓度的方法:
[0135][0136]
该方法包括向该人施用抗病毒化合物,其中该人尚未被施用氯喹或其类似物或盐,该抗病毒化合物在向人施用后转化为式ii的化合物,并且该式ii的化合物的血浆或血液浓度在不存在氯喹或其类似物或盐的情况下被优化。在一些实施方案中,在向该人施用抗病毒化合物的1天内尚未向该人施用氯喹或其类似物或盐。在一些实施方案中,在向该人施用抗病毒化合物的10天内尚未向该人施用氯喹或其类似物或盐。
[0137]
在一些实施方案中,在向该人施用抗病毒化合物的30分钟、1小时、2小时、3小时、4小时、6小时、8小时、10小时、12小时、14小时、16小时、20小时或24小时内尚未向该人施用氯喹或其类似物或盐。在一些实施方案中,在向该人施用抗病毒化合物的1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天内尚未向该人施用氯喹或其类似物或盐。在一些实施方案中,在向该人施用第一剂量的抗病毒化合物时该人具有小于50ng/ml,诸如小于45ng/ml、40ng/ml、35ng/ml、30ng/ml、25ng/ml、20ng/ml、15ng/ml、10ng/ml或5ng/ml的氯喹或其类似物或盐的血浆或血液浓度。在一些实施方案中,在向该人施用第一剂量的抗病毒化合物时,该人具有小于50ng/ml的氯喹或其类似物或盐的血浆或血液浓度。
[0138]
在一些实施方案中,抗病毒化合物是式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,该人中的式ii的化合物的血浆或血液浓度高于用氯喹或其类似物或盐以及抗病毒化合物治疗的参考人中的式ii的化合物的第二浓度。在一些实施方案中,该人中的式ii的化合物的血浆或血液浓度是用氯喹或其类似物或盐以及抗病毒化合物治疗的参考人中的该化合物的第二浓度的约1.1倍至约10倍,诸如约1.2倍至约5倍、约1.3倍至约5倍、约1.2倍至约4倍、约1.3倍至约4倍、约1.2倍至约3倍、约1.3倍至约3倍、约1.2倍至约2倍或约1.3倍至约2倍。在一些实施方案中,该人中的式ii的化合物的血浆或血液浓度是用氯喹或其类似物或盐以及抗病毒化合物治疗的参考人中的该化合物的第二浓度的至少1.1倍,诸如至少1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.1倍、2.2倍、2.3倍、2.4倍、2.5倍、2.6倍、2.7倍、2.8倍、2.9倍、3倍、3.2倍、3.5倍、3.6倍、3.8倍、4倍、
4.2倍、4.4倍、4.6倍、4.8倍、5倍、6倍、7倍、8倍、9倍或10倍。
[0139]
在一些实施方案中,本公开提供了一种优化有需要的人中的式ii的化合物或其药学上可接受的盐的血浆或血液浓度的方法,该方法包括:(a)向该人施用式i、式ia或式ib的化合物或其药学上可接受的盐;(b)测量人中的式ii的化合物的血浆或血液浓度;以及(c)调节式i、式ia或式ib的化合物的任何剩余剂量,以优化该人中的式ii的化合物的血浆或血液浓度。在一些实施方案中,该方法包括向人施用日剂量。在一些实施方案中,该方法包括向人施用10个日剂量。
[0140]
在一些实施方案中,该人中的式ii的化合物的血浆或血液浓度是用氯喹或其类似物或盐以及式i、式ia或式ib的化合物或其药学上可接受的盐治疗的参考人中的该化合物的第二浓度的约1.1倍至约10倍,诸如约1.2倍至约5倍、约1.3倍至约5倍、约1.2倍至约4倍、约1.3倍至约4倍、约1.2倍至约3倍、约1.3倍至约3倍、约1.2倍至约2倍或约1.3倍至约2倍。在一些实施方案中,该人中的式ii的化合物的血浆或血液浓度是用氯喹或其类似物或盐以及式i、式ia或式ib的化合物或其药学上可接受的盐治疗的参考人中的该化合物的第二浓度的至少1.1倍,诸如至少1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.1倍、2.2倍、2.3倍、2.4倍、2.5倍、2.6倍、2.7倍、2.8倍、2.9倍、3倍、3.2倍、3.5倍、3.6倍、3.8倍、4倍、4.2倍、4.4倍、4.6倍、4.8倍、5倍、6倍、7倍、8倍、9倍或10倍。
[0141]
在一些实施方案中,本公开提供了一种确定用于治疗有需要的人中的病毒感染的式i、式ia或式ib的化合物或其药学上可接受的盐的递送剂量的方法,该方法包括:(a)提供初始剂量的式i、式ia或式ib的化合物或其药学上可接受的盐;(b)确定是否已向人施用氯喹或其类似物或盐;以及(c1)如果已向该人施用氯喹或其类似物或盐,则增加式i、式ia或式ib的化合物或其药学上可接受的盐的初始剂量以确定递送剂量,或者(c2)如果尚未向该人施用氯喹或其类似物或盐,则选择式i、式ia或式ib的化合物或其药学上可接受的盐的初始剂量作为递送剂量。
[0142]
在一些实施方案中,确定递送剂量的方法包括确定在治疗病毒感染之前的1天内是否已向人施用氯喹或其类似物。在一些实施方案中,该方法包括确定在治疗病毒感染之前的10天内是否已向人施用氯喹或其类似物。在一些实施方案中,确定是否已向人施用氯喹或其类似物包括自我报告、采访人、审查人的医疗记录、或测量人的血浆或血液中氯喹或其类似物或盐的水平。在一些实施方案中,在向该人施用抗病毒化合物的1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天内尚未向该人施用氯喹或其类似物或盐。
[0143]
在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的30分钟、1小时、2小时、3小时、4小时、5小时、6小时、8小时、10小时、12小时、16小时或20小时内尚未被施用氯喹或其类似物或盐。
[0144]
在一些实施方案中,当在治疗病毒感染之前已向人施用氯喹或其类似物或盐时,该方法包括将式i、式ia或式ib的化合物或其药学上可接受的盐的初始剂量增加约1.1倍至约10倍以确定递送剂量,或增加约1.2倍至约5倍、约1.3倍至约5倍、约1.2倍至约4倍、约1.3倍至约4倍、约1.2倍至约3倍、约1.3倍至约3倍、约1.2倍至约2倍、或约1.3倍至约2倍以确定递送剂量。在一些实施方案中,当在治疗病毒感染之前已向人施用氯喹或其类似物或盐时,
该方法包括将式i、式ia或式ib的化合物或其药学上可接受的盐的初始剂量增加至少1.1倍以确定递送剂量,或增加至少1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.1倍、2.2倍、2.3倍、2.4倍、2.5倍、2.6倍、2.7倍、2.8倍、2.9倍、3倍、3.2倍、3.5倍、3.6倍、3.8倍、4倍、4.2倍、4.4倍、4.6倍、4.8倍、5倍、6倍、7倍、8倍、9倍或10倍以确定递送剂量。在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的30分钟、1小时、2小时、3小时、4小时、5小时、6小时、8小时、10小时、12小时、16小时或20小时内尚未被施用氯喹或其类似物或盐。在一些实施方案中,在向该人施用抗病毒化合物的1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天内尚未向该人施用氯喹或其类似物或盐。
[0145]
在一些实施方案中,本公开提供了一种在有需要的人中形成式ii的化合物的方法,该方法包括向该人施用治疗有效量的式ia的化合物,并指示该人不服用氯喹或其类似物或盐,其中该式ia的化合物在不存在氯喹或其类似物或盐的情况下代谢为式ii的化合物。在一些实施方案中,该人在接受第一剂量的式ia的化合物或其药学上可接受的盐的30分钟、1小时、2小时、3小时、4小时、5小时、6小时、8小时、10小时、12小时、16小时或20小时内尚未被施用氯喹或其类似物或盐。在一些实施方案中,该人在施用式ia的化合物的1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天内尚未被施用氯喹或其类似物或盐。在一些实施方案中,在指示该人不服用氯喹或其类似物或盐之后,该人在施用式ia的化合物之前等待至少1天。
[0146]
在一些实施方案中,本公开提供了一种降低式ia的化合物或其药学上可接受的盐在患有病毒感染的人中功效减弱的风险的方法,该方法包括:(a)确定该人在施用式ia的化合物或其药学上可接受的盐之前是否已服用氯喹或其类似物或盐,(b)指示该人在用式ia的化合物或其药学上可接受的盐治疗的同时不服用氯喹或其类似物或盐,以及(c)向该人施用式ia的化合物或其药学上可接受的盐,由此降低式ia的化合物或其药学上可接受的盐的功效减弱的风险。在一些实施方案中,该人在接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐的30分钟、1小时、2小时、3小时、4小时、5小时、6小时、8小时、10小时、12小时、16小时或20小时内尚未被施用氯喹或其类似物或盐。在一些实施方案中,该人在施用式ia的化合物或其药学上可接受的盐的1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天内尚未被施用氯喹或其类似物或盐。在一些实施方案中,如果确定该人在施用式ia的化合物或其药学上可接受的盐之前已服用氯喹或其类似物或盐,则该人在施用式ia的化合物或其药学上可接受的盐之前等待至少1天。
[0147]
对于需要指示该人在用式ia的化合物或其药学上可接受的盐治疗的同时不服用氯喹或其类似物或盐的本公开的方法,在接受该指示之后和在接受式ia的化合物或其药学上可接受的盐之后向该人施用氯喹或其类似物或盐的情况下,可单独或组合地采取任何数量的动作。在一些实施方案中,该人停止服用氯喹或其类似物或盐。在一些实施方案中,该人在最后剂量的氯喹或其类似物或盐之后等待至少30分钟、1小时、2小时、3小时、4小时、5小时、6小时、8小时、10小时、12小时、16小时或20小时,然后接受第一剂量的式i、式ia或式
ib的化合物或其药学上可接受的盐。在一些实施方案中,该人在最后剂量的氯喹或其类似物或盐之后等待至少1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天,然后接受第一剂量的式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,在指示该人不服用氯喹或其类似物或盐之后,该人在施用式ia的化合物或其药学上可接受的盐之前等待至少1天。在一些实施方案中,与尚未施用氯喹或其类似物或盐的参考人相比,该人服用另外1个剂量、2个剂量、3个剂量、4个剂量、5个剂量、6个剂量、7个剂量、8个剂量、9个剂量或10个剂量的式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,与尚未施用氯喹或其类似物或盐的参考人相比,该人服用更高剂量的式i、式ia或式ib的化合物或其药学上可接受的盐,或与尚未施用氯喹或其类似物或盐的参考人相比,服用至少1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.1倍、2.2倍、2.3倍、2.4倍、2.5倍、2.6倍、2.7倍、2.8倍、2.9倍、3倍、3.2倍、3.5倍、3.6倍、3.8倍、4倍、4.2倍、4.4倍、4.6倍、4.8倍、5倍、6倍、7倍、8倍、9倍或10倍更高剂量的式i、式ia或式ib的化合物或其药学上可接受的盐。
[0148]
在一些实施方案中,本公开提供了一种预防患有病毒感染的人中的禁忌症的方法,该方法包括:(a)确定该人在施用式ia的化合物或其药学上可接受的盐之前是否已服用氯喹或其类似物或盐,(b)指示该人在用式ia的化合物或其药学上可接受的盐治疗的同时不服用氯喹或其类似物或盐,以及(c)向该人施用式ia的化合物或其药学上可接受的盐,由此预防该人中的禁忌症。在一些实施方案中,如果确定该人在施用式ia的化合物或其药学上可接受的盐之前已服用氯喹或其类似物或盐,则该人在施用式ia的化合物或其药学上可接受的盐之前等待至少1天。
[0149]
在一些实施方案中,预防该人中的禁忌症是与在施用式ia的化合物或其药学上可接受的盐之前已服用氯喹或其类似物或盐或尚未被指示不服用氯喹或其类似物或盐的第二人相比。在一些实施方案中,在施用式ia的化合物或其药学上可接受的盐之前已服用氯喹或其类似物或盐的第二人比在施用式ia的化合物或其药学上可接受的盐之后的人更可能具有禁忌症。在一些实施方案中,在施用式ia的化合物或其药学上可接受的盐之前尚未被指示不服用氯喹或其类似物或盐的第二人比在施用式ia的化合物或其药学上可接受的盐之后的人更可能具有禁忌症。在一些实施方案中,该第二人具有禁忌症的可能性是在施用式ia的化合物或其药学上可接受的盐之后的人的至少1.1倍,诸如1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.1倍、2.2倍、2.3倍、2.4倍、2.5倍、2.6倍、2.7倍、2.8倍、2.9倍、3倍、3.2倍、3.5倍、3.6倍、3.8倍、4倍、4.2倍、4.4倍、4.6倍、4.8倍、5倍、6倍、7倍、8倍、9倍、或10倍。
[0150]
在一些实施方案中,本公开提供了一种保持式ia的化合物或其药学上可接受的盐在患有病毒感染的人中的功效的方法,该方法包括:(a)确定该人在施用式ia的化合物或其药学上可接受的盐之前是否已服用氯喹或其类似物或盐,(b)指示该人在用式ia的化合物或其药学上可接受的盐治疗的同时不服用氯喹或其类似物或盐,以及(c)向该人施用式ia的化合物或其药学上可接受的盐,由此保持式ia的化合物或其药学上可接受的盐的功效。在一些实施方案中,保持功效包括与在施用式ia的化合物或其药学上可接受的盐之前未服用氯喹或其类似物或盐的第二人相比,在施用后在人中保持足够的式ii的化合物的血浆或
血液浓度。在一些实施方案中,施用后人中式ii的化合物的血浆或血液浓度是在施用式ia的化合物或其药学上可接受的盐之前未服用氯喹或其类似物或盐的第二人中式ii的化合物的第二血浆或血液浓度的约50%至约100%,或在施用式ia的化合物或其药学上可接受的盐之前未服用氯喹或其类似物或盐的第二人中式ii的化合物的第二血浆或血液浓度的约60%至约100%、约70%至约100%、约80%至约100%、或约90%至约100%。在一些实施方案中,如果确定该人在施用式ia的化合物或其药学上可接受的盐之前已服用氯喹或其类似物或盐,则该人在施用式ia的化合物或其药学上可接受的盐之前等待至少1天。
[0151]
在一些实施方案中,本公开提供了一种降低患有病毒感染的人中的式ii的化合物的血浆浓度减小的风险的方法,该方法包括:(a)确定该人在施用式ia的化合物或其药学上可接受的盐之前是否已服用氯喹或其类似物或盐,(b)指示该人在用式ia的化合物或其药学上可接受的盐治疗的同时不服用氯喹或其类似物或盐,以及(c)向该人施用式ia的化合物或其药学上可接受的盐,由此降低式ii的化合物的血浆浓度减小的风险。在一些实施方案中,如果确定该人在施用式ia的化合物或其药学上可接受的盐之前已服用氯喹或其类似物或盐,则该人在施用式ia的化合物或其药学上可接受的盐之前等待至少1天。
[0152]
在一些实施方案中,降低式ii的化合物的血浆浓度减小的风险包括与在施用式ia的化合物或其药学上可接受的盐之前未服用氯喹或其类似物或盐的第二人相比,在施用式ia的化合物或其药学上可接受的盐之后在人的血浆中保持足够浓度的式ii的化合物。在一些实施方案中,施用后人中式ii的化合物的血浆浓度是在施用式ia的化合物或其药学上可接受的盐之前未服用氯喹或其类似物或盐的第二人中式ii的化合物的第二浓度的约50%至约100%,或在施用式ia的化合物或其药学上可接受的盐之前未服用氯喹或其类似物或盐的第二人中式ii的化合物的第二浓度的约60%至约100%、约70%至约100%、约80%至约100%、或约90%至约100%。
[0153]
对于需要确定该人在施用式ia的化合物或其药学上可接受的盐之前是否已服用氯喹或其类似物或盐的本公开的方法,该确定可通过任何合适的手段进行。例如,非限制性技术包括自我报告、采访人、审查人的医疗记录、或测量人血浆或血液中氯喹或其类似物或盐的水平。在一些实施方案中,该确定包括测量人的血浆或血液中氯喹或其代谢物、类似物或盐的水平。
[0154]
iv.试剂盒
[0155]
在一些实施方案中,本公开提供了包含本文所公开的化合物或组合物的试剂盒的用途。在一些实施方案中,试剂盒还包括用于在本公开的方法中使用化合物或药物组合物的标签和/或说明。例如,在一些实施方案中,试剂盒包括指示人在病毒感染的治疗期间不服用氯喹或其类似物或盐。
[0156]
在一些实施方案中,试剂盒包括指示该人在服用氯喹或其类似物或盐之后等待至少30分钟、1小时、2小时、3小时、4小时、5小时、6小时、8小时、10小时、12小时、16小时或20小时,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,试剂盒包括指示该人在服用氯喹或其类似物或盐之后等待,诸如在服用氯喹或其类似物或盐之后等待至少1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,试剂盒包括指示该
人在服用氯喹或其类似物或盐之后等待至少1天,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,试剂盒包括指示该人在服用氯喹或其类似物或盐之后等待至少10天,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,试剂盒包括指示该人在服用氯喹或其类似物或盐之后等待至少14天,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐。在一些实施方案中,试剂盒包括指示该人在服用氯喹或其类似物或盐之后等待至少21天,然后施用式i、式ia或式ib的化合物或其药学上可接受的盐。
[0157]
在一些实施方案中,试剂盒包括指示该人在服用氯喹或其类似物或盐之后等待至少30分钟、1小时、2小时、3小时、4小时、5小时、6小时、8小时、10小时、12小时、16小时或20小时,然后施用式ia的化合物或其药学上可接受的盐。在一些实施方案中,试剂盒包括指示该人在服用氯喹或其类似物或盐之后等待,诸如在服用氯喹或其类似物或盐之后等待至少1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、21天、28天、30天、45天、60天、75天、90天、120天、150天、180天、210天、240天、270天、300天、330天或365天,然后施用式ia的化合物或其药学上可接受的盐。在一些实施方案中,试剂盒包括指示该人在服用氯喹或其类似物或盐之后等待至少10天,然后施用式ia的化合物或其药学上可接受的盐。在一些实施方案中,试剂盒包括指示该人在服用氯喹或其类似物或盐之后等待至少14天,然后施用式ia的化合物或其药学上可接受的盐。在一些实施方案中,试剂盒包括指示该人在服用氯喹或其类似物或盐之后等待至少21天,然后施用式ia的化合物或其药学上可接受的盐。
[0158]
在一些实施方案中,试剂盒还包括喷雾器。可使用任何合适的喷雾器。在一些实施方案中,喷雾器是玻璃喷雾器。在一些实施方案中,喷雾器是手持灯泡喷雾器。在一些实施方案中,喷雾器是喷射式喷雾器或振动网状喷雾器。在一些实施方案中,喷雾器是喷射式喷雾器(例如,vixone tm
、pariplus)。在一些示例中,喷雾器是振动网状喷雾器(例如rapid)。在一些实施方案中,喷雾器是超声喷雾器。在一些实施方案中,喷雾器是适应性气溶胶递送喷雾器。在一些实施方案中,喷雾器是定量剂量吸入器(例如,定量剂量液体吸入器)。
[0159]
v.实施例
[0160]
实施例1.氯喹对细胞中式ia的化合物的影响
[0161]
式ia的化合物针对呼吸道合胞病毒(rsv)的抗病毒效力在hep2细胞中以如下方式确定。将hep2细胞(3
×
103个/孔)悬浮于dmem培养基 glutamax(补充有10% fbs和1%青霉素/链霉素)中并接种在96孔板中。在37℃ 5% co2下孵育4小时后,使用hp d300e数字分配器将化合物的三倍连续稀释液(最终rdv浓度为9.28nm至2000nm)添加至各孔中。为了确定氯喹(cq)对式ia抗病毒活性的影响,将式ia稀释系列另外掺入dmso或4x增加浓度的cq(最终浓度:10nm、40nm、160nm、640nm和2560nm)。然后将细胞用稀释于dmem培养基 glutamax中的rsv a2病毒以moi=4感染,并在37℃和5% co2下孵育4天。每个孔中的最终体积为200μl。包括未感染和未处理的孔作为100%细胞活力的对照。孵育后,从每个孔中取出100μl培养上清液,并用100μl celltiter-glo试剂(promega)替换。然后将板摇动2分钟,接着在25℃下孵育10分钟。然后通过使用envision读板器测量发光信号来评估细胞活力。将值对未感染和感染的dmso对照(分别为100%和0%感染)进行归一化,并用xlfit软件使用非线性
回归分析拟合数据。ec
50
值被确定为50%感染的非线性回归曲线的点。使用三个生物学重复产生编辑的数据,每个生物学重复包含每个cq浓度的技术重复。
[0162]
测量式ia的化合物和氯喹(cq)浓度的组合对hep2细胞中rsv复制的影响。结果显示cq以剂量依赖性方式拮抗式ia的化合物的抗rsv活性,如通过随着cq浓度增加的较高式ia ec
50
值所证明的(表1)。
[0163]
表1.氯喹对hep2细胞中式ia的抗rsv活性的影响
[0164][0165]
实施例2:代谢数据
[0166]
将a549-hace2和nhbe细胞分别以4
×
105和2.5
×
105个细胞/孔接种在6孔板中。将hep-2细胞以2.5
×
105个细胞/孔接种在12孔板中。二十四小时后,将细胞培养基替换为含有单独的1μm式ia或与1或10μm cq或hcq组合的培养基,并在37℃下孵育。在药物添加后2、8、24和48小时,将细胞用冰冷的tris缓冲盐水洗涤3次,刮到0.5ml冰冷的70%甲醇中并储存在-80℃。将提取物以15,000g离心15分钟,并将上清液转移到干净的管中,以在mivac duo浓缩器(genevac)中蒸发。将干燥的样品在含有3mm甲酸铵(ph5)和10mm二甲基己胺(dmha)水溶液的流动相a中重构,用于通过lc-ms/ms分析,使用流动相a中10%至50%乙腈的多级线性梯度,流速为360μl/min。使用与lc-20adxr(shimadzu)三元泵系统和hts pal自动进样器(leap technologies)连接的50
×
2mm、2.5μm luna c18(2)hst柱(phenomenex)分离分析物。在以正离子和多反应监测模式操作的qtrap(6500 ab sciex)质谱仪上进行检测。使用在来自未处理细胞的提取物中制备的范围为0.624至160pmol/百万个细胞的7点标准曲线对分析物进行定量。为了通过细胞数目进行归一化,在每个时间点计数多个未处理的培养孔。
[0167]
在a549-hace2、nhbe和hep-2细胞培养物中,在与单独和当与cq或hcq组合的式ia的化合物一起孵育后,评价式ia的化合物向活性三磷酸盐物质(式ia-tp)的代谢。在这些体外测定中使用的cq和hcq的浓度对应于根据covid-19的以前的eua指南推荐的剂量产生的全身和肺暴露。平均全身暴露范围对于cq为610-760nm,并且对于hcq为约1.7μm,这两种药物均可达到超过20μm的肺浓度{salman 2017,zhao2014}。在a549-hace2细胞中,与不存在cq或hcq的式ia-tp相比,式ia的化合物与1μm cq或hcq的共孵育没有显著降低式ia-tp水平;然而,在10μm cq或hcq下孵育确实显著降低了式ia-tp的产生(表2;图1)。尽管在用cq或1μm hcq浓度处理的nhbe培养物中,式ia-tp水平趋于更低,但这些差异在统计学上不显著。相反,用10μm hcq处理nhbe培养物显著降低式ia-tp水平(表3;图2)。在hep-2宫颈癌细胞中,用1或10μm的cq或hcq处理显示细胞内式ia-tp形成的剂量依赖性降低(表4;图3)。在处理后8小时观察到hep-2细胞中式ia-tp形成的显著cq或hcq拮抗作用,并持续48小时。在cq或hcq存在下所观察到的式ia-tp降低表明对式ia的化合物代谢为其活性三磷酸盐的潜在
拮抗作用。
[0168]
表2.cq或hcq对a549-hace2细胞中rdv-tp形成的影响
[0169][0170][0171]a值是在每个时间点从两个单独的实验收集的一式两份样品的平均值
±
sem。
[0172]b使用graphpad prism 8.1.2由通过lc-ms在0、2、8、24和48小时检测的式ia-tp浓度的曲线下总面积并除以总的测定时间(48小时)来确定平均式ia-tp浓度。
[0173]c使用graphpad prism 8.1.2,使用式ia dmso与不同浓度的cq或hcq比较的单因素anova与dunnett多重比较分析确定p值。
[0174]
表3.cq或hcq对nhbe培养物中rdv-tp形成的影响
[0175][0176]a值是在每个时间点从两个单独的实验收集的一式两份样品的平均值
±
sem。
[0177]b使用graphpad prism 8.1.2由通过lc-ms在0、2、8、24和48小时检测的式ia-tp浓度的曲线下总面积并除以总的测定时间(48小时)来确定平均式ia浓度。
[0178]c使用graphpad prism 8.1.2,使用式ia dmso与不同浓度的cq或hcq比较的单因素anova与dunnett多重比较分析确定p值。
[0179]
表4.cq或hcq对hep-2细胞中rdv-tp形成的影响
[0180][0181]a值是在每个时间点从两个单独的实验收集的一式两份样品的平均值
±
sem。
[0182]b使用graphpad prism 8.1.2由通过lc-ms在0、2、8、24和48小时检测的式ia-tp浓度的曲线下总面积并除以总的测定时间(48小时)来确定平均式ia-tp浓度。
[0183]c使用graphpad prism 8.1.2,使用式ia dmso与不同浓度的cq或hcq比较的单因素anova与dunnett多重比较分析确定p值。
[0184]
实施例3.sars-cov-2抗病毒数据
[0185]
在a549-hace2转化的气道上皮细胞中评价式ia的化合物和cq或hcq的抗sars-cov-2活性。式ia的化合物、cq和hcq各自表现出有效的抗sars-cov-2的体外抗病毒活性,其中ec
50
值分别为约59.5nm、451nm和365nm(表5)。当以高达2.5μm的浓度与cq或hcq组合时,式ia的化合物的ec
50
值没有明显不同(表5);然而,在cq或hcq存在下,测定中的总nluc信号以剂量依赖性方式降低(图4)。如图4a所示,在0μm式ia(dmso) cq下的nluc信号对应于在该处理条件下在特定cq浓度下的nluc信号。将每个式ia滴定曲线的基线nluc信号降低至对应于该处理条件下cq浓度的水平。在hcq处理条件下观察到类似的效果(图4b)。在10μm的cq或hcq单独存在时,nluc信号被完全抑制,表明cq或hcq单独存在时sars-cov-2复制被完全抑制。由于cq和hcq在10μm浓度下的有效抗病毒活性,标准ec
50
值比较不能揭示当与cq或hcq组合时针对sars-cov-2的式ia活性的潜在降低。在所分析的式ia和hcq组合浓度下未观察到细胞毒性(数据未示出)。
[0186]
表5.a549-hace2细胞中rdv cq或hcq的sars-cov-2nluc ec50值
[0187]
治疗ec
50
(nm)b式ia dmso59.5cq dmso451hcq dmso365式ia 10nm cq52.0式ia 40nm cq52.4式ia 160nm cq52.2式ia 640nm cq46.0式ia 2500nm cq39.8式ia 10000nm cqndc式ia 10nm hcq63.6式ia 40nm hcq50.7式ia 160nm hcq60.0式ia 640nm hcq56.2式ia 2500nm hcq63.0式ia 10000nm hcqndc[0188]
a n=1
[0189]
b ec
50
值在graphpad prism 8.1.2中定义为nluc每秒计数(cps)相对于单独dmso溶媒(0%病毒抑制)和未感染对照培养物(100%病毒抑制)降低50%时的浓度。
[0190]
c nd表示由于cq或hcq对nluc信号的完全抑制而不能计算ec
50
值的情况。
[0191]
虽然为了理解清楚和目的已通过说明和示例的方式较详细地描述了前述公开内容,但本领域技术人员将理解,可在所附权利要求书的范围内实践某些变化和修改。此外,本文提供的每个参考文献全文以引用方式并入,其程度如同每个参考文献单独地以引用方式并入。在本技术与本文提供的参考文献之间存在冲突的情况下,本技术应占主导地位。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。