微球药物涂覆的医疗装置和方法
发明领域
1.本技术总体上涉及材料和制造方法领域,其涉及用于生产微球涂覆的药物递送技术的无水单溶剂或多溶剂、无赋形剂和聚合物(excipient and polymer-free)的药物涂覆制剂。
背景技术:
2.球囊血管成形术是治疗各种动脉疾病病症的既定方法。然而,支架和药物释放支架的出现将球囊血管成形术推到了背景中。最近,药物涂覆的血管成形术球囊(dcb)已成为非药物涂覆的球囊“poba”(普通旧球囊血管成形术)的可行替代方式。这种突现最初是由临床数据推动的,其支持使用涂覆有掺入赋形剂的抗增殖紫杉醇的血管成形术球囊来治疗支架内再狭窄。(chow等人,interv cardiol 7(2):169-180(2015))
3.在人体临床试验中,各种紫杉醇药物形式、赋形剂、球囊和涂覆方法已被用于治疗,结果参差不齐。(picard等人,archives of cardiovascular disease110:259-272(2017))。最近,西罗莫司被建议用于dcb用途。紫杉醇和西罗莫司均可有效预防再狭窄,但生化机制不同。研究表明,紫杉醇的潜在毒性更大,治疗范围更窄。(pires等人,heart 93:722-727(2007))。这种理解引起了极大的兴趣,并进行了许多研究来评估用血管支架和药物涂覆的球囊使用西罗莫司。
4.现在普遍认为西罗莫司和西罗莫司衍生物(“limus”)化合物是用于涂覆的血管支架的优选药物。然而,该行业对开发limus涂覆的球囊的愿望更具挑战性。现在可以理解,为了使用这些化合物获得最佳结果,需要药物在患病组织中以治疗水平保留约一个月或更长时间。为了试图满足这一要求,这些药物已经使用了各种聚合物和赋形剂以及各种组分物理形式,所有这些都试图避免或减缓插入过程中球囊中的药物损失,以允许药物转移和保留在所需的部位,并最大限度地减少药物洗脱和/或相对于到达组织的时间提供治疗量的药物。
5.这些要求导致了复杂的limus dcb涂覆组合物和制造方法。(arpit等人,trends biomat artif organs 22(2):87-92(2008))。现在还进一步认识到,含有微粒和/或微球形式成分的dcb涂层可以帮助在治疗部位的药物保留和定时释放(timed release)。这些产品要求导致公开了各种各样的药物形式和组合物。
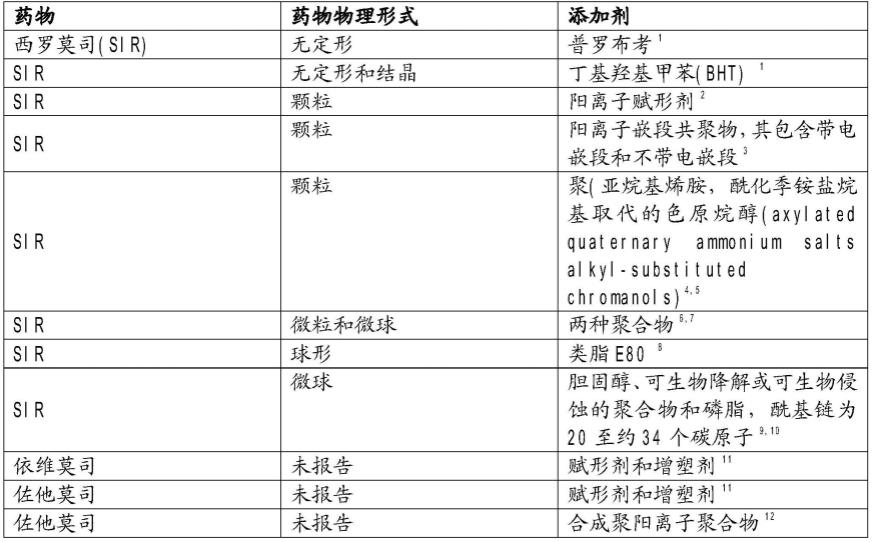
6.下面的表1列出了几种limus涂覆的球囊设计及其所含的所需涂层添加剂。
7.表1limus涂覆的球囊设计
[0008][0009]
1.claver等人,circ cardiovasc interv 9:4e003543(apr 2016).
[0010]
2.u.s.10,213,529surmodics
[0011]
3.u.s.10,213,528surmodics
[0012]
4.u.s.9,949,957surmodics
[0013]
5.u.s.10,449,180surmodics
[0014]
6.u.s.10,188,772micell tech
[0015]
7.u.s.10,117,972micell tech
[0016]
8.u.s.8,778,379concept medical
[0017]
9.u.s.9,492,594medalliance
[0018]
10.u.s.10,098,987medalliance
[0019]
11.u.s.2014/0046254abbott
[0020]
12.u.s.9,782,516abbott
[0021]
药物微球的原位球囊形成已有报道。例如,u.s.9,295,663公开了原位球囊微球形成相对于传统球囊微球涂层制剂的若干优点。然而,所公开的材料和方法、所需的组合物和必要的工艺是非常复杂的。这些材料和方法需要平衡特定的化学品及其化学和物理性质,以及使用两种不同的溶剂,之后该技术利用特定的干燥要求来产生所需的结果。
[0022]
本领域的这种教导要求传统药物涂层制剂的优化将无法产生原位形成微球的涂层。此外,相关领域要求,为了使药物微球正确形成,制剂必须利用水作为第一溶剂,其比例为第二溶剂的30%。更重要的是,如果涂层制剂的蒸发速度过快,药物的微球将无法形成。
[0023]
可以认识到,利用聚合物、外来添加剂和赋形剂来产生满足临床要求的最佳物理和化学药物产品构造具有挑战性。各种产品添加剂会大大增加制造复杂性和成本,也会对产品所需的包装和稳定性(保质期)产生负面影响。此外,添加产品成分会增加患者血管和/或全身毒性的风险,所有这些都会影响患者的预后和总治疗成本。本领域显然需要改进limus dcb物质组成和制造工艺。
技术实现要素:
[0024]
本发明提供了涂覆基材表面以形成包含至少一种药物的微球层的方法,该方法包括:(1)提供至少一种疏水材料;并提供至少一种溶剂;将来自(1)的至少一种疏水材料溶解在来自(1)和(2)的至少一种溶剂中,在基材表面上形成溶解的产物;(3)从基材表面蒸发溶解的产物以产生微球层。或者,所述至少一种疏水材料包含所述至少一种药物。优选地,所述至少一种溶剂是醇类。更优选地,溶解的疏水混合物通过移液管或喷雾沉积到基材上。最优选地,该方法不包括在上述定义的任何步骤中合成聚合物的使用。任选地,该基材表面选自球囊、医疗装置和支架。
[0025]
在另一方面,本发明提供了制造包含至少一种药物的微球组合物的方法,该方法包括以下步骤:提供疏水混合物,其中至少一种药物与疏水混合物一起含有,将疏水混合物溶解在至少一种溶剂中,将溶解的疏水混合物沉积到基材上并从基材中蒸发沉积、溶解的疏水混合物以产生微球组合物。优选地,所述至少一种溶剂是醇类。更优选地,溶解的疏水混合物通过移液管或喷雾沉积到基材上。最优选地,该方法在任何步骤中不包括合成聚合物的使用。任选地,所述基材选自球囊、医疗装置和支架。
[0026]
因此,本发明的一个方面涉及具有包含本文所述和定义的多种药物微球或由本文所述和定义的多种药物微球组成的涂层的医疗装置。
[0027]
与前面方面相关,本发明涉及医疗装置,优选具有球囊的球囊导管,其涂层包含本文所述和定义的多种药物微球或由本文所述和定义的多种药物微球组成。上述医疗装置的一个优选实施方案涉及球囊导管,其具有球囊,所述球囊具有包含水溶性材料的底涂层(primer coating layer)和包含本文所述和定义的多种药物微球或由本文所述和定义的多种药物微球组成的第二层。本文中使用的底涂层应该施加在基材的表面上。例如,将球囊导管的底涂层施加在球囊表面上。
[0028]
此外,本发明提供了制造包含至少一种药物的药物微球的方法,包括以下步骤:(1)将至少一种药物溶解在至少一种溶剂中以形成疏水混合物,(2)将溶解的疏水混合物沉积到基材上,以及(3)从基材中蒸发沉积、溶解的疏水混合物以产生药物微球。如上所述的方法可优选地包括在步骤(2)之前施加的中间步骤(1b),其中步骤(1b)包括将水溶性材料施加到基材上并干燥水溶性材料。步骤(1b)的应用在基材上形成水溶性材料的底层(primer layer)。因此进行随后的步骤(2),将溶解的疏水混合物沉积到具有底层的基材上。
附图说明
[0029]
本文所包含的公开主题最好结合附图进行描述,其中:
[0030]
图1显示了每个涂覆的球囊的sem图像。(a)在球囊上涂覆的在无水甲醇中的3.1mg/ml crc-015;(b)在球囊上涂覆的在无水甲醇中的6.3mg/ml crc-015;(c)在球囊上涂覆的在无水甲醇中的12.5mg/ml的crc-015;和(d)在球囊上涂覆的在无水甲醇中的25.0mg/ml crc-015。
[0031]
图2显示了在球囊上涂覆的紫杉醇球体。(a)涂覆有25mg/ml的在甲醇中的紫杉醇制剂的球囊图像;(b)药物微球的sem图像。
[0032]
图3显示了涂覆在球囊上的crc-015、紫杉醇和吉西他滨球体。(a)涂覆有在甲醇中
一起溶解的crc-015、紫杉醇和吉西他滨的球囊图像;(b)药物制剂微球的sem图像。
[0033]
图4显示了用在甲醇中的crc-015(37.5mg/ml)和5%水中产生的微球。
[0034]
图5显示了在甲醇中的雷帕霉素(25mg/ml)和7%水中产生的微球。
[0035]
图6显示了在甲醇中的紫杉醇(10mg/ml)和4%水中产生的微球。
[0036]
图7显示了在乙醇中的依维莫司(45mg/ml)和1%水中产生的微球。
[0037]
图8显示了用含有在34.2%甲醇(v/v)和56.8%丙酮(v/v)中的依维莫司和阿立塞替(alisertib)的制剂产生的微球。
[0038]
图9显示了用涂覆在hsa顶部的甲醇中的crc-015制剂产生的微球。
[0039]
图10显示了用涂覆在pva顶部的甲醇中的crc-015制剂产生的微球。
[0040]
图11显示了体内数据,其支持了crc-015dcb对比西罗莫司dcb对比magictouch西罗莫司dcb的动脉血管药物保留比较。
具体实施方式
[0041]
定义
[0042]
如本文所用,术语“大环三烯免疫抑制化合物”包括如本公开中所述的雷帕霉素(西罗莫司)、依维莫司(everolimus)、佐他莫司(zotarolimus)、优美莫司(biolimus)、诺维莫司(novolimus)、米尔莫司(myolimus)、替西罗莫司(temsirolimus)和雷帕霉素衍生物。
[0043]
如本文所用,术语“微球”或“微球形”包括直径在纳米至微米范围内的小的、主要是球形的颗粒。术语“微球”或“微球形”既包括空心的胶束结构,也包括充满材料直至核心而内部没有任何特定空心空间的球状结构。该术语直接指术语“颗粒”,其也可以具有部分空心或完全填充的含义。
[0044]
本发明提供了用于治疗某些疾病或病症的药物微球的新型生产的材料和方法。
[0045]
本发明的一个方面提供了制造包含至少一种药物的药物微球的方法,包括以下步骤:(1)将至少一种药物溶解在至少一种溶剂中以形成疏水混合物,(2)将溶解的疏水混合物沉积到基材上,以及(3)从基材中蒸发沉积、溶解的疏水混合物以产生药物微球。如上所述的方法可包括在步骤(2)之前施加的中间步骤(1b),其中步骤(1b)包括将水溶性材料施加到基材上并干燥水溶性材料。用于该步骤的水溶性材料可以是本文中定义为水溶性材料的任何材料。优选的是,基材是诸如球囊导管或支架的医疗装置,但也可以是起搏器、植入式除颤器或植入式神经刺激装置。同样,本文描述的方法可以包括先前应用于步骤(1)或步骤(1b)(如果存在)的步骤(1a)。步骤(1a)提供用于用本文所述的有机溶剂清洁和润湿基材,优选球囊导管的球囊。优选地,步骤(1a)用丙酮、戊烷、己烷、乙醇、乙醚或乙酸乙酯进行。进行步骤(1a)的优点是,水溶性材料或药物微球显示出对基材的改进的粘附性。此外,在将溶解的疏水混合物沉积到基材上之前,可以通过等离子体处理(plasma treatment)清洁基材。优选地,等离子体处理步骤在清洁之后和应用步骤(1b)之前进行。等离子体处理可以支持水溶性材料的溶出,从而更快地转移所述至少一种药物。
[0046]
本发明优选实施方案的某些优点包括但不限于,在毫克规模上提高药物产量(甚至当使用亲脂性药物化合物时),降低与微球形成相关的复杂性(包括减少员工培训和昂贵的仪器要求),显著减少处理时间(导致药物分解的可能性降低和降低程序费用)和从生产步骤去除昂贵的材料(如挥发性化合物和昂贵的合成聚合物)。
[0047]
本发明涉及提供在至少一种溶剂或多种溶剂中增溶至少一种药物或药物组合物(或多种药物组合物)后形成药物微球的方法和处理步骤。该增溶或溶解步骤之后,将所得混合物分配到基材上。图1示出了如何将混合物分配到特定基材上的一个实施方案。优选地,使用注射器将溶解的药物混合物分配到基材上。或者,移液器或针头或套管可以以类似的方式使用。
[0048]
如上所述,各种溶剂可用于本技术。优选的溶剂是使用前已干燥的有机溶剂。优选只使用一种溶剂用于增溶或溶解步骤,但也使用各种溶剂,因此可以使用溶剂混合物。溶剂应无水。无水的溶剂应理解为已采取措施从中除去水分。去除的程度的范围通常可以从溶剂的简单蒸馏到在蒸馏后或蒸馏期间用干燥剂如钠、钾、naalh4等处理和储存溶剂。优选地,溶剂含有少于7%的水,更优选少于3%的水,甚至更优选少于1%的水,最优选少于0.01%的水。在这一点上,优选的是,如果水存在于溶剂中,其量最多为约7%的最大值。在该优选实施方案中,满足了本领域对溶液的未满足需求,其利用含有单一或多溶剂的无水分制剂,该制剂将迅速形成药物微球,并且,如果水的存在量高达约7%,则微球形成仍然在环境温度迅速进行。
[0049]
如果溶剂的含水量确实低于1%,则更优选。合适的溶剂是有机溶剂,例如醇类,特别是c1至c3脂肪族醇、丙酮、醚类,特别是乙醚、氯仿、二氯甲烷、乙腈、己烷和戊烷。特别优选的是c1至c3醇,例如甲醇或乙醇。
[0050]
将溶剂-药物混合物沉积到基材上后,混合物的蒸发导致在基材表面上形成药物微球。生产条件的优化可能会导致最终产品的具体改进,例如,控制球体尺寸或自动化加工步骤。优选的是,蒸发至少一种溶剂的步骤发生在不存在加速蒸发的手段,例如通过轻微的风或气流的情况下。如果蒸发缓慢发生,则观察到窄粒径分布。如果像更强的气流一样施加强力的加速蒸发手段,则不会观察到将溶剂加热到接近或高于至少一种溶剂的沸腾温度形成微球形疏水材料。就气流而言,如果气体在溶液表面的移动速度慢于0.2m/s,则是优选的。
[0051]
疏水药物组合物在至少一种溶剂中的浓度应在0.1至200mg/ml的范围内。在优选的实施方案中,浓度在10至100mg/ml的范围内。在上述范围内观察到窄粒径分布。此外,在上述定义的较高药物浓度的情况下,可以观察到微球形疏水材料在基材上的更好粘附。不受以下理论的约束,据信随着浓度的增加,微球形颗粒的直径趋于变大,并且随着直径的增加,有助于颗粒与表面之间粘附的表面积也增加。
[0052]
优选地,本发明中使用的至少一种药物是选自雷帕霉素(西罗莫司)、依维莫司、佐他莫司、优美莫司、诺维莫司、米尔莫司、替西罗莫司和雷帕霉素衍生物的大环三烯免疫抑制化合物,包括任何药学上可接受的盐和水合物,以及任何立体异构体、立体异构体的混合物和外消旋体。更优选地,大环三烯免疫抑制化合物,包括任何药学上可接受的盐和水合物,以及任何立体异构体、立体异构体的混合物和外消旋体,其具有以下结构:
[0053][0054]
其中r是c(o)-(ch2)
n-x,n是0、1或2,x是具有3-8个碳并且任选地含有一个或多个不饱和键的环烃。在最优选的实施方案中,c(o)-(ch2)
n-x具有以下结构之一:
[0055][0056]
在一个实施方案中,药物微球由大环三烯免疫抑制化合物组成,所述大环三烯免疫抑制化合物包括任何药学上可接受的盐和水合物,以及任何立体异构体、立体异构体的混合物和外消旋体,如上定义。在另一个实施方案中,药物微球包含大环三烯免疫抑制化合物,所述大环三烯免疫抑制化合物包括任何药学上可接受的盐和水合物,以及任何立体异构体、立体异构体的混合物和外消旋体,如上定义。一个特别优选的实施方案包括由大环三烯免疫抑制化合物和阿立塞替形成的药物微球,所述大环三烯免疫抑制化合物包括任何药学上可接受的盐和水合物,以及任何立体异构体、立体异构体的混合物和外消旋体,如上定义。两种化合物之间的比例从以重量计5:95到以重量计95:5之间变化。在优选的实施方案中,药物微球的阿立塞替含量以重量计小于50%。
[0057]
进一步优选的实施方案涉及药物微球,包括本文定义的雷帕霉素或其衍生物和紫杉醇或由本文定义的雷帕霉素或其衍生物和紫杉醇组成。在具体实施方案中,药物微球由紫杉醇和大环三烯免疫抑制化合物组成,所述大环三烯免疫抑制化合物包括任何药学上可接受的盐和水合物,以及任何立体异构体、立体异构体的混合物和外消旋体,具有以下结构:
[0058][0059]
其中r是c(o)-(ch2)
n-x,n是0、1或2,x是具有3-8个碳并且任选地含有一个或多个不饱和键的环烃。在最优选的实施方案中,c(o)-(ch2)
n-x具有以下结构之一:
[0060][0061]
本发明的再一方面涉及医疗装置,优选球囊导管,其具有涂层,所述涂层包含本文描述和定义的多种药物微球或由本文描述和定义的多种药物微球组成。上述医疗装置的一个优选实施方案涉及球囊导管,其具有球囊,所述球囊具有包含水溶性材料的底涂层和包含本文所述和定义的多种药物微球或由本文所述和定义的多种药物微球组成的第二层。本文中使用的底涂层应该施加在基材的表面上。例如,将球囊导管的底层施加在球囊表面上。
[0062]
本发明的意义在于提供具有本文所述的微球作为外层的医疗装置,以便于药物从医疗装置转移到患者的组织。一方面,微球层可以直接施加在装置的表面上。在进一步优选的方面中,可以在医疗装置表面和微球层之间引入另外的层,但优选一层,即底层。
[0063]
优选的是,所述底涂层包含水溶性材料或由水溶性材料组成,并且在球囊导管的表面上形成第一涂层。优选通过浸涂来涂覆所述底涂层,其中将所述球囊导管放置在包含
所述水溶性材料的溶液中,所述溶液被涂覆到所述球囊导管的表面上。其他适合的方法例如喷涂或通过线(thread)、针、套管、海绵或一块布来涂覆所述溶液都可以用于涂覆过程。在如此施加所述底涂层之后,从所述溶液或所述涂覆装置中移除所述球囊导管,并且使其干燥,例如在环境室温下干燥少于24小时的时间。
[0064]
应包含大部分所述底涂层的水溶性材料是分子量约为50至200kd的材料或蛋白质。在一个实施方案中,所述水溶性材料是蛋白质,其优选地选自水溶性人血清蛋白或水溶性血液蛋白,所述蛋白优选具有约50至200kd的分子量。在一个实施方案中,所述水溶性材料是具有约65至70kd的分子量的聚合物或蛋白质,优选具有约65至70kd的分子量的球状血清蛋白。在另一个实施方案中,所述水溶性材料选自血蛋白,例如分子量直到约160kd的球蛋白和/或纤维蛋白原。更优选的是,所述水溶性材料是人纤维蛋白原或免疫球蛋白。最优选的是,所述水溶性材料是与以下序列具有至少90%同一性的人血清蛋白:
[0065]
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefa
[0066]
ktcvadesaencdkslhtlfgdklctvatlretygemadccakqepern
[0067]
ecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyf
[0068]
yapellffakrykaafteccqaadkaacllpkldelrdegkassakqrl
[0069]
kcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchg
[0070]
dllecaddradlakyicenqdsissklkeccekpllekshciaevendem
[0071]
padlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlll
[0072]
rlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeq
[0073]
lgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrm
[0074]
pcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdet
[0075]
yvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalgl(seq id no:1)。
[0076]
在本发明最优选的实施方案中,所述水溶性材料是人血清白蛋白。人血清白蛋白的使用是优选的,因为该化合物具有人源性,因此不会对用本文所述的球囊导管治疗的患者造成不必要的药物或化合物负荷。因此,使用人血清白蛋白可减少对患者不必要的污染。当作为底层使用和施用时,人血清白蛋白可能包括杂质范围内的少量稳定化合物。在底层应由人血清白蛋白或任何其他合适的蛋白质组成的实施方案中,这些少量应由词语“由
…
组成”所涵盖在本发明和本文提出的实施方案的含义内。
[0077]
如上所述,药物微球是小的,主要是球形颗粒,直径在纳米到微米范围内。在一个实施方案中,药物微球在微米范围内并且具有1至20μm的平均直径。在优选的实施方案中,药物微球具有3至10μm的平均直径。在这样的范围内,当在球囊导管上使用时,可以观察到协同效应,因为微球显示出对基材的强粘附,而同时药物非常有效地洗脱到组织中。不受该理论的束缚,据信明显超出纳米镜的直径具有相对较高的表面积,有助于颗粒和表面之间的粘附,同时仍然具有有效药物转移所必需的整体大表面积。
[0078]
同样如上所述,通过优选不使用除药物微球层以外的其他层或另外一层人血清白蛋白,将外来化合物对患者的负荷保持在最低限度。特别是在这些实施方案中,为了提供具有有效药物洗脱/转移的高效植入程序,其可以承受比其它层组合(其中通常除了api之外还施加粘合剂,赋形剂或表面活性剂)施加更高的药物剂量。例如,球囊导管上的常用载药
量保持在0.3至1.2mg/mm2之间。由于本文所述的实施方案的污染是低的,因此可以应用1.5至3.0mg/mm2之间的较高载药量。
[0079]
在实施方案中,如果医疗装置是球囊导管,可以观察到,当球囊由聚酰胺材料制成时,特别是当药物微球包含至少一种在本文描述为crc-15种类的化合物时,颗粒的粘附性得到改善(见下表1)。表现出良好粘附性的球囊材料包括尼龙6、尼龙66、尼龙11、尼龙12等聚酰胺,嵌段共聚物包括以商标出售的分段聚酰胺-聚醚-聚酯,或尼龙弹性体,其是具有尼龙6、尼龙66、尼龙11、尼龙12的嵌段共聚物。聚酰胺基球囊材料和包含crc-15种类或由crc-15种类组成的药物微球的组合是有利的,因为微球颗粒显示出良好的粘附性,而聚酰胺材料与例如聚碳酸酯相比具有更高的柔韧性。于此,具有由聚酰胺基材料制成的球囊并具有本文所述的微球涂层,特别是包含本文所述的至少一种crc-15种类或由本文所述的至少一种crc-15种类组成的微球药物涂层的球囊导管具有改进的用于小而弯曲的血管例如冠状动脉血管的特性,因为材料的柔韧性允许通过那些血管,而良好的粘附性最大限度地减少了材料对这些难以到达的位置的损失。同样,在不存在底层的实施方案中,球囊导管表现出非常小的直径,这支持通过非常小的位置。
[0080]
因此,在一个具体实施方案中,本发明涉及球囊导管,其球囊由本文定义的聚酰胺材料制成,其施加在球囊表面的涂层包括或由以下组成:雷帕霉素(西罗莫司)、依维莫司、佐他莫司、优美莫司、诺维莫司、米尔莫司、替西罗莫司和/或雷帕霉素衍生物,包括任何药学上可接受的盐和水合物,以及任何立体异构体、立体异构体的混合物和外消旋体以及大环三烯免疫抑制化合物,包括任何药学上可接受的盐和水合物,以及任何立体异构体、立体异构体的混合物和外消旋体,其具有以下结构:
[0081][0082]
其中r是c(o)-(ch2)
n-x,n是0、1或2,x是具有3-8个碳并且任选地含有一个或多个不饱和键的环烃。在最优选的实施方案中,c(o)-(ch2)
n-x具有以下结构之一:
[0083][0084]
最优选在该实施方案中,药物包含大环三烯免疫抑制化合物或由大环三烯免疫抑制化合物组成,包括任何药学上可接受的盐和水合物,以及任何立体异构体、立体异构体的混合物和外消旋体,如上文直接定义的那样。
[0085]
在一个实施方案中,本发明涉及球囊导管,其具有施加在球囊表面的涂层,该涂层由药物微球组成,其中药物微球由大环三烯免疫抑制化合物组成,所述大环三烯免疫抑制化合物包括任何药学上可接受的盐和水合物,以及任何立体异构体、立体异构体的混合物和外消旋体,具有以下结构:
[0086][0087]
其中r是c(o)-(ch2)
n-x,n是0、1或2,x是具有3-8个碳并且任选地含有一个或多个不饱和键的环烃。在最优选的实施方案中,c(o)-(ch2)
n-x具有以下结构之一:
[0088][0089]
球囊导管的该特定实施方案在球囊表面上仅具有一层单层,其由上面直接定义的微球组成。该实施方案还可以在球囊材料、粒径和球囊载药量方面具有本文所定义的限制。
[0090]
一个优选的实施方案涉及具有底层和由药物微球组成的涂层的球囊导管。涂层施加在底层的顶部。底层施加在球囊导管的球囊表面。底层由水溶性材料组成,优选优选分子量在50至200kd之间的蛋白质且最优选人血清白蛋白。药物微球由大环三烯免疫抑制化合物组成,所述大环三烯免疫抑制化合物包括任何药学上可接受的盐和水合物,以及任何立体异构体、立体异构体的混合物和外消旋体,其具有以下结构:
[0091][0092]
其中r是c(o)-(ch2)
n-x,n是0、1或2,x是具有3-8个碳并且任选地含有一个或多个不饱和键的环烃。在最优选的实施方案中,c(o)-(ch2)
n-x具有以下结构之一:
[0093][0094]
该特定实施方案应该仅具有上面直接定义的两层。不应将其他层施加于球囊。该实施方案还可以在球囊材料、粒径和球囊载药量方面具有本文所定义的限制。
[0095]
进一步实施方案
[0096]
1.涂覆基材表面以形成包含至少一种药物的微球层的方法,该方法包括:(a)提供至少一种疏水材料;(b)并提供至少一种溶剂;(c)将来自(a)的至少一种疏水材料溶解在来自(b)的至少一种溶剂中以在基材表面上形成溶解的产物;以及(d)从基材表面蒸发溶解的产物以产生微球层。
[0097]
2.实施方案1所述的方法,其中所述至少一种疏水材料包含所述至少一种药物。
[0098]
3.实施方案1或2所述的方法,其中所述至少一种溶剂是醇类。
[0099]
4.前述实施方案之一所述的方法,其中所述方法不包括在任何步骤中使用赋形剂或合成聚合物。
[0100]
5.前述实施方案之一所述的方法,其中所述基材表面选自球囊、医疗装置和支架。
[0101]
6.制造包含至少一种药物的微球组合物的方法,其中至少一种药物与疏水混合物一起含有,将疏水混合物溶解在至少一种溶剂中,将溶解的疏水混合物沉积到基材上并从基材中蒸发沉积、溶解的疏水混合物以产生微球组合物。
[0102]
7.实施方案6所述的方法,其中所述至少一种溶剂是醇类。
[0103]
8.实施方案6或7所述的方法,其中所述方法不包括在任何步骤中使用合成聚合物或赋形剂。
[0104]
9.实施方案6至8之一所述的方法,其中所述基材选自球囊、医疗装置和支架。
[0105]
10.医疗装置,其包含含有水溶性材料的底层和包含多个药物微球的第二层。
[0106]
11.实施方案10所述的医疗装置,其中所述底涂层在所述医疗装置表面形成第一涂层。
[0107]
12.实施方案10或11的医疗装置,其中所述医疗装置为球囊导管。
[0108]
13.实施方案10至12之一所述的医疗装置,其中所述底涂层通过选自浸渍涂层、喷涂涂层、线(thread)、针头、套管、海绵和一块布之一施加。
[0109]
14.实施方案10至13之一所述的医疗装置,其中所述水溶性材料构成底涂层的大部分。
[0110]
15.实施方案10至14之一所述的医疗装置,其中所述水溶性材料是分子量在50至200kd之间的聚合物或蛋白质。
[0111]
实施例
[0112]
实施例药物制剂:
[0113]
本发明的大环三烯免疫抑制化合物具有一个以上的实施方案,并且可以描述为包含表1中的以下种类中的至少一种:
[0114]
表1crc-015种类描述
[0115][0116][0117]
本文所指的crc-015是一个术语,旨在涵盖一个属,并用于指表1中的以下每个种类:crc-015a、crc-015b、crc-015c、crc-015d、crc-015e、crc-015f、crc-015g和crc-015h。
[0118]
i.crc-015球涂覆的球囊
[0119]
研究了25.0、12.5、6.3和3.1mg/ml的无水crc-015制剂通过本发明方法产生球体的能力以及药物浓度相对于球体尺寸的作用。
[0120]
材料:无水甲醇;sigma 900641-4x2ml密封玻璃安瓿瓶,批号shbh9540(0.001%水,karl fischer cert)。4ml玻璃瓶;在140℃热处理过夜,然后用塑料ptfe衬里盖盖上。不锈钢刮刀和1ml玻璃移液器;与玻璃小瓶一样进行热处理。crc-015;0.47%水分(karl fischer)。5.0x 40mm passeo 35球囊导管(biotronik inc.)。
[0121]
制剂方法:通过使用不锈钢刮刀将所需药物量添加到去了皮重的小瓶中来制备crc-015的无水制剂。使用玻璃测量移液器加入所需的无水甲醇体积,并立即盖上小瓶。药物通过小瓶的短暂涡旋溶解。
[0122]
球囊涂层材料:涂覆仪器;adept engineering limited,p/n 768-01,注射泵;sono-tek注射泵ti p/n 12-05-00144,分配套管;不锈钢55mm l x 1.5mm od,0.9mm id x 0.7mm d侧孔。
[0123]
球囊涂覆方法:将crc-015的每种无水制剂涂覆到相应的充气5.0x 40mm passeo 35球囊上。分配套管在近端或远端与球囊直接接触,并沿着球囊从头到尾冲浪(surf),同时在球囊沿其轴旋转时水平分配50μl制剂溶液穿过充气球囊。对于这些实施例,使用以下工艺参数:溶液流速=0.2ml/min,分配时间=15秒,导致湿球囊表面,旋转速率=120/min,旋转时间=240秒,导致溶剂蒸发和药物微球的形成。在成像分析之前,将球体涂覆的球囊保持在环境温度。使用hitachi tm-1000台式扫描电子显微镜(sem)对涂覆的球囊进行成像。将药物涂覆的球囊分为3个相等的部分:远端、中部和近端。将每个部分放置在样品载物台上,然后溅射涂上金。然后将样品载物台放置在sem的样品室内进行分析。测量了球囊远端、中部和近端部分sem中存在的crc-015球体的大小。每个涂覆的球囊的代表性sem图像如图1所示。crc-015球体尺寸测量详见表2。当药物制剂浓度从3.1mg/ml增加到6.3mg/ml至12.5mg/ml时,未观察到crc-015球体尺寸的明显变化。然而,当crc-015浓度增加到25mg/ml时,观察到crc-015球体的尺寸的统计学显著性(在95%置信区间p《0.0001)差异。
[0124]
表2crc-015球体尺寸测量
[0125][0126]
ii.紫杉醇球体涂覆的球囊
[0127]
紫杉醇(lc laboratories p-3600,批号asm-121)在甲醇(emd mxo488p-1,批号59129)25mg/ml中配制,溶液用于以类似于实施例i的方法涂覆球囊。对所得球囊进行成像(图2(a)),图2(b)显示了显示产生的药物微球的sem分析。
[0128]
iii.西罗莫司球体涂覆的球囊
[0129]
西罗莫司(雷帕霉素)(lc laboratories r-5000,批号asw-134)如实施例i所述配制,并利用该制剂在球囊表面上产生药物球体。
[0130]
iv.依维莫司球体涂覆的球囊
[0131]
依维莫司(lc laboratories e4040,批号bde-115)如实施例i所述配制,并利用该制剂在球囊表面上产生药物球体。
[0132]
v.优美莫司球体涂覆的球囊
[0133]
优美莫司如实施例i所述配制,并利用该制剂在球囊表面上产生药物球体。
[0134]
vi.佐他莫司球体涂覆的球囊
[0135]
佐他莫司(molcan,批号10081)如实施例i所述配制,并利用该制剂在球囊表面上产生药物球体。
[0136]
vii.crc-015球体涂覆的球囊
[0137]
crc-015如实施例i所述配制,但使用100%乙醇(sigma 459844,批号shbj8382)作为溶剂。利用该制剂在球囊表面上产生药物球体。
[0138]
viii.crc-015、紫杉醇和吉西他滨球体涂覆的球囊
[0139]
将crc-015、紫杉醇和吉西他滨游离碱(lc laboratories g4199,批号gmb-103)分别以以下浓度一起溶解在甲醇中:20mg/ml,17mg/ml,5.2mg/ml。该溶液通过实施例i的方法用于涂覆球囊。对所得球囊进行成像(图3(a)),所得药物球体如图3(b)所示。
[0140]
以下制剂是含水涂层的实施例。
[0141]
ix.crc-015
[0142]
将crc-015溶于甲醇中至浓度为37.5mg/ml。加入hplc级水以制备含有浓度约为5%体积的水的涂层溶液。将该涂层溶液移液到5x 120mm球囊导管的表面上,并在环境条件干燥30秒。通过sem检查球囊表面,得到的sem图像显示产生的药物球体(图4)。
[0143]
x.雷帕霉素
[0144]
将雷帕霉素溶于甲醇中至浓度为25mg/ml。加入hplc级水以制备含有浓度约为7%体积的水的涂层溶液。球囊涂层和检查与实施例i相同。所得sem图像显示产生的药物球体(图5)。
[0145]
xi.紫杉醇
[0146]
紫杉醇溶于甲醇中至浓度为10mg/ml。加入hplc级水以制备含有浓度约为4%体积的水的涂层溶液。球囊涂层和检查与实施例i相同。所得sem图像显示产生的药物球体(图6)。
[0147]
xii.依维莫司
[0148]
将依维莫司溶于100%乙醇中至浓度为45mg/ml。加入hplc级水以制备含有浓度约为1%体积的水的涂层溶液。球囊涂覆与实施例1相同,但溶剂干燥45秒后进行sem分析。所得sem图像显示产生的药物球体(图7)。
[0149]
这些微球制剂的实施例表明,尽管使用无水溶剂系统快速产生药物微球,但不同少量水的存在并不抑制微球形成过程。
[0150]
以下实施例表明用于微球产生的含有多溶剂和多化合物混合物的涂层制剂。
[0151]
xiii.多溶剂和多化合物混合物
[0152]
依维莫司和阿立塞替(mln 8237)adooq bioscience 1028486-01-2,批号li0004b007一起溶解在34.2%甲醇和65.8%丙酮,v/v(emd)的溶液中至浓度分别为4.5mg/ml和2.5mg/ml。将溶液移液到充气球囊的表面上,并在sem分析前干燥30秒。sem所得微球如图8所示。
[0153]
以下实施例显示了利用下层形成的药物微球。
[0154]
xiv.存在下层的药物微球形成
[0155]
充气的5.0x 40mm passeo 35球囊通过用润湿有丙酮的无尘纸(kimwipe)擦拭球囊表面来清洁。球囊任选用等离子体(w/氩气)进行预处理。通过将干燥的球囊插入(远端先插入)含有5% hsa溶液(albumedix p/n 200-010,批号2107,用hplc水稀释至5%)的管中来用人血清白蛋白(hsa)进行浸渍。将浸渍涂覆的球囊从管中取出,然后翻转,使球囊的远端朝上。用无尘纸去除多余的流向球囊的近端的hsa。将hsa涂覆的球囊在环境条件干燥14-38小时。如实施例i所述配制crc-015并涂覆到hsa涂覆的球囊上。通过sem检查球囊表面,图9显示所得的显示产生药物球的sem图像。
[0156]
在另一个实施方案中,将充气的5.0
×
40mm passeo 35球囊浸渍涂覆在0.25%聚乙烯醇(pva;emd p/n 1.41350.1000,批号k50570650,85-89%水解,3.4-4.6mpa*s粘度)中,所述0.25%聚乙烯醇通过使用不锈钢刮刀将pva添加到去了皮重的小瓶中制备。使用玻璃测量移液管将所需量的hplc级水加入小瓶中。将搅拌子加入小瓶中并盖上小瓶盖。通过在80℃水浴中搅拌溶液3-4小时来溶解pva。在将pva冷却至环境温度后,将球囊如实施例xiv所述浸渍涂覆,crc-015如实施例i所述配制并涂覆到pva涂覆的球囊上。通过sem检查球囊表面,图10显示所得的显示产生药物球的sem图像。
[0157]
xv.支持crc-015微球涂覆的球囊的体内数据
[0158]
尤卡坦迷你猪的左右深部(股深动脉)和股浅动脉(sfa)用crc-015dcb(实施例xiv)处理,以评估药物涂层向动脉血管的体内转移。普遍认为,这种猪模型是人类表现的一般预测指标。在用crc-015dcb处理之前,首先用未涂覆的球囊预先扩张目标血管,以模仿通常在人类临床环境中进行的外科手术。在给予麻醉后,将动物的颈动脉通过手术暴露和结扎。插入并固定了8f引入鞘。18000导丝和8f引导管通过引入鞘插入并推进到目标血管。用造影剂获得血管的血管造影图像,并使用校准标记测量血管尺寸。
[0159]
在荧光镜的指导下,将未涂覆的无菌5.0x 40mm预扩张球囊导管插入导丝上,穿过引导管,推进到目标部位,并充气30秒。预扩张的球囊放气并取出。然后将5.0x 40mm药物涂覆的球囊导管推进到扩张的血管段并充气120秒。药物涂覆的球囊放气并取出。每次球囊充气后用造影剂获得处理血管的血管造影。
[0160]
共有六只动物接受了crc-015dcb处理。3只动物(每组6股动脉)在14天时安乐死,3只动物(每组6股动脉)在28天时安乐死。在尸检时回收处理过的血管,并通过hplc定量测定药物含量。crc-015在14天和28天时的组织药物保留归一化为球囊上ng药物/mg组织/μg/mm2药物剂量的函数,并报告为ng/mg/(μg/mm2)。将crc-015dcb的动脉血管药物保留与magictouch西罗莫司dcb(concept medical,cardiovascular innovation pipeline@europcr,2010年5月26)和selution西罗莫司dcb(zeller等人,mac,2017年12月7-09日)报告的结果进行比较,如图11所示。
[0161]
这些结果表明,与所引用的化学更复合和更复杂的产品相比,本发明产品具有改
善的体内性能。
[0162]
在本发明的进一步方面,球体形成组合物的涂覆可以通过喷涂、辊涂、刷涂、浸渍涂覆、直接流体或喷墨将溶液施加到基材上来完成。本发明还允许在医疗装置上一起生产含有两种或多种药物的药物球体以治疗各种疾病病症。
[0163]
本文示例性描述的发明可以在不存在本文未具体公开的任何要素或多个要素、限制或多个限制的情况下适当地实践。因此,例如,术语“包含”、“包括”、“含有”等应被广泛而无限制地解读。另外地,本文使用的术语和表达方式已被用作描述性术语而非限制性术语,并且并非意图使用此类术语和表达方式排除未来显示和描述的任何等同形式或其任何部分,并且应当认识到,在所要求保护的本发明的范围内可以进行各种修改。因此,应当理解,尽管本发明已经通过优选实施方案和任选特征进行了具体公开,但是本领域技术人员可以借助本文公开的发明的修改和变化,并且这些修改和变化被认为是在本文公开的发明的范围内。在本文中已对这些发明进行了广义和一般性的描述。落入一般公开的范围的每个较窄的种类和亚属类也构成这些发明的一部分。这包括每个发明的一般性描述,并且从属类(genus)中去除任何主题的条件或否定限制,无论所去除的物质是否专门存在于其中。
[0164]
另外,在以马库什组来描述发明的特征或方面的情况下,本领域技术人员将认识到,因此本发明也以马库什组的任何单个成员或成员的亚组来描述。还应理解,以上描述仅是说明性的而非限制性的。许多实施方案对于本领域普通技术人员而言,在回顾了以上描述后将是显而易见的。因此,本发明的范围应不参照以上描述来确定,而是应当参考所附的权利要求书以及这些权利要求书所享有的等效方式的全部范围来确定。所有文章和参考文献的公开内容,包括专利出版物,都通过引用结合在此。
[0165]
对于本领域技术人员将显而易见的是,根据上述教导,所描述的实施例和实施方案的多种修改和变化是可能的。所公开的实施例和实施方案可以包括本文所公开的一些或所有特征。因此,意图涵盖可能落入本发明的真实范围内的所有这样的修改和替代实施方案。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。