1.本发明涉及传染病检测技术领域,具体而言,涉及细胞因子作为标记物在制备肺外结核诊断或治疗预后产品中的应用。
背景技术:
2.结核病是当前人类面临的严重公共卫生安全威胁之一,也是单一传染病中死亡人数最多的疾病。世界卫生组织(who)最新的全球结核病报告数据显示:2019年全球新发结核病患者约1000万,其中16%属于肺外结核。骨关节结核是一种常见的肺外结核,发生比例约占全部结核病的5%。由于骨关节结核临床症状不典型、脓液/骨组织等标本的难获得性,以及标本中少菌的状态,诊断延误和治疗方案缺乏针对性的情况非常普遍,由此常导致严重的并发症,如病变累及脊柱可引起截瘫,累计关节可导致关节畸形、活动受限,严重影响患者的身心健康,给家庭和社会带来巨大危害。制定合理有效的化疗方案是成功治疗骨结核、减少并发症的关键。
3.骨关节结核具有治疗周期长的特点,一般情况下化疗方案需要实施12~18个月,而耐药骨关节结核的治疗常需18~24个月,即使结合了手术治疗,化学治疗的疗程也长达18个月。在治疗过程中,所采用方案是否有效依靠评估患者症状体征和影像学改善情况,结合可以获得的细菌学检查结果进行综合判断。由于骨关节结核留取标本为有创取样,限制了治疗随访过程中细菌学检测的开展,而症状体征和影像学的变化,又有明显的滞后性且易受主观因素影响。无法及时发现治疗效果不佳的患者并调整方案,不仅延长了患者罹患疾病的痛苦,且易于发生耐药,还会增加关节畸形、活动受限等后遗症的发生几率。寻找能够早期预测结核病疗效和预后的诊断标识物,是临床迫切需要关注的重要问题,也是结核病研究领域的热点问题。
4.已有研究证实结核病患者血液中一些特定细胞因子的浓度会升高,但这种升高是否会随着疾病进展而发生变化?细胞因子水平是否会在治疗过程中逐步降低并回归至正常水平?能否通过动态监测患者血清中细胞因子浓度的变化作为早期疗效评价的指标?上述研究尚未有所报道。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一些特定的细胞因子作为标记物在制备肺外结核诊断或治疗预后产品中的应用,从而为早期预测结核病疗效提供有力的根据。本发明的提出,有利于及时发现治疗效果不佳的患者,根据疗效及时调整治疗方案,进而缩短患者治疗疗程。本发明的提出有利于成功治疗骨结核,减少并发症的发生。
7.本发明是这样实现的:
8.本发明提供了细胞因子作为标记物在制备肺外结核诊断或治疗预后产品中的应
用,细胞因子选自ip-10、il-2rα和mcp-1中的至少一种。
9.发明人研究发现,结核分枝杆菌体外感染巨噬细胞后,与未感染组相比,细胞因子ip-10、il-2rα、mcp-1的表达水平显著升高。经过反复验证,确认上述细胞因子可用于诊断是否感染结核分枝杆菌。可用于诊断肺外结核病。
10.发明人针对肺外结核患者治疗前和治疗后的疗效进行调查,针对治疗前后的细胞因子表达水平研究发现,上述细胞因子还可以用于治疗效果预测。不同的细胞因子在治疗前和抗结核治疗早期的表达水平有显著差异,可以用于预测疗效。上述细胞因子的筛选,有利于及时发现治疗效果不佳的患者,根据疗效及时调整治疗方案,进而缩短患者治疗疗程。本发明的提出有利于成功治疗骨结核,减少并发症的发生。
11.在本发明应用较佳的实施方式中,上述肺外结核选自骨关节结核。研究发现,上述细胞因子可以用于早期预测骨关节结核病疗效和预后的诊断标识物。
12.在本发明应用较佳的实施方式中,上述诊断或治疗预后产品包括不限于试剂、试剂盒和芯片。
13.在本发明应用较佳的实施方式中,细胞因子作为标记物在制备肺外结核诊断产品中的应用时,标记物以细胞因子ip-10、il-2rα、mcp-1、il-6、il-10和il-12p40为共同标记物。
14.研究发现,当结核分枝杆菌感染巨噬细胞时,相比于未感染组,感染组的细胞因子ip-10、il-2rα、mcp-1、il-6、il-10和il-12p40的表达水平升高,表明上述细胞因子可以作为共同标记物,用于体外诊断肺外结核。
15.在本发明应用较佳的实施方式中,细胞因子作为标记物在制备肺外结核治疗预后产品中的应用时,标记物以细胞因子ip-10、il-2rα和mcp-1为共同标记物。
16.在本发明应用较佳的实施方式中,上述治疗预后是用于肺外结核治疗后0-8周的疗效预测。
17.在本发明应用较佳的实施方式中,上述治疗预后包括如下至少一种情形:
18.若治疗后0-8周的患者血清中的ip水平持续上升,则预判治疗预后良好;若ip水平无明显变化,则预判治疗预后不佳。
19.若治疗后0-8周的患者血清中的mcp-1水平持续上升,则预判治疗预后良好;若mcp-1水平无明显变化,则预判治疗预后不佳。
20.若治疗后1-8周的患者血清中的il-2rα水平相比于治疗前,先下降,持续增加,则预判治疗预后良好;
21.若治疗后1-8周的患者血清中的il-2rα水平相比于治疗前,先保持稳定至第三周开始明显上升,则预判治疗预后不佳。
22.本发明还提供了细胞因子作为标记物在制备病原菌类型鉴定产品中的应用,细胞因子选自ip-10、mcp-1、il-10和il-6中的至少一种,病原菌类型鉴定产品用于区分样本属于结核分枝杆菌感染和非结核分枝杆菌感染。
23.发明人发现,ip-10、mcp-1、il-10和il-6还可区分mtb和ntm感染,具有菌种特异性。
24.在本发明应用较佳的实施方式中,上述鉴定产品选自试剂、试剂盒和芯片。
25.在本发明应用较佳的实施方式中,上述标记物以细胞因子ip-10、mcp-1、il-10和
il-6为共同标记物。
26.本发明具有以下有益效果:
27.本发明发现:结核分枝杆菌体外感染巨噬细胞后,与未感染组相比,细胞因子ip-10、il-2rα、mcp-1的表达水平显著升高。即上述细胞因子可用于诊断是否感染结核分枝杆菌,用于诊断肺外结核病。
28.发明人针对肺外结核患者治疗前和治疗后的疗效进行调查,针对治疗前后的细胞因子表达水平研究发现,上述细胞因子还可以用于治疗效果预测。不同的细胞因子在治疗前和抗结核治疗早期的表达水平有显著差异,可以用于预测疗效。上述细胞因子的筛选,有利于及时发现治疗效果不佳的患者,根据疗效及时调整治疗方案,进而缩短患者治疗疗程。本发明的提出有利于成功治疗骨结核,减少并发症的发生。
29.ip-10、mcp-1、il-10和il-6还可用于区分mtb和ntm感染,具有菌种特异性。
附图说明
30.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
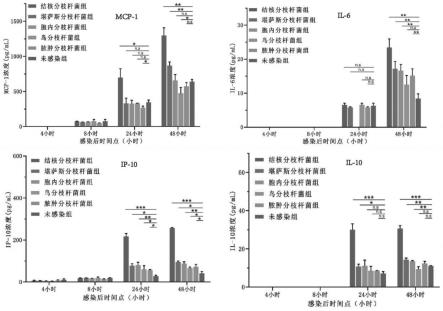
31.图1为mcp-1、il-6、ip-10以及il-12p40在分枝杆菌感染细胞的表达情况;
32.图2为ip-10在21例骨关节结核患者血清中的表达水平;
33.图3为mcp-1在21例骨关节结核患者血清中的表达水平;
34.图4为il-2rα在21例骨关节结核患者血清中的表达水平。
具体实施方式
35.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
36.除非另外指明,否则实践本发明将采用细胞生物学、分子生物学(包含重组技术)、微生物学、生物化学和免疫学的常规技术,所述常规技术在本领域技术人员的能力范围内。文献中充分解释了这种技术,如《分子克隆:实验室手册(molecular cloning:a laboratory manual)》,第二版(sambrook等人,1989);《寡核苷酸合成(oligonucleotide synthesis)》(m.j.gait编,1984);《动物细胞培养(animal cell culture)》(r.i.freshney编,1987);《酶学方法(methods in enzymology)》(学术出版社有限公司(academic press,inc.);《实验免疫学手册(handbook of experimental immunology)》(d.m.weir和c.c.blackwell编);《哺乳动物细胞用基因转移载体(gene transfer vectors for mammalian cells)》(j.m.miller和m.p.calos编,1987);《当代分子生物学方法(current protocols in molecular biology)》(f.m.ausubel等人编,1987);《pcr:聚合酶链反应(pcr:the polymerase chain reaction)》(mullis等人编,1994);以及《当代免疫学方法(current protocols in immunology)》(j.e.coligan等人编,1991),所述文献中的每个文
献均通过引用明确并入本文中。
37.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
38.以下结合实施例对本发明的特征和性能作进一步的详细描述。
39.实施例1
40.1.不同分枝杆菌感染巨噬细胞的细胞上清收集方法
41.(1)感染分枝杆菌菌种
42.结核分枝杆菌标准菌株h37rv和4种非结核分枝杆菌标准菌株(堪萨斯分枝杆菌、胞内分枝杆菌、鸟分枝杆菌、脓肿分枝杆菌)均来自于国家结核病临床实验室的样本资源库。
43.(2)诱导thp-1为巨噬细胞
44.将thp-1细胞,用完全培养基(加入10%fbs的1640培养基)培养,将细胞浓度调整为5
×
105cells/ml。加入终浓度为10μg/ml的pma诱导24小时,诱导thp-1贴壁生长。将含pma的细胞悬液加至培养板上,细胞量为1
×
106,每孔为2ml。铺匀培养板中细胞,置于细胞培养箱中,37℃孵育24小时。
45.(3)结核分枝杆菌和非结核分枝杆菌感染巨噬细胞
46.感染前先吸去未贴壁细胞的上清,用1640培养基后清洗两次去除pma,再加入完全培养液2ml,置于细胞培养箱。取出接种于中性罗氏培养基的mtb标准菌株h37rv和4种ntm标准株,刮取菌落至无菌磨菌瓶中,充分涡旋震荡后,加入完全培养基重悬并稀释,使每种菌液最终od600为0.6。按照moi=1,即细菌数目:细胞数=1:1,将上述菌液用完全培养基进行稀释,使菌液终浓度为5
×
105cfu/ml。取出已贴壁巨噬细胞的培养板,吸去每孔中的上清后,将上述菌液加入六孔培养板中,每孔2ml,一式三份作为重复。将六孔培养板置于细胞培养箱孵育,计时为感染时间。在感染2小时,取出感染后的细胞,吸去每孔中的上清,加入1640培养基后轻晃,再吸去上清,重复两次,清洗胞外菌,再加入完全培养液2ml,置于细胞培养箱孵育。
47.(4)收集感染模型的细胞上清
48.分别于感染4、8、24和48小时收集分枝杆菌感染后的细胞上清。细胞上清用无菌注射器吸取上清,经0.22μm无菌针式过滤器除去细菌。将所得上清分装于ep管,-80℃冰箱保存备用。
49.2.液相芯片技术检测细胞因子水平
50.将存于-80℃冰箱的细胞上清取出,解冻并平衡至室温。将融解的样本涡旋震荡,充分混匀。取上清75μl样品至ep管中,加入75μl多因子试剂盒中的稀释液进行2倍稀释,充分吹打混匀。将制备好的标准品和待测样本加入到多因子检测试剂盒(magneticassay)提供的96孔板中,每孔50μl。向避光瓶中加入5ml稀释液rd2-1。
51.取出human magnetic premixed micro particle cocktail,先以1000g离心30秒,再涡旋1分钟重悬磁珠,吸取500μl加入避光瓶中,充分混匀。再向96孔板中加入磁珠稀释液,每孔50μl。将96孔板贴上避光锡箔膜,置于水平振荡器上,室温下800rpm孵育2小时。
将上述孵育后的96孔板取下,置于磁性分离板上,使孔中磁珠留于底部;撕下锡箔膜,倒掉液体;除去磁性分离板,每孔加入100μl洗液,重悬并冲洗磁珠;将96孔板置于磁性分离板上1分钟,再倒掉洗液;重复此清洗步骤三次,将96孔板从磁性分离板上取下。加生物素-抗体cocktail:取出试剂,先以1000g离心30秒,再涡旋1分钟,吸取500μl与5ml稀释液rd2-1充分混匀。再向96孔板中加入生物素抗体cocktail稀释液,每孔50μl。孵育:将96孔板贴上避光锡箔膜,rt,800rpm,1小时。按上述步骤进行洗板。
52.加streptavidin-pe:取出streptavidin-pe concentrate,先以1000g离心30秒,再涡旋1分钟,吸取220μl与5.35ml洗液充分混匀。再加入上述试剂,每孔50μl。再次贴上避光膜,rt,800rpm,30分钟。按上述步骤进行洗板。向96孔板加入洗涤缓冲液重悬微粒,每孔100μl。置于水平振荡器上,室温下800rpm孵育2分钟,即放入多功能液态芯片分析仪200tm(luminex公司,美国)读数。
53.当mtb感染巨噬细胞时,ip-10、mcp-1、il-10和il-12p40均高水平表达,当感染时间达到48小时,il-6和tnf-α的表达量也升高。同时,ip-10、mcp-1、il-10和il-6还可区分mtb和ntm感染,可能具有菌种特异性(图1)。
54.实施例2
55.本实施例对21骨关节结核患者中血清细胞因子与疗效进行初步评价。
56.(1)骨关节结核患者的血清样本收集
57.采集患者各时间点的静脉血3~4ml于真空促凝采血管中;将标本以1000g离心15分钟;用移液器吸取血清,分装至ep管,-80℃保存备用。
58.(2)液相芯片技术检测细胞因子水平
59.将存于-80℃冰箱的患者样本取出,解冻并平衡至室温。将融解的样本涡旋震荡,充分混匀。取上清75μl样品至ep管中,加入75μl多因子试剂盒中的稀释液进行2倍稀释,充分吹打混匀。将制备好的标准品和待测样本加入到多因子检测试剂盒(magneticassay)提供的96孔板中,每孔50μl。向避光瓶中加入5ml稀释液rd2-1。
60.取出human magnetic premixed micro particle cocktail,先以1000g离心30秒,再涡旋1分钟重悬磁珠,吸取500μl加入避光瓶中,充分混匀。再向96孔板中加入磁珠稀释液,每孔50μl。将96孔板贴上避光锡箔膜,置于水平振荡器上,室温下800rpm孵育2小时。将上述孵育后的96孔板取下,置于磁性分离板上,使孔中磁珠留于底部;撕下锡箔膜,倒掉液体;除去磁性分离板,每孔加入100μl洗液,重悬并冲洗磁珠;将96孔板置于磁性分离板上1分钟,再倒掉洗液;重复此清洗步骤三次,将96孔板从磁性分离板上取下。
61.加生物素-抗体cocktail:取出试剂,先以1000g离心30秒,再涡旋1分钟,吸取500μl与5ml稀释液rd2-1充分混匀。再向96孔板中加入生物素抗体cocktail稀释液,每孔50μl。孵育:将96孔板贴上避光锡箔膜,rt,800rpm,1小时。按上述步骤进行洗板。
62.加streptavidin-pe:取出streptavidin-pe concentrate,先以1000g离心30秒,再涡旋1分钟,吸取220μl与5.35ml洗液充分混匀。再加入上述试剂,每孔50μl。再次贴上避光膜,rt,800rpm,30分钟。按上述步骤进行洗板。向96孔板加入洗涤缓冲液重悬微粒,每孔100μl。置于水平振荡器上,室温下800rpm孵育2分钟,即放入多功能液态芯片分析仪200
tm
(luminex公司,美国)读数。
63.结核患者血清中ip-10表达量参照图2所示,图2显示预后良好组的ip-10水平持续
上升,而预后不佳组则无明显变化。在治疗前和治疗早期(8周内),预后良好组的ip-10水平表达量高于预后不佳组(p《0.05)。可见,骨关节结核患者在治疗前和抗结核治疗早期,ip-10的表达水平在不同预后组间有差异。
64.结核患者血清中mcp-1表达量参照图3所示,图3显示在骨关节结核组中,预后良好组的mcp-1表达量在治疗早期(8周内)呈上升趋势,预后不佳组则无明显规律变化。在抗结核治疗后第2周,预后不佳组的血清mcp-1表达水平显著高于预后良好组。
65.结核患者血清中il-2rα表达量参照图4所示,图4显示在骨关节结核患者的血清中,在开始治疗的早期,预后良好组的细胞因子表达量较治疗前先下降,而后持续增加,且高于预后不佳组。而预后
66.不佳组的il-2rα水平先保持稳定至第3周开始明显上升。所以,在治疗前和治疗后2周,预后良好组的il-2rα表达水平均高于预后不佳组(p《0.05)。而在治疗后第1周和第3周,预后良好组与预后不佳组的il-2rα表达量差距减小(p》0.05)。
67.综上,本发明对21例骨结核患者治疗前、抗结核治疗2周后、4周和8周后的血标本进行上述细胞因子的检测,发现ip-10和il-2rα在预后良好组与预后不良组间除了绝对浓度存在显著性差异之外,预后良好组还显示出细胞因子水平上升幅度更加明显的趋势。此外,预后良好组的mcp-1表达量在治疗早期呈上升趋势,预后不佳组则无明显规律变化。因此,骨关节结核患者在早期治疗过程中细胞因子ip-10、il-2rα和mcp-1的浓度水平及变化趋势与疗效相关,有望应用于骨关节结核的疗效预测,可用于开发相应的检测试剂盒。
68.以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。