1.本发明涉及达托霉素制备技术领域,尤其涉及一种注射用达托霉素及其制备方法。
背景技术:
2.随着新型抗生素的不断出现,细菌对抗生素的耐药性不断升级,注射用达托霉素被称为抗耐药性抗生素的“最后一道防线”。达托霉素的作用机制不同于任何其他的抗生素,达托毒素与细菌细胞膜结合,并引起细胞膜电位的快速去极化。细胞膜电位的这种缺失抑制dna、rna和蛋白质的合成,最终导致细菌细胞死亡。正是由于它独特的性质,可迅速杀死病原菌,使耐药菌产生的几率大大降低,且不会受到来自其他抗生素所致交叉耐药性的影响。与传统抗生素给药(至少1日2次)相比,注射用达托霉素仅需1日1次用药,有效降低医疗成本支出,且还能治疗不能耐受其他抗生素治疗的患者。
3.然而达托霉素稳定性差,杂质多且复杂,质轻且吸潮易诱发粘性,在水中溶解度低,呈现出ph依赖性,溶解后非常容易起泡、发粘结团及产生降解。因此在制剂过程中原料药存在溶解时间长、冻干效果差、杂质多、稳定性差等问题。
技术实现要素:
4.本发明提供了一种注射用达托霉素及其制备方法,以解决达托霉素制剂存在溶解时间长、冻干效果差、杂质多、稳定性差的技术问题。
5.为了解决上述技术问题,本发明目的之一提供了一种注射用达托霉素的制备方法,包括以下步骤:
6.(1)取部分水进行配制,控制水温在2-8℃;
7.(2)在搅拌状态下预先缓慢加入少量达托霉素,待药液ph下降至4.0时同步加入浓度0.1-3.0mol/l的ph调节剂,达托霉素持续添加,同步调节药液ph值保持在4.0-7.0之间范围内,直至达托霉素完全溶解,达托霉素总添加重量份为50份-150份;
8.(3)达托霉素溶解完全后,调节药液终点ph值维持在4.0-7.0,再加水至总重量1000份;
9.(4)将药液过滤后灌装,进入冻干设备中冻干,制得浅黄色疏松块状物;
10.在步骤(4)中,冻干工艺包括以下步骤:
11.s01、预冷:进箱温度0-5℃;
12.s02、预冻:降温至-30℃~-45℃,保持2-4小时;
13.s03、升华:开启真空泵,抽真空至20pa以下,以15-20℃/h速度匀速升温至-5℃-0℃,保持10-15小时:
14.s04、干燥:以20-25℃/h速度匀速升温至20℃-25℃,干燥4-8小时;
15.s05、保温结束后,真空压塞,复压,出箱。
16.作为优选方案,在步骤(1)中,配制用水为总体积量的20%-70%。
17.作为优选方案,在步骤(2)中,所述ph调节剂为盐酸、乳酸、醋酸、磷酸、磷酸氢二钠、枸橼酸、枸橼酸钠、碳酸氢钠、氢氧化钠溶液中的一种或多种。
18.作为优选方案,所述ph调节剂为氢氧化钠溶液。
19.作为优选方案,在步骤(4)中,所述药液通过两级0.22μm除菌过滤器过滤。
20.作为优选方案,在步骤(2)中,所述达托霉素的总添加重量份为75份-125份。
21.作为优选方案,在步骤(3)中,调节药液终点ph值为4.0-5.0。
22.通过采用上述方案,药液ph值越高,达托霉素溶解速率越快,配制时间越短,但主要降解杂质也会随着ph升高而增加,限定药液终点ph值为4.0-5.0,综合考虑控制杂质降解速率可接受的范围内。
23.为了解决上述技术问题,本发明目的之二提供了一种注射用达托素霉,采用上述一种注射用达托霉素的制备方法制备获得。
24.相比于现有技术,本发明实施例具有如下有益效果:
25.本发明专利中的制备方法通过对配液过程中药液温度、ph的控制、物料加入溶解的先后顺序等,并结合对预冻温度、升华温度、真空度、解析干燥温度计时间等冻干参数的优化,解决了达托霉素药液配制过程中发粘结团、配液效率低及降解生成杂质多等难点,使用的辅料较少,冻干效率高,冻干质量好,产品质量及储存稳定性明显改善。
具体实施方式
26.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
27.实施例1-7
28.一种注射用达托霉素,如表1所示,具体包括以下制备步骤:
29.(1)取配制总体积量20%~70%的注射用水,开启搅拌,控制水温在2-8℃;
30.(2)在搅拌状态下预先缓慢加入少量达托霉素,待药液ph下降至4.0时同步加入0.1-3.0mol/l的氢氧化钠溶液,达托霉素持续添加,同步调节药液ph值保持在4.0-7.0之间范围内,直至达托霉素完全溶解;
31.(3)达托霉素溶解完全后,调节药液终点ph值维持在4.0-7.0,再加注射用水至1000ml;
32.(4)将药液通过两级0.22μm除菌过滤器过滤至缓冲罐中,灌装,进入冻干机中冻干,冻干后制得浅黄色疏松块状物,冻干工艺如下:
33.①
预冷:进箱温度0℃;
34.②
预冻:降温至-45℃,保持3小时;
35.③
升华:开启真空泵,抽真空至20pa以下,以15℃/h速度匀速升温至-5℃,保持12小时:
36.④
干燥:以25℃/h速度匀速升温至25℃,干燥6小时;
37.⑤
保温结束后,真空压塞,复压,出箱。
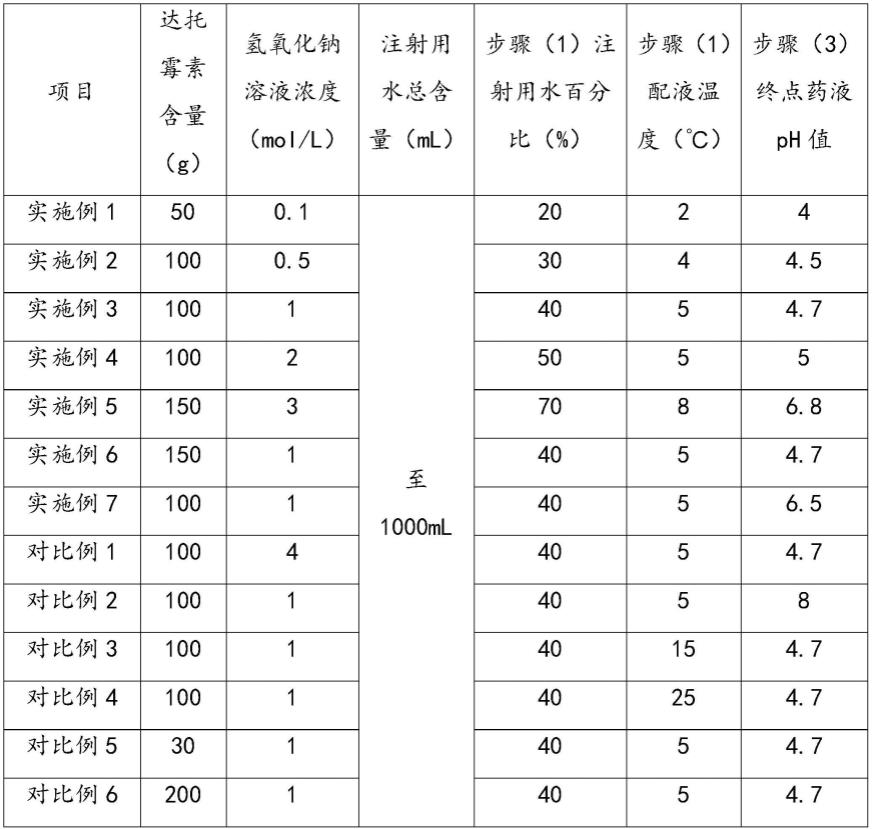
38.表1-本技术实施例1-7和对比例1-6中各组分及工艺参数
[0039][0040]
对比例7
[0041]
一种注射用达托霉素,具体包括以下制备步骤:
[0042]
(1)取配制总体积量40%的注射用水,开启搅拌,控制水温在5℃;
[0043]
(2)预先加入浓度1mol/l氢氧化钠溶液调节ph为10-12,在搅拌状态下缓慢加入100g达托霉素,直至达托霉素完全溶解;
[0044]
(3)达托霉素溶解完全后,调节药液终点ph值至4.7,再加注射用水至1000ml;
[0045]
(4)将药液通过两级0.22μm除菌过滤器过滤至缓冲罐中,灌装,进入冻干机中冻干,冻干工艺如下:
[0046]
①
预冷:进箱温度0℃;
[0047]
②
预冻:降温至-45℃,保持3小时;
[0048]
③
升华:开启真空泵,抽真空至20pa以下,以15℃/h速度匀速升温至-5℃,保持12小时:
[0049]
④
干燥:以25℃/h速度匀速升温至25℃,干燥6小时;
[0050]
⑤
保温结束后,真空压塞,复压,出箱。
[0051]
对比例8-10
[0052]
一种注射用达托霉素,各步骤及各步骤使用试剂、工艺参数均与实施例3相同,不
同的地方在于,在步骤(4)中,如表2所示,冻干工艺步骤如下:
[0053]
①
预冷:进箱温度0℃;
[0054]
②
预冻:降温至-20-45℃,保持3小时;
[0055]
③
升华:开启真空泵,抽真空至20pa以下,以15℃/h速度匀速升温至-10℃-5℃,保持12-20小时:
[0056]
④
干燥:以25℃/h速度匀速升温至15-25℃,干燥6小时;
[0057]
⑤
保温结束后,真空压塞,复压,出箱。
[0058]
表2-本技术对比例8-10中冻干工艺参数
[0059]
项目预冻温度预冻时间升华温度升华时间干燥温度干燥时间对比例8-20℃3小时-5℃12小时25℃6小时对比例9-45℃3小时-10℃20小时25℃6小时对比例10-45℃3小时-5℃12小时15℃6小时
[0060]
表3-实施例1-7和对比例1-10的配液时间
[0061][0062][0063]
性能检测试验
[0064]
1、稳定性考察:采用hplc检测实施例和对比例样品复溶后放置不同时间的内酯水解物、β异构体、脱水达托霉素含量,复溶的方式为采用10ml 0.9%氯化钠溶解500mg样品,检测时间分别为0h、4h、8h、12h、16h、20h、24h:
[0065]
1)供试品溶液:取实施例和对比例的样品用流动相溶解并稀释成每1ml约含1.0mg的溶液;
[0066]
2)对照品溶液:精密量取供试品溶液1ml,置100ml量瓶中,用稀释液稀释至刻度,摇匀;
[0067]
3)色谱条件:色谱柱:phenomenex ib-sil c8柱,5μm,250
×
4.6mm;流动相:ph3.25的磷酸二氢铵溶液-乙腈(67:33);检测波长:214nm;流速:1.5ml/min;进样体积:20μl;
[0068]
4)试验步骤:精密量取供试品溶液20μl注入液相色谱仪,供试品溶液色谱图中如有杂质峰,按自身对照法计算各杂质的含量,结果如表4-5所示。
[0069]
2、冻干效果检测:本技术实施例和对比例的成品关于冻干现象、酸度、水分和复溶
时间性能的检测方法如下所示,检测结果如表6所示:
[0070]
1)冻干现象:目测冻干产品;
[0071]
2)酸度:根据中国药典2020版四部通则0631标准检测;
[0072]
3)水分:根据中国药典2020版四部通则0832第一法(费休氏法)标准检测;
[0073]
4)复溶时间:取实施例或对比例样品500mg,将10ml 0.9%氯化钠注射液采用注射器针头靠在瓶壁上缓缓加入,轻轻转动瓶子,确保粉末全部浸入,轻转动或晃动瓶子数分钟,直到溶液完全溶解,记录复溶时间。
[0074]
表4-本技术实施例1-7的药液24小时的稳定性考察结果
[0075][0076]
[0077]
表5-本技术对比例1-7的药液24小时的稳定性考察结果
[0078][0079]
表6-本技术实施例1-5和对比例1-10的冻干效果检测
[0080][0081]
结合表4-5的性能检测结果可知,与对比例1-7相比,实施例1-7控制药液制备过程中的ph、配液温度、氢氧化钠浓度以及达托霉素的浓度,所配制的达托霉素药液在不同存放时间下,24小时内主要降解杂质均无明显增加,说明药液稳定性较高。
[0082]
对比例1增加调节药液ph值的氢氧化钠溶液浓度至4.0mol/l,对比例2增大了药液的终点ph值至8.0,对比例7配液时先加入氢氧化钠溶液后再加入达托霉素溶解,均导致杂质内酯水解物和β异构体的明显增加;对比例3和4均增加了步骤(1)中药液的配制温度为15-25℃,导致了杂质脱水达托霉素的明显增加。由此说明,在药液配制过程中,控制氢氧化钠溶液浓度在0.1-3.0mol/l之间,配液温度控制在2-8℃,终点药液ph值控制在4.0-7.0之间,可以保证药液存放24小时内降解杂质不会明显增加,提高药液的储存稳定性。
[0083]
同时在药液配制期间,药液ph值越高,达托霉素溶解速率越快,配制时间越短,但主要降解杂质(内酯水解物)也会随着ph升高而增加,综合考虑在杂质降解速率可接受的范围内,实施例3的工艺选择可以获得杂质较低且配置时间短的注射用达托霉素。
[0084]
结合表6中实施例3和对比例5-6的性能检测结果可知,冻干药液中的达托霉素浓
度过高或过低时,均会造成冻干效果不佳,块状产品出现萎缩分层或开裂现象,达托霉素浓度过低时,冻干后的产品水分较大且复溶时间较长。
[0085]
结合表2中对比例8-10的冻干工艺参数以及表6的性能检测结果可知,冻干参数中预冻、升华和解析干燥的温度过高或过低时,均会造成冻干效果不佳和冻干时间延长,其部分产品会出现萎缩分层现象,冻干后的产品水分较大且复溶时间较长。
[0086]
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步的详细说明,应当理解,以上所述仅为本发明的具体实施例而已,并不用于限定本发明的保护范围。特别指出,对于本领域技术人员来说,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。