一种合成
13
c标记的4-三氟甲基甲酸芳酯的方法及应用
技术领域
1.本发明属于有机合成领域,具体涉及一种基于h
13
co2na试剂合成
13
c标记的4-三氟甲基甲酸芳酯的方法及应用。
背景技术:
2.稳定同位素标记的试剂是一种具有高附加值和高技术含量的科研用试剂,
11
c、
13
c和
14
c同位素是标记有机小分子的理想工具,可以在不改变其性质和活性的情况下,无痕插入稳定或放射性标记。与放射性碳同位素(
11
c和
14
c)相比,
13
c是一种不需要专门操作设备的稳定性同位素,具有无放射性、无环境污染、无需放射设备和防辐射措施等优势。
13
c同位素在合成化学、食品安全、环境科学、生命科学研究中被广泛应用。
3.甲酸芳酯在碱的作用下可以温和的方式释放一氧化碳分子,利用甲酸苯酯作为co替代源,在钯催化条件下实现的羰基化反应相继被不断报道([1]org.lett.2012,14,3100;[2]org. lett.2012,14,5370;[3]org.lett.2014,16,186;[4]angew.chem.int.ed.2014,53,3183.)。而利用
13
c标记的甲酸芳酯参与反应合成带有同位素标记的产物的报道仅两例([5]org.biomol. chem.2015,13,10341
–
10347;[6]org.biomol.chem.2016,14,3047
–
3052.),在这一领域有很大的改进与发展的空间。
技术实现要素:
[0004]
为了解决现有技术中存在的不足,本发明提供一种基于h
13
co2na试剂合成
13
c标记的 4-三氟甲基甲酸芳酯的方法。该方法所用的反应条件温和,制备过程简单,提供了一种新的合成路径。
[0005]
本发明提供的技术方案具体如下:
[0006]
第一方面,本发明提供一种基于h
13
co2na试剂合成
13
c标记的4-三氟甲基甲酸芳酯的方法,包括以下步骤:
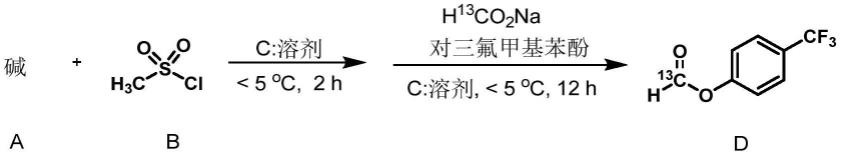
[0007]
以碱a、甲磺酰氯b、对三氟甲基苯酚、h
13
co2na为起始原料,于有机溶剂c中搅拌反应至完全,反应结束后将反应物过滤分离纯化即可得到式d所示的
13
c标记的4-三氟甲基甲酸芳酯化合物。
[0008]
进一步,所述方法,包括以下更具体的步骤:将碱a和甲磺酰氯b溶于有机溶剂c中,低温搅拌混匀;加入4-三氟甲基苯酚和h
13
co2na,保持低温进行反应,反应结束后将反应物过滤分离纯化即可得到式d所示的
13
c标记的对三氟甲基甲酸芳酯化合物。
[0009]
反应方程式如下:
[0010][0011]
进一步,所述碱a为甲酸钠、乙酸钠、乙酸钾、叔丁醇钠、碳酸钠、甲醇钠、氢氧化钠
中的任意一种或几种。优选的碱a为乙酸钠。
[0012]
进一步,所述溶剂c为四氢呋喃、1,4-二氧六环、n,n-二甲基甲酰胺、甲苯、乙腈中的任意一种或几种。优选溶剂c为乙腈。
[0013]
进一步,各原料的投料摩尔比为碱a:甲磺酰氯b:4-三氟甲基苯酚:h
13
co2na =1.0:1.0:1.0:1.0。优选的,碱a:甲磺酰氯b:4-三氟甲基苯酚:h
13
co2na=1.0:1.0:1.0:1.0。
[0014]
进一步,所述反应在空气环境中进行。
[0015]
进一步,所述反应温度低于5℃。优选的,反应温度为0℃~5℃。
[0016]
进一步,所述反应时间为12-24h。优选反应时间为12h。
[0017]
进一步,所述反应物分离的方法为将反应混合物过滤、浓缩和柱层析纯化。
[0018]
更进一步,所述过滤的方法为使用二氯甲烷洗涤;所述浓缩过程可采用低温减压蒸馏等方法,例如用旋转蒸发仪低温减压浓缩;所述纯化方法可采用柱层析分离纯化。
[0019]
第二方面,本发明提供一种
13
c标记的异色满酮类化合物的合成方法,包括第一方面所述的合成
13
c标记的4-三氟甲基甲酸芳酯的方法,还包括以下步骤:
[0020]
在保护气体氛围下,以芳基碘化物、化合物m为起始原料,在钯催化剂e、膦配体f、降冰片烯衍生物g和碱h的作用下,于有机溶剂i中与化合物d和碱j于溶剂k中产生的一氧化碳搅拌反应至完全,反应温度为40-100℃,反应结束后将反应物分离即可得到式l 所示的异色满酮类化合物;
[0021]
反应方程式如下:
[0022][0023]
其中,r1为烷基、芳基、酯基、酰胺基、烷氧基、苄氧基、叔丁氧羰基、卤素中的一种或几种,r1在芳环上的取代位置限定于2-5位;r2为氢、烷基、芳基、酯基、羟基、酰胺基、烷氧基、苄氧基、卤素、卤代烷基、叔丁基二甲基硅氧基、天然产物衍生物如赤霉素、雌酚酮中的一种或几种;r3为烷基、芳基、磺酰基中的一种或几种。
[0024]
进一步,所述保护气体选自氩气或氮气。优选为氩气。
[0025]
进一步,r1、r2和r3的基团中,所述烷基为具有1~16个碳原子的烷基,包括甲基、乙基、异丙基、癸基、十六烷基等;芳基为苯基、稠环芳环及取代芳烃,取代基包括c1-c6 烷基、c1-c6烷氧基、卤素等;酯基为-coor,其中r为具有1~3个碳原子的烷基,包括甲基等;烷氧基是指具有1~10个碳原子的烷氧基,包括甲氧基等;卤素是指氟、氯、溴、碘;卤代烷基为c1-c6的卤代烷基;磺酰基包括对甲苯磺酰基等。
[0026]
进一步,所述钯催化剂e为pd(pph3)4、pd(dba)2、pd2(dba)3、pd(oac)2、pd(phcn)2cl2、 pd(mecn)2cl2、pdcl2、pdi2、[pd(allyl)cl]2中的任意一种或几种。优选的钯催化剂e为pd(oac)2。
[0027]
进一步,所述膦配体f为2-双环己基膦-2',4',6'-三异丙基联苯、2-二-叔丁膦基-2',4',6'-三异丙基联苯、2-双环己基膦-2'-(n,n-二甲基氨基)联苯、2-二叔丁基磷-2-(n,n-二甲氨基)联苯、三芳基膦、三(2-呋喃基)膦、双(2-二苯基磷苯基)醚中的任意一种或几种。优选的膦配体f 为2-双环己基膦-2',4',6'-三异丙基联苯或2-双环己基膦-2'-(n,n-二甲基氨基)联苯。
[0028]
进一步,所述降冰片烯衍生物g的结构式为:
[0029][0030]
其中:
[0031]
i)r3为左边五元环上的取代基,p代表取代基个数,0≤p≤8;r4为双键上的取代基, q代表取代基个数,0≤q≤2;
[0032]
ii)左边五元环上取代基数目为2个及2个以上时,可以相同,也可以不相同;双键上的取代基数目为2个时,可以相同,也可以不相同;
[0033]
iii)r3和r4取代基的种类可以相同,也可以不相同;
[0034]
iii)每个r3和r4独立地为酯基、羧基、氰基、酰胺基、烷氧基、芳基、杂环芳基、烷基或卤素中的一种或几种。
[0035]
更进一步,所述r3和r4的酯基为coor,r为碳数1~2的烷基,包括甲基、乙基;烷氧基为具有1~10个碳原子的烷氧基;芳基为苯基、稠环芳环及取代芳烃,取代基包括 c1-c6烷基、c1-c6烷氧基、卤素等;烷基碳数为具有1~6个碳原子的烷基,包括甲基、乙基、异丙基、己烷基等;卤素为氟、氯。优选的降冰片烯衍生物g为(1s,2s,4s)-2-降冰片烯-5-甲酰苯胺、(1s,2s,4s)-2-降冰片烯-5,6-乙二酰胺联苯或(1s,2s,4s)-2-降冰片烯-5,6-乙二酰胺喹啉作为共催化剂。
[0036]
进一步,所述碱h为为碳酸锂、碳酸钠、碳酸钾、碳酸铯、醋酸钠、醋酸钾、醋酸铯、磷酸三钾、甲酸钾、碳酸氢钠、碳酸氢钾、氢氧化钠、氢氧化钾、叔丁醇钠、叔丁醇钾中的任意一种或几种。优选的,碱h为为醋酸钾。
[0037]
进一步,所述溶剂i为甲醇、乙醇、异丙醇、叔丁醇、四氢呋喃、2-甲基四氢呋喃、乙醚、二甲基乙二醚、甲基叔丁基醚、1,4-二氧六烷、1,3-二氧六烷、二氯甲烷、1,2-二氯乙烷、氯仿、四氯化碳、c
4-12
的饱和烷烃、c
3-12
的氟代或者氯代烷烃、苯、甲苯、二甲苯、三甲苯、二甲亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、丙酮、n-甲基吡咯烷酮、乙腈、c
3-12
的饱和烷基腈中的任意一种或几种。优选的,溶剂i为n-甲基吡咯烷酮。
[0038]
进一步,所述碱j为碳酸氢钠、醋酸钠、碳酸铯、磷酸钾、三乙胺、三乙烯二胺、吡啶、 4-二甲氨基吡啶中的任意一种或几种;优选的,碱j为为三乙胺。
[0039]
进一步,溶剂k为甲醇、乙醇、异丙醇、叔丁醇、四氢呋喃、2-甲基四氢呋喃、乙醚、二甲基乙二醚、甲基叔丁基醚、1,4-二氧六烷、1,3-二氧六烷、二氯甲烷、1,2-二氯乙烷、氯仿、四氯化碳、c
4-12
的饱和烷烃、c
3-12
的氟代或者氯代烷烃、苯、甲苯、二甲苯、三甲苯、二甲亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、丙酮、n-甲基吡咯烷酮、乙腈、c
3-12
的饱和烷基腈中
的任意一种或几种。优选的,溶剂k为1,4-二氧六环。
[0040]
进一步,所述芳基碘化物:环氧化合物:4-三氟甲基苯酚c:催化剂e:膦配体f:降冰片烯衍生物g:碱h=1.0:3.0:1.2:0.05~0.1:0.12~0.24:0.2~0.5:1.5。
[0041]
进一步,所述反应物分离的方法为将反应混合物萃取、浓缩和柱层析纯化。所述萃取的方式,使用乙酸乙酯和饱和氯化钠溶液。所述浓缩过程可采用减压蒸馏等方法,例如用旋转蒸发仪减压浓缩。所述纯化方法可采用柱层析分离纯化。
[0042]
本发明的方法可以合成
13
c标记的4-三氟甲基甲酸芳酯、异色满酮类化合物以及二氢异喹啉酮类化合物,和现有技术相比,本发明具有以下有益效果:
[0043]
i)首次使用h
13
co2na试剂合成
13
c标记的4-三氟甲基甲酸芳酯,是现有合成
13
c标记的甲酸芳酯方法的重要补充,释放
13
c标记的一氧化碳分子参与反应。该反应在空气中进行,无需保护气体,操作简单,反应条件温和。
[0044]
ii)在合成
13
c标记的4-三氟甲基甲酸芳酯的基础上,进一步合成了
13
c标记的异色满酮类化合物及二氢异喹啉酮类化合物。
具体实施方式
[0045]
下面通过实例对本发明给予进一步说明,值得注意的是,本发明不仅限于下述的实施例。
[0046]
实施例1:化合物d的制备
[0047][0048]
取10ml的schlenk反应管,向其中加入乙酸钠(82mg,1.0mmol),甲磺酰氯(114.6mg, 1.0mmol),0.2ml的mecn,于5℃下搅拌2h后,向其中加入4-三氟甲基苯酚(162mg, 1.0mmol)和h
13
co2na(69mg,1.0mmol),在0℃-5℃的条件下反应12h。反应液过滤,用二氯甲烷洗涤,低温减压浓缩,经柱层析分离纯化得化合物d(黄色油状液体)。1h nmr (400mhz,cdcl3)δ8.60(s,0.5h),8.02(s,0.5h),7.69(d,j=8.5hz,2h),7.28(d,j=8.4hz, 2h);
13
c nmr(100mhz,cdcl3)δ158.5(
13
c-enriched),127.2(d,j=3.8hz),121.9(d,j=1.7 hz);
19
f nmr(377mhz,cdcl3)δ-62.4.
[0049]
在实施例1的基础上合成
13
c标记的异色满酮类化合物,反应方程式如下:
[0050][0051]
实施例2:化合物l-1的制备
[0052][0053]
在手套箱中,向干燥并装有磁力搅拌子的双室反应管的一氧化碳消耗室分别加入
醋酸钯 (2.3mg,0.01mmol)、2-双环己基膦-2',4',6'-三异丙基联苯(11.5mg,0.024mmol)、乙酸钾(29.4 mg,0.3mmol)和(1s,2s,4s)-2-降冰片烯-5-甲酰苯胺(8.6mg,0.04mmol)。然后加入2-甲基碘苯(43.6mg,0.2mmol),s-苄基缩水甘油醚(98.5mg,0.6mmol)和干燥的n-甲基吡咯烷酮(1.0ml);在一氧化碳生成室分别加入
13
c标记的4-三氟甲基甲酸苯酯(45.6mg,0.24 mmol)、三乙胺(24.3mg,0.24mmol)和干燥的1,4-二氧六环(1.0ml)。置于60℃在氩气保护氛围下反应16小时。一氧化碳消耗室的混合物用乙酸乙酯和饱和氯化钠溶液萃取,无水硫酸钠干燥,减压蒸馏除去溶剂,柱层析分离纯化得化合物l-1(淡黄色油状液体,78%产率,99%ee)。1h nmr(400mhz,cdcl3)δ7.40
–
7.28(m,6h),7.19(d,j=7.7hz,1h),7.08(d, j=7.5hz,1h),4.67
–
4.57(m,3h),3.79(dd,j=10.2,4.8hz,1h),3.72(dd,j=10.3,5.3hz, 1h),3.11(dd,j=16.1,11.6hz,1h),2.94(dd,j=16.1,3.0hz,1h),2.67(s,3h);
13
c nmr(100 mhz,cdcl3)δ164.5(
13
c-enriched),143.2(d,j=3.0hz),140.0(d,j=1.9hz),137.9,132.9, 131.2(d,j=4.6hz),128.7,128.0,127.9,125.5(d,j=3.6hz),123.8(d,j=68.4hz),76.7(d,j =1.8hz),73.8,71.3(d,j=2.8hz),31.6(d,j=3.3hz),22.4;hrms(esi-tof):calc’d for c
18 [
13
c]h
18
nao3[m na
]306.1182,found 306.1183;hplc:daicel chiralpak ig column,10%iproh in n
hexane,1ml/min,λ=230nm,tr(major)=19.382min,tr(minor)=20.910min;
ꢀ‑
99.057(c=0.61,chcl3).
[0054]
实施例3:化合物l-2的制备
[0055][0056]
操作步骤同实施例2,区别在于所使用的碘化物为邻碘苯乙酸甲酯(55.2mg)、醋酸钯 (4.5mg,0.1mmol)、2-双环己基膦-2',4',6'-三异丙基联苯(23.0mg,0.24mmol)、(1s,2s,4s)-2
‑ꢀ
降冰片烯-5,6-乙二酰胺联苯(31.5mg,0.5mmol),得化合物l-2(黄色油状液体,50%产率)。1h nmr(400mhz,cdcl3)δ7.46(t,j=7.6hz,1h),7.39
–
7.27(m,5h),7.20(dd,j=7.8,3.5 hz,2h),4.72
–
4.64(m,1h),4.62(d,j=1.3hz,2h),4.22(d,j=16.8hz,1h),3.95(d,j=16.9 hz,1h),3.79(dd,j=10.4,4.7hz,1h),3.75
–
3.71(m,1h),3.70(s,3h),3.16(dd,j=16.2,11.5 hz,1h),2.98(dd,j=16.2,3.1hz,1h);
13
c nmr(100mhz,cdcl3)δ172.0,164.5 (
13
c-enriched),140.3(d,j=1.8hz),138.2(d,j=2.6hz),137.9,133.2,131.7(d,j=4.6hz), 128.6,128.0,127.9,127.3(d,j=3.6hz),124.2(d,j=68.5hz),76.8(d,j=2.2hz),73.8,71.1 (d,j=2.7hz),52.1,40.6,31.3(d,j=3.2hz);hrms(esi-tof):calc’d for c
20
[
13
c]h
20
nao
5 [m na
]364.1236,found 364.1237.
[0057]
实施例4:化合物l-3的制备
[0058][0059]
操作步骤同实施例2,区别在于所使用的碘化物为2-甲基-3-氯碘苯(50.4mg),得化合物l-3(淡黄色固体,70%产率)。1h nmr(400mhz,cdcl3)δ7.49(d,j=8.1hz,1h),7.39
ꢀ–
7.28(m,5h),7.03(d,j=8.1hz,1h),4.66
–
4.54(m,3h),3.78(dd,j=10.3,4.8hz,1h),3.71 (dd,j=10.3,5.2hz,1h),3.07(dd,j=16.2,11.5hz,1h),2.92(dd,j=16.2,3.0hz,1h),2.72(s, 3h);
13
c nmr(100mhz,cdcl3)δ163.7(
13
c-enriched),140.5(d,j=3.4hz),138.6(d,j=1.8 hz),137.8,135.5(d,j=6.4hz),133.7,128.6,128.1,127.9,125.89(d,j=68.6hz),126.04(d,j =4.1hz),76.7(d,j=1.8hz),73.8,71.0(d,j=2.8hz),31.4(d,j=3.3hz),18.1;hrms (esi-tof):calc’d for c
18
[
13
c]h
17
clnao3[m na
]340.0792,found 340.0793.
[0060]
实施例5:化合物l-4的制备
[0061][0062]
操作步骤同实施例2,区别在于所使用的碘化物为3-甲基-4-碘苯甲酸甲酯(55.2mg)、醋酸钯(4.5mg,0.1mmol)、2-双环己基膦-2',4',6'-三异丙基联苯(23.0mg,0.24mmol)、(1s,2s, 4s)-2-降冰片烯-5,6-乙二酰胺联苯(31.5mg,0.5mmol),得化合物l-4(白色固体,60%产率)。1h nmr(400mhz,cdcl3)δ7.84(s,1h),7.74(s,1h),7.39
–
7.28(m,5h),4.62(s,3h), 3.94(s,3h),3.79(dd,j=10.3,4.8hz,1h),3.72(dd,j=10.3,5.2hz,1h),3.15(dd,j=16.2, 11.4hz,1h),3.01(dd,j=16.2,3.1hz,1h),2.71(s,3h);
13
c nmr(100mhz,cdcl3)δ166.3, 163.8(
13
c-enriched),143.5,140.2,137.8,133.5,131.9(d,j=4.7hz),128.7,128.1,127.9,127.4 (d,j=68.2hz),126.4(d,j=3.6hz),73.9,71.0(d,j=2.9hz),52.7,31.5(d,j=3.1hz),22.3; hrms(esi-tof):calc’d for c
20
[
13
c]h
20
nao5[m na
]364.1236,found 364.1233.
[0063]
实施例6:化合物l-5的制备
[0064][0065]
操作步骤同实施例2,区别在于所使用的碘化物为2-氯-3,4-二甲氧基碘苯(59.6mg)、醋酸钯(4.5mg,0.1mmol)、2-双环己基膦-2',4',6'-三异丙基联苯(23.0mg,0.24mmol)、(1s,2s, 4s)-2-降冰片烯-5,6-乙二酰胺联苯(31.5mg,0.5mmol),得化合物l-5(白色固体,49%产率)。1h nmr(400mhz,cdcl3)δ7.40
–
7.30(m,5h),6.66(s,1h),4.65
–
4.54(m,3h),3.93(s, 3h),3.85(s,3h),3.78(dd,j=10.2,4.6hz,1h),3.71(dd,j=10.2,5.7hz,1h),3.09(dd,j= 16.1,11.5hz,1h),2.92(dd,j=16.2,3.0hz,1h);
13
c nmr(100mhz,cdcl3)δ161.5 (
13
c-enriched),157.4,146.1(d,j=4.6hz),138.1,137.8,131.8,128.7,128.1,128.0,115.9(d,j= 73.7hz),109.1(d,j=4.3hz),76.3(d,j=1.8hz),73.9,70.9(d,j=3.0hz),60.8,56.4,31.9(d, j=3.2hz);hrms(esi-tof):calc’d for c
19
[
13
c]h
19
clnao5[m na
]386.0847,found 386.0843.
[0066]
实施例7:化合物l-6的制备
[0067][0068]
操作步骤同实施例2,区别在于所使用的碘化物为4-溴-1-碘萘(66.4mg)、醋酸钯(4.5mg, 0.1mmol)、2-双环己基膦-2',4',6'-三异丙基联苯(23.0mg,0.24mmol)、、(1s,2s,4s)-2-降冰片烯-5,6-乙二酰胺联苯(31.5mg,0.5mmol),得化合物l-6(棕黄色固体,,45%产率)。1h nmr (400mhz,cdcl3)δ9.22(d,j=8.6hz,1h),8.31(d,j=8.4hz,1h),7.70(d,j=7.0hz,2h), 7.64(t,j=7.6hz,1h),7.40
–
7.28(m,5h),4.74
–
4.59(m,3h),3.84(dd,j=10.4,4.7hz,1h), 3.78(dd,j=10.3,5.3hz,1h),3.31(dd,j=16.6,11.7hz,1h),3.04(dd,j=16.7,3.1hz,1h);
13
c nmr(100mhz,cdcl3)δ163.8(
13
c-enriched),140.7(d,j=1.7hz),137.8,133.1(d,j= 3.7hz),131.9(d,j=4.3hz),130.6,129.7,129.4(d,j=4.1hz),128.7,128.1,128.0,127.9, 127.8,126.8,120.0(d,j=69.7hz),76..1(d,j=1.8hz),73.9,70.9(d,j=2.8hz),31.6(d,j= 3.5hz);hrms(esi-tof):calc’d for c
21
[
13
c]h
17
brnao3[m na
]420.0287,found 420.0286.
[0069]
实施例8:化合物l-7的制备
[0070][0071]
操作步骤同实施例2,区别在于所使用的碘化物如所示(81.0mg)、醋酸钯(4.5mg,0.1mmol)、2-双环己基膦-2',4',6'-三异丙基联苯(23.0mg,0.24mmol)、(1s,2s, 4s)-2-降冰片烯-5,6-乙二酰胺联苯(31.5mg,0.5mmol),得化合物l-7(无色油状液体,37%产率)。1h nmr(400mhz,cdcl3)δ7.43
–
7.26(m,10h),7.05(s,1h),6.91(s,1h),5.01(d,j= 8.2hz,1h),4.68
–
4.49(m,6h),3.98(s,1h),3.77(dd,j=10.4,4.8hz,1h),3.72(m,4h),3.58 (m,2h),3.48(d,j=5.1hz,1h),3.33(dd,j=13.2,3.4hz,1h),3.18
–
3.06(m,3h),2.99(dd,j =13.7,6.6hz,1h),2.88(dd,j=16.2,2.9hz,1h),1.40(s,9h);
13
c nmr(100mhz,cdcl3)δ 172.1,165.6(
13
c-enriched),155.1,144.0,142.1,140.5,138.5,137.8,132.9,128.7,128.6,128.1, 127.9,127.8,127.1,80.4,74.8,73.8,73.6,72.6,71.0(d,j=2.9hz),54.2,52.6,38.5,31.6,28.4; hrms(esi-tof):calc’d for c
36
[
13
c]h
43
nnao9[m na
]657.2863,found 657.2853.
[0072]
实施例9:化合物l-8的制备
[m na
]233.0339,found233.0335.
[0081]
实施例12:化合物l-11的制备
[0082][0083]
操作步骤同实施例2,区别在于所使用的碘化物为2-甲基碘苯(43.6mg)、环氧化合物为n-(2,3-环氧丙基)邻苯二甲酰胺(121.9mg)、醋酸钯(4.5mg,0.1mmol)、2-双环己基膦-2',4',6'-三异丙基联苯(23.0mg,0.24mmol)、(1s,2s,4s)-2-降冰片烯-5,6-乙二酰胺联苯(31.5mg,0.5mmol),得化合物l-11(白色固体,58%产率)。1hnmr(400mhz,cdcl3)δ7.87(dd,j=5.5,3.0hz,2h),7.74(dd,j=5.5,3.1hz,2h),7.35(t,j=7.6hz,1h),7.18(d,j=7.7hz,1h),7.06(d,j=7.5hz,1h),4.87
–
4.75(m,1h),4.14(dd,j=14.1,7.3hz,1h),3.91(dd,j=14.1,5.6hz,1h),3.03(d,j=6.7hz,2h),2.65(s,3h);
13
cnmr(100mhz,cdcl3)δ168.2,163.8(
13
c-enriched),δ143.3(d,j=2.9hz),139.0(d,j=2.0hz),134.4,133.0,132.1,131.5(d,j=4.7hz),125.6(d,j=3.6hz),123.8(d,j=70.7hz),123.7,74.4(d,j=1.7hz),41.1(d,j=2.5hz),32.4(d,j=3.3hz),22.3;hrms(esi-tof):calc’dforc
19
[
13
c]h
15
nnao4[m na
]344.0893,found344.0889.
[0084]
实施例13:化合物l-12的制备
[0085][0086]
操作步骤同实施例2,区别在于所使用的碘化物为2-苄氧基-4-甲氧基碘苯(68.0mg),环氧化合物为s-环氧丙烷(34.9mg)、醋酸钯(4.5mg,0.1mmol)、2-双环己基膦-2',4',6'-三异丙基联苯(23.0mg,0.24mmol)、(1s,2s,4s)-2-降冰片烯-5,6-乙二酰胺联苯(31.5mg,0.5mmol),得化合物l-12(淡黄色油状液体,45%产率,99%ee)。1hnmr(400mhz,cdcl3)δ7.55(d,j=7.0hz,2h),7.37(t,j=7.6hz,2h),7.30(d,j=7.2hz,1h),6.43(s,1h),6.30(s,1h),5.29
–
5.17(m,2h),4.52(ddt,j=12.2,6.6,4.5hz,1h),3.80(s,3h),2.88(dd,j=16.0,10.9hz,1h),2.79(dd,j=16.0,3.2hz,1h),1.47(d,j=6.3hz,3h);
13
cnmr(100mhz,cdcl3)δ164.3,162.6(
13
c-enriched),162.2,144.0,136.7,128.8,127.9,126.9,107.7,104.5(d,j=3.6hz),99.8(d,j=3.1hz),73.7,70.7,55.7,36.8,20.9(d,j=2.6hz);hrms(esi-tof):calc’dforc
18
[
13
c]h
18
nao4[m na
]322.1131,found322.1133;hplc:daicelchiralpakodcolumn,20%iprohinnhexane,1ml/min,λ=230nm,tr(major)=13.721min,tr(minor)undetected;62.342(c0.12,chcl3).
[0087]
实施例14:化合物l-13的制备
[0088][0089]
操作步骤同实施例2,区别在于所使用的碘化物为2-苄氧基碘苯(62.0mg),环氧化
合物为r-环氧丙烷(34.9mg)、醋酸钯(4.5mg,0.1mmol)、2-双环己基膦-2',4',6'-三异丙基联苯(23.0mg,0.24mmol)、(1s,2s,4s)-2-降冰片烯-5,6-乙二酰胺联苯(31.5mg,0.5mmol),得化合物l-13(无色油状液体,55%产率,99%ee)。1hnmr(400mhz,cdcl3)δ7.54(d,j=7.5hz,2h),7.41
–
7.34(m,3h),7.30(d,j=7.3hz,1h),6.93(d,j=8.5hz,1h),6.79(d,j=7.5hz,1h),5.32
–
5.19(m,2h),4.57(dqd,j=9.9,6.3,3.3hz,1h),2.96
–
2.81(m,2h),1.49(d,j=6.3hz,3h);
13
cnmr(100mhz,cdcl3)δ162.6(
13
c-enriched),160.2,142.2,136.7,134.4,128.7,127.9,126.9,119.7(d,j=3.6hz),114.6(d,j=70.2hz),113.0(d,j=3.0hz),74.2(d,j=1.9hz),70.7,36.3(d,j=3.2hz),20.9(d,j=2.6hz);hrms(esi-tof):calc’dforc
17
[
13
c]h
16
nao3[m na
]292.1025,found292.1025;hplc:daicelchiralpakadcolumn,25%iprohinnhexane,1ml/min,λ=320nm,tr(major)=15.264min,tr(minor)undetected;-149.01(c0.20,chcl3).
[0090]
在实施例1的基础上合成
13
c标记的二氢异喹啉酮类化合物,反应方程式如下:
[0091][0092]
实施例15:化合物l-14的制备
[0093][0094]
在手套箱中,向干燥并装有磁力搅拌子的双室反应管的一氧化碳消耗室分别加入醋酸钯(4.5mg,0.02mmol)、2-双环己基膦-2'-(n,n-二甲基氨基)联苯(15.6mg,0.04mmol)和干燥的n-甲基吡咯烷酮(0.5ml),催化剂和配体预搅半小时后加入碳酸钾(27.6mg,0.2mmol)和(1s,2s,4s)-2-降冰片烯-5,6-乙二酰胺喹啉(29.4mg,0.1mmol)、2-甲基碘苯(43.6mg,0.2mmol);在一氧化碳生成室分别加入
13
c标记的4-三氟甲基甲酸苯酯(76mg,0.4mmol)、三乙胺(24.3mg,0.24mmol)和干燥的1,4-二氧六环(1.0ml),最后将氮杂环丙烷(47mg,0.6mmol)溶于干燥的n-甲基吡咯烷酮(1.0ml)用注射泵设置参数5h慢慢加入一氧化碳消耗室中,置于60℃在氩气保护氛围下反应16小时。一氧化碳消耗室的混合物用乙酸乙酯和饱和氯化钠溶液萃取,无水硫酸钠干燥,减压蒸馏除去溶剂,柱层析分离纯化得化合物l-14(淡黄色固体,72%产率)。1hnmr(400mhz,cdcl3)δ7.96(d,j=8.4hz,2h),7.30(dd,j=17.4,7.9hz,3h),7.10(d,j=7.6hz,1h),7.03(d,j=7.5hz,1h),4.20
–
4.16(m,2h),3.04(t,j=6.1hz,2h),2.54(s,3h),2.42(s,3h);
13
cnmr(100mhz,cdcl3)δ164.0(
13
c-enriched),144.6,142.7(d,j=2.7hz),140.5(d,j=1.7hz),136.9,132.5,131.4(d,j=4.4hz),129.5,128.6,126.9(d,j=65.9hz),125.4(d,j=3.6hz),44.8,30.3(d,j=2.7hz),22.6,21.8;hrms(esi-tof):calc’dforc
17
[
13
c]h
17
nano3s[m na
]339.0852,found339.0856.
[0095]
实施例16:化合物i-15的制备
[0096][0097]
操作步骤同实施例15,区别在于所使用的氮杂环丙烷如所示(50.7mg)、加入三氟乙醇(60mg,3.0equiv),得化合物l-15(白色固体,53%产率)。1h nmr(400mhz,cdcl3) δ7.98(d,j=8.4hz,2h),7.31(t,j=7.9hz,3h),7.10(d,j=7.6hz,1h),7.02(d,j=7.5hz, 1h),5.06(ddt,j=10.6,8.6,3.3hz,1h),3.39(dd,j=15.8,5.6hz,1h),2.76(dd,j=15.7,2.1 hz,1h),2.55(s,3h),2.42(s,3h),1.31(d,j=6.7hz,3h);
13
c nmr(100mhz,cdcl3)δ163.4 (
13
c-enriched),144.5,142.3(d,j=2.8hz),138.0(d,j=1.7hz),137.3,132.7,131.4(d,j=4.5 hz),129.5,128.7,126.7-126.2(m),51.4,36.4(d,j=3.1hz),22.5,21.8,20.2;hrms(esi-tof): calc’d for c
12
[
13
c]h
15
nano3s[m na
]353.1009,found 353.1012.
[0098]
实施例17:化合物l-16的制备
[0099][0100]
操作步骤同实施例15,区别在于所使用的氮杂环丙烷如所示(81.9mg)、加入三氟乙醇(60mg,3.0equiv),得化合物l-16(白色固体,54%产率)。1h nmr(400mhz,cdcl3) δ7.98(d,j=8.4hz,2h),7.30(dd,j=18.0,7.8hz,3h),7.08(d,j=7.6hz,1h),7.01(d,j=7.5 hz,1h),4.86(tt,j=8.0,4.2hz,1h),3.81(dd,j=9.8,4.7hz,1h),3.45(t,j=9.5hz,1h),3.20 (d,j=3.8hz,2h),2.55(s,3h),2.42(s,3h),0.82(s,9h),-0.06(d,j=38.6hz,6h);
13
c nmr (100mhz,cdcl3)δ163.6(
13
c-enriched),144.6,142.0(d,j=2.8hz),137.8(d,j=1.9hz), 137.3,132.6,131.3(d,j=4.7hz),129.5,128.7,126.7(d,j=66.0hz),126.4(d,j=3.7hz),62.8, 55.8,30.6(d,j=3.2hz),25.9,22.5,21.8,18.3,-5.3,-5.5;hrms(esi-tof):calc’d for c
24
[
13
c] h
33
nano4ssi[m na
]483.1818,found 483.1819.
[0101]
以上所述,仅为本发明较佳的具体实施方式,但本发明保护的范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内所做的任何修改,等同替换和改进等,均应包含在发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。