抗cd19抗体及其用途
1.相关申请的交叉引用
2.本技术要求2020年4月24日提交的序列号为60/015,385的美国临时专利申请的优先权,所述申请特此以引用的方式整体并入。
3.序列表
4.本技术含有序列表,所述序列表以ascii格式以电子方式提交并且特此以引用的方式整体并入。所述ascii副本创建于2021年3月30日,名称为mil-004wo_sl.txt,且大小为38,765字节。
背景技术:
5.cd19抗原是一种存在于b细胞上的细胞表面蛋白。cd19在正常b细胞和恶性b细胞上均有表达,其异常生长可导致b细胞淋巴瘤。例如,cd19在b细胞谱系恶性肿瘤上表达,b细胞谱系恶性肿瘤包括但不限于非霍奇金淋巴瘤、慢性淋巴细胞白血病和急性成淋巴细胞性白血病。本领域需要开发抗cd19抗体。
技术实现要素:
6.为了解决与b细胞病症及其治疗相关的许多问题,本发明提供了用于治疗b细胞淋巴瘤和白血病以及自身免疫性病症的人抗cd19抗体及其片段。本发明的抗体及其片段可以单独使用,呈融合蛋白或与至少一种诊断剂和/或治疗剂缀合,或者与其他治疗方式相结合。人cd19与本文所述的抗cd19抗体或其片段结合可以表现出adcc活性、细胞凋亡的诱导以及b细胞增殖的抑制。
7.在一方面,本发明提供了一种特异性结合至cd19的抗体或其片段。在一方面,本发明提供了一种cd19抗体或其片段,所述cd19抗体或其片段包含sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的重链可变互补决定区(cdr)序列。
8.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqagavpit(seq id no:12)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
9.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqvdslhpft(seq id no:13)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
10.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqaggvpplt(seq id no:14)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
11.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvrssyla(seq id no:8)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqlfdspyt(seq id no:15)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
12.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvrssyla(seq id no:8)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqagvpplt(seq id no:16)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
13.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqaggvppft(seq id no:17)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
14.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gasnrat(seq id no:10)(lcdr2)和qqagvfpft(seq id no:18)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
15.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gasrrat(seq id no:11)(lcdr2)和qqagippyt(seq id no:19)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
16.在一些实施方案中,所述cd19抗体或其片段包含含有与seq id no:20具有至少90%同一性的氨基酸序列的免疫球蛋白轻链可变(vl)区;和含有与seq id no:5具有至少90%同一性的氨基酸序列的免疫球蛋白重链可变(vh)区。
17.在一方面,本发明提供了一种cd19抗体或其片段,所述cd19抗体或其片段包含含有与seq id no:20-27具有至少90%同一性的氨基酸序列的免疫球蛋白轻链可变(vl)区;和含有与seq id no:5具有至少90%同一性的氨基酸序列的免疫球蛋白重链可变(vh)区。
18.在一些实施方案中,所述vl区包含与seq id no:20-27具有至少95%同一性的氨基酸序列。
19.在一些实施方案中,所述vl区包含与seq id no:20-27同一的氨基酸序列。
20.在一些实施方案中,所述vh区包含与seq id no:5具有至少95%同一性的氨基酸序列。
21.在一些实施方案中,所述vh区包含与seq id no:5同一的氨基酸序列。
22.在一些实施方案中,所述vl区包含与seq id no:20-27同一的氨基酸序列,并且所述vh区与seq id no:5同一。
23.在一些实施方案中,所述cd19抗体或其片段选自由以下组成的组:iga抗体、igg抗体、ige抗体、igm抗体、双特异性或多特异性抗体、fab片段、fab’片段、f(ab’)2片段、fd’片段、fd片段、分离的cdr或它们的集合;单链可变片段(scfv)、多肽-fc融合物、单结构域抗体、骆驼抗体;掩蔽抗体、小模块免疫药物(“smipstm”)、单链、串联双抗体、vhh、anticalin、纳米抗体(nanobody)、微型抗体、bite、锚蛋白重复蛋白、darpin、avimer、dart、tcr样抗体、adnectin、affilin、跨膜抗体(trans-body);亲和体(affibody)、trimerx、microprotein、fynomer、centyrin;和kalbitor。
24.在一些实施方案中,所述cd19抗体或其片段是单克隆抗体或单链可变片段(scfv)。
25.在一些实施方案中,所述cd19抗体或其片段是包含igg恒定区的抗体。
26.在一些实施方案中,所述cd19抗体或其片段是单链可变片段(scfv)。
27.在一些实施方案中,所述cd19 scfv包含含有seq id no:36-39的接头序列。
28.在一些实施方案中,所述cd19 scfv包含选自seq id no:40-42的信号肽。
29.在一些实施方案中,所述抗体或其片段以约8纳摩尔(nm)与约242nm之间的kd结合cd19。
30.在一些实施方案中,所述抗体或其片段以约0.1nm与约2.7nm之间的ec50结合靶细胞上的cd19。
31.在一方面,本发明提供了一种治疗癌症的方法,所述方法包括将前述权利要求中任一项所述的cd19抗体或其片段施用于需要治疗的受试者。
32.在一些实施方案中,所述癌症选自白血病、淋巴瘤或骨髓瘤。
33.在一方面,本发明提供了一种药物组合物,所述药物组合物包含cd19抗体或其片段和药学上可接受的载剂,其中所述cd19抗体或其片段包含具有sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的互补决定区(cdr)序列的重链可变区。
34.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqagavpit(seq id no:12)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
35.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqvdslhpft(seq id no:13)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
36.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqaggvpplt(seq id no:14)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
37.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvrssyla(seq id no:8)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqlfdspyt(seq id no:15)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
38.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvrssyla(seq id no:8)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqagvpplt(seq id no:16)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
39.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqaggvppft(seq id no:17)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
40.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gasnrat(seq id no:10)(lcdr2)和qqagvfpft(seq id no:18)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
41.在一些实施方案中,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gasrrat(seq id no:11)(lcdr2)和qqagippyt(seq id no:19)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
42.在一方面,本发明提供了一种治疗癌症的方法,所述方法包括将cd19抗体或其抗原结合片段施用于需要治疗的受试者,其中所述cd19抗体或其片段包含具有sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的互补决定区(cdr)序列的重链可变区。
43.在一些实施方案中,所述治疗癌症的方法包括施用cd19抗体或其片段,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqagavpit(seq id no:12)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
44.在一些实施方案中,所述治疗癌症的方法包括施用cd19抗体或其片段,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqvdslhpft(seq id no:13)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
45.在一些实施方案中,所述治疗癌症的方法包括施用cd19抗体或其片段,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqaggvpplt(seq id no:14)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
46.在一些实施方案中,所述治疗癌症的方法包括施用cd19抗体或其片段,所述cd19抗体或其片段还包含具有rasqsvrssyla(seq id no:8)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqlfdspyt(seq id no:15)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
47.在一些实施方案中,所述治疗癌症的方法包括施用cd19抗体或其片段,所述cd19抗体或其片段还包含具有rasqsvrssyla(seq id no:8)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqagvpplt(seq id no:16)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
48.在一些实施方案中,所述治疗癌症的方法包括施用cd19抗体或其片段,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqaggvppft(seq id no:17)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
49.在一些实施方案中,所述治疗癌症的方法包括施用cd19抗体或其片段,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gasnrat(seq id no:10)(lcdr2)和qqagvfpft(seq id no:18)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
50.在一些实施方案中,所述治疗癌症的方法包括施用cd19抗体或其片段,所述cd19抗体或其片段还包含具有rasqsvsssyla(seq id no:7)(lcdr1)、gasrrat(seq id no:11)(lcdr2)和qqagippyt(seq id no:19)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
51.在一方面,本发明提供了编码与seq id no:5具有至少90%同一性的氨基酸序列的核酸。
52.在一方面,本发明提供了编码与seq id no:20-27中任一者具有至少90%同一性的氨基酸序列的核酸。
53.在一方面,本发明提供了一种载体,所述载体包含编码与seq id no:5具有至少90%同一性的氨基酸序列和/或编码与seq id no:20-27中任一者具有至少90%同一性的氨基酸序列的核酸序列。
54.在一方面,本发明提供了一种分离的细胞,所述分离的细胞包含载体,所述载体包含编码与seq id no:5具有至少90%同一性的氨基酸序列和/或编码与seq id no:20-27中任一者具有至少90%同一性的氨基酸序列的核酸序列。
55.定义
56.一个(种):冠词“一个(种)”在本文中用于指冠词的一个或一个以上(即,至少一个)语法对象。举例来说,“元素”意指一种元素或一种以上元素。
57.亲和力:如本文所用,术语“亲和力”是指结合部分(例如,抗原结合部分(例如,本文所述的可变结构域)和/或fc受体结合部分(例如,本文所述的fcrn结合部分))与靶标(例
如,抗原(例如,cd19)和/或fcr(例如,fcrn))之间的结合相互作用的特征,并且其指示结合相互作用的强度。在一些实施方案中,亲和力的量度表示为解离常数(kd)。在一些实施方案中,结合部分对靶标具有高亲和力(例如,kd小于约10-7
m、小于约10-8
m或小于约10-9
m)。在一些实施方案中,结合部分对靶标具有低亲和力(例如,kd高于约10-7
m、高于约10-6
m、高于约10-5
m,或高于约10-4
m)。在一些实施方案中,结合部分在第一ph下对靶标具有高亲和力,在第二ph下对靶标具有低亲和力,并且在第一ph与第二ph之间的ph水平下对靶标具有中等亲和力。
58.大约或约:如本文所用,应用于一个或多个目标值的术语“大约”或“约”是指与陈述的参考值相似的值。在某些实施方案中,除非另有说明或从上下文中明显看出,否则术语“大约”或“约”是指在陈述的参考值的任一方向上(大于或小于陈述的参考值)落入25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小以内的值的范围(除了这样的数将超过可能值的100%的情况外)。
59.抗体:如本文所用,术语“抗体”是指包含至少一个免疫球蛋白可变区的多肽,例如,提供免疫球蛋白可变结构域或免疫球蛋白可变结构域序列的氨基酸序列。例如,抗体可以包括重(h)链可变区(本文缩写为vh)和轻(l)链可变区(本文缩写为vl)。在另一个实例中,抗体包括两个重(h)链可变区和两个轻(l)链可变区。术语“抗体”涵盖抗体的抗原结合片段(例如,单链抗体、fab、f(ab')2、fd、fv和dab片段)以及完整抗体,例如完整的免疫球蛋白类型iga、igg、ige、igd、igm(以及其亚型)。免疫球蛋白的轻链可以是κ型或λ型。
60.结合部分:如本文所用,“结合部分”是能够特异性结合靶标,例如目标靶标(例如,抗原(例如,cd19)和/或fcr(例如,fcrn))的任何分子或分子的一部分。结合部分包括例如抗体、其抗原结合片段、fc区或其fc片段、抗体模拟物、肽和适体。
61.抗原结合片段或其抗原片段是指完整抗体的一部分。抗原结合片段或其抗体片段是指结合至抗原(例如,cd19)的完整抗体的一部分。抗原结合片段可以包含完整抗体的抗原决定可变区。抗体片段的实例包括但不限于fab、fab'、f(ab')2和fv片段、线性抗体、抗体模拟物、scfv和单链抗体。
62.互补决定区(cdr):可变结构域的“cdr”是根据kabat、chothia、kabat和chothia的积累、abm、接触(contact)和/或构象定义或本领域众所周知的任何cdr确定方法的定义确定的可变区内的氨基酸残基。抗体cdr可被鉴定为最初由kabat等人定义的高变区。参见,例如,kabat等人,1992,sequences of proteins of immunological interest,第5版,public health service,nih,washington d.c。cdr的位置也可以被鉴定为最初由chothia和其他人描述的结构环结构。参见,例如,chothia等人,nature 342:877-883,1989。其他cdr鉴定方法包括“abm定义”,它是kabat和chothia之间的折衷,是使用oxford molecular的abm抗体建模软件(现为)得来;或基于观察到的抗原接触的cdr的“接触定义”,陈述于maccallum等人,j.mol.biol.,262:732-745,1996中。在本文称为cdr的“构象定义”的另一种方法中,cdr的位置可以被鉴定为对抗原结合产生焓贡献的残基。参见,例如,makabe等人,journal of biological chemistry,283:1156-1166,2008。还有其他cdr边界定义可能不严格遵循上述方法之一,但仍会与kabat cdr的至少一部分重叠,但是基于特定残基或残基组,甚至整个cdr对抗原结合没有显著影响这一预测或实验结果,它们会被缩短或延长。如本文所用,cdr可以指由本领域已知的任何方法(包括方法的组合)定义的cdr。本
文使用的方法可以利用根据任何这些方法定义的cdr。对于包含多于一个cdr的任何给定实施方案,cdr可以根据kabat、chothia、延伸、abm、接触和/或构象定义中的任一者来定义。
63.恒定区:如本文所用,术语“恒定区”是指对应于或源自抗体的一个或多个恒定区免疫球蛋白结构域的多肽。恒定区可以包括任何或所有以下免疫球蛋白结构域:ch1结构域、铰链区、ch2结构域、ch3结构域(源自iga、igd、igg、ige或igm)和ch4结构域(源自ige或igm)。
64.表位:如本文所用,“表位”是本领域中的术语,是指抗体可以特异性结合的抗原的局部区域。表位可以是例如多肽的连续氨基酸(线性或连续表位),或者表位可以例如共同来自一个或多个多肽的两个或更多个非连续区域(构象、非线性、不连续或非连续表位)。在某些实施方案中,抗体结合的表位可以通过例如nmr光谱学、x射线衍射晶体学研究、elisa测定、氢/氘交换联合质谱(例如,液相色谱电喷雾质谱)、基于阵列的寡肽扫描测定,和/或诱变作图(例如,定点诱变作图)来确定。对于x射线晶体学,可以使用本领域已知的任何方法完成结晶(例如,giege r等人,(1994)acta crystallogr d biolcrystallogr 50(pt 4):339-350;mcpherson a(1990)eur j biochem 189:1-23;chayen ne(1997)structure 5:1269-1274;mcpherson a(1976)jbiol chem 251:6300-6303)。抗体:抗原晶体可以使用众所周知的x射线衍射技术进行研究,并且可以使用本领域已知的计算机软件例如refmac和phenix进行细化。可以使用本领域技术人员已知的任何方法完成诱变作图研究。有关诱变技术,包括丙氨酸扫描诱变技术的描述,参见例如champe m等人,(1995)j biol chem 270:1388-1394andcunningham bc&wells ja(1989)science 244:1081-1085。
65.fc区:如本文所用,术语“fc区”是指两个“fc多肽”的二聚体,每个“fc多肽”包含除第一恒定区免疫球蛋白结构域之外的抗体恒定区。在一些实施方案中,“fc区”包括通过一个或多个二硫键、化学接头或肽接头连接的两个fc多肽。“fc多肽”是指iga、igd和igg的最后两个恒定区免疫球蛋白结构域,以及ige和igm的最后三个恒定区免疫球蛋白结构域,并且还可以包括这些结构域的柔性铰链n末端的部分或全部。对于igg,“fc多肽”包含免疫球蛋白结构域cgamma2(cγ2)和cgamma3(cγ3),以及cgamma1(cγ1)与cγ2之间的铰链下部。尽管fc多肽的边界可能不同,但人igg重链fc多肽通常定义为包含从t223或c226或p230开始到其羧基末端的残基,其中编号是根据如kabat等人(1991,nih publication 91-3242,national technical information services,springfield,va)中的eu索引。对于iga,fc多肽包含免疫球蛋白结构域calpha2(cα2)和calpha3(cα3),以及calpha1(cα1)与cα2之间的铰链下部。fc区可以是合成的,重组的或从天然来源如ivig产生的。
66.ka:如本文所用,“k
a”是指特定结合部分与靶标形成结合部分/靶标复合物的缔合速率。
67.kd:如本文所用,“k
d”是指特定结合部分/靶标复合物的解离速率。
68.kd:如本文所用,“k
d”是指解离常数,其获自kd与ka的比率(即,kd/ka)并且表示为摩尔浓度(m)。kd值可以使用本领域充分确立的方法,例如,通过使用表面等离子体共振,或者使用如系统的生物传感器系统来确定。
69.参考:“参考”实体、系统、数量、条件集等是与如本文所述的测试实体、系统、数量、条件集等进行比较的实体、系统、数量、条件集等。例如,在一些实施方案中,“参考”抗体是如本文所述未经工程化的对照抗体。
70.选择性结合:如本文所用,“选择性结合”、“选择性地结合”、“特异性结合”或“特异性地结合”是指,就结合部分和靶标而言,结合部分优先与靶标缔合,而不是与非靶标的实体结合。在结合部分与非靶标之间可能发生一定程度的非特异性结合。在一些实施方案中,如果结合部分与靶标之间的结合相较于结合部分与非靶标的结合大2倍、5倍、10倍或100倍,则结合部分选择性结合靶标。在一些实施方案中,如果结合亲和力小于约10-5
m、小于约10-6
m、小于约10-7
m、小于约10-8
m,或小于约10-9
m,则结合部分选择性结合靶标。在一些实施方案中,特异性结合抗原的分子可以结合其他肽或多肽,通常具有较低的亲和力,如通过例如免疫测定、kinexa 3000仪器(sapidyne instruments,boise,id),或本领域已知的其他测定所测定的。
71.单链可变片段(scfv):如本文所用,术语“单链可变片段”或“scfv”是指共价连接形成vh::vl异源二聚体的免疫球蛋白(例如,小鼠或人)的重链(vh)和轻链(v
l
)可变区的融合蛋白。重链(vh)和轻链(
vl
)直接接合或通过肽编码接头(例如,10、15、20、25个氨基酸)接合,所述接头将vh的n末端与v
l
的c末端连接,或将vh的c末端与v
l
的n末端连接。接头通常富含甘氨酸以提高柔性,以及丝氨酸或苏氨酸以提高溶解度。接头可以连接细胞外抗原结合结构域的重链可变区和轻链可变区。接头的非限制性实例公开于shen等人,anal.chem.80(6):1910-1917(2008)和wo 2014/087010中,所述文献的内容特此以引用的方式整体并入本文。
72.受试者:如本文所用,术语“受试者”意指需要诊断、预后或治疗的任何受试者。例如,受试者可以是哺乳动物,例如人或非人灵长类动物(如猿、猴、猩猩或黑猩猩)、狗、猫、豚鼠、兔、大鼠、小鼠、马、牛或奶牛。
73.靶标:如本文所用,“靶标”是由抗体或其抗原结合片段的结合部分所特异性结合的任何分子。在一些实施方案中,靶标是本文所述的抗原(例如,cd19)。在一些实施方案中,靶标是fcr(例如,fcrn)。术语“第一靶标”和“第二靶标”在本文中用于指两种不同分子种类的分子,而不是相同分子种类的两个分子。例如,在一些实施方案中,第一靶标是血清蛋白,而第二靶标是fcrn。
74.治疗有效量:如本文所用,术语“治疗有效量”是指以适用于任何医学治疗的合理益处/风险比对被治疗的受试者赋予治疗效果的治疗性分子(例如,本文所述的抗cd19抗体)的量。治疗效果可以是客观的(即,可通过一些测试或标志物测量)或主观的(即,受试者给出感觉到效果的指示)。特别地,“治疗有效量”是指如通过改善与疾病相关的症状、预防或延迟疾病的发作和/或还减轻疾病症状的严重程度或频率而有效治疗、改善或预防特定疾病或疾患或表现出可检测的治疗或预防效果的治疗性分子或组合物的量。可以按可包含多个单位剂量的给药方案施用治疗有效量。对于任何特定的治疗性分子,治疗有效量(和/或有效给药方案内的适当单位剂量)可有所不同,例如取决于施用途径、与其他药剂的组合。另外,用于任何特定受试者的具体治疗有效量(和/或单位剂量)可取决于多种因素,包括所治疗的病症和病症的严重程度;使用的具体药剂的活性;使用的具体组合物;受试者的年龄、体重、一般健康状况、性别和饮食;使用的具体治疗性分子的施用时间、施用途径和/或排泄或代谢速率;治疗的持续时间;以及医学领域中熟知的类似因素。
75.治疗:如本文所用,术语“治疗”(treatment/treat/treating)是指任何部分或完全减轻、改善、缓解、抑制特定疾病、病症和/或疾患的一种或多种症状或特征、延迟其发作、
flklslglpg lgihmrplai wlfifnvsqq mggfylcqpg ppsekawqpg wtvnvegsge lfrwnvsdlg glgcglknrs segpsspsgk lmspklyvwa kdrpeiwege ppclpprdsl nqslsqdltm apgstlwlsc gvppdsvsrg plswthvhpk gpksllslel kddrpardmw vmetglllpr ataqdagkyy chrgnltmsf hleitarpvl whwllrtggw kvsavtlayl ifclcslvgi lhlqralvlr rkrkrmtdpt rrffkvtppp gsgpqnqygn vlslptptsg lgraqrwaag lggtapsygn pssdvqadga lgsrsppgvg peeeegegye epdseedsef yendsnlgqd qlsqdgsgye npedeplgpe dedsfsnaes yenedeeltq pvartmdfls phgsawdpsr eatslgsqsy edmrgilyaa pqlrsirgqp gpnheedads yenmdnpdgp dpawggggrm gtwstr[seq id no:45]
[0088]
在某些实施方案中,本文所述的抗cd19抗体及其抗原结合片段与cd19的细胞外结构域结合。在某些实施方案中,抗cd19抗体及其抗原结合片段与人cd19的细胞外结构域结合。在某些实施方案中,人cd19的细胞外结构域包含seq id no:4的氨基酸20至291或由其组成。在某些实施方案中,人cd19的细胞外结构域包含seq id no:45的氨基酸20至291或由其组成。
[0089]
在某些实施方案中,cd19包含与seq id no:4所示氨基酸序列或其片段具有至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或至少约100%同一性的氨基酸序列或由其组成。
[0090]
在某些实施方案中,cd19包含与seq id no:45所示氨基酸序列或其片段具有至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或至少约100%同一性的氨基酸序列或由其组成。
[0091]
本文所述的抗cd19抗体可以是免疫球蛋白、重链抗体、轻链抗体、基于lrr的抗体或具有抗体样性质的其他蛋白质支架,以及本领域已知的其他免疫结合部分,包括例如,fab、fab'、fab'2、fab2、fab3、f(ab')2、fd、fv、feb、scfv、smip、抗体、双抗体、三抗体、四抗体、微型抗体、最大抗体(maxibody)、tandab、dvd、bite、tandab等,或它们的任何组合。不同类别的抗体的亚单位结构和三维构型是本领域已知的。
[0092]
抗体可以是具有四条多肽链(例如,两条重(h)链和两条轻(l)链)的免疫球蛋白分子。重链可以包括重链可变结构域和重链恒定结构域。重链恒定结构域可以包括ch1、铰链、ch2、ch3,并且在一些情况下包括ch4区。合适的重链恒定区可以源自任何免疫球蛋白(例如,iga、igg或ige)。在一些实施方案中,合适的重链恒定区可以源自igg1、igg2或igg4。在特定实施方案中,合适的重链恒定区源自igg1。轻链可以包括轻链可变结构域和轻链恒定结构域。轻链恒定结构域可以包括κ轻链或λ轻链。重链的重链可变结构域和轻链的轻链可变结构域通常可以进一步细分为具有变异性的区域,称为互补决定区(cdr),其间散布有更保守的区域,称为框架区(fr)。此类重链和轻链可变结构域可各自包括三个cdr和四个框架区,从氨基末端到羧基末端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4,其中一者或多者可以如本文所述进行工程化。每个结构域的氨基酸分配符合kabat sequences of proteins of immunological interest(national institutes of health,bethesda,md.(1987和1991))或chothia和lesk j.mol.biol.196:901-917(1987);chothia等人nature 342:878-883(1989)的定义。如本文所用,cdr指的是重链(hcdr1、hcdr2、hcdr3)和轻链(lcdr1、lcdr2、lcdr3)中的每一个。
[0093]
本发明的实施方案包括包含在本文所述的vh和vl结构域中发现的cdr的抗体,所
述cdr使用常规编号系统如imgt、kabat和clothia编号系统来鉴定。这种编号系统在本领域中是众所周知的。
[0094]
重链可变区
[0095]
在一些实施方案中,本文所述的抗cd19抗体或其片段包含共同的重链可变区。在一些实施方案中,抗cd19抗体包含重链可变区(vh)互补决定区(cdr)序列:
[0096]
vh cdr1:sygmh(seq id no:1)
[0097]
vh cdr2:liwydgsnkyyadsvkg(seq id no:2)
[0098]
vh cdr3:pvegllrgfdy(seq id no:3)
[0099]
在某些实施方案中,cdr是根据kabat编号系统来鉴定的。
[0100]
在一些实施方案中,可变重链包含qvqlvesgggvvqpgrslrlscaasgftfssygmhwvrqapgkglewvaliwydgsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycakpvegllrgfdywgqgtlvtvss(seq id no:5)的氨基酸序列。
[0101]
在一些实施方案中,抗cd19抗体包含与seq id no:5具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的重链氨基酸序列。
[0102]
在一些实施方案中,抗cd19抗体包含重链氨基酸序列,所述重链氨基酸序列与seq id no:5具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性,同时还包括本文所述的vh cdr1、vhcdr2和/或vhcdr3序列中的一者或多者。
[0103]
在一些实施方案中,工程化的抗体包含与seq id no:5同一的重链氨基酸序列。在某些实施方案中,vh包含与seq id no:5所示氨基酸序列具有至少约80%(例如,至少约85%、至少约90%或至少约95%)同一性或同源性的氨基酸序列。例如,vh包含与seq id no:5所示氨基酸序列具有约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或约100%同一性或同源性的氨基酸序列。在一些实施方案中,抗cd19抗体相对于seq id no:5包含不超过30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3或2个氨基酸取代。
[0104]
在一些实施方案中,抗cd19可变重链由包含以下核酸序列的多核苷酸编码:
[0105]
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagactctcctgtgcagcgtctggattcaccttcagtagctatggcatgcactgggtccgccaggctccaggcaaggggctggagtgggtggcactgatatggtatgatggaagtaataaatactatgcagactccgtgaagggccgattcaccatctccagagacaattccaagaacacgctgtatctgcaaatgaacagcctgagagccgaggacacggcggtgtactactgcgccaagccagtggaaggactattaagaggattcgattactggggacagggtacattggtcaccgtctcctca(seq id no:6)
[0106]
在一些实施方案中,抗cd19抗体包含与seq id no:6具有至少85%、90%、95%、98%或99%序列同一性的重链核酸序列。在一些实施方案中,工程化抗体包含与seq id no:6同一的重链核酸序列。在一些实施方案中,抗cd19抗体包含核酸序列,所述核酸序列编码相对于seq id no:5包含不超过30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3或2个氨基酸取代的抗体。
[0107]
在一些实施方案中,抗cd19抗体由包含编码重链氨基酸序列的核酸序列的多核苷酸编码,所述重链氨基酸序列与seq id no:6具有至少85%、90%、95%、98%或99%序列同一性,同时还包括本文所述的vh cdr1、vhcdr2和/或vhcdr3序列中的一者或多者。
[0108]
如本领域技术人员将理解的,任何此类重链cdr序列可以容易地例如通过分子生物学技术与本文提供的或别的本领域已知的任何其他抗体序列或结构域,包括如本文公开或别的本领域已知的任何框架区、cdr或恒定结构域或其部分(如可存在于本文公开或别的本领域已知的任何形式的抗体或其抗原结合片段中)组合。
[0109]
在本文所述的各种工程化抗体中,重链恒定结构域可以是任何类别(或亚类)。在本文所述的各种工程化抗体中,重链恒定结构域可以包括igg、igm、iga、igd或ige中任一者或多者的氨基酸序列,包括亚类,如igg1、igg2、igg3、igg4、iga1和iga2。在各个实施方案中,本文所述的工程化抗体的恒定结构域可以包括免疫球蛋白重链恒定结构域的两种或更多种类别(或亚类)的混合物。例如,抗cd19抗体可以包括具有选自igg、igm、iga、igd或ige类恒定结构域的免疫球蛋白恒定结构域的序列的恒定结构域的第一部分和具有与第一个不同的免疫球蛋白恒定结构域的序列并且选自igg、igm、iga、igd或ige类恒定结构域的恒定结构域的第二部分。在一些情况下,本文所述的抗cd19抗体的恒定结构域可以包括特定类别恒定结构域的两个或更多个亚类的混合物,例如具有选自igg1、igg2、igg3或igg4亚类恒定结构域的免疫球蛋白恒定结构域的序列的恒定结构域的第一部分和具有与第一个不同的免疫球蛋白恒定结构域的序列并且选自igg1、igg2、igg3或igg4亚类恒定结构域的恒定结构域的第二部分。在一些特定实施方案中,恒定结构域包括全部或部分igg2恒定结构域和全部或部分igg4恒定结构域。
[0110]
在一些情况下,抗cd19抗体包括抗体恒定区、fc区或fc片段,其表现出与一种或多种fc受体(例如,fcγri、fcγriia、fcγriib、fcγriiia、fcγriiib、fcγriv或fcrn受体)的改变的结合(如与参考恒定区相比)。在一些实施方案中,恒定区、fc区或fc片段经工程化以相对于参考恒定区、fc区或fc片段以改变的方式(例如,以ph敏感性方式(例如,以更强或更弱的ph敏感性方式)和/或减少或增加的结合)结合靶标(例如,fcrn受体)。在一些实施方案中,抗cd19抗体包括抗体恒定区、fc区或fc片段,其表现出与一种或多种fcγ受体(例如,fcγri、fcγriia、fcγriib、fcγriiia、fcγriiib或fcγriv)的减少的结合(如与参考恒定区相比)。在一些实施方案中,抗cd19抗体包括抗体恒定区、fc区或fc片段,其在血清ph下和/或在细胞内ph下表现出与fcrn受体的增加的结合(如与参考恒定区相比)。
[0111]
例如,抗cd19抗体可以包括igg抗体的恒定区、fc区或fc片段,其经工程化以包括氨基酸残基251-256、285-290、308-314、385-389和428-436(kabat编号(kabat等人,(1991)sequences of proteins ofimmunological interest,nih))中一者或多者的氨基酸添加、缺失或取代。不希望受理论束缚,据信这些恒定区、fc区或fc片段氨基酸中的一者或多者介导与fc受体例如fcrn的相互作用。在一些实施方案中,这些公开的氨基酸中的一者或多者被组氨酸、精氨酸、赖氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、天冬酰胺或谷氨酰胺取代。在一些实施方案中,非组氨酸残基被组氨酸残基取代。在一些实施方案中,组氨酸残基被非组氨酸残基取代。
[0112]
在一些实施方案中,抗cd19抗体包括igg抗体的恒定区、fc区或fc片段,其在位置308、309、311、312和314中的一个或多个位置处具有氨基酸修饰,更具体地,在位置308、309、311、312和314中的一个或多个位置处分别被苏氨酸、脯氨酸、丝氨酸、天冬氨酸和亮氨酸取代。在一些实施方案中,位置308、309和311中的一个或多个位置处的残基分别被异亮氨酸、脯氨酸和谷氨酸取代。在其他实施方案中,位置308、309、311、312和314中的一个或多
个位置处的残基分别被苏氨酸、脯氨酸、丝氨酸、天冬氨酸和亮氨酸取代。
[0113]
在一些实施方案中,抗cd19抗体包括igg抗体的恒定区、fc区或fc片段,其在位置251、252、254、255和256中的一个或多个位置处具有氨基酸修饰,更具体地,在这一个或多个位置处具有取代。在一些实施方案中,残基251被亮氨酸或精氨酸取代,残基252被亮氨酸、酪氨酸、苯丙氨酸、丝氨酸、色氨酸或苏氨酸取代,残基254被苏氨酸或丝氨酸取代,残基255被亮氨酸、甘氨酸、异亮氨酸或精氨酸取代,并且/或者残基256被丝氨酸、苯丙氨酸、精氨酸、谷氨酰胺、谷氨酸、天冬氨酸、丙氨酸、天冬酰胺或苏氨酸取代。在一些实施方案中,残基251被亮氨酸取代,残基252被酪氨酸或亮氨酸取代,残基254被苏氨酸或丝氨酸取代,并且/或者残基255被精氨酸取代。在其他实施方案中,残基252被苯丙氨酸取代并且/或者残基256被天冬氨酸取代。在一些实施方案中,残基251被亮氨酸取代,残基252被酪氨酸取代,残基254被苏氨酸或丝氨酸取代,并且/或者残基255被精氨酸取代。
[0114]
在一些实施方案中,抗cd19抗体包括igg抗体的恒定区、fc区或fc片段,其在位置428、433、434、435和436中的一个或多个位置处具有氨基酸修饰,更具体地,在这一个或多个位置处具有取代。在一些实施方案中,残基428被甲硫氨酸、苏氨酸、亮氨酸、苯丙氨酸或丝氨酸取代,残基433被赖氨酸、精氨酸、丝氨酸、异亮氨酸、脯氨酸、谷氨酰胺或组氨酸取代,残基434被苯丙氨酸、酪氨酸或组氨酸取代,残基435被酪氨酸取代,并且/或者残基436被组氨酸、天冬酰胺、精氨酸、苏氨酸、赖氨酸、甲硫氨酸或苏氨酸取代。在一些实施方案中,一个或多个位置433、434、435和436处的残基分别被赖氨酸、苯丙氨酸、酪氨酸和组氨酸取代。在一些实施方案中,残基428被甲硫氨酸取代并且/或者残基434被酪氨酸取代。
[0115]
在一些实施方案中,抗cd19抗体包括igg抗体的恒定区、fc区或fc片段,其在位置385、386、387和389中的一个或多个位置处具有氨基酸修饰,更具体地,在这一个或多个位置处具有取代。在一些实施方案中,残基385被精氨酸、天冬氨酸、丝氨酸、苏氨酸、组氨酸、赖氨酸或丙氨酸取代,残基386被苏氨酸、脯氨酸、天冬氨酸、丝氨酸、赖氨酸、精氨酸、异亮氨酸或甲硫氨酸取代,残基387被精氨酸、组氨酸、丝氨酸、苏氨酸、丙氨酸或脯氨酸取代,并且/或者残基389被脯氨酸或丝氨酸取代。在一些实施方案中,位置385、386、387和389中的一个或多个位置处的残基分别被精氨酸、苏氨酸、精氨酸和脯氨酸取代。在一些实施方案中,位置385、386和389中的一个或多个位置处的残基分别被天冬氨酸、脯氨酸和丝氨酸取代。
[0116]
在一些实施方案中,抗cd19抗体包括igg抗体的恒定区,fc区或fc片段,其具有以下取代中的一者或多者:残基251处的亮氨酸,残基252处的酪氨酸或亮氨酸,残基254处的苏氨酸或丝氨酸,残基255处的精氨酸,残基308处的苏氨酸,残基309处的脯氨酸,残基311处的丝氨酸,残基312处的天冬氨酸,残基314处的亮氨酸,残基385处的精氨酸,残基386处的苏氨酸,残基387处的精氨酸,残基389处的脯氨酸,残基428处的甲硫氨酸,残基433处的赖氨酸,残基434处的苯丙氨酸或酪氨酸,位置435处的酪氨酸,和/或位置436处的酪氨酸。可以包括在恒定区、fc区或fc片段中的其他氨基酸取代包括在例如美国专利第6,277,375号;第8,012,476号和第8,163,881号中描述的那些。
[0117]
在一些实施方案中,本文所述的抗cd19抗体包括重链恒定结构域,其包括例如pct公布第wo 94/28027号和第wo 98/47531号;和xu等人(2000)cell immunol 200:16-26中描述的ala-ala突变。因此,在一些实施方案中,在包括ala-ala突变的重链恒定区内具有一个
或多个突变的抗cd19抗体具有降低的效应子功能或没有效应子功能。根据这些实施方案,本文所述的抗cd19抗体的恒定区可包含在位置234处对丙氨酸的取代和/或在位置235处的对丙氨酸的突变(eu编号)。
[0118]
如本领域技术人员将理解的,任何此类重链恒定区序列可以容易地例如通过分子生物学技术与本文提供的或别的本领域已知的任何其他抗体序列或结构域,包括如本文公开或别的本领域已知的任何框架区、cdr或恒定结构域或其部分(如可存在于本文公开或别的本领域已知的任何形式的抗体或其抗原结合片段中)组合。
[0119]
轻链可变区
[0120]
本发明另外提供了一种cd19抗体或其片段,所述cd19抗体或其片段包含在一个或多个轻链可变区中的各种特定序列,包含于轻链互补决定区lcdr1-3中。在各个实施方案中,具有特定轻链可变区的分子提供有如上文所讨论的重链序列。在某些实施方案中,cdr是根据kabat编号系统来鉴定的。
[0121]
因此,在一方面,本发明提供了一种cd19抗体或其片段,所述cd19抗体或其片段包含sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的重链可变互补决定区(cdr)序列以及具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqagavpit(seq id no:12)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
[0122]
在一些实施方案中,所述cd19抗体或其片段包含sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的重链可变互补决定区(cdr)序列以及具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqvdslhpft(seq id no:13)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
[0123]
在一些实施方案中,所述cd19抗体或其片段包含sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的重链可变互补决定区(cdr)序列以及具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqaggvpplt(seq id no:14)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
[0124]
在一些实施方案中,所述cd19抗体或其片段包含sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的重链可变互补决定区(cdr)序列以及具有rasqsvrssyla(seq id no:8)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqlfdspyt(seq id no:15)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
[0125]
在一些实施方案中,所述cd19抗体或其片段包含sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的重链可变互补决定区(cdr)序列以及具有rasqsvrssyla(seq id no:8)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqagvpplt(seq id no:16)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
[0126]
在一些实施方案中,所述cd19抗体或其片段包含sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的重链
可变互补决定区(cdr)序列以及具有rasqsvsssyla(seq id no:7)(lcdr1)、gassrat(seq id no:9)(lcdr2)和qqaggvppft(seq id no:17)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
[0127]
在一些实施方案中,所述cd19抗体或其片段包含sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的重链可变互补决定区(cdr)序列以及具有rasqsvsssyla(seq id no:7)(lcdr1)、gasnrat(seq id no:10)(lcdr2)和qqagvfpft(seq id no:18)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
[0128]
在一些实施方案中,所述cd19抗体或其片段包含sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的重链可变互补决定区(cdr)序列以及具有rasqsvsssyla(seq id no:7)(lcdr1)、gasrrat(seq id no:11)(lcdr2)和qqagippyt(seq id no:19)(lcdr3)的互补决定区(cdr)序列的轻链可变区。
[0129]
在一些实施方案中,所述cd19抗体或其片段包含含有与seq id no:20具有至少90%同一性的氨基酸序列的免疫球蛋白轻链可变(vl)区;和含有与seq id no:5具有至少90%同一性的氨基酸序列的免疫球蛋白重链可变(vh)区。
[0130]
在一方面,本发明提供了一种cd19抗体或其片段,所述cd19抗体或其片段包含含有与seq id no:20-27具有至少90%同一性的氨基酸序列的免疫球蛋白轻链可变(vl)区;和含有与seq id no:5具有至少90%同一性的氨基酸序列的免疫球蛋白重链可变(vh)区。在一些实施方案中,所述vl区包含与seq id no:20-27具有至少95%同一性的氨基酸序列。
[0131]
在一些实施方案中,所述抗cd19抗体或其片段包含sygmh(seq id no:1)(hcdr1)、liwydgsnkyyadsvkg(seq id no:2)(hcdr2)和pvegllrgfdy(seq id no:3)(hcdr3)的重链可变互补决定区(cdr)序列并且/或者包含表1中所示的轻链可变区(vl)互补决定区(cdr)序列。在一些实施方案中,所述抗cd19抗体或其片段包含表1中所示的轻链可变区(vl)互补决定区(cdr)序列:
[0132]
表1.抗cd19轻链可变cdr
[0133][0134]
在一些实施方案中,抗cd19抗体或其片段包含具有表2中所示的氨基酸序列或由所示核酸序列编码的轻链可变区(vl)。
[0135]
表2.可变轻链序列
[0136]
[0137]
[0138][0139]
在一些实施方案中,所述抗cd19抗体包含与seq id no:20-27具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的轻链氨基酸序列。
[0140]
在一些实施方案中,所述抗cd19抗体包含轻链氨基酸序列,所述轻链氨基酸序列与seq id no:20-27具有至少85%、90%、95%、98%或99%序列同一性,同时还包括本文所述的vl cdr1、vlcdr2和/或vlcdr3序列中的一者或多者。
[0141]
在一些实施方案中,所述抗cd19抗体或其片段包含与seq id no:20-27同一的轻链氨基酸序列。在一些实施方案中,所述抗cd19抗体相对于seq id no:20-27包含不超过30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3
或2个氨基酸取代。
[0142]
在一些实施方案中,本发明的核酸序列编码抗cd19抗体,所述抗cd19抗体包含轻链氨基酸序列,所述轻链氨基酸序列与seq id no:20-27具有至少85%、90%、95%、98%或99%序列同一性,同时还包括本文所述的vl cdr1、vlcdr2和/或vlcdr3序列中的一者或多者。
[0143]
如本领域技术人员将理解的,任何此类轻链cdr序列可以容易地例如通过分子生物学技术与本文提供的或别的本领域已知的任何其他抗体序列或结构域,包括如本文公开或别的本领域已知的任何框架区、cdr或恒定结构域或其部分(如可存在于本文公开或别的本领域已知的任何形式的抗体或其抗原结合片段中)组合。
[0144]
在一些实施方案中,本文所述的抗cd19抗体包括轻链,所述轻链包括任何轻链恒定结构域序列,例如本领域技术人员已知的轻链恒定序列。如本领域技术人员将意识到的,轻链恒定结构域可以是κ轻链恒定结构域或λ轻链恒定结构域。在某些实施方案中,如本文所公开的轻链恒定结构域是κ轻链恒定结构域。在各个实施方案中,本文所述的抗cd19抗体包括轻链恒定结构域。
[0145]
示例性抗体
[0146]
工程化抗体可以包括本文所述的各种重链和轻链。在一些实施方案中,抗cd19抗体可以包括两条重链和轻链。在各个实施方案中,本公开涵盖这样的抗体,其包含至少一个如本文所公开的重链和/或轻链、至少一个如本文所公开的重链和/或轻链框架结构域、至少一个如本文所公开的重链和/或轻链cdr结构域,和/或任何如本文所公开的重链和/或轻链恒定结构域。
[0147]
在各个实施方案中,本文公开的抗cd19抗体是同源二聚体单克隆抗体。在各个实施方案中,本文公开的抗cd19抗体是异源二聚体抗体。在各个实施方案中,抗cd19抗体是例如典型的抗体或双抗体、三抗体、四抗体、微型抗体、最大抗体、tandab、dvd、bite、scfv、tandab scfv、fab、fab2、fab3、f(ab')2等,或它们的任何组合。
[0148]
在一些实施方案中,本公开提供了包含一个或多个如本文所述的可变结构域或工程化抗体或其部分和一种或多种另外多肽的融合蛋白。
[0149]
示例性单链可变片段
[0150]
在一些实施方案中,本公开提供了单链可变片段。在一些实施方案中,scfv是人scfv。“单链可变片段”或“scfv”是指共价连接形成vh::vl异源二聚体的免疫球蛋白(例如,小鼠或人)的重链(vh)和轻链(v
l
)可变区的融合蛋白。重链(vh)和轻链(v
l
)直接接合或通过肽编码接头(例如,10、15、20、25个氨基酸)接合,所述接头将vh的n末端与v
l
的c末端连接,或将vh的c末端与v
l
的n末端连接。接头通常富含甘氨酸以提高柔性,以及丝氨酸或苏氨酸以提高溶解度。接头可以连接细胞外抗原结合结构域的重链可变区和轻链可变区。接头的非限制性实例公开于shen等人,anal.chem.80(6):1910-1917(2008)和wo 2014/087010中,所述文献的内容特此以引用的方式整体并入本文。在某些实施方案中,接头是g4s接头(seq id no:46)。
[0151]
或者或另外,scfv可以源自fab'(而不是源自抗体,例如从fab文库获得)。在某些实施方案中,抗cd19抗体或其片段是fab。在某些实施方案中,fab是交联的。在某些实施方案中,抗cd19抗体或其片段是fab2。任何前述分子可以包含在具有异源序列的融合蛋白中
以形成抗cd19抗原抗体或其抗原结合片段。
[0152]
在某些实施方案中,抗cd19抗体或其片段以至少约1x 10-6
m、至少约1x 10-7
m、至少约1x 10-8
m、至少约1x 10-9
m或至少约1x-10
m的解离常数(kd)结合cd19(例如,人cd19)。在某些实施方案中,抗cd19抗体或其片段以至少约2x 10-8
m的解离常数(kd)结合cd19(例如,人cd19)。在某些实施方案中,抗cd19抗体或其片段以约2x 10-8
m与约8x 10-9
m之间的解离常数(kd)结合cd19(例如,人cd19)。
[0153]
在一些实施方案中,抗cd19抗体或其片段以约1nm与50nm、约5nm与30nm、约5nm与25nm或约8nm与20nm之间的解离常数(kd)结合cd19(例如,人cd19)。在一些实施方案中,抗cd19抗体或其片段以至少约50nm、至少约40nm、至少约35nm、至少约30nm、至少约25nm、至少约20nm、至少约19nm、至少约18nm、至少约17nm、至少约16nm、至少约15nm、至少约14nm、至少约13nm、至少约12nm、至少约11nm、至少约10nm、至少约9nm、至少约8nm、至少约7nm、至少约6nm、至少约5nm的解离常数(kd)结合cd19(例如,人cd19)。
[0154]
在一些实施方案中,抗cd19 scfv包含含有seq id no:1-4的可变重链。在一些实施方案中,抗cd19 scfv包含含有表1中提供的一个或多个cdr序列的可变轻链。在一些实施方案中,抗cd19 scfv包含含有表2中提供的一个多个轻链序列的可变轻链。
[0155]
在一些实施方案中,抗cd19 scfv包含接头,所述接头包含以下提供的seq id no:36所示氨基酸序列或由其组成:
[0156]
ggggsggggsggggs[seq id no:36]
[0157]
在一些实施方案中,所述接头包含以下提供的seq id no:37所示氨基酸序列或由其组成:
[0158]
ggggsggggsgggsggggs[seq id no:37]
[0159]
在一些实施方案中,所述接头包含以下提供的seq id no:38所示氨基酸序列或由其组成:
[0160]
ggggsggggsggggsgggsggggs[seq id no:38]
[0161]
在一些实施方案中,所述接头包含以下提供的seq id no:39所示氨基酸序列或由其组成:
[0162]
ggggsggggsggggsggggsgggsggggs[seq id no:39]
[0163]
在一些实施方案中,抗cd19抗体或其片段包含保守序列修饰(例如,本文所述的抗cd19抗体或其片段)。在一些实施方案中,保守序列修饰是不显著影响或改变包含氨基酸序列的当前公开的抗cd19抗体或其片段(例如,所述抗体或其片段)的结合特征的氨基酸修饰。保守修饰可以包括氨基酸取代、添加和缺失。可以通过本领域已知的标准技术,如定点诱变和pcr介导的诱变,将修饰引入抗cd19抗体或其片段中。氨基酸可以根据其物理化学性质如电荷和极性进行分类。保守氨基酸取代是其中氨基酸残基被同一组内的氨基酸替代的取代。例如,氨基酸可以按电荷分类:带正电荷的氨基酸包括赖氨酸、精氨酸、组氨酸,带负电荷的氨基酸包括天冬氨酸、谷氨酸,中性电荷的氨基酸包括丙氨酸、天冬酰胺、半胱氨酸、谷氨酰胺、甘氨酸、异亮氨酸、亮氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸。此外,氨基酸可以按极性分类:极性氨基酸包括精氨酸(碱性极性)、天冬酰胺、天冬氨酸(酸性极性)、谷氨酸(酸性极性)、谷氨酰胺、组氨酸(碱性极性)、赖氨酸(碱性极性)、丝氨酸、苏氨酸和酪氨酸;非极性氨基酸包括丙氨酸、半胱氨酸、甘氨酸、异亮氨
酸、亮氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、色氨酸和缬氨酸。因此,cdr区内的一个或多个氨基酸残基可以用来自同一组的其他氨基酸残基替代,并且可以测试改变的抗体的保留功能。在某些实施方案中,指定序列或cdr区内的不超过一个、不超过二个、不超过三个、不超过四个、不超过五个残基被改变。
[0164]
在一些实施方案中,抗cd19 scfv的轻链和/或重链包含信号肽。在一些实施方案中,信号肽包含与氨基酸序列mdmrvpaqllgllllwlpdtrc(seq id no:40)或mefglswvflvallrgvqc(seq id no:41)具有至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同源性或同一性的氨基酸序列。
[0165]
在一些实施方案中,抗cd19 scfv包含seq id no:42所示的氨基酸序列。eivltqspgtlslspgeratlscrasqsvsssylawyqqkpgqaprlliygassratgipdrfsgsgsgtdftltisrlepedfavyycqqagavpitfgggtkveikggggsggggsggggsqvqlvesgggvvqpgrslrlscaasgftfssygmhwvrqapgkglewvaliwydgsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycakpvegllrgfdywgqgtlvtvss[seq id no:42]
[0166]
在一些实施方案中,抗cd19 scfv包含与seq id no:42具有至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同源性或同一性的氨基酸序列。
[0167]
在一些实施方案中,抗cd19 scfv包含seq id no:43所示的氨基酸序列。
[0168]
eivltqspgtlslspgeratlscrasqsvrssylawyqqkpgqaprlliygassratgipdrfsgsgsgtdftltisrlepedfavyycqqlfdspytfgggtkveikggggsggggsggggsqvqlvesgggvvqpgrslrlscaasgftfssygmhwvrqapgkglewvaliwydgsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycakpvegllrgfdywgqgtlvtvss[seq id no:43]
[0169]
在一些实施方案中,抗cd19 scfv包含与seq id no:43具有至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同源性或同一性的氨基酸序列。
[0170]
在一些实施方案中,抗cd19 scfv包含seq id no:44所示的氨基酸序列。
[0171]
qvqlvesgggvvqpgrslrlscaasgftfssygmhwvrqapgkglewvaliwydgsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycakpvegllrgfdywgqgtlvtvssggggsggggsggggseivltqspgtlslspgeratlscrasqsvsssylawyqqkpgqaprlliygasrratgipdrfsgsgsgtdftltisrlepedfavyycqqagippytfgggtkveik[seq id no:44]
[0172]
在一些实施方案中,抗cd19 scfv包含与seq id no:44具有至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同源性或同一性的氨基酸序列。
[0173]
核苷酸序列
[0174]
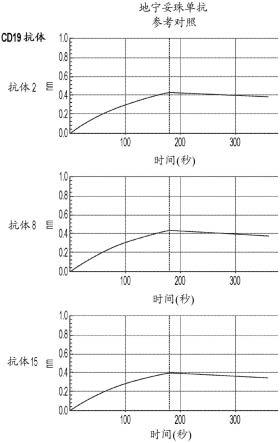
本公开包括编码一种或多种重链、重链可变结构域、重链框架区、重链cdr、重链恒定结构域、轻链、轻链可变结构域、轻链框架区、轻链cdr、轻链恒定结构域,或其他免疫球蛋白样序列,或本文公开的抗体的核苷酸序列。在各个实施方案中,此类核苷酸序列可以存在于载体中。在各个实施方案中,此类核苷酸可以存在于细胞,例如需要治疗的受试者的细胞或用于产生抗体的细胞例如用于产生抗体的哺乳动物细胞的基因组中。
[0175]
工程化抗体和融合蛋白
[0176]
在一些实施方案中,本公开提供了融合蛋白,所述融合蛋白包含(i)本文所述的一个或多个抗原结合区(例如,免疫球蛋白、重链抗体、轻链抗体、基于lrr的抗体或具有抗体样性质的其他蛋白质支架的抗原结合区,以及本领域已知的其他抗原结合部分,包括例如fab、fab'、fab'2、fab2、fab3、f(ab')2、fd、fv、feb、scfv、smip、抗体、双抗体、三抗体、四抗体、微型抗体、最大抗体、tandab、dvd、bite、tandab等),例如本文所述的一个或多个可变结构域或其部分(例如,本文所述的一个或多个cdr),和(ii)一种或多种另外的多肽。例如,白蛋白是一种丰富的血清蛋白,可通过与fcrn相互作用所介导的ph依赖性循环而免于降解。在一些实施方案中,如本文所述的一个或多个可变结构域或工程化抗体或其部分(例如,本文所述的一个或多个cdr)与白蛋白、其部分(例如结合fcrn的白蛋白的部分)和/或以提高的亲和力结合fcrn的白蛋白工程化变体融合。在其他情况下,如本文所述的一个或多个可变结构域或工程化抗体或其部分(例如,本文所述的一个或多个cdr)与结合白蛋白的多肽融合而形成融合蛋白-白蛋白复合物,它又可以结合fcrn。在一些实施方案中,结合白蛋白的多肽是单链可变片段(scfv)。白蛋白或其部分可以包括一个或多个氨基酸的突变,所述突变可以改变白蛋白融合蛋白与fcrn的结合。此类突变在本领域中是已知的(参见,例如,andersen等人,nature communications 3:610doi:10.1038/nocmms1607(2012))。在其他情况下,本文所述的一个或多个可变结构域或工程化抗体或其部分(例如,本文所述的一个或多个cdr)与转铁蛋白融合。转铁蛋白通过与转铁蛋白受体结合而再循环(参见,例如,widera等人,adv.drug deliv.rev.55:1439-66(2003))。
[0177]
抗cd19抗体与cd19和/或fc受体的ph依赖性结合
[0178]
本文所述的工程化抗体可经工程化以表现出对cd19的亲和力方面的ph依赖性或增强的ph依赖性(例如,由本文所述的一个或多个可变结构域介导),和/或改变的(例如,增加的,例如,ph依赖性的)对fcrn的亲和力(例如,由本文所述的一个或多个恒定结构域介导)。例如,在一些实施方案中,能够结合cd19的抗体或能够结合cd19的可变结构域在血清ph(例如,在中性ph或在高于7.4的ph)下以比在区室(例如,内体)ph(例如,在酸性ph或在等于或小于ph 6.0的ph下)下更高的亲和力结合cd19。在其中cd19被具有ph依赖性cd19结合的抗体所结合的各个实施方案中,ph从血清ph到区室ph(例如,从血清到内体)的转变促进cd19和抗体在区室ph和/或在特定区室例如内体中的分离(即,“解结合”)。在各个实施方案中,这种ph依赖性结合可以介导抗体再循环和/或cd19降解。在特定情况下,从血清ph到区室ph(例如,从血清到内体)的转变促进cd19和抗体在区室ph下和/或在特定区室例如内体中的分离(即,“解结合”),使得抗体被fcrn再循环出来并且抗原在溶酶体中被降解。在一些此类情况下,cd19结合的ph依赖性提高了抗体的“持续合成能力”,至少体现在再循环时,抗体返回血清并自由结合靶循环cd19。在一些情况下,展现出ph依赖性cd19结合的抗体的再循环可以继续,直到抗体最终降解或被降解,那时单个抗体分子可能已经结合并介导了多个(而不仅仅是一个)cd19分子的失活。
[0179]
在某些实施方案中,本文公开的抗cd19抗体包括恒定结构域(例如,fc结构域),其展现出相对于对照对fc受体(如fcrn)的增加的亲和力。在一些实施方案中,这种相对于对照增加的亲和力是在血清ph值(例如,高于6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2或更高的ph)下出现的。在一些实施方案中,这种相对于对照增加的
亲和力是在区室ph(例如,低于7.2、7.1、7.0、6.9、6.8、6.7、6.6、6.5、6.4、6.3、6.2、6.1、6.0、5.9、5.8、5.7、5.6、5.5、5.4、5.3、5.2、5.1、5.0或更低的ph)下出现的。在某些实施方案中,本文公开的抗cd19抗体包括恒定结构域(例如,fc结构域),其展现出相对于对照对fc受体(如fcrn)的亲和力的ph依赖性(或增强的ph依赖性)。新生儿fc受体(fcrn)是一种mhc i类分子,其功能是保护igg和白蛋白免受分解代谢,介导igg跨上皮细胞的转运,并参与专职抗原呈递细胞的抗原呈递。igg抗体亚型表现出较长的血清半衰期,这主要是由于fcrn从内体清除抗体,使igg从细胞再循环。
[0180]
在一些实施方案中,抗cd19抗体的血清半衰期增加。例如,抗cd19抗体与fcrn的结合将抗体的血清半衰期增加至约4天至约45天,例如约5天至约30天、约10天至约30天或约20天至约30天。在某些实施方案中,本文所述的抗cd19抗体的血清半衰期为约5天、约10天、约15天、约20天、约25天、约30天、约35天、约40天、约45天、约50天或更长。
[0181]
在某些实施方案中,本文所述的抗cd19抗体表现出对cd19的亲和力的ph依赖性变化。亲和力可以测量为kd,抗体和抗原的平衡解离常数;kd和亲和力是负相关的。在各个实施方案中,如本文所述的抗cd19抗体在血清ph(例如,高于6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2或更高的ph)下或在血清条件下对cd19的kd为小于约10-4
、10-5
、10-6
、10-7
、10-8
、10-9
、10-10
、10-11
、10-12
、10-13
、10-14
或10-15
m。在某些情况下,如本文所述的抗体在血清ph下对cd19的kd在0.001与1nm之间,例如0.001nm、0.005nm、0.01nm、0.05nm、0.1nm、0.5nm或1nm。在一些实施方案中,在区室ph(例如,低于7.2、7.1、7.0、6.9、6.8、6.7、6.6、6.5、6.4、6.3、6.2、6.1、6.0、5.9、5.8、5.7、5.6、5.5、5.4、5.3、5.2、5.1、5.0或更低的ph)下或在区室条件下对cd19的kd比同一抗体在血清ph下或在血清条件下对cd19的kd高(并且/或者在区室ph下或在区室条件下抗体对cd19的亲和力相对于在血清ph下或在血清条件下的亲和力可降低)例如至少2倍,例如2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、75倍、100倍150倍、200倍、250倍、300倍、350倍、400倍、450倍、500倍、600倍、700倍、800倍、900倍、1000倍、2,000倍、3,000倍、4,000倍、5,000倍、6,000倍、7-000倍、8,000倍、9,000倍、10,000倍或更多。在一些实施方案中,在区室ph(例如,低于7.2、7.1、7.0、6.9、6.8、6.7、6.6、6.5、6.4、6.3、6.2、6.1、6.0、5.9、5.8、5.7、5.6、5.5、5.4、5.3、5.2、5.1、5.0或更低的ph)下或在区室条件下cd19的kd可以例如大于10-15
、10-14
、10-13
、10-12
、10-11
、10-10
、10-9
、10-8
、10-7
、10-6
、10-5
、10-4
或10-3
m。在某些情况下,如本文所述的抗cd19抗体在区室ph下或在区室条件下对cd19的kd可以是例如等于或大于1nm,例如1nm、2nm、3nm、4nm、5nm、10nm、20nm、30nm、40nm、50nm、100nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1mm或更多。
[0182]
在一些实施方案中,本文所述的抗cd19抗体在施用于受试者时,例如在受试者的血清中,表现出比参考抗体(例如,交叉竞争cd19结合的抗体)更长的半衰期。在各个实施方案中,参考抗体(例如,交叉竞争cd19结合的抗体)在血清中的半衰期可以是例如250至300小时。在各个实施方案中,如本文所述的抗cd19抗体在血清中的半衰期可以是例如至少250小时,例如至少260、270、280、290或300小时。在某些实施方案中,如本文所述的抗cd19抗体在血清中的半衰期可以是至少300小时,例如至少350、400、450、500、550、600、650、700、750、800、850、900、950或1,000小时。在某些实施方案中,如本文所述的抗cd19抗体在血清中的半衰期可以是至少1,000小时,例如至少1,500、2,000、2,500、3,000、3,500、4,000、4,
500、5,000、6,000、7,000、8,000、9,000、10,000、11,000、12,000、13,000、14,000或15,000小时或更长时间。在各个实施方案中,如本文所述的抗cd19抗体在血清中的半衰期可以是至少12天、15天、20天、25天、30天、35天、40天、45天、50天、2个月、3个月、4个月、5个月、6个月或更长时间。在各个实施方案中,与参考抗体(例如,交叉竞争cd19结合的抗体)相比,如本文所述的抗cd19抗体在血清中的半衰期可以增加至少一个因子,例如2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、75倍、100倍或更多。
[0183]
在某些实施方案中,本文所述的抗cd19抗体表现出血浆中半衰期增加,血浆中平均保留时间增加,和/或cd19清除水平增加(例如,交叉竞争cd19结合的抗体)。这些参数可以通过本领域技术人员已知的方法确定(例如,如nestorov等人,j.clin.pharmacol.48:406-417(2008);leveque等人,anticancer research 25:2327-2344(2005);igawa等人,plos one 8:e63236.doi:10.1371/journal.pone.0063236(2013)所述)。例如,本文所述的抗cd19抗体(例如,单剂量的这种抗cd19抗体)相对于参考抗体将血浆中cd19的水平降低至少10倍、50倍、100倍、250倍、500倍、750倍、1000倍、1500倍或更多。
[0184]
工程化抗体及其片段
[0185]
根据本公开的cd19抗体及其片段经工程化以包括一个或多个结合部分,所述一个或多个结合部分以ph依赖性方式特异性结合一个或多个目标靶标。cd19抗体及其片段涵盖核酸(例如,rna和dna)、蛋白质(例如,抗体)以及它们的组合。ph依赖性结合部分可以是或包括例如核酸(例如,rna和dna)和适体、多肽(例如,抗体或其片段、白蛋白、受体、配体、信号肽、抗生物素蛋白和蛋白a)、多糖、生物素、疏水基团、亲水基团、药物和任何与受体结合的有机分子。
[0186]
作为结合部分的抗体或其片段
[0187]
在一些实施方案中,本文所述的抗体或其片段是抗cd19抗体。在一些情况下,本文所述的一个或多个结合部分是或包括抗体、其抗原结合片段和/或其fc区(或fc片段)。igg抗体的基本结构由通过二硫键连接在一起的两条相同的多肽轻链和两条相同的多肽重链组成。位于每条链氨基末端的第一结构域的氨基酸序列是可变的,提供了在每个单独的抗体中发现的抗体结合特异性。这些被称为可变重(vh)和可变轻(vl)区。每条链的其他结构域的氨基酸序列相对不变,称为恒定重(ch)和恒定轻(cl)区。对于igg抗体,轻链包括一个可变区(vl)和一个恒定区(cl)。igg重链包括可变区(vh)、第一恒定区(ch1)、铰链区、第二恒定区(ch2)和第三恒定区(ch3)。在ige和igm抗体中,重链包括一个另外的恒定区(ch4)。
[0188]
抗体可包括例如单克隆抗体、重组产生的抗体、单特异性抗体、多特异性抗体(包括双特异性抗体)、人抗体、工程化抗体、人源化抗体、嵌合抗体、免疫球蛋白、合成抗体、包含两条重链和两条轻链的四聚体抗体轻链分子、抗体轻链单体、抗体重链单体、抗体轻链二聚体、抗体重链二聚体、抗体轻链-抗体重链对、胞内抗体、抗体融合物(有时在本文中称为“抗体缀合物”)、异源缀合物抗体、单结构域抗体、单价抗体、单链抗体或单链fv(scfv)、骆驼化抗体、affybody、fab片段、f(ab')2片段、二硫键连接的fv(sdfv)、抗独特型(抗id)抗体(包括例如抗抗id抗体)、微型抗体、结构域抗体、合成抗体(有时称为“抗体模拟物”),以及上述任一者的抗原结合片段。在某些实施方案中,本文所述的抗体是指多克隆抗体群体。
[0189]
如本文所用,术语“fc片段”是指保留本文所述的fc功能和/或活性(如与fc受体结合)的fc区的一个或多个片段。如本文所用,术语抗体的“抗原结合片段”是指保留特异性结
合抗原的能力的抗体的一个或多个片段。涵盖在术语抗体的“抗原结合片段”中的结合片段的实例包括fab片段、f(ab')2片段、fd片段、fv片段、scfv片段、dab片段(ward等人,(1989)nature 341:544-546)和分离的互补决定区(cdr)。这些抗体片段可以使用本领域技术人员已知的常规技术获得,并且可以以与完整抗体相同的方式筛选片段的实用性。
[0190]
在一些方面,本发明提供了结合人cd19的抗体或其片段,所述抗体或其片段包含人重和/或轻恒定区,其中人重恒定区包含含有人igg1、人igg2、人igg3或人igg4的fc区的同种型变体。
[0191]
在另一方面,本发明提供了结合人cd19的人源化抗体或其片段,其中所述抗体包含变体人igg fc区,其包含氨基酸取代s324n,即亲本抗体的氨基酸位置324处的丝氨酸被天冬酰胺取代,而包含变体人igg fc区的抗体与亲本抗体相比表现出改善的补体依赖性细胞毒性(cdc)。
[0192]
抗体或片段可以通过本领域已知的用于合成抗体的任何方法产生(参见,例如,harlow等人,antibodies:a laboratory manual,(cold spring harbor laboratory press,第2版.1988);brinkman等人,1995,j.immunol.methods 182:41-50;wo 92/22324;wo 98/46645)。可以使用例如morrison,1985,science 229:1202中描述的方法产生嵌合抗体并通过描述于例如美国专利第6,180,370号中的方法产生人源化抗体。
[0193]
本文所述的另外的组合物和方法是双特异性抗体和多价抗体,如例如segal等人,j.immunol.methods 248:1-6(2001);和tutt等人,j.immunol.147:60(1991)中所述。
[0194]
工程化抗原结合区
[0195]
在一些实施方案中,结合部分是或包括抗体(例如,igg抗体,例如igg1、igg2或igg3抗体)或抗原结合片段,其经工程化以相对于参考抗体或抗原结合片段以改变的方式(例如,以ph敏感性方式,例如以更强或更弱的ph敏感性方式)结合靶标(即,抗原)。例如,可以通过对一个或多个抗体cdr内和/或抗体cdr结构包含的位置处的氨基酸进行修饰(例如,通过添加、缺失或取代)来工程化抗体。可以修饰的抗体的示例性非限制性位点包括以下(氨基酸位置基于kabat编号(kabat等人,(1991)sequences of proteins of immunological interest,nih)指示)。
[0196]
重链:h27、h31、h32、h33、h35、h50、h58、h59、h61、h62、h63、h64、h65、h99、h100b和h102
[0197]
轻链:l24、l27、l28、l32、l53、l54、l56、l90、l92和l94。
[0198]
在一些实施方案中,这些公开的氨基酸中的一者或多者可以被组氨酸、精氨酸、赖氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、天冬酰胺或谷氨酰胺取代。不希望受理论束缚,据信用组氨酸取代这些位置中的一个或多个位置处的氨基酸可以产生具有ph依赖性抗原结合性质的抗体。在一些实施方案中,非组氨酸残基被组氨酸残基取代。在一些实施方案中,组氨酸残基被非组氨酸残基取代。另外的工程化抗原结合区包括描述于例如美国公布第20110229489号中的那些。
[0199]
工程化恒定区
[0200]
在一些情况下,结合部分是或包括结合一种或多种fc受体(例如,fcγri、fcγriia、fcγriib、fcγriiia、fcγriiib、fcγriv或fcrn受体)的抗体恒定区、fc区或fc片段。在一些实施方案中,恒定区、fc区或fc片段经工程化以相对于参考恒定区、fc区或fc片
段以改变的方式(例如,以ph敏感性方式,例如以更强或更弱的ph敏感性方式)结合靶标(例如,fc受体)。
[0201]
在一些情况下,结合部分可以是或包括igg抗体的恒定区、fc区或fc片段,其经工程化以包括本文所述的氨基酸残基(例如,251-256、285-290、308-314、385-389和428-436(kabat编号(kabat等人,(1991)sequences of proteins of immunological interest,nih)))中一者或多者的氨基酸添加、缺失或取代。
[0202]
产生cd19抗体及其片段
[0203]
在一些实施方案中,本文所述的抗体或其片段通过使用已知技术进行诱变而被工程化以包括表现出与一种或多种靶标的ph敏感性结合的一个或多个结合部分。例如,可以获得参考多肽(例如,治疗性抗体或治疗性融合蛋白)的序列,并且可以对一个或多个氨基酸残基进行添加、缺失或取代。在一些实施方案中,一个或多个氨基酸残基被组氨酸、精氨酸、赖氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、天冬酰胺或谷氨酰胺取代。在一些实施方案中,一个或多个氨基酸被组氨酸取代。不希望受理论束缚,据信用组氨酸取代氨基酸残基可导致插入质子化位点,这可以增加结合部分的ph敏感性。多肽可以使用标准方法来产生并如本文所述测定与目标靶标的结合。增加结合部分的ph敏感性的其他方法描述于例如sarkar等人,nature biotechnology 20:908-913(2002);murtaugh等人,protein science 20:1619-1631(2011);和美国公布第20110229489号中。
[0204]
在一些实施方案中,选择第一个目标靶标,并提供、获得和/或产生(例如,使用如本文所述的已知方法)选择性结合所述靶标的抗体。取代(例如,用组氨酸、精氨酸、赖氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、天冬酰胺或谷氨酰胺取代)抗原结合区和/或fc区的一个或多个氨基酸,并且测定与靶标(以及,另外或替代地,与fcrn)结合的ph敏感性。
[0205]
在一些实施方案中,提供、获得和/或产生天然结合目标靶标的多肽。使用已知方法将多肽缀合至本文所述的fc区或fc片段(例如,其以期望的结合亲和力结合fcrn)。例如,多肽和fc区或fc片段可以通过化学方式或通过重组表达缀合作为融合蛋白。另外或替代地,多肽的一个或多个氨基酸可以被取代(例如,被组氨酸、精氨酸、赖氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、天冬酰胺或谷氨酰胺取代),并且测定多肽与靶标结合的ph敏感性。
[0206]
在一些实施方案中,本文所述的抗体或其片段经工程化以包括一个或多个结合部分,所述一种或多种一个或多个结合部分通过筛选鉴定和/或选出。例如,可以使用表达抗原结合部分的文库,例如噬菌体文库,鉴定以ph敏感性方式结合抗原的抗原结合部分。可以针对在第一ph下(例如,在ph 7.4下)对抗原具有第一亲和力并且在第二ph下(例如,在ph 5.5下)对抗原具有第二亲和力的抗原结合部分筛选这样的文库。本文所述的抗体或其片段可经工程化以包括此类鉴定的ph敏感性抗原结合部分。另外和/或替代地,可以使用文库鉴定以ph敏感性方式结合fcrn的fcrn结合部分。筛选重组抗体文库的方法是已知的(参见,例如,hoogenboom,nature biotech.23:1105-1116(2005);美国专利第5,837,500号;美国专利第5,571,698号;wo 2012/044831)。
[0207]
peg化
[0208]
在某些实施方案中,如本文所述的抗cd19抗体可以经peg化以包括单或多(例如,2-4)peg部分。与非peg化参考抗体,例如具有相同氨基酸序列但具有不同的、不同量的peg化或无peg化的抗体相比,此类peg化抗体可展现出增加的半衰期。
[0209]
peg化可以通过本领域已知的任何合适的反应进行。制备peg化蛋白质的方法通常可包括(a)在多肽与一个或多个peg基团连接的条件下,使多肽与聚乙二醇(如peg的反应性酯或醛衍生物)反应;以及(b)获得反应产物。一般来讲,用于反应的条件可以基于已知参数和所需结果逐个确定。
[0210]
本领域技术人员可以使用多种peg连接方法。例如,本文所述的使抗体或其片段peg化的步骤可以通过与反应性聚乙二醇分子的酰化反应或烷基化反应来进行。
[0211]
测量结合部分与靶标的相互作用
[0212]
本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)与靶标(例如,cd19和/或fcrn)的结合性质可以通过本领域已知的方法来测量,所述方法例如以下方法之一:biacore分析、酶联免疫吸附测定(elisa)、x射线晶体学、序列分析和扫描诱变。抗体与cd19和/或fcrn的结合相互作用可以使用表面等离子体共振(spr)来分析。spr或生物分子相互作用分析(bia)实时检测生物特异性相互作用,无需标记任何相互作用物。bia芯片结合表面的质量变化(指示结合事件)会导致表面附近光的折射率发生变化。折射率变化会产生可检测信号,该可检测信号被测量为生物分子之间实时反应的指示。使用spr的方法描述于,例如,美国专利第5,641,640号;raether(1988)surface plasmons springer verlag;sjolander and urbaniczky(1991)anal.chem.63:2338-2345;szabo等人(1995)curr.opin.struct.biol.5:699-705以及biacore international ab(uppsala,sweden)提供的线上资源中。另外,还可以使用从sapidyne instruments(boise,同上)获得的(kinetic exclusion assay)测定。
[0213]
来自spr的信息可用于提供关于结合部分与靶标(例如,抗cd19抗体与cd19和/或fcrn)的结合的平衡解离常数(kd)和动力学参数(包括k
on
和k
off
)的准确和定量测量。此类数据可以用来比较不同的分子。来自spr的信息也可用于开发结构-活性关系(sar)。例如,可以评估特定结合部分在各种ph水平下与靶标的动力学和平衡结合参数。可以鉴定与特定结合参数,例如特定ph水平下的高亲和力、低亲和力和慢k
off
相关的给定位置处的变体氨基酸。
[0214]
治疗方法
[0215]
在一些实施方案中,本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)用于治疗一种或多种cd19相关疾患的方法中。在一些实施方案中,本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)用作药物。cd19相关疾患可以包括但不限于由以下症状引起的疾患,所述症状包括,包括全部或部分由cd19表达导致的症状,或已知与cd19表达一起发生的症状。
[0216]
在一些方面,本发明提供了一种用于治疗癌症的方法,所述方法包括施用特异性结合cd19的剂(例如,本文所述的抗cd19抗体或其片段)。癌症是一大类疾病,其特征是体内异常细胞不受控制地生长。不受控制的细胞分裂和生长导致恶性肿瘤的形成,恶性肿瘤侵袭邻近组织,并且还可能通过淋巴系统或血流转移到身体的远处部位。在一些实施方案中,“癌症”或“癌症组织”包括实体瘤。可以通过本发明的方法治疗的癌症的实例包括但不限于免疫系统的癌症,包括淋巴瘤、白血病、骨髓瘤和其他白细胞恶性肿瘤。在一些实施方案中,所述癌症是b细胞淋巴瘤。
[0217]
在一些实施方案中,b细胞淋巴瘤选自由以下组成的组:急性成淋巴细胞性白血病
(all)、aids相关淋巴瘤、alk阳性大b细胞淋巴瘤、伯基特淋巴瘤(burkitt's lymphoma)、慢性淋巴细胞白血病(cll)、经典型霍奇金淋巴瘤、弥漫性大b细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤、血管内大b细胞淋巴瘤、hhv8相关多中心卡斯特曼病(hhv8-associated multicentric castleman's disease)中出现的大b细胞淋巴瘤、淋巴瘤样肉芽肿、淋巴浆细胞性淋巴瘤、套细胞淋巴瘤(mcl)、边缘区b细胞淋巴瘤(mzl)、粘膜相关淋巴组织淋巴瘤(malt)、结节边缘区b细胞淋巴瘤(nmzl)、结节性淋巴细胞为主的霍奇金淋巴瘤、非霍奇金淋巴瘤、浆母细胞性淋巴瘤、原发性中枢神经系统淋巴瘤、原发性渗出性淋巴瘤、脾边缘区淋巴瘤(smzl)和华氏巨球蛋白血症。在一些实施方案中,b细胞淋巴瘤选自由以下组成的组:急性成淋巴细胞性白血病(all)、慢性淋巴细胞白血病(cll)、弥漫性大b细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤、套细胞淋巴瘤(mcl)、边缘区b细胞淋巴瘤(mzl)、粘膜相关淋巴组织淋巴瘤(malt)和非霍奇金淋巴瘤。在一些实施方案中,b细胞淋巴瘤是非霍奇金淋巴瘤。
[0218]
在各个实施方案中,施用本文所述的抗体或其片段(例如,本文所述的抗cd19抗体或其片段)导致如本文所述或别的本领域中已知的cd19相关疾患的一种或多种症状或生物标志物的发生率、频率、水平和/或量与受试者的先前测量值或参考值相比减少,例如一种或多种症状或生物标志物减少至少3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%、95%、99%或100%。
[0219]
在一些实施方案中,向患有癌症的受试者施用本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)使得在可比条件下相比参考抗体(例如,交叉竞争cd19结合的抗体)癌症的一种或多种症状或生物标志物更大地减少或改善。
[0220]
在一些实施方案中,本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)与参考蛋白(例如,交叉竞争cd19结合的抗体)相比表现出降低的有效剂量。例如,如本文所述的抗cd19抗体的有效剂量可以是,例如,小于1,000mg/剂,例如小于900mg/剂、800mg/剂、700mg/剂、600mg/剂、500mg/剂、550mg/剂、400mg/剂、350mg/剂、300mg/剂、200mg/剂、100mg/剂、50mg/剂、25mg/剂或更低。在某些情况下,如本文所公开的抗cd19抗体的有效剂量低于参考抗体的有效或推荐或批准剂量,参考抗体的剂量可以是例如900mg/剂或600mg/剂。替代地或与如本文所公开的剂量组合,如本文所述的抗cd19抗体可以少于每周一次,例如少于每周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月或一年一次的频率有效或有用地施用。在某些情况下,如本文所公开的抗cd19抗体的有效或有用的施用频率低于参考抗体的有效或推荐或批准的施用频率,所述施用频率可以每周一次(例如,以300-600mg的剂量,取决于受试者的体重)或每两周一次(例如,以300-1200mg的剂量,取决于受试者的体重)施用。
[0221]
在一些实施方案中,本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)可以如与参考蛋白(例如,交叉竞争cd19结合的抗体)相比以降低的剂量施用,同时获得相等、同等有效、相当有效或基本有效的结果,其中抗cd19抗体呈与参考物(例如,交叉竞争cd19结合的抗体)相同、等效或基本等效的制剂和/或通过相同、等效或基本等效的施用途径施用。在一些实施方案中,本文所述的抗cd19抗体可以如与参考抗体(例如,交叉竞争cd19结合的抗体)相比以延长的间隔施用,同时获得相等、同等有效、相当有效或基本有效的结果,其中抗cd19抗体呈与参考物相同、等效或基本等效的制剂和/或通过相同、等效或基本等效的施用途径施用。在一些实施方案中,本文所述的抗cd19抗体可以如与参考抗体相比以降
低的单位剂量数量和/或缩短的治疗时期施用,同时获得相等、同等有效、相当有效或基本有效的结果,其中抗cd19抗体呈与参考物(例如,交叉竞争cd19结合的抗体)相同、等效或基本等效的制剂和/或通过相同、等效或基本等效的施用途径施用。
[0222]
根据一些这样的实施方案,与有效剂量的参考抗体(例如,例如交叉竞争cd19结合的抗体)相比,所施用剂量的本文所述的抗cd19抗体在施用于受试者时不太可能引发不良反应,例如不良免疫反应。因此,在各个实施方案中,与参考抗体相比,如本文所公开的抗cd19抗体每施用活性单位不太可能诱导不良反应或副作用。在各个实施方案中,与参考抗体相比,如本文所公开的抗cd19抗体每施用活性单位不太可能诱导具有特定严重程度的不良反应或副作用。在各个实施方案中,与参考抗体相比,如本文所公开的抗cd19抗体每施用活性单位可在更小的程度上或在更少的患者中诱导一种或多种不良反应或副作用。可能与施用能够结合cd19的抗体相关的不良反应或副作用的实例可能包括头痛、鼻咽炎、背痛、恶心、腹泻、高血压、上呼吸道感染、腹痛、呕吐、贫血、咳嗽、外周水肿和/或尿路感染。
[0223]
在一些实施方案中,在向受试者施用(例如,以单剂量施用)后,在施用后的限定时间(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14天或更多天)测量到血浆中本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)的水平相对于同一限定时间对照(例如,交叉竞争cd19结合的抗体)的水平有所增加。例如,在施用单剂量后的限定时间,本文所述的抗cd19抗体的水平比参考抗体的对应水平高至少10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、300%、400%或500%。
[0224]
在一些实施方案中,在施用(例如,单剂量)后的限定时间(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14天或更多天)测量到血浆中本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)的水平相对于同一限定时间对照的水平有所增加。例如,在施用后的限定时间,本文所述的抗cd19抗体的水平比参考抗体的对应水平高至少10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、300%、400%或500%。
[0225]
在一些实施方案中,本文所述的抗cd19抗体具有增加的半衰期(例如,相对于对照,例如参考抗体,例如交叉竞争cd19结合的抗体),因此抗cd19抗体可以以增加的剂量间间隔施用于受试者。例如,抗cd19抗体可以每周、每两周、每三周、每四周、每6周、每8周或更长的持续时间施用一次。
[0226]
在一些实施方案中,本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)的治疗有效量是参考治疗性蛋白(例如,交叉竞争cd19结合的抗体)的有效量的约90%、80%、70%、60%、50%、40%、30%、20%、10%或5%。在一些实施方案中,本文所述的单剂抗cd19抗体实现与两剂或更多剂参考抗体相当的治疗效果。
[0227]
在一些实施方案中,本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)以为受试者中靶抗原(例如,cd19)的浓度的约90%、80%、70%、60%、50%、40%、30%、20%、10%或5%的剂量施用。
[0228]
在一些实施方案中,可以使用本领域技术人员已知的各种方法和递送系统中的任一种将本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)物理引入受试者。本文公开的制剂的示例性施用途径包括静脉内、肌肉内、皮下、腹膜内、脊髓或其他肠胃外施用途径,例如通过注射或输注。如本文所用的短语“肠胃外施用”意指除了肠内和局部施用以外的施用模式,通常通过注射施用,并且包括但不限于静脉内、肌肉内、动脉内、鞘内、淋巴内、
病灶内、囊内、眶内、心内、真皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊髓内、硬膜外和胸骨内注射和输注,以及体内电穿孔。在一些实施方案中,制剂通过非肠胃外途径施用,这些途径包括局部、表皮或粘膜施用途径,例如鼻内、阴道、直肠、舌下或局部。施用也可以进行例如一次、多次,和/或历经一个或多个延长时期。
[0229]
在一些实施方案中,本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)可用于多种诊断和治疗应用。例如,如本文所述的工程化抗体的可检测标记型式可用于检测样品(例如,生物样品)中cd19的存在或量的测定中。本文所述的工程化抗体可用于体外测定中以研究与cd19的结合。在一些实施方案中,本文所述的抗cd19抗体可用作设计用于鉴定另外可用于治疗cd19相关病症的其他新颖化合物的测定中的阳性对照。例如,本文所述的抗cd19抗体可用作用于鉴定与cd19结合的其他化合物(例如,小分子、适体或抗体)的测定中的阳性对照。
[0230]
本文所述的抗体或其抗原结合片段可用于监测受试者,例如患有、疑似患有、有风险发展出或正在治疗一种或多种cd19相关疾患的受试者。监测可以包括确定受试者中、例如受试者血清中cd19的量或活性。在一些实施方案中,在施用如本文所述的抗cd19抗体后,进行评估持续至少一(1)小时,例如至少2、4、6、8、12、24或48小时,或至少1天、2天、4天、10天、13天、20天或更长时间,或至少1周、2周、4周、10周、13周、20周或更长时间。受试者可以在一个或多个以下时期进行评估:在治疗开始之前;在治疗过程中;或在施用治疗的一个或多个要素之后。评估可以包括评估是否需要进一步治疗,例如,评估剂量、施用频率或治疗持续时间是否应当被改变。它也可以包括评估是否需要添加或删除所选择的治疗方式,例如,添加或删除本文所述的cd19相关病症的任何治疗。
[0231]
制剂和施用
[0232]
在各个实施方案中,本文所述的抗体或其抗原结合片段(例如,本文所述的抗cd19抗体)可以掺入药物组合物中。这种药物组合物可以是可用的,例如,可用于预防和/或治疗疾病,例如cd19相关病症。药物组合物可以通过本领域技术人员已知的方法来配制(例如描述于remington’s pharmaceutical sciences,第17版,alfonso r.gennaro编,mack publishing company,easton,pa.(1985)中)。
[0233]
可以根据受试者的年龄和状况选择合适的施用方式。含有本文所述的抗体或其片段(例如,本文所述的抗cd19抗体)的药物组合物的单剂量可选自0.001至1000mg/kg体重的范围。在另一方面,剂量可以在0.001至100000mg/体重的范围内选择,但本公开不限于此类范围。施用的剂量和方法根据患者的体重、年龄、状况等而有所不同,本领域技术人员可根据需要适当选择。
[0234]
在各个实施方案中,药物组合物可以被配制为包括药学上可接受的载剂或赋形剂。药学上可接受的载剂的实例包括但不限于任何和所有生理上相容的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。本发明的组合物可以包含药学上可接受的盐,例如酸加成盐或碱加成盐。
[0235]
在各个实施方案中,包含如本文所述的抗体的组合物,例如注射用无菌制剂,可以根据常规药学实践使用注射用蒸馏水作为媒介物来配制。例如,生理盐水或含有葡萄糖和其他补充剂如d-山梨糖醇、d-甘露糖、d-甘露糖醇和氯化钠的等渗溶液可用作注射用水溶液,任选地结合合适的增溶剂,例如,醇如乙醇和多元醇如丙二醇或聚乙二醇,以及非离子
表面活性剂如聚山梨醇酯80
tm
、hco-50等。
[0236]
如本文所公开,药物组合物可以呈本领域已知的任何形式。此类形式包括例如液体、半固体和固体剂型,如液体溶液(例如,可注射和可输注的溶液)、分散体或悬浮液、片剂、丸剂、粉剂、脂质体和栓剂。
[0237]
任何特定形式的选择或使用可能部分取决于预期的施用模式和治疗应用。例如,含有预期用于全身或局部递送的组合物的组合物可以呈可注射或可输注的溶液的形式。因此,可以配制组合物以通过肠胃外模式(例如,静脉内、皮下、腹膜内或肌肉内注射)施用。如本文所用,肠胃外施用是指除了肠内和局部施用以外的施用模式,通常通过注射施用,并且包括但不限于静脉内、鼻内、眼内、经肺、肌肉内、动脉内、鞘内、囊内、眶内、心内、真皮内、肺内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊髓内、硬膜外、脑内、颅内、颈动脉内和胸骨内注射和输注。
[0238]
施用途径可以是肠胃外施用,例如通过注射施用、经鼻施用、经肺施用或经皮施用。可以通过静脉内注射、肌肉内注射、腹膜内注射、皮下注射进行全身或局部施用。
[0239]
在各个实施方案中,本发明的药物组合物可以被配制为适于在高浓度下稳定储存的溶液、微乳剂、分散体、脂质体或其他有序结构。可以通过将所需量的本文所述的组合物与一种上文列举的成分或其组合掺入适当的溶剂中,按照需要,接着进行过滤灭菌来制备无菌注射溶液。一般来说,通过将本文所述的组合物掺入无菌媒介物中来制备分散体,所述媒介物含有碱性分散介质和上文列举的所需要的其他成分。在用于制备无菌可注射溶液的无菌粉末的情况下,制备方法包括真空干燥和冷冻干燥,该方法从其先前无菌过滤溶液得到本文所述的组合物外加任何附加的所需成分(见下文)的粉末。例如,通过使用包衣如卵磷脂,在分散体的情况下通过保持所需要的颗粒大小,和通过使用表面活性剂,可以保持溶液的适当流动性。可以通过在组合物中包含延长吸收的试剂(例如单硬脂酸盐和明胶)实现可注射组合物的延长吸收。
[0240]
药物组合物可以以包含在水或另一种药学上可接受的液体中的无菌溶液或悬浮液的可注射制剂的形式肠胃外施用。例如,药物组合物可以通过以下方式来配制:将治疗性分子与药学上可接受的载体或介质适当组合,所述载体或介质如无菌水和生理盐水、植物油、乳化剂、悬浮剂、表面活性剂、稳定剂、风味赋形剂、稀释剂、媒介物、防腐剂、粘合剂,然后混合成普遍接受的药学实践所需的单位剂量形式。包含在药物制剂中的活性成分的量使得提供指定范围内的合适剂量。油性液体的非限制性实例包括芝麻油和大豆油,并且它可以与苯甲酸苄酯或苯甲醇组合作为增溶剂。可以包含的其他项是缓冲剂(如磷酸盐缓冲剂或乙酸钠缓冲剂)、安抚剂(如盐酸普鲁卡因)、稳定剂(如苯甲醇或苯酚)和抗氧化剂。配制的注射剂可以包装在合适的安瓿中。
[0241]
在一些实施方案中,组合物可以被配制成在低于0℃的温度(例如,-20℃或-80℃)下储存。在一些实施方案中,组合物可以被配制成在2℃-8℃(例如,4℃)下储存多至2年(例如,1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、11/2年或2年)。因此,在一些实施方案中,本文所述的组合物在2℃-8℃(例如,4℃)下稳定储存至少1年。
[0242]
在特定情况下,药物组合物可以被配制成溶液。在一些实施方案中,组合物可以被配制成例如合适浓度的且适于在2℃-8℃(例如,4℃)下储存的缓冲溶液。
[0243]
包含一种或多种如本文所述的工程化抗体的组合物可以被配制在免疫脂质体组合物中。此类制剂可以通过本领域已知的方法来制备。具有延长循环时间的脂质体公开于例如美国专利第5,013,556号中。
[0244]
在某些实施方案中,组合物可以被配制成含有将保护化合物免于快速释放的载剂,如包括植入物和微囊化递送系统在内的受控释放制剂。可以使用生物可降解的生物相容的聚合物,如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。制备此类制剂的许多方法在本领域中是已知的。参见,例如,j.r.robinson(1978)"sustained and controlled release drug delivery systems,"marcel dekker,inc.,new york。
[0245]
在一些实施方案中,组合物可以被配制成适于肺内施用(例如,通过吸入器或喷雾器施用)于哺乳动物如人的组合物。配制此类组合物的方法在本领域中是众所周知的。干粉吸入剂制剂和用于施用制剂的合适系统在本领域中也是已知的。肺部施用可以是经口和/或经鼻。用于肺部递送的药物装置的实例包括计量剂量吸入器、干粉吸入器(dpi)和喷雾器。例如,本文所述的组合物可以通过干粉吸入器施用至受试者的肺。这些吸入器是无推进剂的装置,可将可分散且稳定的干粉制剂递送至肺部。干粉吸入器在医学领域是众所周知的,并且包括但不限于:(astrazeneca;london,england)吸入器(cambridge,mass.);(glaxosmithkline;london,england);和eclipse
tm
(sanofi-aventis;paris,france)。另见,例如,pct公布第wo 04/026380号、第wo04/024156号和第wo 01/78693号。dpi装置已用于多肽如胰岛素和生长激素的肺部施用。在一些实施方案中,本文所述的组合物可以通过计量剂量吸入器进行肺内施用。这些吸入器依靠推进剂将离散剂量的化合物递送至肺部。其他装置和肺内施用方法阐述于例如美国专利申请公布第20050271660号和第20090110679号中,所述公布中每一个的公开内容以引用的方式整体并入本文。
[0246]
在一些实施方案中,可以配制组合物以例如以药学上可接受的溶液、悬浮液或软膏的形式递送至眼睛。用于治疗眼睛的制剂可以是无菌水溶液的形式,该无菌水溶液含有例如另外成分,如但不限于防腐剂、缓冲剂、张度剂、抗氧化剂和稳定剂、非离子润湿剂或澄清剂,以及增粘剂。如本文所述的制剂可以通过常规方法,例如以滴剂的形式,或通过将眼睛浸入治疗性溶液中,局部施用至需要治疗的受试者(例如,患有amd的受试者)的眼睛,所述滴剂或治疗性溶液含有一种或多种组合物。
[0247]
在某些实施方案中,用于将药物引入眼睛玻璃体腔的多种装置可能适于施用如本文所述的组合物。例如,美国公布第2002/0026176号描述了一种含有药物的塞子,所述塞子可以插入通过巩膜,使其伸入玻璃体腔,从而将药剂递送至玻璃体腔中。在另一实例中,美国专利第5,443,505号描述了一种用于引入脉络膜上腔或无血管区域中以将药物持续释放到眼睛内部的可植入装置。美国专利第5,773,019号和第6,001,386号各自公开了一种可附着到眼睛巩膜表面的可植入药物递送装置。用于将治疗剂递送至眼睛的其他方法和装置(例如,经巩膜贴片和通过隐形眼镜递送)描述于例如ambati和adamis(2002)prog retin eye res 21(2):145-151;ranta和urtti(2006)adv drug delivery rev 58(11):1164-1181;barocas和balachandran(2008)expert opin drug delivery 5(1):1-10(10);gulsen和chauhan(2004)invest opthalmol vis sci 45:2342-2347;kim等人(2007)ophthalmic res39:244-254;以及pct公布第wo 04/073551号,所述文献的公开内容以引用
的方式整体并入本文。
[0248]
在某些实施方案中,如本文所述的抗体的施用是通过向受试者施用编码所述抗体的核酸来实现的。可将编码本文所述治疗性抗体的核酸掺入基因构建体中以用作基因治疗方案的一部分从而递送可用于在细胞内表达和产生抗体的核酸。此类组分的表达构建体可以在任何治疗有效的载剂,例如能够有效地将组分基因递送至体内细胞的任何制剂或组合物中施用。方法包括将主题基因插入病毒载体,包括重组逆转录病毒、腺病毒、腺相关病毒、慢病毒和单纯疱疹病毒-1(hsv-1),或重组细菌或真核质粒。病毒载体可以直接转染细胞;质粒dna可以借助例如阳离子脂质体(lipofectin)或衍生的多聚赖氨酸缀合物、短杆菌肽s、人工病毒包膜或其他此类细胞内载剂,以及直接注射基因构建体或capo4沉淀来递送(参见,例如,wo04/060407)。合适的逆转录病毒的实例包括本领域技术人员已知的plj、pzip、pwe和pem(参见,例如,eglitis等人(1985)science 230:1395-1398;danos和mulligan(1988)proc natl acad sci usa 85:6460-6464;wilson等人(1988)proc natl acad sci usa 85:3014-3018;armentano等人(1990)proc natl acad sci usa 87:6141-6145;huber等人(1991)proc natl acad sci usa 88:8039-8043;ferry等人(1991)proc natl acad sci usa88:8377-8381;chowdhury等人(1991)science 254:1802-1805;van beusechem等人(1992)proc natl acad sci usa 89:7640-7644;kay等人(1992)human gene therapy 3:641-647;dai等人(1992)proc natl acad sci usa 89:10892-10895;hwu等人(1993)j immunol150:4104-4115;美国专利第4,868,116号和第4,980,286号;以及pct公布第wo89/07136号、第wo89/02468号、第wo89/05345和第wo92/07573号)。另一种病毒基因递送系统利用源自腺病毒的载体(参见,例如,berkner等人(1988)biotechniques 6:616;rosenfeld等人(1991)science 252:431-434;以及rosenfeld等人(1992)cell68:143-155)。源自腺病毒ad 5型dl324株或其他腺病毒株(例如,ad2、ad3、ad7等)的合适的腺病毒载体是本领域技术人员已知的。另一种可用于递送主题基因的病毒载体系统是腺相关病毒(aav)。参见,例如,flotte等人(1992)am j respir cell mol biol 7:349-356;samulski等人(1989)j virol 63:3822-3828;以及mclaughlin等人(1989)j virol62:1963-1973。
[0249]
在各个实施方案中,皮下施用可以通过如注射器、预充式注射器、自动注射器(例如,一次性或可重复使用的)、笔式注射器、贴片注射器、可穿戴注射器、带有皮下输液器的移动式注射器输注泵,或其他结合抗体药物进行皮下注射的装置等装置来完成。
[0250]
本公开的注射系统可以采用如美国专利第5,308,341号中所述的递送笔。笔式装置在本领域中是众所周知的,其最常用于糖尿病患者自行递送胰岛素。此类装置可以包括至少一个注射针头(例如,长度为约5至8mm的31号针头),通常预填充有一个或多个治疗单位剂量的治疗性溶液,并且可用于以尽可能少的痛苦向受试者快速递送溶液。一种药物递送笔包括小瓶支架,其中可以接收治疗性药物或其他药物的小瓶。笔可能是完全机械性的装置,或者可能与电子电路结合以精确设置和/或指示注射到使用者体内的药物剂量。参见,例如,美国专利第6,192,891号。在一些实施方案中,笔式装置的针头是一次性的并且套件包括一根或多根一次性替换针头。适于递送任何一种本发明特征组合物的笔式装置另外描述于例如美国专利第6,277,099号;第6,200,296号;和第6,146,361号中,所述专利各自的公开内容以引用的方式整体并入本文。一种基于微针的笔式装置描述于例如美国专利第7,556,615中,其公开内容以引用的方式整体并入本文。另见由scandinavian health ltd.
制造的精密笔式注射器(ppi)装置molly
tm
。
[0251]
在一些实施方案中,本文所述的组合物可以通过局部施用治疗性地递送至受试者。如本文所用,“局部施用”或“局部递送”可以指不依赖于将组合物或剂经由血管系统运输至其预期靶组织或部位的递送。例如,可以通过注射或植入组合物或剂或通过注射或植入含有组合物或剂的装置来递送组合物。在某些实施方案中,在靶组织或部位附近局部施用后,组合物或剂或其一种或多种组分可以扩散到不是施用部位的预期靶组织或部位。
[0252]
在一些实施方案中,本文提供的组合物以单位剂型存在,所述单位剂型可适于自行施用。这种单位剂型可以提供在容器内,所述容器通常为例如小瓶、药筒、预充式注射器或一次性笔。描述于美国专利第6,302,855号中的剂量仪如剂量仪装置也可以例如与本文所述的注射系统一起使用。
[0253]
本文所述的组合物的合适剂量(该剂量能够治疗或预防受试者的病症)可以取决于多种因素,包括例如待治疗的受试者的年龄、性别和体重以及所使用的特定抑制剂化合物。例如,治疗患有cd19相关病症的受试者所需的包含如本文所述抗体的一种组合物的剂量可能不同于所述抗体的不同制剂的剂量。影响施用于受试者的剂量的其他因素包括例如病症的类型或严重程度。例如,患有一种cd19相关病症的受试者可能需要施用与患有另一种cd19相关病症的受试者不同的剂量。其他因素可以包括,例如,同时或以前影响受试者的其他医学病症、受试者的一般健康状况、受试者的遗传倾向、饮食、施用时间、排泄率、药物组合以及施用于受试者的任何其他治疗剂。还应该理解,任何特定受试者的具体剂量和治疗方案也可以基于治疗医师的判断进行调整。
[0254]
本文所述的组合物可以以固定剂量或以毫克/千克(mg/kg)剂量施用。在一些实施方案中,还可以选择剂量以减少或避免产生针对组合物中一种或多种抗体或其抗原结合片段的抗体或其他宿主免疫反应。尽管决不意在限制,抗体如本文所述的组合物的示例性剂量包括例如1-1000mg/kg、1-100mg/kg、0.5-50mg/kg、0.1-100mg/kg、0.5-25mg/kg、1-20mg/kg和1-10mg/kg。本文所述的组合物的示例性剂量包括但不限于0.1mg/kg、0.5mg/kg、1.0mg/kg、2.0mg/kg、4mg/kg、8mg/kg或20mg/kg。
[0255]
药物溶液可以包含治疗有效量的本文所述的组合物。这样的有效量可以由本领域普通技术人员部分地基于所施用组合物的效果或组合物与一种或多种另外的活性剂的组合效果(如果使用超过一种剂的话)容易地确定。本文所述的组合物的治疗有效量还可以根据个体的疾病状态、年龄、性别和体重以及组合物(和一种或多种另外的活性剂)在个体中引发所需反应(例如,至少一种疾患参数的改善,例如cd19相关病症的至少一种症状的改善)的能力等因素而变化。例如,本文所述的治疗有效量的组合物可以抑制特定病症(减轻其严重程度或消除其发生)并且/或者预防特定病症,和/或本领域已知或本文所述的特定病症的任何一种症状。治疗有效量也是其中组合物的任何毒性或有害作用被治疗有益作用超过的量。
[0256]
本文所述的任何组合物的合适人剂量可以在例如i期剂量递增研究中进一步评估。参见,例如,van gurp等人(2008)am jtransplantation 8(8):1711-1718;hanouska等人(2007)clin cancer res13(2,part 1):523-531;以及hetherington等人(2006)antimicrobial agents and chemotherapy 50(10):3499-3500。
[0257]
组合物的毒性和治疗功效可以通过细胞培养物或实验动物(例如,任何cd19相关
病症的动物模型)中的已知药学程序来确定。这些程序可用于例如确定ld
50
(对50%群体致死的剂量)和ed
50
(对50%群体治疗有效的剂量)。毒性与治疗作用之间的剂量比为治疗指数并且它可表示为ld
50
/ed
50
比。本文所述的表现出高治疗指数的组合物是优选的。虽然可使用表现出毒性副作用的组合物,但是应采取谨慎以设计将所述化合物靶向受影响的组织的部位的递送系统并将对正常细胞的潜在损害降至最低并且由此降低副作用。
[0258]
本领域技术人员将了解可在配制用于人类的剂量范围中使用由细胞培养测定和动物研究获得的数据。本文所述的组合物的适当剂量通常在包含ed
50
且毒性很小或没有毒性的组合物的循环浓度范围内。剂量可取决于所采用的剂型和所利用的施用途径而在这个范围内变化。对于本文所述的组合物,治疗有效剂量最初可由细胞培养测定来估计。可在动物模型中配制剂量来实现包括如在细胞培养中测定的i0(即,实现症状的半最大抑制的抗体的浓度)的循环血浆浓度范围。所述信息可用于更准确地测定人体中的有用剂量。可例如通过高效液相色谱法测量血浆中的水平。在一些实施方案中,例如在需要局部施用(例如,施用至眼睛或关节)的情况下,细胞培养或动物模型建立可用于确定在局部部位内达到治疗有效浓度所需的剂量。
[0259]
组合疗法
[0260]
在各个实施方案中,如本文所述的抗cd19抗体可以包括在还包括向受试者施用至少一种另外的剂的治疗过程中。在各个实施方案中,与如本文所述的抗cd19抗体组合施用的另外的剂可以是剂化疗剂。在各个实施方案中,与如本文所述的抗体组合施用的另外的剂可以是抑制炎症的剂。
[0261]
在一些实施方案中,抗cd19抗体是对人cd19具有特异性的单链可变片段(scfv)。在一些实施方案中,抗cd19 scfv可以缀合(例如,连接)至治疗剂(例如,化疗剂和放射性原子)以结合癌细胞,将治疗剂递送至癌细胞,并杀死表达人cd19的癌细胞。在一些实施方案中,抗cd19抗体连接至治疗剂。在一些实施方案中,治疗剂是化疗剂、细胞因子、放射性原子、sirna或毒素。在一些实施方案中,治疗剂是化疗剂。在一些实施方案中,剂是放射性原子。
[0262]
在一些实施方案中,所述方法可以与针对cd19相关病症的其他疗法联合进行。例如,组合物可以在化疗的同时、之前或之后施用于受试者。在一些实施方案中,组合物可以在过继治疗方法的同时、之前或之后施用于受试者。
[0263]
在各个实施方案中,与如本文所述的抗cd19抗体组合施用的另外的剂可以与抗cd19抗体同时施用,与抗cd19抗体在同一天施用,或者与抗cd19抗体在同一周施用。在各个实施方案中,与如本文所述的抗cd19抗体组合施用的另外的剂可以与抗cd19抗体在单一制剂中施用。在某些实施方案中,另外的剂以与如本文所述的抗cd19抗体的施用在时间上分开的方式施用,例如,在施用抗cd19抗体之前或之后一小时或多小时、之前或之后一天或多天、之前或之后一周或多周,或之前或之后一个月或多个月施用。在各个实施方案中,一种或多种另外的剂的施用频率可以与如本文所述的抗cd19抗体的施用频率相同、相似或不同。
[0264]
组合疗法涵盖的是包括施用如本文所述的两种不同的抗体的治疗方案和/或包括通过多种制剂和/或施用途径施用如本文所述的抗体的治疗方案。
[0265]
在一些实施方案中,组合物可以与一种或多种另外的治疗剂,例如用于治疗或预
防受试者的cd19相关病症(例如,癌症或自身免疫性病症)的另外疗法一起配制。用于治疗受试者的cd19相关病症的另外的剂将根据所治疗的特定病症而变化,但可以包括但不限于利妥昔单抗、环磷酰胺、多柔比星、长春新碱、强的松、异环磷酰胺(osfamide)、卡铂、依托泊苷、地塞米松、阿糖胞苷、顺铂、环磷酰胺或氟达拉滨。
[0266]
本文所述的组合物可以代替或补充先前或目前正在施用的疗法。例如,在用本文所述的组合物治疗后,一种或多种另外的活性剂的施用可以停止或减少,例如以较低水平施用,例如在施用本文所述的抗cd19抗体后以相比交叉竞争cd19结合的参考抗体更低的水平施用。在一些实施方案中,先前疗法的施用可得以保持。在一些实施方案中,先前疗法将一直保持到组合物的水平达到足以提供治疗效果的水平。两种疗法可以组合施用。
[0267]
重组基因技术
[0268]
根据本公开,可以采用本领域技术范围内的常规分子生物学、微生物学和重组dna技术。此类技术描述于以下文献中(参见,例如,sambrook,fritsch&maniatis,molecular cloning:a laboratory manual,第二版(1989)cold spring harbor laboratory press,cold spring harbor,n.y.;dna cloning:a practical approach,第i卷和第ii卷(d.n.glover编1985);oligonucleotide synthesis(m.j.gait编1984);nucleic acid hybridization(b.d.hames&s.j.higgins编(1985));transcription and translation(b.d.hames&s.j.higgins,编(1984));animal cell culture(r.i.freshney编(1986));immobilized cells and enzymes(irl press,(1986));b.perbal,a practical guide to molecular cloning(1984);f.m.ausubel等人(编),current protocols in molecular biology,john wiley&sons,inc.(1994)。
[0269]
基因(如编码多肽(如本文所述的抗cd19抗体)的核酸)的重组表达可以包括构建含有编码所述多肽的核酸的表达载体。一旦获得了多核苷酸,就可以使用本领域已知的技术通过重组dna技术来产生用于产生多肽的载体。已知方法可用于构建包含多肽编码序列和适当的转录和翻译控制信号的表达载体。这些方法包括例如体外重组dna技术、合成技术和体内基因重组。
[0270]
可以通过常规技术将表达载体转移至宿主细胞,然后可以通过常规技术培养转染的细胞以产生多肽。
[0271]
本文提及的所有公布、专利申请、专利和其他参考文献以引用的方式整体并入本文。另外,所述材料、方法和实施例仅为说明性的,并非意在进行限制。除非另有限定,否则本文所用的所有技术和科学术语具有与本发明所属领域内的普通技术人员通常理解的意义相同的意义。尽管与本文所述的那些方法和材料类似或等效的方法和材料可于本发明的实践或测试中,但本文描述合适的方法和材料。
[0272]
实施例
[0273]
以下实施例描述了制造和实践本发明的一些优选模式。然而,应当理解,这些实施例仅用于说明目的,并不意在限制本发明的范围。
[0274]
实施例1.抗cd19抗体的鉴定和表征
[0275]
本实施例展示了对抗cd19抗体的表征。人抗cd19抗体源自adimab酵母并在其中产生。使用ez-link sulfo-nhs-biotinylation试剂盒(thermo scientific,目录号21425)将抗原生物素化。将抗原浓缩至约1mg/ml并将缓冲液更换成pbs,然后添加1:7.5摩尔比的生
物素化试剂。在再次更换缓冲液以去除溶液中的游离生物素之前,将混合物保持在4c过夜。通过在fortebio上标记的蛋白质的链霉亲和素传感器结合来确认生物素化。
[0276]
如先前所述繁殖八个幼稚的人合成酵母文库,每个文库的多样性为约109(参见,例如,y.xu等人,peds 26(10),663-70(2013);wo2009036379;wo2010105256;和wo2012009568)。
[0277]
对于前两轮选择,利用miltenyi macs系统进行磁珠分选技术,如先前所述(参见,例如,siegel等人,j immunol methods 286(1-2),141-153(2004))。简而言之,将酵母细胞(约1010个细胞/文库)与生物素化抗原在30℃的洗涤缓冲液(磷酸盐缓冲盐水(pbs)/0.1%牛血清白蛋白(bsa))中孵育30分钟。用40ml冰冷的洗涤缓冲液洗涤一次后,将细胞沉淀重悬于20ml洗涤缓冲液中,并将链霉亲和素微珠(streptavidin microbeads)(500μl)添加到酵母中并在4℃下孵育15分钟。接下来,使酵母沉淀,重悬于5ml洗涤缓冲液中,并装载到miltenyi ls柱上。装载5ml后,将柱用3ml洗涤缓冲液洗涤3次。然后将柱从磁场中移出,并将酵母用5ml生长培养基洗脱,然后生长过夜。
[0278]
使用流式细胞术(facs)进行第三轮选择。使大约2
×
107个酵母沉淀,用洗涤缓冲液洗涤三次,并在30℃下与100-200nm生物素化抗原在平衡条件下一起孵育。通过将生物素化的nalm-6和raji细胞与来自第3轮facs的选定酵母输出一起孵育来进行第四轮和第五轮选择。孵育后,将预洗过的m-280strepavidin dynabeads(目录号60210)添加到酵母/哺乳动物细胞复合物中并孵育。接下来,使用dynamag-2磁体分离复合物并去除未结合的上清液。将珠粒/细胞复合物用1ml选择缓冲液洗涤三次。然后将捕获的复合物转移到含有酵母生长培养基的烧瓶中进行繁殖。在第六轮选择中,对繁殖的酵母进行任一轮次和附加轮次的nalm-6/raji细胞选择,使用100nm重组cd19抗原进行选择,或使用多特异性试剂(psr)进行阴性选择以去除非特异性抗体。
[0279]
对于psr消耗,将文库与如前所述的1:10稀释度的生物素化psr试剂一起孵育(参见,例如,y.xu等人,peds 26(10),663-70(2013))。然后将酵母用洗涤缓冲液洗涤两次并用1:100稀释的山羊f(ab’)2抗人κ-fitc(lc-fitc)(southern biotech,目录号2062-02)和1:500稀释的streptavidin-af633(sa-633)(life technologies,目录号s21375)或1:50稀释的extravidin-phycoerthyrin(ea-pe)(sigma-aldrich,目录号e4011)二级试剂在4℃下染色15分钟。用冰冷的洗涤缓冲液洗涤两次后,将细胞沉淀重悬于0.3ml洗涤缓冲液中,并转移到过滤器封盖的分选管(strainer-capped sort tube)中。使用facs aria分选器(bd biosciences)进行分选,并确定分选门(sort gate)以选择具有所需特征的抗体。重复选择轮次,直到获得具有所有所需特征的群体。在最后一轮分选后,接种酵母并挑选个别菌落进行表征。
[0280]
轻链多样化
[0281]
将来自初始输出的重链用于制备轻链多样化文库,以用于附加选择轮次。从酵母提取重链质粒,在大肠杆菌中繁殖,随后从中纯化,并转化为多样性为5
×
106的轻链文库。如上文所述对这些文库进行选择,即进行一轮macs,用raji或nalm-6细胞进行两轮细胞选择,随后使用重组cd19抗原进行第四轮facs选择。具体到轻链多样化,raji和nalm-6细胞选择并入对工程化raji和nalm-6细胞的初始阴性选择,这些细胞已经历了cd19基因的靶向基因敲除。在消耗cd19敲除细胞后,使用表达内源性cd19的和过表达的工程化raji和nalm-6
细胞进行阳性选择。在不同的facs选择轮次中,通过抗原滴定评估文库的(多特异性试剂)psr结合、物种交叉反应性和亲和力压力。进行分选以便获得具有所需特征的群体。挑选来自上述每个facs选择轮次的个别菌落用于测序和表征。
[0282]
抗体产生和纯化
[0283]
使酵母克隆生长至饱和,然后在30℃下振荡诱导48小时。诱导后,使酵母细胞沉淀并收获上清液用于纯化。使用蛋白a柱纯化igg,并用ph 2.0的乙酸洗脱。
[0284]
fortebio kd测量
[0285]
在fortebio octet系统(octet red384,一般如先前所述(参见,例如,estep等人,mabs 5(2),270-278(2013))中测试这些抗cd19抗体对可溶性cd19的结合亲和力。简而言之,通过将igg在线装载到ahc传感器上来进行fortebio亲和力测量。将抗体固定在抗人igg针上并与可溶性cd19-hsa融合蛋白(与人血清白蛋白融合的cd19细胞外结构域)结合。将传感器在测定缓冲液中离线平衡30分钟,然后在线监测60秒以建立基线。将装载有igg的传感器暴露于100nm可溶性cd19-hsa融合蛋白抗原3分钟,然后转移到测定缓冲液中保持3分钟以进行解离率测量。使用1:1结合模型分析所有动力学。表3中提供了结合动力学的总结。示例性抗体的亲和力范围在8nm与20nm之间。表3中示出的所有抗cd19抗体的vh包括seq id no:5的vh序列。
[0286]
表3.抗cd19抗体的结合动力学
[0287][0288]
实施例2.抗cd19抗体的细胞上结合
[0289]
通过流式细胞术在表达内源性cd19的raji和nalm-6细胞系上评定抗cd19抗体的细胞上结合。在cd19阳性亲本系和对应cd19敲除raji和nalm-6系上测试每种抗体,以确认细胞上靶标特异性结合。图1中示出的流式细胞术色谱图显示,相比对应敲除细胞系上的背景结合,cd19阳性系上有1-2个对数偏移。
[0290]
图2a至图2c中示出的连续稀释流式细胞术结果显示nalm-6细胞上的饱和结合。从曲线计算的ec50值提供于表4中。示例性抗cd19抗体以至少0.2nm的高亲和力结合cd19阳性nalm-6细胞。在cd19阳性细胞上观察到的比可溶性蛋白更高的亲和力表明这些抗体结合的表位可能比在cd19-hsa融合蛋白中更天然地呈现在细胞上。
[0291]
表4.nalm6细胞上抗cd19抗体的ec50
[0292][0293]
实施例3.通过交叉竞争进行的表位框并
[0294]
进行交叉竞争表位框并测定以确定是否有任何抗cd19抗体与参考抗cd19抗体地宁妥珠单抗(denintuzumab)结合独特的非竞争性表位。使用夹心式交叉阻断测定进行表位框并/配体阻断。将对照抗靶标igg装载到ahq传感器上,并用不相关的人igg1抗体阻断传感器上未占用的fc结合位点。然后将传感器暴露于100nm靶抗原,接着是第二抗靶标抗体或配体。抗原缔合后第二抗体或配体的额外结合表明表位未占用(非竞争者),而没有结合则表明表位阻断(竞争者或配体阻断)。
[0295]
将抗cd19参考对照地宁妥珠单抗捕获在抗人igg针上,然后装载液相中的可溶性cd19。不是进行解离步骤,而是对每种测试抗体进行第二次装载。那些与地宁妥珠单抗结合非竞争性表位的抗体将在迹线上反映新的结合事件,而被地宁妥珠单抗阻断相同表位的抗体反映为平坦的迹线。图3中显示的结果表明,每种抗体都与地宁妥珠单抗竞争结合表位。这些结果表明这些抗体与参考抗cd19抗体地宁妥珠单抗竞争结合cd19上的相似表位。
[0296]
实施例4.抗cd19 scfv与cd19结合的表征
[0297]
在biacore spr测定中评定共同表位的相对竞争。在该测定中,评估包含抗cd19抗体2(seq id no:42)的vh和vl的scfv与cd19-t2结合剂、sj25c1和fmc63(来自kymriah的“tisagenlecleucel”和yescarta的“axicabtagene ciloleucel”)的相对竞争结合。将抗体2scfv固定在biacore cm5芯片上,然后将其由100nm cd19-hsa-his和某一滴定度的各竞争
者scfv(0、50nm、100nm、200nm和800nm)的混合物结合。在3分钟的竞争性结合步骤后,在缓冲液hbs-ep(300mm nacl)中进行5分钟的解离。
[0298]
在该测定中cd19抗体1scfv与所有参考抗体竞争(数据未显示)。即使在最低浓度(50nm)下,fmc63 scfv也完全竞争cd19结合。重复该测定以包括25nm,其中保留了少量与cd19的结合,表明这些抗体与cd19的结合亲和力与sj25c1 scfv相似但略高。这些数据表明,所有测试的结合剂都竞争结合cd19上的重叠表位。
[0299]
为了进一步评定抗cd19抗体结合非特异性膜蛋白的潜力,在表面膜蛋白(smp)测定中评估源自本文所述的cd19抗体的scfv。smp测定是一种基于elisa的测定,其中人hek-293或昆虫sf9细胞膜包被在板上,以测试这些测试抗体与这些膜的非特异性结合。与spr测定类似,将内部对照高和低非特异性结合抗体(高非特异性结合对照sc209,和低非特异性结合对照5f9)包括在内。得到的结果与上述spr测定一致,cd19抗体对hek-293或sf9膜的结合活性较低。
[0300]
其他实施方案
[0301]
尽管本文描述了本发明的许多实施方案,但可以改变本公开内容和实施例以提供本发明的其他方法和组合物。因此,将要理解的是,本发明的范围由所附权利要求外加由借助于实施例表示的具体实施方案来限定。本文引用的所有参考文献特此以引用的方式并入。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。