一种贝莱斯芽孢杆菌yfb3-1及其分离筛选与鉴定方法和应用
技术领域
1.本发明属于微生物技术领域,具体涉及一种贝莱斯芽孢杆菌 yfb3-1及其分离筛选与鉴定方法和应用。
背景技术:
2.百合枯萎病又称根腐病、茎腐病,是百合生产栽培中最为严重、 造成经济损失最大的一种真菌性病害,具有危害大、分布广、防治难 等特点,严重影响了百合的产量和品质,阻碍了百合产业的发展。镰 刀菌引起的百合枯萎病是其栽培过程中最为普遍和严重的。在百合栽 培过程中的任何温度和湿度条件下,镰刀菌都能够有效存活或者进行 生长繁殖,因此,百合在整个生长周期均可能被染病。连作百合的枯 萎病具有发生广泛、发病严重、防治困难等特点,造成产量和品质急 剧下降,已成为百合种植及其相关产业发展的主要限制因素,因此, 防治百合枯萎病已经成为其种植过程中面临的主要难题。
3.蚯蚓是土壤动物中生物量最大的物种,对土壤生态系统的物质循 环和能量转换起着重要的作用,对维持土壤生态系统的结构和功能起 着重要的调控作用,蚯蚓是土壤改良的“工程师”,与微生物具有互 作关系,通过其肠道将随食物进入体内的部分微生物被杀死,与蚯蚓 存在互利共生的微生物会成为优势菌群,在蚯蚓肠道内迅速扩繁,并 且通过其挖掘和排泄有利于在土壤中进一步繁殖和传播,改变了土壤 微生物群落结构和组成。蚯蚓肠道中分离出的菌群与土壤和新鲜的蚯 蚓粪的菌群存在显著差异,主要有四个生理类群,即植物生长促进剂、 游离活氮固化剂、杀菌剂和磷酸盐溶解剂。
4.蚯蚓可以通过直接或间接作用影响了微生物组成、丰富度和活性, 进而有效调节土壤的微生态系统,促进土壤养分循环,提高土壤生物 肥力,并且减少作物枯萎病的发生。
5.因此,利用蚯蚓调控土壤微生态环境成为了缓解作物连作障碍的 新途径。其肠道内是否具有高效拮抗百合尖孢镰刀菌的微生物以及其 作用和运用方向成为目前研究的主要发展方向。
技术实现要素:
6.针对上述缺点,本发明提供了一种贝莱斯芽孢杆菌yfb3-1及其 分离筛选与鉴定方法和应用。本发明贝莱斯芽孢杆菌yfb3-1对百合 枯萎病主要致病菌-尖孢镰刀菌的抑菌效果较强,并对百合的土传病 原真菌三线镰刀菌、茄腐镰刀菌、链格孢、齐整小核菌、疫霉菌、青 霉和黑曲霉都具有较好的拮抗效果,抑制率均在75%以上,具有高效 广谱抗土传病原真菌的能力;本发明方法能够有效从蚯蚓肠道中分离、 纯化、筛选和鉴定贝莱斯芽孢杆菌yfb3-1,本发明方法易于操作, 能够快速分离蚯蚓肠道内含物,通过筛选和鉴定能够准确可靠得到所 述贝莱斯芽孢杆菌yfb3-1。
7.为了实现上述目的,本发明采用如下技术方案:
8.一种贝莱斯芽孢杆菌yfb3-1,其特征在于,所述贝莱斯芽孢杆 菌yfb3-1在中国典型培养物保藏中心的保藏编号为cctcc m20221140,保藏机构地址:湖北省武汉市武昌区
八一路299号,保藏 日期:2022年7月21日,分类名称:bacillus velezensis yfb3-1。
9.优选的,所述贝莱斯芽孢杆菌yfb3-1菌落为乳白色,无光泽, 表面皱褶,边缘隆起不整齐,中间凹陷。
10.本发明还要求保护一种用于分离筛选和鉴定上述贝莱斯芽孢杆 菌yfb3-1的方法,包括如下步骤:
11.(1)分离:用无菌水清洗蚯蚓表面,然后用酒精对蚯蚓体表消 毒并致其死亡,接着解剖取出蚯蚓肠道内含物;
12.(2)纯化:将步骤(1)得到的含物加入到装有经过灭菌处理的 无菌水三角瓶中,振荡后制成悬液,再用无菌水将悬液稀释成10-3
梯 度的稀释液、10-4
梯度的稀释液和10-5
梯度的稀释液;将稀释后的10-3
梯度的稀释液涂布在na培养基的平板上进行培养,将稀释后的10-4
梯度的稀释液涂布到孟加拉红琼脂培养基的平板上进行培养,将稀释 后的10-5
梯度的稀释液涂布到改良高氏一号培养基的平板上进行培养; 然后挑取三种培养基平板上长势好的单菌落进行划线纯化菌株;
13.(3)筛选:将百合尖孢镰刀菌在pda上进行活化,接着用打孔 器在活化后的菌落边缘进行打孔,并取菌饼;将菌饼上长有菌丝的一 面朝下转接到新pda平板中央,然后采用十字交叉法点样分离纯化好 的菌株进行培养并筛选出对百合病原真菌尖孢镰刀菌拮抗作用最强 的拮抗菌株;
14.(4)鉴定:将步骤(3)所筛选出的拮抗菌株进行形态学鉴定, 然后进行分子生物学鉴定,鉴定出所述贝莱斯芽孢杆菌yfb3-1。
15.优选的,步骤(1)中所述酒精的体积分数为75%。
16.优选的,步骤(2)中所述振荡时间为15-45min,所述na培养基 的成分包括:蛋白胨7.5-15g,牛肉膏2-5g,nacl 3-6g,琼脂18-22g, 去离子水1000ml;所述孟加拉红琼脂培养基成分包括:蛋白胨3-8g, 葡萄糖8-12g,mgso4·
7h2o 0.25-1.5g,k2hpo
4 1.0g,孟加拉红 0.015-0.045g,琼脂18-22g,去离子水1000ml,质量浓度为1%的链 霉素溶液2-5ml;所述高氏1号培养基的成分包括:kno
3 0.5-1.5g, 可溶性淀粉18-22g,k2hpo
4 0.25-1g,mgso4·
7h2o 0.25-1g,nacl 0.25-1.5g,feso4·
7h2o 0.005-0.015g,琼脂18-22g,去离子水1000ml; 所述培养温度为25-45℃。
17.优选的,步骤(3)中所述pda的制备方法为:将马铃薯去皮切 块并称取100-300g,加水煮沸25-45min后制成浸汁,然后加入葡萄糖 18-22g,琼脂18-22g,加去离子水定容至1000ml;所述培养温度为 25-45℃。
18.优选的,步骤(4)中所述形态学鉴定的方法为:将拮抗菌划线 到所述na培养基固体平板上,在25-45℃条件下恒温培养箱中培养2-5 天,并且记录有单菌落的菌落形态,然后采用革兰氏染色法对菌体染 色,观察菌体的形态特征以及扫描电镜观察菌体形态和测量大小进行 形态学鉴定;所述分子生物学鉴定的方法为:采用细菌16s rdna基 因片段的通用引物扩增,然后进行基因测序进行分子生物学鉴定。
19.本发明还要求保护一种利用上述贝莱斯芽孢杆菌yfb3-1在防治 百合枯萎病上的应用。
20.与现有技术相比,本发明具有如下有益效果:
21.(1)本发明贝莱斯芽孢杆菌yfb3-1对百合枯萎病主要致病菌
‑ꢀ
尖孢镰刀菌的抑菌
效果较强,并对百合的土传病原真菌三线镰刀菌、 茄腐镰刀菌、链格孢、齐整小核菌、疫霉菌、青霉和黑曲霉都具有较 好的拮抗效果,抑制率均在75%以上,具有高效广谱抗土传病原真菌 的能力。
22.(2)本发明方法能够有效从蚯蚓肠道中分离、纯化、筛选和鉴 定贝莱斯芽孢杆菌yfb3-1,本发明方法易于操作,能够快速分离蚯 蚓肠道内含物,通过筛选和鉴定能够准确可靠得到所述贝莱斯芽孢杆 菌yfb3-1。
23.(3)本发明贝莱斯芽孢杆菌yfb3-1对百合尖孢镰刀菌枯萎病具 有较好的预防和治疗效果,在对缓解作物连作障碍有很大的应用价值。
附图说明
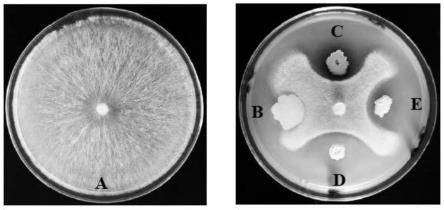
24.图1为蚯蚓肠道微生物对尖孢镰刀菌的拮抗效果图;
25.图2为本发明贝莱斯芽孢杆菌yfb3-1菌落形态图;
26.图3为本发明贝莱斯芽孢杆菌yfb3-1菌膜形态图;
27.图4为本发明贝莱斯芽孢杆菌yfb3-1光学显微镜图;
28.图5为本发明贝莱斯芽孢杆菌yfb3-1扫描电镜图;
29.图6为本发明贝莱斯芽孢杆菌yfb3-1的16s rdna基因序列的 系统发育树;
30.图7为本发明贝莱斯芽孢杆菌yfb3-1百合部分病原真菌的抑菌 效果图。
具体实施方式
31.以下将结合本发明实施例中的附图,对本发明实施例中的技术方 案进行清楚、完整地描述,显然,所描述地实施例是本发明一部分实 施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技 术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属 于本发明保护的范围。
32.如无特殊说明外,本发明中的化学试剂和材料均通过市场途径购 买或通过市场途径购买的原料合成。
33.所述贝莱斯芽孢杆菌yfb3-1在中国典型培养物保藏中心的保藏 编号为cctcc m 20221140,保藏日期:2022年7月21日,分类名称: bacillus velezensis yfb3-1,保藏机构地址:湖北省武汉市武昌区八 一路299号。
34.百合品种为卷丹百合,由湖南龙山绿叶农产品有限公司提供。蚯 蚓品种为赤子爱胜蚓大平2号,收集于中国科学院亚热带农业生态研 究所长沙市农业与环境监测研究站开展接种蚯蚓缓解百合连作障碍 试验的土壤。
35.供试病原菌:尖孢镰刀菌(f.oxysportum)、三线镰刀菌(f. trilobium)和链格孢(a.alternata)来源于湖南农业大学植保学院, 齐整小核菌(s.rolfsii)、疫霉菌(phytophthora parasitica)、茄病镰刀 菌(f.solani)、青霉(penicillium cyclopium)、黑曲霉(aspergillus niger) 和枯草芽孢杆菌(b.subtilis)来源于湖南省农业环境生态研究所,其 中以上的病原真菌均从染病百合植株或种球上分离获得。
36.市售芽孢杆菌复合制剂为北京臻裕疆某农业科技有限公司生产 粉剂,含有枯草芽孢杆菌、侧芽孢杆菌、地衣芽孢杆菌和胶质芽孢杆 菌,有效活菌总数≥2
×
108cfu/g。
37.na固体培养基的成分如下:蛋白胨10.0g,牛肉膏3.0g,nacl 5.0g,琼脂20.0g,去
离子水1000ml,ph自然,121℃灭菌30min。
38.孟加拉红琼脂培养基的成分如下:蛋白胨5.0g,葡萄糖10.0g, mgso4·
7h2o 0.5g,k2hpo
4 1.0g,孟加拉红0.033g,琼脂20.0g,去 离子水1000ml,质量浓度1%的链霉素溶液3ml;
39.高氏1号培养基的成分如下:kno
3 1.0g,可溶性淀粉20.0g, k2hpo
4 0.5g,mgso4·
7h2o 0.5g,nacl 0.5g,feso4·
7h2o 0.01g,琼 脂20.0g,去离子水1000ml;
40.pda的制备方法如下:将马铃薯去皮切块并称取200.0g,加800ml 去离子水煮沸30min后制成浸汁,然后进行过滤得到滤液,在滤液中 加入葡萄糖20.0g和琼脂20.0g,最后加去离子水定容至1000ml。
41.实施例1
42.一种上述贝莱斯芽孢杆菌yfb3-1的分离筛选和鉴定方法,包括 如下步骤:
43.(1)分离:首先无菌水清洗蚯蚓表面,再用75%的酒精对蚯蚓 体表消毒并致其死亡,然后解剖取出蚯蚓肠道内含物;
44.(2)纯化:将步骤(1)得到的含物加入到装有经过灭菌处理的 无菌水三角瓶中,振荡30min后制成悬液,再用无菌水将悬液稀释成 10-3
梯度的稀释液、10-4
梯度的稀释液和10-5
梯度的稀释液;将稀释后 的10-3
梯度的稀释液涂布在na培养基的平板上进行培养,将稀释后的 10-4
梯度的稀释液涂布到孟加拉红琼脂培养基的平板上进行培养,将 稀释后的10-5
梯度的稀释液涂布到改良高氏一号培养基的平板上进行 培养;置于30℃培养,待菌落长到一定程度出后,然后挑取三种培养 基平板上长势好的单菌落进行划线纯化菌株(菌落形态相同的归纳为 一株),保存备用。
45.(3)筛选:将百合尖孢镰刀菌在pda上进行活化,接着用直径 为0.6cm的打孔器在活化后的菌落边缘进行打孔,并取菌饼;将菌饼 上长有菌丝的一面朝下转接到新pda平板中央,然后采用十字交叉法 在距离平板正中央2.5cm处点样分离纯化好的菌株,以不接种作为对 照。置于30℃培养,待对照的病菌长满整个平板为止,测量各病原菌 直径、抑菌带宽等指标,计算抑制率,根据抑制率大小筛选出对百合 病原真菌尖孢镰刀菌拮抗作用最强的拮抗菌株。按照以下公式计算抑 制率:
46.抑制率=[(对照病原菌半径-0.3)-(处理病原菌半径-0.3)]/(对照病原菌 半径-0.3)
×
100%。
[0047]
(4)鉴定:将步骤(3)所筛选出的拮抗菌株进行形态学鉴定, 然后进行分子生物学鉴定,鉴定出所述贝莱斯芽孢杆菌yfb3-1。
[0048]
形态学鉴定:将优选的蚯蚓肠道拮抗菌划线到na培养基固体平 板上,在30℃条件下恒温培养箱中培养3天,记录有单菌落的菌落形 态,采用革兰氏染色法对菌体染色,观察菌体的形态特征,扫描电镜 观察菌体形态和测量大小。
[0049]
分子生物学鉴定:将待测菌株接种到灭菌好的nb培养基中30℃ 培养48h后,取发酵菌液10000r/min离心10min,收集沉淀,用无菌生 理盐水混匀再次离心,收集菌体沉淀,置于在-80℃下迅速冷冻后, 利用冰袋快递到送至长沙奥基生物科技有限公司,采用细菌16s rdna基因片段的通用引物(27f和1492r)扩增,进行基因测序。
[0050]
从接种蚯蚓缓解连作百合试验的蚯蚓肠道中分离纯化得到146株 菌株(包括细菌、真菌和放线菌)。利用平板对峙法并以尖孢镰刀菌 为靶标,对分离纯化好的菌株进行抑
菌试验初筛,一共筛选到对尖孢 镰刀菌具有明显抑菌效果的菌株33株(其中细菌18株、真菌3株、放 线菌12株),对百合尖孢镰刀的抑制率超过76%的菌株有11株,如表1 所示:
[0051]
表1蚯蚓肠道微生物对尖孢镰刀菌的拮抗效果
[0052][0053]
注:数据为四次重复的平均值。小写字母表示不同处理间差异显著(p《0.05)
[0054]
由表1可知,细菌菌株yfb3-1对尖孢镰刀的抑菌效果最好,其抑 制率显著大于其他菌株,为80.03%。图1为蚯蚓肠道微生物对尖孢镰 刀菌的拮抗效果图,图中a为阴性对照,b为阳性对照(枯草芽孢杆 菌),c为yfb1-4,d为yfb3-1,e为yfb6-2。
[0055]
对拮抗细菌yfb3-1进行形态学鉴定,拮抗细菌yfb3-1在na培养 基上,如图2所示,在28℃的培养条件下生长3d形成的纯培养物具有 如下特征:菌落为乳白色,无光泽,表面皱褶,边缘隆起不整齐,中 间凹陷;如图3所示,液体静止培养时形成乳白色菌膜;如图4所示, 经革兰氏染色后,显微镜下观察发现yfb3-1菌体呈蓝紫色,为革兰 氏阳性细菌,大部分为椭圆形,小部分为杆状,直或略弯,单个或短 链状排列;如图5所示,芽孢呈椭圆形,芽孢中生,长度1.4~1.8μm, 宽0.7μm。根据菌落、菌体的形态特征,初步确定yfb3-1属于为芽孢 杆菌类。
[0056]
对拮抗细菌yfb3-1进行分子生物学鉴定,以待测菌株yfb3-1的 基因组dna为模板,利用细菌通用引物27f/1492r,对yfb3-1进行 pcr扩增,得到1条长度1417bp的dna片段。将菌株yfb3-1的16s rdna基因序列输入到ncbi数据库中进行blast相似性比对分析,以 16s rdna基因序列同源性为基础,从结果中选取12株具有代表性的 菌株,采用mega 7.0软件构建该菌株的系统发育树,如图6所示,菌 株yfb3-1的遗传进化距离与芽孢杆菌属最近,与已知菌株 b.velezensis wh-1(mk522153.1s)处于一个最小的分支,同源性达 到99%,可以确定菌株yfb3-1为贝莱斯芽孢杆菌。
[0057]
对贝莱斯芽孢杆菌yfb3-1进行抗菌谱测定,取试验所需的百合 不同病原真菌在pda培养基上进行活化。将不产和产生孢子较差的病 原真菌,如尖孢镰刀菌、茄腐镰刀菌、疫霉菌、三线镰刀菌、齐整小 核菌、链格孢,用直径为0.6cm的打孔器在病菌边缘进行打孔取菌饼, 将菌饼上长有菌丝的一面朝下转接到新的pda平板中央。而产孢子较 好的百合病原真菌如黑曲霉和青霉,采用点样法接种到pda平板中央。
[0058]
抑菌试验方法和利用菌饼转接法的抑制率计算公式如下:采用十 字交叉法在距离平板正中央2.5cm处点样分离纯化好的菌株,以不接 种作为对照。置于30℃培养,待对照的病菌长满整个平板为止,测量 各病原菌直径、抑菌带宽等指标,计算抑制率。抑制率计算
公式如下:
[0059]
抑制率=[(对照病原菌半径-0.3)-(处理病原菌半径-0.3)]/(对照病 原菌半径-0.3)
×
100%。
[0060]
利用病孢子点样法的抑制率计算公式如下:
[0061]
抑制率=(对照病原菌半径-处理病原菌半径)/对照病原菌半径
ꢀ×
100%。
[0062]
结果如表2所示:
[0063]
表2 yfb3-1的抑菌谱结果
[0064][0065]
注:数据为四次重复的平均值。小写字母表示不同处理间差异显著(p《0.05)
[0066]
由表2可知,贝莱斯芽孢杆菌yfb3-1对百合尖孢镰刀菌、三线镰 刀菌、茄腐镰刀菌、链格孢、齐整小核菌、疫霉菌、青霉和黑曲霉八 种病原真菌都具有较好的抑菌效果,抑菌效果图如图7所示,图中a 为尖孢镰刀菌;b为茄腐镰刀菌;c为三线镰刀菌;d为链格孢;e为 齐整小核菌;f为黑曲霉。
[0067]
采用盆栽防治试验,选择圆形花盆(上内直径0.25m
×
下内直径 0.16m
×
内高0.16m),每个花盆栽种3株百合种球,第一年9月25日左右 栽种后放置在网室进行过冬出苗管理,第二年4月3日左右等百合出苗, 将出苗高度为0.15m的百合花盆转移到具有一定光照室内备用。
[0068]
预防试验:先将贝莱斯芽孢杆菌yfb3-1经灭菌好的nb培养基发 酵后稀释为菌体浓度为107cfu/ml的菌液,以无菌水为阴性对照, 以商品芽孢杆菌溶于无菌水制成菌体浓度为107cfu/ml的菌液为阳 性对照,每株百合用50ml菌液或无菌水灌根3d后,在距离每株百合 3cm处接种百合病原真菌尖孢镰刀菌的直径1cm的菌饼1个,每处理栽 培5盆,每盆种植有3株百合种球,重复3次,一共45盆。室内温度控 制在28℃,相对湿度保持在90%左右,灌根20d后观察百合发病情况。
[0069]
治疗试验:先在距离每株百合3cm处接种百合病原真菌-尖孢镰刀 菌的1个直径1cm的菌饼7d后,再以贝莱斯芽孢杆菌yfb3-1的配制菌 液为处理,以无菌水为阴性对照,以市售芽孢杆菌复合制剂的菌液为 阳性对照,每株百合用50ml菌液或无菌水灌根,每处理栽培5盆,每 盆种植有3株百合种球,重复3次,一共45盆。室内温度控制在28℃, 相对湿度保持在90%左右,灌根20d后观察百合发病情况。以株为单 位进行调查,根据百合枯萎病发病程度进行相关的分级调查,统计好 总株数、各级病株数。调查分级标准如下:0级为植株茎秆正常,全 株无病叶;1级为病株底部变黄或变紫叶片数不超过整株叶片数的 25%,茎顶端变浅紫色,心叶向一侧轻度弯曲;2级为病株底部叶片 枯萎或枯萎叶片数占整株的25%~50%,茎上部变紫色且明显弯曲; 3级为病株枯萎的叶片超过50%,茎中上部变紫色,且严重弯曲;4级 为全株的叶片都枯萎或整株枯死,茎基部维管束变褐。其中:
[0070]
发病率=发病株数/总株数
×
100%
[0071]
病情指数=σ(各级病株数
×
相对级数值)/(总株数
×
最高级数值)
×
100
[0072]
相对防治效果=(对照的病情指数-处理的病情指数)/对照的病情指 数
×
100%
[0073]
结果如表3所示:
[0074]
表3贝莱斯芽孢杆菌yfb3-1对百合枯萎病的防治效果
[0075][0076]
由表3可知,在预防条件下,灌根贝莱斯芽孢杆菌yfb3-1菌液, 其尖孢镰刀菌引起的百合枯萎病发病率和病情指数最低,分别为 35.56%和13.33,都显著低于无菌水和商用生防菌剂对照,其相对于 无菌水的防治效果为64.18%,比市售芽孢杆菌复合制剂的防效提高 了34.38%。在治疗条件下,灌根贝莱斯芽孢杆菌yfb3-1菌液,其尖 孢镰刀菌引起的百合枯萎病发病率和病情指数最低,分别为62.22% 和25.56,都显著低于清水对照,其相对于清水的防治效果为30.3%, 比市售芽孢杆菌复合制剂的防效提高了33.3%。因此,贝莱斯芽孢杆 菌yfb3-1在灌根条件下对百合尖孢镰刀菌枯萎病具有较好的预防和 治疗效果。
[0077]
以上内容是结合具体实施实例对本发明所做的进一步详细说明, 不能认定本发明的具体实施只局限于这些说明,对于本发明所属技术 领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做 出若干简单推演或替换,都应当视为属于本发明的保护范围。
[0078]
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例 而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任 何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。