1.本实用新型主要涉及生物化学检测器械领域,特别是涉及一种用于生物化学检测的微阵列芯片。
背景技术:
2.石墨烯作为一种新型材料,自2004年被首次发现并实验室制备出以来,因其具有独特的物理或化学特性,被广泛应用于各个领域,在众多的领域中所发挥的作用越来越大。石墨烯材料在各领域发展的焦点在于,如何充分利用石墨烯的独特属性,融入到本领域中,解决本领域所面临的一些难题,或者优化本领域的现有技术方法,提高工作效率。在生物化学领域,石墨烯的介入目前主要是作为生物传感器而获得一定程度的应用,例如,在石墨烯的表面连接各种生物分子并进行荧光标记,利用其与目标物的相互作用从而淬灭荧光,实现检测的目的,当前制备出的各种石墨烯微阵列已经可以可用于检测各类核酸、 dna、抗原、病毒、肿瘤细胞甚至微生物等。
3.微阵列芯片或称生物芯片体积小,检测灵敏度高,对样本量等等要求相对较低,因此发展快速。图11至图13展示了传统的微阵列,以致病微生物的检测为例,其在微阵列芯片的基板a1上设置有检测位点a11,检测位点a11上固定有抗体t,当样本中的目标物r靠近或者接触检测位点a11上的抗体t时,抗体t与目标物r发生交互作用,从而捕获目标物r,然后通过电化学信号或者荧光信号将检测结果展示出来。
4.如图11至图13所示,传统微阵列为平面,抗体t平铺于各个检测位点a11 之上,微阵列芯片在进行检测时,如果样本本身所含有的目标物r较少或者说目标物r的浓度过低等等,可能会导致检测结果出现假阴性等问题,因此,需要改进现有的阵列检测芯片,从而能够避免出现检测结果不准确或者检测结果的稳定性不佳等问题。
技术实现要素:
5.本实用新型的目的在于改进现有的微阵列芯片,增加微阵列芯片对待检测的目标物的捕获能力,提升微阵列芯片的检测能力,并且解决在增加和改进微阵列芯片的检测能力的同时,可以使得其生产成本的增加控制在一定程度,为规模化生产奠定基础,同时也将微阵列芯片应用到检测致病微生物的含菌量低于正常标准的情况。
6.为了解决上述的技术问题,增加微阵列芯片对样本进行检测时,提高检测的准确率,本实用新型采用的技术方案之一为,提供一种微阵列芯片,其包括有:
7.基板;
8.至少一个检测阵列,其设置于所述基板,并且包括有:
9.电极,
10.至少一个检测位点,所述检测位点的材料为多孔性石墨烯和/或多孔性氧化石墨烯,
11.识别物,所述识别物设于所述检测位点,所述识别物能够特异性地与样本中的目
标物发生相互作用;
12.所述检测位点与所述电极电连接;
13.所述检测阵列呈有序排列。
14.较佳的,如前述的微阵列芯片,其中,进一步包括有至少一个验证阵列,所述验证阵列设于所述基板上,所述验证阵列包括有至少一个所述检测位点和所述识别物。
15.较佳的,如前述的微阵列芯片,其中,所述目标物为微生物,所述样本中的所述微生物的含菌量为:102cells/ml至106cells/ml。
16.较佳的,如前述的微阵列芯片,其中,所述检测阵列的排列方式为交错排列。
17.较佳的,如前述的微阵列芯片,其中,至少一个所述检测阵列的电压为正电压或者负电压,所述正电压为0.2伏特至0.8伏特,所述负电压为-0.2伏特至
ꢀ‑
0.8伏特。
18.本实用新型另外提供一种技术方案,一种如前述的微阵列芯片的制备方法,其包括有以下步骤:
19.s1.在基板上光刻出电极布线图样;
20.s2.在步骤s1所获得的基板上蒸镀成膜,成膜后移除光刻胶制作出电极布线;
21.s3.在步骤s2所获得的电极布线的特定位点喷涂氧化石墨烯溶液;
22.s4.冻干步骤s3所获得的基板;
23.s5.在环境压力小于一个大气压,冻干温度为-50℃至-120℃的条件下,对 s4步骤所获得的基板进行退火,在含有氩气与氢气的环境下升温至400℃至 600℃还原部分氧化石墨烯,获得多孔性石墨烯或多孔性石墨烯与多孔性氧化石墨烯的组合物。
24.较佳的,前述的制备方法,其中,在所述的步骤s2中,所述电极布线的材料选自于下列所组成的群组:钛、铬、铝或镍及其任意组合;所述的成膜的厚度为50至200纳米。
25.较佳的,前述的制备方法,其中,在所述的步骤s3中,所述氧化石墨烯溶液通过hummers method方法制备,所述特定位点所喷涂的所述氧化石墨烯溶液的量为0.5μl至1μl。
26.本实用新型提供的第三个技术解决方案为,提供一种微阵列芯片的检测方法,适用于对样本中微生物的含菌量范围为102cells/ml至106cells/ml的样本进行微生物检测,其包括有以下步骤:使所述微阵列芯片的检测位点带有正电,所述正电的电压为0.2伏特至0.8伏特。
27.较佳的,如前述的检测方法,其包括使用前述的微阵列芯片进行检测。
28.本实用新型的有益之处在于:
29.1.由于目标物的个体整体通常都呈现为带有一定的正电荷或者负电荷,因此,本实用新型的微阵列芯片的检测阵列设置有电极,借助电极连接使每一个检测位点可以带电,并根据目标物所携带电荷的性质,选择对电极施予正电压或者负电压,并同时调整电压至合适的大小,使得每一个检测位点带有的电荷能够与目标物所携带电荷相反,因此可以增加检测阵列对目标物的吸引和聚集能力。例如,致病性的细菌或者单股dna通常带负电,这时则可以对电极施与偏正电压,将能够吸引更多带负电荷的前述目标物至检测阵列与预先布置于检测位点的探针(probe)或是抗体(antibody)进行结合,进而提升检测的灵敏度。
30.2.本实用新型的微阵列芯片制备方法简单,通过光刻、蒸镀成膜、喷涂氧化石墨烯和冻干的步骤,实现对微阵列芯片增加电极,并且检测阵列的排列方式便于调节,成品率高
且价格可控,易于实现商业化的规模生产。
31.3.本实用新型的检测方法能够明显的提升现有微阵列芯片的检测灵敏度和检测下限,特别是对于一些样本中目标物的含量明显较低,并且常规的微阵列检测容易产生假阴性的情况下,能够借助于所施加的电压对目标物的产生吸引力,因此,特别适用于检测通常含菌量较低的目标物,尤其是致病微生物。
32.4.本实用新型的检测方法应用范围广泛,可以与现有的成熟的微阵列检测芯片相结合使用,通过对阵列增加电极来提高现有的微阵列芯片的检测能力。
附图说明
33.图1是本实用新型的实施例一的立体图。
34.图2是本实用新型的实施例一的侧视图。
35.图3是本实用新型实施例一的俯视图。
36.图4是图3中的a区域的细节放大图。
37.图5是图4中b区域的细节放大图。
38.图6是本实用新型的实施例二的示意图。
39.图7至图9是本实用新型的实施例三的检测阵列的排列示意图。
40.图10是本实用新型的制备例一的制备方法步骤示意图。
41.图11是传统的微阵列的俯视示意图。
42.图12是图11中的a’部分的细节放大图。
43.图13是图12中的b’区域的细节放大图。
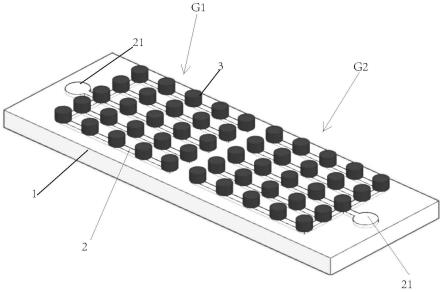
具体实施方式
44.以下配合附图及本实用新型的较佳实施例,进一步阐述本实用新型为达成预定实用新型目的所采取的技术手段。
45.本实用新型为一种微阵列芯片,其包括有基板和检测阵列,基板较佳采用玻璃或石英材质,检测阵列设置于基板,其包括有电极和多个检测位点,检测位点的材料为多孔性石墨烯或者多孔性氧化石墨烯,或者为其两者不同比例的组合,电极与多个检测位点电连接,检测位点上连接有识别物,检测阵列呈有序排列。在本实用新型中,除非特别指出,识别物是指能够与样本中的目标物特异性的相互作用的物质,主要包括但不限于抗体、核酸探针、以及各种rna、 dna等等。相互作用的方式包括物理或化学结合、物理或化学反应等。目标物是指样本中有待于检测的有机或无机物质,例如抗原、dna、离子基团或者微生物、细菌、真菌或者病毒等各类微观生物。
46.本实用新型的微阵列芯片,其检测位点连接的前述识别物一般均经过荧光标记,具体来说,以抗体为例,所述抗体上经过荧光标记,在检测到目标物并发生相互作用后,引起荧光信号的变化,并进一步转化为检测结果展示出来,不再赘述。
47.检测阵列的具体排列方式并不受限,可以是等距离的行列排列,也可以是其他方式的排列,具体可以根据待检测目标物的种类及属性而进行适当的选择,比如也可以选择交叉排列,从而有利于检测进行。在下述优选实例中,以等距离行列排列为例进行说明。
48.检测阵列的数量可以是多个,也可以是一个,通常一般设置二至六个,数量在此并
不限制。检测阵列的电极设置于基板上,并且电连接检测阵列的每一个检测位点。除此之外,本实用新型的微阵列芯片进一步可以包括有验证阵列,即检测位点没有连接电极的验证阵列,使得检测阵列和验证阵列同时存在于一个基板上,作为特殊情况下的使用。
49.实施例一
50.参见图1和图2,是本实用新型的优选实施例一,其包括有玻璃基板1,在玻璃基板1上设置有检测阵列g1和g2,检测阵列g1和g2包括有电极2和检测位点3,检测位点3亦即由多孔性氧化石墨烯所形成的点,电极2电连接检测位点3。同时参见图3,在本优选实施例中,检测位点3和电极2的电连接方式为,每一个电极2如叉子形状铺设于玻璃基板1之上,检测位点3则分别设置于电极2之上。
51.在实施例一之中,共计设置了两个检测阵列,两个检测阵列的电极2的电源端21相互远离分别位于玻璃基板1的两端,电源端21位于玻璃基板1的两端有利于电路的铺设,最大程度减少对样本的干扰。每一个电极2的叉子形状的叉骨上分别等距离设置有检测位点3。检测位点3的均匀布设,有利于增加每一个检测位点3接触样本中目标物r的概率,防止发生如下情况:在样本中目标物r多的区域,由于检测位点3的不足或缺失而漏检或检测结果失真。本领域技术人员可以根据实际需要,设置更多个检测阵列g1或g2,也可以进一步对检测阵列g1和g2进行分组分区,并且电极2的分布态样也不限于图3所示的叉子形状的结构。其中,上述的检测位点3的材料可以是多孔性石墨烯或者多孔性氧化石墨烯,或者是多孔性还原氧化石墨烯,或为多孔性石墨烯与多孔性氧化石墨烯的组合物。
52.如图1和图4所示,当实施例一中的检测位点3的材料优选为多孔性石墨烯或者多孔性氧化石墨烯,或者为其两者不同比例的组合时,多孔性石墨烯或者多孔性氧化石墨烯能够增加检测位点3的比表面积,因此,在检测位点3上连接有识别物时,例如,在实施例一中,识别物优选为经荧光标记的抗体t,那么抗体t的空间分布层次和数量都能获得明显的提升(图4和图5)。
53.与此相对比,如图11至图13所示的传统的微阵列,其玻璃基板a1上的抗体t均处于每一个检测位点a11相同的平面上,抗体t的数量要低很多,而空间立体分布则几乎没有。而抗体t的数量和空间分布能够对抗体t与目标物r 的接触和发生相互作用的几率产生直接的影响,进而影响检测效力。因此,由于本实用新型的检测位点3为多孔性石墨烯或多孔性氧化石墨烯,或为多孔性石墨烯与多孔性氧化石墨烯的组合物,其能够进一步提高微阵列的检测灵敏度,提高检测的准确率。
54.在微阵列芯片实际工作时,可以对检测阵列g1和g2的电极2施加一定的电压,例如,当目标物r为致病性细菌或者是单链的rna,cdna或ssdna时,由于其通常整体上呈现为带有负电荷,因此,可以对电极2施加偏正电压,优选的,实施例一中,所施加的偏正电压为0.2至0.8伏特,经实验检测,在该范围内的电压可以取得最佳的检测结果。在施加电压后,由于异种电荷相互吸引,因此,带正电的电极2使得其所连接的检测位点3带有正电,因此可以吸引和聚集更多的细菌等目标物r至检测位点3的附近,使得检测位点3所连接的抗体t能够靠近目标物,增加抗体t捕获目标物r的能力。由于抗体t经荧光标记,因此,可以进一步通过荧光信号的变化显示出检测的结果(图中未示出)。当然,检测位点3除了绑定抗体t之外,也可以固定为其他的大分子物,例如, dna片段、酶或者蛋白质片段等等,此处不再赘述。
55.当实施例一的微阵列芯片应用于检测带正电荷的目标物r时,例如,一些带正电的
离子基团,或者一些金属离子等等时,则可以对检测阵列g1和g2的电极2施加负电压,与上述相同,其能增加检测位点3对正电离子基团的吸引力,从而提高检测效率,通常,该负压电压的大小为-0.2至-0.8伏特,检测效果最佳,过大或者过小,都不利于对目标物r的吸引。
56.更进一步,在同一个微阵列芯片中,不同的检测阵列可以分别设置为带有正电和负电,从而满足一些需要同时检测呈现为分别带有不同电荷的目标物r 的情况。继续参见图1,实施例一的两个检测阵列g1和g2设置为带有不同的电压。当所要检测的目标物r既包括有致病性细菌,也包括有特定微金属离子或者带正电的某一种离子基团时,那么检测阵列g1的电极2可以设置为被施加偏正电压,与此相对应,检测阵列g2的电极2可以被施加偏负电压。如此,检测阵列g1有利于吸引和聚集致病菌,而检测阵列g2则有利于吸引和聚集带正电的基团,从而可以同时增加对不同目标物r的检测能力。实施例一仅仅列举了设置有两个检测阵列的情况,当设置有更多的检测阵列的时候,其余的检测阵列均可以依此轮替交叉排列设置,有利于提高同时对多样化的目标物r的检测能力。
57.实施例二
58.如图6所示,实施例二与实施例一相类似,所不同之处在于,实施例二的检测阵列共设置有三个,其分别是检测阵列g3、g4和g5,另外新设置了一个验证阵列g6,验证阵列g6的检测位点3并没有设置电极2,也没有和任何一个电极2电连接,因此验证阵列g6也不带有电。实施例二的微阵列芯片除了具有与实施例一相似的检测功能之外,也可以用于以下的用途。
59.实施例二的微阵列芯片可以用于检测或验证目标物r所携带的是正电荷、负电荷还是整体上呈现中性。因此,实施例二的检测阵列g3和g4的电极2被施加正电压、检测阵列g5的电极2被施加负电压,而验证阵列g6作为对照,其检测位点3因没有连接任何一个电极而呈现为中性。在对仅含有待测定目标物r的样本予以检测时,如果检测结果中g3和g4的阳性信号远远强于作为对照g6、更大于负电压的g5,则表明了目标物r整体上携带负电荷。如果检测结果与此相反,则目标物r整体上携带正电荷。如果g3、g4、g5和g6的检测结果相差不大,则表明在很大程度上目标物r为中性基团,或者说在液体中并没有电解离等等。
60.实施例三
61.实施例三的检测阵列不同于实施例一和实施例二的每一个检测阵列分别分区各自排列的排列方式,而是优选的采用了三种交错排列方式,本领域技术人员也可以根据需要采取其他交错排列方式。
62.参见图7至图9,是本实用新型的实施例三的检测阵列的交错排列方式。图 7为行列完全交错排列方式,即每一个检测阵列与另一个检测阵列的行相互交叉而列是错位的。具体来说,图7的交错排列方式中,检测阵列g7和检测阵列 g8相对交错插入在一起,g7和g8均设置有三行检测位点3,以图7为例,第一行为g7的第一行检测位点,第二行为g8的第一行检测位点,然后是g7的第二行检测位点,依次轮替排列下去。并且,g7的每一行的每一个检测位点与 g8的每一行的每一个检测位点并不在同一个条线上,而是相互交错排列。可在芯片上获得最多量最密集的检测位点为此种排列方式的优点。
63.图8为行轮替交错的排列方式,即每一个检测阵列与另一个检测阵列的行是轮替交错排列,而其列是整体上处于同一列,其与图7所示的检测阵列交错排列的方式非常相似,所不同之处仅在于,检测阵列g9的每一行的各个检测位点与检测阵列g10的每一行的各
个检测位点均处于同一条直线上,或者说从平面图上看出处于相同的一列。检测位点整齐排列有利于激光扫描芯片时,激光元件作动平台移动的顺畅度进而提升检测速度,为此种设计的优点。
64.图9所示为检测阵列轮替交错排列方式,其不同于图7和图8所示的排列方式。检测阵列轮替交错排列为整个检测阵列的交错排列,简单说,检测阵列 g11排列之后,下方是检测阵列g12,然后是检测阵列g13,即前两行是检测阵列g11,中间两行是检测阵列g12,最后两行是检测阵列g13。图7至图9的检测阵列交错排列仅仅是示例,实际情况可能并不是如图所示的只有三行或者两行。此种排列设计有利于任意选择检测阵列是否施加电压,对于不施加电压的阵列即可成为检验的对照组,因此在实施上较有弹性为此设计的优点。
65.上述不同的检测阵列的排列方式,可应用于不同的场景。例如,当对同一种目标物r进行精确检测时,可以优先采用图7所示的排列方式,该种交错排列方式能够实现检测位点3的最密集和最均匀的排列,能够最大程度的检测到目标物。
66.本实用新型另提供一种技术解决方案,用于制备微阵列芯片。
67.该制备方法的总体步骤如下所示:
68.s1.于基板上利用光刻制程(lithography)制作电极布线图样。
69.s2.利用蒸镀成膜技术(evaporator)制作电极布线,电极材料选择下列的金属所组成的群组之一:钛(ti),铬(cr),铝(al),镍(ni)或其任意组合的合金。成膜总厚度介于50-200nm,成膜后将光刻胶移除。
70.s3.于步骤s2所制备的电极布线特定位点喷涂氧化石墨烯溶液,该氧化石墨烯溶液通过hummers method制作,每个位点所喷涂的量介于0.5-1μl。
71.s4.将上述材料进行冻干(freeze-drying)程序,快速移除氧化石墨烯溶液内的水分,获得多孔性氧化石墨烯,环境压力小于一大气压,冻干温度介于-50oc 至-120oc之间。
72.s5.将基板进行退火程序,在含有氩气(ar)与氢气(h2)的环境下升温至 400oc-600oc区间,将部分氧化石墨烯还原,获得多孔性石墨烯/氧化石墨烯。
73.s6.于各检测位点上修饰经荧光标记的致病细菌(如:大肠杆菌)的抗体。
74.制备例一
75.制备例一用于制备实施例一所示的微阵列芯片。制备例一的制备流程参见图10,需要说明,图10仅为示例性说明,并非产品的实际态样,例如,图10 所示共有2个检测阵列,每个检测阵列包括有三行的检测位点,每行检测位点仅有两个检测位点,但实际产品要远远超过该数量。制备例一的具体步骤如下:
76.s1.于玻璃基板1上利用光刻制程(lithography)进行电极布线,制作出电极布线的图样,其中共设有两个检测阵列,每一个检测阵列的电极2共设有大约 6-8行,每一行与其上一行和下一行的行间距为2mm至3mm,每一行的长度约为3.5cm。
77.s2.利用蒸镀成膜技术(evaporator)根据步骤s1所制作的电极布线的图样,进一步制作电极布线的蒸镀成膜。电极材料选择钛(20nm)为底部黏着层随后度上镍(100nm)作为与石墨烯形成合金之导电层,成膜总厚度约为120nm,成膜后将光刻胶移除。
78.s3.通过hummers method共计制备100ml氧化石墨烯溶液,然后于电极布线上每间隔2-3mm喷涂氧化石墨烯溶液作为检测位点3,该检测位点3的直径大概为1mm。每个检测位点3所喷涂的量约为0.5μl。
79.s4.将步骤s3所获得玻璃基板1整体上进行冻干,快速移除氧化石墨烯溶液内的水分,获得多孔性氧化石墨烯,环境压力为0.05mbar(40mtorr),冻干温度大约为-50oc。
80.s5.将步骤s4所获得的玻璃基板1进行退火,在含有氩气(ar)与氢气(h2) 的环境下升温至500oc,将部分氧化石墨烯还原,获得多孔性石墨烯/氧化石墨烯。
81.s6.于各检测位点3上修饰经荧光标记的致病细菌(如:大肠杆菌)的抗体 t,从而最终完成本实用新型的多孔性氧化微阵列芯片的制备。
82.检测例
83.如前所述,本实用新型的微阵列芯片由于增加了电极等,因而能够显著的提升检测能力,特别是对于致病性的微生物检测,因大部分的致病性微生物均整体上呈现为携带有负电,当施加正电压使,尤其能发挥其效力。例如,一般临床针对微生物的检测,样本内含菌量的最低要求是106cells/ml,低于该含菌量的样本,通常无法检测出结果,或者说即使仍旧存在有所要检测的目标病菌,但会得到假阴性的结果。而通过本实用新型的技术,样本内含菌量只要超过10
2 cells/ml即可检测到信号,因此,大幅地提升了检测极限(limit of detection:lod),这对于感染检验的处置与判读上有极大的助益。
84.检测例一
85.使用制备例一的微阵列芯片进行检测,以大肠杆菌检测为例,微阵列芯片检测位点上已修饰具有荧光标志之大肠杆菌抗体(可检测长度约5-20μm的大肠杆菌),其主要步骤如下:
86.1.将待检菌落加入缓冲液至5ml试管(若待检菌落的容积达到了5ml,则可省略此步骤);
87.2.置入离心机内,以1800(rpm)转速度旋转5分钟;
88.3.倒掉上层悬浮液,取0.5ml的沉淀物,平均滴到芯片的检测位点上;
89.4.静待5分钟;
90.5.对芯片的电极施加正电压,电压大小为0.2至0.8伏特,共计持续1分钟;
91.6.解除电压,利用缓冲液对芯片的表面进行冲洗;
92.7.沥干水分;
93.8.将芯片置入激光扫描仪(scanner)进行扫描和根据荧光信号的强弱计算出检测的结果。
94.本实用新型的微阵列芯片由于采用了多孔性石墨烯的新材料和增加了电极 2的结构,检测位点3上的探针的数量和空间分布层次获得了明显的提升。更进一步,在对电极2根据实际需要设置为与目标物r所相反的电压时,能够吸引和聚集更多的目标物r至检测位点3,使其与检测位点3上的探针例如抗体t 相互作用,从而提高检测的灵敏度和检测下限。另外,经实验和实际工作结果的经验总结,当对电极2施加的偏正电压为0.2v至0.8v,或者偏负电压为-0.2v 至-0.8v时,检测的灵敏度整体上更高,当然,对于目标物r为具体的致病菌、核酸、抗原、dna时,需要在上述的电压范围内进行微调。本实用新型的微阵列芯片的制备方法,选择先将电极2以蒸镀成膜的方式布置于玻璃基板1上,然后于电极2的布线上喷涂石墨烯制作为检测位点3,之后再冻干为多孔性氧化石墨烯,其步骤简易,能够实现电极2和检测位点3的结合,适于规模化的批量生产。而本实用新型的微阵列芯片的检测方法,通过使微阵列的检测位点带有电压,并且该电压与微生物的个体整体上所呈现的电压相反,能
够专门适用于样本中的微生物含量低于106cells/ml的情况,显著的提高了检测极限(limit ofdetection:lod),有利于进一步拓展针对致病菌的检测。
95.以上所述仅是本实用新型的优选实施例而已,并非对本实用新型做任何形式上的限制,虽然本实用新型已以优选实施例揭露如上,然而并非用以限定本实用新型,任何熟悉本专业的技术人员,在不脱离本实用新型技术方案的范围内,当可利用上述揭示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本实用新型技术方案的内容,依据本实用新型的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本实用新型技术方案的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。