1.本发明属于马来酸噻吗洛尔制剂技术领域,特别是马来酸噻吗洛尔凝胶透皮贴剂及其制备方法。
背景技术:
2.婴幼儿血管瘤是起源于皮肤血管的良性肿瘤,其临床发病率大概为4%-10%之间,且每年有增加的趋势。血管瘤有其自身的生长消退规律,但在血管瘤的整个生长周期过程中可出现出血、糜烂、影响容貌,甚至影响重要部位功能等症状。对于婴幼儿血管瘤,目前常见的治疗方法有外科切除、放射治疗、低温治疗、激光治疗、硬化剂注射等,一般采用综合疗法。马来酸噻吗洛尔是一种强效β受体阻断药,对β1和β2受体都有阻断作用,作用强度为普萘洛尔的8倍,可以制成外用的乳剂、凝胶剂、贴剂应用于婴幼儿血管瘤的治疗中。
3.现有的技术中,中国专利申请cn111067905a提供了一种噻吗洛尔或其盐的水凝胶贴膏剂,其水凝胶层的原料中处噻吗洛尔以外还含有稳定剂、促渗剂、保湿剂、交联剂、交联调节剂、ph值调节剂、粘度调节剂等。中国授权专利cn104274390b也提供了一种噻吗洛尔长效透皮制剂,将噻吗洛尔制成混悬液,再加入多孔纳米颗粒吸附噻吗洛尔,然后再加入促透剂、温敏凝胶、防腐剂和保湿剂,制成长效透皮制剂。文献《马来酸噻吗洛尔透皮贴剂的制备及释药机理研究》中公开了马来酸噻吗洛尔透皮贴剂的简单制备方法,以及其透皮扩散的效果。然而,上述这几种公开的外用噻吗洛尔贴剂技术或相关技术,马来酸噻吗洛尔药物层的稳定性一般,药物缓释速度不理想,透皮扩散效率相对偏低,不利于贴剂的长效、快速发挥药效。
技术实现要素:
4.针对以上现有技术的不足,本发明提供了一种马来酸噻吗洛尔凝胶透皮贴剂及其制备方法,具体通过以下技术实现。
5.马来酸噻吗洛尔凝胶透皮贴剂,包括贴合在一起的药物层、背衬层,所述药物层的表面贴有保护层,所述药物层的原料包括马来酸噻吗洛尔5-10wt%、改性复合蛋白16-22wt%、聚乙烯醇3-8wt%、甘油6-12wt%、促渗剂0.5-2wt%,剩余为ph值调节剂和去离子水,所述ph值调节剂的用量以调节药物层ph值为8-8.5为准;
6.所述改性复合蛋白的制备方法为:按重量比取1.5-3:2.5-5:2取酰化酪蛋白、卵白蛋白、多巴胺加入到200ml、10mm、ph=8.5的tris缓冲液中,加热搅拌;然后将溶液过滤、洗涤、透析,冷冻干燥后得到改性复合蛋白。
7.本发明提供的马来酸噻吗洛尔贴剂,选用的背衬层材料可以为无纺布或是其他常用的贴剂背衬材料,保护层可以选用pe膜等不透水的保护膜。选用的改性复合蛋白可以作为马来酸噻吗洛尔药物的缓释包覆材料,还可以与聚乙烯醇作为凝胶基质发挥协同效果,提升药物层的稳定性。在使用时,撕下马来酸噻吗洛尔贴剂的保护层,将药物层贴敷在婴幼儿血管瘤的表面即可。
8.优选地,所述药物层的原料包括马来酸噻吗洛尔7wt%、改性复合蛋白18wt%、聚乙烯醇5wt%、甘油8wt%、促渗剂1wt%,剩余为ph值调节剂和去离子水,所述ph值调节剂的用量以调节药物层ph值为8-8.5为准。
9.优选地,酰化酪蛋白、卵白蛋白、多巴胺的重量比为2:3:2。
10.优选地,改性蛋白的制备方法中,加热搅拌的方式为:45-50℃,2000-4000rpm搅拌10-15h。
11.更优选地,改性蛋白的制备方法中,加热搅拌的方式为:45-50℃,3500rpm搅拌10h。
12.优选地,促渗剂为月桂醇、薄荷醇、香叶醇、茴香脑、癸基甲基亚砜、十四烷基硫酸钠中至少一种。
13.上述马来酸噻吗洛尔凝胶透皮贴剂的制备方法,包括以下步骤:
14.p1、取马来酸噻吗洛尔、促渗剂搅拌溶解于乙醇中得到第一溶液,取改性复合蛋白、取聚乙烯醇、甘油、去离子水搅拌均匀得到第二溶液;
15.p2、将步骤p1的所述第一溶液加至所述第二溶液中,50-55℃下保温去除乙醇,同时10000-14000rpm剪切35-50min,得第三溶液;
16.p3、取ph值调节剂加至步骤s2的所述第三溶液中调节ph值,同时300-500rpm下搅拌分散20-25min,制得药物层;
17.p4、将所述药物层涂布在背衬层上静置固化,再在所述药物层表面贴上保护层,得到马来酸噻吗洛尔外用贴。
18.优选地,上述马来酸噻吗洛尔凝胶透皮贴剂的制备方法步骤p2中,剪切的方式为13000rpm剪切35min。
19.与现有技术相比,本发明的有益之处在于:采用本发明的原料和制备方法制得的马来酸噻吗洛尔凝胶透皮贴剂,改性复合蛋白和聚乙烯醇共同协同作用,能够起到良好的凝胶基材的作用,同时能够包覆在马来酸噻吗洛尔药物颗粒表面,在保证凝胶状药物层的湿润性的同时,药物稳定性和缓释效果更好。
附图说明
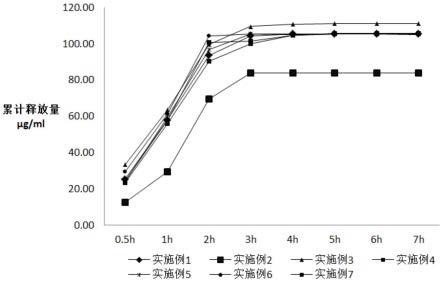
20.图1为实施例1-5的马来酸噻吗洛尔凝胶透皮贴剂的透皮试验结果;
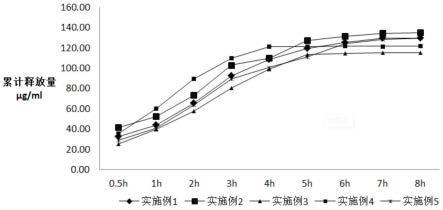
21.图2为对比例1-6的马来酸噻吗洛尔凝胶透皮贴剂的透皮试验结果;
具体实施方式
22.下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动条件下所获得的所有其它实施例,都属于本发明保护的范围。
23.以下实施例和对比例制备的马来酸噻吗洛尔凝胶透皮贴剂,均包括包括贴合在一起的药物层、背衬层,所述药物层的表面贴有保护层;背衬层采用无纺布,保护层采用pe膜。
24.实施例1
25.本实施例提供的马来酸噻吗洛尔凝胶透皮贴剂,药物层的原料包括马来酸噻吗洛尔7wt%、改性复合蛋白18wt%、聚乙烯醇5wt%、甘油8wt%、月桂醇(促渗剂)1wt%,剩余为
ph值调节剂和去离子水,所述ph值调节剂的用量以调节药物层ph值为8.5左右为准。
26.改性复合蛋白的制备方法为:按重量比取2:3:2取酰化酪蛋白、卵白蛋白、多巴胺加入到200ml、10mm、ph=8.5的tris缓冲液中,50℃,3500rpm加热搅拌10h;然后将溶液过滤、洗涤、透析,冷冻干燥后得到改性复合蛋白。
27.马来酸噻吗洛尔凝胶透皮贴剂的制备方法为:
28.p1、取马来酸噻吗洛尔、促渗剂搅拌溶解于乙醇中得到第一溶液,取改性复合蛋白、取聚乙烯醇、甘油、去离子水搅拌均匀得到第二溶液;
29.p2、将步骤p1的所述第一溶液加至所述第二溶液中,55℃下保温去除乙醇,同时13000rpm剪切35min,得第三溶液;
30.p3、取ph值调节剂加至步骤s2的所述第三溶液中调节ph值,同时500rpm下搅拌分散20min,制得药物层;
31.p4、将所述药物层涂布在背衬层上静置固化,再在所述药物层表面贴上保护层,得到马来酸噻吗洛尔外用贴。
32.实施例2
33.本实施例提供的马来酸噻吗洛尔凝胶透皮贴剂,其药物层的原料包括马来酸噻吗洛尔10wt%、改性复合蛋白16wt%、聚乙烯醇8wt%、甘油8wt%、薄荷醇(促渗剂)1wt%,剩余为ph值调节剂和去离子水,所述ph值调节剂的用量以调节药物层ph值为8.5左右为准。改性复合蛋白以及的马来酸噻吗洛尔凝胶透皮贴剂制备方法与实施例1相同。
34.实施例3
35.本实施例提供的马来酸噻吗洛尔凝胶透皮贴剂,其药物层的原料包括马来酸噻吗洛尔5wt%、改性复合蛋白22wt%、聚乙烯醇3wt%、甘油8wt%、薄荷醇(促渗剂)1wt%,剩余为ph值调节剂和去离子水,所述ph值调节剂的用量以调节药物层ph值为8.5左右为准。改性复合蛋白以及的马来酸噻吗洛尔凝胶透皮贴剂制备方法与实施例1相同。
36.实施例4
37.本实施例提供的马来酸噻吗洛尔凝胶透皮贴剂,药物层的原料配方,以及马来酸噻吗洛尔凝胶透皮贴剂制备方法均与实施例1相同。
38.改性复合蛋白的制备方法中,酰化酪蛋白、卵白蛋白、多巴胺的重量比为1.5:5:2。
39.实施例5
40.本实施例提供的马来酸噻吗洛尔凝胶透皮贴剂,药物层的原料配方,以及马来酸噻吗洛尔凝胶透皮贴剂制备方法均与实施例1相同。
41.改性复合蛋白的制备方法中,酰化酪蛋白、卵白蛋白、多巴胺的重量比为3:2.5:2。
42.对比例1
43.本对比例提供的马来酸噻吗洛尔凝胶透皮贴剂,药物层的原料配方,以及马来酸噻吗洛尔凝胶透皮贴剂制备方法均与实施例1相同。改性复合蛋白的制备方法中,酰化酪蛋白、卵白蛋白、多巴胺的重量比为1:6:2。
44.对比例2
45.本对比例提供的马来酸噻吗洛尔凝胶透皮贴剂,药物层的原料配方,以及马来酸噻吗洛尔凝胶透皮贴剂制备方法均与实施例1相同。改性复合蛋白的制备方法中,酰化酪蛋白、卵白蛋白、多巴胺的重量比为2:1:1,即4:2:2。
46.对比例3
47.本对比例提供的马来酸噻吗洛尔凝胶透皮贴剂,药物层的原料配方,以及马来酸噻吗洛尔凝胶透皮贴剂制备方法均与实施例1相同。所述改性复合蛋白的制备方法为:按重量比取5:2取酰化酪蛋白、多巴胺加入到200ml、10mm、ph=8.5的tris缓冲液中,加热搅拌;然后将溶液过滤、洗涤、透析,冷冻干燥后得到改性复合蛋白。
48.对比例4
49.本对比例提供的马来酸噻吗洛尔凝胶透皮贴剂,药物层的原料配方,以及马来酸噻吗洛尔凝胶透皮贴剂制备方法均与实施例1相同。所述改性复合蛋白的制备方法为:按重量比取5:2取卵白蛋白、多巴胺加入到200ml、10mm、ph=8.5的tris缓冲液中,加热搅拌;然后将溶液过滤、洗涤、透析,冷冻干燥后得到改性复合蛋白。
50.对比例5
51.本对比例提供的马来酸噻吗洛尔凝胶透皮贴剂,药物层的原料包括马来酸噻吗洛尔7wt%、复合蛋白18wt%、聚乙烯醇5wt%、甘油8wt%、促渗剂1wt%,剩余为ph值调节剂和去离子水,所述ph值调节剂的用量以调节药物层ph值为8-8.5为准。马来酸噻吗洛尔凝胶透皮贴剂制备方法与实施例1相同。复合蛋白是由卵白蛋白、多巴胺按重量比5:2加入到200ml、10mm、ph=8.5的tris缓冲液中,加热搅拌;然后将溶液过滤、洗涤、透析,冷冻干燥后得到。
52.对比例6
53.本对比例提供的马来酸噻吗洛尔凝胶透皮贴剂,药物层的原料包括马来酸噻吗洛尔7wt%、泊洛沙姆188(代替改性复合蛋白)18wt%、聚乙烯醇5wt%、甘油8wt%、促渗剂1wt%,剩余为ph值调节剂和去离子水,所述ph值调节剂的用量以调节药物层ph值为8-8.5为准。马来酸噻吗洛尔凝胶透皮贴剂制备方法与实施例1相同。
54.试验例:马来酸噻吗洛尔凝胶透皮贴剂的经皮渗透试验
55.参考文献《促进剂对马来酸噻吗洛尔经皮渗透的影响》(冀学芳,中国药科大学学报,1996年,2(1),第6-9页)、《马来酸噻吗洛尔透皮贴剂的制备及释药机理研究》(冀学芳,中国药学杂志,1996年4月第31卷第4期,第217-219页)、《渗透促进剂对马来酸噻吗洛尔角膜透过性的影响,魏刚,中国药学杂志,2002年6月第3卷第6期,430-433》公开的有关马来酸噻吗洛尔的经皮吸收试验的方法,进行上述实施例和对比例的透皮贴剂的经皮渗透试验。
56.具体方法为:
57.1、离体皮肤制备:取体重220
±
10g的大叔,用硫化物脱毛剂处理大鼠腹部脱毛,冲洗,常规饲养24h后处死,剪下腹部皮肤,剥离皮下脂肪和粘液组织,用生理盐水洗净,得到离体皮肤待用。
58.2、取上述离体皮肤,组装双室渗透扩散装置,包括超级恒温水浴、扩散池、接收池,接收液为生理盐水,接收池体积5ml,温度维持37
±
0.5℃,扩散面积约3.14cm2;
59.3、将实施例和对比例的马来酸噻吗洛尔凝胶透皮贴剂进行修剪后,贴在离体皮肤上,并开始计时;第0.5h、1h、2h、3h、4h、5h、6h、7h、8h取接收池中生理盐水2ml作为样品待用,然后用生理盐水补足;
60.4、将各时刻取得的生理盐水样品进行hplc测定,经换算后,得到各实施例和对比例的马来酸噻吗洛尔凝胶透皮贴剂的药物累积渗透量如下附图1、2所示。
61.从附图1、2中可以看到,采用实施例1-5制备的马来酸噻吗洛尔凝胶透皮贴剂,其累积药物释放量处于不断升高的状态,起初的药物释放速度略慢,随后逐渐上升,因此药物累积释放曲线成“j”字型,当试验进行6h之后至8h之前,累积释放量逐渐达到峰值,即贴剂中的药物接近全部释放。实施例2的累积释放量峰值由于药量较高,峰值最高,实施例3的峰值略低;实施例4的峰值出现时间比实施例1略早,实施例5的峰值出现时间比实施例1略晚,这可能与改性复合蛋白中酰化酪蛋白和卵白蛋白的比例有关。
62.对比例1的峰值出现时间比实施例4更早,对比例2则比实施例5更晚,对比例3直至第8h时峰值尚未出现,对比例4、5的峰值出现时间比对比例1更早,对比例6的累积释放曲线与对比例5相差不大。
63.试验例:马来酸噻吗洛尔凝胶透皮贴剂药物层的稳定性评价
64.参考论文文献《应用于婴幼儿血管瘤的马来酸噻吗洛尔凝胶剂的研制》(接丽莉,中国医科大学硕士学位论文,2020年2月)公开的马来酸噻吗洛尔凝胶稳定性考察的内容,对实施例和对比例的马来酸噻吗洛尔凝胶透皮贴剂的药物层的稳定性进行评价。
65.具体评价方法为:取适量上述实施例和对比例的透皮贴剂的药物层,分别于40℃、60℃恒温箱中10天,第3、6、9天观察样品外观;结果如下表1所示。
66.表1马来酸噻吗洛尔凝胶透皮贴剂药物层的样品外观评价(高温试验)
[0067][0068]
由上表1可以看到,当改变改性复合蛋白中酰化酪蛋白、卵白蛋白的比例,或者改性复合蛋白中不选用酰化酪蛋白/卵白蛋白,或者只采用酰化酪蛋白和卵白蛋白时,其透皮贴剂药物层的稳定性会存在一定的影响。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。