1.本发明涉及乳酸菌,尤其涉及一种乳酸菌发酵稳定剂及其制备方法,在常温条件下贮藏,应用所述乳酸菌发酵稳定剂提高乳酸菌菌粉存活率的方法。
背景技术:
2.乳酸菌(lab)是一类革兰氏染色阳性菌,可分为球菌和杆菌,能够发酵糖类产生以乳酸为主的产物,具有抑制有害微生物生长、调整肠道菌群平衡、增强机体免疫力,是肠道重要的功能性菌群。乳酸菌能够为机体提供营养物质,促进机体生长。乳酸菌对人和动物都有保健和治疗功效,国内外均有大量动物和临床试验证明。乳酸菌作为一种益生菌,对维持哺乳动物肠道菌群平衡具有重要作用,其产品广泛应用于食品、医疗与畜牧养殖领等领域。乳酸菌对人及动物体的健康起到举足轻重的作用,而有效的活菌数是其在人及动物体肠道发挥作用的重要因素。目前市售的绝大多数乳酸菌活菌制剂存在一个需要解决的非常关键的问题:乳酸菌对环境温度、氧气、湿度非常敏感,产品在常温下有效保质时间短,有些虽然出厂时活菌数较高,但在常温运输及贮存下活菌量下降迅速,导致在应用效果不佳,如果产品进行冷链运输和低温储存下销售,又影响了产品的应用方式和产品效果,还提高产品的能耗,因此乳酸菌的稳定性的解决关系到微生态制剂更好和更广泛的应用、以及提高生产企业的生产效率。
3.目前采用提高乳酸菌的常温稳定性的方法,主要为通过热激处理提高乳酸菌制剂的热稳定性,如公布号为cn 105316261a一种提高乳酸菌制剂热稳定性的方法中,所采用的方法为:采用鱼溶浆为营养源,乳酸菌发酵过程中采用程序性变温控制,在乳酸菌发酵周期中,至少采用2次升温热激发酵处理。热激处理是在乳酸菌发酵过程中突然升温保持一段时间,从而提高了微生物的热稳定性,微生物的热稳定性的提高和热激蛋白的产生有关。该方法需采用特定的营养源(鱼溶浆),且2次热激发酵处理,发酵过程工艺复杂,所制得的乳酸菌的常温贮存稳定性依然不高(见[0045]段,30天的存活率46.3
±
5.2%)。
[0004]
另一方面,普通的乳酸菌发酵培养的效率较低,乳酸菌发酵培养液中的乳酸菌活菌数量不多,培养液中的营养成分无法被乳酸菌有效利用;且在发酵液中提取乳酸菌,并采用冷冻干燥法制得乳酸菌菌粉的过程中,由于冰晶对乳酸菌的伤害导致冻干过程中损失部分乳酸菌活菌,从而乳酸菌的存活率进一步下降。
[0005]
综上所述,提高乳酸菌发酵液中的活菌数量及增加乳酸菌的稳定性,同时减少冻干过程中的乳酸菌损伤并延长乳酸菌在常温条件贮藏的存活率是充分发挥在营养保健、食品、医药、饲料添加剂等行业中的作用所亟待解决的问题。
技术实现要素:
[0006]
为了克服现有技术的缺点与不足,本发明提供了一种乳酸菌发酵稳定剂及其制备方法和应用方法,实现以下发明目的:
[0007]
第一,应用所述乳酸菌发酵稳定剂发酵培养乳酸菌后,发酵液中的有效活菌数提
高5~10倍;
[0008]
第二,应用所述乳酸菌发酵稳定剂所得到的乳酸菌冻干粉中,每克菌粉活菌数都在万亿以上,冻干过程中,菌体存活率提高2~3倍;
[0009]
第三,所述菌粉在常温贮存时,延缓乳酸菌活菌数量的下降,使乳酸菌在常温下贮藏12个月后菌体存活率保持在90%以上,为乳酸菌的常温贮藏提供一种新方法。
[0010]
本发明为实现上述目的是通过以下技术方案实现的:
[0011]
本发明提供了一种乳酸菌发酵稳定剂,包括糖,氨基酸,无机盐和生长因子,所述无机盐为磷酸氢钙。
[0012]
作为优选地,所述氨基酸为d-氨基酸。
[0013]
作为优选地,所述生长因子为抗坏血酸钠。
[0014]
作为优选地,所述d-氨基酸中包含d-半胱氨酸(d-cys)和d-异亮氨酸(d-leu)。
[0015]
作为优选地,所述乳酸菌发酵稳定剂包括以下组分:按质量分数计,12~20%的糖、0.3~2.7%的氨基酸、0.3~1.8%的抗坏血酸钠、2.5~6.5%的磷酸氢钙和余量的蒸馏水。
[0016]
作为优选地,所述乳酸菌发酵稳定剂包括以下组分:按质量分数计,12~20%的蔗糖、0.3~2.7%的d-氨基酸、0.3~1.8%的抗坏血酸钠、2.5~6.5%的磷酸氢钙和余量的蒸馏水。
[0017]
作为优选地,所述0.3~2.7%的d-氨基酸为0.1~1.2%的d-半胱氨酸(d-cys)和0.2~1.5%的d-异亮氨酸(d-leu)。
[0018]
作为优选地,所述乳酸菌为屎肠球菌、粪肠球菌、乳酸肠球菌、乳酸片球菌、嗜酸乳杆菌、植物乳杆菌、乳酸乳杆菌中的一种或两种以上。
[0019]
除此之外,发明人进一步提供了一种乳酸菌发酵稳定剂的制备方法,包括以下步骤:
[0020]
步骤一,在蒸馏水中依次加入糖、d-氨基酸、磷酸氢钙及抗坏血酸钠,搅拌均匀得到混合液;
[0021]
步骤二,将所述混合液于110~125℃下灭菌15~25min。
[0022]
除此之外,发明人进一步提供了一种乳酸菌发酵稳定剂的应用方法,包括以下步骤:
[0023]
步骤一,将活化的乳酸菌接种到发酵培养基/液中,于37℃下培养8~12小时,得到含乳酸菌的发酵培养基/液a;
[0024]
步骤二,将乳酸菌发酵稳定剂添加至所述发酵培养基/液a中,于37℃下继续培养3~5小时,得到含乳酸菌的发酵培养基/液b;
[0025]
步骤三,将所述含乳酸菌的发酵培养基/液b进行离心浓缩得到乳酸菌菌泥;
[0026]
步骤四,加入保护剂冷冻干燥后得到菌粉,所述菌粉贮藏在常温条件下。
[0027]
作为优选地,所述乳酸菌发酵稳定剂添加到乳酸菌发酵液中的质量比为8~15%。
[0028]
为了获得所述乳酸菌发酵稳定剂,进行了相关试验并进行结果分析,具体如下:
[0029]
s1,选取屎肠球菌、粪肠球菌、乳酸肠球菌、乳酸片球菌、嗜酸乳杆菌、植物乳杆菌、乳酸乳杆菌中的一种或两种以上作为研究对象,将糖类因子(山梨醇、甘露醇、海藻糖、乳糖、蔗糖)、氨基酸(半胱氨酸、d-cys、d-asp、d-glu、d-leu、d-met、d-phe、d-trp、d-tyr)、无
机盐(包括缓冲盐乙酸盐、磷酸氢盐、柠檬酸盐、硫酸盐、碳酸盐等,金属盐mg
2
、mn
2
、zu
2
、ca
2
、cu
2
、fe
2
等,其他类维生素b1、b2、b6、c,吐温80等)等分别添加到mrs培养基中,分析添加的营养因子对发酵液乳酸菌培养的活菌数、冻干存活率以及菌粉常温贮藏3个月后的菌体存活率影响;
[0030]
s2,从s1的研究结果中选取6个因素:蔗糖、d-cys、d-met、d-leu、抗坏血酸钠、磷酸氢钙进行组合复合物的确定;
[0031]
s3,采用plackett-burman试验设计筛选重要因子,筛选出乳酸菌发酵稳定剂的成分为蔗糖、d-cys、d-leu、磷酸氢钙及抗坏血酸钠;
[0032]
s4,利用最陡爬坡试验确定因素的最优值范围;
[0033]
s5,利用中心组合试验设计(ccd)响应面试验优化因素的最佳水平。
[0034]
在获得了所述的乳酸菌发酵稳定剂后,发明人为了验证所述乳酸菌发酵稳定剂的效果,对冷冻干燥过程中及冻干菌粉中的乳酸菌的存活率进行实验验证,具体包括如下验证:
[0035]
t1,验证所述乳酸菌发酵稳定剂对乳酸菌细胞形态的影响;
[0036]
t2,验证所述乳酸菌发酵稳定剂对乳酸菌细胞壁的影响;
[0037]
t3,验证所述乳酸菌发酵稳定剂对乳酸菌细胞膜的影响;
[0038]
t4,验证所述乳酸菌发酵稳定剂对冻干菌粉常温贮藏稳定性的影响。
[0039]
验证结果为:对照组(普通mrs生长培养基)中,发酵液活菌数为(3.85
±
0.15)
×
109cfu/ml,实验组(添加发酵稳定剂的mrs生长培养基),菌株生长情况良好,发酵培养液活菌数为(2.01
±
0.45)
×
10
10
cfu/ml;实验组与对照组相比,培养发酵液活菌数提高了5.22倍,冷冻干燥存活率提高了3.03倍,常温贮藏12周后菌体存活率提高了12.86倍。
[0040]
与现有技术相比,本发明获得的有益效果是:
[0041]
本发明提供的一种包含糖,氨基酸,无机盐和生长因子的乳酸菌发酵稳定剂,通过试验研究发现,糖类,d-氨基酸,磷酸氢钙和抗坏血酸钠可以协同形成乳酸菌营养复合保护体,所述乳酸菌发酵稳定剂为乳酸菌的发酵培养提供营养成分能被有效利用,从而提高了在乳酸菌培养后发酵液中活菌数,试验组(含有所述乳酸菌发酵稳定剂的mrs培养基)与对照组(普通mrs培养基)相比,发酵液有效活菌数提高5~10倍。
[0042]
采用所述乳酸菌发酵稳定剂进行培养后的乳酸菌菌体在形态上变得又短又卵圆,使菌体表面积减小,减少在冷冻过程中形成的冰晶对菌体的损伤,提高了乳酸菌的冷冻干燥的抗逆性,解决了冷冻干燥过程中对乳酸菌的损伤,提高了冷冻干燥过程乳酸菌的存活率。
[0043]
采用所述乳酸菌发酵稳定剂,改性了乳酸菌菌体细胞壁形状和强度,维持了其细胞膜和细胞壁的完整性,保持菌株细胞膜的流动性,更好的保护菌体细胞的dna、蛋白质等物质,可以抵抗常温环境下的不良因素,有效保持乳酸菌活性剂活菌数,提高了乳酸菌在常温下的存活率,使乳酸菌在常温下贮藏12个月后菌体存活率保持在92%以上。
[0044]
本发明提供的乳酸菌发酵稳定剂及其制备方法和应用方法操作简便,配方组成简单、成本低廉,能使乳酸菌的性质更稳定、生物活性更强、常温储存更长久。
附图说明
45.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
[0046]
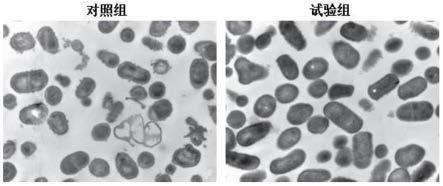
图1示本发明实施例中对照组和实验组乳酸菌细胞形态图(发酵液放大2000倍)。
[0047]
图2示本发明实施例中对照组和实验组乳酸菌细胞形态图(冻干菌粉放大6000倍)。
[0048]
图3示本发明实施例中对照组和实验组乳酸菌细胞形态图(常温贮藏放大800倍)。
具体实施方式
[0049]
以下结合说明书附图和具体实施例来进一步说明本发明,但所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0050]
实施例1一种乳酸菌发酵稳定剂,其具体制备方法的研究过程如下:
[0051]
筛选营养因子:选取嗜酸乳杆菌作为研究对象,将糖类因子(山梨醇、甘露醇、海藻糖、乳糖、蔗糖)、氨基酸(半胱氨酸、d-cys、d-asp、d-glu、d-leu、d-met、d-phe、d-trp、d-tyr)、无机盐(包括缓冲盐乙酸盐、磷酸氢盐、柠檬酸盐、硫酸盐、碳酸盐等,金属盐mg
2
、mn
2
、zu
2
、ca
2
、cu
2
、fe
2
等,其他类维生素b1、b2、b6、c,吐温80等)等分别添加到mrs培养基中,分析添加的营养因子对发酵液乳酸菌培养的活菌数、冻干存活率以及菌粉常温贮藏3个月后的菌体存活率影响;
[0052]
乳酸菌冻干菌粉制备流程:嗜酸乳杆菌冻干菌粉的制备具体流程,甘油管
→
菌种活化
→
制备种子液
→
发酵罐培养
→
离心收集菌体
→
制备菌悬液
→
添加保护剂
→
真空冷冻干燥
→
菌粉贮藏
[0053]
菌株的培养:将嗜酸乳杆菌划线接种于mrs固体培养基中,37℃培养活化;再挑取菌落传代于mrs液体培养基中于37℃培养20h,传三代后将菌株置于4℃冰箱中待用。
[0054]
冷冻干燥条件:预冻温度及预冻时间为-80℃、12h;保护剂与菌体(菌体浓度调整为10
10
cfu/g左右)比例:10:1。冷冻干燥18h后,以mrs固体培养基于37℃培养48h后计数。
[0055]
(1)添加糖类因子对嗜酸乳杆菌发酵剂常温稳定性能影响
[0056]
在mrs培养基中添加不同的糖类因子(山梨醇、甘露醇、海藻糖、乳糖、蔗糖、葡萄糖,添加量为1%)。将菌株按3%(体积比v/v)的接种量接种于添加不同的糖类因子的mrs培养基及普通mrs培养基(对照组一)中,37℃条件下发酵培养18h,通过对比分析发酵液活菌数、冷冻干燥存活率以及菌粉常温储藏后菌体存活率,验证糖类因子对嗜酸乳杆菌发酵剂常温稳定性能影响并确定最佳糖类因子。
[0057]
菌量检测结果:与对照组一的结果相比,糖类因子的添加可以明显促进乳酸菌(嗜酸乳杆菌)的生长,显著提高乳酸菌(嗜酸乳杆菌)的培养活菌数;添加蔗糖、海藻糖和甘露醇发酵后,嗜酸乳杆菌的冷冻存活率均明显高于添加乳糖和未添加的,但添加蔗糖、海藻糖和甘露醇时的差异不显著(p<0.05);在mrs培养基中加入蔗糖和海藻糖可以显著提高嗜酸乳杆菌冻干菌粉常温储藏3个月的菌体存活率,嗜酸乳杆菌具有更好地抵御不良环境的稳定性能,其中蔗糖的效果最好,菌粉常温储藏3个月的菌体存活率为57.8%。
[0058]
在生长培养基中的添加糖类因子对菌株的冷冻干燥保护作用是由于其含有大量
羟基,可以代替水分子与蛋白质的极性基团结合,从而维持蛋白质的空间结构,防止蛋白质的脱水变性。当生长培养基中添加蔗糖时可诱导菌体分泌胞外多糖黏附在细胞壁上,形成玻璃态的保护层,进而在脱水的过程中起到保护作用。
[0059]
(2)添加氨基酸类因子对乳酸菌发酵剂常温稳定性能影响
[0060]
在mrs培养基中分别添加不同的l-氨基酸(l-aas)和d-氨基酸(d-aas),并以不添加氨基酸的普通mrs培养基(对照组一)为对照,对比分析发酵液活菌数、冷冻干燥存活率以及菌粉常温储藏后菌体存活率,确定所需氨基酸的种类及添加量。
[0061]
菌量检测结果:在mrs生长培养基中添加d-氨基酸(d-aas)在冷冻干燥存活率和常温储藏后菌体存活率上显著高于添加l-氨基酸(l-aas)(p《0.05),但发酵液活菌数略低于添加l-氨基酸(p》0.05);分别添加d-cys、d-leu、d-met的mrs培养基在冷冻干燥存活率和常温储藏后菌体存活率上显著高于其他氨基酸(p《0.05),冻干后的活菌数均在1.03
×
10
10
cfu/ml以上,菌粉常温储藏3个月的菌体存活率均在67.3%以上。在mrs培养基中添加d-cys、d-leu、d-met,使得嗜酸乳杆菌形态变为短粗杆状,当菌体的短杆或球形形态可使菌体具有较大的营养摄取表面积,以及在不良环境中保持其活性,从而增强了菌株的抗冷冻干燥和常温稳定性能。
[0062]
氨基酸作为微生物生长代谢所必须的一类生长因子,乳酸菌不能产生某些必须的前体和中间产物,需要另外添加某些氨基酸促进其细胞壁生物合成、生物膜完整性和孢子萌发。外源添加d-aas不参与蛋白质合成,主要参与细菌细胞壁肽聚糖(pg)的形成,细胞壁pg肽链的组成会随着在培养基中外源添加d-aas而发生改变,影响乳酸菌细胞壁形状、数量和强度以及生物膜形成,对保持细胞完整性、维持细胞形状稳定起着重要作用。因此某些d-氨基酸(d-aas)对提高乳酸菌的冷冻干燥存活率和常温储藏稳定性有至关重要的作用。
[0063]
(3)添加无机盐或其他成分对乳酸菌发酵剂常温稳定性能影响
[0064]
分别添加不同的缓冲盐(包括乙酸盐、磷酸氢盐、柠檬酸盐、硫酸盐、碳酸盐等)、金属盐(包括mg
2
、mn
2
、zu
2
、ca
2
、cu
2
、fe
2
等)以及其他类(包括维生素b1、b2、b6、c,吐温80等),并以不添加无机盐或其他成分的空白mrs培养基为对照,确定所需添加无机盐或其他成分的种类及添加量。
[0065]
添加抗坏血酸钠不仅可以促进乳酸菌的生长繁殖,还可以清除氧化产生的自由基,减少细胞膜中不饱和脂肪酸的氧化;添加含磷酸缓冲盐类的生长培养基在促进嗜酸乳杆菌生长同时还可以增强其蛋白酶的活性提高菌株冻干存活率,添加磷酸氢钙的mrs培养基的嗜酸乳杆菌冷冻干燥过程的菌体存活率以及常温储藏3个月后的菌体存活率均显著高于其他组别(p《0.05),所述磷酸氢钙的mrs培养基的嗜酸乳杆菌冻干菌粉常温储藏3个月后的菌体存活率为64.7%。因为磷酸氢钙自身的结晶相变温度较高在冷冻干燥中相变困难,降低了在冷冻干燥中蛋白质变性的几率,是最适合加入冷冻干燥产品中的缓冲物质。
[0066]
镁、锰、锌、铁、钙、铜等微量元素作为酶的激活剂和生物活性成分对乳酸菌的生长繁殖有一定的促进作用。在生长培养基中添加一定量的钙盐比未添加的培养基增殖效果提高了12.6%,添加了钙盐的培养基可以减少蛋白胨的用量,在提高菌数的同时还可以起到节约成本的作用。显微镜观察发现,在添加了ca
2
的培养基中菌株的形态为短杆状,使菌株细胞膜中不饱和脂肪酸含量增加,改善细胞膜的流动性,可以将乳酸菌的冻干存活率提高到85%。因此,磷酸氢钙作为初步筛选出的因子之一。
[0067]
(4)组合复合物对乳酸菌发酵剂常温稳定性能影响
[0068]
①
plackett-burman试验设计筛选重要因子
[0069]
plackett-burman是一种不完全平衡块为原理的试验设计,能从众多的变量中有效筛选出最重要的几个因素。根据前期研究结果,在mrs生长培养基中添加糖类,氨基酸类、无机盐等生长因子,试验利用design expert 8.0.6软件对6种发酵稳定剂设计n=16的二水平因子的plackett-burman试验进一步优化考察,6个因素分别为蔗糖、d-cys、d-met、d-leu、抗坏血酸钠、磷酸氢钙,每个因素分别取2个水平,高水平为低水平的1.25倍。从中筛选出对乳酸菌冻干后存活率和常温储存影响较大的主要因素。
[0070]
表1 plackett-burman试验设计筛选重要因子与结果
[0071][0072]
利用design expert软件对plackett-burman设计回归分析可以看出,该回归模型的p值(pr>f)=0.0216<0.05,回归方程显著,该模型在95%的置信区间内显著(p<0.05),模型的决定系数r2=0.978,表明95%以上实验数据的变化可用该模型解释。通过各因素的主效应进行分析可知,在6种因素中蔗糖、d-cys、d-leu、磷酸氢钙等因素在95%概率水平上有显著影响,且pr>f值<0.05,说明这4个因素均为显著模型因素。
[0073]
通过plackett-burman试验结果筛选出对嗜酸乳杆菌发酵剂常温储存稳定有显著影响作用的发酵稳定剂成分为蔗糖、d-cys、d-leu、磷酸氢钙。
[0074]
②
最陡爬坡试验确定因素的最优值范围
[0075]
对于plackett-burman试验分析得出的不显著因素,为了简化发酵稳定剂组分和降低成本,采用单因素试验确定发酵稳定剂成分的最低添加量。在plackett-burman试验设计分析得出的显著性因素后,对其最佳值区域进行进一步确定的实验方法。根据显著性因素效应值确定变化步长和变化方向,近一步靠近最佳值区域。找到拐点,为后续的中心复合设计提供试验依据。
[0076]
由模型方程和回归分析的结果可以确定最陡爬坡路径。对于发酵剂常温储存稳定,d-met、抗坏血酸钠在95%概率水平上差异不显著,故添加量不变。蔗糖、d-cys、d-leu、磷酸氢钙在95%概率水平上差异显著,改变四者的添加量对发酵剂常温储存稳定性能有着重要的影响。列出了蔗糖、d-cys、d-leu、磷酸氢钙的改变方向及变化步长。最陡爬坡试验的
设计和结果可知:当发酵稳定剂组分为蔗糖16g/l、d-cys 0.5g/l、d-leu 0.5g/l、磷酸氢钙4.5g/l时,嗜酸乳杆菌的冷冻干燥存活率以及菌粉常温储藏(3个月)后菌体存活率较高。因此后续的box-behnken响应面试验设计采用该添加量为响应面的中心点。
[0077]
③
中心组合试验设计(ccd)响应面试验优化因素的最佳水平:
[0078]
根据plackett-burman设计及最陡爬坡试验的结果,以寻找到的中心点为出发点进行ccd试验设计,每个因素取5个水平。用软件design expert 8.0.6对试验进行试验设计回归分析,对实验数据结果进行多项式回归分析得到一个二次多项式方程,此方程反映了响应量与自变量的关系,由此可以找出响应面最高点,就是最佳的发酵稳定剂的成分与含量。
[0079]
以蔗糖、d-cys、d-leu和磷酸氢钙4个重要因素为自变量,分别标记为x1、x2、x3、x4,以嗜酸乳杆菌培养的发酵液活菌数(y1)、冷冻干燥后菌体存活率(y2)以及菌粉常温储藏3个月后的菌体存活率(y3)为响应值,进行发酵剂常温稳定性能优化的中心组合试验设计及结果见表2。
[0080]
表2中心组合试验设计及发酵稳定剂优化
[0081][0082]
[0083]
根据试验结果建立该模型多元二次回归拟合方程,进行方差分析及回归分析,此模型f值为59.98,p《0.0001<0.01,表明该模型自变量与因变量之间的线性关系极显著;失拟项f值为3.58,p=0.0861>0.05,失拟项不显著,说明该模型不需要添加更多的因素,模型拟合程度较好。另外,此模型的决定系数r2=0.9825,修正决定系数r
2adj
=0.9661,方差相差很小,说明此模型可解释96.6%的实验数据变化,预测值与实际值之间有高度相关性;变异系数cv为0.203%,信噪比为14.01,模型的离回归偏差较小,表明方程拟合度较好。因此可以用此模型分析和预测乳酸菌发酵稳定剂的配方。
[0084]
根据响应面建立的二次多项回归方程模型分析,以菌粉常温储藏3个月后的菌体存活率(y3)最高为条件进行优化,得到最优解:蔗糖16.16g/l、d-cys 0.49g/l、d-leu 0.36g/l、磷酸氢钙4.62g/l,在此条件下预测的菌体存活率为91.41%。采用优化得到的结果进行三次冻干验证及菌粉常温储藏试验,得到菌粉在常温储藏3个月后存活率为92.75%
±
1.07%,与预测值相吻合,说明建立的数学模型准确可靠,可信度较高,具有实际操作性,可以用来进行发酵稳定剂配方的筛选和优化。
[0085]
综合实验数据结果及所建立的数学模型,所述乳酸菌发酵稳定剂的组分如下:按质量分数计,12~20%的蔗糖、0.1~1.2%的d-半胱氨酸(d-cys)、0.2~1.5%的d-异亮氨酸(d-leu)、0.3~1.8%的抗坏血酸钠、2.5~6.5%的磷酸氢钙以及余量的蒸馏水,可以实现乳酸菌菌粉常温储藏3个月后的菌体存活率大于92%。
[0086]
实施例2一种乳酸菌发酵稳定剂应用于提高冷冻干燥抗性及常温贮藏高存活率的方法
[0087]
一种乳酸菌发酵稳定剂,包括蔗糖16.16g/l、d-cys 0.49g/l、d-leu 0.36g/l、磷酸氢钙4.62g/l、抗坏血酸钠1.25g/l。
[0088]
(1)添加所述乳酸菌发酵稳定剂对嗜酸乳杆菌细胞形态的影响
[0089]
实验方法:采用jem-1200ex透射电镜(日本jeol公司),莱卡sm5000 cs光学显微镜对菌体细胞形态进行观察。为了更好地观察细胞,细胞使用结晶紫染色。显微镜拍摄后,使用image j对菌株进行长度统计。以嗜酸乳杆菌为研究对象,普通mrs培养基进行培养嗜酸乳杆菌(对照组二),mrs培养基中添加所述乳酸菌发酵稳定剂进行培养嗜酸乳杆菌(实验组二)。
[0090]
请参考附图1至3,结果发现,对照组二(普通mrs培养基)培养条件下,嗜酸乳杆菌的长度范围集中在1.2~1.8μm之间,而实验组二(添加所述乳酸菌发酵稳定剂)培养条件下,嗜酸乳杆菌的长度范围则集中分布于0.7~1.3μm之间,实验组二培养条件下的嗜酸乳杆菌平均长度相较于对照组二培养条件下的嗜酸乳杆菌长度缩短了约0.52μm,菌株都有了不同程度的短杆化或者球体化,短杆或球形相较于长杆更具稳定性,菌体表面积的减小促使在冷冻过程中形成的冰晶对其细胞膜的机械损伤减小,所以短粗杆状的菌体比细长杆状的在冷冻干燥过程中更具稳定性。从实验组二得到的菌体冻干后的菌株透射电镜图可以看出,添加所述乳酸菌发酵稳定剂可以使多数菌体保持完整,菌株细胞膜完整性较好;而对照组二中未添加所述乳酸菌发酵稳定剂的部分菌株完整性受到破坏,有胞内物质外渗出,并将细胞中的内容物释放到了周围的环境中,只剩下了菌体细胞的空壳,且菌株细胞壁也有明显的破裂现象,细胞膜不完整。
[0091]
(2)添加所述乳酸菌发酵稳定剂对嗜酸乳杆菌细胞壁的影响
[0092]
实验原理:
[0093]
①
碱性磷酸酶(akp)存在于细胞壁和细胞膜之间,正常情况下细菌培养液中只能检测到少量的akp,只有当细胞壁通透性增大或损坏时,指示液中akp含量才会增加,所以可以通过检测akp活性来反映细胞壁损伤的情况。
[0094]
②
青霉素是一种肽聚糖合成抑制剂,在培养环境中它会干扰细菌细胞壁的合成并诱导细胞的死亡,细胞壁的损伤是青霉素敏感性增加的原因之一。
[0095]
③
溶菌酶的作用位点为细胞壁中n-乙酰胞壁酸与n-乙酰胺基葡萄糖之间的β-1,4糖苷键,使细胞壁中的不溶性多糖分解为可溶性糖肽,造成细胞壁破裂内容物逸出。随着常温贮藏时间的延长,细胞溶菌酶敏感性的上升,细胞壁发生了损伤。
[0096]
④
fdaas(fluorescent d-amino acids)是一种能够在多种细菌中有效地原位标记肽聚糖(pg)的荧光衍生物,可特异性探测细胞壁形成/重塑、细菌生长和细胞形态。
[0097]
实验方法与结果分析:
[0098]
①
分别取普通mrs培养基培养条件下(对照组三)和添加所述乳酸菌发酵稳定剂的mrs培养基培养条件下(实验组三)得到的菌泥各0.1g,分别加入0.05ml甲苯轻摇15min;碱性磷酸酶(akp)试剂盒分别对样品进行3次重复酶活测定,酶活的单位用u/g表示。
[0099]
结果发现,经冷冻干燥处理后,所述对照组三中碱性磷酸酶(akp)的含量为(726.54
±
4.62)u/g显著高于所述实验组三中碱性磷酸酶(akp)的含量(435
±
2.16)u/g(p《0.05);常温贮藏试验发现,所述实验组三中碱性磷酸酶(akp)随着常温贮藏时间的延长,其活性无明显变化,对照组会显著上升,说明未添加所述乳酸菌发酵稳定剂的所述对照组三中的菌体的细胞壁受到损伤,添加所述乳酸菌发酵稳定剂可提高菌体细胞壁的稳定性。
[0100]
②
分别将普通mrs培养基培养条件下(对照组四)和添加所述乳酸菌发酵稳定剂的mrs培养基培养条件下(实验组四)得到的菌粉,进行贮存,每周进行计活菌数,验证所述乳酸菌发酵稳定剂的添加对于青霉素的作用。称取不同时期的对照组四与实验组四的菌粉,分别统计其在在添加了青霉素的mrs琼脂培养基中和普通mrs琼脂培养基中的活菌数,然后计算对青霉素不敏感得存活率。存活率(%)=含有青霉素的固体mrs培养基中培养的活菌数/普通mrs固体中培养的活菌数。
[0101]
结果发现,随着常温贮藏时间的延长,嗜酸乳杆菌的细胞壁会有一定的损伤,因此对青霉素的敏感程度都有着升高。3个月常温贮藏后,所述对照组四在3个月常温贮藏后在含有青霉素的固体培养基中相比于普通mrs固体存活率仅为36.15%,说明其菌体细胞壁发生破损,青霉素敏感,所述实验组四在3个月常温贮藏后的菌体存活率仍达到81.19%;所述实验组四相较于所述对照组四在经过冷冻干燥与3个月常温贮藏,有效的阻止了细胞壁的损伤;并且从0周到12周的常温贮藏存活率的结果发现,所述对照组四的菌体存活率下降幅度为61.18%,所述实验组四的菌体存活率下降幅度为11.34%,这表明所述实验组四的菌株在3个月常温贮藏中对于青霉素的敏感性无明显的变化。添加所述乳酸菌发酵稳定剂进行培养可以有效的保护细胞壁。
[0102]
③
分别取普通mrs培养基培养条件下(对照组五)和添加所述乳酸菌发酵稳定剂的mrs培养基培养条件下(实验组五)得到的菌泥各0.1g,分别对所述对照组五的菌泥和所述实验组五的菌泥进行活菌量检测;进行冷冻干燥后得到对照组五菌粉和实验组五菌粉,并分别对所述对照组五菌粉和所述实验组五菌粉的初始活菌量进行检测;12周常温贮藏后,
对所述实验组五菌粉和所述对照组五菌粉中的活菌量进行检测。验证所述乳酸菌发酵稳定剂的添加对于溶菌酶的作用。
[0103]
结果发现,所述对照组五的菌泥在冷冻干燥前后嗜酸乳杆菌的存活率下降了27.16%,所述对照组五菌粉12周常温贮藏后相较所述对照组五的菌泥中的活菌量下降了42.37%;所述实验组五的菌泥在冷冻干燥前后嗜酸乳杆菌的存活率下降了6.82%,所述实验组五菌粉12周常温贮藏后相较所述实验组五的菌泥中的活菌量下降了4.23%。说明添加所述乳酸菌发酵稳定剂的mrs培养基培养条件下的乳酸菌对于溶菌酶的敏感性相对于普通mrs培养基培养条件下的乳酸菌对于溶菌酶的敏感性有所降低,降低了溶菌酶对细胞壁的损伤,提升了菌体在冷冻干燥过程及常温贮藏中的存活率。
[0104]
④
将等量的fdaas分别添加到含有发酵稳定剂的mrs培养基(实验组六)和普通mrs培养基(对照组六)中进行乳酸菌的培养,通过观测荧光变化监测pbps(青霉素结合蛋白)的tp(总蛋白)活性变化,探测细菌新生壁的合成情况。
[0105]
结果发现,所述实验组六中培养的乳酸菌的细胞壁肽聚糖(pg)的合成和结构发生变化,与所述对照组六中培养的乳酸菌的pg相比,所述实验组六单位细胞pg的含量减少,且肽链上脂蛋白的结合比例下降了32%,被修饰的肽链占总pg的65%,且d-cys能快速结合到肽链上,在15min左右出现新的、明显稳定的非常规pg聚合物;所述非常规pg聚合物可以诱导乳酸菌由杆状成为短杆或球状,同时使细胞壁pg含量下降约45%;细胞壁肽聚糖中聚糖链长度减少20%以上,五肽减少40%,三聚体寡肽增加40%;出现大量所述非常规pg聚合物,可以控制菌体细胞壁pg的数量和强度,调节每个细胞的细胞壁pg量,保持对低渗透压的抵抗力,帮助乳酸菌应对外界环境压力。在常温贮藏中,所述实验组六中菌株比所述对照组六中菌株表现出更强的存活率,说明乳酸菌培养时添加所述乳酸菌发酵稳定剂可以控制细胞壁的完整性,通过减少pg的合成和结构,改变其细胞壁以在冷冻干燥和常温贮藏的条件下拥有更高的存活率。
[0106]
综上所述,添加所述乳酸菌发酵稳定剂可以改变pg的合成与结构,从而影响了乳酸菌细胞壁的形状、数量和强度,以及生物膜的形成,抑制了孢子萌发和控制细胞壁的完整性,适应不良环境。经碱性磷酸酶(akp)实验、青霉素与溶菌酶敏感性试验发现,所述乳酸菌发酵稳定剂的添加会有效的保护细胞壁,提高了乳酸菌在常温贮藏过程中的稳定性及抵御不良环境的抗性。
[0107]
(3)添加所述乳酸菌发酵稳定剂对嗜酸乳杆菌细胞膜的影响
[0108]
实验原理:
[0109]
①
利用测定菌体细胞对于nacl的敏感性,来判断菌体中细胞膜是否受损。对nacl越敏感,说明菌体的细胞膜活性越强。
[0110]
②
na k -atp酶是一种生物膜酶,可以在一定程度上反映细胞膜的通透性,通过催化atp水解提供能量维持细胞膜两侧的膜电位,对维持渗透压的恒定有决定性的作用。
[0111]
③
利用分子探针live/deadbaclight 7012细菌活力检测试剂盒检测冷冻干燥前后不同培养基对嗜酸乳杆菌菌体细胞膜完整性的影响,用绿色荧光核酸染色剂syto 9和红色荧光核酸染色剂碘化丙啶(pi)来区分细胞膜是否完整,2种染料同时存在时,由于pi仅能穿过受损的菌细胞,与染色体结合使细胞呈现红色,而syto 9对完整细胞膜的细胞进行染色并呈现绿色,从而判断菌体细胞膜的完整性。
[0112]
④
饱和/不饱和脂肪酸的比例决定了细胞膜的流动性和完整性,相对高含量的不饱和脂肪酸可以提高细胞膜的流动性和完整性,从而提高菌体对常温贮藏的抵抗能力。
[0113]
荧光偏振(p)和细胞的平均微黏度(η)关系式为:η=2p/(0.46—2p),p和η越小说明细胞膜流动性越强。
[0114]
实验方法:
[0115]
①
普通mrs培养基培养的嗜酸乳杆菌(对照组七)及添加所述乳酸菌发酵稳定剂的mrs培养基培养的嗜酸乳杆菌(实验组七)在相同的常温条件下贮藏12周,检测菌体对nacl的敏感度。
[0116]
②
普通mrs培养基培养的嗜酸乳杆菌菌粉(对照组八)及添加所述乳酸菌发酵稳定剂的mrs培养基培养的嗜酸乳杆菌菌粉(实验组八),将所述对照组八和实验组八的菌粉样品复水离心弃上清,得到对照组八和实验组八的菌泥分别用0.85%nacl溶液清洗2次后,分别加入2ml酶提取液,后进行超声波破碎(超声3s,间隔10s,7min);4℃,15000r/min,离心10min取上清,得到对照组八上清液和实验组八上清液,用于后续相关酶活测定。
[0117]
na k -atp酶试剂盒分别对对照组八和实验组八的样品进行相关酶活的3次重复测定,酶活的单位用u/g表示。
[0118]
③
普通mrs培养基培养的嗜酸乳杆菌(对照组九)及添加所述乳酸菌发酵稳定剂的mrs培养基培养的嗜酸乳杆菌(实验组九)在相同的常温条件下贮藏12周,采用绿色荧光核酸染色剂syto 9和红色荧光核酸染色剂碘化丙啶(pi)对菌体进行染色。
[0119]
④
普通mrs培养基培养的嗜酸乳杆菌(对照组十)及添加所述乳酸菌发酵稳定剂的mrs培养基培养的嗜酸乳杆菌(实验组十)的不饱和脂肪酸及饱和脂肪酸的含量测定,对对照组十的嗜酸乳杆菌进行冷冻干燥及常温贮藏(对照组十一),对实验组十的嗜酸乳杆菌进行冷冻干燥及常温贮藏(实验组十一)。
[0120]
实验结果:
[0121]
①
当经过真空冷冻干燥后,所述对照组七的菌体对nacl的敏感度下降至89.13%,所述实验组七的菌体对nacl的敏感度下降至93.36%,两者间无显著变化;在常温条件下贮藏过程中,所述对照组七与所述实验组七的细胞膜敏感性有明显的变化,从0周到12周所述对照组七的菌体对nacl的敏感性下降了63.58%,而所述实验组七的菌体对nacl的敏感性仅下降了9.43%。这表明所述乳酸菌发酵稳定剂的添加对菌株的细胞膜起到了一定的保护作用,降低了菌株细胞膜在常温贮藏的过程中的损伤程度,从而提高了菌株的冻干存活率及常温贮藏的稳定性。
[0122]
②
在真空冷冻干燥前,所述实验组八与所述对照组八的酶活并无显著的差异,分别为20.23u/g与20.41u/g;经冷冻干燥后,所述对照组八的酶活为9.56u/g,所述实验组八的酶活是18.15u/g;在常温贮藏过程中,随着贮藏时间延长,菌株的na k -atp酶活性逐渐降低,这与菌株的贮藏稳定性试验结果相似,所述对照组八在12周贮藏期内酶活下降了17.9u/g,而所述实验组八在12周贮藏期内酶活仅下降4.28u/g。说明所述乳酸菌发酵稳定剂可以较好保持菌株酶活性,不仅有效的提升了菌株在真空冷冻干燥过程中的抗性,而且在常温贮藏的环境中,可以稳定细胞内外ph与渗透压的动态平衡,维持乳酸菌细胞活性。
[0123]
③
染色结果显示,所述实验组九的活菌数量有显著增加且活菌比例更高,所述实验组九的细胞绿色荧光数量明显多于所述对照组九。说明所述乳酸菌发酵稳定剂可以降低
冷冻干燥和常温贮藏对菌株细胞膜的损伤程度,提高了菌粉在冷冻干燥与常温贮藏环境下植乳酸菌的活菌比例。
[0124]
④
所述实验组十的嗜酸乳杆菌菌株的不饱和脂肪酸与饱和脂肪酸的比值(ufa/sfa)为0.932,所述对照组十的的嗜酸乳杆菌菌株的不饱和脂肪酸与饱和脂肪酸的比值(ufa/sfa)为0.521,所述实验组十的嗜酸乳杆菌菌株的ufa/sfa值显著高于所述对照组十的嗜酸乳杆菌菌株的ufa/sfa值(p《0.05)。因此,添加所述乳酸菌发酵稳定剂可以使菌株细胞膜脂肪酸组分比例发生改变,在所述实验组十的培养基中生长的嗜酸乳杆菌通过调节自身脂肪酸组分比例,提高了细胞膜中不饱和脂肪酸的含量,从而改善了菌株抗冷冻性。
[0125]
mrs培养基培养菌株为对照组十,mrs培养基培养菌株冷冻干燥与常温贮藏后为对照组十一,添加发酵稳定剂mrs培养基培养菌株冷冻干燥与常温贮藏后为实验组十一。
[0126]
所述实验组十一与所述对照组十相比并无显著性差异,均保持了良好的流动性;所述对照组十一与所述对照组十及所述实验组十一相比,p值和η值均显著性增加(p《0.05),膜的流动性明显降低。说明添加所述乳酸菌发酵稳定剂显著提高了常温贮藏时菌体细胞膜的流动性,验证了提高细胞膜不饱和脂肪酸有利于改善细胞膜的流动性,进而通过提高细胞膜流动性提高菌株对不良环境中的抗性。
[0127]
研究发现添加所述乳酸菌发酵稳定剂到mrs培养基培养(所述实验组十)的菌株细胞膜不饱和脂肪酸含量升高,不饱和脂肪酸与饱和脂肪酸的比值(ufa/sfa)变大,明显高于普通mrs培养基(所述对照组十),致使细胞膜流动性增强;通过透射电镜及荧光显微镜发添加所述乳酸菌发酵稳定剂的菌株较好维持了细胞膜完整性;通过对菌株β-半乳糖苷酶、na k -atp酶、乳酸脱氢酶、丙酮酸激酶及己糖激酶的测定,发现添加所述乳酸菌发酵稳定剂对菌株β-半乳糖苷酶、na k -atp酶及乳酸脱氢酶作用显著,能够较好维持菌株酶活性,提高菌株对不良环境中的抗性,进而显著的增加了乳酸菌的常温贮藏的存活率。
[0128]
(4)添加所述乳酸菌发酵稳定剂对嗜酸乳杆菌冷冻干燥后常温贮藏稳定性的影响
[0129]
实验方法:普通mrs培养基培养的嗜酸乳杆菌(对照组十二)及添加所述乳酸菌发酵稳定剂的mrs培养基培养的嗜酸乳杆菌(实验组十二),将所述对照组十二和所述实验组十二的菌株经真空冷冻干燥后,置于37℃的恒温箱中避光贮藏,每隔一周取出计数。通过分别检测真空冷冻干燥后嗜酸乳杆菌在37℃环境下贮藏3个月的活菌数反映其贮藏稳定性,同时通过存活率变化评价其下降幅度。
[0130]
表3添加所述乳酸菌发酵稳定剂对嗜酸乳杆菌冷冻干燥后常温贮藏稳定性的影响
[0131][0132][0133]
对照组十二:在mrs培养基中发酵;实验组十二:添加所述乳酸菌发酵稳定剂在mrs培养基中发酵。
[0134]
从表3可知,所述对照组十二中,发酵液活菌数为(3.85
±
0.15)
×
109cfu/ml,当贮藏12周后,菌体存活率存活率为7.26%;所述实验组十二的菌株生长情况良好,发酵培养液
活菌数为(2.01
±
0.45)
×
10
10
cfu/ml,12周内贮藏稳定性较高,经12周贮藏后的活菌存活率达到93.42%;在添加所述乳酸菌发酵稳定剂的mrs培养基培养条件下菌株发酵菌数、冷冻干燥存活率和常温贮藏存活率较普通mrs培养基均有显著增高(p《0.05),所述实验组十二与所述对照组十二相比,培养发酵液活菌数提高了5.22倍,冷冻干燥存活率提高了3.03倍,常温贮藏12周后菌体存活率提高了12.86倍;菌株在贮藏2~12周时,在培养基中添加了所述乳酸菌发酵稳定剂可显著提升菌株活菌数且存活率降幅较小,从而提高了菌株的贮藏稳定性(p《0.05)。
[0135]
表4所述乳酸菌发酵稳定剂对嗜酸乳杆菌抗真空冷冻干燥性能及常温贮藏的影响
[0136][0137]
随着所述乳酸菌发酵稳定剂浓度的增加,菌株贮藏稳定性提高,当所述乳酸菌发酵稳定剂添加量过高时菌株生长会受到抑制,影响了菌体培养的生长量和活菌数(相关实验数据见表4)。所述乳酸菌发酵稳定剂添加到乳酸菌发酵液中的质量比为8~15%,所述乳酸菌发酵稳定剂对乳酸菌的细胞壁、细胞膜、dna以及蛋白质具有更好的保护作用,可以有效地提高菌株的冷冻干燥抗性,致使菌株具有较强的常温贮藏稳定性。
[0138]
实施例3:所述乳酸菌发酵稳定剂对多种乳酸菌抗真空冷冻干燥性能及常温贮藏的影响
[0139]
实验方法:将不同种属的乳酸菌活化好,均以2%的接种量接种至添加所述乳酸菌发酵稳定剂的mrs培养基中,培养时间16h后,收取相同质量的乳酸菌菌泥后添加相同的冻干保护剂混匀,使用相同的冻干工艺进行同一批次冻干并进行冻干前后的计数,计算出不同乳杆菌在相同冻干条件下的冻干存活率。
[0140]
在相应的贮藏期,准确称取各组0.1g菌粉,加入9.9ml pbs缓冲液稀释,加入粒玻璃珠摇床混匀5min,之后进行平板计数。实验重复三次,每次实验三个平行。根据以下公式计算贮藏期存活率。
[0141]
存活率(%)=a1/a2
×
100%
[0142]
式中:a1表示贮藏n周时样品单位体积的活菌数(cfu/g),a2表示贮藏0周时样品单位体积活菌数(cfu/g)。
[0143]
表5所述乳酸菌发酵稳定剂对不同种类乳酸菌抗真空冷冻干燥性能及常温贮藏的影响
[0144][0145]
由表5可知,不同乳酸菌在添加所述乳酸菌发酵稳定剂下的菌株发酵菌数、冷冻干燥存活率以及常温贮藏的存活率较普通mrs培养基均有显著增高(p《0.05)。
[0146]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围的内。因此,本发明的保护范围应该以权利要求所界定的保护范围为准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
