1.本发明涉及一种人参皂苷霉素脂质体、其制备方法和应用;进一步公开了一种高效低毒的人参皂苷阿霉素脂质体,其制备方法和应用。
背景技术:
2.脂质体是一种定向载药系统,属于靶向给药系统的一种特殊剂型,它可以将药物包埋在直径为纳米级的微粒中,这种微粒类似于生物膜结构中双分子层微小囊泡,进入人体内主要被网状内皮系统吞噬,并改变被包封药物的体内分布,使药物主要在靶向组织中积蓄,从而提高药物的治疗指数,减少药物的治疗剂量和降低药物的毒性。
3.cn201610693884.2、cn201811447245.3和cn201811447243.4等三篇申请专利都公开了以“被动载药“即”薄膜蒸发法”为主制备的一种以人参皂苷为膜材的脂质体在包载紫杉醇等化疗药物之后,其相关脂质体质量稳定、药效显著等技术优势。而水溶性药物更适合采用主动载药等方法制备。
4.cn200380104235.5和cn200380104175.7等专利公开了一种以磷脂和胆固醇为膜材,以硫酸铵等为梯度的脂质体主动载药制备方法。
5.cn201811532448.2,cn201811552395.0等专利公开了一种以磷脂和胆固醇为膜材,以蔗糖八硫酸酯三乙胺为梯度的脂质体主动载药方法。
6.cn201811305299.6公开了一种以磷脂和胆固醇为膜材,以甲基磺酸铵、4-羟基苯磺酸铵、甲基磺酸三乙胺、4-羟基苯磺酸三乙胺;乙二磺酸铵、丙二磺酸铵、乙二磺酸三乙胺、丙二磺酸三乙胺等为梯度的脂质体主动载药方法。
7.上述现有技术中,人参皂苷脂质体可采用薄膜蒸发法制备难溶性药物的共载脂质体,但水溶性药物一般采用主动载药法制备,其中,双分子膜由磷脂和胆固醇构成,以硫酸铵、蔗糖八硫酸酯三乙胺等离子型盐溶液作为内水相,以ph梯度等原理载入水溶性药物,将药物包载在脂质体内腔。
8.因此,如何选择一个最佳的药物配伍,如何制定最佳的制备工艺,以便生产出一种药效更好、毒性更低,质量和其他指标都能符合药品要求的人参皂苷阿霉素脂质体,以便符合药品申报要求,需要大量的研究工作和技术攻关。
技术实现要素:
9.本发明所要解决的技术问题是针对现有阿霉素脂质体的种类少的缺陷,为此,提供一种人参皂苷阿霉素脂质体、其制备方法和应用。本发明的脂质体的具有稳定性好(例如放置长时间后粒径和药物包封率变化较小)、靶向性好、对肿瘤细胞的抑制性显著和药物毒性小的优点;且本发明的脂质体制备工艺稳定性好和制备条件易于实现,有利于产业化。
10.本发明是通过以下技术方案解决上述技术问题。
11.本发明提供了一种脂质体(简称“ginposome-dox”),其包括如下以重量份数计的组分:5-20份磷脂、0.09-2份聚乙二醇-二硬脂酰基磷脂酰乙醇胺(peg-dspe)、0.1-4份人参
皂苷和1份阿霉素盐;
12.其中,所述的脂质体不含有胆固醇;
13.所述的磷脂为氢化磷脂(dspc)、蛋黄卵磷脂、大豆磷脂和脑磷脂中的一种或多种;
14.所述的人参皂苷为20(s)-人参皂苷rg3、20(s)-人参皂苷rh2、人参皂苷rg5、人参皂苷rk1、人参皂苷rp1、人参皂苷伪rg3、人参皂苷伪gq和20(s)-原人参二醇中的一种或多种。
15.在本发明的某一方案中,所述的脂质体的粒径d90≤150nm,优选d90≤115nm,例如102nm、104nm、108nm或111nm。
16.在本发明的某一方案中,所述的脂质体的包封率≥80%,优选≥90%。
17.较佳地,所述的脂质体中,所述的人参皂苷的包封率为96.05%、95.47%、98.05%、97.30%、95.49%或98.05%。所述的阿霉素盐中阿霉素的包封率为94.56%、93.75%、95.74%、95.64%、94.24%或95.74%。
18.更佳地,所述的脂质体中,所述的人参皂苷和所述的阿霉素盐中阿霉素的包封率为如下任意组:
19.96.05%-94.56%、95.47%-93.75%、98.05%-95.74%、97.30%-95.64%、95.49%-94.24%或98.05%-95.74%。(人参皂苷的包封率对应上述组中的第1个百分比数据,阿霉素的包封率对应上述组中的第2个百分比数据,例如96.05%-94.56%,人参皂苷的包封率为96.05%,阿霉素的包封率为94.56%)。
20.上述的包封率的测定方法优选为离心-高效液相色谱法。
21.在本发明的某一方案中,所述的脂质体的膜相包含所述的人参皂苷。
22.在本发明的某一方案中,所述的磷脂为氢化磷脂或蛋黄卵磷脂。
23.在本发明的某一方案中,所述的磷脂的份数为5-15份,更优选为9-15份,例如10份或12份。
24.在本发明的某一方案中,所述的聚乙二醇-二硬脂酰基磷脂酰乙醇胺的份数为0.22-1.0份,例如0.25份、0.45份、0.5份或0.9份。
25.在本发明的某一方案中,所述的人参皂苷为20(s)-人参皂苷rg3、20(s)-人参皂苷rh2、人参皂苷rg5、人参皂苷rk1和人参皂苷rp1中的一种或多种,优选20(s)-人参皂苷rg3或20(s)-人参皂苷rh2。
26.在本发明的某一方案中,所述的人参皂苷的份数为0.1-2份,优选为0.9-2份,例如1.0份、1.4份、1.5份或1.8份。
27.在本发明的某一方案中,所述人参皂苷的hplc纯度≥99%。
28.在本发明的某一方案中,所述的脂质体通过主动载药法制得。所述的阿霉素盐可为阿霉素或阿霉素盐(可以为盐酸盐形式)通过ph梯度法与盐溶液进行离子交换得到的阿霉素盐(其中阿霉素盐中的阿霉素与所述的盐溶液中的阴离子形成所述的阿霉素盐)。所述的盐溶液优选为硫酸盐水溶液、磺酸盐水溶液或硫酸酯盐水溶液。较佳地,所述的盐溶液为硫酸铵水溶液、蔗糖八硫酸酯三乙胺水溶液、甲基磺酸铵水溶液、甲基磺酸三乙胺水溶液、乙二磺酸铵水溶液、丙二磺酸铵水溶液、乙二磺酸三乙胺水溶液或丙二磺酸三乙胺水溶液;更佳地为硫酸铵水溶液。
29.相应地,所述的阿霉素盐较佳地为硫酸阿霉素盐、磺酸阿霉素盐或硫酸酯类阿霉
素盐。
30.所述的硫酸阿霉素盐较佳地为硫酸阿霉素。
31.所述的磺酸阿霉素盐较佳地为甲基磺酸阿霉素、丙二磺酸阿霉素或乙二磺酸阿霉素。
32.所述的硫酸酯类阿霉素盐较佳地为蔗糖八硫酸酯阿霉素。
33.在本发明的某一方案中,所述的脂质体,还包括所述的脂质体的膜内的内水相和脂质体的膜外的外水相。其中,所述的阿霉素盐被包封于所述的内水相中,所述的阿霉素在内水相中以酸根阿霉素不溶盐的形式存在,所述的人参皂苷作为膜材位于磷脂膜上。
34.较佳地,所述的内水相为硫酸盐水溶液、磺酸盐水溶液或蔗糖八硫酸酯盐水溶液。
35.当所述的内水相为硫酸盐水溶液时,所述的硫酸盐水溶液的浓度较佳地为0.16-0.325m,例如0.325m。
36.当所述的内水相为硫酸盐水溶液时,所述的硫酸盐水溶液较佳地为硫酸铵水溶液。
37.当所述的内水相为磺酸盐水溶液时,所述的磺酸盐水溶液的浓度较佳地为0.16-0.975m,例如0.325-0.975m、0.16-0.65m。
38.当所述的内水相为磺酸盐水溶液时,所述的磺酸盐水溶液较佳地为甲基磺酸铵水溶液或乙二磺酸三乙胺水溶液。
39.当所述的内水相为蔗糖八硫酸酯盐水溶液时,所述的蔗糖八硫酸酯盐水溶液的浓度较佳地为0.05m-0.3m,例如0.1m或0.2m。
40.当所述的内水相为蔗糖八硫酸酯盐水溶液时,所述的蔗糖八硫酸酯盐水溶液的较佳地为蔗糖八硫酸酯三乙胺水溶液。
41.较佳地,所述的外水相为生理等渗溶液。所述的生理等渗溶液较佳地为葡萄糖水溶液(例如5%葡萄糖水溶液)或蔗糖水溶液(例如10%蔗糖水溶液)。
42.在本发明的某一方案中,所述的脂质体包括如下以重量份数计的组分:9-10份所述的磷脂、0.09-1.8份聚乙二醇-二硬脂酰基磷脂酰乙醇胺、0.9-2份所述的人参皂苷和1份所述的阿霉素盐。
43.在本发明的某一方案中,所述的脂质体包括如下以重量份数计的组分:9-10份氢化磷脂、0.09-1.8份聚乙二醇-二硬脂酰基磷脂酰乙醇胺、0.9-2份人参皂苷和1份硫酸阿霉素;
44.所述的人参皂苷为20(s)-人参皂苷rg3或20(s)-人参皂苷rh2。
45.在本发明的某一方案中,所述的脂质体为如下以重量份数计的组分:所述的磷脂(所述的磷脂包括上述的磷脂的种类和重量份数)、所述的聚乙二醇-二硬脂酰基磷脂酰乙醇胺、所述的人参皂苷(所述的人参皂苷包括上述的人参皂苷的种类和重量份数)和1份所述的阿霉素盐。
46.在本发明的某一方案中,所述的脂质体为如下以重量份数计的组分:所述的磷脂(所述的磷脂包括上述的磷脂的种类和重量份数)、所述的聚乙二醇-二硬脂酰基磷脂酰乙醇胺的重量份数、所述的人参皂苷(所述的人参皂苷包括上述的人参皂苷的种类和重量份数)、1份所述的阿霉素盐、所述的内水相和所述的外水相。
47.本发明还提供了一种脂质体,其由如下原料制得,所述的原料包括如下以重量份
数计的组分:5-20份磷脂、0.1-2份聚乙二醇-二硬脂酰基磷脂酰乙醇胺(peg-dspe)、0.1-4份人参皂苷和1份阿霉素或阿霉素盐;
48.其中,所述的脂质体不含有胆固醇;
49.所述的磷脂为氢化磷脂(dspc)、蛋黄卵磷脂、大豆磷脂和脑磷脂中的一种或多种;
50.所述的人参皂苷为20(s)-人参皂苷rg3、20(s)-人参皂苷rh2、人参皂苷rg5、人参皂苷rk1、人参皂苷rp1、人参皂苷伪rg3、人参皂苷伪gq和20(s)-原人参二醇中的一种或多种。
51.在本发明的某一方案中,所述的脂质体的粒径d90≤150nm,优选d90≤115nm,例如102nm、104nm、108nm或111nm。
52.在本发明的某一方案中,所述的脂质体的包封率≥80%,优选≥90%。
53.较佳地,所述的脂质体中,所述的人参皂苷的包封率为96.05%、95.47%、98.05%、97.30%、95.49%或98.05%。所述的阿霉素或所述的阿霉素盐中阿霉素的包封率为94.56%、93.75%、95.74%、95.64%、94.24%或95.74%。
54.更佳地,所述的脂质体中,所述的人参皂苷和所述的阿霉素或所述阿霉素盐中阿霉素的包封率为如下任意组:
55.96.05%-94.56%、95.47%-93.75%、98.05%-95.74%、97.30%-95.64%、95.49%-94.24%或98.05%-95.74%。(人参皂苷的包封率对应上述组中的第1个百分比数据,阿霉素的包封率对应上述组中的第2个百分比数据,例如96.05%-94.56%,人参皂苷的包封率为96.05%,阿霉素的包封率为94.56%)。
56.上述的包封率的测定方法优选为离心-高效液相色谱法。
57.在本发明的某一方案中,所述的磷脂的种类和所述的人参皂苷的种类均如前述所述。
58.在本发明的某一方案中,所述的磷脂的份数为5-15份,更优选为10-15份,例如12份。
59.在本发明的某一方案中,所述的聚乙二醇-二硬脂酰基磷脂酰乙醇胺的份数为0.25-1.0份,例如0.5份。
60.在本发明的某一方案中,所述的人参皂苷的份数为0.1-2份,优选1-2份,例如0.5份、1.0份、1.5份或2份。
61.在本发明的某一方案中,所述的阿霉素盐为硫酸阿霉素盐、磺酸阿霉素盐、硫酸酯类阿霉素盐或盐酸阿霉素。
62.在本发明的某一方案中,所述的脂质体的原料还包括盐溶液和/或生理等渗溶液。所述的盐溶液优选为硫酸盐水溶液、磺酸盐水溶液或蔗糖八硫酸酯盐水溶液。
63.当所述的盐溶液为硫酸盐水溶液时,所述的硫酸盐水溶液的浓度较佳地为0.16-0.325m,例如0.325m。
64.当所述的盐溶液为硫酸盐水溶液时,所述的硫酸盐水溶液较佳地为硫酸铵水溶液。
65.当所述的盐溶液为磺酸盐水溶液时,所述的磺酸盐水溶液的浓度较佳地为0.16-0.975m,例如0.325-0.975m、0.16-0.65m。
66.当所述的盐溶液为磺酸盐水溶液时,所述的磺酸盐水溶液较佳地为甲基磺酸铵水
溶液或乙二磺酸三乙胺水溶液。
67.当所述的盐溶液为蔗糖八硫酸酯盐水溶液时,所述的蔗糖八硫酸酯盐水溶液的浓度较佳地为0.05m-0.3m,例如0.1m或0.2m。
68.当所述的盐溶液为蔗糖八硫酸酯盐水溶液时,所述的蔗糖八硫酸酯盐水溶液的较佳地为蔗糖八硫酸酯三乙胺水溶液。
69.所述的生理等渗溶液较佳地为葡萄糖水溶液(例如5%葡萄糖水溶液)或蔗糖水溶液(例如10%蔗糖水溶液)。
70.在本发明的某一方案中,所述的脂质体通过主动载药法制得。较佳地,将所述的阿霉素盐载入至所述的磷脂形成的空白脂质体后,再载入所述的人参皂苷。
71.在本发明的某一方案中,所述的原料包括如下以重量份数计的组分:10份所述的磷脂、0.1-2份聚乙二醇-二硬脂酰基磷脂酰乙醇胺、1-2份所述的人参皂苷和1份阿霉素或所述的阿霉素盐。
72.在本发明的某一方案中,所述的原料包括如下以重量份数计的组分:10份氢化磷脂、0.1-2份聚乙二醇-二硬脂酰基磷脂酰乙醇胺、1-2份所述的人参皂苷和1份盐酸阿霉素;
73.所述的人参皂苷为20(s)-人参皂苷rg3或20(s)-人参皂苷rh2。
74.在本发明的某一方案中,所述的原料为如下组分:所述的磷脂(所述的磷脂包括上述的磷脂的种类和重量份数)、所述的聚乙二醇-二硬脂酰基磷脂酰乙醇胺(即上述的聚乙二醇-二硬脂酰基磷脂酰乙醇胺的重量份数)、所述的人参皂苷(所述的人参皂苷包括上述的人参皂苷的种类和重量份数)和1份阿霉素或所述的阿霉素盐。
75.在本发明的某一方案中,所述的原料为如下组分:所述的磷脂(所述的磷脂包括上述的磷脂的种类和重量份数)、所述的聚乙二醇-二硬脂酰基磷脂酰乙醇胺(即上述的聚乙二醇-二硬脂酰基磷脂酰乙醇胺的重量份数)、所述的人参皂苷(所述的人参皂苷包括上述的人参皂苷的种类和重量份数)、1份阿霉素或所述的阿霉素盐、所述的盐溶液和所述的生理等渗溶液。
76.本发明还提供了一种脂质体的制备方法,其包括如下步骤;
77.步骤1、将磷脂溶解于溶剂中得到的混合物1;将混合物1与盐溶液进行水化,得到混合物2;将所述的混合物2除去所述的溶剂,得到的溶液a1;
78.步骤2、其为方案1、方案2或方案3;
79.方案1(高压均质法):其包括如下步骤:
80.将步骤1得到的溶液a1进行高压均质,控制粒径d90在100nm以下,得到溶液a2a;
81.方案2(挤出法):其包括如下步骤:
82.将步骤1得到的溶液a1,分别依次通过各孔径挤出板挤出,控制粒径d90在100nm以下,得到溶液a2b;
83.方案3(超声法):其包括如下步骤:
84.将步骤1得到的溶液a1进行超声处理,得到一澄清溶液a2c;
85.步骤3、以生理等渗溶液为介质,将所述的步骤2中得到的溶液a2a、a2b或a2c在透析袋中进行透析,得到溶液a3;
86.步骤4、将步骤3得到的溶液a3与阿霉素或阿霉素盐水溶液混合,得到阿霉素脂质体;
87.步骤5、将步骤4得到的阿霉素脂质体与人参皂苷在溶剂中混合,得到人参皂苷阿霉素脂质体;
88.步骤6、将步骤4得到的人参皂苷阿霉素脂质体和聚乙二醇-二硬脂酰基磷脂酰乙醇胺分散在葡萄糖溶液中,得到所述的脂质体;
89.其中,所述的磷脂、所述的聚乙二醇-二硬脂酰基磷脂酰乙醇胺、所述的人参皂苷、所述的阿霉素或所述的阿霉素盐、步骤1中所述的盐溶液和步骤3中所述的生理等渗溶液均如本发明中任一处所述(所述的磷脂和所述的人参皂苷均包括磷脂和人参皂苷的种类和重量份数;所述的聚乙二醇-二硬脂酰基磷脂酰乙醇胺即上述的所述的聚乙二醇-二硬脂酰基磷脂酰乙醇胺的重量份数;所述的阿霉素盐即阿霉素盐的种类;步骤1中所述的盐溶液和步骤3中所述的生理等渗溶液均包括盐溶液和生理等渗溶液的种类和浓度)。
90.在本发明的某一方案中,步骤1中,所述的溶剂为醇类溶剂,例如无水乙醇。
91.在本发明的某一方案中,步骤1中,所述的磷脂与所述的溶剂的质量体积比为1g/1~10ml,例如1g/2ml。
92.在本发明的某一方案中,步骤1中,所述的水化的温度为55-65℃,例如55-60℃。
93.在本发明的某一方案中,步骤1中,所述的水化的终点为以形成均一的溶液为判断标准。所述的水化的时间优选为2-4小时,优选5-15分钟,例如10分钟。
94.在本发明的某一方案中,步骤1中,所述的水化在旋蒸瓶中进行,转速为40-60rp/min,例如50rp/min。
95.在本发明的某一方案中,步骤2的方案1中,所述的高压均质的温度-5-10℃;较佳地,确保脂质体溶液的温度在5-10℃。
96.在本发明的某一方案中,方案1中,所述的高压均质的压力在800-1400bar之间,例如1200bar。
97.在本发明的某一方案中,方案1中,所述的高压均质的次数为3-4次,例如4次。
98.在本发明的某一方案中,方案2中,所述的挤出的温度为35-45℃,例如40℃。
99.在本发明的某一方案中,方案2中,所述的孔径依次为800nm,400nm、200nm和100nm。
100.在本发明的某一方案中,方案2中,所述的挤出的压力为600-800psi;例如800psi。
101.在本发明的某一方案中,方案2中,所述的挤出的次数为4-10次,例如4次。
102.在本发明的某一方案中,方案3中,所述的超声的次数为20-30次,例如25次。
103.在本发明的某一方案中,步骤3中,所述的透析袋的截留分子量为8000-15000,例如,截留分子量为10000。
104.在本发明的某一方案中,步骤3中,所述的溶液a2a、a2b或a2c与所述的等渗溶液的体积比为1:1000。
105.在本发明的某一方案中,步骤3中,所述的透析的温度为0-10℃,例如4℃。
106.在本发明的某一方案中,步骤3中,所述的透析的时间为10-18小时,例如12小时。
107.在本发明的某一方案中,步骤4中,所述的阿霉素或所述的阿霉素盐浓度为5-20mg/ml,优选10-15,例如10mg/ml,其中所述的浓度为阿霉素在阿霉素的水溶液中的浓度。
108.在本发明的某一方案中,步骤4中,将所述的阿霉素的水溶液加入到所述的步骤3得到的溶液a3中进行混合。
109.所述的脂质体的制备方法还可进一步包括除菌过滤和灌装步骤。所述的除菌过滤和所述的灌装的条件和操作均可为本领域该类工艺中常规的条件和操作。例如,除菌过滤步骤中,采用0.22μm滤膜过滤所述的脂质体。灌装步骤中,灌装于10ml或20ml西林瓶中、压盖和包装。
110.本发明还提供了一种脂质体,其按照上述的脂质体的制备方法制备得到。
111.在本发明的某一方案中,所述的脂质体的粒径d90≤150nm,优选d90≤100nm。
112.在本发明的某一方案中,所述的脂质体的包封率≥80%,优选包封率≥95%。
113.本发明还提供了一种药物组合物,其包括上述的脂质体和辅料,所述的辅料为上述的脂质体的膜外的外水相或生理盐水。
114.本发明还提供了一种物质a在在制备用于治疗或预防癌症药物中的应用;所述的物质a为上述的脂质体或上述的药物组合物。
115.所述的癌症优选为乳腺癌、结直肠癌、乳腺癌、原发性肝癌、胃癌、膀胱癌和脑瘤中的一种或多种。
116.术语“粒径d90”是指一个样品的累计粒度分布百分数达到90%时所对应的粒径。它的物理意义是粒径小于它的颗粒占90%。
117.在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
118.本发明所用试剂和原料均市售可得。
119.本发明的积极进步效果在于:本发明的脂质体具有稳定性好、对肿瘤对细胞的靶向性、对肿瘤对细胞的抑制性和药物毒性小的优点。以实施例中人参皂苷rg3阿霉素脂质体为例,药效显著优于胆固醇阿霉素脂质体;说明了rg3在人参皂苷rg3阿霉素脂质体中起到了更好的“药物、辅料、膜材、靶头”等多种作用,起到了良好的药物协同作用。具体地:
120.(1)药效显著提高。尤其是rg3(1.0)-dox-peg/lp组、rg3(1.5)-dox-peg/lp组、rg3(2.0)-dox-peg/lp和rh2(1.0)-cpt-peg/lp组药效最优,其中,rg3(1.0)-dox-peg/lp、rg3(1.5)-dox-peg/lp和rg3(2.0)-dox-peg/lp的高剂量组(6mg/kg)在第21天,肿瘤已完全消失,比市售对照组(caelyx组)具有显著性优效。同时,该三组实验组的中剂量组(3mg/kg)第28天的抑瘤率为3-7%,比市售对照组(caelyx组)的高剂量组(6mg/kg)第28天抑瘤率(11%)更优,显示出本发明rg3阿霉素脂质体对传统阿霉素脂质体在药效学上显著优势。
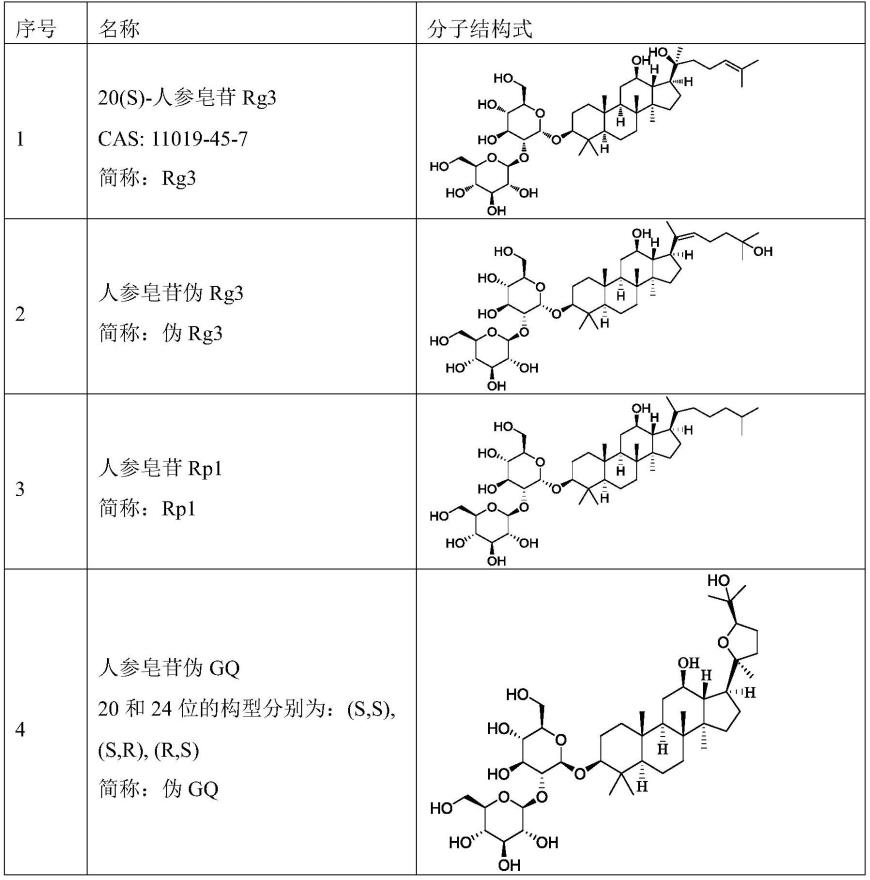
121.(2)glut1靶向性显著提高。在荷瘤鼠的glut1靶向性实验中,所述的人参皂苷脂质体的glut1靶向性都是比普通胆固醇脂质体的靶向性提高了4倍以上。
122.(3)毒副作用显著降低。按本发明的处方制备的脂质体,rg3阿霉素脂质体(rg3(1.0)-dox-peg/lp组和rg3(2.0)-dox-peg/lp组)和rh2阿霉素脂质体(rh2(1.0)-dox-peg/lp组和rh2(2.0)-dox-peg/lp组)在20mg/kg未见死亡,40mg/kg分别死亡1/6或2/6,60mg/kg时死亡5/6或6/6;而市售对照组(caelyx组)在20mg/kg死亡4/6,40mg/kg全部死亡。说明caelyx组的ld50在约低于20mg/kg,rg3阿霉素脂质体和rh2阿霉素脂质体的ld50在40-60mg/kg之间,人参皂苷阿霉素脂质体的急性毒性比caelyx组显著性降低。
具体实施方式
123.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实
施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
124.实验药物和器材
125.实验药物:20(s)-人参皂苷rg3(简称:rg3)、人参皂苷伪rg3(简称:伪rg3)、人参皂苷rp1(简称:rp1)、人参皂苷伪gq(简称:伪gq)、人参皂苷rk1(简称:rk1)、人参皂苷rg5(简称:rg5)、20(s)-人参皂苷rh2(简称:rh2)、人参皂苷rk2(简称:rk2)、20(s)-人参皂苷rg2(简称:rg2)、20(s)-人参皂苷rh1(简称:rh1)、20(s)-原人参二醇(简称:ppd)、20(s)-原人参三醇(简称ppt)、盐酸阿霉素等为本领域常规市售可得,例如上海本素医药科技有限公司、上海金和生物制药有限公司、上海源叶生物科技有限公司等。
126.本发明所述的人参皂苷分子结构式如表1:
127.表1
128.[0129][0130]
试验仪器:下述实施例中所使用的仪器为上海本素医药科技有限公司、复旦大学药学院自有仪器设备,其设备型号和来源信息如下:
[0131]
安捷伦液相色谱:安捷伦1100一套,奥泰3300elsd,安捷伦科技(中国)有限公司;
[0132]
旋蒸蒸发仪:zx98-1 5l,上海鲁伊工贸有限公司;
[0133]
超声波清洗机(sb3200dt,宁波新芝生物科技股份有限公司);
[0134]
氮吹仪(hgc-12a,天津市恒奥科技发展有限公司);
[0135]
探头超声仪(jyd-650,上海智信仪器有限公司,中国);
[0136]
高压均质机(b15,加拿大avestin);
[0137]
微型挤出器(mini-extruder,avanti polar lipids inc);
[0138]
激光粒度分析仪(nano zs,英国马尔文公司);
[0139]
马尔文粒度仪malvern nanosizer zs90(英国马尔文公司);
[0140]
酶标仪(thermo scientific,waltham,ma,usa);
[0141]
酶标仪(infinitie 200,瑞士tecan trading co.,ltd);
[0142]
流式细胞仪(bd biosciences,usa);
[0143]
流式细胞仪(cytoflex s,beckman coulter,inc.,usa);
[0144]
倒置荧光显微镜(leica,dmi 4000d,germany);
[0145]
荧光显微镜观察(zeiss lsm 710,oberkochen,germany);
[0146]
激光共聚焦显微镜(leica,dmi 4000d,germany);
[0147]
共聚焦活体显微镜(confocal intravital microscopy,ivm);
[0148]
正置双光子显微镜(dm5500 q;nikon);
[0149]
小动物活体光学成像系统(in vivo imaging system,ivis)(perkinelmer,usa);
[0150]
生物大分子相互作用仪biacore t 200仪器(ge,usa);
[0151]
洁净工作台(sw-cj-1fd,苏州安泰空气技术有限公司);
[0152]
20l旋转蒸发仪:r5002k,上海夏丰实业有限公司;
[0153]
冷冻干燥机:fd-1d-80,上海比朗仪器制造有限公司;
[0154]
冷冻干燥机:pdfd glz-1b,上海浦东冷冻干燥设备有限公司;
[0155]
电子天平:cpa2250(精度0.00001g),赛多利斯(上海)贸易有限公司;
[0156]
电子天平:jy3003(精度0.001g),上海舜宇恒平科学仪器有限公司;
[0157]
光电显微镜(xds-1b,重庆光电仪器有限公司);
[0158]
细胞培养箱(ccl-170b-8,新加坡esco)。
[0159]
动物和细胞株
[0160]
动物:balb/c裸小鼠,鼠龄3-4周,中科院上海药物研究所生产。
[0161]
肿瘤细胞株:
[0162]
乳腺癌原位瘤4t1细胞株,复旦大学药学院提供
[0163]
人结肠癌c-26细胞株,购自江苏凯基生物技术股份有限公司
[0164]
人胰腺癌capan-1细胞株,购自江苏凯基生物技术股份有限公司
[0165]
乳腺癌mcf-7细胞株,购自江苏凯基生物技术股份有限公司
[0166]
1)色谱条件:c18色谱柱(kromasil c18,250
×
4.6mm,5μm)
[0167]
2)流动相:十二烷基硫酸钠溶液:乙腈:甲醇=500:500:60(体积比)
[0168]
十二烷基磺酸钠溶液:十二烷基硫酸钠1.44g和磷酸0.68ml,加水500ml使溶解。
[0169]
3)检测波长:254nm,流速1.0ml/min,柱温30℃,进样量10μl。
[0170]
4)计算:记录色谱图,以外标法计算供试品溶液中盐酸阿霉素的含量。
[0171]
人参皂苷含量检测方法:
[0172]
1)色谱条件:kromasil 100-3.5c4 150mm
×
4.6mm色谱柱。
[0173]
2)流动相:乙腈:水=55:45。
[0174]
3)检测波长:203nm,流速1ml/min,柱温35℃,进样量10μl。
[0175]
4)计算:记录色谱图,以外标法计算供试品溶液中rg3的含量。
[0176]
阿霉素(或人参皂苷)包封率检测方法:
[0177]
取2份待检测脂质体样品各1ml,离心(18000r/min,30min,3次,每次间隔30分钟),分别取上清液和脂质体沉淀,沉淀脂质体用蒸馏水洗涤3次,每次1ml蒸馏水,合并上清液,于25ml容量瓶中,去离子水定容,hplc检测得到药物浓度(阿霉素脂质体中的游离的阿霉素或人参皂苷的浓度)为v1;另一份于25ml容量瓶中,去离子水定容,hplc法检测药物浓度为v0。包封率=(v0-v1)/v0
×
100%。
[0178]
简称:盐酸阿霉素(dox),氢化磷脂(hspc),胆固醇(cho),20(s)-人参皂苷rg3(rg3),20(s)-人参皂苷rh2(rh2)。
[0179]
实施例1:人参皂苷空白脂质体在各种离子型水溶液中的稳定性研究
[0180]
称取处方量的hspc、人参皂苷,超声溶解于1ml氯仿中,减压浓缩至干,加入10ml水化溶液,水化10分钟,然后超声25次(600w,开5秒,停5秒),得到各实验组的空白脂质体,检测外观和包封率。
[0181]
3)实验结果见表2:
[0182]
表2
[0183][0184]
结果分析:人参皂苷脂质体在纯化水、糖类等中性溶液中稳定,但在离子型水溶液中不稳定,即:传统被动载药法制备的空白人参皂苷脂质体不适用于传统主动载药法制备离子型药物脂质体,例如,盐酸阿霉素、盐酸阿霉素等。
[0185]
实施例2传统主动载药法中磷脂用量对阿霉素包封率的影响实验
[0186]
表3
[0187][0188][0189]
结果分析:采用传统主动载药法中的乙醇注入法,药脂比(hspc/药物)对包封率具有较大影响,当药脂比≥10时,包封率没有显著差异。因此,本发明优选药脂比5-15的磷脂比例。
[0190]
实施例3传统主动载药法中胆固醇用量对阿霉素包封率的影响实验
[0191]
表4
[0192][0193]
结果分析:采用传统主动载药法中的乙醇注入法,胆固醇可提高脂质体稳定性并提高阿霉素的包封率。当胆固醇/药物≥0.5时,改善显著;当胆固醇/药物≥1时,胆固醇的数量对包封率无显著差异。
[0194]
实施例4传统主动载药法中rg3用量对阿霉素包封率的影响实验
[0195]
表5
[0196][0197]
结果分析:采用传统主动载药法中的乙醇注入法,hspc和rg3同步成膜,然后离子型水溶液水化、5%葡萄糖水透析和载药,无法制备合格的rg3阿霉素共载脂质体。
[0198]
实施例5传统主动载药法中胆固醇用量对rg3脂质体包封率的影响实验
[0199]
表6
[0200][0201]
结果分析:采用传统主动载药法中的乙醇注入法,hspc、rg3和胆固醇先同步成膜,然后离子型水溶液水化、5%葡萄糖透析,得到rg3脂质体,该工艺制备的脂质体的rg3包封率低,离子型水溶液造成了rg3泄漏。
[0202]
实施例6传统主动载药法中胆固醇用量对rg3脂质体包封率的影响实验
[0203]
表7
[0204][0205]
结果分析:采用传统主动载药法中的乙醇注入法,在透析之后外水相为5%葡萄糖时,rg3作为药物载入脂质体,rg3的包封率合格,其中胆固醇的用量对rg3包封率的影响不大。通过效果实施例1:glut1的细胞摄取实验中的c6-c-rg3(后)/lp组的靶向性实验结果显示:该组的glut1介导的靶向性差,显示rg3的葡萄糖基未暴露在脂质体表面,因此rg3应被包裹于脂质体的内腔中。
[0206]
实施例7传统主动载药法中rg3和阿霉素同步载入实验
[0207]
表8
[0208]
[0209][0210]
结果分析:采用传统主动载药法中的乙醇注入法,在不同比例的rg3和胆固醇用量下,所述的空白脂质体的内水相为硫酸铵溶液,外水相为5%葡萄糖溶液,rg3和阿霉素为药物,同步载入,阿霉素和rg3的包封率都不合格。离子型水溶液同时影响了rg3和盐酸阿霉素的包封率。
[0211]
实施例8传统主动载药法中先载rg3再载阿霉素对包封率的影响实验
[0212]
表9
[0213]
[0214][0215]
结果分析:采用传统主动载药法中的乙醇注入法,采用了不同比例的rg3和胆固醇比例,在透析之后,所述的空白脂质体的内水相为硫酸铵溶液,外水相为5%葡萄糖溶液,先载入rg3,再载入盐酸阿霉素,所制备的rg3阿霉素共载脂质体的包封率都不合格。
[0216]
实施例9不同制备方法对rg3阿霉素共载脂质体包封率的影响实验
[0217]
表10
[0218]
[0219][0220]
结果分析:
[0221]
1)被动载药(薄膜法)无法制备合格的rg3阿霉素共载脂质体;
[0222]
2)普通主动载药法无法制备合格的rg3阿霉素共载脂质体;
[0223]
3)普通主动载药法,先载rg3再载阿霉素,或rg3与阿霉素同步载入,无法制备合格的rg3阿霉素共载脂质体;
[0224]
4)普通主动载药法,先载阿霉素再rg3,可制备得到合格的rg3阿霉素共载脂质体。利用该方法制备的脂质体,经本发明应用实施1:glut1的细胞摄取实验,c6-rg3(后)-dox/lp组实验结果表明:利用该方法制备的rg3脂质体具有显著的glut1介导的主动靶向作用,证明rg3是嵌入在磷脂双分子膜中,其中rg3分子中的葡萄糖基(glc)裸露在脂质体外表面。
[0225]
实施例10rg3用量对rg3阿霉素共载脂质体包封率的影响实验
[0226]
表11
[0227]
[0228][0229]
结果分析:
[0230]
1)采用上述的乙醇注入法,可制备合格的rg3阿霉素共载脂质体,具体地,该脂质体的内水相为硫酸阿霉素盐,该脂质体的外水相为5%葡萄糖等渗溶液,该脂质体的双分子膜为氢化磷脂和rg3,其中rg3分子中的葡萄糖基(glc)裸露在脂质体外表面,该脂质体膜材中不含胆固醇。
[0231]
2)所述的rg3阿霉素脂质体,当hspc:rg3:dox=10:0.1~4:1时,rg3和阿霉素的包封率良好。随着rg3用量上升,rg3和阿霉素的包封率急剧下降。
[0232]
3)本发明rg3的使用范围为hspc:rg3:dox=10:0.1~4:1。
[0233]
实施例11不同盐对rg3阿霉素共载脂质体包封率的影响实验
[0234]
表12
[0235][0236]
结果分析:采用本发明的乙醇注入法,蔗糖八硫酸酯三乙胺、硫酸铵、甲基磺酸铵、甲基磺酸三乙胺、乙二磺酸铵、丙二磺酸铵、乙二磺酸三乙胺和丙二磺酸三乙胺均能满足rg3阿霉素脂质体的制备,包封率都合格。
[0237]
实施例12不同盐浓度对rg3阿霉素共载脂质体包封率的影响实验
[0238]
表13
[0239]
[0240][0241]
结果分析:采用本发明的乙醇注入法,1)蔗糖八硫酸酯三乙胺浓度低于0.05m时,将包封率不能满足的工艺要求;当浓度≥0.1m时,包封率无显著差别。2)硫酸铵和乙二磺酸三乙胺浓度低于0.16m时,包封率无法满足工艺要求;浓度在0.32m和0.65m时,包封率无显著差别。3)甲基磺酸铵浓度低于0.325m时,包封率无法满足工艺要求;浓度在0.65m和0.975m时,包封率无显著差别。
[0242]
实施例13不同人参皂苷对皂苷阿霉素共载脂质体包封率的影响实验
[0243]
表14
[0244][0245]
结果分析:采用本发明的乙醇注入法,20(s)-rg3、20(s)-rh2、rg5、rk1、rp1、伪rg3、伪gq和ppd等皂苷制备的共载脂质体,其包封率符合质量要求;而20(r)-rg3和ppt等皂苷制备的共载脂质体,其包封率不符合质量要求。
[0246]
实施例14不同均质方法对rg3阿霉素共载脂质体包封率的影响实验
[0247]
表15
[0248]
[0249][0250]
结果分析:采用本发明的乙醇注入法,在粒径控制的三个常用方法(超声法、高压均质法、推挤过膜法),均能符合工艺要求。
[0251]
实施例15不同磷脂对rg3阿霉素共载脂质体包封率的影响实验
[0252]
表16
[0253][0254]
结果分析:采用本发明的乙醇注入法,氢化磷脂、蛋黄卵磷脂、大豆磷脂和脑磷脂所制备的rg3阿霉素共载脂质体的包封率符合药品申报要求,peg-dspe不符合要求。
[0255]
实施例16不同阿霉素浓度对rg3阿霉素共载脂质体包封率的影响实验
[0256]
表17
[0257][0258][0259]
结果分析:采用本发明的乙醇注入法,在药物浓度为5~15mg/ml时,包封率最佳,特别是药物浓度为10mg/ml时最佳。当药物浓度低于5mg/ml或高于20mg/ml时,包封率不合
符药品质量要求。
[0260]
实施例17不同生理等渗溶液对rg3阿霉素共载脂质体包封率的影响实验
[0261]
表18
[0262][0263]
结果分析:采用本发明的乙醇注入法,5%葡萄糖和10%蔗糖水溶液对rg3和阿霉素包封率无显著差别,0.9%生理盐水不适用。
[0264]
现有技术中,尚未发现用主动载药法制备的“以人参皂苷取代胆固醇作为双分子膜的共载脂质体”,其客观原因如下:
[0265]
经过本发明实验证实(实施例1):以磷脂和胆固醇为膜材构成的脂质体,在离子型盐溶液中稳定;而以磷脂和人参皂苷(例如rg3)为膜材构成的脂质体,在离子型盐溶液中不稳定。因此,采用常规的主动载药法,无法制备以人参皂苷为膜材的载药脂质体。
[0266]
采用了改进的主动载药法,处方比例、药物加入顺序和数量,都会影响rg3在脂质体中所处的位置。例如:
[0267]
情形1(人参皂苷位于脂质体纳米粒的内腔):在胆固醇参与下,因胆固醇和磷脂的亲和性强于人参皂苷与磷脂的亲和性,在此制备条件下,人参皂苷将被包载于脂质体内腔,使得脂质体外表面失去了由人参皂苷的葡萄糖基构成的靶头(应用实施例1,c6-c-rg3-vcr/lp组实验证明);
[0268]
情形2(人参皂苷位于脂质体纳米粒的内腔):虽然采用主动载药法,在外水相为5%葡萄糖水溶液时,先加入人参皂苷并构成了以人参皂苷为膜材的脂质体,但随后加入的离子型药物(例如,盐酸伊立替康,硫酸长春新碱)水溶液,药物带入的离子(例如,盐酸、硫酸)不仅破坏了rg3和磷脂构成的双分子膜,并进一步影响了水溶性药物的载入,造成rg3和水溶性药物共载脂质体的失败(实施例9证明);
[0269]
情形3(本发明,人参皂苷位于脂质体膜上,不在内腔):在内水相为梯度盐溶液(例如,蔗糖八硫酸酯三乙胺),外水相为等渗溶液(例如,5%葡萄糖)时,先载入水溶性药物(例如,盐酸伊立替康,硫酸长春新碱),在内水相形成药物不溶物(例如,蔗糖八硫酸酯伊立替康等),然后再载入人参皂苷,即得本发明所述的rg3水溶性药物共载脂质体。虽然该方法中,外水相也含有由水溶性药物带入的离子,与上述情形2相同,但实验结果不同,机理尚不明确。
[0270]
实施例18rg3阿霉素脂质体的制备
[0271]
处方:hspc 10g,rg3 1g,盐酸阿霉素1g,无水乙醇适量,5%葡萄糖注射液适量,注射用水适量,0.325m硫酸铵溶液适量。
[0272]
操作方法:
[0273]
步骤(1):成膜和水化
[0274]
称取处方量的hspc,溶于20ml无水乙醇中,加入100ml 0.325m的硫酸铵,55~60℃
水化10分钟,挥发除去大部分乙醇,制备得到内外水相均是硫酸铵溶液,磷脂浓度在80-120mg/ml的空白脂质体粗品;
[0275]
步骤(2):推挤过膜
[0276]
将步骤(1)的空白脂质体溶液在压力600-800psi,依次通过孔径分别为800nm、400nm、200nm、100nm的聚碳酯膜过滤板各4次,最终得到粒径小于100nm内外水相均是硫酸铵溶液的空白脂质体。
[0277]
步骤(3):透析
[0278]
将步骤(2)的空白脂质体置于截留分子量为10000的透析袋中,以5%葡萄糖水溶液作为透析介质,4℃透析12小时,样品与透析介质体积比为1:1000,透析期间每4小时更换1次透析液,完全去除空白脂质体外水相中的硫酸铵,得到由5%葡萄糖组成的外水相由硫酸铵为内水相的空白脂质体。
[0279]
步骤(4):载入阿霉素
[0280]
将步骤(3)中的空白脂质体与浓度为10mg/ml的盐酸阿霉素水溶液,按照体积比为1:1混合,并于50-60℃水浴中孵育40分钟,即得阿霉素脂质体。具体地,该脂质体内水相为硫酸阿霉素不溶盐,该脂质体外水相为5%葡萄糖水溶液。
[0281]
步骤(5):嵌入rg3
[0282]
将100ml 10mg/ml的rg3乙醇溶液于20-30℃下,缓慢加入到步骤(4)的阿霉素脂质体溶液,搅拌45分钟,挥发除去大部分乙醇,然后再置于截留分子量为10000的透析袋中,以5%葡萄糖水溶液作为透析介质,4℃透析12小时,样品与透析介质体积比为1:1000,透析期间每4小时更换1次透析液,完全去除乙醇溶剂、无机盐、未包裹的盐酸阿霉素和rg3,即得rg3阿霉素脂质体。
[0283]
步骤(6):添加peg-dspe
[0284]
准确称取0.2g peg-dspe,溶于300ml5%葡萄糖中,然后加入到步骤(5)的rg3阿霉素脂质体溶液,得到阿霉素和rg3浓度都是约2mg/ml的rg3阿霉素脂质体溶液。
[0285]
步骤(7):除菌过滤
[0286]
将步骤(6)的rg3阿霉素脂质体过0.22μm滤膜。
[0287]
步骤(8):灌装
[0288]
将步骤(7)溶液灌装于10ml或20ml西林瓶中,压盖,包装,即得。
[0289]
经检测,上述脂质体,阿霉素浓度=4.95mg/ml,rg3浓度=4.96mg/ml,粒径d90=102nm,rg3包封率=98.05%,阿霉素包封率=95.74%。
[0290]
实施例19peg-dspe用量对rg3阿霉素共载脂质体稳定性的影响
[0291]
制备方法:取上述实施例18步骤(5)的rg3阿霉素脂质体溶液,然后按本实施例处方加入不同浓度的peg-dspe水溶液,其他后续步骤同实施例18,然后将各处方制剂置于2-8℃冰箱,考察脂质体溶液的稳定性。
[0292]
表19
[0293][0294]
结果分析:
[0295]
1)未添加peg-dspe,rg3阿霉素脂质体在2-8℃保存3个月后,粒径快速上升,rg3和阿霉素的泄漏率明显上升;
[0296]
2)当peg-dspe/hspc≤0.025时,在2-8℃保存3个月后,rg3阿霉素脂质体的粒径显著上升,包封率显著下降,不合格稳定性质量要求。其中,peg-dspe/hspc=0.025,3个月的稳定性数据可接受。
[0297]
3)当peg-dspe/hspc≥0.025时,在2-8℃保存3个月后,rg3阿霉素脂质体的粒径稳定、rg3和阿霉素的包封率较稳定,符合药品申报要求。
[0298]
4)当peg-dspe/hspc≥0.05时,粒径和包封率没有显著差别。
[0299]
本发明peg-dspe的保护范围为0.1~2。
[0300]
实施例20不同处方脂质体的稳定性研究
[0301]
实验方法:将脂质体至于2-8℃避光保存(同实施例19),根据相关方法检测包封率。
[0302]
对比脂质体1:按cn201610693884.2实施例16处方制备得人参皂苷rg5阿霉素脂质
体,处方为大豆卵磷脂:人参皂苷rg5:盐酸阿霉素:大豆油:vc=0.8g:0.6g:0.2g:0.4g:0.5g,将制得的人参皂苷rg5阿霉素脂质体按照本发明实施例18步骤(6)和(7)制备含有peg-dspe脂质体1。
[0303]
对比脂质体2:请cn201811447243.4实施例18处方制备人参皂苷rg3阿霉素脂质体,处方为大豆卵磷脂s100:人参皂苷rg3:盐酸阿霉素:ve=0.9g:0.3g:0.2g:0.1g,将制得的人参皂苷rg5阿霉素脂质体按照本发明实施例18步骤(6)和(7)制备含有peg-dspe脂质体2。
[0304]
对比脂质体3:根据本发明实施例18得方法,按处方大豆卵磷脂:人参皂苷rg5:盐酸阿霉素:大豆油:vc=0.8g:0.6g:0.2g:0.4g:0.5g,其中大豆油与磷脂同时加入,vc与rg3同时加入,制备脂质体3。
[0305]
对比脂质体4:根据本发明实施例18得方法,按处方大豆卵磷脂s100:人参皂苷rg3:盐酸阿霉素:ve=0.9g:0.3g:0.2g:0.1g,其中ve与rg3同时加入,制备脂质体4。
[0306]
表20
[0307][0308]
上述实验表明,对比脂质体1和2中的rg3在脂质体中不稳定,仅在6个月后,rg3的包封率即降低至80%以下(不符合药品质量标准)。
[0309]
应用实施例1:glut1的细胞摄取实验
[0310]
1)实验目的:通过对比载荧光素的rg3脂质体和胆固醇脂质体在4t1细胞上的摄取来观察rg3脂质体是否在肿瘤细胞上有更多的摄取;通过添加葡萄糖抑制剂等证明glut1靶向机制;通过glut1靶向验证本发明的人参皂苷位于磷脂双分子膜中,并且葡萄糖基裸露在脂质体外表面。
[0311]
2)实验方法:为了比较4t1对各实验组的摄取,探讨脂质体的摄取机制,将4t1细胞按2
×
105的细胞密度接种于12孔板中,对于实验组 葡萄糖、实验组 根皮苷和实验组 槲皮素组,12小时后分别用20mm的葡萄糖溶液、根皮苷溶液和槲皮素溶液代替培养基。这三种溶质应在无葡萄糖培养基中溶解,孵育1小时后,加入各实验组药物(紫外荧光显色剂的浓度为100ng/ml),孵育4小时后,消化,用新鲜pbs溶液洗涤,采用流式细胞仪进行分析。
[0312]
为了研究rg3脂质体的摄取机制,将底物(葡萄糖),glut1竞争性抑制剂根皮苷和槲皮素预先孵育1小时将glut1先饱和后,再加入制剂,rg3-lp/c6的荧光强度分别降低了31%,43%和74%。由此可见glut1底物和抑制剂的加入,阻止了rg3-lp/c6的细胞摄取,证明人参皂苷rg3脂质体可通过与glut1相互作用增强其摄取效率。
[0313]
3)实验组制备方法:所述操作条件同本发明实施例18的操作条件。
[0314]
方法1(被动载药):将处方量的hspc、人参皂苷和/或胆固醇、荧光探针(香豆素)和/或药物,溶于适量乙醇和氯仿的混合溶剂中(体积比1:1),减压浓缩至干,纯化水水化,超声,然后按本应用实施例的实验方法检测荧光强度。
[0315]
方法2(主动载药):将处方量的hspc、rg3和荧光探针,超声溶解于适量乙醇中,加入0.325m硫酸铵溶液水化10分钟,然后超声25次(开5秒停5秒),用5%葡萄糖溶液透析,再依次载入(和/或)药物,再次透析除去游离药物,(和/或)适量peg-dspe,得到各实验组的脂质体溶液,然后按本应用实施例的实验方法检测荧光强度。
[0316]
方法3(主动载药)(同实施例18):将处方量的hspc和荧光探针,超声溶解于适量乙醇中,加入0.325m硫酸铵溶液水化10分钟,然后超声25次(开5秒停5秒),用5%葡萄糖溶液透析,再依次载入药物或rg3,再次透析除去游离药物,(和/或)加入适量peg-dspe,得到各实验组的脂质体溶液,然后按本应用实施例的实验方法检测荧光强度。
[0317]
表21
[0318]
[0319][0320]
实验结果如表22:
[0321]
表22
[0322]
[0323][0324]
实验结论:
[0325]
1)采用传统被动载药法(薄膜蒸发法),靶向性实验数据证明:无法制备合格的rg3阿霉素共载脂质体。
[0326]
2)采用传统的主动载药法,具体地:
[0327]
i.在透析之前加入rg3,酸根溶液造成rg3在脂质体中发生泄漏,从而造成脂质体制备失败。
[0328]
ii.在透析之后加入rg3,可分两种情况:
[0329]
a)rg3在盐酸阿霉素之前加入,因药物产生的离子型溶液导致脂质体中的rg3严重泄漏,从而脂质体制备失败;
[0330]
b)rg3在盐酸阿霉素之后加入,脂质体制备成功。
[0331]
上述两个条件基本相同,两者先后顺序虽然不同,但都存在离子型溶液,却产生了不同的结果,机制尚不明确。
[0332]
1)适量加入peg-dspe影响了glut1介导的靶向性,提示peg-dspe的用量有限制。
[0333]
2)本实验提示,本发明所述的rg3阿霉素共载脂质体,须按实施例18相同或相似的方法制备。
[0334]
实验结果2如表23:
[0335]
表23
[0336][0337]
由上述结果此可见,随着glut1底物和抑制剂的加入,c6-c/lp的荧光强度无显著改变,但阻止了c6-rg3/lp的细胞摄取,证明人参皂苷rg3脂质体通过与glut1相互作用增强其摄取效率,从而证明rg3位于脂质体的膜上,rg3的葡萄糖基(glc)裸露在脂质体表面。
[0338]
应用实施例2:人乳腺癌(mcf-7)体内药效学研究
[0339]
1)试验方法:将肿瘤细胞株(mcf-7)注入小鼠皮下,建立皮下肿瘤模型。当肿瘤体积达到100mm3(接种后7d)时,将小鼠随机分组(n=8每组)治疗,每组尾静脉注射空白溶剂(5%葡萄糖,blank)、阿霉素脂质体注射剂(caelyx组)和各实验组,剂量按阿霉素计高中低三组(6mg、3mg、1.5mg),每7天给一次药,持续到第28天,给药的同时测量肿瘤的长度、宽度和记录体重。计算肿瘤体积(v)的公式为:v=(w2×
l)/2。长度(l)为实体瘤的最长直径,宽度(w)是垂直于长度的最短直径。在第28天实验结束,所有动物均处死,取出肿瘤进行影像学和组织学检测。抑瘤率t=(未给药组重量-测试组肿瘤重量)/未给药组肿瘤重量
[0340]
备注:阿霉素 rg3=6mg/kg 6mg/kg,表示药物浓度,下同。
[0341]
2)实验组如表24:
[0342]
表24
[0343][0344]
3)试验结果如表25:
[0345]
表25
[0346]
[0347][0348]
结论:
[0349]
1)rg3/dox=1.0、1.5和2.0,在药效学上,无显著差别。
[0350]
2)rg3阿霉素脂质体的体内药效学比caelyx组和rg3胆固醇阿霉素脂质体组(c-rg3(1.0)-dox-peg/lp)具有显著优效,其中,rg3(1.0)-dox-peg/lp、rg3(1.5)-dox-peg/lp和rg3(2.0)-dox-peg/lp的高剂量组(12mg/kg)在第21天,肿瘤已完全消失,比市售对照组(caelyx组)具有显著性优效。同时,该三组实验组的中剂量组(8mg/kg)第28天的抑瘤率为3-7%,比市售对照组(caelyx组)的高剂量组(12mg/kg)第28天抑瘤率(11%)更优,显示出本发明rg3阿霉素脂质体对传统阿霉素脂质体在药效学上显著优势。
[0351]
人结肠癌c-26细胞株:根据体内药效学实验方法,针对人结肠癌(c-26)细胞体内药效学的研究数据如表26。
[0352]
表26
[0353]
项目blankcaelyx组rg3(1.0)-dox-peg/lprh2(1.0)-dox-peg/lp给药剂量/6mg/kg6mg/kg 6mg/kg6mg/kg 6mg/kg7天肿瘤抑制率-18%39%17%12%14天肿瘤抑制率-26%25%5%6%21天肿瘤抑制率-41%11%肿瘤消失肿瘤消失28天肿瘤抑制率-69%3%肿瘤消失肿瘤消失
[0354]
结果显示:
[0355]
1)rg3阿霉素脂质体和rh2阿霉素脂质体的药效学无显著差别;
[0356]
2)rg3阿霉素脂质体和rh2阿霉素脂质体的药效学比市售对照组(caelyx组)具有显著优效。
[0357]
人胰腺癌capan-1:根据体内药效学实验方法,针对人胰腺癌(capan-1)细胞体内药效学的研究数据如表27。
[0358]
表27
[0359]
项目blankcaelyx组rg3(1.0)-dox-peg/lprh2(1.0)-dox-peg/lp
给药剂量/6mg/kg6mg/kg 6mg/kg6mg/kg 6mg/kg7天肿瘤抑制率-32%67%54%56%14天肿瘤抑制率-55%53%42%45%21天肿瘤抑制率-73%45%23%26%28天肿瘤抑制率-101%28%12%9%
[0360]
结果显示:
[0361]
1)rg3阿霉素脂质体和rh2阿霉素脂质体的药效学无显著差别;
[0362]
2)rg3阿霉素脂质体和rh2阿霉素脂质体的药效学比市售对照组(caelyx组)具有显著优效。
[0363]
应用实施例3:急性毒性(ld50)研究(sd大鼠)
[0364]
1)实验方法:大鼠160~260g,6~9周龄,每组6只,给药方式:缓慢静推(约1ml/min),给药频率:3次/天。
[0365]
本试验供试品阿霉素剂量设置为20,40,60和80mg/kg/天,供试品中含rg3根据处方剂量计算。同时设置溶媒对照组(5%葡萄糖注射液)、市售阳性对照组(caelyx组)、rg3(1.0)-dox-peg/lp、rg3(2.0)-dox-peg/lp、rh2(1.0)-dox-peg/lp、rh2(2.0)-dox-peg/lp,缓慢静推(约1ml/min),3次/天,每次给药间隔至少4h。
[0366]
2)实验组制备方法:根据处方要求,依实施例18方法制备。
[0367]
表28
[0368][0369]
3)实验结果如表28:
[0370]
表29
[0371][0372][0373]
通过以上实验显示,
[0374]
1)rg3阿霉素脂质体和rh2阿霉素脂质体的急性毒性无显著差别;
[0375]
2)rg3阿霉素脂质体(rg3(1.0)-dox-peg/lp组和rg3(2.0)-dox-peg/lp组)和rh2阿霉素脂质体(rh2(1.0)-dox-peg/lp组和rh2(2.0)-dox-peg/lp组)在20mg/kg未见死亡,40mg/kg死亡1/6或2/6,60mg/kg时死亡5/6或6/6;而市售对照组(caelyx组)在20mg/kg死亡4/6,40mg/kg全部死亡。说明caelyx组的ld50在约低于20mg/kg,rg3阿霉素脂质体和rh2阿霉素脂质体的ld50在40-60mg/kg之间,人参皂苷阿霉素脂质体的急性毒性比caelyx组显著性降低。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。