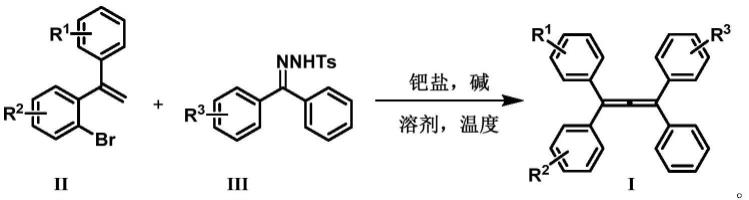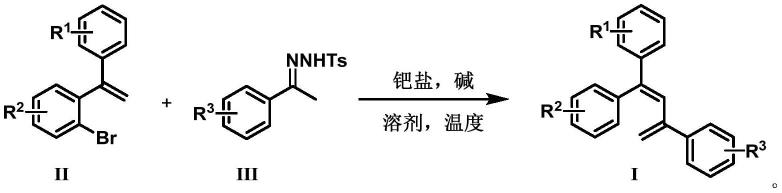
1.本发明涉及一种1,1,3-三芳基-1,3-丁二烯衍生物及其合成方法,属于化学有机合成技术领域。
背景技术:
2.取代的1,3-二烯是一种常见的重要合成砌块,1,1,3-三芳基-1,3-丁二烯衍生物具有潜在的聚集诱导发光性能,因此高效合成1,1,3-三芳基-1,3-丁二烯就显得至关重要。目前其合成策略包括heck反应(chem.eur.j.2013,19,3504)、交叉偶联(rsc advances.2014,4,39497)、wittig型双键断裂(rsc advances.2020,10,35109)等。然而这些方法存在一定的缺点,反应条件苛刻,敏感操作,合成步骤复杂,产物存在异构体,感官能团无法与强碱性的有机金属试剂兼容,底物的适用范围也十分有限,因此发展1,1,3-三芳基-1,3-丁二烯一步催化的合成方法仍然非常必要。
技术实现要素:
3.本发明的目的在于以易于制备、具有结构多样性和反应效率高的邻溴二苯乙烯ii和苯乙酮对甲苯磺酰腙iii为原料,通过1,4-钯迁移/卡宾插入/β-氢消除,一步实现了1,3-丁二烯骨架的构建,加以调控邻溴二苯乙烯和苯乙酮对甲苯磺酰腙中r1、r2、r3取代基,合成具有潜在的聚集诱导发光性能的一系列不同结构的1,1,3-三芳基-1,3-丁二烯衍生物。
4.本发明提供一种1,1,3-三芳基-1,3-丁二烯衍生物,其分子结构式i如下:
[0005][0006]
r1,r2,r3选自甲基、乙基、叔丁基、甲氧基、三氟甲基、氟、氯、三氟甲氧基、氰基中的1-5种,取代基的个数为1-5个。
[0007]
本发明提供一种1,1,3-三芳基-1,3-丁二烯衍生物i的合成方法,以邻溴二苯乙烯ii为起始原料,过渡金属钯盐为催化剂,在碱性条件下,在溶剂中与苯乙酮对甲苯磺酰腙iii反应,通过1,4-钯迁移/卡宾插入/β-氢消除过程,一步生成1,1,3-三芳基-1,3-丁二烯衍生物i。
[0008]
邻溴二苯乙烯ii的分子结构式如下:
[0009][0010]
r1,r2选自甲基、乙基、叔丁基、甲氧基、三氟甲基、氟、氯、三氟甲氧基、氰基中的1-5种,取代基的个数为1-5个;
[0011]
苯乙酮对甲苯磺酰腙iii的分子结构式如下:
[0012][0013]
r3选自甲基、乙基、叔丁基、甲氧基、三氟甲基、氟、氯、三氟甲氧基、氰基中的1-5种,取代基的个数为1-5个;
[0014]
合成路线如下述反应式所示:
[0015][0016]
其中:过渡金属钯盐选自氯化钯(pdcl2)、醋酸钯(pd(oac)2)、四苯基膦钯(pd(pph3)4)、三氟乙酸钯、双三苯基膦二氯化钯的一种或两种以上,邻溴二苯乙烯ii与催化剂的摩尔比为1:0.01-1:0.5;
[0017]
邻溴二苯乙烯ii与苯乙酮对甲苯磺酰腙iii的摩尔比为1:1-1:3;
[0018]
碱选自碳酸锂、碳酸钠、碳酸钾、碳酸铯、磷酸钾、醋酸钠、醋酸钾、醋酸铯、叔丁醇钾、叔丁醇锂(
t
buoli)中的一种或两种以上,邻溴二苯乙烯ii与碱的摩尔比为1:0.1-1:5;
[0019]
反应溶剂选自n,n-二甲基甲酰胺(dmf)、二甲基亚砜(dmso)、三氟甲苯、乙腈、甲苯(phme)、1,4-二氧六环、四氢呋喃(thf)中的一种或两种以上的混合物,邻溴二苯乙烯ii在反应溶剂中的摩尔浓度为0.05-1.0m;
[0020]
反应气氛为空气、氧气、氮气、氩气中的一种或两种以上;反应时间为0.1-48小时;反应温度为0-130℃。
[0021]
进一步地,在上述技术方案中,过渡金属钯盐最好是pdcl2。
[0022]
进一步地,在上述技术方案中,反应所用的碱最好是
t
buoli。
[0023]
进一步地,在上述技术方案中,反应最好在氮气气氛中进行。
[0024]
进一步地,在上述技术方案中,邻溴二苯乙烯ii与苯乙酮对甲苯磺酰腙iii生成i的反应最佳反应时间为1-4小时。
[0025]
进一步地,在上述技术方案中,最佳反应温度是40-80℃。
[0026]
进一步地,在上述技术方案中,反应最好在非质子极性溶剂二甲基亚砜中进行。
[0027]
进一步地,在上述技术方案中,邻溴二苯乙烯ii与苯乙酮对甲苯磺酰腙iii的优选
摩尔比为1:2.0。
[0028]
进一步地,在上述技术方案中,邻溴二苯乙烯ii与催化剂(钯盐)的优选摩尔比为1:0.1。
[0029]
进一步地,在上述技术方案中,邻溴二苯乙烯ii与碱的优选摩尔比为1:1-1:4,更优选为1:2.0。
[0030]
本发明以邻溴二苯乙烯和苯乙酮对甲苯磺酰腙为起始原料,过渡金属钯盐为催化剂,在碱性条件下,通过1,4-钯迁移及卡宾插入过程,一步生成1,1,3-三芳基-1,3-丁二烯衍生物。与已报道的合成1,1,3-三芳基-1,3-丁二烯衍生物的方法相比较,本发明仅需一步反应、操作简便、条件温和、合成反应效率高,收率在31%-84,优选为50%-84%,且产物具有很好的区域选择性及官能团多样性。本发明合成的1,1,3-三芳基-1,3-丁二烯具有潜在的聚集诱导发光性能,同时骨架结构可以作为药物及多种化工用品结构的合成砌块。
[0031]
本发明具有以下优点:
[0032]
1)合成子邻溴二苯乙烯ii和苯乙酮对甲苯磺酰腙iii具有结构多样性,可以用来合成不同类型和结构的1,1,3-三芳基-1,3-丁二烯衍生物i。
[0033]
2)合成子iii易于制备,成本低廉,易于工业化生产。
[0034]
3)1,1,3-三芳基-1,3-丁二烯衍生物i的合成反应使用价格较低的pdcl2作为催化剂。
[0035]
4)1,1,3-三芳基-1,3-丁二烯衍生物i合成反应仅需一步构建1,3-丁二烯骨架,产物收率高,最高可达到84%。
[0036]
5)1,1,3-三芳基-1,3-丁二烯衍生物i合成反应条件较温和,温度范围为40-80℃。
[0037]
6)1,1,3-三芳基-1,3-丁二烯衍生物i产物有好的立体选择性,及官能团多样性,具有广泛的应用性。
[0038]
总之,本发明利用邻溴二苯乙烯ii和苯乙酮对甲苯磺酰腙iii的结构多样性与多反应中心来高效合成不同类型和结构的1,1,3-三芳基-1,3-丁二烯衍生物i,原料便宜易得,仅需一步反应,得到一系列1,1,3-三芳基-1,3-丁二烯衍生物结构,操作简便,条件温和,目标产物收率高。
具体实施方式
[0039]
在氮气下,在四氢呋喃溶剂中,邻溴二苯甲酮a与甲基三苯基溴化磷b反应生成邻溴二苯乙烯ii。式a中r1、r2中定义同式ii。
[0040][0041]
具体过程为:将甲基三苯基溴化磷b(10.0mmol)和叔丁醇钾(16.5mmol)加入反应瓶中,氮气下加入10ml四氢呋喃,室温下缓慢滴加邻溴二苯甲酮a(2.0mmol)的四氢呋喃溶液(1m),室温搅拌反应过夜。饱和氯化铵溶液淬灭,乙酸乙酯萃取,饱和食盐水洗涤有机相,无水硫酸钠干燥,减压下除去挥发组份,然后用硅胶柱层析分离(洗脱液为石油醚(60-90
℃)/乙酸乙酯,v/v=50:1),得到目标产物ii。目标产物通过核磁共振谱和高分辨质谱测定得到确认。
[0042]
下述实施例的原料2a采用如下文献方法制备得到:
[0043]
q.n.wang,r.j.chen,j.lou,d.h.zhang,y.g.zhou,and z.k.yu,acs catal.2019,9,11669-11675.
[0044]
在乙醇溶液中,苯乙酮c与对甲苯磺酰肼d反应生成苯乙酮对甲苯磺酰腙iii。式c中rr3中定义同式iii。
[0045][0046]
具体过程为:向100ml单口瓶中加入苯乙酮(10mmol),tsnhnh2(10mmol,1.8623g),乙醇50ml,65℃下回流2h。停止反应后取出磁子,减压浓缩至20ml左右,放入冰箱降温结晶。重结晶后,抽滤,pe洗涤,干燥得目标产物白色固体iii。目标产物通过核磁共振谱得到确认。
[0047]
下述实施例的原料3a、3b用如下文献方法制备得到:
[0048]
f.huang,z.q.liu,q.n.wang,j.lou,z.k.yu,org.lett.2017,19,3660-3663.
[0049]
通过下述实施例有助于进一步理解本发明,但本发明的内容并不仅限于此。
[0050]
实施例1
[0051][0052]
在手套箱中,依次称取pdcl2(0.03mmol),
t
buli(0.6mmol),苯乙酮对甲苯磺酰腙3a(0.6mmol),n2下加入邻溴二苯甲酮2a(0.3mmol),二甲基亚砜3ml,放入60℃的油浴中反应2小时。反应结束后,将混合物冷却至室温,然后用硅胶柱层析分离(洗脱液为石油醚(60-90℃)/乙酸乙酯,v/v=50:1),得到无色液体目标产物1a(67mg,收率79%)。目标产物通过核磁共振谱测定得到确认。
[0053]
化合物表征数据
[0054]
1,1,3-三苯基-1,3-丁二烯衍生物(1a),无色液体.1h nmr(400mhz,cdcl3)δ7.40(dd,j=7.7,2h,1.2hz),7.33(m,5h),7.19(m,8h),6.76(s,1h),5.41(s,1h),5.05(s,1h).
13
c{1h}nmr(100mhz,cdcl3)δ145.43,144.82,143.25,140.87,140.20,130.26,128.46,128.31,128.22,128.09,128.05,127.73,127.53,127.16,126.82,117.49.
[0055]
实施例2
[0056][0057]
在手套箱中,依次称取pdcl2(0.03mmol),
t
buli(0.6mmol),4-溴苯乙酮对甲苯磺酰
腙3b(0.6mmol),n2下加入邻溴二苯甲酮2a(0.3mmol),二甲基亚砜3ml,放入60℃的油浴中反应2小时。反应结束后,将混合物冷却至室温,然后用硅胶柱层析分离(洗脱液为石油醚(60-90℃)/乙酸乙酯,v/v=50:1),得到白色固体目标产物1b(79mg,收率83%)。目标产物通过核磁共振谱测定得到确认。
[0058]
化合物表征数据
[0059]
1,1-二苯基-3-对氯苯基-1,3-丁二烯衍生物(1b),白色固体.1h nmr(400mhz,cdcl3)δ7.35(m,7h),7.19(m,7h),6.79(s,1h),5.43(s,1h),5.17(s,1h).
13
c{1h}nmr(100mhz,cdcl3)δ145.19,144.60,143.02,139.94,139.25,133.16,130.22,128.33,128.22,128.17,128.09,128.04,127.89,127.87,127.29,118.15.
[0060]
实施例3
[0061]
反应步骤与操作同实施例1,与实施例1不同之处在于,2a与pdcl2的摩尔比为1:0.05。停止反应,经后处理得到目标产物1a(38mg,收率45%)。
[0062]
实施例4
[0063]
反应步骤与操作同实施例1,与实施例1不同之处在于,dmso改为thf。停止反应,经后处理得到目标产物1a(50mg,收率60%)。
[0064]
实施例5
[0065]
反应步骤与操作同实施例1,与实施例1不同之处在于,dmso改为phme。停止反应,经后处理得到目标产物1a(40mg,收率47%)。
[0066]
实施例6
[0067]
反应步骤与操作同实施例1,与实施例1不同之处在于,pdcl2改为pd(pph3)4。停止反应,经后处理得到目标产物1a(35mg,收率41%)。
[0068]
实施例7
[0069]
反应步骤与操作同实施例1,与实施例1不同之处在于,pdcl2改为pd(oac)2。停止反应,经后处理得到目标产物1a(26mg,收率31%)。
[0070]
实施例8
[0071]
反应步骤与操作同实施例1,与实施例1不同之处在于,n2改为o2。停止反应,经后处理得到目标产物1a(30mg,收率35%)。
[0072]
实施例9
[0073]
反应步骤与操作同实施例1,与实施例1不同之处在于,n2改为空气。停止反应,经后处理得到目标产物1a(37mg,收率43%)。
[0074]
实施例10
[0075]
反应步骤与操作同实施例1,与实施例1不同之处在于,60℃改为40℃。停止反应,经后处理得到目标产物1a(42mg,收率50%)。
[0076]
本发明方法原料易得,操作简便,合成反应条件温和、反应效率高,其官能团具有多样性。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。