1.本发明属于治疗肝损伤药物的技术领域,涉及一种用于治疗对乙酰氨基酚过量服用诱导的药物性肝损伤的联合用药物,具体涉及铁死亡(ferroptosis)和受体相互作用蛋白1(receptor-interacting protein 1,rip1,亦称为ripk1)抑制剂作为联合用药物用于治疗对乙酰氨基酚过量服用诱导的药物性肝损伤。
背景技术:
2.对乙酰氨基酚(apap,又称扑热息痛)是一种温和的非麻醉性镇痛和退热药,广泛用作止痛药和退烧药,fda确定其在治疗剂量1-4g/day下是安全有效的。新的研究数据表明,单次摄入量为10-15g会导致严重或致命性肝损伤,继而诱发肝坏死;连续几天每天摄入低于10g的剂量对一些人来说也存在肝脏损伤的风险;在治疗剂量下,apap 甚至可能引起血清转氨酶的短暂性升高。然而,apap作为一种良好的退烧和镇痛药物,目前被广泛应用于片剂、液体制剂和直肠栓剂等多种形式的制剂中,并且人们很难在这些产品中识别apap,导致长期过量服用apap的患者持续增加。人们过量服用apap 后会导致肝转氨酶含量升高、胆汁淤积和肝炎等,一旦发生急性肝功能衰竭,肝移植是唯一公认的挽救生命的方法。所以,由apap过量服用导致的药物性肝损伤现已发展成为一个重大的公共卫生问题,造成较大的医疗压力。因此找到一种行之有效的方法来治疗apap过量服用导致的药物性肝损伤具有重要的现实意义。
3.stockwell等人在2012年首次提出一种铁依赖性的新型细胞死亡方式,称之为铁死亡。铁死亡是由细胞内氧化还原稳态失衡引起的,其具有独特的形态特征,表现为细胞体积减少、线粒体受损、细胞内铁离子和活性氧的大量积累,进而导致氧化应激和脂质过氧化。铁死亡过程中细胞内谷胱甘肽过氧化物酶4(glutathione peroxidase 4,gpx4) 的活性会受到抑制,导致谷胱甘肽(gsh)水平下调和脂质过氧化物的积累,造成细胞或亚细胞膜损伤,最终引起细胞死亡。由于gsh的耗竭是apap诱导肝毒性的直接原因,同时gsh对于铁死亡的发生起着至关重要的作用,这暗示着铁死亡可能参与了 apap过量服用导致的药物性肝损伤。研究发现铁死亡的抑制剂fer-1可以显著降低 apap诱导的小鼠原代肝细胞的死亡率(lorincz t,jemnitz k,kardon t,et al.ferroptosisis involved in acetaminophen induced cell death[j].pathol oncol res,2015,21(4): 1115-21.),发现fer-1可以通过抑制脂质过氧化和gsh耗竭来降低apap过量服用诱导的急性肝损伤(yamad n,karasawa t,kimura h,et al.ferroptosis driven by radicaloxidation of n-6polyunsaturated fatty acids mediates acetaminophen-induced acute liverfailure[j].cell death dis,2020,11(2):144.),另外,fer-1治疗还可完全阻止大剂量apap 所致的死亡(ofengeim d,yuan j.regulation of rip1 kinase signalling at the crossroads ofinflammation and cell death[j].nat rev mol cell biol,2013,14(11):727-36.)。这些发现为 apap诱导的药性肝损伤的分子机制提供了新的见解,并揭示
了铁死亡可能作为治疗该疾病的一个新型的治疗靶标。
[0004]
受体相互作用蛋白1(receptor-interacting protein 1,rip1,亦称为ripk1)是细胞死亡的关键调控分子,在调控细胞存活、细胞死亡以及炎症反应的发生等过程中发挥了重要作用,是一个决定细胞命运的重要传感器分子,参与调控了包括nf-κb信号通路、细胞凋亡和坏死、炎症小体活化和细胞焦亡等多条重要的信号通路和细胞效应。ripk1 激酶的表达水平、蛋白质修饰状态以及与其他蛋白分子的相互作用等因素决定了细胞命运的选择,是继续存活还是走向死亡。ripk1通过死亡结构域与相应的衔接蛋白形成复合物,并激活下游通路来调控细胞的命运。当机体发生炎症时,炎症部位会高表达tnf-α和il-1β等促炎因子,而细胞膜上的肿瘤坏死因子识别受体tnfr1会特异性的识别并结合tnf-α,然后其位于胞内的死亡结构域会募集胞质中的ripk1和肿瘤坏死因子受体相关死亡域蛋白(tradd)形成复合物i,开启细胞的存活通道,继而激活下游nf-κb信号通路,导致细胞抗凋亡基因以及前炎症因子的转录激活,促进细胞的存活。有研究表明apap诱导的细胞凋亡主要为ripk1依赖型的细胞凋亡,因此抑制ripk1激酶活性能够显著降低凋亡细胞的数量,从而缓解apap诱导的急性肝损伤。目前的研究发现,在服用apap 8小时以内使用n-乙酰半胱氨酸(n-acetylcysteine,nac)时会100%的缓解apap诱导的药性肝损伤,但在临床上,大多数apap用药过量的患者在寻求医疗救治时肝损伤症状已经比较严重,那时nac的有效性已经大大降低了,部分患者会从急性肝损伤恶化成急性肝衰竭,这时肝移植是唯一的选择,而抑制ripk1的激酶活性对 apap过量造成的肝毒性晚期仍然有效(dara l,johnson h,suda j,et al.receptorinteracting protein kinase 1mediates murine acetaminophen toxicity independent of thenecrosome and not through necroptosis[j].hepatology,2015,62(6):1847-57.)。因此ripk1 的激酶活性位点可以作为很好的治疗靶点,目前已经开发出一些针对ripk1的激酶活性的抑制剂,例如nec-1、nec-1s和ripa56等,并逐渐进入治疗炎症性相关疾病的临床试验阶段。
技术实现要素:
[0005]
本发明的目的在于提供一种用于治疗对乙酰氨基酚过量服用诱导的药物性肝损伤的联合用药物。
[0006]
本发明所述的用于治疗对乙酰氨基酚过量服用诱导的药物性肝损伤的联合用药物,包括铁死亡和ripk1激酶抑制剂,通过靶向ripk1激酶失活和细胞铁死亡来治疗对乙酰氨基酚过量服用诱导的药物性肝损伤。
[0007]
本发明中,所述的铁死亡抑制剂为本领域常见的铁死亡抑制剂,例如: ferrostatin-1(fer-1)、n-acetylcysteine(nac)、erastin等。在本发明的具体实施方式中,采用的铁死亡抑制剂为fer-1。
[0008]
本发明中,所述的ripk1激酶抑制剂为本领域常见的ripk1激酶抑制剂,例如: necrostatin-1(nec-1)、necrostatin-1s(nec-1s)和ripa56等。在本发明的具体实施方式中,采用的ripk1激酶抑制剂为nec-1。
[0009]
本发明首次发现与单独铁死亡抑制剂或ripk1激酶抑制剂相比,铁死亡和ripk1 激酶抑制剂联合用药物对对乙酰氨基酚过量服用诱导的药物性肝损伤具有更显著的治疗效果。
附图说明
[0010]
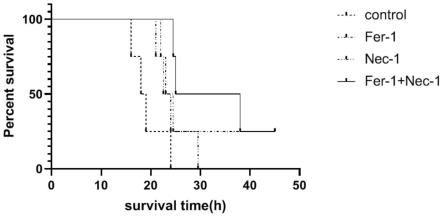
图1为对照组、fer-1组、nec-1组、fer-1和nec-1联合用药组小鼠死亡曲线。
[0011]
图2为各实验组的血清中谷丙转氨酶(alt)和门冬氨酸氨基转移酶(ast)的含量图。
[0012]
图3为c57bl/6j雄鼠的肝组织苏木精和伊红染色方法(he)染色图,a为对照组; b为fer-1给药组;c为nec-1给药组;d为fer-1和nec-1联合给药组。
具体实施方式
[0013]
下面结合实施例和附图对本发明作进一步详述。
[0014]
下述实施例中采用的fer-1、nec-1均购自medchemexpress(mce)。
[0015]
实施例1
[0016]
1.构建apap致死模型
[0017]
选取6周大的c57bl/6j雄鼠进行实验,所有小鼠过夜禁食12小时后按每千克小鼠体重10mg抑制剂的剂量腹腔注射fer-1、nec-1或fer-1 nec-1(fer-1与nec-1的质量比为1:1),1小时后腹腔注射700mg/kg的apap,观察统计48h内不同组中小鼠的死亡时间。
[0018]
2.构建apap肝毒性模型
[0019]
选取6周大的c57bl/6j雄鼠进行实验,所有小鼠过夜禁食12小时后按每千克小鼠体重10mg抑制剂的剂量腹腔注射fer-1、nec-1和fer-1 nec-1,1小时后腹腔注射300 mg/kg的apap,在24h时处死小鼠,收集小鼠的血液和肝脏样本,并检测其相关的生理生化指标。
[0020]
3.ast/alt检测
[0021]
1)将小鼠眼球取血,全血在1.5ml离心管中室温放置半小时,然后5000rpm/min 离心10分钟,吸取上层清澈的血清样品保存于-20℃待测。
[0022]
2)将血清样品用pbs稀释10-20倍,充分混匀。
[0023]
3)取一个新的96孔板,每个孔内加入20μl ast/alt的基质液,然后吸取5μl 血清加入孔板底部的基质液中,其中对照孔内加入5μl的pbs溶液,反复吹打混匀后放于37℃培养箱30分钟。
[0024]
4)30分钟后取出,每个孔内加入20μl的显色液,反复吹打混匀后,放到37℃培养箱反应20分钟。
[0025]
5)将4mol/l的氢氧化钠溶液稀释十倍,配制成0.4mol/l的终止液,然后每孔加入200ml终止反应,轻轻水平摇动96孔板,室温放置15分钟后,使用酶标仪在510nm 波长处测定各孔的od值。
[0026]
6)按照公式计算每个样品中ast/alt的含量。
[0027]
4.苏木精和伊红染色方法(he)染色
[0028]
1)组织固定、包埋和切片:剪取小鼠新鲜的肝脏组织放于4%的多聚甲醛溶液中固定至少24小时,然后将其用石蜡包埋并切片。
[0029]
2)石蜡切片脱蜡:将石蜡切片放入二甲苯中浸泡20min,然后换新鲜的二甲苯溶液继续浸泡20min,再依次将切片转移至无水乙醇ⅰ号溶液中浸泡5min,无水乙醇ⅱ号溶液中5min和75%酒精5min,最后用自来水洗,将石蜡脱洗完全。
[0030]
3)苏木素染色:将脱蜡完全的切片用配好的苏木素染液染色3-5min,然后用自来
水冲洗掉玻片上残余的染液。接着使用1%的盐酸酒精溶液分化5-10秒,继续用自来水冲洗,最后使用0.6%氨水溶液进行返蓝,用自来水冲洗干净。
[0031]
4)伊红染色:配制85%和95%的酒精溶液,将切片依次放入其中各5min进行脱水,然后使用伊红染液染色5min。
[0032]
5)脱水封片:将染色完全的切片放入新鲜的无水乙醇溶液连续浸泡,每次5min,连续三次。然后再放入新鲜的二甲苯溶液中浸泡5min,连续浸泡两次,使切片脱水透明,最后用中性树胶封片。
[0033]
6)显微镜镜检:其中可观察到细胞核呈蓝色,细胞质呈红色。
[0034]
图1为对照组、fer-1组、nec-1组、fer-1和nec-1联合用药组小鼠死亡曲线。结果表明,在注射700mg/kg的apap后24h时,对照组小鼠存活率为0,fer-1治疗组存活率为50%,nec-1治疗组存活率为25%,而fer-1和nec-1联合用药治疗组的存活率达到75%,说明fer-1和nec-1联合用药对apap服用过量诱导的急性肝损伤具有显著的治疗效果。
[0035]
图2为各实验组的血清中谷丙转氨酶(alt)和门冬氨酸氨基转移酶(ast)的含量图。结果显示fer-1和nec-1联合用药治疗组能够显著降低alt、ast的含量,表明fer-1 和nec-1联合用药能够显著缓解apap服用过量诱导的急性肝损伤。
[0036]
图3为c57bl/6j雄鼠的肝组织苏木精和伊红染色方法(he)染色图,a为对照组; b为fer-1给药组;c为nec-1给药组;d为fer-1和nec-1联合给药组。通过小鼠肝脏组织he染色,发现fer-1和nec-1单独给药时均能够减轻apap服用过量诱导的急性肝损伤,但fer-1和nec-1联合用药后小鼠的肝损伤得到更加显著的缓解。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。