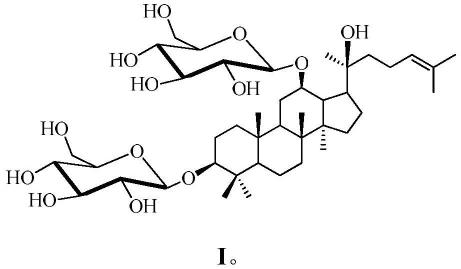
1.本发明涉及涉及一种胆酸修饰的口服紫杉醇纳米粒及其制备方法,本发明还涉及该口服紫杉醇纳米粒的用途,属医药制剂技术领域。
背景技术:
2.化疗作为一种全身性的治疗手段,药物会随着血液循环而分布于全身大部分器官和组织,因此更适合应用于一些有全身播撒倾向的或者已经发生转移的中晚期肿瘤。传统化疗方案大多采用三周一次的最大耐受剂量依赖(maximally tolerateddose,mtd)方案,依托于高剂量的给药方式会伴随着严重的不良反应,多次给药后会产生肿瘤耐药性。除了极少部分的抗肿瘤药物如环磷酰胺、顺铂等,大部分药物在临床上的给药途径为静脉给药,这是由药物性质决定的,然而患者需要忍受长期静脉给药所带来的依从性差、血液毒性、感染等问题,并承担高昂的住院费用。与传统mtd相比,口服方案具有低毒性、低耐药性等优势。口服化疗药物由于其安全性、便捷性、成本低、依从性好等优点在近些年吸引了研发者的关注。相较于静脉注射,口服递送系统具有维持平稳的血药浓度、通过控释药物延长药物的半衰期等巨大优势。然而多重胃肠道物化屏障的存在限制了口服化疗药物的开发,包括:胃肠道复杂的环境对化药的结构破坏、化药的肠道低渗透性等。因此,通过精巧的设计克服上述屏障带来的吸收限制对于提高化疗药物的口服生物利用度具有重要意义。
3.胆盐(bile salts,bs)是由胆汁分泌进入小肠的,借助小肠回肠上皮的胆盐转运体(asbt)进入血液循环的一种内源性物质,其重吸收率可以达到90%以上。 bs中初级胆汁酸(bile acids,ba)和两亲性共轭胆汁酸(conjugated bile acids, cba)由肝脏合成,通过胆管和胆囊分泌到十二指肠以消化脂质类物质。通过肝肠循环,正常人体每天可在胃肠道和肝脏间回收12~18g ba和cba。基于以上理论,有一些研究将ba作为靶头修饰在纳米粒表面促进多肽的口服吸收,并取得了不错的成果。有相关研究报道,对asbt具有亲和力的纳米粒可以通过asbt介导的内吞作用进入肠道内皮细胞,并帮助荷载的药物实现溶酶体逃逸作用,继而通过内质网、高尔基体胞内转运途径形成乳糜微粒,到达细胞基底层后通过淋巴转运系统进入血液循环,这种吸收方式可以极大地避免药物的肝脏首过效应,显著提升药物的口服生物利用度。课题组前期制备了一种甘氨胆酸修饰的包载生物大分子药物的口服纳米递送系统,用于ii型糖尿病的治疗,研究结果表明经甘氨胆酸修饰后,药物的口服生物利用度提高了2倍,相关研究成果已申请专利(高钟镐. 一种包载生物大分子的口服纳米聚合物靶向递送系统:中国, 201910927139.3[p].2019-9-27.)。
[0004]
壳聚糖是一种生物安全性良好的阳离子聚合物多糖,有研究表明壳聚糖可作为一种生物膜黏附材料从而延长药物在肠道的滞留时间,提高药物的口服吸收。此外,有许多研究将壳聚糖修饰在脂质体表面,可以提高脂质体的口服稳定性。
[0005]
槲皮素(quercetin,qt)是一类在茶叶、洋葱等植物中具有较高含量的天然黄酮类化合物,有研究发现qt可以竞争性拮抗包括p-gp、mrp1和bcrp在内的 mdr家族,作为一种天然来源的p-gp抑制剂在多株耐药细胞系中表现出良好的 p-gp外排抑制生物学功能。紫杉
槲皮素聚合物,溶于氯仿至完全溶解成澄清的溶液,经0.22μm滤膜除菌过滤后加入旋转瓶中置恒温水浴(40℃
±
5℃)进行减压成干燥脂质膜;将上述形成脂质膜的旋转瓶放入真空干燥箱中,在40℃
±
5℃条件下真空干燥1-2小时;在上述形成脂质膜的旋转瓶内加5%葡萄糖溶液,在40℃
±
5℃水浴条件下进行水化至混悬液无肉眼可见不溶物,然后将水化液体经冰水浴探头超声,用挤压过膜或超声等方法进行整粒,得到符合粒径要求的内层紫杉醇脂质体混合液。将上述形成的内层紫杉醇脂质体混合液加入圆底烧瓶中,按照处方比例称取壳聚糖-甘氨胆酸溶解于5%葡萄糖溶液,与紫杉醇脂质体混合液搅拌混合15min-30min后,室温静置20-50min,得到符合粒径要求的胆酸修饰的口服紫杉醇纳米粒混合液。本发明还提供本发明的胆酸修饰的口服紫杉醇纳米粒药物组合物在制备治疗肿瘤的药物中的用途。
[0017]
有益技术效果:
[0018]
1)本发明制备的胆酸修饰的口服紫杉醇纳米粒具有包封率高,稳定性好的优点。
[0019]
2)本发明制备的胆酸修饰的口服紫杉醇纳米粒具有肠道渗透性好、生物相容性好和生物膜黏附性好的优点,从而能有效提高紫杉醇的口服生物利用度,进而获得良好的抗肿瘤药效。
[0020]
3)本发明制备的胆酸修饰的口服紫杉醇纳米粒提供了一种安全、便捷的口服给药方式,可以提高患者的依从性,减少静注带来的感染、血管刺激等毒副作用,具有安全性好的优点。
附图说明
[0021]
图1:胆酸修饰的口服紫杉醇纳米粒动态光散射(dls)粒径分布图
[0022]
图2:胆酸修饰的口服紫杉醇纳米粒动态光散射(dls)电位图
[0023]
图3:胆酸修饰的口服紫杉醇纳米粒透射电镜图
[0024]
图4:胆酸修饰的口服紫杉醇纳米粒体外释放曲线
[0025]
图5:胆酸修饰的口服紫杉醇纳米粒在人工胃液中的稳定性结果图
[0026]
图6:胆酸修饰的口服紫杉醇纳米粒在人工肠液中的稳定性结果图
[0027]
图7:空白胆酸修饰的口服纳米粒对人结直肠细胞caco-2细胞安全性实验结果图
[0028]
图8:胆酸修饰的口服紫杉醇纳米粒对人结直肠细胞caco-2细胞安全性实验结果图
[0029]
图9:胆酸修饰的口服紫杉醇纳米粒在体外类人小肠上皮细胞的转运效率结果图
[0030]
图10:胆酸修饰的口服紫杉醇纳米粒在体外类人小肠上皮细胞的表观渗透系数结果图
[0031]
图11:胆酸修饰的口服紫杉醇纳米粒在sd大鼠中的血药浓度-时间曲线结果
[0032]
图12:胆酸修饰的口服紫杉醇纳米粒体外抑瘤效果结果图
[0033]
图13:胆酸修饰的口服紫杉醇纳米粒治疗荷瘤小鼠12天后瘤重结果图
[0034]
图14:胆酸修饰的口服紫杉醇纳米粒体外安全性考察结果图
具体实施方式
[0035]
以下实施例旨在说明本发明而不是对本发明的进一步限定。下面参照实施例进一步详细阐述本发明,但本发明并不限于这些实施例以及使用的制备方法。而且,本领域技术
人员根据本发明的描述可以对本发明进行等同替换、组合、改良或修饰,但这些都将包括在本发明的范围内。
[0036]
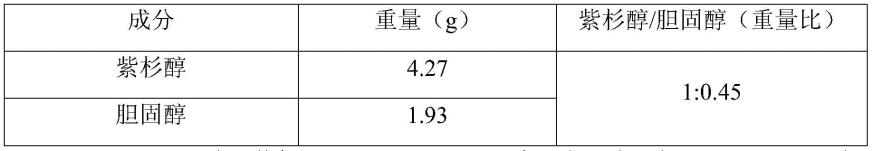
实施例1:紫杉醇胆固醇复合物的制备
[0037]
表1为紫杉醇胆固醇复合物的组成:
[0038][0039]
按上述处方量称取紫杉醇和胆固醇,置于具塞三角瓶中,加入丙酮100ml将其溶解,在45℃温度条件下搅拌2小时,转移至旋转蒸发仪中,旋转蒸发去除丙酮,在45℃温度条件下真空干燥15小时,得到紫杉醇胆固醇复合物。
[0040]
实施例2:胆酸修饰的口服紫杉醇纳米粒的制备
[0041]
表2为胆酸修饰的口服紫杉醇纳米粒的处方组成:
[0042][0043]
制备方法:在100ml茄形瓶中,将8mg紫杉醇胆固醇复合物、280mg大豆卵磷脂、7mg胆固醇、50mg磷脂-聚乙二醇与30mg磷脂-聚乙二醇-槲皮素聚合物溶于6ml氯仿至完全溶解成澄清的溶液,经0.22μm滤膜除菌过滤后加入旋转瓶中置恒温水浴(40℃
±
2℃)进行减压成干燥脂质膜;将上述形成脂质膜的旋转瓶放入真空干燥箱中,在40℃条件下真空干燥1-2小时;在上述形成脂质膜的旋转瓶内加入 5%葡萄糖溶液,在40℃水浴条件下进行水化至混悬液无肉眼可见不溶物,然后将水化液体经冰水浴探头超声进行整粒,得到符合粒径要求的内层紫杉醇脂质体。将上述形成的紫杉醇脂质体混合液加入圆底烧瓶中,称取60mg壳聚糖-甘氨胆酸溶解于2.5ml 5%葡萄糖溶液,与紫杉醇脂质体混合液搅拌混合15min-30min后,室温静置20-50min,得到符合粒径要求的胆酸修饰的口服紫杉醇纳米粒混合液。本发明还提供本发明的胆酸修饰的紫杉醇纳米粒在制备口服抗肿瘤纳米递送系统的用途。
[0044]
胆酸修饰的口服紫杉醇纳米粒的物理性质:粒径:以动态光散射法测定,为 87.5nm,pdi为0.228;电位:以动态光散射法测定,为 14.1mv;包封率:经高效液相色谱法测定,为99.05%;载药量:经高效液相色谱法测定,为1.51%。
[0045]
实施例3:胆酸修饰的口服紫杉醇纳米粒体外释放度的测定
[0046]
将胆酸修饰的口服紫杉醇纳米粒溶液0.5ml(含紫杉醇0.6mg)转移至透析袋中,两端扎紧后置于30ml的含有0.5%吐温80的ph 1.2盐酸水溶液中,以中国药典2015版四部溶出度测定法之第三法(小杯法)的装置和方法,37℃恒温振荡,回旋速度为100rpm。在1、1.5、2h定时取出0.5ml释放介质,同时补充同温等体积新鲜释放介质,然后将透析袋转移至含有0.5%吐温80的ph 6.8等渗pbs溶液中继续释放,在3、5、7、10、12、24、36、48、72h定时取出0.5ml释放介质,同时补充同温同体积新鲜释放介质。取出的释放介质离心(12000rpm,10min)后,应用高效液相色谱法测定紫杉醇的累积含量,同法测定市售紫杉醇注射液体外释放度。
[0047]
表3为释放度数据:
[0048][0049][0050]
结果如图4所示,结果显示,在ph 1.2模拟人工胃液环境中,2h内胆酸修饰的口服紫杉醇纳米粒组释放度不到3%,在转移至ph6.8释放介质后,紫杉醇注射液组药物释放在48h已达到71.54%,而纳米粒在48h内药物释放为61.17%。可以证明制备得到的纳米粒在胃肠道的稳定性良好,可以满足口服给药条件。
[0051]
实施例4:胆酸修饰的口服紫杉醇纳米粒在人工胃、肠液稳定性
[0052]
配制人工胃液:取100ml ph 1.2的盐酸溶液,加入320mg胃蛋白酶,溶解即得。
[0053]
配制人工肠液:取100ml ph 6.8的缓冲溶液,加入1000mg胰蛋白酶,溶解即得。
[0054]
分别取1ml胆酸修饰的口服紫杉醇纳米粒和1ml无胆酸修饰的口服紫杉醇纳米粒与2ml人工胃液及人工肠液混合孵育,置于37℃,100rpm恒温震荡。其中,人工胃液组样品,在1h,2h时间点分别取300ul样品,人工肠液组样品,在1h, 2h,4h,6h时间点分别取300ul样品。测定所取样品的粒径及粒径分布,考察样品在模拟人工胃液和肠液中的稳定性。
[0055]
表4为纳米粒在人工胃液中的不同时间点下的粒径
[0056][0057]
表5为纳米粒在人工肠液中的不同时间点下的粒径
[0058][0059]
图5、6与表4、5表明胆酸修饰的口服紫杉醇纳米粒在人工胃液2h和人工肠液6h时稳定性良好,粒径及pdi维持在稳定水平。说明本专利提供的口服紫杉醇系统在胃肠道稳定性方面存在一定优势,可以以相对完整的状态到达小肠吸收部位。
[0060]
实施例5:材料的细胞毒性研究
[0061]
将空白胆酸修饰的口服纳米粒制剂用培养液稀释成预定浓度的溶液。每个浓度设6个复孔,并设对照组和调零组。将人结肠癌细胞caco-2细胞以1
×
104个/孔的密度接种于96孔板中,继续培养24h后,介质以含有1、10、20、50、100、200μg/ml 的空白胶束浓度的新鲜培养液替换,分别继续培养24h。每孔加入cck-8试剂20μl。继续孵育1-4h,于450nm处测定吸收值,并以650nm为参考波长。计算细胞活力,公式如下:
[0062]
细胞活力(%)=[(od
实验-od
调零
)/(od
对照-od
调零
)]
×
100
[0063]
表6为空白胆酸修饰的口服紫杉醇纳米粒对人结肠癌细胞caco-2细胞的增殖抑制情况
[0064]
浓度(μg/ml)细胞存活率(%)196.10%
±
0.041091.86%
±
0.052094.06%
±
0.045086.67%
±
0.1210090.03%
±
0.0520083.38%
±
0.02
[0065]
图7与表6表明,空白胆酸修饰的口服紫杉醇纳米粒在所测定的浓度范围内, caco-2细胞的活力均在80%以上,表明材料本身对细胞毒性较小。说明本专利提供的胆酸
修饰的口服纳米粒系统在安全性方面存在优势。
[0066]
实施例6:载药纳米粒的细胞毒性研究
[0067]
将胆酸修饰的口服紫杉醇纳米粒用培养液稀释成预定浓度的溶液。每个浓度设6个复孔,并设对照组和调零组。将人结肠癌细胞caco-2细胞以1
×
104个/孔的密度接种于96孔板中,继续培养24h后,介质以含有1、10、20、50、100、200μg/ml 的胆酸修饰的口服紫杉醇纳米粒的新鲜培养液替换,分别继续培养24h。每孔加入 cck-8试剂20μl。继续孵育1-4h,于450nm处测定吸收值,并以650nm为参考波长。计算细胞活力和细胞增殖抑制率,公式如下:
[0068]
细胞增殖抑制率(%)=[1-(od
实验-od
调零
)/(od
对照-od
调零
)]
×
100
[0069]
表7为胆酸修饰的口服紫杉醇纳米粒对人结肠癌caco-2细胞的增殖抑制情况
[0070]
浓度(μg/ml)细胞增殖抑制率(%)198.26%
±
0.041085.21%
±
0.042090.12%
±
0.025081.60%
±
0.0510085.27%
±
0.0220080.92%
±
0.04
[0071]
图8与表7表明,在药物浓度为1-200μg/ml的范围中,胆酸修饰的口服紫杉醇纳米粒与caco-2孵育4h后,细胞存活率均在80%以上,证明在该浓度范围内,本专利提供的口服紫杉醇纳米粒可以满足tranwell单层模型转运试验的安全性要求。
[0072]
实施例6:香豆素6标记的胆酸修饰的口服纳米粒的制备
[0073]
按上述实施例1中纳米粒的制备方法,制备香豆素6标记的纳米粒。称取处方量的大豆卵磷脂、胆固醇、磷脂-聚乙二醇和磷脂-聚乙二醇-槲皮素聚合物溶于氯仿至完全溶解成澄清的溶液,再向其中加入一定量的香豆素6氯仿溶液,使最终香豆素6的浓度约为15μg/ml或120μg/ml,经0.22μm滤膜除菌过滤后加入旋转瓶中置恒温水浴(40℃
±
2℃)进行减压成干燥脂质膜;将上述形成脂质膜的旋转瓶放入真空干燥箱中,在40℃条件下真空干燥1-2小时;在上述形成脂质膜的旋转瓶内加入5%葡萄糖溶液,在40℃水浴条件下进行水化至混悬液无肉眼可见不溶物,然后将水化液体经冰水浴探头超声进行整粒,即得香豆素6标记的cou-6-lip。将上述形成的cou-6-lip混合液加入圆底烧瓶中,按照处方比例称取壳聚糖-甘氨胆酸或壳聚糖溶解于5%葡萄糖溶液,与内层紫杉醇脂质体混合液搅拌混合 15min-30min后,室温静置20-50min,得到符合粒径要求的胆酸修饰的口服纳米粒混合液cou-6-gql和无胆酸修饰的口服纳米粒混合液cou-6-cql。
[0074]
实施例7:人结肠癌caco-2细胞transwell模型的建立
[0075]
将人结肠癌caco-2细胞以1
×
105个细胞接种于12孔tranwell小室中,下室加入1.5ml培养基,于37℃、5%co2培养箱中培养48h后,弃去培养基更换新鲜培养液,于37℃、5%co2培养箱中继续培养。前一周每两天换液,一周后每天换液,培养21天后,即得体外类人小肠上皮细胞模型。
[0076]
实施例8:载药纳米粒在体外小肠上皮细胞模型上的转运
[0077]
利用液相色谱定量考察胆酸修饰的紫杉醇口服纳米粒在体外小肠上皮细胞上的转运能力。实验室预先用37℃保温的hank’s溶液冲洗小室和外室3遍。,在小室中分别加入
500ul用hank’s溶液稀释的紫杉醇注射液、胆酸修饰的紫杉醇口服纳米粒和无胆酸修饰的紫杉醇口服纳米粒,继续置于37℃、5%co2培养箱中进行转运试验。分别在30min、60min、90min、120min从外室取300ul下层接收液进行紫杉醇含量测定,并及时补充37℃预热的hank’s溶液于外室。每组设定3个复孔。将取得的样品加入等体积乙腈涡旋混匀,超声10min后,12000rpm离心10min,收集上清液进高效液相色谱进行含量测定。
[0078]
计算无胆酸修饰的口服紫杉醇纳米粒、胆酸修饰的口服紫杉醇纳米粒、紫杉醇注射液三组在不同时间下的转运效率及表观渗透系数。表观渗透系数的计算公式为:p
app
=dq/dt
×
1/(a
×
c0)。
[0079]
表8为胆酸修饰的口服紫杉醇纳米粒在体外模拟人小肠上皮细胞模型中的转运效率。
[0080][0081]
表9为胆酸修饰的口服紫杉醇纳米粒在体外模拟人小肠上皮细胞模型中的表观渗透系数。
[0082][0083]
由表8-9,图9-10可以看出,胆酸修饰的口服紫杉醇纳米粒在体外模拟小肠上皮细胞模型上转运120min时,转运效率可以达到15.79%,紫杉醇注射液组的转运效率为2.95%。胆酸修饰的口服紫杉醇纳米粒转运渗透系数为6.25
×
10^-6
cm/s,紫杉醇注射液的转运渗透系数为6
×
10^-7
cm/s。由此可见,本发明所构建的口服纳米粒可以明显提高紫杉醇的肠道转运能力。
[0084]
实施例9:胆酸修饰的口服紫杉醇纳米粒体内药动学研究
[0085]
利用液质对胆酸修饰的口服紫杉醇纳米粒在sd大鼠体内的血药浓度变化进行检测。取150~160g sd大鼠,禁食12h后,随机分成6组,每组3只。其中,胆酸修饰的口服紫杉醇纳米粒 牛磺胆酸盐组提前1h灌胃牛磺胆酸盐,剂量为 25mg/kg,胆酸修饰的口服紫杉醇纳米粒 环己酰内亚胺组提前1h腹腔注射环己酰内亚胺,剂量为6mg/kg。各组给药剂量均为10mg/kg,分别在0h、0.05h、0.25h、 0.5h、1h、1.5h、2h、4h、6h、8h、12h、24h经大鼠外眼眦取血0.5ml,以4000rpm 转速离心10min收集血清。取100μl血清与300μl含内标物多西他赛的乙腈溶液混合后,以12000rpm转速离心10min收集上清液,制备的样品利用液质测定血浆中紫杉醇的血药浓度。
[0086]
表10是各组制剂在sd大鼠内的紫杉醇血药浓度结果。
[0087][0088]
由表10和图11可知,胆酸修饰的口服紫杉醇纳米粒绝对生物利用度相较于口服紫杉醇注射液提高了15倍,cmax相较于口服紫杉醇注射液11倍。在预先给asbt转运体抑制剂牛磺胆酸盐后,胆酸修饰的口服紫杉醇纳米粒绝对生物利用度下降1.3倍,证明asbt转运体介导了本专利提供的胆酸修饰的口服纳米粒在体内口服生物利用的提高。总结来看,本专利提供的胆酸修饰的口服纳米粒可以显著提高紫杉醇的口服生物利用度,具有潜在的开发价值。
[0089]
实施例10:荷ll2肺癌动物模型的建立
[0090]
取处于对数生长期的ll2肺癌细胞,用胰酶消化,离心弃去上清液,加pbs 重悬后,以1
×
10^6/只的数量接种于4~6周龄,体重18~22g的雄性c57bl/6小鼠右前腿侧面(腋窝下),形成皮下荷肺癌动物模型。用游标卡尺动态测量瘤块体积。
[0091]
肿瘤体积计算公式:v=0.5
×
l
×
d2(v为肿瘤体积,l为肿瘤长径,d为肿瘤短径)。
[0092]
实施例10:胆酸修饰的口服紫杉醇纳米粒对肺癌的抑制作用
[0093]
取4~6周龄的雄性c57bl/6小鼠,按照实施例9的方法建立皮下肺癌模型。待瘤体积到100mm3后,将c57bl/6小鼠随机分组,每组6只。紫杉注射液静注组每4天给药一次,其余各口服制剂组每2天给药一次,给药剂量均为10mg/kg,静注共给药3次,口服共给药6次。试验期间记录小鼠的肿瘤体积。12天后,停止给药。对药效组实施解剖手术,取出肿瘤组织进行称量。
[0094]
表11是荷瘤小鼠接受各制剂治疗12天后肿瘤的重量统计结果。
[0095][0096]
表12是荷瘤小鼠接受各制剂治疗12天内体重统计结果。
[0097][0098]
由表11-12,图12-14可得,葡萄糖注射液口服组的肿瘤大小呈持续上升趋势,相同剂量下,胆酸修饰的口服紫杉醇纳米粒组获得和紫杉醇注射液静注相似的药效,在第12天时,胆酸修饰的口服紫杉醇纳米粒组肿瘤体积为1477.01
±
671.17mm3,紫杉醇注射液静注组肿瘤体积为1593.22
±
186.11mm3,紫杉醇注射液口服组肿瘤体积为 2411.65
±
420.37mm3,无胆酸修饰的口服紫杉醇纳米粒组肿瘤体积为1915.67
±
411.90mm3,无槲皮素的口服紫杉醇纳米粒肿瘤体积为1643.90
±
498.75mm3,可以看出本专利提供的口服紫杉醇纳米粒具有良好的抗肿瘤效果,槲皮素在药效的增强上具有一定作用。安全性方面,紫杉醇注射液静注组在后期存在体重下降趋势,而口服紫杉醇纳米粒组的体重呈上升趋势,证明本专利提供的口服紫杉醇纳米粒具有良好的安全性。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。