溶瘤病毒或与pd-1单抗联合在胰腺癌治疗上的应用
技术领域
1.本发明属于生物医药领域,具体涉及新型溶瘤病毒vg161单药在胰腺癌治疗上的应用,尤其涉及新型溶瘤病毒vg161与免疫检查点抑制剂pd-1单抗联合在胰腺癌治疗上的应用。
背景技术:
2.截至目前,世界范围内进入各期临床试验研究阶段的溶瘤病毒产品近30个。其中,全球首个获批上市的溶瘤病毒药物h101(安科瑞) 于2005年通过了国家食品药品监督管理局的批准。而直至2015 年,时隔10年后,表达粒细胞-巨噬细胞集落刺激因子 (granulocyte-macrophage colony stimulating factor,gm-csf) 的溶瘤病毒药物(t-vec)才在美国上市,成为第二款上市的溶瘤病毒产品。然而,以上产品并不携带或只携带了一个武装基因gm-csf。近年来的研究表明,gm-csf不但可以诱导肿瘤组织的髓源性抑制细胞,抑制t细胞功能,还是构成肿瘤免疫逃逸的重要因素。而在t-vec联合keytruda的i期临床研究中,t-vec注射后肿瘤组织中的treg有上升趋势。可见,单纯表达gm-csf并不是最佳策略。
3.单纯疱疹病毒是目前研究最多且抗肿瘤作用最好的溶瘤病毒之一。除去已批准上市的t-vec外,目前有近十个单纯疱疹溶瘤病毒进入临床研究阶段(见表1)。
4.表1.单纯疱疹病毒临床试验情
[0005][0006]
值得注意的是,以上病毒中除m032表达白细胞介素(interleukin, il)-12,t3011表达il-12和pd-l1单抗外,均不携带或只携带一个 gm-csf基因,属于老一代溶瘤病毒。目前,国内从事单纯疱疹溶瘤病毒研发的机构主要有北京奥源和力(orienx010)、武汉滨会(oh2) 和深圳市亦诺微(t3011)。随着抗肿瘤免疫学、病毒学和分子生物学的不断发展,以表达多个免疫刺激因子为特点的新一代溶瘤病毒正在不断涌现,是当今溶瘤病毒领域的发展趋势之一。
[0007]
人体的抗肿瘤免疫主要由获得性免疫和固有免疫两大部分组成。在机体获得性免疫应答中,免疫系统可形成一个杀伤肿瘤细胞的癌症
‑ꢀ
免疫环(cancer-immunity cycle,
cic)。在此过程中,一旦肿瘤细胞被杀死,相关抗原被释放,循环又将重新开始,进一步加强免疫系统对肿瘤细胞的识别和杀伤。如果cic中任何一个环节出现问题,都将导致这个循环的中断,从而削弱机体免疫系统的抗肿瘤免疫应答,使肿瘤发生免疫逃逸。一个理想的抗肿瘤免疫治疗药物最好能够作用到上述所有步骤,打通所有环节,最大限度发挥抗肿瘤作用。现有的研究表明,溶瘤病毒本身会对cic中的抗原释放、吸引t细胞浸润到肿瘤中以及加强t细胞对肿瘤细胞识别等几个步骤有促进作用,但无法完全覆盖。此外,机体抗肿瘤免疫的另一个重要组成部分是以nk细胞和巨噬细胞为主的固有免疫功能,也是设计抗肿瘤免疫药物需要考虑的一个重要方面。
[0008]
因此,为了打通机体获得性免疫的所有环节并激活固有免疫,充分发挥溶瘤病毒可以搭载多个基因的特点,越来越多的新一代溶瘤病毒正在尝试携带两个或两个以上具有免疫刺激或其它肿瘤杀伤功能的外源基因。代表性产品有load 703(携带cd40l和4-1bb两个基因)、 ng348(携带了cd80和cd3两个基因)以及携带pd-1抗体和il-12的重组疱疹溶瘤病毒t3011,后者刚刚获得国家药品监督管理局的新药研究申请批准。然而,以上病毒所携带的武装基因全部局限于激活获得性免疫反应,没有兼顾刺激机体固有免疫系统的效应细胞。近年来,随着对固有免疫应答的深入了解,国内外学者开始构建搭载il-5、 il-15 il-15ra或il-21的溶瘤病毒,然而这些病毒均未同时携带能够激活过继性抗肿瘤效应的细胞因子基因,均处于试验室验证阶段。
[0009]
携带4个外源性免疫调控基因的溶瘤病毒vg161正是在这样的大背景下产生的。vg161的所有外源性基因产物(il-12、il-15 il-15ra 和pd-l1阻断肽)均能被有效地释放到被感染的细胞外。其中,il-12 能够有效激活获得性免疫的效应细胞cd8 t细胞,而il-15/il-15ra 能够刺激固有免疫中的nk细胞,籍此产生协同性抗肿瘤免疫反应。此外,病毒释放的pd-l1拮抗肽能够阻断局部注射溶瘤病毒以后肿瘤细胞一过性上调表达的pd-l1和t细胞pd-1之间的作用,有利于t细胞在肿瘤局部的活化和浸润。有趣的是,我们的前期研究证实vg161具有改变肿瘤微环境,诱导特异性抗肿瘤免疫记忆和系统性抗肿瘤免疫效应的作用。
[0010]
胰腺癌独特的肿瘤微环境是其恶性程度远远高于其他肿瘤的重要原因之一,也是导致胰腺癌患者对放化疗和免疫治疗不敏感以及预后差的主要原因之一。胰腺癌的肿瘤微环境中存在大量致密的基质成分,一方面为胰腺癌细胞的生长提供了有利条件,另一方面致密的纤维组织压迫胰腺癌组织内的血管,使抗肿瘤药物无法进入癌组织发挥作用,同时致密的纤维组织阻止了cd8 t细胞、nk细胞等免疫效应细胞在肿瘤组织内的浸润,使肿瘤组织逃避免疫系统的监视。
[0011]
有研究发现,30%左右的胰腺癌患者具有pd-l1的阳性表达。但有临床数据表明,pd-1/pd-l1抑制剂单药治疗对胰腺癌患者疗效不佳,可能的主要原因是胰腺癌的肿瘤微环境中缺乏t细胞浸润。因此,增加t细胞在胰腺癌肿瘤微环境中的比例,可以改善pd-1/pd-l1抑制剂单药治疗不佳的效果,如何增强胰腺癌pd-1/pd-l1抑制剂治疗效果的研究,是胰腺癌研究的热点之一。
[0012]
从胰腺癌肿瘤微环境的特点出发,设计新的免疫治疗策略来消除胰腺癌免疫抑制环境,对于治疗胰腺癌具有重要意义。溶瘤病毒可以在肿瘤细胞内特异性复制导致肿瘤细胞直接杀伤死亡,改善周边致密的基质成分;此外病毒感染肿瘤细胞后激发并释放细胞因
子,重塑肿瘤免疫微环境、趋化免疫细胞浸润到肿瘤组织,促进“冷肿瘤”向“热肿瘤”转变。溶瘤病毒可以显著改变肿瘤微环境,吸引免疫细胞浸润的特点,联合pd-1/pd-l1抑制剂将可以起到综合治疗的作用。
[0013]
目前,尚未有文献报道溶瘤病毒联合pd-1/pd-l1单抗在胰腺癌上的应用。
技术实现要素:
[0014]
本发明在当前研究的基础上,提供一种新型溶瘤病毒vg161单药治疗胰腺癌的新医药应用,同时提供一种新型溶瘤病毒vg161与pd-1单抗在胰腺癌上联合增效应用,本发明可广泛用于一线治疗失败的中晚期胰腺癌患者以及边界可切除胰腺癌患者的新辅助治疗。
[0015]
发明人前期对新型溶瘤病毒vg161的抗肿瘤免疫原理进行研究,证实vg161具有改变肿瘤微环境,诱导特异性抗肿瘤免疫记忆和系统性抗肿瘤免疫效应的作用,作用原理图参见图1。
[0016]
本发明的第一方面,提供了新型溶瘤病毒vg161单药在治疗胰腺癌的应用。
[0017]
在细胞体外试验中,证实了vg161在感染胰腺癌细胞系bxpc-3后可以有效复制传代,并稳定表达其所携带的外源性免疫增强因子 il-12、il-15已经pd-l1拮抗肽(见图2),从而提示vg161在胰腺癌中存在改变肿瘤免疫微环境的潜能。
[0018]
因此,以新型溶瘤病毒vg161作为唯一活性成分的药物组合物,能够用于作为治疗胰腺癌的药物。
[0019]
本发明的第二方面,提供了新型溶瘤病毒vg161联合pd-1单抗在治疗胰腺癌中的理论依据。
[0020]
在细胞体内试验中,由于溶瘤病毒存在一个负面作用,即引起细胞表面pd-l1表达的升高;因此我们利用不同浓度的vg161感染胰腺癌细胞系bxpc-3后,通过elisa检测细胞表面pd-l1的表达。结果显示,骨架病毒vg160引起细胞表面pd-l1的表达高达30%,而vg161所感染的细胞表面pd-l1的表达仅10%,提示vg161所释放的pd-l1拮抗肽发挥了一定作用(见图3)。尽管如此,vg161所感染细胞的pd-l1表达仍有10%,这为vg161需进一步联用pd-1单抗提供了理论依据。
[0021]
本发明的第三方面,提供了新型溶瘤病毒vg161联合pd-1单抗在治疗胰腺中的联合应用。
[0022]
在上述理论依据的基础上,通过在免疫健全小鼠胰腺癌bxpc-3双侧移植瘤模型中,vg161及vg161与pd-1单抗联合用药组都显示了强大的溶瘤作用,不但可以有效地抑制瘤内注射侧的肿瘤,对非注射侧的肿瘤也有强烈的免疫抑制作用(见图4)。说明vg161可以启动全身性的抗肿瘤免疫反应,与pd-1单抗联用后进一步提升了抗肿瘤效果。
[0023]
进一步地,为了探究vg161改变肿瘤免疫微环境的具体机制。我们构建了免疫健全小鼠胰腺癌bxpc-3双侧移植瘤模型,予vg160、vg161 注射后,分别于第3天、第7天以及第15天取材,通过细胞流式试验以及酶联免疫斑点试验检测相关因子表达,结果提示双侧移植瘤均存在 cd8 t细胞浸润,同时ifn-γ显著高表达(见图5)。提示vg161主要通过激活效应t细胞同时招募nk细胞来改变肿瘤免疫微环境。
[0024]
本发明的第四方面,提供了一种治疗胰腺癌的药物组合物,由新型溶瘤病毒vg161以及药学上可接受的辅料组成。
[0025]
本发明的有益效果:一种新型溶瘤病毒vg161或与pd-1单抗在胰腺癌上的联合应用,在细胞体外试验中,通过elisa检测,证实vg161可在胰腺癌细胞中稳定传代并释放外源性免疫刺激因子如il-12、il-15 以及pd-l1拮抗肽;而elisa检测同样证实vg161所携带的pd-l1拮抗肽可有效抑制肿瘤细胞表面pd-l1的表达;通过免疫健全小鼠的体内试验,证实vg161单药可有效治疗胰腺癌小鼠模型中的移植瘤,联用pd-1 单抗(程序性死亡受体1)后,治疗效果进一步提升,提示vg161可有效改变肿瘤免疫微环境,而改变作用主要通过刺激和招募效应t细胞以及nk细胞来实现。本发明为胰腺癌的临床治疗提供了新的治疗方案。
附图说明
[0026]
图1是新型溶瘤病毒vg161的抗肿瘤免疫原理示意图。
[0027]
图2是vg161在体外试验中感染胰腺癌细胞系后释放外源性基因的结果图。bxpc3常见的人源胰腺癌细胞系,moi可理解为病毒浓度。 il12、il15以及pd-l1 blocker分别为vg161所表达的外源性免疫刺激因子。target gene expression指外源性基因表达浓度,越高表明表达越多。
[0028]
图3是不同浓度vg160和vg161感染bxpc-3细胞后,导致细胞表面pd-l1表达量上调的结果图。数字5和数字10分别代表moi=5、 moi=10,moi可理解为病毒浓度。vg160为骨架病毒,不表达任何外源性因子,可以理解为对照组。expression of pd-l1(%)表示pd-l1 表达比例,越高表示表达越多。
[0029]
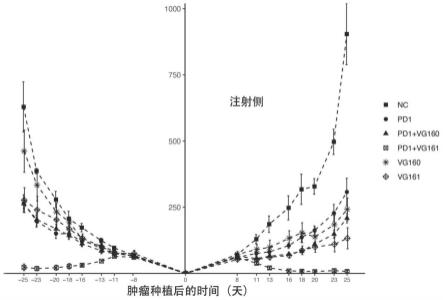
图4是vg161联用pd-1单抗在免疫健全小鼠构建的双侧荷瘤 bxpc-3胰腺癌模型上应用的作用效果图。于注射侧给药,中轴为肿瘤大小(mm3),越小说明效果越好。
[0030]
图5是免疫健全小鼠构建的双侧荷瘤bxpc-3胰腺癌模型接受 vg160以及vg161给药后相关免疫指标检测结果图。day 3、day 7、day15分别为注射后的天数。其中r侧为注射侧,l侧为非注射侧。图中%cd8t cells是指cd8 t细胞的数量,越高提示该种细胞浸润越多。 (cd45 cd3 cd8 )为该类细胞的表型。下图中ifn-γ为干扰素伽马,由nk或nkt细胞分泌。其表达越高,提示nk或nkt细胞浸润越多。
具体实施方式
[0031]
下面结合实施例和附图对本发明进行详细描述,但下列实施例不应看作对本发明范围的限制。
[0032]
为进一步阐述本发明vg161对免疫健全小鼠胰腺癌模型的治疗有效,以及在联合pd-1单抗(程序性死亡受体1)后可提高疗效的显著特征,发明人将其分解为4个实施例,逐步展开陈述,以便更好地理解。
[0033]
实施例1:新型溶瘤病毒vg161单药在胰腺癌中的稳定表达
[0034]
为了在体外试验中证实vg161可在胰腺癌细胞中稳定表达il-12、 il-15以及pd-l1拮抗肽等外源性免疫刺激因子,因此采用elisa对此进行检测。
[0035]
酶联免疫吸附测定(enzyme linked immunosorbent assay,简写 elisa)指将可溶性的抗原或抗体结合到聚苯乙烯等固相载体上,利用抗原抗体特异性结合进行免疫反应的定性和定量检测方法。这一方法的基本原理是:1.使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。2.使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或
抗体既保留其免疫活性,又保留酶的活性。在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。加入酶反应的底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅有无定性或定量分析。由于酶的催化效率很高,故可极大地放大反应效果,从而使测定方法达到很高的敏感度。
[0036]
本实施中,选取常见的人胰腺癌细胞系bxpc3,加入moi=1的 vg161,进行elisa检测。
[0037]
结果如图2所示:反映的是vg161在体外试验中感染胰腺癌细胞系后释放外源性基因的结果图。bxpc3常见的人源胰腺癌细胞系,moi可理解为病毒浓度。il12、il15以及pd-l1 blocker分别为vg161所表达的外源性免疫刺激因子。target gene expression指外源性基因表达浓度,越高表明表达越多。elisa结果显示,vg161在感染bxpc-3细胞后,可稳定表达il-12、il-15以及pd-l1拮抗肽,其中pd-l1拮抗肽表达值最高,达到1000pg/ml以上。
[0038]
实施例2:新型溶瘤病毒vg161联合pd-1单抗在治疗胰腺癌中的理论依据
[0039]
由于溶瘤病毒存在一定负面作用,其感染肿瘤细胞后,可导致肿瘤细胞表面的pd-l1的表达上调(达到1000pg/ml以上)。而pd-l1 是众所周知的免疫检测点抑制剂,可影响免疫治疗效果。因此,vg161 所携带的pd-l1拮抗肽主要用于在一定程度上抵消该负面影响。而剩余的pd-l1表达则需要pd-1单抗进行协同抑制。通过elisa检测vg160 和vg161感染肿瘤细胞后,表面pd-l1的改变。
[0040]
选取常见的人胰腺癌细胞系bxpc3,分别加入moi=5、moi=10的 vg161,培养箱培养48h后收集上清和细胞,进行elisa测定试验,计算得出vg160与vg161感染后细胞表面pd-l1的表达情况。
[0041]
结果如图3所示:反映不同浓度vg160和vg161感染bxpc-3细胞后,导致细胞表面pd-l1表达量上调的结果图。数字5和数字10分别代表 moi=5、moi=10,moi可理解为病毒浓度。vg160为骨架病毒,不表达任何外源性因子,可以理解为对照组。expression of pd-l1(%)表示 pd-l1表达比例,越高表示表达越多。elisa结果显示,当给药浓度达到moi=10时,vg161所释放的pd-l1拮抗肽可显著抑制肿瘤细胞表面 pd-l1的表达,抑制率同比vg160下降约65%,抑制效果显著。
[0042]
实施例3:新型溶瘤病毒vg161联合pd-1单抗在治疗胰腺癌中的联合应用
[0043]
基于实施例2获得需要结合pd-1单抗进行协同抑制的理论依据后,由于在体内进行药效学研究是验证药物疗效的重要过程,通过在免疫健全小鼠上构建双侧胰腺癌皮下瘤模型并进行瘤内注射,从而验证 vg161单药以及与pd-1联用方案在实体瘤中的治疗效果。
[0044]
在免疫健全小鼠双侧腋下注射bxpc3细胞悬液,一般于2周后成瘤,待瘤体大小达到800mm3时进行给药治疗。共设置nc对照组、pd-1单药组、vg160单药组、vg161单药组、pd-1联用vg160组以及pd-1联用vg161组;报告60与vg161予右侧瘤内注射给药,pd-1单抗予腹腔注射给药。观察指标包括肿瘤体积变化、小鼠体重,每3天测量1次,记录小鼠生存曲线。观察终点包括小鼠死亡或小鼠肿瘤体积超过 2000mm3。
[0045]
结果如图4所示,图4反映的是vg161联用pd-1单抗在免疫健全小鼠构建的双侧荷瘤bxpc-3胰腺癌模型上应用的作用效果图。于注射侧给药,中轴为肿瘤大小(mm3),越小说
明效果越好。从图4可以看出,在免疫健全胰腺癌小鼠模型中,nc对照组随着时间增加肿瘤细胞不断繁殖,在25天后呈现最高值,达到900;而pd-1单药组、vg160 单药组、vg161单药组和pd-1联用vg160组虽然随着时间增加肿瘤细胞也呈上升趋势,但总量相比nc对照组数量低很多,处在150~300之间,说明给药有抑制胰腺癌细胞扩散的效果;进一步地,vg161单药治疗效果优于pd-1单抗单药以及vg160单药;进一步地,vg161联用pd-1 单抗后,其肿瘤细胞随着时间增加(在第8天后)不断降低,并在16 天达到最低值,接近于0,到后面25天仍处于较低的水平,证实vg161 联用pd-1单抗治疗胰腺癌效果进一步提升。
[0046]
实施例4:vg161改变免疫微环境的具体机制
[0047]
为了探索vg161改变免疫微环境的具体机制,分别采用细胞流式和 elisopt试验进行检测。
[0048]
流式细胞术工作原理是在细胞分子水平上通过单克隆抗体对单个细胞或其他生物粒子进行多参数、快速的定量分析。它可以高速分析上万个细胞,并能同时从一个细胞中测得多个参数,具有速度快、精度高、准确性好的优点,是当代最先进的细胞定量分析技术之一。随着酶联免疫分析技术在医学及生物学领域的广泛应用,使体外检测各种细胞因子及抗体研究有了新的突破。在研究免疫应答机制时以往常用用酶联免疫吸附法(elisa)检测体液中游离的细胞因子(ck)或抗体,但由于游离的循环抗体或ck的半哀期不同,使之在体液中不断的被代谢或与靶器官结合,而不能确切的反映体内的抗体及ck的水平。 80年代,国外的科研工作者根据elisa技术的基本原理,建立了体外检测特异性抗体分泌细胞和ck分泌细胞的固相酶联免疫斑点技术 (elispot)。因其具有较高的特异性和敏感性,目前正被国内外广泛应用,对探索自身免疫系统疾病发病机制具有重要意义。
[0049]
在免疫健全小鼠双侧腋下注射bxpc3细胞悬液,一般于2周后成瘤,待瘤体大小达到800mm3时进行给药治疗。共设置nc对照组、vg160单药组、vg161单药组。分别于给药后第3天、第7天和第15天处死小鼠并留取肿瘤标本。通过细胞流式试验以及elisopt试验检测相关免疫细胞浸润情况。
[0050]
结果如图5所示:图5反映的是免疫健全小鼠构建的双侧荷瘤 bxpc-3胰腺癌模型接受vg160以及vg161给药后相关免疫指标检测结果图。day 3、day 7、day 15分别为注射后的天数,其中r侧为注射侧, l侧为非注射侧。图中%cd8 t cells是指cd8 t细胞的数量,越高提示该种细胞浸润越多。(cd45 cd3 cd8 )为该类细胞的表型。图中ifn
‑ꢀ
γ为干扰素伽马,由nk或nkt细胞分泌。其表达越高,提示nk或nkt细胞浸润越多。图5中的流式细胞试验以及elisopt试验结果显示,vg161 可有效动员cd8 t细胞以及nk/nkt细胞,从而改变肿瘤免疫微环境。
[0051]
从上述实施例得出,vg161单药具有治疗胰腺癌的效果,同时其与 pd-1单抗联用将进一步提高在胰腺癌中的治疗效果。
[0052]
以上列举的仅是本发明的具体实施方式。显然,本发明不限于以上实施方式。本领域的普通技术人员能从本发明公开的内容中直接导出或联想到的所有变形,均应认为是本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。