1.本发明属于生物医药技术领域,具体涉及一种复合材料及制备方法和用途。
背景技术:
2.近几十年来,纳米技术在生物医学运载工具领域的应用越来越受到人们的关注。纳米载体作为纳米技术的重要组成部分,具有持续释放、减少毒副作用的优势。纳米载体中,如介孔二氧化硅纳米颗粒具有结构稳定、孔径可调、孔容大、比表面积大、生物相容性好等优点,近年来被认为是治疗、药物和诊断等领域的理想载体。然而,由于介孔二氧化硅纳米微球的固有脆性,其与多孔钛合金或多孔钛之间会产生应力。
3.骨骼肌约占人体体重的45%,负责维持运动功能,在轻微损伤和运动后,骨骼肌有内在的再生能力,在基底层下肌纤维表面的卫星细胞的帮助下。然而,假肢重建手术后骨骼肌的再生往往受到阻碍。目前,由于严重的骨关节炎、外伤、强直和自身免疫性疾病等终末期关节疾病导致解剖结构或关节功能严重受损,通常需要全关节置换(total joint replacement,tjr)治疗。tjr通常以骨骼肌质量损失为特征,导致严重的肌肉功能损害和审美缺陷。
4.然而,目前外科医生通常只专注于用假体置换骨,而不尝试假体周围肌肉组织的再附着或再生。髋关节外展肌缺乏导致全髋关节置换术后髋关节不稳定和脱位同样,全肩关节置换术可能会导致肩胛下肌功能的永久性丧失,患者在全膝关节置换术后往往会因为股四头肌受损而导致功能受限侧翼肌和咬肌的丧失也会导致全颞下颌关节置换术后下颌活动受限和咬合力降低,伴假体周围纤维囊性结构肿块。综上所述,tjr术后由于肌肉组织与假体之间失去联系而导致的运动功能障碍是非常常见的。因此,迫切需要在修复过程中使假体周围肌肉再生,以恢复正常的关节运动功能。
技术实现要素:
5.鉴于以上现有技术中存在的问题,本发明的目的在于提供一种复合材料及制备方法和用途,用于解决现有技术中的问题。
6.为实现上述目的及其他相关目的,本发明是通过以下技术方案获得的。
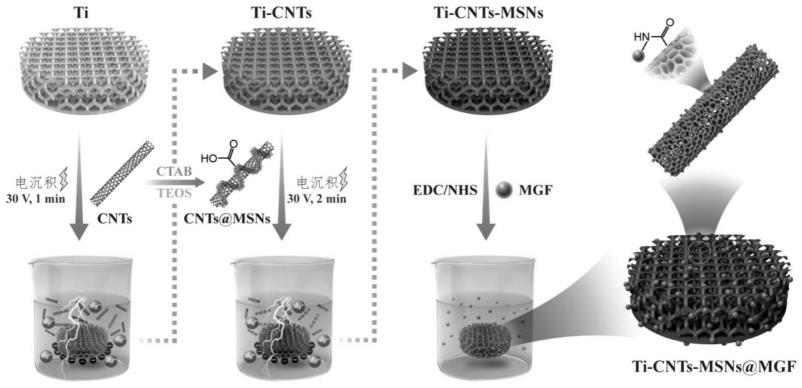
7.本发明的目的之一在于保护一种复合材料,所述复合材料包括多孔钛合金或多孔钛、包裹在所述多孔钛合金或多孔钛外的碳纳米管层、包裹在所述碳纳米管层外的羧基介孔硅包覆碳纳米管层。
8.在本技术的某些实施方式中,1)中,所述多孔钛合金或多孔钛的孔隙率为60~90%。优选地,所述多孔钛合金或多孔钛通过magics软件设计,呈钻石型多孔结构,导出stl格式数据后进行3d打印得到。优选地,孔隙率为80%。
9.在本技术的某些实施方式中,1)中,所述多孔钛合金包含钛、铝和钒。具体地,为ti6al4v。
10.在本技术的某些实施方式中,所述碳纳米管层的厚度为0.6~1.0μm。在某个优选
的实施方式中,为0.8μm。
11.在本技术的某些实施方式中,所述羧基介孔硅包覆碳纳米管层的厚度为8~10μm。在某个优选的实施方式中,为7.8μm。
12.在本技术的某些实施方式中,所述羧基介孔硅包覆碳纳米管的制备方法为:
13.1-1)碳纳米管、模板剂、硅源和碱在溶剂中进行第一反应,得到羟基介孔硅包覆碳纳米管;
14.1-2)所述羟基介孔硅包覆碳纳米管和3-氨丙基三乙氧基硅烷进行第二反应,得到氨基介孔硅包覆碳纳米管;
15.1-3)所述氨基介孔硅包覆碳纳米管与酸酐进行第三反应,得到所述的羧基介孔硅包覆碳纳米管。
16.在本技术的某些实施方式中,所述模板剂选自十六烷基三甲基溴化铵、十六烷基三甲基氯化铵、十四烷基三甲基氯化铵、十四烷基三甲基溴化铵、十八烷基三甲基溴化铵和十八烷基三甲基氯化铵中的至少一种。
17.优选地,所述模板剂为十六烷基三甲基溴化铵(ctab)。
18.在本技术的某些实施方式中,所述硅源选自正硅酸乙酯、正硅酸甲酯、四丙氧基硅烷、正硅酸钠和硅溶胶中的一种。
19.优选地,所述硅源为正硅酸乙酯(teos)。
20.在本技术的某些实施方式中,所述酸酐包括琥珀酸酐或马来酸酐。
21.优选地,所述酸酐为琥珀酸酐。
22.在本技术的某些实施方式中,所述碳纳米管的直径为20~50nm,长径比≥100。
23.在本技术的某些实施方式中,所述碳纳米管和模板剂的质量比为1:(30~80)。
24.在本技术的某些实施方式中,所述模板剂与硅源的质量体积比为(200~700)mg:0.1ml。
25.在本技术的某些实施方式中,所述第一反应的温度为40~80℃。
26.在本技术的某些实施方式中,所述硅源和3-氨丙基三乙氧基硅烷的体积比为1:(2~8)。
27.在本技术的某些实施方式中,所述3-氨丙基三乙氧基硅烷和酸酐的体积质量比为(1~5)ml:1g。
28.本发明的目的之二在于保护如上文所述复合材料的制备方法,包括以下步骤:
29.1)以多孔钛或多孔钛合金作为阴极,以铝作为阳极,以含有碳纳米管的溶液作为第一电解液,使所述第一电解液中的碳纳米管电沉积于所述多孔钛或多孔钛合金的表面,得到第一产物;
30.2)以所述第一产物作为阴极,以铝作为阳极,以含有羧基介孔硅包覆碳纳米管的溶液作为第二电解液,使所述第二电解液中的羧基介孔硅包覆碳纳米管电沉积于所述第一产物的表面,得到所述的复合材料。
31.本发明的复合材料具有良好的蛋白负载/释放特性,能改善细胞微环境,促进组织再生。
32.在本技术的某些实施方式中,1)中,所述多孔钛合金或多孔钛的孔隙率为60~90%。优选地,所述多孔钛合金或多孔钛通过magics软件设计,呈钻石型多孔结构,导出stl
格式数据后进行3d打印得到。优选地,孔隙率为80%。
33.在本技术的某些实施方式中,1)中,所述多孔钛合金包含钛、铝和钒。具体地,为ti6al4v。
34.在本技术的某些实施方式中,1)中,所述第一电解液包含碳纳米管、镁盐和乙醇。
35.优选地,以第一电解液的总体积为基准计,所述碳纳米管的浓度为0.1~0.6mg/ml。
36.更优选地,所述碳纳米管的浓度可以为0.1~0.3mg/ml,也可以为0.2~0.5mg/ml,也可以为0.4~0.6mg/ml。在某个优选的实施方式中,为0.3mg/ml。
37.优选地,以第一电解液的总体积为基准计,所述硝酸镁的浓度为0.5~12mm。
38.更优选地,所述镁盐的浓度可以为0.5~0.1mm,也可以为08~1.6mm,也可以为1.5~2mm。在某个优选的实施方式中,为1mm。
39.优选地,所述镁盐选自硝酸镁。
40.在本技术的某些实施方式中,2)中,所述第二电解液包含羧基介孔硅包覆碳纳米管、镁盐和乙醇。
41.优选地,以第二电解液的总体积为基准计,所述羧基介孔硅包覆碳纳米管的浓度为0.2~1.0mg/ml。
42.更优选地,所述羧基介孔硅包覆碳纳米管的浓度可以为0.2~0.6mg/ml,也可以为0.4~0.8mg/ml,也可以为0.6~1.0mg/ml。在某个优选的实施方式中,为0.6mg/ml。
43.优选地,以第二电解液的总体积为基准计,所述硝酸镁的浓度为0.5~2mm。
44.更优选地,所述硝酸镁的浓度可以为0.5~0.1mm,也可以为08~1.6mm,也可以为1.5~2mm。在某个优选的实施方式中,为1mm。
45.优选地,所述镁盐选自硝酸镁。
46.电沉积技术是通过带电粒子在外加电场下的电泳运动来实现的,这需要悬浮液的稳定性和分散良好,以提高电沉积的效率,在电解液中添加镁盐,如mg(no3)2为正电荷剂,被添加到乙醇溶剂中,能减少电解质的聚集。
47.在本技术的某些实施方式中,所述电沉积的电压为20~40v。
48.优选地,所述电沉积的电压可以为20~32v,也可以为25~35v,也可以为28~40v。
49.在某个优选的实施方式中,为30v。
50.在本技术的某些实施方式中,所述电沉积的时间为0.5~4min。
51.优选地,所述电沉积的电压可以为0.5~4min,也可以为0.5~4min,也可以为0.5~4min。
52.在某个优选的实施方式中,为1min、2min。
53.在本技术的某些实施方式中,所述羧基介孔硅包覆碳纳米管的制备方法为:
54.1-1)在碱性条件下,碳纳米管、模板剂和硅源在溶剂中进行第一反应,得到羟基介孔硅包覆碳纳米管;
55.1-2)所述羟基介孔硅包覆碳纳米管和3-氨丙基三乙氧基硅烷进行第二反应,得到氨基介孔硅包覆碳纳米管;
56.1-3)所述氨基介孔硅包覆碳纳米管与酸酐进行第三反应,得到所述的羧基介孔硅包覆碳纳米管。
57.优选地,所述碳纳米管和模板剂的质量比为1:(30~80)。
58.更优选地,所述碳纳米管和模板剂的质量比可以为1:(30~55),也可以为1:(50~70),也可以为1:(65~80)。在某个优选的实施方式中,为1:50。
59.优选地,所述模板剂与硅源的质量体积比为(200~700)mg:0.1ml。
60.更优选地,所述模板剂与硅源的质量体积比可以为(200~450)mg:0.1ml,也可以为(400~650)mg:0.1ml,也可以为(550~700)mg:0.1ml。在某个优选的实施方式中,为500mg:0.1ml。
61.优选地,所述硅源和3-氨丙基三乙氧基硅烷的体积比为1:(2~8)。
62.更优选地,所述硅源和3-氨丙基三乙氧基硅烷的体积比为1:(2~5),也可以为1:(4~8),也可以为1:(6~10)。在某个优选的实施方式中,为1:5。
63.优选地,所述3-氨丙基三乙氧基硅烷和酸酐的体积质量比为(1~5)ml:1g。
64.更优选地,所述模板剂和酸酐的质量比可以为(1~3)ml:1g,也可以为(2~4)ml:1g,也可以为(3~5)ml:1g。在某个优选的实施方式中,为2.5ml:1g。
65.优选地,1-1)中,所述模板剂选自十六烷基三甲基溴化铵(ctab)、十六烷基三甲基氯化铵、十四烷基三甲基氯化铵、十四烷基三甲基溴化铵、十八烷基三甲基溴化铵和十八烷基三甲基氯化铵中的至少一种。
66.更优选地,所述模板剂为十六烷基三甲基溴化铵(ctab)。
67.优选地,1-1)中,所述碱性条件的ph值为8.0~12.0。
68.优选地,1-1)中,所述碳纳米管的直径为20-50nm,长径比≥100。
69.优选地,1-1)中,所述硅源选自正硅酸乙酯(teos)、正硅酸甲酯(tmos)、四丙氧基硅烷(tpos)、正硅酸钠(na4o4si)和硅溶胶中的一种。
70.更优选地,所述硅源为正硅酸乙酯(teos)。
71.优选地,1-1)中,所述第一溶剂为水或乙醇。
72.优选地,将碳纳米管、模板剂和去离子水进行混合,超声分散5~720min,得到分散液;采用碱将所述分散液调节为碱性,加入硅源的醇溶液进行第一反应。
73.优选地,1-2)中,所述第一反应的温度为40~80℃。
74.更优选地,所述第一反应的温度可以为40~55℃,也可以为50~70℃,也可以为60~80℃。在某个优选的实施方式中,为60℃。
75.优选地,1-2)中,所述第一反应的时间为6~18h。
76.更优选地,所述第二反应的时间可以为6~12h,也可以为10~16h,也可以为15~18h。在某个优选的实施方式中,为12h。
77.优选地,1-3)中,所述第二反应的温度为40~80℃。
78.更优选地,所述第三反应的温度可以为40~55℃,也可以为50~70℃,也可以为60~80℃。在某个优选的实施方式中,为60℃。
79.优选地,1-3)中,所述第二反应的时间为6~18h。
80.更优选地,所述第二反应的时间可以为6~12h,也可以为10~16h,也可以为15~18h。在某个优选的实施方式中,为13h。
81.优选地,1-4)中,所述酸酐包括琥珀酸酐或马来酸酐。
82.更优选地,所述酸酐为琥珀酸酐。
83.优选地,1-4)中,所述第三反应的时间为20~28h。
84.更优选地,所述第三反应的时间可以为20~25h,也可以为23~27h,也可以为24~28h。
85.在某个优选的实施方式中,为24h。
86.本发明的目的之三在于保护如上文所述的复合材料在制备生物医用材料中的用途。
87.在本技术的某些实施方式中,所述用途包括如下中的至少一项:
88.d1)制备促进细胞迁移的生物医用材料;
89.d2)制备促进血管生成的生物医用材料;
90.d3)制备促进细胞增殖的生物医用材料;
91.d4)制备促进细胞分化的生物医用材料。
92.优选地,所述的细胞为成肌细胞。
93.本发明的目的之四在于保护一种生物医用材料,所述生物医用材料包括如上文所述的复合材料和生长因子。
94.在本技术的某些实施方式中,所述生长因子选自mgf。
95.在本技术的某些实施方式中,所述复合材料通过酰胺键与所述生长因子偶联。
96.本发明的目的之五在于保护如上文所述生物医用材料的制备方法,包括如下步骤:
97.将所述复合材料、nhs和eds混合,加入生长因子进行偶联,得到所述的生物医用材料。
98.在本技术的某些实施方式中,所述偶联的时间为0.5~4h。
99.优选地,所述偶联的时间可以为0.5~2h,也可以为1~3h,也可以为2~4h。在某个优选的实施方式中,为2h。
100.在本技术的某些实施方式中,所述偶联的温度为20~45℃。
101.优选地,所述第二反应的时间可以为20~35℃,也可以为30~40℃,也可以为35~45℃。在某个优选的实施方式中,为37℃。本发明的复合材料通过电化学沉积技术,在多孔钛合金或多孔钛的表面首先电沉积一层碳纳米管(cnts),随后在碳纳米管层上再电沉积一层包绕着羧基介孔硅包覆碳纳米管层(cnts@msns-cooh)。羧基介孔硅包覆碳纳米管层(cnts@msns-cooh)的电镜图显示,沿着单壁碳纳米管呈现出有序的多孔结构,并且很少观察到游离的单分散二氧化硅。碳纳米管层的理化特性,缓解了介孔二氧化硅微球和多孔钛合金或多孔钛之间的应力。本发明的复合材料具有良好的亲水性,且无生物毒性,并利用介孔二氧化硅微球(msns)的比表面积大的特性能作为生长因子的优良载体。此外,本发明还提供来了一种生物医学材料,由复合材料与生长因子偶联形成,其在体外能促进细胞的增殖和分化,提高伤口愈合的速度以及增加生肌基因和蛋白的表达,在体内增强成肌细胞分化,导致肌管形成,并改善肌肉衍生的力学性能。
102.与现有技术相比,本发明具有以下有益效果:
103.1.本发明的复合材料包括多孔钛合金或多孔钛、包裹在多孔钛合金或多孔钛外的碳纳米管层、包裹在所述碳纳米管层外的羧基介孔硅包覆碳纳米管层。利用羧基介孔硅包覆碳纳米管层中介孔二氧化硅微球(msns)的比表面积大的特性,复合材料能作为生长因子
leu-ser-thr-asn-lys-lys-thr-lys-leu-gln-arg-arg-arg-lys-gly-ser-thr-phe-glu-glu-his-lys。
139.pbs为磷酸缓冲液,10mm,ph值为6.8。
140.实施例1羧基介孔硅包覆碳纳米管的制备
141.本实施例中,制备羧基介孔硅包覆碳纳米管(标记为cnts@msns-cooh),包括如下:
142.1.1用天平称取500mg ctab(模板剂)、10mg cnts于50ml离心管中,加入10ml超纯水,在室温下超声震荡3h。使用超声细胞粉碎机对超声后的溶液进行超声以获得更稳定的分散液,条件为冰水浴,每工作2s间隔2s,总时间1h,得到分散液;将分散液、90ml超纯水和0.1ml 2m naoh溶液混合均匀后加入三口烧瓶,在60℃水浴预热10min,随后缓慢滴加0.5ml的teos-乙醇混合溶液,其中teos-乙醇混合溶液中teos:无水乙醇的体积比为1:4,搅拌30s后将反应物于60℃水浴锅中停止搅拌进行第一反应12h,得到羟基介孔硅包覆碳纳米管(标记为cnts@msns)。
143.1.2步骤1.1得到的羟基介孔硅包覆碳纳米管(cnts@msns)中继续加入0.5ml的aptes搅拌进行第二反应1h,老化12h后取出三口烧瓶自然冷却至室温,得到氨基介孔硅包覆碳纳米管(标记为cnts@msns-nh2)。
144.1.3将步骤1.2得到的氨基介孔硅包覆碳纳米管(cnts@msns-nh2)离心,并用乙醇洗一次后分散为20ml,滴加到装有琥珀酸酐乙醇溶液的离心管中,搅拌进行第三反应24h,离心弃上清液,然后再用无水乙醇清洗沉淀2次,最后将所得颗粒状沉淀分散到20ml无水乙醇中得到分散液,将分散液超声震荡分散30min,加入大约20mg硝酸铵超声处理2h以除模板剂,得到羧基介孔硅包覆碳纳米管(标记为cnts@msns-cooh)。其中,琥珀酸酐乙醇溶液由0.2g琥珀酸酐与20ml无水乙醇,超声溶解20min,直至琥珀酸酐完全溶解,获得。
145.使用zetasizer纳米仪器(malvern,uk)在298k下评估羟基介孔硅包覆碳纳米管(cnts@msns)、氨基介孔硅包覆碳纳米管(cnts@msns-nh2)和羧基介孔硅包覆碳纳米管(cnts@msns-cooh)的zeta电位。
146.图2为本实施例羟基介孔硅包覆碳纳米管(cnts@msns)、氨基介孔硅包覆碳纳米管(cnts@msns-nh2)和羧基介孔硅包覆碳纳米管(cnts@msns-cooh)的zeta电位。
147.从图2可知,羟基介孔硅包覆碳纳米管(cnts@msns)、氨基介孔硅包覆碳纳米管(cnts@msns-nh2)和羧基介孔硅包覆碳纳米管cnts@msns-cooh分散性都很均匀。通过测定ph 7.0下的zeta电位来测量表面电荷。羟基介孔硅包覆碳纳米管(cnts@msns)具有负的zeta电位(-20.8-22.5mv);而经过aptes处理后,羟基端转变为氨基端时,氨基介孔硅包覆碳纳米管(cnts@msns-nh2)的zeta电位转变为正的zeta电位( 32.2- 33.8mv);经琥珀酸酐处理后,将氨基端转化为羧基端,得到羧基介孔硅包覆碳纳米管(cnts@msns-cooh),其具有负的zeta电位(-21.6~-22.5mv),有利于后续电沉积、促进生长因子的偶联。
148.图3为本实施例中羧基介孔硅包覆碳纳米管(cnts@msns-cooh)的透射电镜图。
149.从图3可知,沿着单壁碳纳米管呈现出有序的多孔结构,并且很少观察到游离的单分散二氧化硅。
150.实施例2复合材料和生物医用材料的制备
151.本实施例中,制备复合材料和生物医用材料。包括如下:
152.1、采用电沉积法制备复合材料
153.1.1配置10mm mg(no3)2的乙醇溶液,超声至完全溶解。
154.1.2将1ml本实施例中步骤1.1得到的10mm mg(no3)2乙醇溶液、0.5ml 0.6mg/ml cnts乙醇溶液和8.5ml乙醇超声混合均匀并作为电解液,以多孔钛合金作为阴极,以铝板作为阳极,在烧杯中,于30v电压下,沉积1min,得到第一产物(标记为ti-cnts)。
155.1.3将1ml本实施例中步骤1.1得到的10mm mg(no3)2乙醇溶液、0.25ml 2.4mg/ml实施例1得到羧基介孔硅包覆碳纳米管(标记为cnts@msns-cooh)和8.75ml乙醇超声混合均匀,以本实施例中步骤1.2得到的第一产物(标记为ti-cnts)作为阴极,以铝板作为阳极,在烧杯中,于30v电压下,沉积2min,得到复合材料(标记为ti-cnts-msns)。复合材料包括多孔钛合金或多孔钛、包裹在多孔钛合金或多孔钛外的碳纳米管层、包裹在碳纳米管层外的羧基介孔硅包覆碳纳米管层,碳纳米管层的厚度为0.8μm,羧基介孔硅包覆碳纳米管层的厚度为7.8μm。
156.2、复合材料(ti-cnts-msns)表面偶联mgf制备生物医用材料
157.2.1取本实施例步骤1.3得到的复合材料(ti-cnts-msns),用pbs清洗2-3遍。
158.2.2加入预先配置好的nhs(50mg/ml)和edc(50mg/ml),1:1混合,置于摇床上15min,活化偶联复合材料(标记为ti-cnts-msns)表面羧基。
159.2.3吸去上清,用pbs清洗2-3遍。
160.2.4加入1ml 1000ng/ml mgf溶液,置于37℃摇床上2h后,弃多余上清,得到生物医用材料(ti-cnts-msns@mgf)。
161.图4为本实施例中钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)元素分析图。
162.从图4可知,与钛合金(ti)相比,在第一产物(ti-cnts)中,检测到元素c,说明碳纳米管层成功沉积于多孔钛合金表面;与第一产物(ti-cnts)相比,在复合材料(ti-cnts-msns)中检测到si,说明羧基介孔硅包覆碳纳米管(cnts@msns-cooh)中的介孔硅沉积于第一产物(ti-cnts)上;与复合材料(ti-cnts-msns)相比,在生物医用材料(ti-cnts-msns@mgf)中检测到n,说明生长因子mgf沉积于复合材料上。此外,在第一产物(ti-cnts)和复合材料(ti-cnts-msns)均检测到元素mg,mg
2
的加入降低了还原电位,使电沉积过程更加容易。此外,涂层上的mg能作为粘合剂,提高碳纳米管层与多孔钛合金的粘附性能,羧基介孔硅包覆碳纳米管(标记为cnts@msns-cooh)与第一产物(ti-cnts)的粘附性能。
163.图5为本实施例中钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)的xps图。
164.从图5可知,与钛合金(ti)相比,本发明的生物医用材料(ti-cnts-msns@mgf)中出现si峰(si 2s:si 2p)和n峰(n1s),新增的硅元素(si)来源于msns,新增的氮元素(n)来源于mgf,说明本发明的生物医用材料(ti-cnts-msns@mgf)负载生长因子mgf制备成功。
165.图6为本实施例中钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)的高分辨率c1s xps图。
166.从图6可知,键能峰为284.8、285.7、286.6和288.5ev,分别对应c-c、c-n/c-o、n-c=0和o-c=o基团中的碳,复合材料(ti-cnts-msns)中酰胺键增加;与钛合金(ti)和第一产物(ti-cnts)相比,由于cnts@msns-cooh的修饰,复合材料(ti-cnts-msns)中o-c=o的含量增加。经edc/nhs交联后ti-cnts-msns@mgf的o-c=o含量大幅降低,而n-c=o含量大幅增
加,表明羧基参与交联,并通过edc/nhs介导的聚合与mgf反应形成酰胺键。
167.图7为本实施例中钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)的扫描电镜图。第一行为300μm下的扫描电镜图,第二行为1μm下的扫描电镜图。
168.从图7可知,300μm下的电镜图中,钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)的多孔结构没有本质区别;1μm下的电镜图中,尽管碳纳米管是无机的,但单壁碳纳米管均匀地覆盖在钛合金表面,形成了一个具有适当机械弹性和强范德华相互作用的网络缓冲层。复合材料(ti-cnts-msns)中有介孔二氧化硅沉积于第一产物的表面,且有介孔二氧化硅的微孔;在生物医用材料(ti-cnts-msns@mgf)表面,mgf填充了二氧化硅的微孔。说明本发明的复合材料(ti-cnts-msns)具有纳米/介观结构,具有良好的生物活性物质负载能力。
169.实施例3接触角考察
170.本实施例中,对实施例2得到的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)进行亲水性考察,包括如下:
171.1)分别将实施例2得到的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)置于工作台上。
172.2)利用微量进样器调整液滴的量,使在针头形成液滴,体积为1μl左右。转动旋钮使工作台上移,让试样表面与液滴接触,再下移工作台,试样上即可留下液滴。
173.3)调整水平线位置,采用接触角仪(jy-82b,kruss,德国)测量接触角的大小。
174.同时,以钛合金(ti)、第一产物(ti-cnts)作为对照组,进行接触角实验。
175.图8为本实施例中钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)的接触角实验结果图。
176.从图8可知,本发明的生物医用材料(ti-cnts-msns@mgf)表面的接触角为37.4
°±
2.8
°
;复合材料(ti-cnts-msns)接触角为42.4
°±
3.1
°
,第一产物(ti-cnts)的接触角为119.5
°±
4.4
°
,而未经表面改性的钛合金表面的接触角为128.1
°±
6.4
°
。由疏水到亲水的转变,表明疏水的钛合金和碳纳米管被亲水的msn修饰,从而使得生物医用材料(ti-cnts-msns@mgf)和复合材料(ti-cnts-msns)具备更好的亲水性,从而有利于细胞附着。
177.实施例4释放性考察
178.本实施例中,对实施例2得到的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)进行体外释放考察,包括如下:
179.将实施例2得到的生物医用材料(ti-cnts-msns@mgf),浸泡在1ml 37℃的ph值为7.4的pbs中,每日收集上清液并更换pbs,采用elisa检测上清液中mgf的含量,步骤如下:
180.(1)分别设空白孔,标准孔,待测样品孔。在酶标包被板上加样50μl。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动摇匀。
181.(2)温育:用封板膜封板后置37℃温育30min。
182.(3)洗涤:小心揭去封板膜,弃去液体,甩干,每孔加满洗涤液,静置30s后弃去,重复5次。
183.(4)加酶:每孔加入酶标试剂50μl。
184.(5)温育:用封板膜封板后置37℃温育30min。
185.(6)洗涤:小心揭去封板膜,弃去液体,甩干,每孔加满洗涤液,静置30s后弃去,重复5次。
186.(7)显色:每孔加入显色剂,轻轻震荡混匀,37℃避光显色10-20min。
187.(8)终止:每孔加终止液50μl,终止反应。
188.(9)测定:以空白孔调零,450nm波长测量各孔的吸光度。
189.图9为本实施例中生物医用材料(ti-cnts-msns@mgf)体外释放性考察实验结果图。
190.从图9可知,mgf在第3天的累积释放率为20%,第12天的累积释放率为50%,这种爆发性释放归因于mgf被吸附于单分散二氧化硅微球的外部孔中,从而有利于在体内达到有效浓度。内偶联mgf驻留在中孔中,30天后缓释率稳定为70%。表明本发明的生物医用材料(ti-cnts-msns@mgf)实现了mgf的长效释放。
191.实施例5对细胞的增殖和分化研究
192.本实施例中,考察实施例2得到的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)对成肌细胞增殖和分化的影响,以及对伤口愈合的影响。包括如下:
193.1、对细胞的增殖影响
194.c2c12成肌细胞,购买自中科院上海细胞库。将c2c12成肌细胞以5
×
104个细胞接种于分别铺设有钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)的24孔培养板里,加入完全培养基培养(10%胎牛血清),于37℃培养箱和5%co2分别孵育1和3天。随后,用pbs洗涤细胞,然后用钙黄素am处理细胞,使用钙黄素/pi检测试剂盒(beyotime biotechnology,shanghai)根据说明书检测活细胞。37℃黑暗孵育30分钟后,用pbs清洗细胞,并在荧光显微镜下观察(奥林巴斯公司)。
195.钙黄素细胞染色步骤(染色试剂盒购自碧云天):
196.(1)将细胞用pbs洗涤1遍
197.(2)加入适当体积的calcein检测工作液,37℃避光孵育30min
198.(3)孵育结束后,在荧光显微镜下观察染色效果,拍照。
199.同时,以钛合金(ti)、第一产物(ti-cnts)作为对照组,进行肌细胞增殖和分化实验。
200.图10为本实施例中成肌细胞分别在钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)表面培养1d和3d后的荧光显微镜图。第一行是第1天的细胞染色;第二行是第3天的细胞染色。
201.从图10可知,培养3d后,本发明的生物医用材料(ti-cnts-msns@mgf)的活细胞数高于钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns),说明本发明的生物医用材料(ti-cnts-msns@mgf)释放的mgf促进了细胞的增殖,为细胞生长提供了平台。2、对细胞的分化影响。
202.2、对细胞分化的影响
203.将c2c12成肌细胞以5
×
104个接种于钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)上,观察c2c12细胞在不同材料上的粘附和分化形态。
204.细胞培养2d或7d后,用2.5%戊二醛固定2h,然后用不同浓度的乙醇脱水。用扫描
电镜(日立s-4800,日本)观察了样品溅射镀金膜后的细胞形态。if染色时,4%多聚甲醛固定后,0.5-1%triton x-100渗透性作用15min。室温下用5%pbs稀释的bsa封闭样品60分钟,4℃与抗b-actin一抗孵育过夜。第二天,与荧光分子偶联二抗在37℃孵育1h。细胞核用dapi(sigma-aldrich,usa)在黑暗中标记10分钟。图像在lscm(carl zeiss,germany)下拍摄。
205.图11为本实施例中成肌细胞分别在钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)表面培养2d的扫描电镜图。
206.从图11可知,成肌细胞在本发明的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)呈扩散分布,充分伸展,多边形形状,具有更多的细胞伪足。而钛合金(ti)和第一产物(ti-cnts)表面的细胞呈细长的纺锤状,细胞面积有限,伪足较少,说明钛合金(ti)和第一产物(ti-cnts表面的细胞粘附较少。介孔二氧化硅和生长因子mgf增加了成肌细胞与多孔钛合金的粘附。
207.图12为本实施例中c2c12细胞第7天分化成肌管的显微图。
208.从图12可知,生物医用材料(ti-cnts-msns@mgf)与c2c12细胞共培养5天后,胞体伸长,出现多核成肌细胞融合,在第7天逐渐观察到大量的肌管,这些细胞在7天后甚至形成了收缩细胞簇,表明成熟程度增加。而钛合金(ti)、第一产物(ti-cnts)的表面并未出现肌管。
209.图13为本实施例中成肌细胞分别在钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)表面培养7天后的扫描电镜图。其中,箭头为清晰对齐的肌管。
210.从图13可知,成肌细胞在本发明的生物医用材料(ti-cnts-msns@mgf)分化成肌丝状,有丰富的伪足,而在其他如第一产物(ti-cnts)和ti上则成平片状细胞,说明本发明的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)能促进肌肉分化。
211.从图12和图13综合可知,成肌细胞一旦附着在生物医用材料(ti-cnts-msns@mgf)表面,就会扩散分化成肌管,肌管穿透材料的孔隙,实现功能性肌肉收缩。
212.3、伤口愈合实验考察
213.将c2c12成肌细胞以5
×
104个接种在12孔培养板中,直至细胞达到所需的合流。用常规的200μl移液针尖轻轻划伤细胞层,在细胞层上形成一个直切口。用pbs冲洗三次,除去浮细胞。划痕产生后,分别将钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)的细胞培养插入物置于细胞接种孔中,并随时间推移进行成像。在光显微图像的基础上,利用imagej软件测量细胞迁移。
214.图14为本实施例中伤口愈合实验中,钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)分别于12h、24h和48h诱导迁移伤口愈合实验的显微图。
215.从图14可知,随着时间的推移,复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)24h后,提高了细胞的运动能力,尤其是生物医用材料(ti-cnts-msns@mgf),其迁移率远高于其他各组,48h后基本愈合。说明在复合材料与mgf偶联能增加c2c12细胞的迁移能力,使细胞更容易越过多孔结构迁移。因此,本发明的生物医用材料(ti-cnts-msns@mgf)能加速预后预测,成为tjr后多孔支架肌肉再生的一种有前景的材料。
216.综合说明,本发明的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)具有良好的细胞粘附和迁移性能。
217.实施例6体内评估复合材料和生物医用材料对新生血管和肌肉的影响
218.本实施例中,构建动物模型,考察实施例2得到的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)对新生血管的影响。包括如下:
219.动物模型构建如图15所示,取6周龄sd大鼠,麻醉后于背部做正中切口,分离皮下组织,暴露椎间肌,分别将钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)材料埋入肌肉组织之间,构建得到动物模型。然后正常饲养8周之后,分别将材料从大鼠体内取出,制备硬组织切片后进行范吉森(van gieson,vg)染色。
220.硬组织切片步骤如下:
221.1)将取出后的复合材料浸泡在4%多聚甲醛固定24h后,自来水冲洗过夜;2)梯度酒精脱水;3)包埋:用mma(甲基丙烯酸甲酯)做包埋处理,在干燥器内抽气处理,4℃放置一周,室温下放置至单体变粘稠,转入37℃烘箱内至单体硬化;4)完全硬化后,使用硬组织切片机切片,切片厚度为200μm,打磨至50μm,封片,抛光。
222.范吉森(van gieson,vg)染色,具体操作流程如下:
223.1)对硬组织切片采用弱酸冲洗1min,接着流水冲洗,stevenel’s blue染液2min,然后流水冲洗。2)根据说明书配制vg染色液(酸性品红∶饱和苦味酸=1∶9),避光条件下现用现配。3)vg染色液步骤1)处理后的硬组织切片进行染色3min。4)弃染液,水洗。4)吸干切片表面液体,显微镜下观察、拍照。
224.同时设立空白对照组(nc组)。
225.图16为本实施例中钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)埋入大鼠肌肉组织中培养8周后取出的实拍图。
226.从图16可知,本发明的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)呈红粉色,生物医用材料(ti-cnts-msns@mgf)红粉色部分更多,表明肌肉组织形成。相比之下,钛合金(ti)、第一产物(ti-cnts)周围的组织呈白色,这可能是由于纤维组织的主要成分—致密胶原蛋白的沉积。
227.图17为本实施例中钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)的最大撕脱力分析结果图。
228.从图17可知,复合材料(ti-cnts-msns)的最大撕脱力可达到20n/cm2以上,生物医用材料(ti-cnts-msns@mgf)最大撕脱力达到31.17n/cm2,而钛合金(ti)、第一产物(ti-cnts)的撕裂力较弱且低于20n/cm2。
229.图18为本实施例中钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)的显微ct分析图。
230.从图18可知,黑色区域为未填充区域,钛合金(ti)、第一产物(ti-cnts)中,材料边缘仅可见少量软组织,而大量软组织填充了复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)内部深层的大部分孔隙。
231.图19为本实施例中采用钛合金(ti)、第一产物(ti-cnts)、复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)构建动物模型8周后,硬组织切片染色结果图。
其中,从左边数第5张图为第4张图中白色框线内的放大图。
232.从图19可知,本发明的复合材料(ti-cnts-msns)内有肌肉组织的长入,生物医用材料(ti-cnts-msns@mgf)内有大量肌肉组织的长入,且伴有新生的血管(新生血管见红色箭头),而钛合金(ti)、第一产物(ti-cnts)仅有少量肌肉组织穿透。因此,本发明的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)有助于促进肌肉再生。
233.综合本实施例结果表明,本发明的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)能与周围组织形成了相对紧密的机械网络,有利于肌肉组织的长入和再生,而肌肉在复合材料或生物医用材料内的填充对于维持收缩肌产生的运动功能非常重要。
234.此外,本发明还比较m1巨噬细胞特异性标志物cd68和m2巨噬细胞特异性标志物cd206的表达,发现生物医用材料(ti-cnts-msns@mgf)的m2/m1巨噬细胞比例远高于肽合金(ti),说明复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)倾向于诱导m2极化,从而缓解炎症的进展,改善恢复过程。在对巨噬细胞亚群的分析中,生物医用材料(ti-cnts-msns@mgf)中m2巨噬细胞占总巨噬细胞的90%以上,肽合金(ti)中m1巨噬细胞占总巨噬细胞的85.7%,占总巨噬细胞的五分之四。
235.综上所述,这些结果表明复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)在体内有效改善肌肉再生和免疫调节,具有生物安全性,能加速肌肉再生,重建人体关节假体的生理和功能。
236.本发明通过电化学沉积技术,在多孔钛合金或多孔钛的表面首先电沉积一层碳纳米管(cnts),随后在碳纳米管层上再电沉积一层羧基介孔硅包覆碳纳米管(cnts@msns-cooh)获得了复合材料(ti-cnts-msns)。复合材料(ti-cnts-msns)的双层结构具有纳米拓扑结构、优异的负载生长因子的能力和通过共价结合延长生长因子的释放性能。本发明的复合材料(ti-cnts-msns)和生物医用材料(ti-cnts-msns@mgf)具有亲水性、无生物毒性,在体外能促进细胞的增殖和分化,提高伤口愈合的速度以及增加生肌基因和蛋白的表达,在体内增强成肌细胞分化,导致肌管形成,并改善肌肉衍生的力学性能,因此本发明的生物医用材料可再生假体周围肌肉组织,并恢复与自然关节相当的运动功能,能深度优化肌功能保存型关节假体,使得假体置换后肌肉结构和功能得到保存和恢复,解决了关节假体置换术后运动功能障碍的问题。
237.上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。