1.本发明涉及在向人的眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞、包含该细胞的药物、该细胞的制造法等。
背景技术:
2.针对以水疱性角膜症为代表的角膜内皮障碍的现在的治疗法只有使用供体角膜的角膜移植术,但该手术的长期临床结果不充分。另外,关于角膜移植后的视力,因诱导角膜不规则散光而在患者的满意度方面也不充分。角膜移植患者的约60%以上为水疱性角膜症、包括早期富克斯角膜营养不良的角膜内皮功能不全。水疱性角膜症的主要原因为因白内障手术、青光眼手术、玻璃体视网膜手术或激光虹膜切除术等眼科手术引起的角膜内皮障碍、角膜外伤、假性表皮剥脱综合征及富克斯角膜内皮营养不良。据报道,欧美的具有富克斯角膜内皮营养不良的遗传倾向性的潜伏患病率为约5%以上。在角膜移植术中,需要1个眼睛的供体角膜来治疗一个病理性眼睛,不构成解决持续性的供体不足的手段。鉴于全世界存在很多潜伏患者,作为非常重要的课题,全世界强烈希望提供一种革新的医疗,其与角膜移植技术相比具有能够适用于广泛的医疗机关中的通用性和简便性。而且,细胞注入疗法会带来角膜的正常形状而不会产生伴随角膜移植的变形,其结果,能够实现长期良好的视觉功能恢复。
技术实现要素:
3.用于解决课题的技术手段
4.本发明的发明人们在世界上首次发现培养人角膜内皮细胞因培养中的细胞相变(纤维化、上皮间质转化、内皮间质转化、老化、脱分化等)而夹杂与健康的角膜内皮组织所保持的角膜内皮细胞性状不同的细胞亚群,通过设计选择性地增殖培养中的亚群的技术,确认了特定亚群、即具有充分的成熟分化人角膜内皮细胞功能的功能性细胞(也称为效应(effector)细胞。)形成最适于细胞注入疗法的小型且六边形类卵石形状,并且具有与健康的角膜内皮组织所保持的角膜内皮细胞类似的性状。
5.在本发明中,针对用于特定培养人角膜内皮细胞(其在临床试验中确认到早期临床效果发生及长期稳定的临床效果)的细胞性状的检定技术进行了深入研究,并且在世界上首次实现了该技术的发明。基于新发明创造出的技术,完成了用于特定、提供培养人角膜内皮细胞(其通过利用各种代谢相关酶规定线粒体功能,从而确保早期临床效果发生及长期稳定的临床效果)的发明。
6.本发明在世界上首次提供一种对患者友好的划时代的医疗,其通过能够稳定生产(是用于在任何时间提供相同医疗的绝对要件)、并且能够广泛适用于全世界的成本非常低廉的制法,长期重建均质且小型的移植后高细胞密度角膜内皮组织。其是线粒体依赖性氧化的呼吸亢进的培养人角膜内皮细胞。表明其在角膜移植中对于引起排斥应答的患者也是有效的。
7.另外,在本发明的制造法中,通过革新性的发明(即,通过避免表观遗传性(epigenetic)的多基因的活化、例如在细胞质、核中发挥作用的基于与tca代谢路径有关的酶得到的代谢产物、特别是基于乙酰辅酶a(accoa)进行的组蛋白的乙酰化等,从而代谢重编程向线粒体功能的保持倾斜而不引起培养细胞的相变),提供使上述的夹杂亚群细胞的生成极小化、对于广泛改善角膜内皮功能不全患者的角膜混浊、水肿长期有用的高功能内皮细胞。
8.因此,本发明提供以下内容。
9.(项目1)一种方法,其是制造在向人的眼前房内注入时能引发人角膜功能的人功能性角膜内皮细胞的方法,
10.所述方法包括:(b)使角膜内皮前体细胞在能将增殖应激等培养应激极小化的培养条件下增殖和/或分化
·
成熟的工序。
11.(项目2)根据(项目1)所述的方法,其中,上述人角膜功能包括角膜内皮细胞功能特性。
12.(项目3)根据(项目1)或(项目2)所述的方法,其中,所述方法还包括:(a)使来自人角膜内皮组织的细胞脱分化而得到上述角膜内皮前体细胞的工序。
13.(项目4)根据(项目1)~(项目3)中任一项所述的方法,其是制造在向人的眼前房内注入时能引发人角膜功能、特别是角膜内皮细胞功能特性的功能性人角膜内皮细胞的方法,所述方法使人角膜内皮前体细胞在细胞生长因子的存在下增殖和/或分化
·
成熟,所述细胞生长因子的量低于发生转化的量。
14.(项目5)根据(项目1)~(项目4)中任一项所述的方法,其中,上述细胞生长因子包括上皮生长因子(egf)。
15.(项目6)根据(项目1)~(项目5)中任一项所述的方法,其中,上述转化包括内皮-间充质转化。
16.(项目7)根据(项目1)~(项目6)中任一项所述的方法,其中,上述增殖和/或分化
·
成熟的工序在rock抑制剂的存在下进行。
17.(项目8)根据(项目1)~(项目6)中任一项所述的方法,其中,所述方法包括确认如下内容的工序:(b)中所得的细胞为在线粒体中线粒体依赖性氧化的磷酸化增加、在细胞质
·
核内的乙酰coa的表达不增加、并且不引发表观遗传性多基因表达的细胞,所述表观遗传性多基因表达由通过乙酰coa进行的组蛋白乙酰化介导。
18.(项目9)根据(项目1)~(项目8)中任一项所述的方法,其中,所述方法包括确认如下内容的工序:(b)中所得的细胞为在线粒体中表达选自柠檬酸合酶(cs)、乌头酸酶2(aco2)(aconitase 2)、异柠檬酸脱氢酶2(idh2)、苹果酸脱氢酶2(mdh2)、苹果酸酶3(me3)、acss1、乙酰coa乙酰转移酶1(acat1)、丙酮酸脱氢酶(pdh)、bcat2及支链酮酸脱氢酶2(bckdh2)中的1种或多种代谢相关酶的细胞。
19.(项目10)根据(项目1)~(项目9)中任一项所述的方法,其中,所述方法包括确认如下内容的工序:(b)中所得的细胞不表达或几乎不表达atp柠檬酸裂解酶(acly)、乌头酸酶1(aco1)、异柠檬酸脱氢酶1(idh1)、苹果酸脱氢酶1(mdh1)、苹果酸酶1(me1)、acss2、乙酰coa乙酰转移酶2(acat2)和/或乳酸脱氢酶(ldh)。
20.(项目10a)根据上述项目中任一项所述的方法,其中,(b)中所得的细胞中的idh1
和/或acss2的表达与非人功能性角膜内皮细胞相比减弱。
21.(项目10b)根据上述项目中任一项所述的方法,其中,(b)中所得的细胞中,不表达atp柠檬酸裂解酶(acly)。
22.(项目10c)根据上述项目中任一项所述的方法,其中,(b)中所得的细胞中的idh2的表达与非人功能性角膜内皮细胞相比增强。
23.(项目11)根据(项目1)~(项目10)中任一项所述的方法,其中,所述方法包括确认如下内容的工序:(b)中所得的细胞被确认到表达与角膜内皮(细胞)功能特性相关联的离子通道和/或单羧酸转运体,所述角膜内皮(细胞)功能特性为角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善。
24.(项目12)根据(项目1)~(项目11)中任一项所述的方法,其中,所述方法包括确认如下内容的工序:(b)中所得的细胞使钠/氢交换体1(nhe1)和/或水通道蛋白1(aqp-1)的表达亢进。
25.(项目13)根据(项目9)~(项目10)中任一项所述的方法,其中,所述方法包括确认如下内容的工序:(b)中所得的细胞使重碳酸脱水酶5b(ca5b)(bicarbonic anhydrase)的表达亢进。
26.(项目14)根据(项目1)~(项目12)中任一项所述的方法,其中,所述方法包括确认如下内容的工序:(b)中所得的细胞具有不存在于细胞质、核中而细胞器选择性地定位于线粒体中的特性,以使与tca循环等有关的代谢酶、乙酰辅酶a(acetylcoa)等代谢产物不会导致夹杂相转移细胞的生成。
27.(项目15)根据(项目1)~(项目14)中任一项所述的方法,其中,上述人功能性角膜内皮细胞以如下细胞作为起源来制作,所述细胞选自来自角膜内皮组织的细胞、多能性干细胞、间质干细胞、从角膜内皮采集的角膜内皮前体细胞、从角膜内皮采集的细胞、以及利用直接编程法制作的角膜内皮前体细胞及角膜内皮样细胞。
28.另外,还提供以下的发明。
29.(项目16)一种细胞,其是人功能性角膜内皮细胞,其被确认到表达与角膜内皮(细胞)功能特性相关联的功能性蛋白、或者其不引发或降低阻碍该角膜内皮(细胞)功能特性的蛋白,所述角膜内皮(细胞)功能特性为细胞角膜混浊、水肿的改善,其结果能够持续地长期保持角膜内皮组织细胞密度,实现视力改善。
30.(项目17)根据(项目16)所述的细胞,其中,上述细胞为在向人眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞,其中,所述细胞在线粒体中表达选自柠檬酸合酶(cs)、乌头酸酶2(aco2)、异柠檬酸脱氢酶2(idh2)、苹果酸脱氢酶2(mdh2)、苹果酸酶3(me3)、acss1、乙酰coa乙酰转移酶1(acat1)、丙酮酸脱氢酶(pdh)、bcat2及支链酮酸脱氢酶2(bckdh2)中的1种或多种代谢相关酶。
31.(项目18)根据(项目16)或(项目17)所述的细胞,其中,上述细胞为在向人眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞,其包括选自如下特性中的至少一者:
32.在线粒体中线粒体依赖性氧化的磷酸化增加或者在细胞质
·
核内的乙酰coa的表达不增加;以及
33.不引发由通过乙酰coa进行的组蛋白乙酰化介导的表观遗传性的多基因表达。
34.(项目19)根据(项目16)~(项目18)中任一项所述的细胞,其中,上述细胞为人角膜内皮细胞,其不表达或实质上不表达atp柠檬酸裂解酶(acly)、乌头酸酶1(aco1)、异柠檬酸脱氢酶1(idh1)、苹果酸脱氢酶1(mdh1)、苹果酸酶1(me1)、acss2、乙酰coa乙酰转移酶2(acat2)和/或乳酸脱氢酶(ldh)。
35.(项目20)根据(项目16)~(项目19)中任一项所述的细胞,其中,在上述人功能性角膜内皮细胞中,钠/氢交换体1(nhe1)和/或水通道蛋白1(aqp-1)的表达亢进。
36.(项目21)根据(项目16)~(项目20)中任一项所述的细胞,其中,在上述人功能性角膜内皮细胞中,重碳酸脱水酶5b(ca5b)的表达亢进。
37.(项目22)根据(项目16)~(项目21)中任一项所述的细胞,其中,上述人功能性角膜内皮细胞包括选自如下的全部特性:(i)不存在于细胞质、核中而细胞器选择性地定位于线粒体中,以使与tca循环等有关的代谢酶、乙酰辅酶a等代谢产物不会导致夹杂相转移细胞的生成;(ii)线粒体中的线粒体依赖性氧化的磷酸化的增加;(iii)由通过乙酰coa进行的组蛋白乙酰化介导的表观遗传性的多基因表达的降低(包括无引发);(iv)钠/氢交换体1(nhe1)和/或水通道蛋白1(aqp-1)的表达的亢进;以及(v)重碳酸脱水酶5b(ca5b)的表达的亢进。
38.(项目23)根据(项目16)~(项目22)中任一项所述的细胞,其中,所述细胞不引起或实质上不引起内皮间质转化。
39.(项目24)一种细胞,其是在向人眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞,所述细胞不引起或实质上不引起内皮间质转化。
40.(项目25)根据(项目16)~(项目24)中任一项所述的细胞,其中,上述人功能性角膜内皮细胞以如下细胞作为起源来制作,所述细胞选自来自角膜内皮组织的细胞、多能性干细胞、间质干细胞、从角膜内皮采集的角膜内皮前体细胞、从角膜内皮采集的细胞、以及利用直接编程法制作的角膜内皮前体细胞及角膜内皮样细胞。
41.(项目26)一种细胞群,其包含通过(项目1)~(项目15)中任一项所述的方法制造的细胞和/或权利要求16~25中任一项所述的细胞。
42.(项目27)一种方法,其是在向人的眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞的品质管理或工序管理的方法,
43.所述方法包括确认如下内容的工序:在上述细胞的线粒体中,表达选自柠檬酸合酶(cs)、乌头酸酶2(aco2)、异柠檬酸脱氢酶2(idh2)、苹果酸脱氢酶2(mdh2)、苹果酸酶3(me3)、acss1、乙酰coa乙酰转移酶1(acat1)、丙酮酸脱氢酶(pdh)、bcat2及支链酮酸脱氢酶2(bckdh2)中的1种或多种代谢相关酶。
44.(项目28)根据(项目27)所述的方法,其中,所述方法还包括确认如下内容的工序:在上述细胞中不引发细胞质
·
核内的乙酰coa的表达及由通过乙酰coa进行的组蛋白乙酰化介导的表观遗传性的多基因表达。
45.(项目29)根据(项目27)或(项目28)中任一项所述的方法,其中,所述方法还包括确认如下内容的工序:在上述细胞中,钠/氢交换体1(nhe1)和/或水通道蛋白1(aqp-1)的表达亢进。
46.(项目30)根据(项目27)~(项目29)中任一项所述的方法,其中,所述方法还包括确认如下内容的工序:在上述细胞中,重碳酸脱水酶5b(ca5b)的表达亢进。
47.(项目31)一种方法,其是在向人的眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞的品质管理或工序管理的方法、或者对混杂于人功能性角膜内皮细胞中的角膜内皮非功能性细胞进行检测的方法,所述方法包括确认以下(1)~(13)中的1个或多个项目的工序:
48.(1)在移植日的基于相位差图像的外观检查中,无成纤维细胞、异物、变色或其他的异常;
49.(2)移植日2周前和/或移植日的细胞数为1.5
×
106个细胞/450μl;
50.(3)通过台盼蓝染色,细胞存活率为85%以上;
51.(4)在细胞上清的基于elisa的纯度试验中,pdgf-bb为100pg/ml以上;
52.(5)在移植日2周前和/或移植日所采集的细胞上清的基于facs的纯度试验中,cd166
>99%、cd24
<5%、cd26
<5%、cd200
<5%、cd44
high
<5%、cd44
low
>90%、cd105-~weak
>90%、cd90
<5%;
53.(6)效应细胞(e-ratio)>90%;
54.(7)移植日2天前的泵功能(na /k atpase):阳性;
55.(8)移植日2天前的屏障功能(zo-1):阳性;
56.(9)在bsa阴性试验中不足125ng/μl;
57.(10)移植日的ecd为1500个细胞/mm2以上;
58.(11)mir184的表达;
59.(12)乳酸产生;
60.(13)细胞尺寸不足250μm。
61.(项目32)一种细胞群,其是在向人的眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞的细胞群,所述细胞群满足以下(1)~(13)中的1个或多个项目:
62.(1)在移植日的基于相位差图像的外观检查中,无成纤维细胞、异物、变色或其他的异常;
63.(2)移植日2周前和/或移植日的细胞数为1.5
×
106个细胞/450μl;
64.(3)通过台盼蓝染色,细胞存活率为85%以上;
65.(4)在细胞上清的基于elisa的纯度试验中,pdgf-bb:100pg/ml以上;
66.(5)在移植日2周前和/或移植日所采集的细胞上清的基于facs的纯度试验中,cd166
>99%、cd24
<5%、cd26
<5%、cd200
<5%、cd44
high
<5%、cd44
low
>90%、cd105-~weak
>90%、cd90
<5%;
67.(6)效应细胞(e-ratio)>90%;
68.(7)移植日2天前的泵功能(na /k atpase):阳性;
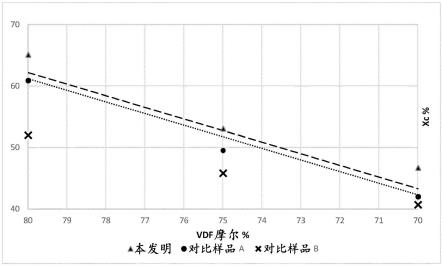
69.(8)移植日2天前的屏障功能(zo-1):阳性;
70.(9)在bsa阴性试验中不足125ng/μl;
71.(10)移植日的ecd为1500个细胞/mm2以上;
72.(11)mir184的表达;
73.(12)乳酸产生;
74.(13)细胞尺寸不足250μm。
75.另外,还提供以下的发明。
76.(药物)
77.(项目a1)一种药物,其是包含人功能性角膜内皮细胞的药物,所述药物被确认到表达与角膜内皮(细胞)功能特性相关联的功能性蛋白、或者其不引发或降低阻碍该角膜内皮(细胞)功能特性的蛋白,所述角膜内皮(细胞)功能特性为角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善。
78.(项目a12)根据(项目a1)所述的药物,其中,上述细胞为在向人眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞,并且上述细胞在线粒体中表达选自柠檬酸合酶(cs)、乌头酸酶2(aco2)、异柠檬酸脱氢酶2(idh2)、苹果酸脱氢酶2(mdh2)、苹果酸酶3(me3)、acss1、乙酰coa乙酰转移酶1(acat1)、丙酮酸脱氢酶(pdh)、bcat2及支链酮酸脱氢酶2(bckdh2)中的1种或多种代谢相关酶。
79.(项目a3)根据(项目a1)或(项目a2)所述的药物,其中,上述细胞为在向人眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞,并且上述细胞包括选自如下特性中的至少一者:
80.在线粒体中线粒体依赖性氧化的磷酸化增加或者在细胞质
·
核内的乙酰coa的表达不增加、以及
81.不引发由通过乙酰coa进行的组蛋白乙酰化介导的表观遗传性的多基因表达中的至少一者。
82.(项目a4)根据(项目a1)~(项目a3)中任一项所述的药物,其中,上述细胞为人角膜内皮细胞,并且上述细胞不表达或实质上不表达atp柠檬酸裂解酶(acly)、乌头酸酶1(aco1)、异柠檬酸脱氢酶1(idh1)、苹果酸脱氢酶1(mdh1)、苹果酸酶1(me1)、acss2、乙酰coa乙酰转移酶2(acat2)和/或乳酸脱氢酶(ldh)。
83.(项目a5)根据(项目a1)~(项目a4)中任一项所述的细胞,其中,在上述人功能性角膜内皮细胞中,钠/氢交换体1(nhe1)和/或水通道蛋白1(aqp-1)的表达亢进。
84.(项目a6)根据(项目a1)~(项目a5)中任一项所述的药物,其中,在上述人功能性角膜内皮细胞中,重碳酸脱水酶5b(ca5b)的表达亢进。
85.(项目a7)根据(项目a1)~(项目a6)中任一项所述的药物,其中,上述人功能性角膜内皮细胞包括选自如下的全部特性:(i)不存在于细胞质、核中而细胞器选择性地定位于线粒体中,以使与tca循环等有关的代谢酶、乙酰辅酶a等代谢产物不会导致夹杂相转移细胞的生成;(ii)线粒体中的线粒体依赖性氧化的磷酸化的增加;(iii)由通过乙酰coa进行的组蛋白乙酰化介导的表观遗传性的多基因表达的降低(包括无引发);(iv)钠/氢交换体1(nhe1)和/或水通道蛋白1(aqp-1)的表达的亢进;以及(v)重碳酸脱水酶5b(ca5b)的表达的亢进。
86.(项目a8)根据(项目a1)~(项目a7)中任一项所述的药物,其中,所述药物具有不引起或实质上不引起内皮间质转化的上述细胞。
87.(项目a9)一种药物,其是具有在向人眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞的药物,上述细胞不引起或实质上不引起内皮间质转化。
88.(项目a10)根据(项目a1)~(项目a9)中任一项所述的药物,其中,上述人功能性角膜内皮细胞以如下细胞作为起源来制作,所述细胞选自来自角膜内皮组织的细胞、多能性干细胞、间质干细胞、从角膜内皮采集的角膜内皮前体细胞、从角膜内皮采集的细胞、以及
利用直接编程法制作的角膜内皮前体细胞及角膜内皮样细胞。
89.(项目a11)一种药物,其包含细胞群,所述细胞群包含通过(项目1)~(项目15)中任一项所述的方法制造的细胞和/或(项目16)~(项目25)中任一项所述的细胞。
90.(项目a12)一种药物,其是包含在向人的眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞的细胞群的药物,上述细胞群满足以下(1)~(13)中的1个或多个项目:
91.(1)在移植日的基于相位差图像的外观检查中,无成纤维细胞、异物、变色或其他的异常;
92.(2)移植日2周前和/或移植日的细胞数为1.5
×
106个细胞/450μl;
93.(3)通过台盼蓝染色,细胞存活率为85%以上;
94.(4)在细胞上清的基于elisa的纯度试验中,pdgf-bb为100pg/ml以上;
95.(5)在移植日2周前和/或移植日所采集的细胞上清的基于facs的纯度试验中,cd166
>99%、cd24
<5%、cd26
<5%、cd200
<5%、cd44
high
<5%、cd44
low
>90%、cd105-~weak
>90%、cd90
<5%;
96.(6)效应细胞(e-ratio)>90%;
97.(7)移植日2天前的泵功能(na /k atpase):阳性;
98.(8)移植日2天前的屏障功能(zo-1):阳性;
99.(9)在bsa阴性试验中不足125ng/μl;
100.(10)移植日的ecd为1500个细胞/mm2以上;
101.(11)mir184的表达;
102.(12)乳酸产生;
103.(13)细胞尺寸不足250μm。
104.在本发明中旨在表明上述的一个或多个特征除了所明示的组合以外还可进一步组合来提供。对于本发明的另一方面的实施方式及优点,通过根据需要阅读以下的详细说明并加以理解,就能被本领域技术人员所认识。
附图说明
105.图1为表示由cd44介导的线粒体的能量代谢控制作用的概念图。
106.图2为表示本发明的一个实施方式的功能性人角膜内皮细胞(标准细胞)的各种临床效果的作用机序的概念图。
107.图3为表示对变更本发明的一个实施方式的功能性人角膜内皮细胞的制造方法时所带来的影响进行调查的结果的图表。
108.图4为表示本发明的一个实施方式的由成体(干)细胞通过脱分化途径进行的分化成熟
·
功能性人角膜内皮细胞的诱导的概念图。
109.图5为表示使包含分化和emt的相变同时发生时所产生的拮抗作用的概念图。
110.图6为在本发明的一个实施方式中将制造本发明的功能性人角膜内皮细胞时所添加的egf浓度设为未添加(-)、0.5ng/ml、1ng/ml或5ng/ml的情况下在p2中的细胞照片。
111.图7为在本发明的一个实施方式中将制造本发明的功能性人角膜内皮细胞时所添加的egf浓度设为未添加(-)或0.5ng/ml的情况下在p3中的facs结果。
112.图8为在本发明的一个实施方式中将制造本发明的功能性人角膜内皮细胞时所添加的egf浓度设为1ng/ml或5ng/ml的情况下在p3中的facs结果。
113.图9为在本发明的一个实施方式中将制造本发明的功能性人角膜内皮细胞时所添加的egf浓度设为未添加(-)或0.5ng/ml的情况下在p4中的facs结果。
114.图10为在本发明的一个实施方式中将制造本发明的人功能性角膜内皮细胞时所添加的egf浓度设为1ng/ml或5ng/ml的情况下在p4中的facs结果。
115.图11为在本发明的一个实施方式中为了对制造本发明的功能性人角膜内皮细胞时自初代培养时添加egf的情况的效果进行调查而在p0中设为未添加(-)或0.5ng/ml的情况的facs结果。
116.图12为在本发明的一个实施方式中为了对制造本发明的功能性人角膜内皮细胞时自初代培养时添加egf的情况的效果进行调查而在p0中设为未添加(-)、并且在p1中设为未添加(-)或0.5ng/ml的情况的facs结果。
117.图13为在本发明的一个实施方式中为了对制造本发明的功能性人角膜内皮细胞时自初代培养时添加egf的情况的效果进行调查而在p0中设为0.5ng/ml、并且在p1中设为未添加(-)或0.5ng/ml的情况的facs结果。
118.图14为在本发明的一个实施方式中为了对制造本发明的功能性人角膜内皮细胞时自初代培养时添加egf的情况的效果进行调查而在p0中设为未添加(-)、并且在p2中设为未添加(-)或0.5ng/ml的情况的facs结果。
119.图15为表示用于测定mir378、mir146、mir34、mir184在细胞内的基因变动的情况区分的示意图。
120.图16为表示有无egf及有无y27632的各个情况下的facs测定及照片评价结果的表。
121.图17为表示有无egf及有无y的情况的mir184基因表达变动的结果的图表。
122.图18为表示有无egf及有无y的情况的mir34a-5p基因表达变动的结果的图表。
123.图19为表示代谢产物的层次性的例子的示意图。
124.图20为表示在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞(目标细胞)和不是人功能性角膜内皮细胞的细胞(非目标细胞)的代谢产物特性进行确认的结果的图表。
125.图21为表示在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞(目标细胞)和不是人功能性角膜内皮细胞的细胞(非目标细胞)的代谢产物特性进行确认的结果的图表。
126.图22为表示在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞(目标细胞)和不是人功能性角膜内皮细胞的细胞(非目标细胞)的代谢产物特性进行确认的结果的图表。
127.图23为表示在本发明的一个实施方式中用于对各种添加物的效果进行试验的各培养条件的表。
128.图24为图23的条件1及2下的ct09 p5的细胞照片。
129.图25为图23的条件3及4下的ct09 p5的细胞照片。
130.图26为图23的条件5下的ct09 p5的细胞照片。
131.图27为图23的条件1及2下的facs结果。
132.图28为图23的条件3及4下的facs结果。
133.图29为图23的条件5下的facs结果。
134.图30为elisa pdgf-bb及il-8的ct09 p4及p5的培养上清
·
样品列表。
135.图31为表示在本发明的一个实施方式中将pdgf-bb按添加物进行分类的结果的图表。
136.图32为表示在本发明的一个实施方式中将pdgf-bb按周进行分类的结果的图表。
137.图33为表示在本发明的一个实施方式中将il-8按添加物进行分类的结果的图表。
138.图34为表示在本发明的一个实施方式中将il-8按周进行分类的结果的图表。
139.图35为在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞的线粒体呼吸能力进行调查的结果。
140.图36为在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞的线粒体呼吸能力进行调查的结果。
141.图37为在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞的线粒体呼吸能力进行调查的结果。
142.图38为表示在本发明的一个实施方式中的供体信息的表,用于对rock抑制剂的添加相对于本发明的人功能性角膜内皮细胞的影响进行调查。
143.图39为表示在本发明的一个实施方式中的培养条件的表,用于对rock抑制剂的添加相对于本发明的人功能性角膜内皮细胞的影响进行调查。
144.图40为表示在本发明的一个实施方式中的添加物和上清回收的时期的表,用于对rock抑制剂的添加相对于本发明的人功能性角膜内皮细胞的影响进行调查。
145.图41为在本发明的一个实施方式中将对rock抑制剂的添加相对于本发明的人功能性角膜内皮细胞的影响进行调查的facs结果进行汇总得到的表。
146.图42为在本发明的一个实施方式中对rock抑制剂的添加相对于本发明的人功能性角膜内皮细胞的影响进行调查的细胞照片。
147.图43为在本发明的一个实施方式中对rock抑制剂的添加相对于本发明的人功能性角膜内皮细胞的影响进行调查的facs结果。
148.图44为在本发明的一个实施方式中对rock抑制剂的添加相对于本发明的人功能性角膜内皮细胞的影响进行调查的facs结果。
149.图45为在本发明的一个实施方式中对rock抑制剂的添加相对于本发明的人功能性角膜内皮细胞的影响进行调查的facs结果。
150.图46为表示本发明的一个实施方式的#190719的培养上清中的elisa pdgf-bb测定结果(每个项目)的图表。
151.图47为表示本发明的一个实施方式的#190318的培养上清中的elisa pdgf-bb测定结果(每个项目)的图表。
152.图48为表示本发明的一个实施方式的#190719的培养上清中的elisa pdgf-bb测定结果(每周)的图表。
153.图49为表示本发明的一个实施方式的#190318的培养上清中的elisa pdgf-bb测定结果(每周)的图表。
154.图50为表示本发明的一个实施方式的#190719的培养上清中的elisa il-8测定结果(每周)的图表。
155.图51为表示本发明的一个实施方式的#190318的培养上清中的elisa il-8测定结果(每周)的图表。
156.图52为表示本发明的一个实施方式的#190802的培养上清中的elisa pdgf-bb及il-8测定结果(每个项目)的图表。
157.图53为表示#190318的培养上清中的细胞因子测定(bio plex)的结果(每个项目)的图表。
158.图54为表示在本发明的一个实施方式中的添加物的条件的表,用于对rock抑制剂的添加相对于本发明的人功能性角膜内皮细胞的影响进行调查。
159.图55为本发明的一个实施方式的#190719在有无rock抑制剂下于p4中的细胞照片。
160.图56为本发明的一个实施方式的#190719在有无rock抑制剂下于p4中的facs结果。
161.图57为本发明的一个实施方式的#190719在有无rock抑制剂下于p4中的facs结果。
162.图58为表示本发明的一个实施方式的利用elisa进行的pdgf-bb及il-8的每个项目的结果的图表。
163.图59为表示本发明的一个实施方式的利用elisa进行的pdgf-bb及il-8的每周的结果的图表。
164.图60为在本发明的一个实施方式中对由rock抑制剂所致的粘附增强是否与本发明的细胞制造有关进行调查的结果的细胞照片。
165.图61为在本发明的一个实施方式中对由rock抑制剂所致的粘附增强是否与本发明的细胞制造有关进行调查的结果的细胞照片。
166.图62为在本发明的一个实施方式中对由rock抑制剂所致的粘附增强是否与本发明的细胞制造有关进行调查的结果的细胞照片。
167.图63为在本发明的一个实施方式中对由rock抑制剂所致的粘附增强是否与本发明的细胞制造有关进行调查的结果的细胞照片。
168.图64为针对代谢产物的表观遗传学(epigenetics)控制和细胞老化、细胞分化的破绽所示的示意图。
169.图65为在本发明的一个实施方式中能够在本发明的人功能性角膜内皮细胞(分化成熟细胞)中表达的酶列表。
170.图66为表示本发明的一个实施方式的用于david解析的hcec的培养条件的示意图。
171.图67为本发明的一个实施方式的用于david解析的hcec在p1中的facs结果。
172.图68为本发明的一个实施方式的用于david解析的hcec在p4中的facs结果。
173.图69为本发明的一个实施方式的用于david解析的hcec在p4中的细胞照片。
174.图70为本发明的一个实施方式的用于蛋白组学(proteomics)的david解析的步骤。
175.图71为本发明的一个实施方式的3组解析的结果。
176.图72为本发明的一个实施方式的goterm解析的结果。
177.图73为表示本发明的一个实施方式中的david解析后的线粒体有关的比较结果的表。
178.图74为表示本发明的一个实施方式中的david解析后的线粒体有关的比较的聚类结果(clustering results)的表。
179.图75为表示本发明的一个实施方式中的david解析后的线粒体有关的比较的聚类结果的表。
180.图76为在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞(标准细胞)和非标准细胞的代谢路径所涉及的酶、基质的蛋白表达强度进行比较的示意图。
181.图77为在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞(标准细胞)和非标准细胞的代谢路径所涉及的酶、基质的蛋白表达强度进行比较的示意图。
182.图78为在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞(标准细胞)和非标准细胞的代谢路径所涉及的酶、基质的蛋白表达强度进行比较的示意图。
183.图79为在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞(标准细胞)和非标准细胞的代谢路径所涉及的酶、基质的蛋白表达强度进行比较的示意图。
184.图80为在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞(标准细胞)和非标准细胞的代谢路径所涉及的酶、基质的蛋白表达强度进行比较的示意图。
185.图81为在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞(标准细胞)和非标准细胞的代谢路径所涉及的酶、基质的蛋白表达强度进行比较的示意图。
186.图82为在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞(标准细胞)和非标准细胞的代谢路径所涉及的酶、基质的蛋白表达强度进行比较的示意图。
187.图83为在本发明的一个实施方式中对本发明的人功能性角膜内皮细胞(标准细胞)和非标准细胞的代谢路径所涉及的酶、基质的蛋白表达强度进行比较的示意图。
188.图84为在本发明的一个实施方式中为了对本发明的人功能性角膜内皮细胞(标准细胞)和非标准细胞的代谢路径所涉及的酶、基质的蛋白表达强度进行比较而使用的抗原列表。
189.图85为表示在本发明的一个实施方式中用于对离子通道单羧酸转运体系统进行调查的细胞染色结果的照片。
190.图86为表示在本发明的一个实施方式中用于对离子通道单羧酸转运体系统进行调查的细胞染色结果的照片。
191.图87为表示在本发明的一个实施方式中用于对离子通道单羧酸转运体系进行调查的细胞染色结果的照片。
192.图88为表示在本发明的一个实施方式中用于对离子通道单羧酸转运体系统进行调查的细胞染色结果的照片。
193.图89为表示本发明的一个实施方式的#190719(标准细胞)在p2中的facs结果和细胞内ph的图表。
194.图90为本发明的一个实施方式的#190719(标准细胞)在p2中的细胞照片。
195.图91为表示本发明的一个实施方式的#190802(非标准细胞)在p3中的facs结果和
细胞内ph的图表。
196.图92为本发明的一个实施方式的#190802(非标准细胞)在p3中的细胞照片。
197.图93为表示在本发明的一个实施方式中对#190719(标准细胞)和#190802(非标准细胞)的细胞内ph进行比较的结果的图表。
198.图94为表示在本发明的一个实施方式中对添加物的效果进行调查的结果的facs和细胞照片。
199.图95为表示在本发明的一个实施方式中用于对添加物的效果进行调查的培养条件的示意图。
200.图96为在本发明的一个实施方式中各培养条件下的细胞中的facs结果。
201.图97为在本发明的一个实施方式中各培养条件下的细胞中的facs结果。
202.图98为在本发明的一个实施方式中各培养条件下的细胞中的facs结果。
203.图99为表示在本发明的一个实施方式中各培养条件下的细胞中的细胞因子测定结果的图表。
204.图100为表示各培养条件下的细胞中的细胞因子测定结果的图表。
205.图101为对线粒体的氧化的磷酸化呼吸的亢进进行说明的示意图。
206.图102为表示本发明的一个实施方式的线粒体的氧化的磷酸化呼吸的亢进的图表。
207.图103为表示线粒体的氧化的磷酸化呼吸的亢进与临床药理效果的关联性的示意图。
208.图104为表示基于来自成体(干)细胞的脱分化途径进行的分化成熟
·
功能性人角膜内皮细胞的诱导的示意图。
209.图105为对通过细胞内ph来影响线粒体功能并规定细胞的分化
·
脱分化状态的情况进行说明的概念图。
210.图106为本发明的一个实施方式的#cr04(标准细胞)在p3中的facs结果及其照片。
211.图107为在本发明的一个实施方式中通过细胞的免疫染色来确认离子通道的选择性表达的结果。
212.图108为表示在本发明的一个实施方式中非标准细胞中的组蛋白的乙酰化亢进的结果。
213.图109为在本发明的一个实施方式中标准细胞和非标准细胞的免疫印迹的结果。
214.图110为本发明的一个实施方式的#191224s(标准细胞)在p4中的facs结果及其照片。
215.图111为本发明的一个实施方式的#200313(非标准细胞)在p1中的facs结果及其照片。
216.图112为本发明的一个实施方式的#191224s(标准细胞)在p4中的facs结果及其照片。
217.图113为本发明的一个实施方式的#191224s(标准细胞)在p4中的facs结果及其照片。
218.图114为表示本发明的一个实施方式的hat/hdac活性的测定结果的图表。
具体实施方式
219.以下,对本发明的实施方式进行详细地说明。需要说明的是,针对同样的内容,为了避免重复的烦杂,省略适当说明。在整个说明书中,只要没有特别说明,单数形式的表达应理解为也包括其复数形式的概念。因此,只要没有特别说明,单数形式的冠词(例如,在英语的情况下为"a"、"an"、"the"等)应理解为也包括其复数形式的概念。另外,只要没有特别说明,本说明书中所使用的术语应理解为以该领域中通常所用的含义使用。因此,只要没有其他定义,本说明书中所使用的所有专业术语和科技术语具有与本发明所属领域的普通技术人员通常所理解的含义相同的含义。在矛盾的情况下,以本说明书(包括定义)为准。
220.首先,对本发明中所使用的术语及一般技术进行说明。
221.本说明书中,“约”是指后续数值
±
10%。
222.本说明书中,“角膜内皮”及“人角膜内皮”以该领域中所使用的通常含义来使用。角膜是构成眼的层状组织之一,其为透明且位于最接近外界的部分。角膜在人体中从外侧(体表面)起依次由5层构成,从外侧起由角膜上皮、前界膜(外边界线)、固有层、后界膜(内边界线)及角膜内皮构成。只要没有特别特定,除上皮及内皮以外的部分有时统称为“角膜实质”,在本说明书中也如此命名。
223.在本说明书中,将来自角膜内皮组织的细胞称作“来自角膜内皮组织的细胞”。另外,将通过分化而成为角膜内皮细胞的细胞统称为“角膜内皮前体细胞”。
224.本说明书中“在向人的眼前房内注入时能引发人角膜功能的人功能性角膜内皮细胞”是指具有引发角膜的功能的能力的细胞,其具有在向人的眼前房内注入时引发人角膜功能(在针对人的情况下是指“人的人角膜功能”,虽然并无特别限制,但是在本说明书中简称为“人角膜功能”)的能力。“能引发人角膜功能”可包括能引发角膜内皮功能特性(例如具有如下功能等:角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善)。
225.本说明书中“在向人的眼前房内注入时能引发角膜内皮功能特性的人功能性角膜内皮细胞”是指具有角膜内皮的功能性的细胞,其具有在向人的眼前房内注入时显现角膜内皮功能特性(在针对人的情况下是指“人角膜内皮功能特性”,虽然并无特别限制,但是在本说明书中简称为“角膜内皮功能特性”)的能力。作为具代表性的功能,显示为具有如下功能:角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善。在特别省略的情况下也称为“本发明的角膜内皮特性具备功能性细胞”。在针对人细胞时,称为“在向人的眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞”。本发明主要与人的角膜细胞相关联,因此,只要没有特别说明,均可理解为是指人细胞。在本说明书中,本发明的角膜内皮特性具备功能性细胞包括:在其原始状态下具有角膜内皮功能特性的“功能性成熟分化角膜内皮细胞”;以及虽然功能部分缺失但能够同样地使用或注入后发挥与功能性成熟分化角膜内皮细胞同等功能的“中程度分化角膜内皮细胞”。
226.本说明书中“角膜内皮(细胞)功能特性”是指在角膜内皮组织中存在的角膜内皮细胞在正常状态下所具有的对视功能保持有用的(细胞)功能特性。需要说明的是,在本说明书中,角膜内皮细胞功能特性和角膜内皮功能特性具有相同的意义,在体外(invitro)的议论中,大多情况下表示前者。
227.本说明书中“功能性成熟分化角膜内皮细胞”是指在健康的人角膜内皮组织中存
在的成熟分化角膜内皮细胞以及具有该成熟分化角膜内皮细胞的功能(具代表性的为上述角膜内皮(细胞)功能特性)的任意细胞,在人的细胞的情况下,是指功能性成熟分化人角膜内皮细胞。特别是,对于角膜内(细胞)皮功能特性,可通过如下方式确认,即,利用形成小型且六边形类卵石形状并基于线粒体功能的能量代谢系统、以及保持性状(如,改善角膜混浊、水肿,其结果能够持续地长期保持角膜内皮组织细胞密度,实现视力改善)来确认,并且可通过在注入时(例如在人的眼前房内)是否能够具有治疗效果来判定,但是并不限定于此,角膜内皮功能特性也能以替代指标(surrogate marker)为指标来判定。作为此种替代指标,也能通过以下10种中的任一种或其组合来判定,即,(1)内皮泵
·
屏障功能的保持(包括紧密连接蛋白(claudin)的表达);(2)对特定层粘连蛋白的粘附
·
结合性;(3)分泌细胞因子谱;(4)产生的microrna(mirna)谱、(5)产生的代谢产物谱;(6)与上述的角膜内皮(细胞)功能特性(角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善)相关联的离子通道、单羧酸转运体的表达;(7)与相变细胞的生成相关联的tca循环等所涉及的代谢酶不存在于细胞质、核而细胞器选择性地定位于线粒体的特性;(8)体外培养时的饱和细胞密度;(9)在培养时所得的细胞的空间大小及其分布;(10)在对小鼠角膜进行液体氮低温冻结损伤后注入细胞时的细胞维持。
228.关于(1)内皮泵
·
屏障功能的保持的判定,例如能够使用在角膜内皮中通常使用的泵功能测定法、屏障功能测定法来判定。这样的判定可列举使用在片形态的情况下所利用的ussing chamber并应用wigham c,hodson s.:current eye research,1,37-41,1981、hodson s,wigham c.:j physiol.,342:409-419,1983、hatou s.,yamada m.,akune y.,mochizuki h.,shiraishi a.,joko t.,nishida t.,tsubota k.:investigative ophthlmology&visual science,51,3935-3942,2010中记载的方法的技术。紧密连接蛋白表达能够使用该领域中公知的方法、例如免疫学方法来确认,紧密连接蛋白表达能够使用该领域中公知的任意的免疫学方法来确认。但是,由于设想为将本发明的细胞注入至悬浮液中,因此,在该情况下,优选的是:能够应用紧密连接蛋白表达或(2)~(10)中的任一种或其组合来评价角膜内皮功能。
229.关于(2)对特定层粘连蛋白的粘附
·
结合性的判定,能够以对层粘连蛋白511(α5链、β1链、γ链1的复合体)、层粘连蛋白521(α5链、β2链、γ链1的复合体)或其功能性片段(例如层粘连蛋白511-e8片段)的粘附性和/或针对该粘附性的整联蛋白(例如α3β1、α6β1等)表达的上升为指标来判定。这样的方法能够通过细胞粘附测定来实施。
230.在此,关于层粘连蛋白α链,“α5链”(lama5)是处于细胞外基质的细胞粘附分子的蛋白
·
层粘连蛋白的亚单元之一,称作lama5、kiaa1907等。人lama5的基因及蛋白的序列分别登录在ncbi登录号的nm_005560及np_005551中。用登录号601033来鉴定omim。关于层粘连蛋白β链,“β1链”(lamb1)是处于细胞外基质的细胞粘附分子的蛋白
·
层粘连蛋白的亚单元之一,称作lamb1、clm、lis5等。人lamb1的基因及蛋白的序列分别登录于ncbi登录号的nm_002291及np_002282。用登录号150240来鉴定omim。另外,“β2链”(lamb2)(laminin s)是处于细胞外基质的细胞粘附分子的蛋白(层粘连蛋白)的亚单元之一,称作lamb2、lams、nphs5等。人lamb2的基因及蛋白的序列分别登录于ncbi登录号的nm_002292及np_002283。用登录号150325来鉴定omim。关于层粘连蛋白γ链,“γ1链”(lamc1)是处于细胞外基质的细胞粘附分子的蛋白(层粘连蛋白)的亚单位之一,称作lamc1、lamb2等。人lamc1的基因及
蛋白的序列分别登录于ncbi登录号的nm_002293及np_002284。用登录号150290来鉴定omim。
231.关于(3)分泌细胞因子谱的判定,能够通过测定在本说明书中另外的部位中所说明的“血清”或“前房水”的细胞因子谱的产生水平来实施。这样的细胞因子包括rantes、pdgf-bb、ip-10、mip-1b、vegf、eotaxin、il-1ra、il-6、il-7、il-8、il-0、il-10、il-12(p70)、il-13、il-17、fgfbasic、g-csf、gm-csi、ifn-γ、mcp-1、mip-1a、tnf-α等,但并不限定于此。具体而言,能够使用用于细胞因子的统合解析的bio-plex等细胞因子测定试剂盒及解析系统进行解析。
232.关于(4)产生的microrna(mirna)谱的判定,能够使用在本说明书中另外的部位中所说明的“mirna谱”的解析方法进行测定。例如能够使用microrna表达谱的分析方法来实现,例如能够使用toray的“3d-gene”人mirna寡核苷酸芯片(mirbase version 17)来实施。制备如下rna:将从组织及细胞这两者的试样中取得的全部rna使用例如mircury lna(注册商标)microrna power labeling kits(exiqon,vedbaek,denmark)等试剂盒用hy5等标记物进行了标记的rna;和将从上清中取得的全部mirna进行了标记的mirna。使标记后的microrna分别与microrna芯片的表面杂交,在适当条件(例如16小时、32℃)下进行培养。将该microrna芯片在不含臭氧的环境中进行清洗及干燥后,使用3d-gene scanner 3000(toray industries inc.,tokyo,japan)之类的扫描器进行扫描,再使用3d-gene extraction software(toray)进行解析。
233.关于(5)产生的代谢产物谱,例如由具有甲醇(含有internal standard solution(human metabolome technologies;hmt,inc.,tsuruoka,japan)等内标试药)的chcec培养容器制备细胞内代谢物的代谢提取物。置换培养基,对细胞提取物进行处理,再进行ce-ms分析,对代谢物进行解析。代谢物组学(metabolome)解析能够按照由soga,et al.(soga,d.et al.,t.soga,et al.,anal.chem.2002;74:2233-2239anal.chem.2000;72:1236-1241;t.soga,et al.,j.proteome res.2003;2:488-494)开发的方法进行测定,适宜使用自动统合软件(分别为masterhands,keio university,tsuruoka,japan(m.sugimoto,et al.,metabolomics,2009;6:78-95)及masshunter quantitative analysis b.04.00,agilent technologies,santa clara,ca,usa)进行解析。基于ce中的mt及通过tofms测定的m/z值,从hmt代谢物数据库,利用假定的代谢物对峰进行标注,进行标准化来计算。进行层次聚类分析(hca)及主成分分析(pca),能够进行代谢物组学测定。
234.关于(6)与上述的角膜内皮(细胞)功能特性(角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善)相关联的离子通道、单羧酸转运体的表达,能够使用本说明书中记载的方法或公知的任意方法进行测定。例如,如实施例中记载那样,将从角膜组织得到的细胞进行固定,使用特异性抗体进行免疫染色,用荧光显微镜等进行观察,由此能够进行测定。除此以外,通过测定离子通道、单羧酸转运体的功能,也能测定它们的表达。
235.关于(7)与相变细胞的生成相关联的tca循环等所涉及的代谢酶不存在于细胞质、核而细胞器选择性地定位于线粒体的特性,也能使用本说明书中记载的方法或公知的任意方法进行测定。例如能够应用david解析等而对代谢酶细胞器选择性地定位于线粒体的情况进行观察,但并不限定于此。
236.关于(8)体外培养时的饱和细胞密度,能够通过使用本说明书中记载的适当的培养条件测定细胞密度来判定,有时也与细胞的大小同时测定,能够利用倒立显微镜系统(例如ckx41,olympus,tokyo,japan)并使用包含bz x-700显微镜系统(keyence,osaka,japan)等图像取得系统的设备来取得所拍摄的相位差显微镜图像,使用细胞计数软件(例如bz-h3c hybrid细胞计数软件(keyence))等进行定量。本发明中优选的饱和细胞密度记载于本说明书的其他部分。
237.关于(9)在培养时所得的细胞的空间大小及其分布,使用本说明书中记载的适宜的培养条件,拍摄细胞的照片,利用任意的软件等进行测定,或者对细胞的空间大小及其分布进行测定,由此能够进行判定,并且能够通过bz-h3chybrid细胞计数软件(keyence)等粗图像处理软件来实现。本发明中优选的细胞的空间大小及其分布记载于本说明书的其他部分。
238.关于(10)在对小鼠角膜进行液体氮低温冻结损伤后注入细胞时的细胞维持的判定,能够通过制作小鼠模型来实施。具体而言,对适当的小鼠(例如balb/c)的角膜的中央区域(例如2mm)利用低温损伤进行前处理,除去内皮细胞,制作模型。然后,对该模型的眼前房注入所应判定的细胞,在临床上观察角膜透明性的特征,利用测厚仪对角膜的厚度进行评价,利用人核染色在病理组织学上检查hcec的粘附,确认该细胞是否具有功能。
239.对于不是来自角膜内皮组织的细胞(也包括因角膜内皮组织的脱分化而得到的细胞)的细胞(例如干细胞(例如从诱导性多能干细胞(ips细胞)、胚胎干细胞(es细胞)等向角膜内皮前体细胞、角膜内皮细胞成熟分化而生产的细胞),只要具有本发明中记述的角膜内皮功能特性,则也落入本发明的在向人的眼前房内注入时能引起角膜内皮功能特性的功能性角膜内皮细胞或功能性成熟分化角膜内皮细胞的范围。在本说明书中所示的说明和实验中,本发明的人功能性成熟分化角膜内皮细胞有时也称作“人功能性成熟分化角膜内皮细胞”、“功能性成熟分化人角膜内皮细胞”、“功能性细胞”、“目标细胞”、“标准细胞”等,均以同义来使用。
240.在本说明书中,“角膜内皮非功能性细胞”为除本发明的角膜内皮特性具备功能性细胞(即,“功能性成熟分化角膜内皮细胞”)以外的细胞,有时称作“非目标细胞”、“不合格细胞”、“目标外细胞”、“非功能性细胞”、“非标准细胞”等。
241.在本说明书中,“细胞指标”是指显示某细胞为本发明的角膜内皮特性具备功能性细胞(例如功能性成熟分化角膜内皮细胞)的任意指标,由于是成熟分化人角膜内皮及具有成熟分化人角膜内皮的功能的任意细胞所具有的特性,因此也称作“功能性细胞指标”。其具体的特性也称作“细胞功能特性”。
242.本说明书中“能将培养应激极小化的培养条件”是指能够使增殖应激等细胞的培养时的应激最小化(极小化)的任意的培养条件。对于“培养应激”,能够以在采用相位差显微镜的观察中发生相变的大型且异形的细胞的混杂被确认为5~20%以上、或者在培养第30天以后至第40天为止的细胞密度是否低于1000个
·
mm2水准为指标进行测定,如果针对某供体在预备的实验中表明按照该指标能够将培养应激极小化,则能够将其条件应用于实际的细胞的制备及施用时。这样的培养条件例如能够通过使细胞生长因子、例如上皮生长因子的量低于发生转化的量进行培养来达成,但是并不限定于此。尽管该量能够基于供体的年龄、细胞接种时的细胞密度、生长因子的添加浓度等发生变动,但本领域技术人员能够
考虑能获得的各种信息、供体的信息等而确定这样的条件(例如量等)。
243.本说明书中“转化”是指变化为细胞的性状不正常的状态,包括如下意思:正常细胞无限制地进行分裂即癌化、或者在化生中特别动态(dynamic)的状态(脱分化至干细胞或者越过组织的基本形态的壁而发生变化的状态)。作为转化的例子,可列举emt,纤维化、上皮间质转化、老化、脱分化、内皮间质转化等之类的细胞状态相变(cst)。角膜内皮细胞大多频繁发生上皮间质相变之类的转化而变得不再是功能性成熟分化角膜内皮细胞。或者,转化包括内皮间质转化。本发明的制造方法包括如下的制造法:即使是如上所述的发生了上皮间质转化或内皮间质转化的细胞,通过使其脱分化后进行成熟分化,也能转化为功能性成熟分化角膜内皮细胞。
244.本说明书中“低于发生转化的量”是指在提及细胞生长因子等时比使成为对象的角膜内皮细胞发生转化(例如内皮间质转化)的量少或根本不发生转化的量。在以低于发生转化的量使用细胞生长因子的情况下,其特征是不引发包括由增殖应激所致的内皮间质转化在内的转化。例如在使用egf作为细胞生长因子的情况下,作为低于发生转化的量的量,为少于约1ng/ml,优选少于约0.5ng/ml,进一步优选少于0ng/ml。
245.本说明书中“内皮间质转化”(endmt)是指内皮细胞向间质细胞转化。
246.在本说明书中,“上皮间质相变”(emt;也称作上皮间质转化)是指上皮细胞失去其细胞极性、与周围细胞的细胞粘附功能并且得到迁移、浸润能力从而变化为间质样细胞的过程。
247.本说明书中“细胞生长因子”是在动物的体内促进特定细胞的生长、增殖的蛋白的统称,有时与“增殖因子”、“细胞增殖因子”同义。可列举上皮细胞生长因子(egf)、成纤维细胞生长因子(fgf)、胰岛素样生长因子(igf)、转化生长因子(tgf等)。在本发明中,其特征之一为在培养中不添加对细胞赋予细胞应激(称作增殖应激)的生长因子。应激的强度根据添加浓度、添加时间、添加时期而发生变动。
248.在此,作为本说明书中所能使用的各种试样、制造方法中的起始细胞,只要是功能性成熟分化角膜内皮细胞或目标细胞或被认为包含来自这些细胞的能够进行基因表达的物质的试样即可,例如,能够使用从角膜内皮直接分离的细胞(也称为来自角膜内皮组织的细胞)或通过进行分化而具有角膜内皮样功能的细胞。来自角膜内皮组织的细胞能够通过公知的方法来取得(koizumi n,okumura n,kinoshita s.,experimental eye research.2012;95:60-7.)。优选能够使用从角膜内皮的供体得到的细胞等作为细胞试样。另外,能够使用培养细胞(包含在体外被分化诱导的、本发明的角膜内皮特性具备功能性细胞或功能性成熟分化角膜内皮细胞)作为试样。对于向体外的本发明的角膜内皮特性具备功能性细胞或功能性成熟分化角膜内皮细胞的分化诱导,能够通过以公知的es细胞、ips细胞、骨髓间质细胞等细胞作为起始材料并利用公知的方法、例如amed法等使其进行分化<ueno m,matsumura m,watanabe k,nakamura t,osakada f,takahashi m,kawasaki h,kinoshita s,sasai y:,proc natl acad sci usa.103(25):9554-9559,2006.>处理来实施。
249.在用于本说明书的情况下,具代表性地,在相对地表现细胞的表达强度时可以使用cd44阴性~弱阳性cd24阴性cd26阴性的、mirna的“高表达”、“中表达”及“低表达”等的表现形式。需要说明的是,有时也没有“中表达”,在该情况下,能够用“高表达”及“低表达”来
识别各个细胞。
250.本说明书中“细胞的大小”为本发明的角膜内皮特性具备功能性细胞的一个细胞指标,可通过该领域中惯用的技术来测定。细胞的大小例如通过细胞面积来表现。本说明书中“细胞面积”是本发明的角膜内皮特性具备功能性细胞的一个细胞指标,能够拍摄细胞的照片并用任意的软件等进行测定。作为这样的测定方法,可列举例如利用bz-h3c hybrid细胞计数软件(keyence)等图像处理软件的方法。其平均值是指“平均细胞面积”。通常使用算术平均。
251.本说明书中“细胞的密度”、“(平均)细胞密度”是以一定面积中存在的细胞的数量来表示的细胞的指标,可通过该领域中惯用的任意技术来测定。细胞群的平均密度是本发明的角膜内皮特性具备功能性细胞或功能性成熟分化角膜内皮细胞的一个细胞指标。作为平均,通常使用算术平均。有时也与细胞的大小同时测定,能够利用倒立显微镜系统(例如、ckx41,olympus,tokyo,japan)并使用包含bz x-700显微镜系统(keyence,osaka,japan)等图像取得系统的设备来取得摄影相位差显微镜图像,使用细胞计数软件(例如bz-h3c hybrid细胞计数软件(keyence))等进行定量。关于细胞密度,除了以饱和细胞培养(也称作(培养)汇合(confluent),在本说明书中,饱和细胞培养和(培养)汇合以相同含义来使用。)时的密度为指标外,接种时的密度也在本发明的制造方法中作为基准来使用。另外,细胞密度也能作为注入后的治疗成绩的指标来使用。
252.本说明书中“细胞代谢产物”是指细胞所生成的任意代谢产物,“细胞代谢产物(该产物)的相关生物体物质”是指与细胞代谢产物相关的任意的生物体物质(例如合成该代谢产物的酶、进行代谢的酶、与信号转导通路关联的蛋白等),其是本发明的角膜内皮特性具备功能性细胞或功能性成熟分化角膜内皮细胞的一个细胞指标。作为代谢产物,例如包括与线粒体系统中的能量代谢系统的产物、谷胱甘肽代谢系统产物、蛋氨酸代谢循环产物、脂质代谢产物、戊糖磷酸路径产物、三羧酸(tca)循环代谢产物、糖酵解系统代谢产物等相关的任意产物,特别重要的是tca循环代谢产物、糖酵解系统代谢产物。作为细胞代谢产物及该产物的相关生物体物质,可列举例如琥珀酸、pro、gly、甘油3-磷酸酯、glu、乳酸、精氨琥珀酸、黄嘌呤、n-氨基甲酰基天冬氨酸、异柠檬酸、顺乌头酸、柠檬酸ala、3-磷酰甘油酸、羟基脯氨酸、苹果酸、尿酸、甜菜碱、叶酸、gln、2-氧代异戊酸、丙酮酸、ser、次黄嘌呤、asn、trp、lys、胆碱、tyr、尿素、phe、met、肌肽、asp、鸟氨酸、arg、肌酸、2-羟基谷氨酸、β-ala、瓜氨酸、thr、ile、leu、val、肌酸酐、his、n,n-二甲基甘氨酸。
253.本发明的细胞的检测、鉴定、品质管理等能够通过使用与成为标记物的物质结合的物质、相互作用分子来实现。在本发明的上下文中,与成为标记物的物质“结合的物质”或“相互作用分子”是至少暂时与成为标记物的物质(例如cd44)等分子结合、而且优选能显示已结合(例如为被标记或能标记的状态)的分子或物质。与cd44等分子结合的物质可以为cd44等分子的配体,作为其例子,可列举抗体、反义寡核苷酸、sirna、低分子量分子(lmw)、结合性肽、适体(aptamer)、核糖酶及拟肽(peptidomimetic)等,也包括例如针对cd44等分子的结合性蛋白或结合性肽、以及针对cd44等分子的基因的核酸。在本说明书中,针对cd44等分子的“结合性蛋白”或“结合性肽”是指与cd44等分子结合的种类的蛋白或肽,而且包括针对cd44等分子的多克隆抗体或单克隆抗体、抗体片段及蛋白骨架,但并不限定于此。
254.在本说明书中,活性、表达产物(例如、蛋白、转录物(rna等))的“降低”、“减少”或“抑制”或其同义词是指特定的活性、转录物或蛋白的量、质或效果的降低、减少、或使之减少的活性。在减少之中,活性、表达产物等低于检测限时,有时特别区别而称作“消失”。在本说明书中,“消失”包含在“降低”、“减少”或“抑制”中。另外,“降低”不仅包括某些基因等的量或效果等与其完全表达的状态相比减少,而且还包括毫不引发表达的情况。
255.在本说明书中,活性、表达产物(例如蛋白、转录物(rna等))的“增加”或“活化”或其同义词是指特定的活性、转录物或蛋白的量、质或效果的增加或使之增加的活性。对于“增加”,除了包括在比较前的状态下特定的活性、转录物或蛋白的量、质或效果存在的情况(已经存在的量相对地增加)以外,还包括在特定的活性、转录物或蛋白的量、质或效果不存在的情况下被引发(从无到有)。
256.本说明书中“线粒体依赖性氧化的磷酸化”是指也称作“线粒体oxphos”的、依赖于呼吸活性的氧化的磷酸化反应。对于与“线粒体oxphos”相关的反应,对细胞内代谢的状态进行解析的细胞外通量分析仪(extracellular flux analyzer)能够测量作为oxphos活性的指标的氧消耗速度(ocr)及作为糖酵解活性的指标的细胞外酸性化速度(ecar)。
257.本说明书中“细胞质
·
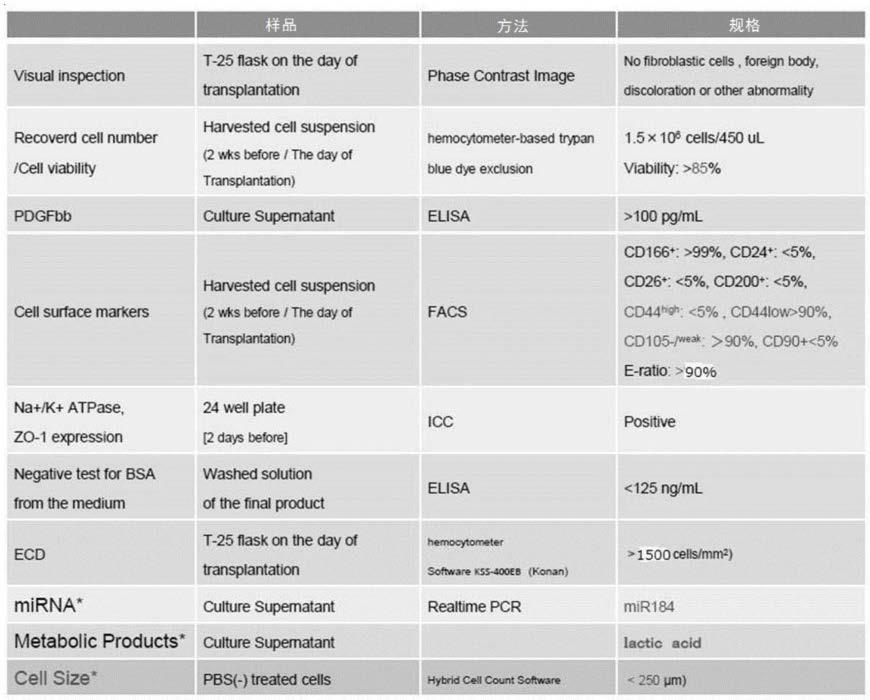
核内的乙酰coa的表达”是指乙酰coa在细胞质
·
核内表达。在本说明书中,通过使用对公知的蛋白表达进行解析的任意的方法、抗体的细胞免疫染色,从而能够测定乙酰coa的表达。
258.本说明书中“由通过乙酰coa进行的组蛋白乙酰化介导的表观遗传性的多基因表达”是指通过利用乙酰coa将组蛋白乙酰化来调节多种基因的表达。利用这些多基因的表达,可引起细胞的相变cst。在本说明书中,例如能够利用cellmetab.2015mar 3;21(3):349-50.、trendsincell biology,june 2017,vol.27,no.6及sheikhet al.nature rev.genetics,2019中所公开的方法来测定表观遗传性的多基因表达,另外,针对代谢产物的表观遗传学控制和细胞老化、细胞分化的破绽,认为如图64的示意图所示。
259.本说明书中,对于“与角膜内皮(细胞)功能特性(混浊、水肿的改善,其结果能够持续地长期保持角膜内皮组织细胞密度,实现视力改善)相关联的功能性蛋白角膜”,也指“角膜内皮(细胞)功能特性关联功能性蛋白”或“(本发明的)功能性蛋白”,是指具有如下功能的任意的蛋白,所述功能为角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善,可理解为除包括aqp1、na-katpase、nhe1等本说明书中记载的任意蛋白以外,还包括其他蛋白。可理解为:功能性蛋白除了包括例如钠/氢交换体1(nhe1)和/或水通道蛋白1(aqp-1)、重碳酸脱水酶5b(ca5b)(表达亢进)以外,还包括线粒体中的、柠檬酸合酶(cs)、乌头酸酶2(aco2)、异柠檬酸脱氢酶2(idh2)、苹果酸脱氢酶2(mdh2)、苹果酸酶3(me3)、acss1、乙酰coa乙酰转移酶1(acat1)、丙酮酸脱氢酶(pdh)、bcat2及支链酮酸脱氢酶2(bckdh2)等。
260.另外,对于“功能性蛋白”的“表达”,除了包括“功能性蛋白”表达以外,还包括在线粒体中线粒体依赖性氧化的磷酸化增加或细胞质
·
核内的乙酰coa的表达、以及不引发由通过accoa进行的组蛋白乙酰化介导的表观遗传性的多基因表达。
261.此外,对于“功能性蛋白”的“表达”,除了包括“功能性蛋白”表达以外,还包括降低或不引发具有与“功能性蛋白”相反功能的蛋白的表达,此种情况包括不表达或几乎不表达atp柠檬酸裂解酶(acly)、乌头酸酶1(aco1)、异柠檬酸脱氢酶1(idh1)、苹果酸脱氢酶1(mdh1)、苹果酸酶1(me1)、acss2、乙酰coa乙酰转移酶2(acat2)和/或乳酸脱氢酶(ldh)等。
262.在此,对于实质上或几乎“不表达”,能够通过在使用于本发明中时是否能引发人角膜内皮功能特性来判定。
263.综上所述,“被确认到表达与角膜内皮(细胞)功能特性(角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善)相关联的功能性蛋白”有时也能表现为“被确认到表达与角膜内皮(细胞)功能特性(角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善)相关联的功能性蛋白、或者不引发或降低阻碍该角膜内皮(细胞)功能特性的蛋白。
264.在本发明中,“rho激酶”或“rock”(rho-associated coiled-coil forming kinase:rho结合激酶)是指随着rho的活化而被活化的丝氨酸/苏氨酸激酶。可列举例如rokα(rock-ii:leung,t.et al.,j.biol.chem.,270,29051-29054,1995)、p160rock(rokβ、rock-i:ishizaki,t.et al.,the embo j.,15(8),1885-1893,1996)及其他的具有丝氨酸/苏氨酸激酶活性的蛋白。
265.作为rock抑制剂(也称作rho激酶抑制剂),可列举下述文献中公开的化合物,所述文献为美国专利4678783号、日本专利第3421217号、国际公开第95/28387、国际公开99/20620、国际公开99/61403、国际公开02/076976、国际公开02/076977、国际公开第2002/083175、国际公开02/100833、国际公开03/059913、国际公开03/062227、国际公开2004/009555、国际公开2004/022541、国际公开2004/108724、国际公开2005/003101、国际公开2005/039564、国际公开2005/034866、国际公开2005/037197、国际公开2005/037198、国际公开2005/035501、国际公开2005/035503、国际公开2005/035506、国际公开2005/080394、国际公开2005/103050、国际公开2006/057270、国际公开2007/026664等。上述化合物能够通过各自所公开的文献中记载的方法来制造。作为具体例,可列举1-(5-异喹啉磺酰基)高哌嗪或其盐(例如法舒地尔(fasudil;1-(5-异喹啉磺酰基)高哌嗪))、( )-反-4-(1-氨基乙基)-1-(4-吡啶基氨基甲酰基)环己烷((r)-( )-反-(4-吡啶基)-4-(1-氨基乙基)-环己烷甲酰胺)或其盐(例如y-27632((r)-( )-反-(4-吡啶基)-4-(1-氨基乙基)-环己烷甲酰胺二盐酸盐一水合物)等)等,这些化合物也能适合使用市售品(和光纯药株式会社,asahi kasei pharma等)。本说明书中的rock抑制剂能够特别用于使培养人角膜内皮细胞增殖和/或分化
·
成熟的工序中。在一个实施方式中,有时也会在进行脱分化而得到角膜内皮前体细胞的工序中不使用rock抑制剂。另外,虽然不期望受到理论束缚,但是,对于rock抑制剂,可以根据成为脱分化或分化
·
成熟的对象的角膜内皮细胞或角膜内皮前体细胞等的传代数、或者成为其来源的供体年龄等细胞固有的性质,用于或不用于在进行脱分化而得到角膜内皮前体细胞的工序中。例如,针对一例进行阐述时,在传代数少的情况(例如传代数为1、2或3左右的情况)和/或来自年轻供体的细胞的情况下,可以仅用于增殖和/或分化
·
成熟的工序中,在传代数多的情况(例如传代数为4、5、6等)下,也可以在细胞接种时使用rock抑制剂。这样,在一定的实施方式中,发现仅通过只在增殖和/或分化
·
成熟的工序中使用rock抑制剂,就能够得到与整个期间赋予rock抑制剂的情况相匹敌的水平的细胞,这也是本发明的成果之一。
266.(优选的实施方式)
267.以下对本发明的优选实施方式进行说明。以下提供的实施方式是为了更好地理解本发明而提供的,不应理解为本发明的范围受到以下记载的限定。因此,本领域技术人员明
显能够参考本说明书中的记载在本发明的范围内进行适当地改变。另外,可理解为本发明的以下的实施方式可以单独使用、或者将它们组合来使用。
268.需要说明的是,在本说明书中,适宜参考国际公开2017/141926并将其援引于下述的各个方面中。因此,应理解为在适当的情况下wo2017/141926的内容作为参考而援引于本说明书中。
269.(在向人的眼前房内移入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞)
270.在本发明的一个方面中,本发明提供一种人功能性角膜内皮细胞,其被确认到表达与角膜内皮(细胞)功能特性相关联的功能性蛋白、或者其不引发或降低阻碍该角膜内皮(细胞)功能特性的蛋白,所述角膜内皮(细胞)功能特性为角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善。这样的功能性蛋白的表达或者不引发或降低蛋白是本领域技术人员能够按照本说明书的公开内容并鉴于本实施例的例示而适当实施的。在本发明中,对于被确认到表达与角膜内皮(细胞)功能特性(角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实施视力改善)相关联的功能性蛋白、或者不引发或降低阻碍该角膜内皮(细胞)功能特性的蛋白的人功能性角膜内皮细胞,有时也表述为“被确认到表达与角膜内皮(细胞)功能特性(角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善)相关联的功能性蛋白的人功能性角膜内皮细胞,只要它们未被特别注释,则为同义。
271.在一个实施方式中,本发明提供一种细胞,其是在向人眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞,所述人功能性角膜内皮细胞包括选自如下中的至少一个特性:(i)在线粒体中线粒体依赖性氧化的磷酸化增加;(ii)细胞质
·
核内的乙酰coa的表达不增加;以及(iii)由通过乙酰coa进行的组蛋白乙酰化介导的表观遗传性的多基因表达降低。在该情况下,乙酰coa的表达增加也包括在非功能性角膜内皮细胞中不表达的乙酰coa进行表达,另外,表观遗传性的多基因表达降低也包括完全不引发。另外,在本发明的一个实施方式中,这样的细胞也可以包括选自如下的全部特征:(i)在线粒体中线粒体依赖性氧化的磷酸化增加;(ii)在线粒体内中细胞器选择性地引发乙酰coa的表达而不发生细胞质
·
核内的乙酰coa表达;(iii)表达与上述的角膜内皮(细胞)功能特性(角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善)相关联的离子通道、单羧酸转运体;以及(iv)与相变细胞的生成相关联的tca循环等所涉及的代谢酶不存在于细胞质、核而细胞器选择性地定位于线粒体中的特性、特别是降低或不发生由通过乙酰coa进行的组蛋白乙酰化介导的表观遗传性的多基因表达。
272.在本发明的一个实施方式中,本发明的人功能性角膜内皮细胞不发生或实质上不发生内皮-间充质转化。
273.另外,在本发明的一个实施方式中,本发明的人功能性角膜内皮细胞在线粒体中表达选自柠檬酸合酶(cs)、乌头酸酶2(aco2)、异柠檬酸脱氢酶2(idh2)、苹果酸脱氢酶2(mdh2)、苹果酸酶3(me3)、acss1、乙酰coa乙酰转移酶1(acat1)、丙酮酸脱氢酶(pdh)、bcat2及支链酮酸脱氢酶2(bckdh2)中的1种或多种代谢相关酶,在另一个实施方式中,该细胞不表达或实质上不表达选自atp柠檬酸裂解酶(acly)、乌头酸酶1(aco1)、异柠檬酸脱氢酶1(idh1)、苹果酸脱氢酶1(mdh1)、苹果酸酶1(me1)、acss2、乙酰coa乙酰转移酶2(acat2)及乳
酸脱氢酶(ldh)中的至少1种酶。
274.另外,在本发明的一个实施方式中,本发明的人功能性角膜内皮细胞使钠/氢交换体1(nhe1)和/或水通道蛋白1(aqp-1)的表达亢进,在另一个实施方式中,本发明的人功能性角膜内皮细胞使重碳酸脱水酶5b(ca5b)的表达亢进。
275.另外,在本发明的一个实施方式中,本发明的人功能性角膜内皮细胞也能以如下细胞作为起源来制作,所述细胞选自来自角膜内皮组织的细胞、多能性干细胞、间质干细胞、从角膜内皮采集的角膜内皮前体细胞、从角膜内皮采集的细胞、以及利用直接编程法制作的角膜内皮前体细胞及角膜内皮样细胞。
276.进而,在本发明的一个实施方式中,提供一种方法,其是在向人的眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞的品质管理或工序管理的方法、或者对混杂于人功能性角膜内皮细胞中的角膜内皮非功能性细胞进行检测的方法,所述方法包括确认以下(1)~(13)中的1个或多个项目的工序:
277.(1)在移植日的基于相位差图像的外观检查中,无成纤维细胞、异物、变色或其他的异常;
278.(2)移植日2周前和/或移植日的细胞数为1.5
×
106个细胞/450μl;
279.(3)通过台盼蓝染色,细胞存活率为85%以上;
280.(4)在细胞上清的基于elisa的纯度试验中,pdgf-bb为100pg/ml以上;
281.(5)在移植日2周前和/或移植日所采集的细胞上清的基于facs的纯度试验中,cd166
>99%、cd24
<5%、cd26
<5%、cd200
<5%、cd44
high
<5%、cd44
low
>90%、cd105-~weak
>90%、cd90
<5%;
282.(6)效应细胞(e-ratio)>90%;
283.(7)移植日2天前的泵功能(na /k atpase):阳性;
284.(8)移植日2天前的屏障功能(zo-1):阳性;
285.(9)在bsa阴性试验中不足125ng/μl;
286.(10)移植日的ecd为1500个细胞/mm2以上;
287.(11)mir184的表达;
288.(12)乳酸产生;
289.(13)细胞尺寸不足250μm。
290.另外,在另一实施方式中,提供一种细胞群,其是在向人的眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞的细胞群,所述细胞群满足以下(1)~(13)中的1个或多个项目:
291.(1)在移植日的基于相位差图像的外观检查中,无成纤维细胞、异物、变色或其他的异常;
292.(2)移植日2周前和/或移植日的细胞数为1.5
×
106个细胞/450μl;
293.(3)利用台盼蓝染色得到的细胞存活率为85%以上;
294.(4)在细胞上清的基于elisa的纯度试验中,pdgf-bb为100pg/ml以上;
295.(5)在移植日2周前和/或移植日所采集的细胞上清的基于facs的纯度试验中,cd166
>99%、cd24
<5%、cd26
<5%、cd200
<5%、cd44
high
<5%、cd44
low
>90%、cd105-~weak
>90%、cd90
<5%;
296.(6)效应细胞(e-ratio)>90%;
297.(7)移植日2天前的泵功能(na /k atpase):阳性;
298.(8)移植日2天前的屏障功能(zo-1):阳性;
299.(9)在bsa阴性试验中不足125ng/μl;
300.(10)移植日的ecd为1500个细胞/mm2以上;
301.(11)mir184的表达;
302.(12)乳酸产生;
303.(13)细胞尺寸不足250μm。
304.在该情况下,也可以为满足(1)~(13)的所有项目的细胞群。
305.需要说明的是,在实际的运用中,未必需要采用所有项目,作为品质标准,也可以仅采用(1)~(13)中的若干个项目。
306.例如,可以采用以下的项目作为品质标准:(3)、(5)中cd44
high
<5%、cd44
low
>90%、cd105-~weak
>90%、cd90
<5%;(6)、(11)、(12)、(13)。
307.另外,例如在发生一些事故而不能确保细胞的一致性时,进行生物学等同性试验,此时可以应用采用(1)~(13)的全部的实施方式。
308.此外,在试验中可以在(1)~(13)的基础上或代替性地追加本说明书中公开的1种或多种其他评价项目。
309.如上所述,本发明制作出了临床上显示极其优异的效果的培养人角膜内皮细胞,并且也明确了能够对其该细胞进行鉴定的技术,在这一点上可以说提供了有用性极高的技术。
310.在另一个方面,本发明提供一种在向人的眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞(也称为本发明的角膜内皮特性具备功能性细胞。)。本发明的角膜内皮特性具备功能性细胞为具有成熟分化角膜内皮的角膜内皮功能特性的细胞,在细胞注入治疗(例如在向人的眼前房内注入时能引发角膜内皮功能特性)中也发挥效果,因此,代表性地,可以称为在向人的眼前房内注入时能引发角膜内皮功能特性的人功能性角膜内皮细胞。本发明的角膜内皮特性具备功能性细胞除包括功能性成熟分化角膜内皮细胞外还可包括中程度分化角膜内皮细胞。本发明的功能性成熟分化角膜内皮细胞为发挥角膜内皮功能的成熟分化的细胞,作为最适合于注入的亚群的效应细胞形成小型且六边形的类卵石形状,利用基于线粒体功能的能量代谢系统。
311.以往报道了“培养角膜内皮细胞”或“培养人角膜内皮细胞”这样的名称的细胞,但是并不知晓这些细胞由多个亚群构成,将其明确后也不知晓其中存在特别最适合于细胞注入疗法的亚群,因此,本发明的意义重大。特别是,在本发明公开之前,与伴随再生医疗的细胞的不均质性有关的课题本身在人角膜内皮细胞中就未被明确地认识,找出并解决这样的课题的意义重大。人角膜内皮细胞(hcec)在体内不能进行细胞分裂并且在细胞周期的g1期停止,但是依然保持增殖能力,根据近年的研究,其原因可理解为长期培养hcec非常困难。
312.作为本发明的应用例,特别是在以下方面受到注目:将高品质、不显示核型异常、不引发免疫排斥应答的“allo”功能性成熟分化人角膜内皮细胞制成悬浮液来使用,能够通过前房内注入来再生角膜内皮功能。在使用本发明的细胞的医疗技术中,特别是能够将来自青年供体的角膜内皮细胞在生物体外扩增培养、放大后,将细胞悬浮液注入水疱性角膜
症患者的前房内进行治疗,在基于与使用人干细胞的临床研究有关的方针进行的临床研究中,人应用时的安全性、临床poc通过本发明得以证实
·
确立。
313.作为能够提供本发明的细胞的原因之一,发现了在注入治疗中使用的细胞为不均质细胞亚群的混合物、以及治疗中能使用的“在向人的眼前房内注入时能引发人角膜内皮功能特性的人功能性角膜内皮细胞”被限定为其一部分。
314.在本发明中,还判明:在角膜内皮细胞中,核型异常以亚群选择性地生成,且存在亚群选择性地反应的自体抗体。还判明,本发明的角膜内皮特性具备功能性细胞、特别是功能性成熟分化角膜内皮细胞中没有上述异常,与其他亚群相比,与免疫排斥反应有关的hla i类抗原相较于其他亚群相对地低表达,以往一直被推测为细胞标记物的cd200抗原的表达为阴性。还判明,在非目标细胞中与细胞老化有关的细胞因子(sasp相关蛋白)高产生。
315.在本发明公开前,再现性良好的培养手段有限,因此,对于想要将没有纤维化、细胞老化、上皮间质转化(emt)、内皮间质转化等之类的细胞状态相变(cst)且无核型非整倍性的培养人角膜内皮细胞在体外增殖的尝试,非常困难,原因在于,完全没有与该细胞特性有关的见解以及与细胞群是否由多个亚群构成、根据培养条件而产生的细胞群是否显示稳定的构成等有关的见解
·
报告,甚至连这样的视角上的解析也没有进行。
316.培养hcec具有发生cst而向老化表现型、emt及成纤维细胞形态转化的倾向。本发明的发明人们鉴定明确的细胞表面标记物(用于识别不适合作为移入细胞的这些培养夹杂细胞),能够规定可应用于重建非功能性人角膜内皮组织的hcec群。
317.需要说明的是,在本发明中,可以根据需要而适宜使用wo2017/141926中所记载的细胞标记物。
318.在一个实施方式中,本发明的角膜内皮特性具备功能性细胞具有本说明书中所规定的细胞指标的角膜表达特性。
319.对于本发明的角膜内皮特性具备功能性细胞可具有的细胞指标,包括细胞表面标记物(cd标记物等)、细胞产物特性、细胞形态指标、细胞的基因特性等,具体而言,可包括:细胞表面标记物(cd标记物等);蛋白性产物及该产物的相关生物体物质的特性;sasp相关蛋白的表达特性;mirna(例如细胞内mirna、分泌型mirna等)的表达;外来体的特性;细胞代谢产物及该产物的相关生物体物质的表达特性;细胞的大小;细胞的密度及自体抗体反应性细胞的存在。对于本发明的功能性成熟分化角膜内皮细胞,其细胞指标表示为特定的范围或水平的细胞功能特性或其组合。因此,通过确定特定的细胞指标的特定的范围或水平的细胞功能特性或其组合,能够判定是否为本发明的功能性成熟分化角膜内皮细胞。关于本发明的功能性成熟分化角膜内皮细胞所特有的特定的范围或水平的细胞功能特性或其组合,其是在本发明中首次鉴定的,由此能够特定各种的细胞亚群,能够进行品质管理、品质检定,进而能够实现效果高的治疗。以下,针对这些细胞指标及其特定的范围或水平的细胞功能特性或其组合,具体进行详细说明。
320.在特定的实施方式中,本发明的角膜内皮特性具备功能性细胞具有包括cd166阳性及cd133阴性的细胞功能特性。作为其他的细胞功能特性,重要的有cd44的表达特性,其表达强度可列举优选cd44阴性~中阳性、更优选cd44阴性~弱阳性、进一步优选cd44阴性,但并不限定于此。在本发明中,发现:为了确认角膜内皮细胞或分化为角膜内皮样的细胞是否具有功能性,可以通过确认为cd166阳性及cd133阴性,从而确认是否具有功能性。此外,
针对cd44,也可以通过确认其表达低(cd44阴性~中阳性,优选cd44阴性~弱阳性),从而以更高精度发现是否具有功能性。
321.因此,在优选的实施方式中,本发明的角膜内皮特性具备功能性细胞具有包括cd166阳性、cd133阴性及cd44阴性~弱阳性的细胞功能特性。虽然不期望受到理论束缚,但是通过具有这三种细胞标记物,可确认到在角膜内皮细胞或分化为角膜内皮样的细胞中为具有高品质的功能性的功能性成熟分化角膜内皮细胞。对于这样的功能性,在临床研究的结果中,以在短期(例如1个月左右)内角膜内皮细胞检查(specular)的值来看,显示为能够实现超过约1000(个/mm2)的水平、超过约2000(个/mm2)的水平、优选超过约2300(个/mm2)的水平、进一步优选超过约2500(个/mm2)的水平、根据情况超过约3000(个/mm2)的水平这样的高水平的治疗效果。
322.进一步优选的是:本发明的角膜内皮特性具备功能性细胞具有包括cd166阳性、cd133阴性及cd44阴性的细胞功能特性。虽然不期望受到理论束缚,但是通过进一步限定为cd44阴性细胞,能够更适当地提供高度确保了增殖能力等的品质高的细胞(在本说明书中,有时称作“高品质”的功能性成熟分化角膜内皮细胞。)。“高品质”的功能性成熟分化角膜内皮细胞具有更稳定、已改善的角膜内皮功能特性。
323.在另一个实施方式中,本发明的角膜内皮特性具备功能性细胞具有包括cd166阳性、cd133阴性及cd200阴性的细胞功能特性。以往,对于cd200,据称cd200阳性为角膜内皮细胞的特性,但是在本发明中通过对每个亚群进行详细研究,判明cd200阳性细胞为不适合移入的具有cst的大型细胞,并且发现cd200阴性为在向人的眼前房内移入时能引发人角膜内皮功能特性的功能性角膜内皮细胞的特性。对于这样的特性,是以往的见解所不能被预想到的,可以说是在本发明中对亚群进行潜心分析的结果。
324.在另一个实施方式中,本发明的角膜内皮特性具备功能性细胞具有包括cd166阳性、cd133阴性、cd44阴性~cd44弱阳性及cd90阴性~弱阳性的细胞功能特性。由此能够进一步确保细胞的同质性。或者,细胞表面抗原包括cd166阳性、cd133阴性及cd44阴性~中阳性、cd90阴性表现型。在另一个实施方式中,细胞表面抗原包括cd166阳性、cd133阴性及cd44阴性~cd44弱阳性表现型,或者细胞表达包括cd44阴性~cd44弱阳性表现型的细胞表面抗原。
325.本发明的角膜内皮特性具备功能性细胞可进一步具有追加的细胞功能特性。作为这样的细胞功能特性,可包括cd90阴性(cd90阴性~弱阳性)、cd105阴性~弱阳性、cd24阴性、cd26阴性、lgr5阴性、ssea3阴性、mhc1弱阳性(特别是与相变细胞相比为弱阳性。)、mhc2阴性、pdl1阳性、zo-1阳性、na
k
/atpase阳性、紧密连接蛋白10阳性等表达特性中的一个或多于一个的表达特性,但是并不限定于此。或者,群组可以为由cd105阴性~弱阳性、cd24阴性、cd26阴性、lgr5阴性、ssea3阴性、mhc1弱阳性、mhc2阴性、zo-1阳性、na /k atpase阳性组成的群组。
326.在本说明书中,对于cd标记物等细胞指标的标记物的表达强度,将实质上不表达的情况表示为阴性(有时表示为-。另外,分成-和
±
的情况也都包含在内)。在此,阴阳性(dull positive)在本说明书中包含在阴性中。将不是阴性的情况、即观察到显著表达的情况以阳性(即,在以 和-两个分类来表示的情况下,有时表示为 。)来表示。在特别区分表达水平的情况下,将其强度分成三个等级,用弱阳性、中阳性、强阳性来识别。根据facs测定的
结果图表的显示等关系,它们有时也以 的个数来表示,弱阳性、中阳性、强阳性有时也分别以 、 、 来表示,但是它们为同义。在该情况下,能够以“弱阳性”“中阳性”“强阳性”的形式加以区别。在不能区分的情况下,也可以简称为阳性。在不满足弱阳性的情况下,通常称作阴性。这些水平的强度如该领域中所惯用那样来使用。这些水平是相对的,按照以下方式来定义。例如
“‑”
是指实质上观察不到表达。可确认到表达的情况分成弱阳性、中阳性、强阳性三个等级。在facs分离时,信号可以分成阴性、弱阳性、中阳性、强阳性四个等级。
327.具体的水平与facs中的信号强度的显示有关,关于阴性、阴阳性、弱阳性、中阳性、强阳性的表示,可以使用平均荧光信号强度(mfi)来识别。将细胞的分布用直方图(histogram)来表示,进行相对性地判断,可以表示为阴性、阴阳性、弱阳性、中阳性、强阳性,对与更具体的测定值有关的判断基准进行说明时,具体而言,可例示如以下所述的水平。
328.在本说明书中,对于cd标记物等细胞指标的标记物的表达强度,具代表性地,荧光强度根据标记的荧光的种类、设备设定的不同而不同,因此为以下的条件:使用pe-cy 7标记抗人cd44抗体(bd biosciences),将facs canto ii的blue laser的area scaling factor设为0.75、将pe-cy 7的voltage设为495时的弱荧光强度范围小于约3800,中荧光强度范围为约3800以上至小于27500,强荧光强度范围为约27500以上。需要说明的是,在本说明书的实施例中,该设定下的阴性对照(同型对照)的平均荧光强度为约50。(55
±
25的范围,根据细胞批次的不同,即使在相同的设定下也会略有偏差,但是本领域技术人员能够理解这些偏差来实施。)。因此,从“弱荧光强度范围为小于约3800,中荧光强度范围为约3800以上且小于27500,强荧光强度范围为约27500以上。”来看,阴性对照(同型对照)的平均荧光强度pe-cy 7为约50[33~80左右],因此弱:<76倍、中:76~550倍、强>550倍。关于阴性对照(同型对照),如果是相同的染色强度图谱,则为阴性,只要有一点偏移,则判断为阳性。
[0329]
在本说明书中使用的情况下,作为其他的设定值,可列举以下内容:
[0330]
·
area scaling factor:fsc=0.5、blue laser=0.75、red laser=0.8
[0331]
·
voltage:fsc=270、ssc=400、fitc=290、pe=290、percp-cy 5.5=410、pe-cy 7=495、apc=430
[0332]
·
作为阴性对照(同型对照)的平均荧光强度,可列举以下内容。
[0333]
fitc:约130[65~225左右]
[0334]
pe:约120[73~204左右)]
[0335]
percp-cy5.5:约120[74~191左右]
[0336]
pe-cy 7:约50[33~80左右]
[0337]
apc:约110[67~196左右]。
[0338]
需要说明的是,这样的细胞的标记物的强度能够易于通过荧光活化细胞分类及免疫组织化学等(并不限定于此)的技术来评价。关于上述的标记物及它们的表达水平,“阴性”是指标记物的表达欠缺或其水平显著变低,“阳性”是指表达显著。细胞标记物从“阴性”向“阳性”的转移表示从欠缺的表达或低水平的表达向高水平或显著水平的表达的变化。“弱阳性”这一术语是指弱表达即低水平的表达,有时也表示为“低表达”,“中阳性”是指能够容易地检测的中水平的表达,因此有时也表示为“中表达”,“强阳性”是指表达显著且能够极容易地检测的强表达即高水平的表达,有时也表示为“高表达”。在该情况下,能够容易
地确认表达从“弱阳性”向“中阳性”的转移、表达从“中阳性”向“强阳性”的转移或者表达从“强阳性”向“中阳性”的转移、表达从“中阳性”向“弱阳性”的转移。例如,非目标细胞显示cd44强阳性,前体细胞显示cd44中阳性,本发明的功能性成熟分化角膜内皮细胞显示cd44阴性或cd44弱阳性。例如如实施例所示,能够使用2个以上的细胞表面标记物等而将细胞分类成亚群等。
[0339]
本发明中所使用的其他的细胞指标包括mhc-1、mhc-2的表达强度,均与无免疫排斥相关联。本发明在临床上被用于细胞注入治疗,因此优选无免疫排斥反应或免疫排斥反应低。
[0340]
本发明中所使用的其他细胞指标包括zo-1、na
k
/atpase。它们是为了显示人角膜内皮细胞的功能性而密接相关的特性,因此优选它们均正常地明确表达( )。
[0341]
本发明所提供的本发明的角膜内皮特性具备功能性细胞能够实现革新性治疗法的临床应用,但是需要进行品质管理,并且需要用于该品质管理的信赖度高的方法。在本发明中可提供不发生细胞相变(cst)及核型异常(非整倍性)的功能性成熟分化角膜内皮细胞的识别及品质管理。
[0342]
在一个实施方式中,本发明的角膜内皮特性具备功能性细胞可具有针对特定的细胞因子或其相关物质而功能性特异的特性。作为这样的特性,可列举例如pdgf-bb高产生、il-8低产生、mcp-1低产生、tnf-α高产生、ifnγ高产生及il-1r拮抗剂高产生、vegf低产生等,但是并不限定于此。作为优选的指标,反映攻击炎症性细胞等的状态时的细胞因子水平是不优选的,反映为正常状态时的状态的细胞因子水平是优选的。
[0343]
本发明的细胞优选在使用前进行品质检定时满足如以下所述的基准。
[0344]
在此,外观试验包括确认为六边形的类卵石形状或未进行纤维化等。
[0345]
在本发明中,作为品质标准,作为一例可列举满足下表所述的基准。
[0346]
[表1]
[0347][0348]
本发明的角膜内皮特性具备功能性细胞优选的是其细胞面积小、即为小细胞。在本发明中,细胞面积通常利用在将经pbs处理的细胞图像化的条件下的细胞面积来评价。即,在本说明书中,对于杂种细胞计数(hybrid cell count)的测定值,由于利用经pbs处理的细胞取得图像,因此利用在细胞间形成间隙的状态的面积来测定。即,用与培养液中饱和细胞培养(汇合)时的形成有紧密接头(tight junction)的成熟分化的状态相比细胞面积更低的值来测定。功能性细胞的每1个细胞的面积小,培养时的细胞密度最高,由此在本发明中判明品质高。这可以说是与正常角膜内皮组织的内皮细胞相同水准的细胞面积、细胞密度的水平或超出该水平的水平。作为经pbs处理的细胞的优选饱和细胞培养(汇合)时的细胞面积,可列举该细胞群的平均或各个细胞为约250μm2以下,更优选可列举约245μm2以下、约240μm2以下、约235μm2以下、约230μm2以下、约225μm2以下、约220μm2以下、约215μm2以下、约210μm2以下、约205μm2以下、约200μm2以下等。另一方面,对于作为本发明的角膜内皮特性具备功能性细胞的优选的细胞面积所能实现的值而言,可列举例如约150μm2以上、约155μm2以上、约160μm2以上、约165μm2以上、约170μm2以上、约175μm2以上、约180μm2以上等,但是并不限定于此。细胞面积能够利用该领域中公知的任意方法来测定,作为其代表性的例子,有使用相位差显微镜图像的测定法,在此,能够使用倒立显微镜系统(ckx41,olympus,tokyo,japan)等市售的系统进行拍摄。另外,为了测定面积分布,例如能够通过将成为对象的细胞用pbs(-)清洗3次等方式进行易于测定的前处理后,使用例如bz x-700显微镜系统(keyence,osaka,japan)等市售的系统来取得相位差显微镜图像。另外,面积分布能够使用bz-h3c hybrid细胞计数软件(keyence)等市售的软件进行定量。
[0349]
因此,对于本发明的角膜内皮特性具备功能性细胞而言,在选自细胞的大小、细胞
的密度及自体抗体反应性细胞的存在中的至少1个细胞指标中具有上述优选的数值是有利的。
[0350]
对于本发明的角膜内皮特性具备功能性细胞,优选如本说明书中所说明的、在选自细胞表面标记物、蛋白性产物及该产物的相关生物体物质、sasp关联蛋白、细胞内或分泌型mirna、外来体、包含氨基酸的细胞代谢产物及该产物的相关生物体物质、细胞的大小、细胞的密度及自体抗体反应性细胞的存在中的至少一个细胞指标中,具有与本发明的角膜内皮特性具备功能性细胞(即包括功能性成熟分化角膜内皮细胞及中程度分化角膜内皮细胞)相同的细胞功能特性、优选与功能性成熟分化角膜内皮细胞相当的细胞功能特性。作为本发明中优选的细胞指标,例如可以任意地采用在本说明书的关于各指标的说明中所记载的具体的数值、范围、水平,也可采用它们的组合。在某候补细胞针对这些细胞指标而具有本说明书中所规定的本发明的角膜内皮特性具备功能性细胞、优选功能性成熟分化角膜内皮细胞所应具有的值的情况下,该候补细胞被判定为在向人的眼前房内注入时表达人角膜内皮功能特性的中程度分化角膜内皮细胞或功能性成熟分化角膜内皮细胞。另外,除利用上述所列举的细胞指标的判定以外或者同时还能参照如以下所示的指标。特别是,本发明的角膜内皮特性具备功能性细胞的功能能够通过形成小型且六边形的类卵石形状利用基于线粒体功能的能量代谢系统来确认,并且能够通过在注入时(例如注入至眼前房内)是否具有治疗效果来判定。进而,替代指标之类的指标也是有效的,并不受限定。作为此种替代指标,也能将以下10种中的任一种或其组合作为指标,即,(1)内皮泵
·
屏障功能的保持、(包括紧密连接蛋白表达)的阳性;(2)对层粘连蛋白511或其片段e8的高粘附
·
结合性;(3)分泌细胞因子谱、pdgfbb、tnfα、ifnγ、il-1受体拮抗剂的产生量为基准值以上;(4)基于产生的microrna(mirna)谱的规定;(5)基于产生的代谢产物谱的规定;(6)表达与上述的角膜内皮(细胞)功能特性(角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实现视力改善)相关联的离子通道、单羧酸转运体;(7)与相变细胞的生成有关的tca循环等所涉及的代谢酶不存在于细胞质、核中而细胞器选择性地定位于线粒体中的特性;(8)体外培养时的饱和细胞密度;(9)在培养时所得的细胞的空间的大小、其分布;(10)在对小鼠角膜进行液体氮低温冻结损伤后注入细胞时的对角膜内皮面的粘附性。特别是,虽然不期望受到理论束缚,但是其原因为:能够通过蛋白性产物或该产物的相关生物体物质来大致判别是否为该cst细胞,通过mirna,能够将目标外细胞的一部分或全部除去,通过细胞代谢产物或该产物的相关生物体物质,能够将中程度分化角膜内皮细胞和功能性成熟分化角膜内皮细胞加以区分,能够在培养物中选择性地增殖品质更高的功能性角膜内皮细胞。
[0351]
在优选的实施方式中,本发明的角膜内皮特性具备功能性细胞、特别是成熟分化角膜内皮细胞不具有核型异常。在将chcec应用于细胞注入再生药物上的最大障碍是如miyai等所示那样chcec大多情况下因数代的传代而在培养中显示非整倍性(miyai t,et al.,mol vis.2008;14:942-50)。因细胞分裂而在培养中诱导了chcec中所观察到的非整倍性。在此,本发明的发明人们提供新见解,指出chcec有无非整倍性与在chcec中占优势的特定的细胞亚群密切相关。本发明的发明人们发现无核型异常的特定细胞亚群与在角膜组织中存在的功能性成熟分化角膜内皮细胞同时出现在表面表达型的特定图谱中。成功地确立了从无核型异常的功能性成熟分化角膜内皮细胞中选择性地增殖大部分细胞亚群的经过精炼的培养条件,由此为了水疱性角膜症等角膜内皮障碍的处置而将功能性成熟分化角膜
内皮细胞以细胞悬浮液的形态注入前房,从而能够提供安全且稳定的再生药物。这样,在本发明中发现亚群选择性地产生核型异常,这是迄今为止还未不明确的。而且,通过使用本发明的技术,能够选择实质上不发生核型异常的亚群。
[0352]
在另一个方面,本发明提供一种细胞群,其包含本发明的角膜内皮特性具备功能性细胞、特别是功能性成熟分化角膜内皮细胞。
[0353]
本发明的细胞群的平均细胞密度在饱和细胞培养(汇合)时优选为至少约1500个/mm2以上、至少约1600个/mm2以上、至少约1700个/mm2以上、至少约1800个/mm2以上、至少约1900个/mm2以上、或至少约2000个/mm2以上。可理解为包含本发明的角膜内皮特性具备功能性细胞的细胞群由于细胞的大小较小,因此可将其密度提供得相当高。细胞密度是伴随高品质的角膜内皮功能特性出现的特征,通过反向地测定这样的细胞密度,能够用作选择品质高的功能性成熟分化角膜内皮细胞的一个指标。细胞密度是与细胞面积直接相关的数值,因此能够通过利用该领域中公知的任意方法测定细胞面积来同样地推算。如上所述,作为其代表性的例子,有使用相位差显微镜图像的测定法,在此,能够使用倒立显微镜系统(ckx41,olympus,tokyo,japan)等市售的系统进行拍摄。另外,为了测定面积分布,例如能够通过将成为对象的细胞用pbs(-)清洗3次等方式进行易于测定的前处理后,使用例如bz x-700显微镜系统(keyence,osaka,japan)等市售的系统来取得相位差显微镜图像。另外,面积分布能够使用bz-h3c hybrid细胞计数软件(keyence)等市售的软件进行定量。
[0354]
在优选的实施方式中,本发明的细胞群的平均细胞密度为至少约2100个/mm2以上、至少约2200个/mm2以上、至少约2300个/mm2以上、至少约2400个/mm2以上、至少约2500个/mm2以上,但是并不限定于此。作为上限,可列举任意的可实现的数值,例如即使是约3000个/mm2以上、约3100个/mm2、约3200个/mm2、约3300个/mm2、约3400个/mm2、约3500个/mm2、约3600个/mm2、约3700个/mm2、约3800个/mm2、约3900个/mm2、约4000个/mm2等,也能作为上限来实现。可理解为这些上限下限的任意组合也能作为本发明的细胞群的优选的细胞密度范围来使用。
[0355]
这样的细胞密度或细胞面积的特征能够应用在培养最终细胞产物的试验应用适合性评价中,其基于采用杂种细胞计数法的培养细胞的相位差像定量化技术进行。判明本发明的功能性成熟分化角膜内皮细胞的每1个细胞的面积小、培养时的细胞密度最高。即使是利用本发明的制造法制作的培养人角膜内皮细胞,如实施例中所例示那样,也能显示细胞面积为216μm2、细胞密度为2582个/mm2这样的与正常角膜内皮组织的内皮细胞相同水准的细胞面积、细胞密度。
[0356]
在一个实施方式中,本发明的细胞群的特征是本发明的角膜内皮特性具备功能性细胞以比天然存在的比率更高的比率存在。这是由于:通过提供能引发角膜内皮功能特性的细胞的比率比天然存在的比率更高的细胞群,能够提供效果比使用可天然获得的角膜内皮细胞的细胞群更高的治疗。之所以能够如此地提高能引发角膜内皮功能特性的细胞的比率,是由于提供了能够在大量的亚群中特定并选择出本发明的角膜内皮特性具备功能性细胞(例如功能性成熟分化角膜内皮细胞或中程度分化角膜内皮细胞)的技术。
[0357]
在优选的实施方式中,本发明的细胞群中的至少5%以上的、约10%以上的、约15%以上的、约20%以上的、约25%以上的、约30%以上的、约35%以上的、约40%以上的、约45%以上的、约50%以上的、约55%以上的、约60%以上的、约65%以上的、约70%以上
的、约75%以上的、约80%以上的、约85%以上的、约90%以上的、约95%以上的、约98%以上的、约99%以上的细胞为本发明的角膜内皮特性具备功能性细胞是有利的。在此,这些细胞群中所含的细胞可具有本说明书中记载的角膜内皮细胞功能特性。例如,作为这些细胞群中所含的细胞,可选择出具备包括cd166阳性及cd133阴性的细胞功能特性、且根据需要具有cd44阴性~中阳性的细胞。作为本发明的细胞群发挥效果的理由,虽然不期望受到理论束缚,但是,理由是:通过包含一定程度的本发明的角膜内皮特性具备功能性细胞,从而在将该细胞群注入受试体时显示良好的治疗效果或预防效果。在优选的实施方式中,本发明的细胞群的约70%以上的细胞为本发明的角膜内皮特性具备功能性细胞是有利的。这是由于:通过存在该水平的本发明的角膜内皮特性具备功能性细胞,能够实现作为角膜细胞注入治疗的成功基准的细胞密度(例如约2300个细胞/mm2)。在更优选的实施方式中,本发明的细胞群的约90%以上的细胞为本发明的角膜内皮特性具备功能性细胞是有利的。这是由于:在想要实现该水平的本发明的角膜内皮特性具备功能性细胞的存在比的情况下,利用偶然的方法是无法实现的,需要确立能够恰当可靠地识别并分离细胞亚群的技术及信息,在以往的技术中这样的情况是几乎不可能的。需要说明的是,对于作为角膜细胞注入治疗的成功基准的细胞密度,能够通过测定在注入细胞群后植入人的角膜内皮面的细胞的平均细胞密度来推算。这样的细胞密度可以为至少约1000个/mm2以上,优选为至少约1100个/mm2以上,优选为至少约1200个/mm2以上,优选为至少约1300个/mm2以上,优选为至少约1400个/mm2以上,优选为至少约1500个/mm2以上,优选为至少约1600个/mm2以上,优选为至少约1700个/mm2以上,优选为至少约1800个/mm2以上,优选为至少约1900个/mm2以上,优选为至少约2000个/mm2以上,优选为至少约2200个/mm2以上,优选为至少约2300个/mm2以上,优选为至少约2400个/mm2以上,优选为至少约2500个/mm2以上,优选为至少约2600个/mm2以上,优选为至少约2700个/mm2以上,优选为至少约2800个/mm2以上,优选为至少约2900个/mm2以上,优选为至少约3000个/mm2以上。
[0358]
在进一步优选的实施方式中,本发明的细胞群的特征是功能性成熟分化角膜内皮细胞以比天然存在的比率更高的比率存在。这是由于功能性成熟分化角膜内皮细胞直接向眼前房内注入时表达人角膜内皮功能特性,通过提供高品质的细胞的比率比天然存在的比率高的细胞群,能够提供效果比使用可天然获得的角膜内皮细胞的细胞群更高的治疗。之所以能够如此地提高赋予高品质的功能性的细胞的比率,是由于提供了能够在大量的亚群中特定并选择出本发明的功能性成熟分化角膜内皮细胞的技术。
[0359]
在优选的实施方式中,本发明的细胞群中的至少5%以上的、约10%以上的、约15%以上的、约20%以上的、约25%以上的、约30%以上的、约35%以上的、约40%以上的、约45%以上的、约50%以上的、约55%以上的、约60%以上的、约65%以上的、约70%以上的、约75%以上的、约80%以上的、约85%以上的、约90%以上的、约95%以上的、约98%以上的、约99%以上的细胞为功能性成熟分化角膜内皮细胞是有利的。对于这样的功能性成熟分化角膜内皮细胞的比率,在本说明书中有时表示为“e-ratio”(也称为“e比”)。e-ratio的计算方法记载于本说明书的其他部分。在此,这些细胞群中所含的细胞可具有本说明书中记载的角膜内皮细胞功能特性。例如,作为这些细胞群中所含的细胞,可选择具有cd166阳性、cd133阴性及cd44阴性~弱阳性(优选cd44阴性)的细胞。或者,可选择cd166阳性、cd133阴性及cd200阴性的细胞。作为进一步提高了品质的本发明的细胞群发挥效果的理
由,虽然不期望受到理论束缚,但是,理由是:通过包含一定程度的功能性成熟分化角膜内皮细胞,从而在将该细胞群注入受试体时更进一步显示良好的治疗效果或预防效果。在优选的实施方式中,本发明的细胞群的约40%以上的细胞为功能性成熟分化角膜内皮细胞是有利的。这是由于:通过该水平的功能性细胞的存在,能够更可靠地实现作为角膜细胞注入治疗的成功基准的高品质的细胞密度(例如以植入角膜内皮面的细胞计为约1000个细胞/mm2以上、优选为约2000个细胞/mm2、通常为约2300个细胞/mm2)。在进一步优选的实施方式中,本发明的细胞群的至少约70%以上的、更优选至少80%以上的、进一步更优选至少约90%以上的细胞为功能性成熟分化角膜内皮细胞是有利的。这是由于:在想要实现该水平的功能性细胞的存在比的情况下,利用偶然的方法是无法实现的,需要确立能够恰当可靠地识别并分离细胞亚群的技术及信息,在以往的技术中这样的情况是几乎不可能的。需要说明的是,通过使用发明的技术,能够进一步提高功能性成熟分化角膜内皮细胞的比率,例如,还能提供至少约95%以上的、至少约96%以上的、至少约97%以上的、至少约98%以上的、至少约99%以上的细胞为功能性成熟分化角膜内皮细胞的细胞群。而且,通过提供这样的包含功能性成熟分化角膜内皮细胞的细胞群,还证实了能够在注入后不到1个月的时间内实现超过约2300个细胞/mm2(例如约3000个细胞/mm2)的治疗成绩,可以说提供了以往所没有的迅速且高品质的治疗技术。
[0360]
在一个实施方式中,本发明的角膜内皮特性具备功能性细胞(包括功能性成熟分化角膜内皮细胞)或细胞群的特征还在于:与其他亚群相比,与免疫排斥反应有关的hla i类抗原、细胞变性相关抗原的表达低。另外,本发明的角膜内皮特性具备功能性细胞、特别是功能性成熟分化角膜内皮细胞不存在可在其他亚群中观察到的自体抗体,因此可以说是免疫学性质也稳定的细胞。
[0361]
在另一个方面,本发明提供包含本发明的角膜内皮特性具备功能性细胞或细胞群的产品。这样的产品可以为任意的形态,例如是指为了对人施用而制备的细胞加工产品等,但是并不限定于此。这样的细胞产品优选具有如下特性:不发生目标以外的转化;没有由细胞
·
组织所产生的生理活性物质带来的影响或该影响小;没有对正常的细胞或组织的影响或该影响小;没有形成异位组织的可能性或该可能性小;没有产生不期望的免疫反应的可能性或该可能性小;没有肿瘤形成及癌化的可能性或该可能性小;在进行基因导入的情况下进行基因治疗用产品指南中所规定的安全性评价;以及通过一般毒性试验等。
[0362]
在另一个方面,本发明提供一种该细胞或细胞群的保存方法,其包括将本发明的角膜内皮特性具备功能性细胞、功能性成熟分化角膜内皮细胞或细胞群通过培养基交换来进行传代的步骤。在此,本发明中所阐明的是:通过该培养基交换,可维持保存细胞功能特性。在此所使用的培养基能够使用任意的培养基,优选的是:使用在本说明书中所说明的细胞的制法中所使用的成分、培养基较为有利。
[0363]
在另一个实施方式中,本发明提供一种本发明的角膜内皮特性具备功能性细胞、功能性成熟分化角膜内皮细胞或细胞群的送达方法,其包括实施本发明的角膜内皮特性具备功能性细胞、功能性成熟分化角膜内皮细胞或细胞群的保存方法的工序。
[0364]
需要说明的是,作为分取本发明的角膜内皮特性具备功能性细胞、功能性成熟分化角膜内皮细胞的步骤,具代表性地可列举分选(sorting),作为除此以外的方法,例如可以使用如下方法,即,活用目标细胞与非目标细胞的细胞特性之差而对非目标细胞进行选
择性地细胞凋亡诱导(mirna开关法)、坏死诱导(葡萄糖饥饿等)的方法。然而,在本发明中,通常通过本发明的制法来提高本发明的角膜内皮特性具备功能性细胞或功能性成熟分化角膜内皮细胞的纯度。
[0365]
在一个实施方式中,本发明提供包含本发明的角膜内皮特性具备功能性细胞或细胞群的细胞库。细胞库是指用于存放通过研究等产生或收集的“细胞”(通常培养的细胞)并将其提供给其他研究者或运营商的机关或系统。
[0366]
在另一个方面,本发明提供一种产品,其包含本发明的角膜内皮特性具备功能性细胞或细胞群。这样的产品可以为任意的形态,例如是指为了对人施用而制备的细胞加工产品等,但是并不限定于此。这样的细胞产品优选具有如下特性:不发生目标以外的转化;没有由细胞
·
组织所产生的生理活性物质带来的影响或该影响小;没有对正常的细胞或组织的影响或该影响小;没有形成异位组织的可能性或该可能性小;没有产生不期望的免疫反应的可能性或该可能性小;没有肿瘤形成及癌化的可能性或该可能性小;在进行基因导入的情况下进行基因治疗用产品指南中所规定的安全性评价;以及通过一般毒性试验等。
[0367]
在另一个方面,本发明提供一种药物,其包含在向人的眼前房内注入时能引发人角膜组织功能(特别是人角膜内皮功能特性)的功能性角膜内皮细胞(本发明的角膜内皮特性具备功能性细胞)或功能性成熟分化角膜内皮细胞。本发明的药物中所使用的细胞可以包含还记载于本说明书的其他部位的任意细胞。本发明在其他的治疗评价项目例如角膜厚度、视力等上也得到显著地改善,例如,从角膜厚度的评价来看,与以往法相比,也更早期实现了治疗效果,e-ratio上升,角膜厚度减少,观察到显著的改善。本发明的药物在其他项目例如视力、基质浮肿及它们的合计得分上也得到显著地改善,另外,可理解为在未观察到严重的有害事项、也几乎未观察到不严重的有害事项的情况下提供良好的治疗结果。本发明的药物能以水疱性角膜症等角膜具有障碍的患者作为对象进行培养角膜内皮细胞注入。
[0368]
在一个具体实施方式中,本发明的药物为用于处置角膜内皮功能障碍、角膜内皮障碍或角膜内皮疾病的药物。作为这样的角膜内皮功能障碍、角膜内皮障碍或角膜内皮疾病,包括选自角膜内皮障碍grade3和角膜内皮障碍grade4(具代表性地,为水疱性角膜症)(例如富克斯角膜内皮营养不良,pex-bk(pseudoexfoliation bullous keratopathy;与假性表皮剥脱综合征相伴的水疱性角膜症)、激光虹膜切除术后水疱性角膜症、白内障手术术后水疱性角膜症(假晶状体眼或无晶状体水疱性角膜症)、青光眼术后水疱性角膜症、外伤后的水疱性角膜症、原因不明的多重手术后的水疱性角膜症、角膜移植后的移植片不全、先天遗传性角膜内皮营养不良、先天性前房隅角形成不全综合征等)中的至少一种,但是并不限定于此。本说明书中所使用的等级系统依照基于japanese journal of ophthalmology 118:81-83,2014的角膜内皮疾病的重症度分类。例如,作为水疱性角膜症的一例,有激光虹膜切除术后水疱性角膜症,其是在仅使用青光眼治疗药物难以控制眼内压的患者的虹膜中通过激光进行穿孔以改善房水流动的手术,但是认为该水流会撞击角膜内皮而损伤内皮,并且认为本发明的药物显示出显著效果。关于富克斯角膜营养不良,是先天性的基因疾病,据称在欧美有4~5%的40~50岁以上的人患病,角膜中央的内皮脱落而呈现混浊,占据欧美的角膜移植的原因的巅峰。认为本发明的药物对富克斯角膜营养不良也显示显著的效果。另外,对于被称作multipleop-bk的原因不明的多重手术后的水疱性角膜症也有效。作为这样的多重手术,具代表性地,可列举同时进行视网膜玻璃体手术和白内障 眼内透镜插
入的手术中通常被称作“三重手术”的术后等。
[0369]
本发明的药物能够以任意的形态对受试体施用,但是在优选的实施方式中,期望将本发明的药物中所含的细胞进行前房内施用。这是由于:已确立将培养角膜内皮细胞注入前房内的技术,虽然不期望受到理论束缚,但是通过前房内注入来再生角膜内皮的概念能够使用(1)低侵袭性、(2)不使用人工材料、(3)来自青年的老化少的高功能性的角膜内皮细胞作为宿主细胞。另外,通过进行前房内注入,可最高效地进行角膜内皮功能再生;另外,在生物体外进行培养扩增后将细胞悬浮液注入(水疱性角膜症等的)患者的前房内时,基于使用人干细胞的临床研究相关的指南进行研究(侦察
·
探索临床研究),由此在本发明的过程中明确确立了人应用时的安全性、临床poc。
[0370]
本发明的药物除细胞以外还可以与其他药剂一起施用。作为这样的其他药剂,可以使用在眼科治疗中通常所使用的药剂(例如甾类剂、抗生素、抗菌物质、nsaid)。这样的其他药剂可以作为药物包含在本发明的细胞药物中,或者也可以以另外施用的形态来提供。在另外提供或施用的形态的情况下,以试剂盒或组合药剂的形式来提供。在作为试剂盒或组合药剂使用的情况下,也可以组合有记载了其使用方法的添加文件等。
[0371]
需要说明的是,在提及有关“其他药剂”时,也可代替本细胞注入而将此处所详细叙述的细胞的产物单独或与该细胞一起注入,本发明也包括适合于该施用的细胞、其产物。
[0372]
本发明的药物、药物组合物或药剂(治疗剂或预防剂等)可以以试剂盒的形式来提供。在特定的实施方式中,本发明提供一种药剂包或试剂盒,其包含1个以上的容器,该容器填充有本发明的细胞或药物的1种以上成分。根据情况,也可以随附于上述容器、以由政府机关(规制药物或生物学产品的制造、使用或销售)规定的形式示出如下信息,该信息表示由政府机关授予用于人施用用途的制造、使用或销售的许可。
[0373]
本发明的药物可以进一步包含细胞注入媒介物(vehicle)。这样的细胞注入媒介物可以与本发明的细胞混合来提供,或者也可以分开提供。在另外提供或施用的形态的情况下,可以试剂盒活组合药剂的形式来提供。在作为试剂盒或组合药剂使用的情况下,也可以组合有记载了其使用方法的添附文件类等。
[0374]
在本说明书中,“试剂盒”是指通常分为两个以上的分区来提供所应提供的部分(例如检查药、诊断药、治疗药、抗体、标记、说明书等)的单元。在目的为提供一种为了稳定性等不应该以混合的形式提供而优选在即将使用之前将之混合使用的组合物时,该试剂盒的形态是优选的。这样的试剂盒优选具备记载如何使用所提供的部分(例如检查药、诊断药、治疗药)或者应如何处理试药的指示书或说明书是有利的。在本说明书中,当试剂盒作为试药试剂盒使用的情况下,在试剂盒中通常包含记载有检查药、诊断药、治疗药、抗体等的使用方法等的指示书等。
[0375]
在本说明书中,“指示书”记载有针对医生或其他使用者的使用本发明的方法的说明。该指示书记载有指示本发明的检测方法、诊断药的使用方法或施用药物等的文字。另外,在指示书中可以记载有指示向眼球或前房施用(例如采用注射等)作为施用部位的文字。该指示书按照实施本发明的国家监管机构(例如日本的厚生劳动省、美国的食品药品监督管理局(fda)等)规定的方式来制作,并且明确记载了已经获得该监管局的批准。指示书是所谓的添附文书(label),通常以纸介质来提供,但是并不限定于此,例如也能以电子介质(例如由互联网提供的主页、电子邮件)的形态来提供。
[0376]
本说明书中所使用的“细胞注入媒介物”只要能够维持细胞,则任意的液体均可使用,包括制成眼灌流液等使用的细胞注入媒介物。就作为细胞注入媒介物使用的物质而言,可列举opti-mem、该添加物追加形态、opeguard-ma、opeguard f等。发明中所使用的细胞注入媒介物可以进一步包含白蛋白、抗坏血酸及乳酸中的至少一者。
[0377]
基于在本说明书中所得到的见解,可以以代谢产物等作为指标而将患者进行分级,根据经过分级的患者的病态而适宜地制备本发明的细胞,进行适当的的治疗。
[0378]
(在向人的眼前房内注入时能表现出人角膜内皮细胞功能特性的人功能性角膜内皮细胞的制造方法)
[0379]
在一个方面,本发明提供一种方法,其是制造在向人的眼前房内注入时能引发人角膜功能的功能性人角膜内皮细胞的方法,所述方法包括:(b)使上述角膜内皮前体细胞在能将增殖应激等培养应激极小化的培养条件下增殖和/或分化
·
成熟的工序。
[0380]
在另一个方面,本发明提供一种方法,其是制造在向人的眼前房内注入时能引发人角膜功能特性的人功能性角膜内皮细胞的方法,所述方法包括:(a)使来自人角膜内皮组织的细胞脱分化而得到角膜内皮前体细胞的工序;以及(b)使上述角膜内皮前体细胞在能将增殖应激等培养应激极小化的培养条件下增殖和/或分化
·
成熟的工序。
[0381]
在又一个方面,本发明提供一种方法,其是制造在向人的眼前房内注入时能引发人角膜功能特性的人功能性角膜内皮细胞的方法,所述方法包括:(a)使来自人角膜内皮组织的细胞脱分化而得到角膜内皮前体细胞的工序;(b)使上述角膜内皮前体细胞在细胞生长因子(其量低于发生转化的量)的存在下增殖和/或分化
·
成熟的工序。
[0382]
在又一其他方面,本发明提供一种方法,其是制造在向人的眼前房内注入时能引发人角膜功能特性的人功能性角膜内皮细胞的方法,所述方法包括使角膜内皮前体细胞在细胞生长因子(其量低于发生转化的量)的存在下增殖和/或分化
·
成熟的工序。
[0383]
在优选的实施方式中,人角膜功能包括角膜内皮细胞功能特性,进一步优选人角膜功能为角膜内皮细胞功能特性。
[0384]
在本发明的一个实施方式中,cd44抗原的表达强度影响本发明的人功能性角膜内皮细胞的功能。针对由cd44介导的线粒体的能量代谢控制作用,可认为如图1所示。
[0385]
例如,以使下述代谢相关酶定位于线粒体而规定的确认到早期临床效果发生、长期稳定临床效果的培养人角膜内皮细胞是本发明的细胞的一例。
[0386]
[表2]
[0387][0388]
在本发明的一个实施方式中,对于培养人角膜内皮细胞的与临床效果有关的功能特性而言,如图2所示,作为在标准细胞中关系到临床效果的细胞功能,通过激活线粒体oxphos并且维持阳离子
·
阴离子平衡和细胞内ph,从而水排出功能提高,实现角膜混浊的改善、水肿的改善、角膜内皮细胞的小型化、内皮组织的细胞高密度化。
[0389]
在本发明的一个优选实施方式中,在制作本发明的人功能性角膜内皮细胞时,可以采用将rock抑制剂(例如y-27632)连续地添加到培养液中的培养方法,或者可以通过在脱分化时或培养早期不添加rock抑制剂而使rock抑制剂仅存在于增殖和/或分化
·
成熟工序来生产品质高的标准细胞或品质高的标准细胞的纯度高的细胞群。另外,在另一个实施方式中,也可以采用在培养液中不添加tgf-β抑制剂(例如sb-431542)的培养方法。在一个实施方式中,由在亚群水平上的解析结果可知:在不抑制tgf-β作用时细胞性状良好。另外,在另一个实施方式中,也可以采用在培养液中不添加p38map激酶抑制剂(例如sb203580)、或者仅在培养的最终成熟工序中添加p38map激酶抑制剂(例如sb203580)的培养方法。在一个实施方式中,由在亚群水平上的解析结果可知:在不施加细胞应激的条件下,不抑制p38map激酶时细胞性状良好。
[0390]
作为在本发明中有用的一点,可列举如下:通过最小量地使用rock抑制剂、tgf-β抑制剂、p38map激酶抑制剂和/或egf等试药,发现以经济低廉的价格便能提供品质与使用的场合相匹敌的细胞。
[0391]
另外,利用体外的制法能够获得生物体组织中所得水平的细胞,由此能够推测生物体组织的细胞的品质,这一点也是有用的。
[0392]
在非限定性的优选的实施方式中,虽然不期望受到理论束缚,但是在提及tgf-β抑制剂(例如sb-431542)时,优选在整个培养期间不添加该抑制剂。
[0393]
在非限定性的优选实施方式中,虽然不期望受到理论束缚,但是在提及p38map激酶抑制剂(例如sb203580)时,可以在整个培养期间不添加该抑制,也可以采用仅在培养最终的28-35天的阶段添加该抑制剂的方式。
[0394]
另外,在本发明的一个实施方式中,在制作本发明的人功能性角膜内皮细胞时,也可以不使用人间质干细胞条件培养基。这是由于:在开展万人规模的医疗的情况下,人msc
的供体差异/批次差异成为障碍,含有的sasp使品质不稳定,mir旁泌性地抑制相变,但批次差异较大。在非限定性的优选的实施方式中,虽然不期望受到理论束缚,但是可理解为在整个培养期不添加人间质干细胞条件培养基(msc-cm)就足矣。
[0395]
另外,在本发明的一个实施方式中,在制作本发明的人功能性角膜内皮细胞时,也可以不添加egf(其是细胞生长因子的一种),由此能够更稳定地生产目标细胞。另外,即使在p5等长期传代时也能以高收率得到目标细胞。在一个实施方式中,优选的是在本发明的培养方法(制造方法)中在整个培养期间不使用egf。在另一个实施方式中,可以使用仅在培养初期(例如7天以内等)添加egf的培养方法。在一个替代性的实施方式中,理解为可以按照不发生培养应激的程度的浓度来使用egf的浓度。
[0396]
在本发明的一个实施方式中,即使如以上那样变更制造方法,进行基因表达变化的全面搜索或使用通量分析仪进行线粒体呼吸功能的检定等的结果,也没有发现影响培养人角膜内皮细胞功能的变化(图3)。
[0397]
在本发明的一个实施方式中,由体(干)细胞通过脱分化途径进行的分化成熟
·
功能性人角膜内皮细胞的诱导可以如图4那样地进行。根据该方法,对于增殖性
·
可传代数,在青年供体中为p6:83,000倍水准,可获得从1眼至约10,000眼的量,扩大供体年龄幅度,即使在壮年者供体中,也能在p4中获得从1眼至约600眼的量。另外,能够实现良好的细胞形态
·
形状的维持、高密度的维持、细胞面积约200mm、分布小。
[0398]
在本发明的一个实施方式中,虽然不期望受到理论束缚,但是如图5所示的制法由于同时进行包含分化和emt的相变,因此可能产生由拮抗作用所致的不良情况,但是,像本发明那样,使角膜内皮前体细胞在能将增殖应激等培养应激极小化的培养条件下增殖和/或分化
·
成熟的工序和/或增殖和/或分化
·
成熟的工序在经调节的微量的细胞生长因子的存在下进行,从而能够解决由拮抗作用(其针对由转化带来的分化作用)带来的副作用。
[0399]
在本发明的一个实施方式中,转化包括内皮间质转化,增殖和/或分化
·
成熟的工序也能在rock抑制剂的存在下进行。
[0400]
另外,在本发明的一个实施方式中,也可以进一步包含如下工序:在增殖和/或分化
·
成熟的工序后所得的候补细胞中,确认选自以下项目中的至少一个特征,在包含至少一个该特征的情况下,鉴定该候补细胞为该人功能性角膜内皮细胞,所述项目为:(i)不存在于细胞质、核中而细胞器选择性地定位于线粒体中,以使与tca循环等有关的代谢酶、乙酰辅酶a等代谢产物不会导致夹杂相转移细胞的生成;(ii)在线粒体中线粒体依赖性氧化的磷酸化增加;(iii)由通过乙酰coa进行的组蛋白乙酰化介导的表观遗传性的多基因表达的降低(包括无引发);(iv)钠/氢交换体1(nhe1)和/或水通道蛋白1(aqp-1)的表达的亢进;以及(v)重碳酸脱水酶5b(ca5b)的表达亢进。
[0401]
在本发明中,其特征之一是可提供以与水的排出有关的aqp1表达亢进等性状来规定的细胞,所述水的排出直接关系到临床效果,例如与细胞内ph控制有关的细胞所表达的离子通道碳酸酐酶(ca)、nhe-1、单羧酸〔丙酮酸、乳酸等代谢产物〕的细胞内转运体表达、角膜混浊、水肿的减轻等。作为具有这些特征的结果,在本发明中可提供一种细胞,该细胞精致地规定了细胞内ph,从而规定了细胞的大小、规定了与线粒体功能的控制有关的功能。
[0402]
因此,在本发明的一个实施方式中,也可以进一步包括如下工序:确认在增殖和/或分化
·
成熟的工序后所得的候补细胞的线粒体中是否表达选自柠檬酸合酶(cs)、乌头酸
酶2(aco2)、异柠檬酸脱氢酶2(idh2)、苹果酸脱氢酶2(mdh2)、苹果酸酶3(me3)、acss1、乙酰coa乙酰转移酶1(acat1)、丙酮酸脱氢酶(pdh)、bcat2及支链酮酸脱氢酶2(bckdh2)中的1种或多种代谢相关酶,在确认到该表达的情况下,将该候补细胞鉴定为人功能性角膜内皮细胞。
[0403]
另外,在本发明的另一个实施方式中,也可以进一步包括如下工序:确认在增殖和/或分化
·
成熟工序后所得的候补细胞中是否表达选自atp柠檬酸裂解酶(acly)、乌头酸酶1(aco1)、异柠檬酸脱氢酶1(idh1)、苹果酸脱氢酶1(mdh1)、苹果酸酶1(me1)、acss2、乙酰coa乙酰转移酶2(acat2)及乳酸脱氢酶(ldh)中的至少一种酶,在该酶不表达或实质上不表达的情况下,将该候补细胞鉴定为人功能性角膜内皮细胞。
[0404]
进而,在另一个实施方式中,也可以进一步包括如下工序:确认在增殖和/或分化
·
成熟工序后所得的候补细胞中是否存在钠/氢交换体1(nhe1)和/或作为水通道的水通道蛋白1(aqp-1)的表达亢进,在确认到该亢进的情况下,将该候补细胞鉴定为人功能性角膜内皮细胞。在另一个实施方式中,也可以进一步包括如下工序:确认在增殖和/或分化
·
成熟工序后所得的候补细胞中是否存在重碳酸脱水酶5b(ca5b)的表达亢进,在确认到该亢进的情况下,将该候补细胞鉴定为人功能性角膜内皮细胞。
[0405]
另外,在本发明的一个实施方式中,也可以进一步具有如下工序:确认人功能性角膜内皮细胞是否为以如下细胞作为起源来制作的细胞,所述细胞选自来自角膜内皮组织的细胞、多能性干细胞、间质干细胞、从角膜内皮采集的角膜内皮前体细胞、从角膜内皮采集的细胞、以及利用直接编程法制作的角膜内皮前体细胞及角膜内皮样细胞,在另一个实施方式中,也可以包括如下工序:以选自来自角膜内皮组织的细胞、多能性干细胞、间质干细胞、从角膜内皮采集的角膜内皮前体细胞、从角膜内皮采集的细胞、以及利用直接编程法制作的角膜内皮前体细胞及角膜内皮样细胞中的细胞作为起源,制作角膜内皮前体细胞。
[0406]
如本说明书中的其他部分中所定义那样,本说明书中“来自角膜内皮组织的细胞或角膜内皮前体细胞”分别是指来自角膜内皮组织的细胞以及通过经脱分化工序进行分化而成为本发明的角膜内皮特性具备功能性细胞或功能性成熟分化角膜内皮细胞的细胞,这些细胞除了从供体的角膜内皮获得的细胞以外还包括从ips细胞、es细胞等分化为角膜内皮样细胞的细胞、分化为角膜内皮细胞之前的前体细胞等任意细胞,也包括在本说明书中所定义的中程度分化角膜内皮细胞。
[0407]
在本发明的制造方法中,作为可使用的起始材料的来自角膜内皮组织的细胞为从生物体采集的细胞,或者可使用的起始材料为从角膜内皮前体细胞、例如干细胞或前体细胞分化出的细胞。这样分化出的细胞例如可包括从各种干细胞(作为例子,为诱导性多能干细胞(ips细胞)、胚胎干细胞(es细胞)、受精卵、成体干细胞)分化出的细胞,但是并不限定于此。因此,在具体的实施方式中,本发明中所使用的(作为起始材料的)来自角膜内皮组织的细胞或角膜内皮前体细胞可列举多能性干细胞、间质干细胞、从角膜内皮采集的角膜内皮前体细胞、从角膜内皮采集的角膜内皮细胞、以及利用直接编程法制作的角膜内皮前体细胞及角膜内皮样细胞等,但是并不限定于此。在此,作为多能性干细胞,可列举诱导性多能干细胞(ips细胞)、胚胎干细胞(es细胞)等,但是并不限定于此。因此,可理解为本发明中所使用的(作为起始材料的)角膜内皮细胞或其前体细胞包括通过从诱导性多能干细胞(ips细胞)、胚胎干细胞(es细胞)等分化为角膜内皮样而制备的细胞。从诱导性多能干细胞
(ips细胞)、胚胎干细胞(es细胞)等分化为角膜内皮样的技术在该领域中是公知的,可列举例如amed法(ueno等人上述)、wo2013/051722(庆应义塾)等,但是并不限定于此。
[0408]
在使用不分化为角膜内皮样的细胞的情况下,优选包括使其分化或成熟分化为角膜内皮样的工序。
[0409]
(品质管理)
[0410]
在本发明的一个实施方式中,本发明提供一种方法,其是在向人的眼前房内注入细胞时能引起人角膜内皮功能特性的人功能性角膜内皮细胞的品质管理或工序管理的方法,所述方法可以包括确认如下内容的工序:在上述细胞的线粒体中,表达选自柠檬酸合酶(cs)、乌头酸酶2(aco2)、异柠檬酸脱氢酶2(idh2)、苹果酸脱氢酶2(mdh2)、苹果酸酶3(me3)、acss1、乙酰coa乙酰转移酶1(acat1)、丙酮酸脱氢酶(pdh)、bcat2及支链酮酸脱氢酶2(bckdh2)中的1种或多种代谢相关酶。在该情况下,也可以进一步包括确认如下内容的工序:在人功能性角膜内皮细胞中不引起细胞质
·
核内的乙酰coa的表达及由通过乙酰coa进行的组蛋白乙酰化介导的表观遗传性的多基因表达。
[0411]
另外,在另一个实施方式中,在进行品质管理时,也可以进一步包括确认如下内容的工序:在人功能性角膜内皮细胞中,atp柠檬酸裂解酶(acly)、乌头酸酶1(aco1)、异柠檬酸脱氢酶1(idh1)、苹果酸脱氢酶1(mdh1)、苹果酸酶1(me1)、acss2、乙酰coa乙酰转移酶2(acat2)和/或乳酸脱氢酶(ldh)不表达或实质上不表达。在另一个实施方式中,也可以进一步包括确认如下内容的工序:在功能性角膜内皮细胞中,钠/氢交换体1(nhe1)和/或水通道蛋白1(aqp-1)、或重碳酸脱水酶5b(ca5b)的表达亢进。另外,在另一个实施方式中,在进行品质管理时,也可以包括在人功能性角膜内皮细胞中测定细胞内ph的工序。
[0412]
(其他实施方式)
[0413]
基于实施方式对本发明的1个或多个方式涉及的判定方法及解析方法进行了说明,但是本发明并不限定于该实施方式。只要不脱离本发明的主旨,将本领域技术人员所能想出的各种变形应用于本实施方式、将不同实施方式中的构成要素组合而构建的形态也包含在本发明的一个或多个方式的范围内。
[0414]
在本说明书中,“或”在能够采用文章中所列举的事项的“至少1个以上”时使用。“或者”也同样。在本说明书中,在明确记载为“2个值的范围内”的情况下,该范围也包括2个值本身。
[0415]
以上,为了便于理解而示出优选的实施方式来说明本发明。以下,基于实施例来说明本发明,但是,上述的说明及以下的实施例仅以例示的目的来提供,并不以限定本发明的目的来提供。因此,本发明的范围并不限定于本说明书中具体记载的实施方式和实施例,而仅受到权利要求书的限定。
[0416]
实施例
[0417]
以下,使用实施例对本发明进行更详细地说明,但是本发明并不限定于这些实施例。
[0418]
以下,对本发明中使用的实验方法及材料进行说明。需要说明的是,在本实施方式中使用以下的实验方法,但是,即使使用除此以外的实验方法,也能得到同样的结果。
[0419]
在以下的实施例中,遵守赫尔辛基宣言等医疗伦理规定、gch等规则、以及由京都府立医科大学等所规定的规定,并且在与发明人所属的组织有关的伦理委员会批准下进
行。在取得必要的知情同意的基础上进行了以下实验。
[0420]
(实施例1:i.添加egf浓度的研究实验)
[0421]
在本实施例中,在功能性人角膜内皮细胞的制造中,对所使用的上皮生长因子(egf)的浓度进行了研究。以下示出详细情况。
[0422]
(方法及材料)
[0423]
供体信息如下:#202、abg-404oscn/odcn(右眼左眼)、年龄64、内皮细胞密度(ecd)=3104/3070,死因(cod):metastatic neuroendocrine carcinoma of the uterus、d-p(角膜供体死亡后,直至将角膜放入保存液为止的时间)=12:15、d-c(角膜供体的死亡后,直至进入细胞培养为止的时间)=8d。
[0424]
添加egf的浓度在以下的培养条件下进行了研究。详细情况如以下所示。
[0425]
0 y、sb2、egf、asc(抗坏血酸)的条件下进行培养
[0426]
↓
[0427]
p1 y、sb2、egf、asc的条件下进行培养
[0428]
↓
[0429]
p2在egf(-)、0.5ng/ml、1ng/ml、5ng/ml四种条件下进行培养( y、sb2、asc)
[0430]
↓
从p2各自的条件进行传代培养
[0431]
p3在egf(-)、0.5ng/ml、1ng/ml、5ng/ml四种条件下进行培养( y、sb2、asc)
[0432]
↓
从p3各自的条件进行传代培养
[0433]
p4在egf(-)、0.5ng/ml、1ng/ml、5ng/ml四种条件下进行培养( y、sb2、asc)
[0434]
*剥离时的胰蛋白酶(tryple、thermofisher)浓度
×
10,接种细胞数ecd800
[0435]
(以上,p表示传代数。)
[0436]
培养条件如以下所示。
[0437]
sb2、egf、asc分别是指sb203580、上皮细胞生长因子、抗坏血酸。表皮生长因子购自和光纯药工业株式会社(大阪,日本),sb203580(sb2)购自cayman chemical(ann arbor,密歇根州)。dulbecco's modified eagle medium-high glucose(dmemhg)及胎牛血清购自gibco industries公司(langley,ok),塑料培养板购自康宁公司。只要没有不同的指示,其他所有的化学物质均购自sigma-aldrich、inc.(密苏里州圣路易斯)。
[0438]
egf(-)、0.5ng/ml、1ng/ml、5ng/ml是指在上述sb2、egf、asc中添加各个浓度的egf或者不添加egf。
[0439]
(结果)
[0440]
将p2的在d41的4张照片示于图6中。另外,将在p3~p4中的facs的结果示于图7~图10中。
[0441]
由这些结果可知:虽然不期望受到理论束缚,但是从在显微镜观察中的细胞形状及细胞表面cd抗原性状这两方面判断,即使在p2-p4的任意传代时,均期望不添加egf。另外,作为通过不添加生长因子egf来解除增殖应激的意义,认为:若在制作本发明的人功能性角膜内皮细胞时不添加egf,则解除包括emt的细胞相变cst,回避细胞老化循环,效率良好地制造成熟分化细胞。
[0442]
(实施例2:ii.来自初代培养时的egf添加效果)
[0443]
接着,对在初代培养时的添加egf所带来的影响进行了调查。以下示出详细情况。
[0444]
(方法及材料)
[0445]
接着,对自p0初代培养时添加了egf的情况的效果进行了调查。
[0446]
供体信息如下:#214、abs-355oscn/odcn、nancyy( )、年龄18、内皮细胞密度(ecd)=3571/3401、死因:multitrauma 2’mva、d-p=12:32、d-c=7d。
[0447]
另外,培养条件等如以下所示。
[0448]
p0将2眼一并在egf(-)、0.5ng/ml两种条件下进行培养( y、sb2、asc)
[0449]
↓
从p0各自的条件进行传代培养
[0450]
p1在egf(-)、0.5ng/ml两种条件下进行培养( y、sb2、asc)
[0451]
↓
从p1各自的条件进行传代培养
[0452]
p2在egf(-)、0.5ng/ml两种条件下进行培养( y、sb2、asc)
[0453]
*剥离时的tryple浓度
×
10,接种时ecd800
[0454]
y、sb2、asc分别是指y27632、sb203580、抗坏血酸。rho相关蛋白激酶(rock)抑制剂y-27632(y)及表皮生长因子购自和光纯药工业株式会社(大阪,日本),sb203580(sb2)购自cayman chemical(ann arbor,密歇根州)。dulbecco's modified eagle medium-high glucose(dmemhg)及胎牛血清购自gibco industries公司(langley,ok),塑料培养板购自康宁公司。只要没有不同的指示,其他所有的化学物质均购自sigma-aldrich、inc.(密苏里州圣路易斯)。
[0455]
egf(-)、0.5ng/ml是指在上述y、sb2、asc中添加各个浓度的egf或者不添加egf。除具体记载的情况以外,以实施例1为准。
[0456]
(结果)
[0457]
另外,将在p0~p2中的facs的结果示于图11~图14中。虽然不期望受到理论束缚,但是可理解为:对于本发明的角膜内皮细胞,在不添加egf的情况下,其比率上升,因此在不添加egf的情况(或浓度低的情况)下,培养应激减少,可制造更优选的细胞。可理解为对于制造在向人的眼前房内注入时能引发人角膜功能的人功能性角膜内皮细胞是优选的。
[0458]
因此,据此也可理解:在本发明中,为了进行标准细胞比例高的培养,使角膜内皮前体细胞在能将增殖应激等培养应激极小化的培养条件下增殖和/或分化
·
成熟是至关重要的。
[0459]
(实施例3:iii.不添加egf用mir表达的检定、rock抑制剂的添加效果)
[0460]
在本实施例中,针对是否能用mir表达检定不添加egf的细胞标准进行试验,另外,还对rock抑制剂的添加效果进行了验证。
[0461]
(材料及方法)
[0462]
如图15所示,根据情况分别测定了mir378、mir146、mir34、mir184在细胞内的基因变动。
[0463]
作为rock抑制剂,使用了y27632。
[0464]
培养条件参照实施例1及2。
[0465]
(结果)
[0466]
将facs测定及照片评价结果示于图16中。其结果可知年龄差的影响叠加在y /-上。
[0467]
将在有无egf及有无y的情况下通过qrt-pcr得到的mir184、mir34、mir378、mir146
基因表达变动的结果示于图17及图18中。
[0468]
其结果可知:虽然不期望受到理论束缚,但是mir184表现为:(1)与细胞内cd44基因表达量为反比例关系;(2)与壮年相比,青年中表达量增加;(3)与不添加rock抑制剂相比,添加rock抑制剂时表达量增加;(4)与添加egf相比,不添加egf时表达量增加。
[0469]
另外,虽然不期望受到理论束缚,但是认为mir34a-5p表现为:(1)在同一供体内与细胞内cd44基因表达量为反比例关系,但是在超出供体的比较中与cd44的对比表现出相反的可能性;(2)与壮年相比,青年中无表达量变化;(3)与不添加rock抑制剂相比,添加rock抑制剂时表达量增加;(4)与添加egf相比,不添加egf时表达量增加。
[0470]
虽然不期望受到理论束缚,但是由该结果可确认从细胞特性指标的mir184、34a表达强度来看,也期望不添加egf。另外,还可确认到:通过添加rock抑制剂,mir184及34a的表达量增加。
[0471]
由此还可理解:在本发明中使角膜内皮前体细胞在能将增殖应激等培养应激极小化的培养条件下增殖和/或分化
·
成熟是至关重要的。
[0472]
(实施例4:iv.对不添加egf时的细胞功能特性代谢产物进行的检定、rock抑制剂的添加效果)
[0473]
接着,对不添加egf的本发明的细胞的细胞功能特性代谢产物进行了检定。另外,还判定了rock抑制剂的添加效果。
[0474]
(材料及方法)
[0475]
在本实施例中,确认到人功能性角膜内皮细胞的代谢产物特性和非目标细胞的代谢产物特性存在差异。
[0476]
(代谢产物检定)
[0477]
培养基中的代谢产物的测定
[0478]
将20μl的cs及包含内标溶液1(h3304-1002;humanmetabolome technologies、inc.、yamagata、japan)的80μl milli-q(merck1 kgaa、德国、达姆施塔特)完全混合后,用于培养上清(cs)的代谢物的测定。阳离子化合物用ce飞行时间型质谱(ce-tofms)的正离子模式(positive mode)来测定,阴离子化合物用ce串联ms(ce-ms/ms)的正离子模式和负离子模式来测定。层次聚类分析(hca)使用单独的软件“peakstat”来执行。针对值的差异,使用学生t检验或一元配置分散分析(anova)和邦费罗尼(bonferroni)的事后检验(graphpadprism6.0、graphpad软件)进行统计学上的分析。将《0.05的p值视为统计上有显著差异。
[0479]
对于rock抑制剂的添加效果,参照实施例3来进行。
[0480]
(结果)
[0481]
将代谢产物的层次性的例子示于图19中。
[0482]
另外,对本发明目标细胞即在向人的眼前房内注入时能引发人角膜功能的人功能性角膜内皮细胞(目标细胞)和不是目标的细胞(非目标细胞)的代谢产物特性进行确认,将所得的结果示于图20~图22中。
[0483]
其结果可知,对于目标细胞,乳酸、l/p(乳酸/丙酮酸)比的增加欠缺,这表明厌氧性糖酵解活性低。另外可知目标细胞的gln增加,但是glu不怎么增加,这表明由谷氨酰胺分解(glutaminonysis)使gln合成途径亢进。
[0484]
另外,目标细胞中bcaa显示出显著低的值,可见这是bcaa依赖性高的代谢。
[0485]
进而,在egf的添加量变少时,可见目标细胞的特征之一即支链氨基酸(ile,leu)的产生量降低,由此可知目标细胞含量增加。
[0486]
虽然不期望受到理论束缚,但是由以上的结果可知:通过添加egf,培养内皮细胞的代谢产物显示为非目标细胞谱。
[0487]
另外可知:egf的添加量少时,乳酸、l/p比的增加欠缺,因此厌氧性糖酵解活性低的目标细胞的含量增加,即,通过添加egf,培养内皮细胞显示出厌氧性糖酵解活性高的非目标细胞谱。
[0488]
由此也可理解,在本发明中使角膜内皮前体细胞在能将增殖应激等培养应激极小化的培养条件下增殖和/或分化
·
成熟是至关重要的。
[0489]
(实施例5:v.各种添加物的效果)
[0490]
在本实施例中,对各种添加物的效果进行了试验。以下进行详细叙述。
[0491]
v-1.利用不存在p38 mapk抑制剂(sb203580)的新培养法进行的产品的评价
[0492]
在本实施例中,对不添加p38 mapk抑制剂sb203580的方法(也称为sb2-。)进行了试验。
[0493]
(材料及方法)
[0494]
为了用sb2-的新培养法来评价产品,使用批次ct09 p5对添加物的效果进行了检定。首先,使用ct09 p4(fbs批次检定用剩余细胞),在传代前日回收培养上清(day42),之后对ct09 p5用ecd400进行传代培养(181219),用nancy培养基(fbs#1652794、含抗坏血酸)在图23所示的1~5的条件下进行了培养(各6孔板的2孔)。在第1周~第5周回收培养上清,在day34(190122)对1孔进行facs测定,对培养上清用elisa测定了il-8、pdgf-bb。
[0495]
另外,关于实验条件,在图30中示出elisa pdgf-bb及il-8的ct09 p4、p5的培养上清
·
样品列表。
[0496]
(结果)
[0497]
将在各条件下的ct09 p5的照片示于图24~图26中,并且将在day34的facs的结果示于图27~图29中。
[0498]
另外,将elisa pdgf-bb及il-8的ct09 p4、p5的培养上清
·
样品列表示于图30中。将按添加物对pdgf-bb进行分类的结果示于图31中,将按周对pdgf-bb进行分类的结果示于图32中。另外,将按添加物对il-8进行分类的结果示于图33中,将按周对il-8进行分类的结果示于图34中。
[0499]
虽然不期望受到理论束缚,但是由以上的结果可知,关于添加物的效果,综合来看,理想的是:无sb4、egf;从第10天开始添加y;不添加sb2或仅在培养最终期添加sb2。
[0500]
v-2.线粒体呼吸能力
[0501]
在本实施例中,对线粒体呼吸能力进行了调查。
[0502]
(材料及方法)
[0503]
从sightlife(seattle、wa、usa)所提供的供体角膜获得角膜内皮细胞(hcec),用对所公开的操作规程(toda m,uenom,et al.invest ophthalmol vis sci.2017;58:2011)加以若干修改的方法将该hcec进行了培养。在所有的实验中使用2~5代的hcec。包含cst的sp以低细胞密度进行了传代培养。chcec的sp使用相位差显微镜图像和流式细胞仪法通过
细胞表面标记物(cd24、44、105、166)进行了特定。
[0504]
(结果)
[0505]
将其结果示于图35~图37中。
[0506]
由以上的结果可知在标准细胞中线粒体呼吸能力高。另外可知:egf的添加使标准细胞比率降低,但是线粒体呼吸能力与之对应地降低,氧化的磷酸化(oxphos)降低。
[0507]
(实施例6:vi.rock抑制剂的添加)
[0508]
在本实施例中,对rock抑制剂(例如y27632)的添加给在向人的眼前房内注入时能引发人角膜功能的人功能性角膜内皮细胞(目标细胞)的产生带来的效果进行了调查。
[0509]
(材料及方法)
[0510]
将供体信息示于图38中。关于培养的条件,在#190719中用p1、p2进行了y添加时期的研究,在#190802中用p1进行y添加时期的研究,因此在图39所示的条件下回收了各1w~5w的培养上清。另外,在#190318中,用p1、p2在图40所示的条件下回收了培养上清。
[0511]
(结果)
[0512]
将facs结果示于图41及图43~图45中,将培养细胞照片示于图42中。根据该结果,在3个实验的任意实验中,均是在培养开始后第10天添加rock抑制剂时标准细胞的比例变高。虽然不期望受到理论束缚,但是由该结果可理解为在增殖和/或分化
·
成熟的工序中优选在rock抑制剂的存在下进行培养。由此还表明在本发明中诱导了对于得到角膜内皮前体细胞不可缺少的效率良好的分化。
[0513]
另外,将#190719的培养上清中的elisapdgf-bb测定结果(每个项目)示于图46中。其结果为:在p1及p2的2个实验的任意实验中,即使在培养开始后第10天添加rock抑制剂,成熟标准细胞的标准之一的pdgf也会在从分化至成熟期增多,表示在本培养条件下出于粘附的目的从培养初始日开始添加昂贵的y是没有意义的。认为这是由于在分化的时期添加不会阻碍脱分化。另外还可知:对于p1,在4w中出现峰,在5w中略降低。
[0514]
另外,将#190318的培养上清中的elisapdgf-bb测定结果(每个项目)示于图47中。其结果可知:在不添加p38mapk抑制剂sb2的方法中,在3w时出现pdgf高值,显示为分化的早期诱导。
[0515]
另外,将#190719的培养上清中的elisa pdgf-bb测定结果(每周)示于图48中,将#190318的培养上清中的elisa pdgf-bb测定结果(每周)示于图49中。虽然不期望受到理论束缚,但是其结果表明对于#190719的p1、p2,在添加y27632时呈现pdgf高值,并且p1增殖期呈现略低值。另外,虽然不期望受到理论束缚,但是表明pdgf与有无sb203580基本无关,为独立因子。
[0516]
另外,将#190719的培养上清中的elisa il-8测定结果(每个项目)示于图50中。其结果为:在p1及p2的2个实验的任意实验中,即使在培养开始后第10天添加rock抑制剂,成熟标准细胞的标准之一的il8也会在从分化至成熟期变得最低。另外还表明:在p1中,增殖期为高值,分化进行时,变成低值,在p2中,分化进行时,也变成低值。
[0517]
另外,将#190318的培养上清中的elisa il-8测定结果(每周)示于图51中。其结果表明il-8基本与有无sb2依赖性地变动。
[0518]
另外,将#190802的培养上清中的elisa pdgf-bb及il-8测定结果(每个项目)示于图52中。其结果表明:pdgf与基于rock抑制剂(y27632)的分化诱导依赖性地增加,并且il-8
metab.2015mar 3;21(3):349-50.、trends incell biology,june2017,vol.27,no.6、及sheikh et al.nature rev.genetics,2019等中有详细记载,关于代谢产物的表观遗传学控制和细胞老化、细胞分化的破绽,认为如图64的示意图所示。另外,作为细胞器定位的酶,可考虑图65的酶,上述的脱分化前体细胞中表达的同工酶存在于细胞质、核中,由此由核内转化accoa介导而进行组蛋白的乙酰化。
[0538]
在本实施例中,验证了代谢酶等的蛋白表达在标准细胞与发生了相变的非标准细胞之间显著不同,能够显示出同工酶的细胞器选择性定位的明确差异。
[0539]
(材料及方法)
[0540]
进行了所谓的david解析。以下示出步骤。
[0541]
(hcec)
[0542]
首先,hcec按照对所公开的操作规程加以若干修正的方法进行了培养。将包含cec的后界膜从供体角膜剥离,用1mg/ml胶原酶a(rocheapplied science、penzberg、germany)在37℃消化2小时。将从单一供体角膜得到的hcec接种于i型胶原包被6孔板(corning,inc.,corning,ny)的1孔中。培养基按照所公开的操作规程来制备。在hcec达到(培养)汇合时用在37℃下12分钟的10
×
trypl select(thermofisherscientific,inc.,waltham,ma)处理收获后进行了传代。在所有实验中使用了2~3代的hcec的供体信息如下:#184、abf-956oscn/odcn、age=11、gender=female、ecd=3207/3588和#225、abz-612oscn/odcn、age=27、gender=male、ecd=3195/3425。另外,培养条件如图66所示。将在p1和p4中的facs结果示于图67及图68中,并且将各细胞照片示于图69中。
[0543]
(培养人角膜内皮细胞(chcecs)传代
·
细胞悬浮液的制备)
[0544]
除显微镜照片以外的作业全部在安全柜内进行,进入培养室时,将手清洗干净,并戴上面罩
·
手套。
[0545]
预先将pbs(-)、培养基(nancy medium)在37℃下加温,并且将添加试药(灰盒(gray box))恢复至常温。取出培养中的细胞,确认批次编号,在相位差显微镜下观察了细胞。用相位差显微镜用照相机拍摄了40倍(24-孔:1个部位,12-孔:1个部位,6-孔:2个部位,t-25:3个部位)和100倍(24-孔:2个部位,12-孔:2个部位,6-孔:3个部位,t-25:3个部位)的照片。将细胞放入安全柜内,使用自动移液器或一次性使用吸管,将培养上清回收至管(1.5-ml或15-ml)中。注入pbs(-)(24-孔:500ml,12-孔:1ml,6-孔:2.5ml,t-25:7ml)(第1次),轻轻摇动培养容器,对孔内进行了清洗。将孔内的pbs(-)用一次性使用吸管去除,注入pbs(-)(24-孔:500ml,12-孔:1ml,6-孔:2.5ml,t-25:7ml)(第2次),轻轻摇动培养容器,对孔内进行了清洗。将孔内的pbs(-)用一次性使用吸管去除,注入pbs(-)(24-孔:500ml,12-孔:1ml,6-孔:2.5ml,t-25:7ml)(第3次)。开启10分钟的计时器,用相位差显微镜用照相机拍摄了40倍(24-孔:1部位,12-孔:1部位,6-孔:2个部位,t-25:3个部位)和100倍(24-孔:2个部位,12-孔:2个部位,6-孔:3个部位,t-25:3个部位)的照片。在co2培养箱中静置10分钟(直至计时器响起为止)。在恒温槽中将tryple select(10
×
)在37℃下加温,在计时器经过10分钟之前放置于安全柜内。用pbs(-)将tryple select(10
×
)稀释至(5
×
)(1:1稀释),用一次性使用吸管将pbs(-)去除,用p-1000将其完全除去。注入tryple select(5
×
)(24-孔:200ml,12-孔:400ml,6-孔:1ml,t-25:2.5ml),在co2培养箱中静置15分钟。用相位差显微镜确认是否有全体的一半以上的细胞变成圆形,轻轻敲击,将细胞从底面剥离。在圆形细胞不
足全体的一半时,再次在co2培养箱中静置2~5分钟静置(将tryple的酶处理时间最大记作20分钟,即使在圆形细胞不足全体的一半的情况下,也在经过共计20分钟的时刻将其用于下道工序)。
[0546]
接着,放入安全柜内,用p-1000芯片反复地进行吸引和向底面的排出,剥离细胞,回收至1.5-ml蛋白保存管或15-ml管中。在此,可以点亮安全柜的灯。使用p-1000,每1个孔添加回收的培养上清(24-孔:200ml,12-孔:400ml,6-孔:1ml,t-25:2.5ml),对孔进行清洗,一并回收至21个管中。用离心机进行离心(300
×
g;用eppendorf#5452000034台式离心机以2,100rpm离心3分钟,用tomy#lc-220管式离心机以1,200rpm离心5分钟),换成p-1000芯片(long),除去上清。更换为新的芯片,对每1个孔(24-孔:100ml,12-孔:200ml,6-孔:500ml,t-25:1ml)添加所回收的培养基,使细胞悬浮。用离心机进行离心(300
×
g;用eppendorf#5452000034台式离心机以2,100rpm离心3分钟,用tomy#lc-220管式离心机以1,200rpm离心3份),换成p-1000芯片(long),除去上清。更换为新的芯片,对每1个孔(24-孔:200ml,12-孔:400ml,6-孔:1ml,t-25:2.5ml)添加所回收的培养基,使细胞悬浮。对p-20安装芯片,从细胞悬浮液中快速抽取10ml,放入测量用96-孔板(falcon:35591、96-孔分析板无u底盖的非灭菌聚苯乙烯)中。向10ml的细胞悬浮液中添加台盼蓝10ml,通过移液进行混合,取10ml,用血细胞计数器对活活细胞数进行了计数。
[0547]
细胞数计算
[0548]
活细胞数(计数值)
÷
____(分区数)
×2×
104=活细胞数(个细胞/ml)
[0549]
活细胞数(个细胞/ml)
×
悬浮液量(ml)=总活细胞数(个细胞)
[0550]
在进行facs解析的情况下,将16
×
104个细胞(抗体1种 negative control(阴性对照))分注于蛋白保存管中,其余进行了传代培养。关于facs,针对1种抗体,需要8
×
104个细胞。传代培养按照endothelialcell density(ecd:个细胞/mm2)400(191001时点)进行了接种(24-孔:7.6
×
104个细胞,12-孔:15.2
×
104个细胞,6-孔:38
×
104个细胞,t-25:100
×
104个细胞)。
[0551]
(培养基的调整)
[0552]
取使用量的培养基 α(24-孔:500ml,12-孔:1ml,6-孔:2.5ml,t-25:7ml)于适合的管中,加入添加试药(相对于培养基液量,各为1/1000量)。添加试药不耐光,因此在调整时
·
培养基更换时,安全柜的灯熄灭。将板纵横摇动,均匀地接种细胞,在co2培养箱中进行了培养。
[0553]
(facs测定)
[0554]
〈需要的试药类〉
[0555]
□
chcec悬浮液(facs抗体1种 negative control(nc),需要16
×
104个细胞)
[0556]
□
facs缓冲液( nan3)
[0557]
bsa(球蛋白游离)0.5%/nan
3 0.05%/1
×
pbs 100ml
[0558]
facs缓冲液(-nan3)
[0559]
bsa(球蛋白游离)0.5%/1
×
pbs 100ml
[0560]
facs用抗体(ex.cd90-fitc/cd166-pe/cd24-percp-cy5.5/cd44-pe-cy7/cd105-apc)
[0561]
细胞过滤器(cell strainer)
[0562]
冰箱
[0563]
〈facs的测定〉
[0564]
启动facs,按照以下方式调整了抗体溶液(以下遮光、冰上)。
[0565][0566][0567]
facs缓冲液( nan3)9.75(total vol.20μl)
[0568]
在存在多个样品的情况下,调整了 α的溶液。
[0569]
将细胞悬浮液在250
×
g(1,800rpm)、2分钟、4℃的条件下进行离心,使用p-200除去上清,将浓度调整至4
×
106个细胞/ml,用facs缓冲液( nan3)进行了悬浮。在悬浮液不足30μl的情况下,用30μl进行悬浮,将20μl用于反应,将10μl用作nc。
[0570]
通过移液将抗体溶液20μl和悬浮液20μl充分混合,在管上卷绕铝箔进行遮光,在4℃下用旋转器使其旋转2小时(最长至4小时)。在250
×
g(1,800rpm)、2分钟、4℃的条件下进行离心,舍弃上清,用facs缓冲液( nan3)100μl进行清洗。在250
×
g(1,800rpm)、2分钟、4℃的条件下进行离心,舍弃上清,用facs缓冲液(-nan3)350μl进行悬浮,通过细胞过滤器而转移至5-ml管中。将nc用facs缓冲液(-nan3)悬浮,使剩余最初悬浮液的总量达到350μl,通过细胞过滤器而转移至5-ml管中。在facs测定的期间,样品也遮光,并放置于冰上,确定facs的激光的值、靶细胞的范围,制作文件(按照以下路径:打开book打开syringe绿色cytometer tab:laserarea scaling for hcec label:fsc 0.5/blue 0.75/red 0.80)。将nc设置于sit并短暂地运行(流速:设置为中等、acquire data 5秒将样品从sit卸下并放于冰上),检查荧光的参数图表和靶细胞的范围。参数:确认是否在102~103之间出现峰,在偏离的的情况下,在运行的期间将参数的数值进行上下调动,再通过重启进行确认,从而进行了调整。如果在运行样品时出峰至图表外,则图表外的峰均被换算为最大值105,因此需要进行调整以免超出该值。靶细胞:进行调整以使死细胞、细胞的团块不进入测定范围。按照nc、样品的顺序运行(acquire datarecord data10,000events or 5min(after 5min)stop recordingstop acquire)。样品完成运行后,进行facs关闭的步骤。
[0571]
基于液相色谱/质谱分析(lc/ms)的复合蛋白组学
[0572]
将传代4的chcec的细胞裂解物(cell lysate)用于蛋白组分析。对以93.9%的比率(效率(effector)比=e比、n=3)包含cd44-/ 成熟分化chcec sp的高品质(hq)chcec及以73.8%的比率(n=3)包含cd44 / 未成熟chcec sp的低品质(lq)chcec进行了分析。使来自hq chcec或lq chcec各自的3等分试样的细胞裂解物干燥,使其在20mmol/l hepes-naoh(ph58.0)、12mmol/l脱氧胆酸钠及12mmol/l n-月桂酰基肌氨酸钠中进行重建。在100℃下用20mmol/l二硫苏糖醇还原10分钟并且在环境温度下用50mmol/l碘乙酰胺进行45分钟烷基化后,一边在37℃下以1000rpm摇动振荡6小时,一边将蛋白用固定化胰蛋白酶
(thermo fisher scientific)消化。除去脱氧胆酸钠后,将所得的肽用oasis hlb m-洗脱板(waters)脱盐,供于质谱分析。通过ulti-mate 3000rslc nanoflow hplc系统(thermo fisher scientific)联用ltq-orbitrap-velos质谱仪(thermo fisher scientific)对肽进行了分析。利用maxquant软件进行了蛋白的鉴定及定量分析。将肽鉴定过滤器及蛋白鉴定过滤器两者的错误发现率设定为1%,参照swiss-prot中的智人蛋白数据库,检索了ms/ms光谱。仅将“razor unique peptides”用于相对蛋白浓度的计算。关于蛋白的复合分析,通过将中位值修正为1.0-104,对所检测到的所有峰进行标准化。
[0573]
(lc/ms数据集组分析)
[0574]
lc/ms数据集组由总计4641种蛋白构成,其通过使用proteome discoverer 2.2软件来得到。除去无法计算存在量比的数据后,本发明人等网络的程序david v6.8(the database for annotation,visualization and integrated discovery;https://david.ncifcrf.gov)对剩余的数据进行了分析。最终变成4315种基因,为了进行后续分析,对各个基因赋予固有的david基因id。关于基因表达分析,本发明的发明人们计算2组间的统计学p值及变化倍率,描绘volcano plots,抽取在hq chcec及lq chcec中差异表达的基因。通过使用david及其选项“biocarta”及“kegg_pathway”,对所着眼的基因以及暗示与chcec代谢有关的相关基因/途径进行了进一步调查。参照biocarta(https://cgap.nci.nih.gov/pathways/biocarta_pathways)或kegg(kyotoencyclopediaofgenes and genomes;https://www.genome.jp/kegg/)的原有的数据库,略微改变了图中的参照基因/途径。关于基因本体(go)分析,基于存在比率(lq/hq)的范围,将数据分成3组,对各组使用“goterm_direct”选项,利用david进行了分析。将go的结果按p值进行分选,显示各组的前10位的go术语。在lc/ms数据解析中,hq与lq chcec的差异的显著性通过f检验确认后,利用学生student或welch的t检验进行了评价。
[0575]
(蛋白组学的david解析)
[0576]
接着,按照以下的顺序进行了蛋白组学的david解析(图70)。
[0577]
(1)3组解析
[0578]
(2)比率超过27的情况的解析
[0579]
(3)仅goterm的解析
[0580]
(4)david解析后的与线粒体有关的比较
[0581]
(1)3组解析
[0582]
针对4641个蛋白数,排除了323个无丰度比(丰度比):(225)相变非标准细胞lq/(184)标准细胞hq的蛋白(323个)。剩余的4318个蛋白根据丰度比:lq/hq进行分组(只要有一个数据,就被作为解析对象)。
[0583]
三组的划分如下表所示。
[0584]
[表3]
[0585][0586]
(2)比率超过27的情况的解析
[0587]
接着,针对比率超过27的情况进行了解析。在图71中,针对丰度比:lq/hq超过27的2种情况进行了david解析,结果为cluster 0。用kegg pathway进行调查时,存在氮代谢(nitrogen metabolism)。对kegg pathway的氮代谢中所包含的基因(17个)和用于此次解析的蛋白(4641个)之间的共性进行了搜索,挑选了7个(ca12、ca2、ca3、ca5b、glud1、glud2、glul)。将它们进一步加入david中,对kegg pathway(氮代谢)进行搜索、确认。
[0588]
(3)仅用goterm进行的解析
[0589]
接着,仅用goterm进行解析。在david解析中,可使用约50个数据库进行解析,在david推荐(defaults)的解析中,使用其中的约10个(例如up_keyword、kegg_pathway、interpro等)(也包括goterm),此次仅使用其中的3个(goterm_bp_direct,goterm_cc_direct,goterm_mf_direct)goterm进行了解析。biological process(bp):在细胞内的功能。cellular component(cc):细胞的构成要素。molecular function(mf):分子的功能。将其结果示于图72中。
[0590]
(4)david解析后的与线粒体有关的比较
[0591]
接着,进行david解析后的与线粒体有关的比较。
[0592]
在丰度比:lq/hq0.5-0.2的组(398个)的annotation cluster1(enrichmentscore:72.73354929082193)中,大多与线粒体有关(图73)。为此,为了对pathway作进一步的少许确认,将这398个再次用david进行解析,按照在goterm、pasthway、proteindomains的项目中被david的defaults选出的项目进行聚类(图74)。根据聚类的结果,选出所调查的pathway(图75)。对pathway进行调查,写入genes的图谱。进而,对代谢途径上感兴趣的途径用keggpathway进行检索图示〔粗字〕,并且对相变非标准细胞和标准细胞的与代谢途径有关的酶、基质的蛋白表达强度进行了比较(图76~图83)。
[0593]
(实施例10:x.离子通道单羧酸转运体系细胞免疫染色)
[0594]
在本实施例中,对离子通道单羧酸转运体系进行了调查。
[0595]
(材料及方法)
[0596]
对由以下的供体的角膜组织得到的细胞进行了免疫染色。另外,使用抗体数据示于图84中。
[0597]
#190802s/d、acw-134oscn/odcn、年龄28/性别:女性、ecd=3003/3021、死因:esrdd-p=08:57、d-c=5d
[0598]
免疫染色结果如下表所示。
[0599]
[表4]
[0600][0601]
1为标准细胞,2为相变非标准细胞,且为添加egf的培养。均在培养至day0-41、42或43后,用于实验。所有细胞均分别用200倍进行图像取得,对各2个部位进行染色。
[0602]
在进行chcecs的免疫荧光染色(24-孔板)时,准备了以下的物质。
[0603]
□
固定液(-30℃冰冷特级甲醇(nacalai#21915-35)或恢复至rt的4% pfa/磷酸缓冲液(wako#163-20145))
[0604]
□
pbs(-)
[0605]
□
pbs(-)/0.2% tritonx-100(0.5ml
×
wells
×
1.1=ml)
[0606]
□
1%bsa/pbs(-)(bsa:eia/ria grade,nacalai#01281084)(bsa g/pbs(-)ml)
[0607]
□
一次抗体(包含isotypecontrol)
[0608]
□
荧光标记二次抗体
[0609]
□
dapi(同人化学,wako#340-07971)
[0610]
另外,步骤如以下所示。所有容量均是针对24-孔板的1个孔。
[0611]
首先,将细胞的培养上清除去,用pbs(-)0.5ml进行清洗(1次)。添加0.5ml固定液,在室温下静置15分钟(在meoh的情况下为-30℃)。添加0.5ml pbs(-)/0.2%tritonx-100,在室温下进行培养15分钟。除去溶液,添加1%bsa/pbs(-)0.5ml,在室温下封闭60分钟。除去溶液,将一次抗体用1%bsa/pbs(-)进行稀释,添加0.3ml,在4℃下进行培养o/n。用pbs(-)0.5ml清洗5分钟(3次)。除去溶液,将荧光标记二次抗体用1%bsa/pbs(-)稀释,添加0.3ml,在室温下培养60分钟以上。用pbs(-)0.5ml清洗5分钟(1次)。除去溶液,将dapi用pbs(-)稀释200倍,添加0.3ml,在室温下培养5~15分钟。用pbs(-)0.5ml清洗5分钟(2次)。添加pbs(-)0.5ml,用荧光显微镜进行了观察。
[0612]
(结果)
[0613]
将其结果示于图85~图88中。其结果表明:atp1a1(na klatpase)及aqp1在标准细胞中高表达于细胞膜,但是在非标准细胞中不表达。slc4a11、nhe1、slc25a42也同样。根据以上情况,虽然不期望受到理论束缚,但是明确了单羧酸转运体的细胞器选择性定位。根据以上情况可理解:在标准细胞中可确认到与角膜内皮(细胞)功能特性(角膜混浊、水肿的改善,其结果能持续地长期保存角膜内皮组织细胞密度,实施视力改善)相关联的功能性蛋白的表达。
[0614]
(实施例11:xi.转运体slc家族蛋白)
[0615]
接着,在本实施例中,观察了在标准细胞中可确认到哪些转运体slc家族蛋白的表达。以下进行详细叙述。
[0616]
(材料及方法)
[0617]
在本实施例中,对转运体slc家族蛋白及表达进行了实验。
[0618]
针对cd44-/ (成熟)主构成chcec或cd44 / 细胞状态转移(cst)主构成chcec的任意者,各自以3个检体为对象,通过液相色谱-串联质谱(lc-ms/ms)对细胞裂解物进行整合蛋白组学解析。细胞培养的条件等参照、上述实施例中记载的条件等。
[0619]
对阳离子/阴离子转运体(离子转运体)、单羧酸转运体及溶质载体(slc)家族蛋白的表达谱以及碳酸脱氢酶(ca)进行了检定。
[0620]
针对人蛋白序列数据库(swissprot),使用mascot或sequest检索引擎,并且使用proteome discoverer 2.2软件(thermo fisher scientific),对ms/ms光谱进行了解析。
[0621]
(结果)
[0622]
标准细胞和非标准细胞之间的转运体slc家族蛋白的存在比率
[0623]
[表5]
[0624][0625]
根据上述的结果,在cst chcec中,与烟酸及烟酰胺代谢物相关的酶被控制在最上方,另一方面,在成熟chcec中,仅外核苷酸焦磷酸酶(ectonucleotide pyrophosphatase)被控制在上方。有趣的是:在cst chcec中谷氨酸-氨连接酶(glul)的表达上升,与此相对,谷氨酸脱氢酶1,2(glud1,2)及谷氨酰胺酶2(gls2)的表达减少。根据整合蛋白组学,观察到:阳离子/阴离子转运体(离子转运体)、单羧酸转运体(mct)及溶质载体(slc)家族蛋白的表达谱以及碳酸脱氢酶(ca)在成熟chcec(目标细胞)和cstchcec(非目标细胞)中显示细胞器选择性的定位表达。
[0626]
(实施例12:xii.细胞内ph测定)
[0627]
在本实施例中,对目标细胞调查了与细胞内ph的关系。以下进行详细叙述。
[0628]
(材料及方法)
[0629]
接着,测定了细胞内ph。供体信息如以下所示。lot#190802p3:#190802s/d、acw-134oscn/odcn、年龄28/性别女性、内皮细胞密度ecd=3003/3021、死因:esrd、d-p=08:57、d-c=5d
[0630]
(细胞内ph测定)
[0631]
利用表示细胞形态的相位差显微镜照片和细胞表面cd抗原表达谱进行了亚群解析以及ph测定。
[0632]
认为培养人角膜内皮细胞的细胞内ph规定细胞的大小、线粒体功能。以下,在培养条件下制作标准细胞和相变非标准细胞,对ph进行检定,验证了cd44-的标准细胞的细胞内ph比cd44 / 的相变非标准细胞低。
[0633]
[表6]
[0634]
[0635]
(chcecs细胞内ph测定方法)
[0636]
(调整试药)
[0637]
hepes缓冲液(153mm nacl,5mm kcl,5mm葡萄糖,20mm hepes,ph7.4)
[0638]
校准缓冲液(calibration buffer)(130mm kcl,10mmnacl,1mm mgso4,10mm na-mops)
…
ph6.6/7.0/7.2/7.4/7.8/8.2
[0639]
2mg/ml nigercin/etoh储备溶等
…
分注并保存于-30℃
[0640]
1mm bcecf-am/dmso溶液(同人化学b221:以50mg/管添加
·
混合72.612ml dmso,进行分注并保存于-30℃)
[0641]
(准备物)
[0642]
黑色平底96-孔板(thermo fisher:237105带盖独立包装、未处理)
[0643]
预先对能回收的细胞数进行研究(1
×
105个细胞/样品;校准时使用6个样品,因此最少准备7~8
×
10 5
个细胞)
[0644]
phi测定试药(hepes,1mm bcecf-am/dmso,2mg/ml nigercin/etoh)
[0645]
chcecs剥离相关试药(pbs,tryple/pbs)
[0646]
(方法)
[0647]
(细胞悬浮液(想要测定的细胞)的制备)
[0648]
用相位差显微镜用照相机拍摄细胞,将人培养角膜内皮细胞用pbs(-)(用相位差显微镜用照相机拍摄细胞)、5
×
tryple/pbs(-)进行了剥离。
[0649]
对细胞数进行计数(实数值:cells/ml,total cells/ml),在1根1.5-ml蛋白保存管中按照成为2-10
×
105个细胞/1mlhepes的方式悬浮于hepes缓冲液中。每1ml添加1mm bcecf-am/dmso5 ml(finalconc.5mm)(实数值:cells/ml
×
根),在培养室的37℃5%co2培养箱中使其反应30分钟。移至实验台,进行300
×
g(1,867rpm:eppendorf centrifuge5418)3min离心,去除上清,用hepes缓冲液200ml悬浮细胞颗粒(冲洗第1次)。进行300
×
g(1,867rpm)3min离心,去除上清,以成为2
×
105个细胞/ml hepes的方式悬浮于hepes缓冲液中,全部合并至15-ml管中(ex.8
×
105个细胞/4ml hepes)。从该细胞悬浮液中将细胞分取至500ml/1.5-ml蛋白保存管中(ex.在总量为8
×
105个细胞/4mlhepes的情况下为2根管)。在分取前进行混合以使细胞悬浮液变得均匀(在分取后,进入校准用细胞悬浮液准备中)。进行300
×
g(1,867rpm)3min离心(冲洗第2次),舍弃上清,细胞pellet悬浮于hepes缓冲液500ml中。
[0650]
(校准用细胞悬浮液制备)
[0651]
准备校准用缓冲液,从细胞悬浮液中将细胞分取至6根500ml/1.5-ml蛋白保存管中。进行300
×
g(1,867rpm)3min离心(冲洗第2次),舍弃上清,将细胞pellet用各ph液500ml进行悬浮。每500ml添加2.5ml的2mg/ml nigercin/etoh(final conc.10mg/ml),在室温下培养10分钟。将校准用细胞悬浮液和细胞悬浮液按照150ml/孔(96-孔板)各添加至3个孔。
[0652]
(测定)
[0653]
使用荧光板读数器(glomax explorer,promega),在激发波长500nm
·
荧光波长530nm下进行了测定(在glomax中设定为激发blue(475nm)、荧光滤波器500-550nm)。
[0654]
(结果)
[0655]
将结果示于图89~图93中。
[0656]
(实施例13:xiii.添加物的效果)
[0657]
在本实施例中,进一步调查了添加物的效果。以下进行详细叙述。
[0658]
(材料及方法)
[0659]
将p3 t-251枚传代至24wp来使用(=p4)。c37、abh-096oscn/odcn、age=26y/ecd=3255/3137、cod:trauma、d-p=17:57/d-c=8d
[0660]
[表7]
[0661][0662]
*nd:未确定
[0663]
(结果)
[0664]
将结果示于图94~图100中。在测定项目中,il-1b、il-2、il-4、il-5、il-7、il-9、il-10、il-13、il-15、il-17、basic fgf、ifn-g、mip-1a、mip-1b、tnf-a、vegf为检测限以下。
[0665]
根据以上的实施例1~13,可理解使角膜内皮前体细胞在能将增殖应激等培养应激极小化的培养条件下增殖和/或分化
·
成熟是至关重要的。另外,可理解在标准细胞中可确认到与角膜内皮(细胞)功能特性(角膜混浊、水肿的改善,其结果能持续地长期保持角膜内皮组织细胞密度,实施视力改善)相关联的功能性蛋白的表达。此外,可理解:在优选的实施方式中,在增殖和/或分化
·
成熟的工序中优选在rock抑制剂的存在下进行培养。
[0666]
(实施例14:氧化的磷酸化呼吸的增加)
[0667]
如图1中的说明所示,在非标准细胞中mir34a表达降低,结果线粒体的糖酵解系统亢进。为此,强制性地向细胞内导入mir43a的mimics,提高了mir43a的表达,结果确认到氧化的磷酸化呼吸(图101、图102)。
[0668]
线粒体氧化的磷酸化呼吸oxphos提高时,角膜基质的水分被排出,由此带来临床的药理效果(图103)。另外,使增殖性的未分化细胞增加,之后使其分化,由此能够生产药理效果优异的标准细胞、高品质细胞(图104)。
[0669]
认为本发明的细胞为成熟分化细胞还是呈现脱分化状态是由于线粒体功能受到细胞内ph操纵(图105)。
[0670]
本发明的角膜内皮细胞发挥以下功能:将多余的水从角膜基质排出至前房侧,使角膜基质保持透明。因此,可列举作为临床效果而评价的角膜混浊减轻
·
透明化、角膜肥厚的非薄化等。另外,在细胞注入医疗合格细胞中线粒体的oxphos亢进,在内皮细胞内从基质侧向前房侧形成乳酸的浓度梯度,结果因渗透压而促进aqp1通道介导的水排出。因此,作为细胞功能特性评价,可列举线粒体氧化的磷酸化功能、aqp1通道表达等。而且,如上所述,细胞内ph抑制脱分化抑制性mir34a的降低,抑制cd44的表达,维持线粒体的oxphos,因此,作为细胞功能特性评价,可列举细胞内mir34a、cd44的表达降低等。细胞内阳离子
·
阴离子平
衡使细胞内ph维持在7.0~7.2的中性域,由此将线粒体的oxphos维持在高水准。作为细胞功能特性评价,可列举na k atpase(at1p1)、nbce1(碳酸氢根离子通道)、nhe1(na ,h 交换离子通道)、mct4(乳酸转运体:向前房水侧放出)、slc4a11等。另外,作为向最终产品合格细胞中混杂非合格细胞的功能的评价法,可考虑确认细胞内阳离子
·
阴离子平衡使细胞内ph偏向于碱域的方法,作为细胞功能特性评价,能够确认有无组蛋白的乙酰化、线粒体功能异常等。
[0671]
(实施例15:细胞的免疫染色)
[0672]
在实施例10中,基于蛋白组学的结果对离子通道和/或单羧酸转运体系进行了确认,而在本实施例中,通过细胞的免疫染色来确认离子通道的选择性表达。
[0673]
facs 离子通道系分子免疫染色结果
[0674]
(lot#cr04_p3:供体信息)
[0675]
#cr04
[0676]
orl2002-314 lcn/rcn
[0677]
·
年龄=12/性别=男性
[0678]
·
ecd=3546/3460
[0679]
·
死因:钝性头部创伤(blunt head trauma)
[0680]
·
d-p=6:42
[0681]
·
d-c=
‑‑d[0682]
facs测定结果
[0683]
(lot#cr04_day41)
[0684]
通过cpc在ecd800~900进行接种后,在day2移至控制车,之后培养至day41,用5xtryple select进行剥离,用于facs。培养条件如下表所示。
[0685][0686]
另外,将第41天的照片示于图106中。
[0687]
进而,针对免疫染色,如上述那样培养至day41后,用于实验,以200倍获取图像。使用抗体如下表所示。
[0688][0689]
其结果为:atp1a1定位于细胞膜,nhe1定位于细胞内,并且一部分还定位于细胞膜,aqp1定位于细胞膜,nbce1定位于细胞膜,ae2定位于细胞内
·
细胞膜,acetyl-histone h3为低表达。将其结果归纳示于图107中。
[0690]
(实施例16:非标准细胞中的组蛋白的乙酰化亢进)
[0691]
在本实施例中,对是否生成非标准细胞进行了确认。如图108所示,细胞内ph使线粒体的糖酵解亢进,从线粒体向核移送的柠檬酸盐通过定位于核内的acly、acss2将组蛋白乙酰化,暗示着线粒体matrix构成蛋白组成发生变化。
[0692]
(实施例17:标准细胞和非标准细胞的比较)
[0693]
本实施例中,对标准细胞和非标准细胞(cst细胞)中的特定蛋白的表达进行了比较。作为标准细胞,使用了#191224s p4 day46( y),作为非标准细胞,使用了#200313p1 day74( sb4、egf)。将结果示于图109~图111中。
[0694]
另外,作为在非标准细胞中组蛋白乙酰化亢进的理由之一,在标准细胞中确认到组蛋白脱乙酰化酶活性降低,因此在标准细胞及非标准细胞中测定了hat/hdac活性。hat/hdac活性的测定如以下所示那样进行。
[0695]
作为供体,使用了以下的lot#191224s_p4。
[0696]
#191224s
[0697]
aen-024oscn
[0698]
年龄=29/性别=男性
[0699]
ecd=2941
[0700]
死因:急性呼吸窘迫综合征(acute respiratory distress syndrome)
[0701]
d-p=07:32
[0702]
d-c=7d
[0703]
培养条件如下表所示。
[0704][0705]
对于1,在ecd400中接种,对于2,在ecd800(从非标准细胞的传代)中接种,之后,培养至day42。
[0706]
分别将1个孔用facs:5xtryple select进行剥离,用于实验(mirna表达测定用相同的样品)。另外,对1个孔进行核蛋白提取,直接用nuclear extraction kit回收细胞。将结果示于图112~图114中。
[0707]
对于线粒体呼吸系的基质要求性,与标准细胞相比,确认到在cst细胞中anaplerosis亢进、在标准细胞中线粒体内的与支链氨基酸代谢有关的bcat2、bckdh亢进。有趣的是:与tca途径有关的线粒体偏在代谢酶cs、aco2、idh2、mdh2、me3、与乙酰辅酶a产生有关的acss1、acat1全部在标准细胞中亢进,遍及细胞质的作为同工酶的acly、aco1、idh1、mdh1、me1、与细胞质、核内的乙酰辅酶a产生有关的acss2、acat2在作为非合格细胞的cst细胞中表达亢进。这是由于:在培养应激这样的环境因子的影响下细胞质、核内的乙酰辅酶a在表观遗传学上与组蛋白的乙酰化有关,暗示着控制cst细胞的性状表达的可能性。认为对于在脱分化细胞的分化破绽而言核定位乙酰辅酶a的偏在起着重要的作用。
[0708]
(注释)
[0709]
如上所述,使用本发明的优选实施方式对本发明进行了例示,但可理解为本发明应该仅通过权利要求书来解释其范围。可理解为本说明书中引用的专利、专利申请以及文献的内容本身与被本说明书具体记载的内容同样、并且该内容作为对本说明书的参考而援引于此。本技术对在2020年2月27日向日本专利局申请的日本特愿2020-32139主张优先权,其全部内容如同构成本技术的内容的情况同样地作为参考援引于本文中。
[0710]
产业上的可利用性
[0711]
发现本发明具有在有关角膜内皮再生医疗的医疗产业及其周边产业中利用的可能性。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。