1.本发明涉及干细胞用培养基及干细胞的培养方法。
背景技术:
2.以多分化能干细胞为代表的干细胞是具有自我复制能力的未分化细胞,是能够向各种细胞分化的细胞。近年来,正在积极地研究向患者的受损组织移植多分化能干细胞或从多分化能干细胞分化诱导的细胞以实现其功能再生的再生医疗。在再生医疗中,需要大量准备多分化能干细胞、间充质干细胞等干细胞或其分化细胞,因此对使这些干细胞高效增殖的方法、使其高效分化的方法进行了研究。
3.通常,就干细胞的培养而言,在干细胞用基础培养基的mtesr1培养基(非专利文献2)、essential-8培养基(非专利文献3)、dubecco修饰eagle培养基(dmem)/f12培养基中使用各种细胞因子、血清或其替代物(例如白蛋白等)等添加剂。
4.专利文献1中公开了作为上述添加剂使用的7种非必需氨基酸减少的培养基。专利文献2中公开了将白蛋白和聚乙烯醇添加到培养基中。另外,专利文献3中公开了在干细胞中的间充质干细胞的培养中使用与多个细胞因子一起含有磷脂、脂肪酸的无血清培养基。
5.现有技术文献
6.专利文献
7.专利文献1:美国专利申请公开第2017/0198258号说明书
8.专利文献2:美国专利申请公开第2017/0009200号说明书
9.专利文献3:美国专利申请公开第2012/0329087号说明书
10.非专利文献
11.非专利文献1:ludwig,et al.,nat.methods,2006,vol.3(8),p.637-46
12.非专利文献2:chen,et al.,nat.methods,2011,vol.8(5),p.424-9
技术实现要素:
13.但是,在专利文献1~3以及非专利文献1和2中记载的技术中,干细胞的增殖性等效果并不充分,因此要求开发进一步的改良技术。因此,本发明的目的在于提供在维持干细胞的分化能力的同时增殖性能良好的干细胞用培养基及使用该培养基的干细胞的培养方法。
14.本发明者们为了解决上述课题进行了深入研究,结果发现,通过使培养基中含有作为水溶性高分子化合物的羧甲基纤维素和聚乙烯基吡咯烷酮中的至少任一者,在维持干细胞的分化能力的同时具有良好的增殖性能,从而完成了本发明。
15.本发明是基于上述见解而完成的,本发明提供以下的干细胞用培养基及使用该培养基的干细胞的培养方法。
16.[1]一种干细胞用培养基,其含有作为水溶性高分子化合物的羧甲基纤维素及聚乙烯吡咯烷酮中的至少任一者。
[0017]
[2]根据上述[1]所述的干细胞用培养基,其中,培养基中的羧甲基纤维素的添加量为终浓度0.001μg/ml~1mg/ml。
[0018]
[3]根据上述[1]所述的干细胞用培养基,其中,培养基中的聚乙烯吡咯烷酮的添加量为终浓度0.05μg/ml~2mg/ml。
[0019]
[4]根据上述[1]~[3]中任一项所述的干细胞用培养基,其中,培养基中的重组白蛋白的添加量以终浓度0.05~1mg/ml含有。
[0020]
[5]根据上述[1]~[4]中任一项所述的干细胞用培养基,其进一步含有β-烟酰胺单核苷酸。
[0021]
[6]一种干细胞的培养方法,其使用上述[1]~[5]中任一项所述的干细胞用培养基。
附图说明
[0022]
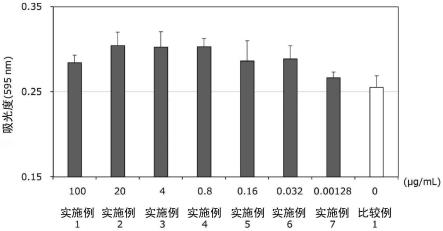
图1是表示实施例1~7及比较例1中的增殖性能试验i的通过结晶紫染色法得到的吸光度的测定结果的图表。
[0023]
图2是表示实施例11及比较例1中的增殖性能试验i的通过结晶紫染色法得到的吸光度的结果的图表。
[0024]
图3(a)是表示实施例8及比较例1中的增殖性能试验ii的累积分裂次数的推移的图表,图3(b)是表示实施例13及比较例1中的增殖性能试验ii的累积分裂次数的推移的图表。
[0025]
图4是表示实施例8、实施例13及比较例1中的分化能力试验i的流式细胞法的结果的图表。
[0026]
图5是表示实施例8、实施例13及比较例1中的分化能力试验ii的进行了分化诱导的干细胞的状态的图像。
具体实施方式
[0027]
以下,基于本发明优选的实施方式(方式)对本发明进行说明。
[0028]
本发明的干细胞用培养基用于干细胞的培养。“干细胞”是指具有自我复制能力且具备能够向多种细胞种类分化的分化能力的未分化细胞。作为干细胞,例如除了es细胞(胚胎干细胞)、ips细胞(人工多能干细胞)等多能干细胞以外,还可举出间充质干细胞、造血干细胞、神经干细胞、皮肤干细胞等体干细胞。
[0029]
作为使用本发明的干细胞用培养基进行培养的干细胞,优选动物来源的干细胞,更优选哺乳类来源的干细胞,进一步优选人来源的干细胞。
[0030]
从在维持分化能力的同时得到更良好的增殖性能的观点出发,使用本发明的干细胞用培养基培养的干细胞优选为可分化为外胚层、中胚层及内胚层中的任一细胞的干细胞,更优选为可分化为中胚层细胞的干细胞。作为该干细胞,可举出间充质干细胞等。
[0031]
本发明的干细胞用培养基的特征在于,含有作为水溶性高分子化合物的羧甲基纤维素及聚乙烯吡咯烷酮中的至少任一者。通过在干细胞用培养基中含有这些水溶性高分子化合物中的任一者,可以在维持干细胞的分化能力的同时得到良好的增殖性能。
[0032]
羧甲基纤维素(以下也称为“cmc”;cas登录编号为9000-11-7)是纤维素衍生物之
一,是将构成纤维素的吡喃葡萄糖的羟基的一部分用羧甲基取代而得到的纤维素醚。
[0033]
本发明中使用的cmc可以没有特别限制地使用以往在细胞培养的培养基中使用的cmc等。另外,也可以使用羧甲基纤维素盐。
[0034]
从进一步提高增殖性能的观点出发,cmc优选每单位无水葡萄糖的羧甲基醚基的取代度(醚化度)为0.6~0.8。这样的cmc有市售,例如可以使用nacalai tesque公司制羧甲基纤维素钠(cat.no.07326-95)、富士胶片和光纯药公司制羧甲基纤维素(cat.no.11676-85)等市售品。
[0035]
聚乙烯吡咯烷酮(以下也称为“pvp”;cas登录编号为9003-39-8)是n-乙烯基-2-吡咯烷酮聚合而成的水溶性高分子化合物。
[0036]
本发明中使用的pvp可以没有特别限制地使用以往在细胞培养的培养基中使用的pvp等。从进一步提高增殖性能的观点出发,pvp的重均分子量优选为40,000-1,200,000。这样的pvp有市售,可以使用例如nacalai tesque公司制聚乙烯吡咯烷酮k-30(cat.no.06306-72)、nacalai tesque公司制聚乙烯吡咯烷酮k-90(cat.no.28315-72)等市售品。
[0037]
本发明的干细胞用培养基中添加有cmc及pvp中的至少任一者。在该干细胞用培养基中,可以添加cmc及pvp中的任一者,也可以添加cmc及pvp这两者。
[0038]
从在维持干细胞的分化能力的同时进一步提高增殖性能的观点出发,本发明的干细胞用培养基中的羧甲基纤维素的添加量优选为终浓度0.001μg/ml~1mg/ml,更优选为终浓度0.02μg/ml~0.5mg/ml。
[0039]
从与上述同样的观点出发,本发明的干细胞用培养基中的聚乙烯吡咯烷酮的添加量优选为终浓度0.05μg/ml~2mg/ml,更优选为终浓度0.1μg/ml~1mg/ml。
[0040]
通常,用于干细胞培养的培养基含有血清白蛋白等白蛋白(白蛋白蛋白)。
[0041]
从进一步提高增殖性能的观点出发,本发明的干细胞用培养基优选含有白蛋白,更优选含有哺乳动物的白蛋白,进一步优选为与所要培养的干细胞同种的白蛋白。另外,该白蛋白优选为重组白蛋白。例如,为了培养人来源的干细胞,优选使用人来源的重组白蛋白。
[0042]
本发明的干细胞用培养基通过含有上述羧甲基纤维素及聚乙烯基吡咯烷酮中的至少任一者,可使花费成本的白蛋白的含量显著地降低。因此,本发明的干细胞用培养基中的白蛋白的添加量可以为终浓度0.05~1mg/ml的范围,优选为终浓度0.05~1mg/ml、更优选为0.1~0.5mg/ml的范围。
[0043]
从进一步提高增殖性能的观点出发,白蛋白优选为所担载的脂肪酸降低的白蛋白。作为该白蛋白,可以适当使用实施了活性炭处理等脱脂肪酸处理的白蛋白。脱脂肪酸处理例如可以通过国际公开2014-192938号公报中记载的方法进行。
[0044]
从在维持干细胞的分化能力的同时进一步提高增殖性能的观点出发,本发明的干细胞用培养基优选进一步含有β-烟酰胺单核苷酸。烟酰胺单核苷酸(以下也称为“nmn”。化学式:c
11h15
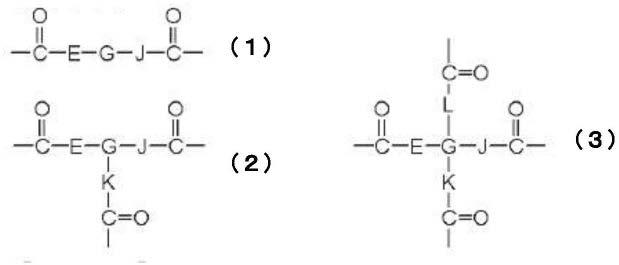
n2o8p)中作为光学异构体存在α体及β体这2种,在本发明的干细胞用培养基中,优选使用β-nmn(cas编号:1094-61-7)。β-nmn的结构如下所示。
[0045]
[化学式1]
[0046][0047]
作为β-nmn,可以使用通过任意方法制备的β-nmn。例如,可以将通过化学合成法、酶法、发酵法等人工合成并精制的β-nmn用作有效成分。作为合成β-nmn的化学合成法,例如可以通过使nam与l-四乙酰核糖反应,将得到的烟酰胺单核苷进行磷酸化来制造β-nmn。作为酶法,例如可以由nam和5'-磷酸核糖-1'-焦磷酸(prpp)通过烟酰胺磷酸核糖转移酶(nampt)来制造β-nmn。作为发酵法,例如可以利用表达nampt的微生物的代谢系统,由nam来制造β-nmn。
[0048]
另外,β-nmn是广泛地存在于生物体中的成分,因此也可以将通过从动物、植物、微生物等天然原料中提取、精制而得到的β-nmn用作有效成分。另外,也可以使用市售的经精制的β-nmn。
[0049]
从在维持干细胞的分化能力的同时进一步提高增殖性能的观点出发,本发明的干细胞用培养基中的β-nmn的添加量优选为终浓度0.01~5mm,更优选为终浓度0.05~2mm,进一步优选为终浓度0.1~1mm。
[0050]
作为本发明的干细胞用培养基中使用的基础培养基,可以使用用于维持干细胞的多能性(未分化的状态)或使其增殖的培养基、用于动物细胞的培养的培养基等通常的基础培养基。该基础培养基也可以使用市售的各种干细胞用的培养用培养基。作为基础培养基,例如可举出eagle最小必需培养基(mem)、dubecco修饰eagle培养基(dmem)、αeagle最小必需培养基(αmem)、iscove修饰dulbeco培养基(imdm)、f-12培养基、f-10培养基、dmem/f12培养基、rpmi-1640培养基、间充质细胞基础培养基(mscbm)、e8(essential 8)培养基、tesr-e8培养基、mtesr1培养基、以及它们的混合培养基等。
[0051]
本发明的干细胞用培养基中,除了上述成分以外,还可以根据需要含有氨基酸、无机盐类、维生素类、抗生素等有效成分,这些有效成分可以仅含有1种,也可以组合含有2种以上。本发明的干细胞用培养基中可含有的有效成分为已知可提高干细胞的生存效率、增殖效率的成分、已知可提高分化效率的成分等。例如,可以从各种氨基酸、抗坏血酸、α-生育酚等维生素类、胰岛素、转铁蛋白等生长因子、亚硒酸钠等矿物质、乙醇胺、rock抑制剂、丙戊酸、二甲基亚砜、地塞米松、丁酸、曲古霉素a、gsk3抑制剂、bmp抑制剂、wnt抑制剂等生理活性物质、pdgf-bb、egf、vegf、tgf-β、fgf2激活素、noggin等细胞因子类中适当选择使用。
[0052]
已知上述有效成分有可提高干细胞的生存效率、增殖效率、提高维持干细胞的未分化状态的作用。
[0053]
本发明的干细胞的培养方法是用于在维持干细胞所具有的分化能力的同时有效地使该干细胞增殖的培养方法。即,是用于稳定且高效地培养干细胞的培养方法。
[0054]
本发明的干细胞的培养方法可适当使用本发明的干细胞用培养基。该干细胞的培养方法除了含有作为水溶性高分子化合物的羧甲基纤维素及聚乙烯吡咯烷酮中的至少任一者这点以外,可以通过与常规方法的干细胞的培养方法同样的方法进行。
[0055]
另外,培养条件可以采用通常培养动物细胞的培养条件,也可以根据需要适当改
变。例如,可以在培养温度为30~40℃、co2浓度为1~10体积%、o2浓度为0.1~25体积%下进行培养。
[0056]
实施例
[0057]
接着,示出实施例对本发明进行更详细的说明,但本发明不受以下的实施例的任何限定。
[0058]
[干细胞用培养基的制作]
[0059]
准备干细胞用培养基。该培养基中,除了添加作为水溶性化合物的cmc或pvp来代替聚乙烯醇(pva)这点以外,使用与日本专利第5804385号公报中记载的无血清培养基a相同组成的培养基。上述无血清培养基a是在将deme(sigma公司、cat.no.d6046)和mcdb201(sigma公司、cat.no.m6770)以1∶1混合而成的基础培养基中加入fgf、pdgf、tgf-β、hgf、egf、磷脂、脂肪酸、pva等有效成分而成的培养基(参照日本专利第5804385号公报的表1)。无血清培养基a中的白蛋白的添加量为终浓度0.2mg/ml。详细而言,将加入有cmc(nacalai tesque公司、羧甲基纤维素钠、醚化度为0.59~0.85、cat.no.07326-95)代替无血清培养基a中的pva的培养基作为实施例1~10的干细胞用培养基,将加入有pvp(nacalai tesque公司、聚乙烯吡咯烷酮k-90、重均分子量为360,000、cat.no.28315-72)代替无血清培养基a中的pva的培养基作为实施例11~14的干细胞用培养基。另外,在实施例8~10和实施例12~14的干细胞用培养基中进一步添加有β-nmn。将仅由上述无血清培养基a构成的培养基作为比较例1的培养基。
[0060]
各实施例及比较例的干细胞用培养基中的cmc、pvp及β-nmn的各添加量(培养基中的终浓度)如下表所示。
[0061]
[表1]
[0062][0063]
[增殖性能试验i]
[0064]
用2.5μg/cm2的纤连蛋白(corning公司,产品编号:356008)涂布细胞培养用96孔板。在该96孔板中,使用实施例1~7或比较例1的干细胞用培养基以100μl的规模接种干细
胞,使其达到800cells/孔,在37℃、5%co2条件下进行静置培养。所使用的干细胞为人脂肪组织来源的间充质干细胞(lonza公司,产品编号:pt-5006,1个供体)。接种1天后和4天后进行培养基更换,从培养开始起继续培养6天。在该培养中使用了上述的cmc含量的干细胞用培养基(实施例1~7或比较例1的干细胞用培养基)。
[0065]
接着,通过结晶紫染色法评价干细胞的增殖性能。首先,除去96孔板中的培养上清液,在各孔中添加0.99%多聚甲醛(pfa),在4℃静置1小时以上。然后,对于各孔,除去pfa,分别用超纯水和100%乙醇进行清洗。作为超纯水,使用milliq水。milliq水是采用millipore公司的超纯水制造装置milliq制造的超纯水。清洗后,将2.5%结晶紫添加到各孔中,在室温下静置10分钟。接着,将各孔进一步用自来水依次清洗3次之后,使孔干燥,用酶标仪测定595nm波长的吸光度。对独立的6孔进行以上的测定,通过t检验对其显著性进行分析。将测定结果示于图1。
[0066]
另外,在用2.5μg/cm2的纤连蛋白涂布了的培养用平皿(60mm平皿)中,使用实施例11或比较例1的干细胞用培养基以3ml的规模接种干细胞,使其达到5
×
103cells/cm2,除这点以外,利用与上述实施例1~7同样的方法培养干细胞并评价干细胞的增殖性能。将测定结果示于图2。
[0067]
[增殖性能试验ii]
[0068]
在用2.5μg/cm2的纤连蛋白涂布了的培养用平皿(60mm平皿)中,使用实施例8~10或比较例1的干细胞用培养基,以3ml的规模接种与增殖性能试验i中使用的干细胞相同的干细胞,使其达到5
×
103cells/cm2,在37℃、5%co2条件下进行静置培养。接种1天后进行培养基更换,以后2天或3天一次使用各干细胞用培养基实施培养基更换。在该培养用平皿内的细胞密度达到约80~90%的次融合的时间点,进行传代。更具体而言,除去培养用平皿的培养上清液,用磷酸缓冲盐水[1
×
pbs(-)]清洗后,加入1
×
tryple select(thermo fisher公司、产品编号:12563011),在37℃、5%co2的条件下静置4分钟。接着,通过用吸量管吹吸使其悬浮,将从培养用平皿剥离的细胞单化。接着,加入各干细胞用培养基进行离心(1500rpm,5min),除去上清液后,向沉淀的细胞中加入上述各培养基使其悬浮。对该悬浮液进行细胞计数,接种于预先用上述纤连蛋白涂布了的培养用平皿(60mm平皿)中,使其达到5
×
103cells/cm2。对于这样进行了传代的培养用平皿,使用各干细胞用培养基,以2天或3天一次的频率实施培养基更换。重复上述传代8次。
[0069]
接着,求出经过上述传代得到的干细胞的累积分裂次数,将其制成图表。累积分裂次数是基于干细胞的初次接种数及每次传代所计数的细胞数,累积并计算出干细胞的分裂次数。然后,通过与比较例1的累积分裂次数对比,按照以下的评价基准评价各实施例中的干细胞的增殖性能。在以下的评价基准中,将累积分裂次数比比较例1多1次以上的情况评价为“比比较例1高的增殖性能”,将累积分裂次数为与比较例1相同的次数或-(少)1次的情况评价为“与比较例1同等的增殖性能”。
[0070]
:显示了与比较例1同等的增殖性能。
[0071]
:显示了比比较例1高的增殖性能。
[0072]
将使用了实施例8~10及比较例1的各干细胞用培养基的本增殖性能试验ii的评价结果示于表2。另外,将实施例8及比较例1中的干细胞的累积分裂次数的测定结果示于图3(a)。
[0073]
使用实施例12~14及比较例1的各干细胞用培养基实施了上述本增殖性能试验ii。将评价结果示于表3。另外,将实施例13及比较例1中的干细胞的累积分裂次数的测定结果示于图3(b)。
[0074]
[表2]
[0075][0076]
[表3]
[0077][0078]
[分化能力试验i]
[0079]
在用2.5μg/cm2的纤连蛋白涂布了的培养用平皿(60mm平皿)中,使用实施例8、实施例13或比较例1的干细胞用培养基,以3ml的规模接种与增殖性能试验i中使用的干细胞相同的干细胞,使其达到5
×
103cells/cm2,在37℃、5%co2条件下进行静置培养。在培养用平皿内的细胞密度达到约80~90%的次融合的时间点,进行与上述传代同样的操作,将干细胞从培养用平皿剥离,每次1
×
105个细胞回收到1.5ml试管中。用1
×
pbs清洗回收的干细胞,添加下述所示的各抗体,在4℃下使其反应30分钟以上。之后,用1
×
pbs再次进行清洗,使用流式细胞仪(becton dickinson公司,机种:facs calibur)进行流式细胞法分析,确认回收的干细胞的细胞表面抗原的表达。流式细胞法分析按照所述流式细胞仪的使用说明书进行。
[0080]
本分化能力试验i中使用以下的抗体。
[0081]
·
fitc小鼠igg1,κisotype ctrl(biolegend公司、产品编号:400108)
[0082]
·
pe小鼠igg1,κisotype ctrl(biolegend公司、产品编号:400112)
[0083]
·
percp/cyanine5.5小鼠igg1,κisotype ctrl(biolegend公司、产品编号:400150)
[0084]
·
fitc抗人cd90(thy1)(biolegend公司、产品编号:328108)
[0085]
·
pe抗人cd105(biolegend公司、产品编号:323206)
[0086]
·
percp/cyanine5.5抗人cd73(ecto-5
’‑
核苷酸酶)biolegend公司、产品编号:344014)
[0087]
·
fitc抗人cd235a(biolegend公司、产品编号:349105)
[0088]
·
pe抗人cd45(biolegend公司、产品编号:304008)
[0089]
·
percp/cyanine5.5抗人cd31(biolegend公司、产品编号:303131)
[0090]
上述抗体所结合的蛋白中,细胞表面表达的cd90、cd105和cd73是间充质干细胞的标记蛋白,cd235a、cd45和cd31是间充质干细胞的阴性标记蛋白。
[0091]
(分化能力试验ii)
[0092]
使用实施例8、实施例13或比较例1的干细胞用培养基,对于重复了4次增殖性能试验ii的传代的干细胞,在细胞培养用48孔板中以2
×
104cells/孔进行接种,培养至细胞密度达到约100%融合。接着,使用用于分化为成骨细胞、软骨细胞及脂肪细胞各细胞的分化培养基进行培养基更换,进行约3周的分化诱导。将分化诱导下的干细胞在37℃、5%co2条件下进行静置培养。
[0093]
本分化能力试验ii中,使用以下的分化诱导用培养基。
[0094]
·
骨分化诱导用培养基
[0095]
在α-mem培养基中,添加胎牛血清至终浓度为10%,添加地塞米松至终浓度为10nm、添加β甘油磷酸至终浓度为10mm、添加抗坏血酸至终浓度为50μg/ml、以及添加青霉素-链霉素至终浓度为0.1%。
[0096]
·
软骨分化诱导用培养基
[0097]
在α-mem培养基中,添加胎牛血清至终浓度为10%,添加地塞米松至终浓度为100nm、添加抗坏血酸至终浓度为25μg/ml、以及添加丙酮酸至终浓度为1mm。
[0098]
·
脂肪分化诱导用培养基
[0099]
在dmem-high glucose培养基中,添加胎牛血清至终浓度为10%,添加ibmx至终浓度为0.5mm,添加地塞米松至终浓度为1μm、添加吲哚美辛至终浓度为200μm、以及添加青霉素-链霉素至终浓度为0.1%。
[0100]
使用了上述各分化培养基的分化诱导后,除去细胞培养用48孔板的上清液,添加0.99%pfa使其静置30分钟,将细胞固定。然后,除去pfa,用水清洗,添加细胞染色液静置20分钟,进行细胞染色。细胞染色后,用milliq水清洗3次以上,用显微镜观察细胞染色的状态。将观察图像示于图5。
[0101]
本分化能力试验ii中,细胞染色使用以下的染色液。
[0102]
·
茜素s染色液(merck millipore公司,产品编号:tms_008_c)
[0103]
茜素s染色液含有与钙结合的色素,因此能够基于该染色液的染色程度,评价向成骨细胞的分化。
[0104]
·
阿利新蓝(nacalai tesque公司,产品编号:37154-44)
[0105]
由于阿利新蓝能够对聚集蛋白聚糖或糖胺聚糖等软骨细胞的细胞外基质进行染色,因此可基于其染色的程度评价向软骨细胞的分化。
[0106]
·
油红o(nacalai tesque公司,产品编号:25633-92)
[0107]
由于油红o能够对脂肪滴进行染色,因此能够基于其染色程度评价向脂肪细胞的分化。
[0108]
根据增殖性能试验i的结果可知,与比较例1的培养基相比,使用添加有cmc的实施例1~7及添加有pvp的实施例11的各干细胞用培养基为干细胞的增殖性能更高的结果(参照图1及图2)。即使在增殖性能试验ii中对干细胞进行传代培养的情况下也显示出该增殖性能(参照表2和表3)。另外,使用添加有cmc的实施例1~7及添加有pvp的实施例11的各干
细胞用培养基与未添加cmc或pvp的比较例1的培养基相比,为干细胞的累积分裂次数更多的结果〔参照图3(a)及(b)〕。
[0109]
由分化能力试验i的结果可知,在添加有cmc的实施例8及添加有pvp的实施例13的各干细胞用培养基中培养的干细胞与在既未添加cmc也未添加pvp的比较例1的培养基中培养的干细胞同样地,未分化的状态得以良好地维持(参照图4)。
[0110]
另外,在分化能力试验ii中,在添加有cmc的实施例8和添加有pvp的实施例13的各干细胞用培养基中培养的干细胞与在既未添加cmc也未添加pvp的比较例1的培养基中培养的干细胞同样地,分化为成骨细胞、软骨细胞或脂肪细胞(参照图5)。即,显示了通过cmc或pvp,干细胞所具有的分化能力不变。
[0111]
根据上述增殖性能试验i和ii以及上述分化能力试验i和ii的结果,显示了本发明的添加有cmc或pvp的干细胞用培养基不会对干细胞的维持、增殖产生不良影响,并且显示了能够在维持干细胞的分化能力的同时提高增殖性。由此,能够更稳定且更高效地培养干细胞。
[0112]
产业上的利用可能性
[0113]
本发明的干细胞用培养基通过在干细胞的培养所需的基础培养基中含有作为水溶性高分子化合物的羧甲基纤维素及聚乙烯吡咯烷酮中的至少任一者,在维持干细胞的分化能力的同时具有良好的增殖性能。因此,通过使用该干细胞用培养基,能够更稳定且更高效地培养干细胞。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。